Method Article
Geniş hacimli içinde belirli hücresel hedefleri bulmak için seri bölümlerin Multimodal hiyerarşik görüntüleme
Bu Makalede
Özet
Bu iletişim kuralı bir Taramalı elektron mikroskobu (SEM) kullanarak Nano çözünürlükte görüntüleme için bir doku belirli hücreleri hedef alıyor. Biyolojik malzeme reçine gömülü seri bölümleri çok sayıda hedefi tanımlamak için bir ışık mikroskobu ve sonra SEM hiyerarşik bir düzen izler ilk görüntüsü
Özet
Bir karma hücre grubun veya bir doku içinde ultrastructural çözünürlükte belirli hücreleri hedefleme bir ışık ve elektron mikroskobu kullanarak hiyerarşik görüntüleme tarafından elde edilebilir. Reçine gömülü örnekleri ultrathin bölümleri yüzlerce kurdela oluşan diziye kesitli ve silikon gofret veya conductively kaplı coverslips parçaları yatırılır. Dizileri düşük çözünürlükte bir dijital tüketici smartphone kamera veya hızlı geniş alanı genel bakış için ışık mikroskobu (LM) veya geniş alan floresan mikroskop (Floresan ışık mikroskobu (FLM)) gibi fluorophores ile etiketleme sonra kullanarak yansıma. Ağır metaller ile sonrası sonra boyama, diziler bir Taramalı elektron mikroskobu (SEM) görüntüsü. Hedeflerin seçimi 3D rekonstrüksiyonlar FLM tarafından oluşturulan veya floresan hiçbir işaretleri yoksa SEM görüntü yığınları orta çözünürlükte yapılmış 3D rekonstrüksiyonlar mümkündür. Ultrastructural analiz için seçilen hedefleri sonunda yüksek çözünürlüklü, SEM kaydedilir (bir kaç nanometre görüntü piksel). Herhangi bir ultramicrotome için güçlendirilmiş bir şerit işleme aracı gösterilmiştir. Bu dizi üretim ve parça bıçak tekne substrat kaldırılması ile yardımcı olur. SEM dizilerin otomatik görüntüleme sağlayan bir yazılım platformu ele alınmıştır. Seri blok-yüz SEM (SBF-SEM) veya odaklı iyon demeti SEM (FIB-SEM), gibi büyük hacimli EM verileri oluşturan diğer yöntemlere göre bu yaklaşım iki önemli yararı vardır: (1) reçine gömülü örnek, dilimlenmiş-up versiyonu da olsa korunmuş. Farklı şekillerde lekeli ve farklı çözümler sunarak görüntüsü. (2) gibi bölümler sonrası Boyanabilen, kontrast için SEM düşsel tanıtmak veya doku blok iletken işlemek için ağır metaller ile örnekleri güçlü blok lekeli kullanmak gerekli değildir. Bu yöntem çok çeşitli malzeme ve biyolojik sorular için geçerli hale getirir. Özellikle önekli malzemeler örneğin, biyopsi bankalar ve patoloji laboratuarları, doğrudan olabilir gömülü ve 3D yeniden.
Giriş
Doku ultrastructural çözünürlükte geniş hacimli yeniden inşa için SEM dayalı farklı görüntüleme yaklaşımlar bir dizi olmuştur kullanılan1: kapsamlı değerlendirmeleri vardır kullanılabilir örn., SBF-SEM2, FIB-SEM3ve dizi Tomografi (AT)4. İkinci yöntem için örnek malzeme seri bir substrat bölümlerde dizisi olarak korunur, SBF-SEM ve FIB-SEM yıkıcı yöntemleri, örnek blokta çalışma ve görüntüleme sırasında alıcı iken. SEM reçine şarj nedeniyle, onlar da şiddetle metalize örnek blok5üzerinde bağlıdır.
Öte yandan, belirli hücreleri veya doku örneği içinde faiz yapılarının belirlenmesi özellikle Bağdaşık ışık ve elektron mikroskobu (CLEM)6,7,8yararlanabilirsiniz. Bu floresan sinyal9gidermek beri FLM için hedefleme kullanarak uygulama heavy metal büyük miktarda engellemektedir. Diziler LM görüntüleme sonra kolayca sonrası heavy metal ile lekeli olabilir beri böyle sadece biraz metalize örnekleri için AT yönteminin seçimi var. Ayrıca, hemen hemen her örnek türü için kullanılabilir, patolog'ın bile rutin örnekleri göğüs10hazine.
AT bir diğer büyük avantajı hiyerarşik11 veya çoklu çözünürlük görüntüleme12için potansiyel mevcuttur: her şeyde yüksek çözünürlüklü görüntü gerek yoktur, hedefleri farklı bir yöntem (örneğin, FLM) ya da seçilebilir düşük çözünürlüklü SEM görüntüleri. Sadece ilginç bölgeleri, yüksek çözünürlüklü bir doku veya hücre nüfusunun görüntüleme dijital veri depolama alanı kaydeder ve kolay olan daha küçük görüntü veri kümeleri üretir. Burada, oldukça zayıf metalize bir örnek kullanarak AT iş akışı gösterilmiştir: yüksek basınç bitki kökleri (Arabidopsis thaliana) dondurulmuş gömülü hidrofilik reçine.
Diziler hazırlanan, lekeli ve FLM ve SEM görüntüsü ve görüntü yığınları kayıtlı nasıl açıklanmıştır. Ayrıca, FLM birim 3D yeniden inşası SEM Nano çözünürlükte görüntüleme için belirli hücreleri seçmek için nasıl kullanılabileceği gösterilmiştir.
Protokol
Not: Örnek blok polymerized ve bazı ağır metal içeren. Fiksasyon ve şekil 1A-B gösterilen iki örnek olmuştur için protokolleri katıştırma11başka bir bölümünde. Kısacası, şekil 1A ' gösterilen örnek kimyasal olarak, en bloc % 1 OsO4, sonra ' % 1'uranyl asetat, ile ilk ve gömülü Spurr'ın reçine lekeli tespit edildi. 1B rakam yüksek basınç donmuştu, gösterilen örnek freeze % 0,4 uranyl asetat aseton ile değiştirilen ve Lowicryl HM20 reçine gömülü. Toz ücretsiz eldiven için sonraki hazırlık adımları kullanın.
1. diziler oluşturma
- Örnek blok kesme
Not: Her zaman iyi parçalar eklerken vidayı sıkın.- Örnek blok ultramicrotome örnek yuvasına takın, yer tutucu kesme blok ve ultramicrotome alt sahne içine kaydırın.
- Reçine örnek etrafında küçük bir kenarında bırakarak bir tıraş bıçağı ile dış görev reçine katıştırılmış doku çevresinde kırpın. Hedefe ulaşılana kadar en baştan kırpın.
Not: Trapez veya dikdörtgen blok-yüz şeklinde olabilir (biz başarıyla her iki şekiller kullanmıştır). Dikdörtgenin uzun kenarlarında geniş bir alana şeritlere sabitleme yapıştırıcı karışımı tarafından kaplıdır sağlamak için önde gelen ve trailing edge kullanılması önemlidir. - Örnek sahibi ultramicrotome kol yerleştirin ve kesme blok alt aşamasında bıçaklıklı tarafından değiştirin. Bir elmas kesim bıçak (normalde 45 °), bıçak yuvasına takın. Blok-yüz tam olarak kesim bıçak kenarına paralel hizalayın.
Not: tam olarak paralel lideri (alt) ve (üst) kenarları sondaki üretmek için açmak veya sadece bıçak ters tarafı kırpmaya taşıyın. (Daha--dan birkaç yüz bölüm) büyük miktarlar için 90° kesim bıçağı avantajlıdır. - Dört kenarı da pürüzsüz sonra trailing edge ve önde gelen şimdi yatay konumda olması örnek tutucu döndürün.
- Dikkatle baştaki ve sondaki kenarlarına yapıştırıcı karışımı ile blok kat. Birkaç saç için kürdan13sabit oluşmuştur küçük bir fırça kullanın. Bu karışımdan solvent saniye içinde buharlaşır çünkü hızlı bir şekilde bu adımı gerçekleştirin. Blok-yüz bu karışımı ile kontamine değil. 5-10dk için Kuru kaplamalı örnek blok izin.
Not: bölüm daha büyük sayılar için (> 200), zamanla, bir çıkıntı tutkal etkileyebileceği firar kenarında inşa ve potansiyel olarak geri bölümleri üzerinde knife-edge çekmek için sadece, öncü kat daha iyi olabilir.
- Belgili tanımlık substrate hazırlanması
- Bıçak tekne (kabaca 2 x 2, 5 cm2 Jumbo bıçak) sığar bir boyuta silikon gofret parçalar koparıp. Gerekirse, gofret parçalar (sayılar veya harfler) temizlemeden önce bir elmas scriber ile veya kalıcı marker ile temizlendikten sonra işaretleyin. Silikon gofret isopropanol ve hav bırakmayan dokusu ile elle temizle.
Not: Bağdaşık görüntüleme için indiyum kalay oksit (ITO) kullanın-kaplı cam coverslips. Onlar çok dikkatli bir şekilde ele alınması gerekir ve ekstra temizlik gerekli değildir. - Belgili tanımlık substrate için çıkarılabilir bir yapıştırıcı kullanarak taşıyıcı plaka bir ucunu düzeltmek.
Not: Alternatif olarak, alt katman kenarları paralel olarak yapışkan bant iki çizgiler kullanarak knife-edge aşağı pinned. - Plazma hidrofilik bir yüzey elde etmek için hava ile belgili tanımlık substrate (kızdırma deşarj) etkinleştirin. Bir damla su çok ince film (düşük kişi açılı, şekil 2C, D) substrat yayılır üzerine yerleştirilen şekilde yapılması gerekir. Hydrophilization parametreleri plazma ayg bağlıdır; Burada kullanılan parametreleri için bkz: Malzemeler tablo.
Not: Plazma harekete geçirmek çok uçucu, yani bu hemen önce substrat kullanımı gerçekleştirmek. - Taşıyıcı bir substrat sahibi, ile belgili tanımlık substrate bıçak tekne içinde en iyi Islatıcı elde etmek için knife-edge için daha yakın monte substrat kelepçe takın.
Not: Bilgisayar destekli tasarım (CAD) çizimler dahil olmak üzere substrat sahibinin ayrıntılı bir açıklama Wacker ve arkiçinde verilir. 11
- Bıçak tekne (kabaca 2 x 2, 5 cm2 Jumbo bıçak) sığar bir boyuta silikon gofret parçalar koparıp. Gerekirse, gofret parçalar (sayılar veya harfler) temizlemeden önce bir elmas scriber ile veya kalıcı marker ile temizlendikten sonra işaretleyin. Silikon gofret isopropanol ve hav bırakmayan dokusu ile elle temizle.
- Hazırlık kesit
- Bir Jumbo elmas bıçak bıçak yuvasına takın, boşluk açısı (0 ° Jumbo bıçak için) ayarlamak ve bıçak tekne distile su ile doldurun. Örnek 1-2 mm uzaklığa bıçak yaklaşım.
- Belgili tanımlık substrate vida 1-3 (şekil 2A) substrat sahibinin kullanarak suya indirin. Su hattı substrat üst üçte yer aldığını kontrol edin.
Not: tutkal substrat ve taşıyıcı plaka arasında de temiz Forseps ile belgili tanımlık substrate hafifçe hareket ettirme tedavi kontrol edin. Bu taşımamalısınız. - Yerden yükseklik silikon gofret kullanırken görmek zordur çünkü sen hissedene kadar substrat alt yere değiyor. Şimdi küçük bir miktar substrat kaldırın. Ne belgili tanımlık substrate ne de taşıyıcı ise kesme bıçağı tekne dokunduğundan emin olun.
- Bir şırınga veya pipet teknede su seviyesini ayarlamak için kullanın. Dürbün ile izlerken, Ekle/Kaldır su yüzeyinde tam alanı ultramicrotome en iyi ışık aydınlatma homojen bir yansımasıdır gösterir kadar su.
- Ultramicrotome altta ışık geçiş. Kol orta konumda ve ultramicrotome el çarkı kullanarak geri çekilmesi olduğundan emin olun. Knife-edge yansıması blok yüzünde görünene kadar örnek bir yaklaşım bıçak.
- Örnek bıçak hizalamak için ultramicrotome ayarı seçeneklerini kullanın. İlk bıçağı döndürmek sonra döndürmek ve örnek tilt.
Not: örnek ve bıçak arasındaki boşluğu görülebilir, ışık şerit, paralel kenarlar (düz paralel çizgiler ve değil kama şeklinde) gösteriyorsa o düzgün hizalanır. - Örnek eğimi kontrol: ışık şerit kalın haline gelmediğinden emin olun veya örnek yukarı ve aşağı hareket ederken daha ince. Gerekirse, bu durumu düzeltmek için yay ayar vidasını kullanın. Bu sadece blok-yüz (ama does değil değmek kadar) bıçak daha yakın örnek için taşıyın.
- (Yem), bölüm kalınlığı kesme hızı ve kontrol ünitesi kesme penceresinde ayarlayın.
- Kesit başlatın. Gerekirse, ilk tam bölüm kesmek kadar bekleyin. Bazı bölümler emin olmak için birlikte form şeritler için sopa kesmek (aksi takdirde tutkal yeniden uygulanması vardır). Başlangıç yüksek bir besleme değeri ile (en fazla, 200 nm Ultra bıçak için) ilk tam bölüm kesmek kadar. Sonra istediğiniz besleme değeri ayarlayın. Yeterli şerit istikrar için bir bölümü kalınlığı 100 nm ve kesme hızı 1 mm/s olduğunu iyi bir başlangıç noktası. En düşük fiyat ulaşılabilir bölüm kalınlığı yaklaşık 60 olduğunu bağlı olarak örnek kalite nm.
- Kesit durdurmak. Knife-edge tüm gereksiz (kısmen kesilmiş) bölümleri kaldırın ve bir kirpik/kedinin saç kullanarak tekne. Küçük enkaz bir sürü varsa, yüzen bir pipet tamamen suyla kaldırın ve tekne taze su ile doldurun. Şimdi ilk verimli Şerit'in hazır bir süreçtir.
- Kesit
- Kesit başlatın. (Gerçek sayı bölümleri ve substrat boyutuna bağlı olarak) bölüm sayısı kesilmiş oldu sonra parça işlemini durdurmak ve Şerit'ten knife-edge yavaşça bir kirpik14 veya daha iyisi ile knife-edge üzerinden okşayarak tarafından serbest bir çok bir kedinin kürk yumuşak saç.
- Manipüle (itme/çekme) şerit ile belgili tanımlık substrate doğru kirpik ve ilk bölümü için belgili tanımlık substrate ekleyebilirsiniz.
Not: Belgili tanımlık substrate kuru parçası sopa kadar yavaşça itin şerit gereklidir. - Kesit ve substrat için kurdela bağlama devam ediyor. Bir tarafta başlayın ve yavaş yavaş üzerinde her yeni şerit ile diğer gider.
Not: zaten ekli şeritler gevşeme önlemek için büyük su hareketleri önlemek. Aynı hava akımları için geçerlidir. Ultramicrotome ile teslim nefes kalkan kullanın. Olumsuz çevresel koşullar içinde bir kasa ultramicrotome için15önerilir. - Ne zaman belgili tanımlık substrate tamamen kaplıdır şeritler ile (genellikle 4 – 5 kurdela mümkün), hafifçe Asansör-substrat substrat sahibinin micromanipulator vidaları kullanarak bıçak tekne out.
Not: Uygun hareketleri vardır: dikey olarak yukarı kaldırın (1 vida) ve döndürme/devirme (vida 3) dışarı, ya da her ikisinin bir birleşimi. - Tozsuz ortamda depolamadan önce kuru şerit dizi izin. Kuruduktan sonra yapışkanlı takılı substrat (substrat kaldırmak çok zor olabilir veya demontaj sırasında bile kırılabilir aynı gününe, aksi takdirde) gemisinden en kısa zamanda kaldırın.
2. LM görüntüleme için boyama
Not: Farklı boyama/etiketleme ayirt iletişim kuralları da dahil olmak üzere mümkün yöntemlerdir. Burada doğrudan, oldukça belirsiz bir leke hücre duvarları anahat için seçilir.
-
Propidium iyodür boyama
- Büyük bir cam Petri kabına (30 cm çapında) parafilm ile alt kapak ve nemli bir oda oluşturmak için ıslak mendil ile çanak kenarına hattı.
- Yaklaşık 300-500 µL çözüm coverslip başına kullanın. Her coverslip için bir damla parafilm yerleştirin ve böylece bölümleri ile temas boyama sıvı cam baş aşağı açılan koymak. Çanak kapağı ve örnekleri ışıktan korumak için alüminyum folyo ile sarın. Örnekleri 4 ° C'de 16 h için kuluçkaya
- Forseps ile coverslip kaldırmak ve o yukarı ve aşağı hareket ettirerek 80 mL distile su ile dolu bir 100 mL ölçek yıkayın. Başka bir ölçek temiz su ile bu işlemi tekrarlayın. Kuru basınçlı hava ile dikkatli bir şekilde coverslip.
3. kayıt görüntü yığını içinde FLM
- Coverslip ortak bir geniş alanlı FLM sahnesinde yerini.
- Uygun filtre kümesi (Tablo reçetesi) uyması gereken floresan için seçin.
- Uygun bir objektif lens ile nesnenin her bölümünde fotoðraf: görüş alanı doldurmak ve yönlendirmesini sabit tutmak deneyin. Kök ipucu için 40 X hava amaç kullanıldı.
Not: şeritler mükemmel düz değilseniz, dönen bir sahne görüntüleri çekerken bölümleri reorient yardımcı olabilir. Mümkünse, görüntünün belirli bir özellik üzerinde ortalamak veya kaydedilen görüntünün kenarı eşit uzaklıkta, bölümünün kenarından bir özelliği almak. - Mümkünse, 16 bit doymuş piksel sınırlamak ve çekim hızı sabit tutmak için kullanın.
4. kayıt FLM görüntü yığını
- Görüntü serisi Fiji16 sanal bir yığın içe aktarın.
- Bir yeni TrakEM17 (boş) Dosya menüsünden açın.
- Sağ tıklayın görüntü alanına ve yığın "Tabaka başına bir dilim" olarak TrakEM alın.
- Hizalama katmanları (sağ tıkla) görüntü alanına, aralığı ayarlayın (ilk görüntü için son) ve referans olarak seçeneğini belirleyin. Tüm ayarlar için varsayılan değerleri kullanın ve istediğiniz dönüştürme olarak katı seçin.
- Kayıt bitmiş ve tatmin edici olduğunda hizalanmış DataSet'in Kaydet'i sağ tıklatın ve Ver'i seçin. Düz görüntü yapmak, aralığı son resme ilk olarak ayarlayın ve elde edilen yığınını göster yazılım izin. Yığın TIF-biçiminde kaydedin.
5. boyama ve SEM görüntüleme için montaj
Not: boyama çözümleri hazırlamak için Malzemeler tablobakın. Işık ve hava korumalı çözümler 4 ° C'de 12 aya kadar depolanabilir.
Dikkat: Kurşun sitrat ve uranyl asetat içeren zehirli ağır metaller. Eldiven giymek ve yerel yetkililerin talimatlarına göre atık bertaraf.
- Büyük bir cam Petri kabına (30 cm çapında) parafilm ile alt kapak ve nemli bir oda oluşturmak için ıslak mendil ile çanak kenarına hattı.
Not: Birkaç granül NaOH Petri kabına yakınındaki kurşun sitrat, aşırı yağış önlemek için boyama damla içinde konumlandırılmış önemlidir. -
Uranyl asetat boyama
- Uranyl asetat çözüm 2680 x g de tortu küçük parçacıklar için birkaç saniye için santrifüj kapasitesi.
- Yaklaşık 300-500 µL çözüm coverslip başına kullanın. Her coverslip için bir damla parafilm yerleştirin ve böylece bölümleri ile temas boyama sıvı cam baş aşağı açılan koymak.
- Oda sıcaklığında 10 dakika için kuluçkaya ve boyama sırasında çanak kapağı.
- Kaldır coverslip forseps ve bir ölçek yukarı ve aşağı hareket ettirerek yıkama ile dolu ile distile su (bkz. Adım 2.1.3).
-
Kurşun nitrat boyama
- Uranyl asetat kuluçka sırasında kurşun sitrat çözüm hazırlamak.
Not: Kurşun sitrat her zaman hemen kullanmadan önce herhangi bir precipitates kaldırmak için filtre. Ayrıca kurşun sitrat çözüm 2680 x g de Adım 5.2.1 olduğu gibi bir kaç saniye süreyle santrifüj kapasitesi. - Yaklaşık 300-500 µL çözüm coverslip başına kullanın. Her coverslip için bir damla üzerinde parafilm hemen coverslips uranyl asetat boyama sonra yıkama önce yerleştirin ve böylece bölümleri ile temas boyama sıvı cam baş aşağı açılan koymak. Damla (300-500 µL) üzerinde parafilm hemen coverslips uranyl asetat boyama sonra yıkama önce yere.
Not: precipitates oluşumunu önlemek için kurşun sitrat damlacıkları nefes değil. - Yıkanmış coverslip baş aşağı açılan üzerine yerleştirin (kuru için gerek yoktur).
- Oda sıcaklığında 5 min için kuluçkaya ve boyama sırasında çanak kapağı.
- Forseps ile coverslip kaldırmak ve taze su (Adım 5.2.4'ten) ile bir ölçek yukarıda açıklandığı gibi yıkayın.
- Uranyl asetat kuluçka sırasında kurşun sitrat çözüm hazırlamak.
- Kuru basınçlı hava ile dikkatli bir şekilde coverslip.
-
SEM görüntüleme için montaj örnekleri
- Silikon gofret alüminyum taslakları yapışkan karbon pad ile bağlama.
Not: ITO kaplı coverslips da gümüş boya ve Cu-bant kullanarak monte edilebilir — iletim tipi yüzey için saplama takılı olduğundan emin olun — veya yukarıdaki gibi karbon yastıkları ile. Bu durumda, saplama ITO-yüzey arasında iletken bir bağlantı gümüş boya bir damla ile yapılabilir.
- Silikon gofret alüminyum taslakları yapışkan karbon pad ile bağlama.
6. SEM hiyerarşik görüntüleme
Not: bir alan emisyon SEM, düşük bir birincil enerji seçin (3 kV veya daha düşük), ikincil ve/arka dağınık veya elektron verimli toplama için şarj önlemek için 800 pA ve uygun bir çalışma mesafesi 50 aralığında geçerli bir ışın. Işın geçerli seçimi bağlıdır örnek özellikleri (örn., reçine katıştırma); Elektron doz da küçük akım (örnek için daha az zararlı) ve hızlı görüntüleme için yararlı olduğunu ve bu nedenle Toplam görüntü edinme zaman düşürür yüksek bir akım arasında bir uzlaşma olacak. Arka dağınık elektron için adanmış dedektörleri iyi kontrast sağlamak, örnek şarj için daha az duyarlıdır ve örnek'ın yüzey yapıların (kıvrımlar, bıçak izleri) daha az göster. Öyle ki histogram merkezli kontrast ve parlaklık ayarlanmalıdır.
-
SEM görüntüleme
- İlk dizi dört köşesine her köşe 100 x hakkında düşük büyütmede görüntüsünü tarafından kapma tanımlayın. İlgi (ROI) tüm dizi kapsayan bir bölge oluşturun. Şu parametrelerle bir görüntüleme iletişim kuralı atayın: bir büyük görüntü piksel boyutu (için örnek 1.000 nm) ve kısa Işınma Zamanı (örneğin, 0.2 µs) yüksek hızlı görüntüleme için sağlar bir ikincil elektron (SE) dedektörü kullanın.
Not: bir büyük tarama alanları distorsiyonları görüntülerin çevre neden, bakış (FOV), elektron optik sınırlamalarını aşmak için adanmış düşük büyütme modları (çoğu SEM üreticileri tarafından sağlanan) kullanın veya orta, 1-2 k tarama alanlar için kullanın tek görüntüleri. - Sadece doku ilk bölümünde ortaya koyan bir yatırım Getirisi oluşturarak ayarla bir bölüm oluşturun. Damga aracı kullanarak tüm sonraki bölümlerine klon. Bükülmüş şerit karşılamak için gerektiğinde ROIs döndürün.
- Bir orta piksel boyutu kullanarak görüntü dizi kaydetmek (yaklaşık 50 nm) ve belirlemek ve hedef yapısı tanımak için uzun zaman durmak. 6-10 k piksel aralığında tek görüntüleri için bir FOV kullanın.
Not: Atlas 5 yazılım otomatik olarak seri bölümleri arasında büyük yatırım Getirisi/bölüm alanları kapsayacak şekilde bitişik görüntüleri oluşan mozaikler toplayabilirsiniz. - Daha yüksek çözünürlük SEM görüntüleme için hedef yapısı içeren bu bölüm kümesi içinde ayarla bir site oluşturun. Sahne hassasiyet için hesap için yatırım Getirisi yeterince büyük olun. Kontrol edin ve siteleri konumlarını ayarlayın.
Not: Nerede otofokus ve autostigmation gerçekleştirilecektir, Merkezi, "boş" malzeme ile hiçbir yapısal ayrıntı, e.güzerinde oturmak değil böyle bir şekilde ROIs yer önemlidir., boşluklara. - Otofokus ayarlarını tanımlamak ve performans en az kontrol bir Şerit (Yani, sahne seyahat etmek zorunda en uzun mesafe) uzunluğu yansıma site yakın küçük bir yatırım Getirisi üzerinde.
- Yüksek çözünürlüklü SEM Alım için bir görüntüleme iletişim kuralını tanımlar. Membran bölmeleri görmek için 3-5 nm görüntü piksel boyutu seçin. Görüntü çok gürültülü değil Dedektör bağlı olarak bir bekleme süresi seçin.
- Satın alma başlamadan önce onay iletişim kuralı seçeneğini kullanarak her şerit ilk bölümünde en azından odak değerleri tanımlayın.
- Otomatik SEM görüntüleme hedef ROIs dizi üzerinde başlayın.
- Alınan veri görüntü serisi, tercihen TIF formatı olarak dışa aktarın.
- İlk dizi dört köşesine her köşe 100 x hakkında düşük büyütmede görüntüsünü tarafından kapma tanımlayın. İlgi (ROI) tüm dizi kapsayan bir bölge oluşturun. Şu parametrelerle bir görüntüleme iletişim kuralı atayın: bir büyük görüntü piksel boyutu (için örnek 1.000 nm) ve kısa Işınma Zamanı (örneğin, 0.2 µs) yüksek hızlı görüntüleme için sağlar bir ikincil elektron (SE) dedektörü kullanın.
7. kayıt SEM görüntü yığını
- Görüntü serisi Fiji sanal bir yığın içe aktarın.
Not: Bu veri dosyaları bölüm sayısı ve ROI boyutuna bağlı olarak birkaç GB aralığında olacak. - SEM görüntü ve daha fazla bir alana yakın gibi faiz mümkün olduğunca yapısını işlemek için yığın parlaklığını ve karşıtlığını ayarlamak kırp.
- Bir yeni TrakEM17 (boş) Dosya menüsünden açın.
- Sağ tıklayın görüntü alanına ve yığın "Tabaka başına bir dilim" olarak TrakEM alın.
- Görüntü alanına (sağ tıkla) katmanları hizalamak, en küçük kareler modunu seçin, aralığı ayarlayın (ilk görüntü için son) ve referans olarak seçeneğini belirleyin. Ayarlar için varsayılan değerleri kullanın ve istediğiniz dönüştürme olarak katı seçin.
- Kaydı tamamlanmış ve tatmin edici olduğunda, hizalanmış DataSet'in Kaydet'i sağ tıklatın ve Ver'i seçin. Düz görüntü yapmak, aralığı son resme ilk olarak ayarlayın ve elde edilen yığınını göster yazılım izin. Yığın TIF-biçiminde kaydedin.
Sonuçlar
İş akışı (Resim 1) başlar bir reçine blok içinde gömülü bir örnek ile burada açıklanan. Numune Hazırlama sırasında bazı ağır metal dokusu içine tanıttı olabilir, ama oldukça güçlü metallization için en iyi duruma getirilmiş iletişim kuralı kullanmak üzere gerekli değildir. Şekil 1A bitki kök (tere) blok standart olarak %1 OsO4 ile lekeli ve % 0.5 uranyl asetat kullanarak şekil 1B Arabidopsis kökte sadece zayıf ise % 1 uranyl asetat, metalize gösterir. Bazı ağır metallerin Floresans gidermek eğilimi olarak ikinci örnek türü Bağdaşık yaklaşımlar için uygundur. Bir adanmış substrat tutucu (Şekil 2) ile birkaç yüz bölümleri bir dizi olabilir (şekil 1 c) üretilen. Floresan etiketlemeyi sonra böyle diziler bir standart geniş alanlı FLM (şekil 1 d), yansıma sonra ağır metal çözümleri ile lekeli ve farklı çözünürlüklerde (şekil 1E-G) bir SEM görüntüsü.
Önemli diziler, tekrarlanabilir nesil için özellikle birkaç şeritler bir substrat üzerine microtome'nın bıçak tekneden yerleştirirken substrat tutucu (şekil 2A,) yazarın laboratuvarda özel olarak tasarlanmış ve bir Jumbo elmas araçlardır bir tekne mikroskop slaytlar (2B rakam) kapsayacak kadar büyük bıçak. Düz bir Menisküs, şerit, iyi gözlem izin gereklidir ve belgili tanımlık substrate plazma Temizleme tarafından elde edilebilir: distile su küçük damlacık bir objektif benzeri yapıda olduğu gibi şekil 2C (tedavi edilmemiş substrat), substrat üzerine oluşturması gerektiğini değil Ama ince bir film (2D rakam, aktif plazma yüzey). Bu koşullar altında kolayca bir ITO kaplı coverslip kuru bölümüne bağlı şeritler vardır (şekil 2E) görüntülenir ve gözlenen ve Asansör-dışarı-in belgili tanımlık substrate su sırasında kontrol.
Örneğin, standart geniş alan FLM (şekil 3A) ile bitki hücre duvarları etiketlemek için propidium iyodür ile lekeli diziler görüntüsü. Bölümleri yalnızca 100 olduğundan kalın, hatta burada gösterildiği gibi aşırı boyama nm tanıttı biraz bulanık. Kayıt olduktan sonra tamamen restore edilmiş hacmindeki kapalı iki hücre için yüksek çözünürlüklü düşsel 3D görüntü yığını (şekil 3B) üzerinden seçildi (Ayrıca bkz: Tamamlayıcı film S1). Ek uranyl asetat ve kurşun sitrat ile boyama ardından dizileri görüntüsü SEM'de 3 C rakam 60 nm görüntü piksel; kaydedilen genel bir bakış, gösterir Resmin merkezine karanlık meydanda nerede otofokus işlevleri idam edildi ve ek doz için hafif kirlenme yol konumunu gösterir. Uygun ROIs bu seri bölümler (dilim 51-248 435 dilimleri toplam) içinde FLM yığın içinde seçilen iki hedef hücreleri içeren bir 5 nm görüntü piksel boyutu ile sonra kaydedildi (şekil 3D; Ayrıca Tamamlayıcı film S2bakınız).
Burada açıklanan SEM dizide otomatik hiyerarşik görüntüleme yazılım/donanım platformu çözüm ZEISS Atlas 5 ile yapıldı. İlk olarak, Bütün dizi genel bir bakış ile SE dedektörü kullanılarak oluşturulmuş çok büyük (1.000 nm) görüntü piksel ve çok düşük Işınma Zamanı (şekil 4A). Sadece doku özetleyen bir yatırım Getirisi için dizinin tüm diğer bölümleri bulaşan ve ilk bölümüne yerleştirilir. Bu bölümde set sonra uzun bekleme süresi (4B rakam) kullanarak 60 nm görüntü piksel ile kaydedildi. Son olarak, iki hedef hücreleri artı bir "sahne yanlışlık için hesap için hücreleri çevreleyen tabaka" içeren bir site küme aşağıdaki parametrelerle kuruldu: ESB (enerji seçici Backscatter) dedektörü, 5 nm görüntü piksel, çok uzun (40 µs) durmak zaman ( Şekil 4 c). Böyle bir görüntüye zum hücre altı detay (şekil 4 d) boşluklar (V), mitokondri (M), çekirdek (N) ve endoplazmik retikulum (oklar) gibi gösterir. Ayrıca bir hedef hücre hücre altı en ayrıntısına kadar bütün dizi bir bakış yakınlaştırma için Tamamlayıcı film S3 bakın.
Burada (200 bölümler) gösterilen dizi artı bir ek 250 bölümlerden birini üretmek için yaklaşık 8 h aldı, LM (el ile) FLM kaydetmek ve bir gün için leke için bir gece. Boyama sonrası yaklaşık 1-2 h toplam bireysel diziler sayısına bağlı olarak alır. SEM kayıt için bir kaç saat Atlas koşmak ayarlamak için gerekli ve otomatik kayıt oldu 3-4 h orta çözünürlük (60 nm piksel boyut) bölüm kümesinin (200 bölümleri, 450 x 200 µm2) ve yaklaşık 5 gün yüksek çözünürlüklü (5 nm piksel boyutu) için yatırım Getirisi iki hedef hücreleri (200 bölümleri, 55 x 30 µm2) içeren. Burada gösterilen örnek düşük metal içeriği nedeniyle, çok yavaş bir tarama hızı (belgili tanımlık şimdiki elde edilebilir bulmak için) bir bekleme süresi 40 µs, yüksek çözünürlüklü yatırım Getirisi için örtük bir iyi sinyal-gürültü algılama erişmek için kullanılan gerektiğini unutmayın.
Birkaç adım vardır tüm iş akışında tuzaklar için eğilimli: ideal şeritler az ya da düz ve doğru sırada (5A rakam) yerleştirilmiş olmalıdır. Ancak, bent (şekil 5B), eğri (şekil 5 d) ya da kırık şeritler kez üretilmektedir. Bu yanlış düzeltme (önde gelen ve firar kenarları tam olarak paralel) veya non-birörnek uygulanan yapışkan nedeniyle, aynı zamanda asimetrik ya da düzensiz infiltre örneği neden olabilir. Özellikle zahmetli olduğu çok sert ve yumuşak olan bileşenleri. İkinci bileşenleri (şekil 5C) burada gösterilen bitki kökleri gibi hücre duvarına sızmak zor olabilir. Bu durumda, kıvrımlar (ok uçları) kolayca değişken sıkıştırma ve gevşeme kesit sırasında neden olabilir. ROIs şerit eğriliği karşılamak için döndürülebilir beri SEM Imaging otomatik için kıvrımlı şeritler, büyük bir sorun değildir.
Başka bir önemli adım protokolündeki boyama: yetersiz yıkama yol kalıntıları bölümüne (şekil 5E, F) ve en kötü durumda en ilginç alanı ( şekil 5Fiki hedef hücrelerde birini yuvarlağına) kapsamaktadır. Ayrıca, bıçak tekne içine, örneğin, bir kirli substrat taşıyıcı ile tanıtılan toz (şekil 5 d, güçlü ışık saçılma parçacıklar) ciddi sorunlara neden olabilir: FLM, toz-ebilmek var olmak son derece floresan (bkz bazı dilimler halinde tamamlayıcı film. S1) bazı kayıt algoritmalar fonksiyonu için böyle bir ölçüde. TrakEM17 "align" işlevinde ancak, Tamamlayıcı film S1içinde gösterildiği gibi yığınlar işleyebilir.
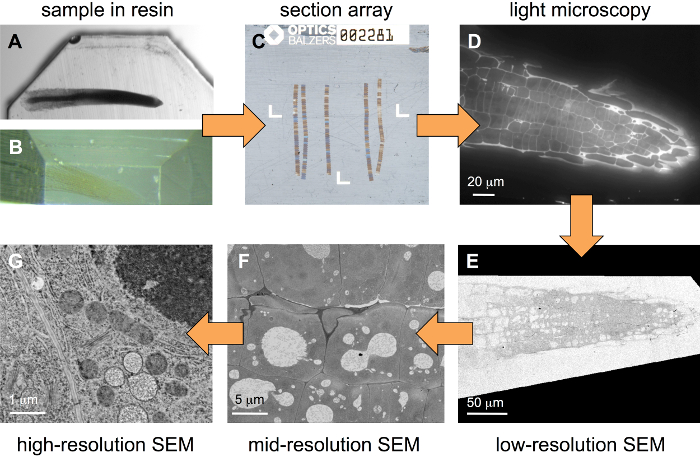
Şekil 1: iş akışı için Bağdaşık hiyerarşik düşsel. Bir örnek başlayan katıştırılmış bir reçine bloğunda (A, güçlü metalize örnek), örnek ilk kesilmiş (B, zayıf metalize örnek) ve sonra diziler seri bölümler (C) birkaç kurdela oluşan, buraya yerleştirilen bir Coverslip, ITO kaplı bir ultramicrotome kullanılarak üretilmektedir. Bir floresan boya boyama sonra yığınları görüntülerin bir geniş alanlı FLM (D) kaydedilir. Sonra daha fazla mermi ağır metal boyama tuzlar, yığınlar farklı çözünürlüklerde (görüntü piksel boyutları) bir SEM (E-G) görüntüsü. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 2: diziler hazırlanması için araçları. Substrat tutucu bir standart ultramicrotome(a)bağlı dolaşım yedi eksenli micromanipulators monte: dikey (1) ve yatay (2) hız ve substrat taşıyıcı (3), devirme vurgulanmış olan daireler, vidalar, yöneliktir . Geniş yüzeylerde (ok), burada bir slayt ölçekli alüminyum taşıyıcı (B) monte edilmiş plazma-harekete geçirmek silikon gofret bir parçası ile karşılamak için büyük boy bir tekne ile jumbo elmas bıçak. 20 µL distile su damlaları bir plazma-harekete geçirmek substrat (D) üstünde ya da bir tedavi edilmezse silikon gofret substrat (C) üzerine yerleştirilir. Dört şerit ITO kaplı bir coverslip alt amaçları tarafından bağlı bıçak tekne yüzer. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
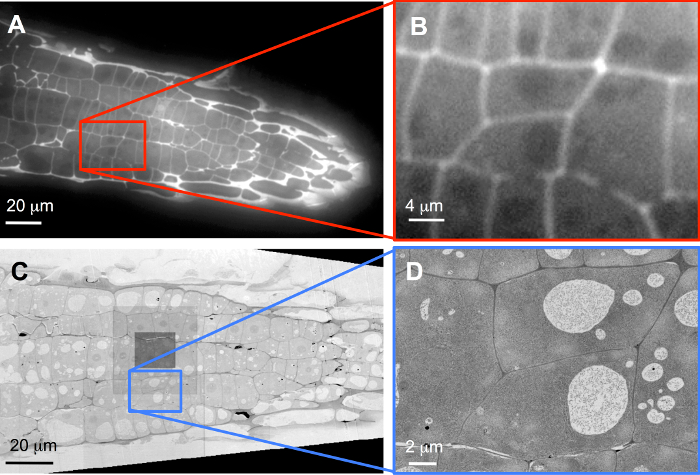
Şekil 3: SEM verilerle LM veri korelasyon. Genel bakışlar (A, C) ve hedef hücreler (B, D) kaydedilen FLM (A, B) ve SEM (C, D). (B) bir yazılım zoom ve (C) 60 nm görüntü piksel boyutu ve (D) ile kaydedilir iken özgün veri bir 1,388 x 1,040 piksel kamera yonga üzerinde 40 X objektif lens ile gerçek gösteren 5 nm görüntü piksel boyutu ile kaydedildi SEM çözünürlük artışı Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 4: hiyerarşik ZEISS Atlas 5 AT. kullanarak SEM görüntüleme Bir dizi genel bakış ile 1.000 nm Görüntü piksellerini SE dedektörü(a)kullanarak kaydetti. Doku her bölümünde yerleştirilir ve 60 nm görüntü piksel (B) ile kaydedilen yatırım Getirisi ile bölümü ayarlar. Hedef hücrelere yerleştirilir ve 5 nm görüntü piksel (C) ile kaydedilen bir seri yatırım Getirisi ile site belirler. Böyle yüksek çözünürlüklü görüntü (D) içine zum yapıldığında, hücre içi membran bölmeleri boşluklar (V), çekirdek (N), mitokondri (M) ve endoplazmik retikulum (oklar) gibi görünür hale gelir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
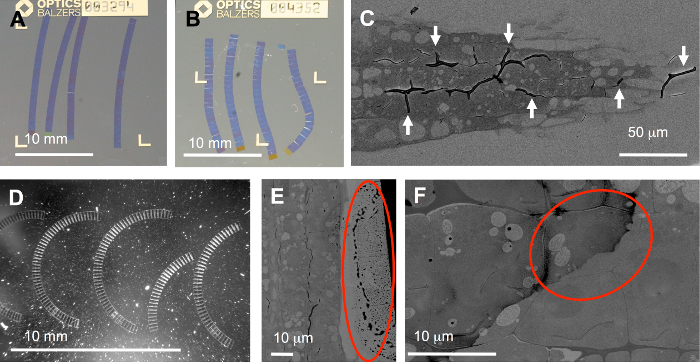
Şekil 5: tipik sorunlar. 1. parça işleminden doğan: kesit sırasında coverslips ITO kaplı olan ideal düz(a)ama düzensiz sıkıştırma yerleştirilen şeritler bent (B) veya kıvrımlı şeritler (D) veya hatta kıvrımlar (C) neden olabilir. 2. neden substrat ve kurdeleler su, örneğin, kesit ve boyama sırasında işleyerek: ışık parçacıkları substrat (D) saçılma, RIM damlacıkları bölümü ( Eçemberde) veya kir bulaşmış dışarı nedeniyle yetersiz doku üzerinde (F) Boyama sonra yıkama. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tamamlayıcı film S1: FLM görüntü yığını. 435 görüntüleri TrakEM17 kullanarak Fiji16 ' hizaladım ve film dosyası (.avi) olarak kaydedilmiş. Bu dosyayı indirmek için buraya tıklayınız.
Tamamlayıcı film S2: SEM görüntü yığını. 210 fotoğraf TrakEM17kullanarak Fiji16 ' uyumlu. Bu veri kümesinin özgün yığını (300 fotoğraf) 15 GB oldu. (Hizalama ve sadece iki hücre hedef için kırpma sonrası) 3,3 GB yığından küçültülmesi için o x ölçekli ve y 0.2 bir faktörle Fiji kullanarak ve sonra .avi film kaydedilir. Bu dosyayı indirmek için buraya tıklayınız.
Tamamlayıcı film S3: SEM seviyelerinde farklı çözünürlük ile yakınlaştırma Film içinde oluşturulan ve .mp4 biçiminde Atlas 5 yazılım ihraç. Bu dosyayı indirmek için buraya tıklayınız.
Tartışmalar
Bir doku Multi-Modal hiyerarşik AT tarafından içindeki belirli hücreleri hedefleme için bir iş akışı gösterilmiştir: reçine gömülü bir örnek, bir özel tasarlanmış substrat tutucu kullanarak iletken bir substrat yerleştirilen seri kesitler, bir dizi içine doğradı. Bir fluorophore ile etiketleme ve FLM görüntüleme sonra yeniden oluşturulan birim hedef hücreleri seçmek için kullanılır. Ek boyama ağır metaller ile kontrast tanıtmak için tur sonra bu hedefleri bir SEM bir otomatik yazılım platformu kullanarak Nano çözünürlükte birkaç yüz bölüm üzerinde görüntüsü.
Birkaç uzun şeritler yoğun dolu diziler üretmek için burada açıklanan benzer bir substrat tutucu gereklidir. Yetenekli ve sabırlı kişi birkaç şeritler bıçak tekne yarı dalmış bir silikon yüzey ekleyin ve kurdeleler yüzey üzerinde oturuyorsun kadar yavaş yavaş su seviyesini düşürerek dizi almak mümkün olabilir. Ancak, bizim deneyim ne zaman belgili tanımlık substrate bıçak tekne (1.3.2 protokolündeki cf. Not) herhangi bir bölümünü dokunuyor oluşumu paramparça için bir eğilim vardır. Buna ek olarak, bu yordam ITO kaplı yüzeyler ile çok daha zor olacaktır: (1) ITO-cam şeffaflık nedeniyle su kenarı kurdele uçlarını iliştirilecek; olduğu görmek zordur ve (2) ITO kaplı yüzey çok parlak silikon gofret kadar kaba olduğu için kurdeleler bölümlerin sırasını böylece yok edip Asansör-out ve birkaç bölümden oluşan daha küçük parçaları savrulabilirsırasında kırmak eğilimindedir.
Tüm iş akışı da korelasyon FLM veri olmadan mümkün olabilir. Bu durumda, veri toplama SEM içinde çeşitli oturumlarda yapılması gerekebilir. İlk 3D yeniden yapılandırma ya da en azından düşük veya orta çözünürlükte veri değerlendirme hedefleri tanımlamak gerekli olabilir. Buna ek olarak, aydınlık alan LM için geleneksel histolojik lekeleri (değil gerektiren FLM) uygulanabilir. Zaten18, ilk kağıt üzerinde gösterdiği gibi diziler üzerinde etiketleme veya genetik olarak flüoresan proteinleri (XFPs) kodlanmış veya etiketleme önceden katıştırma antikor are-in yön, diğer seçenekleri6,7,8 Floresans numune hazırlama sırasında korunması ile.
Belirli bir kalınlık bölümlerini ve 3B cilt elde edilen ayrık örnekleme kullanımı genel kısıtlamasıdır tartışılan yöntem: Z de çözüm sadece olabilir bölümleri kalınlık olarak iyi SEM tek veri bölümü yüzeyden (d toplar bu yana epending Seçili birincil enerji/açılış enerji). Bu elde edilen 3B cilt Anizotropik voxels, e.golduğu anlamına gelir., 5 x 5 x 100 nm3 Eğer 100 nm bölümleri ve bir görüntü piksel boyutu 5 nm kullanılır. Bir boyut aralığı 1 µm aşağıda çok küçük varlıklar için bu gerçek bir ultrastructural açıklama için yeterli olmayabilir. SEM Imaging otomatik için kullanılan sahne doğruluğunu daha teknik bir kısıtlamadır. Bu nedenle, tam hedef alan görüntüsü güvence altına almak için bir yatırım Getirisi daha büyük sahne doğruluk özellikleri seçmek gereklidir.
SBF-SEM ve FIB-SEM blok suratlı görüntüleme yöntemleri olarak göre Bağdaşık Anizotropik voxels, yukarıda açıklandığı gibi kesin bir dezavantajı vardır. Ne zaman uygun drift düzeltme yer FIB-SEM ile 5 x 5 x 5 nm3 izotropik voxels elde edilebilir.
Yeniden oluşturulan birimin bölümler diziler hazırlanması sırasında kaybı nedeniyle boşluklar da SBF-SEM veya FIB-SEM ile karşılaştı değil bir endişe olabilir Tutkal tarafından iyi şerit stabilization ile bu genellikle sadece bir Şerit'in son bölümü için bir sorun: ne zaman serbest bırakmak o kirpik kullanarak knife-edge hasar görmüş. Ancak, deneyim, her 20 – 50 bölümlerde bir bölümünün kaybı görüntü kayıt etkilemez.
Öte yandan, diziler sonrası leke imkanı iyi sinyal ve kontrast için kök ipuçları burada gösterilen donmuş yüksek basınç gibi zayıf metalize örnekleri üzerinde bile SEM düşsel confers. Bu nedenle, çok sayıda kimyasal fiksasyonu ve metallization adımları tarafından en iyi ultrastructural korunması tehlikeye gerek yoktur. Ayrıca, orta derece metallization olan patoloji laboratuarından rutin örnekleri mükemmel veri10teslim. Sonrası gömme kontrast geliştirme genel olarak SBF-SEM ve FIB-SEM için mümkün değildir. Bu yöntemler yıkıcı olduğundan, Ayrıca, Yani, örnek görüntü, farklı çözünürlüklerde ve siteleri görüntüleme hiyerarşik veya zaman içinde daha sonra noktalarda tekrarlanan görüntüleme sırasında tüketmek mümkün değildir. Prensip olarak, sınırsız birim, büyük FOVs (örneğin, connectomics tüm fare beyinlerinde için birkaç milimetre kadar) oluşan mozaikler dikiş tarafından oluşturulan ve bölümler çok büyük sayılara AT, FIB-SEM iken, FOVs 100 µm x 100 µm ötesinde tarafından elde edilebilir rutin araçlarıyla ulaşmak zordur.
Yukarıda belirtilen yöntem SBF-SEM ve FIB-SEM hem kesit ve tam otomatik bir şekilde aynı araç içinde görüntüleme gerçekleştirmek daha fazla otomasyon iş akışının açıklandığı AT-bir avantaj olacaktır. Otomasyon kesit, bir tür var: ATUMtome12 oluşturmak ve bölümler binlerce toplamak, ama böyle bir substrat yapar gibi Kapton Teyp kullanımını zor bir FLM görüntüde diziler. ITO kaplı coverslips burada kullanılan üzerinde bile süper kararlılık düşsel mümkün. Otomasyon için daha fazla, çok istenen hedef FLM veri yığınları kayıt olurdu. Öte yandan, otomasyon pahalı olabilir ve substrat sahibi dışında burada sunulan iş akışı (donanım açısından) sadece araçları düşük yapma bir rutin EM laboratuvar veya çekirdek tesis, genellikle mevcut dayanan düzey erişim.
Açıklamalar
KIT substrat sahibinin işlevsel bir model temini için Boeckeler aygıtlar tarafından geri ödeme aldı. Marlene Thaler ZEISS mikroskobu GmbH, bu makalede belirtilen mikroskop sistemleri üretici çalışandır. Ayrıca, ZEISS SEM ve FIB-SEM Araçları için geniş bir alan, 3D görüntüleme uygulamalarında geniş bir yelpazesi için ZEISS Atlas çözüm paketleri gibi belirli çözümler sunmaktadır. Diğer yazarlar ifşa gerek yok.
Teşekkürler
Bu eser grant FKZ 13GW0044 Alman Federal Bakanlığı Eğitim ve araştırma, proje MorphiQuant-3D için desteklenen bir durumdu. Carolin Bartels teknik destek için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Instrumentation | |||
| Ultramicrotome | RMC | PT-PC | Alternative: Leica UC7 |
| Substrate holder | RMC | ASH-100 | Alternative: home built |
| Plasma cleaner | Diener | Zepto 40kHz | Alternatives: Ted Pella Pelco or other benchtop plasma cleaner Example Parameters for Diener Zepto with 40kHz generator (0-100W); 0.5 mbar, 5 sccm (Air), 10% performance |
| Widefield fluorescence light microscope | Zeiss | Axio Observer.Z1 | Alternatives: Leica, Nikon, Olympus |
| Fluorescence filter set | Zeiss | 43 HE (Cy3/DsRed) | |
| Objective lens | Zeiss | Zeiss Neofluar 40x | 0.75 NA |
| Decent workstation able to handle GB-sized image data | |||
| FESEM | Zeiss | Ultra 55 | Alternatives: FEI, Jeol, Hitachi, TESCAN |
| Name | Company | Catalog Number | Comments |
| Sectioning | |||
| Razor blades | Plano | T585-V | |
| Diamond knife for trimming 45° | Diatome | DTB45 | |
| Diamond knife for trimming 90° | Diatome | DTB90 | |
| Jumbo diamond knife for sectioning | Diatome | DUJ3530 | |
| Silicon wafer (pieces) | Si-Mat | Custom Made | Doping: P/Bor, orientation: <100>, thickness: 525 ± 25 µm, resistivity: 1-30 Ω-cm http://si-mat.com/silicon-wafers.html |
| ITO-coated coverslips | Balzers | Type Z | 22 × 22 × 0.17 mm https://www.opticsbalzers.com/de/produkte/deckglas-fenster/corrslide.html |
| Aluminium carrier | Custom Made | 76 × 26 mm | |
| Wafer forceps | Ideal-tek | 34A.SA | |
| Stubs forceps | Dumont | 0103-2E1/2-PO-1 | Dumoxel-H 2E 1/2 |
| Diamond scriber | Plano | T5448 | |
| Eyelash/very soft cat's hair | Selfmade | Alternative: Plano | |
| Brush | Selfmade | ||
| Pattex contact adhesive | Pattex | PCL3C | Kraftkleber Classic (the yellowish one) |
| Fixogum | Marabu | 290110001 | for fixing substrate to carrier |
| Adhesive tape | 3M | 851 | for fixing substrate to carrier |
| Isopropanol | Bernd Kraft | 07029.4000 | |
| Xylene | Carl Roth | 4436 | thinner for glue mixture |
| Rotihistol | Carl Roth | 6640 | alternative, limonene based thinner |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Image processing | Open source | Fiji (http://fiji.sc/#download) | |
| Image acquisition | Zeiss | Atlas 5 AT (module for Zeiss SEM) | Alternative for automated image acquisition: WaferMapper: https://software.rc.fas.harvard.edu/lichtman/LGN/WaferMapper.html |
| Name | Company | Catalog Number | Comments |
| Staining | |||
| Propidiumiodide | Sigma-Aldrich | P4170 | Stock solution: 1.5 mM in 0.1 % sodium azide |
| Uranylacetate | Science Services | E22400 | |
| Lead(II) Nitrate | Merck | 107398 | |
| Tri Sodium Citrate Dihydrate | Merck | 106448 | |
| NaOH pellets | Merck | 106469 | |
| 1M NaOH solution | Bernd Kraft | 01030.3000 | |
| Glass petri dish | Duran | 23 755 56 | |
| Name | Company | Catalog Number | Comments |
| Mounting | |||
| Stubs | Plano | G301F | |
| Carbon pads | Plano | G3347 | |
| Copper tape | Plano | G3397 | double-sided adhesive, conductive |
| Silver paint | Plano | G3692 | Acheson Elektrodag 1415M |
| Name | Company | Catalog Number | Comments |
| Solutions/mixtures | |||
| Adhesive mixture for coating blocks | Pattex contact adhesive /xylene as thinner, ratio 1:3. (Alternative for xylene: Rotihistol) | ||
| Reynolds lead citrate | 50 mL: Dissolve 1.33 g of lead(II) nitrate in 10 mL of dH2O. Dissolve 1.76 g of tri-sodium citrate dihydrate in 10 ml dH2O. Mix both and add 1 M sodium hydroxide until the solution is clear. Fill up with dH2O to 50 mL. | ||
| Propidium iodide staining solution | Prepare 1:1500 dilution from stock in dH2O. Vortex for adequate mixing. | ||
| Aqueous uranyl acetate | Dissolve 3 % uranyl acetate in dH2O (mix thoroughly). |
Referanslar
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: Volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Wanner, A. A., Kirschmann, M. A., Genoud, C. Challenges of microtome-based serial block-face scanning electron microscopy in neuroscience. J Microsc. 259 (2), 137-142 (2015).
- Kizilyaprak, C., Daraspe, J., Humbel, B. Focused ion beam scanning electron microscopy in biology. J Microsc. 254 (3), 109-114 (2014).
- Wacker, I., Schröder, R. R. Array tomography. J Microsc. 252 (2), 93-99 (2013).
- Tapia, J. C., Kasthuri, N., Hayworth, K. J., Schalek, R., Lichtman, J. W., Smith, S. J., Buchanan, J. High-contrast en bloc staining of neuronal tissue for field emission scanning electron microscopy. Nat protoc. 7 (2), 193-206 (2012).
- Lucas, M. S., Günthert, M., Gasser, P., Lucas, F., Wepf, R. Bridging Microscopes: 3D Correlative Light and Scanning Electron Microscopy of Complex Biological Structures. Methods Cell Biol. 111, 325-356 (2012).
- De Boer, P., Hoogenboom, J. P., Giepmans, B. N. Correlated light and electron microscopy: ultrasructure lights up!. Nat Methods. 12 (6), 503-513 (2015).
- Verkade, P., Müller-Reichert, T. . Methods in Cell Biology Correlative Light and Electron Microscopy III. 140, 1-352 (2017).
- Gibson, K. H., Vorkel, D., Meissner, J., Verbavatz, J. -. M. Fluorescing the Electron: Strategies in Correlative Experimental Design. Methods Cell Biol. 124, 23-54 (2014).
- Wacker, I., Schröder, R. R., Schroeder, J. A. Pathology goes 3D: Exploring the potential of array tomography versus FIB nanotomography for a CADASIL sample. Ultrastruct Pathol. 41 (1), 114-115 (2017).
- Wacker, I., Spomer, W., Hofmann, A., Thaler, M., Hillmer, S., Gengenbach, U., Schröder, R. R. Hierarchical imaging: a new concept for targeted imaging of large volumes from cells to tissues. BMC Cell Biol. 17 (1), 38 (2016).
- Hayworth, K. J., Morgan, J. L., Schalek, R., Berger, D. R., Hildebrand, D. G. C., Lichtman, J. W. Imaging ATUM ultrathin section libraries with WaferMapper: a multi-scale approach to EM reconstruction of neural circuits. Front Neural Circuits. 8, (2014).
- Micheva, K. D., O'Rourke, N., Busse, B., Smith, S. J. Array Tomography: Production of Arrays. Cold Spring Harb Protoc. 11, 1267-1269 (2010).
- Fahrenbach, W. H. Continuous serial thin sectioning for electron microscopy. J. Elec. Microsc. Tech. 1 (4), 387-398 (1984).
- Harris, K. M., et al. Uniform serial sectioning for transmission electron microscopy. J Neurosci. 26 (47), 12101-12103 (2006).
- Schindelin, J., Arganda-Carreras, I., Frise, E., Kaynig, V., Longair, M., Pietzsch, T., Preibisch, S., Rueden, C., Saalfeld, S., Schmid, B., Tinevez, J. -. Y., White, D. J., Hartenstein, V., Eliceiri, K., Tomancak, P., Cardona, A. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Cardona, A., Saalfeld, S., Schindelin, J., Arganda-Carreras, I., Preibisch, S., Longair, M., Tomancak, P., Hartenstein, V., Douglas, R. J. TrakEM2 software for neural circuit reconstruction. PLoS ONE. 7 (6), e38011 (2012).
- Micheva, K. D., Smith, S. J. Array Tomography: A new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55 (1), 25-36 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır