Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yağ asidi 13C profil oluşturma Isotopologue trofik karbon Transfer ve Lipid metabolizması, omurgasız tüketicilerin sağlar
Bu Makalede
Özet
Yani, yağ asitleri asimilasyon tüm molekül ve transfer tüketici doku içine yağ asidi trofik marker yaklaşım değişiklik, engel olmayan ya da küçük küçük toprak omurgasızlar yağ asidi metabolizması bilgi boşlukları tarafından. Isotopologue profil oluşturma trofik etkileşimleri disentangle için değerli bir araç olarak sağlanır.
Özet
Çünkü onlar genellikle tam bir molekül asimile ve küçük veya diyet farklı trophic düzeyleri arasında yönlendirme sağlayan hiçbir değişiklik ile tüketici doku içine transfer yağ asitleri (FAs) gıda web ekoloji yararlı biyolojik vardır. Ancak, SK trofik marker yaklaşım hala toprak fauna lipid metabolizması sınırlı bilgi engel oluyor. Bu çalışmada yağ asidi metabolizması yollar iki yaygın toprak Collembola, Protaphorura fimata ve Heteromurus nitidusbir izleyici olarak tamamen etiketli palmitik asit (13C16:0, 99 atom %) kullanılır. Kader ve metabolik değişiklikler bu öncü araştırmak için isotopologue profil oluşturma yöntemi, tek iyon izleme kullanarak kütle spektrometresi tarafından gerçekleştirilen sunulur. Ayrıca, ters yönde laboratuvar deney besleme, ayıklama ve baskın lipid fraksiyonları (nötr lipitler, fosfolipitler) ve ilgili formül hesaplamaları metilasyonu yanı sıra açıklanmıştır. Isotopologue profil oluşturma yalnızca genel 13C zenginleştirme yağ asitleri 13habercisi etiketli C türetilmiş verim değil ama aynı zamanda üst iyon (Yani, SK moleküler iyon kütle aşan isotopologues desen oluşturur M+) her biri bir veya daha fazla kitle birimleri (M+ 1, M+ 2, M3, vb) tarafından SK etiketli. Bu bilgi de novo sentezi ile karşılaştırıldığında tamamen tüketilen bir SK diyet yönlendirilmesini oranı üzerinde sonuçlar sağlar. İsotopologue profil oluşturma trofik etkileşimleri disentangle için toprak hayvanlarda yağ asidi metabolizmasının değerlendirilmesi için yararlı bir araç olarak önerilmektedir.
Giriş
Toprak gibi şifreli bir yaşam alanı, trofik ilişkileri adresine zordur ve fauna küçük boyutuna göre daha fazla kısıtlanır. Son on yılda beslenme stratejileri toprak fauna altında alan koşulları1,2,3tanımlamak için kullanılan biyolojik olarak yağ asitlerinin özellikle biyokimyasal ekoloji gelişmeler gördü. Yağ asitleri kaynaklardan gelen tüketici dokusunda tüm molekül olarak dahil edilebilir gerçeğine dayanarak bu, bir işlemi diyet yönlendirme4olarak. Yani, mantar dan nematodlar Collembola5için üç trophic seviyeleri üzerinde transfer yağ asitlerinin bildirilmiştir. Son zamanlarda, yırtıcı fauna6,7 olarak kabul edildi ve yağ asitleri toprak gıda ağları içinde trofik işaretleyici olarak ilk incelemelere yayımlanmış8,9olmuştur.
Trofik etkileşimleri hakkında daha fazla bilgi (SK-SIP) sondalama yağ asidi kararlı izotop tarafından elde edilebilir. 13C belirlenmesi /12C oranları yağ asitleri diyetler ve tüketicilerin can ikili bağlantılar atfetmek ve ilişkili karbon akışını tahmin ve karasal olarak istihdam tatlı su ve deniz gıda ağları10,11 ,12,13. Temel varsayım diyet yönlendirilmiş yağ asitleri enzimatik süreçleri tabi değildir; Bu nedenle, onların 13C sinyal, Yani, 13C /12C yağ asidi, tüketici oranıdır diyet1benzer. Ancak, gıda zinciri 13C izi yavaş yavaş tükenmesi su sistemlerinde, böylece SK-SIP geniş uygulama trofik çalışmalar14,15,16engelleyen bildirilmiştir. Ayrıca, karasal gıda ağları içinde en omurgasızlar lipid metabolizmasında bilgide hala sınırlıdır.
Lipid metabolizma yollar tüketicilerin bir anlayış trofik marker yağ asitleri gıda web ekoloji nicel karbon akışında belirlenmesi için aracı olarak kullanımı için gereklidir. Bu akılda, 13C-isotopologue profil oluşturma, umut verici bir yöntemdir içinde hangi ilkeye herhangi bir biyolojik sistem17, karbon metabolizması incelenmesi için uygulanabilir. 13C etiketli karbon substrat, 13C metabolik ağ dağıtım getirilmesi sonrasında oluşturulan metabolik ürünler tüketici gösterisinde belirli isotopologue dağıtım beri izlenebilir. Bu nicel nükleer metabolik rezonans spektroskopisi18,19 veya kütle spektrometresi20,21, onun yüksek nedeniyle düşük biyokütle ile ikinci tercih içinde biyolojik örnekleri ile tespit edilebilir duyarlılık.
Her ne kadar isotopologue profil oluşturma edilmiş başarıyla amino asitler için uygulanan ve içgörü vivo içinde karbon metabolizması bakteriyel patojenler17,22,23, yağ kendi uygulamasında sağlanan asitler geride gecikmeli. İlk detaylı analiz öncü yağ asidi, diyet yönlendirme veya bozulma toprak omurgasız tüketicilerin, β-oksidasyon yoluyla etiketli bir kararlı izotop kaderi üzerinde son zamanlarda Menzel vd tarafından gerçekleştirildi 24. burada, metodolojik temelini 13C yağ asitleri sık toprak omurgasızlar, Collembola anahtar alt öğelerin analizini isotopologue ardından etiketli ile birleşme deneyleri için sağlanır. Onlar are iyi için onların trofik marker yağ asitleri8,25araştırıldı ve toprak gıda web önemli bileşenleri biçimi olarak bu microarthropods iyi model grubu vardır.
Lipid metabolizma yollar tüketicilerin bir anlayış trofik marker yağ asitleri gıda web ekoloji nicel karbon akışında belirlenmesi için aracı olarak kullanımı için gereklidir. Mevcut iletişim kuralı bir laboratuvar deney ve çıkarma ve baskın lipidler kesirler (nötr lipitler, fosfolipitler) metilasyonu biyokimyasal yordamları Collembola besleme için dizayn ve kurulum verir. Nasıl yağ asitlerinin isotopologue kompozisyon tarafından kütle spektrometresi analiz edilir gösterir ve ilgili formül ve hesaplamaları açıklar. Bu yordamı sonuçlanır: (i) üst iyon (Yani, yağ asidi moleküler iyon M+) kitle tarafından bir veya daha fazla aşan isotopologues oranları birimleri (M+ 1, M+ 2, M3, vb) ve (II) genel kitle 13 C zenginleştirme yağ asitleri 13C etiketli habercisi türetilmiş. Collembola için kullanılmış olmasına rağmen bu yaklaşım genellikle diğer avcı-av etkileşim bunlar kontrollü koşullarda başarılı etiket alımını sağlamak için yeterli miktarda culturable ve sonraki öncül uygulanabilir doğrulama.
Protokol
Açıklanan protokol hayvan etik yetki altında girmemektedir. Ancak, ne zaman insanlar yüksek hayvanlar açıklanan protokollere uyum, kurumsal hayvan Etik Komitesi için hayvan Taşıma Protokolü onaylanmış ilgilen.
1. hayvan tarımı
Not: Tüm iyi kurulmuş protokolleri26,27,28tarihinde dayalı deneysel adımlar açıklanmıştır. Biotests laboratuvarda kolayca culturable organizmalar sürekli bir kaynağı gerekir. Burada, Collembola türler Protaphorura fimata (Gisin, 1952) ve Hetermurus nitidus (Templeton, 1835) kullanılmıştır. Her iki tür olarak fırıncı mayası ile beslenen üretken laboratuvar kültürleri korumak basittir.
- Sıkı uygun kapakları ile plastik microcosms içinde (çapı 7 cm, yüksekliği 4.5 cm), aktif kömür, Paris alçı, karışımı ekleyin ve distile su son derece nemli üreme substrat (şekil 1A) sağlamak için.
- Microcosms mix yeterli substrat, Örneğin, bir toplu iş 10 microcosms için hazırlanırken. Paris alçı (225 g) parçalarını Mix 9 ve kuru aktif kömür (25 g) birlikte bir sıva tencerede, 1 kısım distile su (250 mL) dikkatle yaklaşık 10 parçaları ekleyin ve karıştırma, oda sıcaklığında olmadan 5 dakika oturmak sağlar.
- Kalın bir sulu tutarlılık elde kadar hava kabarcıklarını önlemek için saat yönünde Orta hızda bir laboratuvar kaşıkla karıştırın. Hemen microcosms yaklaşık 1 cm yüksekliği için içine dökün.
- Sıva düz nazik bankta dokunarak ve dönen tarafından. Delik (Hava kabarcıkları rastgele ürün) ve (steril bir spatula ile aktif olarak eklendi) gozlerime orada yumurtalarını bırakmak için verimli Collembola teşvik olabilir unutmayın. Bu çalışmada delikleri ve aynı tekrarlanabilir koşullara sahip lehine gozlerime kaçınılmalıdır. Ancak, gösterim amacıyla bazı delikler şekil 1B sunar.
- Yaklaşık 1-2 gün oda sıcaklığında kurutma izin; 60 ° C'de kuluçka o zaman 1-2 h azaltabilir.
- Microcosms kullanmadan önce belgili tanımlık substrate hafif nemli olana bir pipet ile musluk suyu ekleyerek nemlendirin. Evren Collembola yumuşak bir manikür ve kuruma için duyarlı gibi düzenli olarak saf su ekleyerek rutubetli.
- Collembola kolayca bir basit emme borusu, Yani, bir uzun silikon tüp yaklaşık 25 cm kullanarak sıva üsse transfer uzun bir pipet ucu ile tüpün içine emme hayvanların önlemek için küçük bir kafes ile donatılmış. Alternatif olarak, hayvanlar onlara küçük bir fırça kılları üzerinde uygun izin vererek aktarın.
- (Bkz. Adım 1.2) Aktarım 30 taze Collembola yeni microcosms yumurtadan ve gıda (yaklaşık bir bıçak ucu) olarak toz kuru fırıncı mayası sağlar (şekil 1B); haftada en az iki kez yenilemek. Plan üç bağımsız örnekleme günlük çoğaltır; Bu çalışma gün 0 - 7 ve 14. 15 ° C'de karanlıkta kuluçkaya. Sabit bir sıcaklık esastır sürdürmek, yağ asitleri gibi membran akışkanlık için gereksinimleri karşılamak için hayvan metabolizma tarafından değiştirilmiş.
- Collembola fırıncı mayası ile homojen bir 13C almak için pozlama deneyler başlamadan önce dört hafta için besleme /12C sinyal ve yağ asitleri desende. Tüm yumurta (şekil 1 c), dışkı granül, kaldırmak için emme borusu veya bir fırça kullanın ve exuviae düzenli olarak onları böylece onların lipid profili değiştirme hayvanları beslemek.

Şekil 1: Collembola tarımı. (A)evren substrat, kurutulmuş Paris alçı, aktif kömür ve distile su karışımı üreme ile dolu. (B) ve (C) temsili numune Protaphorura fimata kültür; Kuru Baker's maya besin kaynağı olarak ve aynı zamanda üreme substrat (siyah ok) delik olarak kullanılan küçük nuggets Not (B) yanı sıra iki yumurta (beyaz ok) (C). Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
2. diyet, hasat ve örnek işleme etiketleme
- Etiketleme
- Collembola kültürler kurduktan sonra dört hafta 30 bireyler yeni microcosms yerleştirin ve 15 ° C'de karanlıkta kuluçkaya.
- 13C harfiyle palmitik asit fırıncı mayası ile bir oranı 0.5:1, örneğin, 5 g, bir spatula ile karıştırılarak bir tamamen 13C harfiyle palmitik asit (13C16:0, 99 atom %) içeren Fırıncılar Maya besleyerek darbe etiket tanıtmak 13 C16:0 ve 10 g baker Maya kuru. Her Evren üzerinde bir bıçak ucu hakkında yerleştirin.
- 6 h sonra bu etiketli gıda tamamen etiketlenmemiş fırıncı mayası ile değiştirin.
-
Daha fazla ekimi
- Deneme süresince her üç gün Maya diyet yenilemek ve ne Collembola bu süre içinde-ecek tüketmek daha yüksek miktarda ekleyin. En önemlisi, Collembolan yumurta, dışkı granül ve düzenli olarak sağlanan gıda hayvanlar tarafından özel besleme sağlamak için exuviae kaldırmak için bir emme borusu veya fırça kullanın.
- Hasat
- Örnek microcosms destructively günlük 7 güne kadar. Daha sonra 14 günde üç bağımsız çoğaltır her örnekleme zamanında toplamak; farklı örnekleme zamanları mümkündür.
- 10 mL cam tüpleri Teflon coated vidalı kapakları, her örnek için bir donatılmış hazırlayın. Önceden bir cam yıkayıcı bu tüplerde temiz ve daha sonra iki kez deiyonize suyla durulayın. Son olarak, hidrofobik izlerini kaldırmak için kirletici iki kez kloroform (HPLC grade), 2 mL ekleyerek yıkama girdap kabaca ve solvent atın.
- Kontrol örnekleri (0 gün) için 3 30 Sigara maruz Collembola öncesi kültürlerden gün 0 örnek almam.
- Maruz kalan örnekleri için (1. gün ve sonraki sürümleri), almak için her durumda 3 30 günlük örnekleri Collembola kültürler ayda maruz beslenen 13C harfiyle palmitik asit ve fırıncı mayası karışımı ile.
- Collembola taze ağırlık bir ultra-microbalance tarafından kaydedin. Hayvanlar bir aspiratör veya uygun ölçek-tava için fırça kullanarak aktarın. Ölçek-tava, şok-cool hayvanlar (2 h-80 ° C) daha önce Tartım sırasında Collembola kolay kullanım sağlamak için. Alternatif olarak, 10 min için bir CO2 dere güvenli bir şekilde hayvanlar stun.
- Doğrudan sonra ağırlığında hayvanlar ölçek-tava dikkatle 10 mL cam test tüpleri koymak. Tüpler 1 mL metanol (HPLC grade) ve mağaza-20 ° c ile analiz kadar doldurun.
Not: Bu adımından itibaren organik çözücüler ilgili örnek kullanım ile plastik donanımları kaçının; Bunun yerine dağıtıcılar ve solventler için hem de cam kaplar uygundur Pipetler kullanın.
3. lipid çekme--dan hayvan doku ve Methanolysis
- Üç cam test (Teflon coated vidalı kapakları ile donatılmış) tüpleri sadece 1 mL metanol boş değerler içeren toplu iş başına hazırlayın. Önemlisi, eklemek veya bu protokol için yalnızca cam Pipetler veya kloroform/metanol durulanır solvent dayanıklı dağıtıcılar tarafından kullanılan herhangi bir solvent aktarabilirsiniz.
- Lipid çıkarma işleminin başında Muhafazası (veya silme) için buharlaşma tarafından; uygulanan metanol azaltmak kompakt benchtop dönme vakum yoğunlaştırıcı (RVC) bir vakum pompası ve soğuk bir tuzak ile donatılmış önerilir. Açık tüpler RVC aktarmak ve kuru 50 ° C ve vakum basınç 20 dk için 200 hPa kadar buharlaşır.
- Tek fazlı ayıklama solvent (chloroform/methanol/0.05 M fosfat tampon 1:2:0.8, pH 7,4) 5 mL (boşluklar dahil) her örnek ekleyin ve oda sıcaklığında Collembolan lipidler gecede sallayarak ayıklamak (~ 200 devir/dakika).
- Çözücü için yeni tüpler aktarmak ve örnekleri ile ekstraksiyon çözücü bir ek 2.5 mL 3 h için sallayarak yeniden ayıklayın. Bundan sonra her iki adım özler birleştirmek; Pasteur Pipetler cam kullanılması önerilir. 0.8 mL kloroform ve 0.8 mL distile su ekleyin sonra mix ve 5 min için 20 ° C'de 2000 g, santrifüj kapasitesi. Son olarak, sulu ayrılması için 5 min için durmak ve kloroform örnekleri izin aşamaları.
- Yağ asidi desen analiz için Collembola toplam hücresel lipidler tarafsız lipid, glycolipid ve Fosfolipid kesirler bölün.
- Her örnek için bir silis asit sütun hazırlamak (0.5 g Molibdik asit, kafes ile ticari sütun boyutu 100-200 µm, Malzemeler tablobakınız) (Önkoşullanma) kloroform 1 mL ekleyerek. Bu süreci hızlandırmak için Kromatografi katı faz çıkış için yaygın kullanılan bir vakum blokta sütunları bağlayın. Naylon iğne kullanmayın; Paslanmaz çelik tüpler yukarıda kullanın.
- Sonra kloroform Önkoşullanma için kullanılan sütun aktarma yoluyla tek bir sütun için her örnek tam alt kloroform aşaması geçti. Bu yordamı basitleştirmek için üst sulu faz önceden kaldırılabilir. Kullanım Pasteur Pipetler, cam, ancak, sütunları kurumasına da dikkat et.
- Gittikçe lipid fraksiyonları ile 5 mL de kloroform (dahil olmak üzere tarafsız lipid yağ asitleri, NLFAs), 10 mL aseton (glikolipitler - bu projede analiz değil) ve 5 mL metanol (Fosfolipid yağ asitleri, PLFAs de dahil olmak üzere) de elute. Her kesir bireysel cam kaplar içinde toplamak.
- Ayıklama sonunda, kloroform (NLFAs) ve bir RVC içinde buharlaşma yoluyla metanol (PLFAs) azaltın. Açık tüpler için RVC aktarmak ve kuru kadar buharlaşması ~ 90 dk 60 ° C ve bir vakum 24 hPa.
- Welch (1991)29 1 mL metanol sodyum hidroksit çözeltisi (45 g sodyum hidroksit, 150 mL metanol ve 150 mL distile su) eklenmesi ile protokol sonrası lipidler (NLFA ve PLFA kesirler) Sabunlaşma başlatmak ve 100 kuluçkaya ° C 30 dk içinde bir su banyosu için. Örnek 2 dk, buzlu suda serin sonra örnekleri bankta geri koymak ve oda sıcaklığında çalışmaya devam.
- Dahili standart boşlukları dahil olmak üzere her örnek ekleyin. Bir yağ asidi deneysel organizmalarda yaygın değildir seçin; Ayrıca doymuş yağ asidi bölünme tarafından kaybı en aza indirgemek ve ara zincir uzunluğu olan bir molekül seçmek için kullanın. Birçok amaç, iyi tek sayılı nonadecanoic asit (19:0) çalışıyor. Yani, isooctane içinde 30 µL 0,74 mM çözüm ekleyin. Tam miktarı çok önemlidir - pipet ile bir microbalance duyarlığını önceden kontrol emin olun.
- Hidroklorik asit-metanol (mix 275 mL metanol ile 6.0 N hidroklorik asit 325 mL) 2 mL ekleyin, bir su banyosu ve serin 10 min 2 min için buz üzerinde hızla için 80 ° C'de kuluçkaya. Bu zaman ve sıcaklık hassas adımdır; 80 ± 1 ° C ve 10 ± 1 dk. onay kaç örnekleri su banyosu ile gidebilirsiniz aynı anda 80 ° C. tutmak için kullanın
Not: Bu yordam yağ asitleri metil esterleri (alevlerini), Yani, Gaz Kromatografi buharlaşma için stabilize yağ asidi analitler sonuçlanır. - Son olarak, hekzan/metil Tersiyer Bütil eter (1:1) 1,25 mL ekleyip hafifçe için 10 dk sonra 5 dakika süreyle santrifüj 2000 g de rock alt aşaması ve üst aşaması alevlerini oluşur tutun; Pasteur Pipetler cam kullanın. 3 mL sulu sodyum hidroksit (NaOH 900 mL distile su içinde çözünmüş 10,8 g) için bir yıkama adım ekleyin.
- Rock ve tekrar santrifüj.
- Teflon septum ile donatılmış bir Gaz Kromatografi örnek şişe cam Pasteur pipet ve transfer kullanmayı tam üst lipid içeren faz al. Bu GC ölçüm sorunları neden olur gibi sulu faz, hatta küçük miktarlarda eklemekten kaçının. Şişe saklanması ve analiz kadar-20 ° C'de depolayın.
4. GC-FID tarafından yağ asitlerinin miktar
- Gaz Kromatografi tanımlayıp Collembola (hayvan) lipidler NFLA ve PLFA kesirler alevlerini ölçmek için kullanın. Bir gaz alev iyonizasyon detektörü (FID) ile donatılmış Kromatograf (GC) kurulmuş ve kanıtlanmış ekipman30' dur.
- Alevlerini tanımlaması için o şöhret standart bir örnekteki zirvesinin tutma zamanı karşılaştırın. Bunlar, anahtar alevlerini kapsayan çeşitli gıda ürünleri ve organizmalar nitel veya nicel standart karışımıdır.
- Şöhret standart karışımları temsilcisi FAs incelenen organizma grubu ve deneysel diyet için oluşan istihdam. Collembola, bu yağ asitleri karakteristik Ökaryotlar, örneğin, Araşidonik asit (20:4ω6) gibi uzun zincirli doymamış yağ asitleri vardır. Maya diyet olarak istihdam bu linoleik asit (18:2ω6) gibi mantar işaretleri vardır. 37 farklı yağ asitleri hayvan, mantar sık oluşan sözde şöhret karması, iyi bir seçimdir ve mix bitki materyali ve bakteriyel asit metil ester (BAME) ( Tablo malzemelerigörmek).
- GC-FID üzerinde örnekleri çalıştırmak için bir dizi ile ilgili yazılım enstrümanın ayarlayın. Yönergeler için üreticinin el kitabına başvurun. Örnekleri tarafından takip dış standart karışımları (örneğin şöhret ve BAME mix), ile bağlantı işlemini başlatır. Yani, bir saklama zaman kaydırma biraz gecikme ile örnekleri çalışırken her koşmak, GC sütundan yağ asitlerinin elüsyon zamanında dikkat! Ya her 10th örnek sırayla çalıştırmak veya kilitleme tutma zamanı palmitik asit (16:0) için kullanmak bir standart içerir.
- GC ayarları araç üzerinde bağımlı uyum. Aşağıdaki programı bir yüksek performans (HP) kapiller sütun için önerilmektedir (25 m x 0.2 mm kimlik, film kalınlığı 0,33 µm. Set enjeksiyon splitless modunda 1 µL birime ve hidrojen taşıyıcı gaz kullanın. Sıcaklık programı başlangıcı (1 dk. için düzenlenen) 50 ° c ve 25 ° C min-1 175 ° C 230 ° c (5,7 min için düzenlenen) 3 ° C min-1 tarafından takip tarafından artan istihdam.
- Aşağıdaki formülü kullanarak ilgili yağ asidi bilinen tutarlarının uygulanması her Şöhret için FID tarafından alınan yanıt kullanarak organizmalar gram taze (kuru) ağırlığının başına nmol yağ asidi Hesapla:
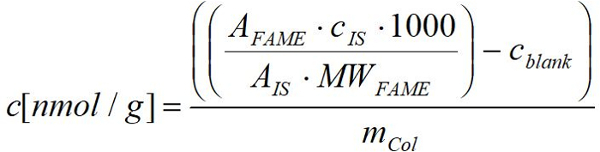
Birşöhret: pik alanı örnek ilgili ün
MWFM: µg/µmol ilgili şöhret molekül ağırlığı
CIs: µg iç standart konsantrasyonu
Is: pik alanı iç standart
mCol: ilgili Collembola örnek g taze (kuru) ağırlığı
1000: nmol için dönüştürme faktörü µmol üzerinden
cBW: nmol karşılık gelen boş değerlerin ortalamasını anılan sıraya göre şöhret konsantrasyonu
5. Isotopologue profil oluşturma tarafından 13C analiz
- İçin bir kitle seçici dedektörü (isotopologue tayini için bir elektron iyonlaşma (EI) kaynağıyla sağlanan MS) birleştiğinde bir GC sistemi kullanır.
- Bu daha fazla doymamış yağ asitleri çift Tahvil aynı sayılarla bile ayırma verir gibi bir kutup kapiller sütun (Örneğin, DB 23, CP-Sil 88) kullanın. GC sütun gibi yağ asitleri molekül iyon iyi gösterimini belirler sonuçlar için kritik bir seçimdir.
- DB 23 sütun için (60 m x 0,25 mm kimlik, film kalınlığı 0.15 µm), 130 ° c sıcaklık fırın başlayın ve 6,5 ° C/dk ile 170 ° c artış 203 ° C-3 ° C/dak bir artış ile izleyin ve 1,9 dk. 230 ° C-40 ° C/dak bir artış ile izleyin ve 280 ° C'ye 8.3 min. Set transfer satırı sıcaklığı için basılı tutun Yine, GC yöntemi araç için ayarlamak.
- Niceliksel standartlar alevlerini tüm yağ asitleri için bilinen miktarda oluşan 13C birleşme için soruşturma olması için kullanın. Bu standartlar başlangıç ve bitiş çalıştırmak her örnek serisinin koymak. Bu standartlar dan ilgi yağ asitlerinin saklama kez sınava.
- Her zaman bundan sonra etiketlenmemiş örnekleri ve etiketli probları ile başlayan deneyler ölçü örnekleri. Örnek konsantrasyonları, örneğin 1:12.5.If için araç kullanılabilir uygun bir bölme oranı uygulamak, sonra açık kalan analitler sütundan uzakta çalıştırmak her örnek bir backflush helyum ile geçerlidir.
- GC-MS yöntemine böylece SIM edinme döşeme--dan zarar vermez ve tekrarlanabilir analit saklama kere kilitleme tutma zamanı geçerli.
- Moleküler iyon 13C birleşme GC/EI-MS (SIM) modu araç izleme seçilen iyon kullanarak tarafından yağ asitlerinin belirlemek. Tam tarama modu göre artan duyarlılığı ile belirli analitler algılamak için SIM modunda çalışma sağlar.
- İlk ne mevcut olduğunu görmek için bir başlangıç tarama çalıştırın ve SIM üzerinde uygun iyonları çalıştırın. Veri ilgi moleküler kütlesi m/z tarama windows (SIM gruplar) anılan sıraya göre yağ asidi Kromatografik en yoğun zaman kapsayan seçerek elde. Genellikle, iki ila dört iyonları analit ve zaman pencere başına izlemek.
- Duyarlılığı artırmak amacıyla toplu tarama hızını ayarlamak ve (her ayinde bakarak harcanan zaman) kez yaşamak. En iyi kalitede veri mümkün olan en düşük hız elde edilen ve bir genellikle SIM 8-12 taramaları analit tepe üzerinde kuraldır. Ortalama bekleme süresi bir döngü süresi 6 9 ms, kütlesi başına enstrüman ayarlarını proxy'dir s ve a inceden inceye gözden geçirmek zaman-in 175 ms döngüsü-1.
- Moleküler iyon (M+) ilgili yağ asidi ve onun bütün isotopologues (M+ 1, M+ 2 ve benzeri) algılamak. Örnekler için bkz: temsilcisi sonuçlar.
- Kaydı her iyon parçası (isotopologue) bolluğu. Not molekül iyon ve onun isotopologues bereket nispeten düşüktür ve miktar kalitesini büyük ölçüde MS sistem performansına bağlıdır. Bir büyük örnek sırası (deneme) başlamadan önce bir melodi çalıştırın ve İyon kaynağı temiz.
Not: İlk olarak, bu veriler genel 13C enrichments tarafından tüketilen habercisi (burada 16:0) her yağ asitlerinin verim. - İzotop kompozisyonu işaretsiz karşılıklarından etiketli yağ asitlerinin oranının trofik karbon akı atamak için kullanın. Atom % formülü adım 6.1 ilgili yağ asidi etiketli karbon (atom yüzde, atom %) yüzdesi hesaplamak için kullanın. Tüketici içine 13C diyet gelen akış için göreli gösterge olarak yüzde 13C Collembola yağ asitleri etiketli (1 ve sonraki gün) ve etiketsiz hayvanlar (0 gün) arasında karşılaştırır.
- 13C birleşme yağ asidi zinciri içine konumunu atayın. Dağılımı üzerinde dayalı isotopologues diyet tüm işaretli izleyici yağ asidi (burada 16:0) yönlendirme zincir uzaması lipid metabolizma tarafından disentangle. Asimilasyon tüm marker molekülünün isotopologues en uzak için üst iyon (M+), örneğin, bereket artar iken M+ 15, M16, 13C kullanımı zincir uzaması ile C2 etiketli parçaları (13C acetyl-CoA) moleküler iyon yakın isotopologues daha sık alın.
6. 13C zenginleştirme hesaplamalar
- İsotopologues dağıtım göre genel etiketli karbon yüzdesi (atom %) anılan sıraya göre yağ asidi aşağıdaki ilişki kullanarak hesaplamak: atom % (dahil oranı 13C isotopologue) = (frekans x ilgili isotopologue)
Bu Kuppardt et al. sonra hesaplanır 31 olarak: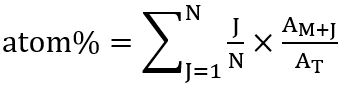
N yağ asidi, Karbon atomu sayısı nerede J 13C izotoplar sayısı, M + J ilgili isotopologue ve T tüm isotopologues toplam bolluk bereket. - Hesaplama için SIM-MS analizi ile tespit ve % 100 göreli bereket için ayarlanan en yüksek alan değerleri ilgili SK ve bütün isotopologues (M+ 1, M+ 2vb.), moleküler iyon (M+) toplamı. Algılanan her isotopologue bölümünü kolayca üç kuralı takip ederek hesaplamak.
- Sadece geri gerçekleştirilen dış 13C etiketleme takip son verileri elde etmek için deneysel değerlerden sigara etiketli gün 0 denetim değeri (doğal 13C arka plan) çıkarın.
Sonuçlar
Collembola taze ağırlık ve lipid içeriği
Açıklanan deney sırasında NLFAs ve PLFAs içeriğinde önemli ölçüde zaman içinde değişmedi örneklerin taze ağırlık biraz önemli24artış ise. Her iki parametre Collembola örneklerin fiziksel fitness iyi bir düzeyde gösterir. Collembola'nın taze ağırlık ve lipid içerik örnekleme gün yağ asidi ve izotop analizi için karşılık gelen deney boyunca araştırmak için unutmay?...
Tartışmalar
Isotopologue profil oluşturma
13C dağıtım FAs yılında niceliksel açıdan ayrıntılı bir analizini gıda ağları içinde bölümleme karbon atamak için son teknoloji ihtiyacı var. Mevcut çalışma istihdam 13C değerlendirmek için profil oluşturma isotopologue / tropic etkileşimler için ortak FA biyolojik12C oranlarının. Bu yöntem sıvı Kromatografi (LC-MS) amino asit analizi için iyi kurulmuş ve araştırmalar Patojen bak...
Teşekkürler
R. Menzel ve L. Ruess tarafından Deutsche Forschungsgemeinschaft (RU RU780/11-1) mali desteği minnetle kabul edilmektedir. R. Nehring RU 780/10-1 tarafından finanse edildi. Son olarak, biz bizim el yazması proofreading için Dr Hazel Ruvimbo Maboreke için son derece müteşekkir olan.
Malzemeler
| Name | Company | Catalog Number | Comments |
| neoLab-Round jars | neoLab | 2-1506 | 69 x 40 mm, 10 pacs/pack |
| Charcoal activated | Carl Roth | X865.1 | p.a., powder, CAS No. 7440-44-0 |
| Alabaster Dental | RÖHRICH-GIPSE | --- | http://www.roehrich-gipse.de/dentalgipse.php |
| Chloroform | Carl Roth | 7331.1 | HPLC ≥ 99,9 % |
| Methanol | Carl Roth | P717.1 | HPLC ≥ 99,9 % |
| Hexan | Carl Roth | 7339.1 | HPLC ≥ 98 % |
| tert-Butyl methyl ether (MTBE) | Carl Roth | T175.1 | HPLC ≥ 99,5 % |
| Aceton | Carl Roth | 7328.2 | HPLC ≥ 99,9 % |
| NaOH | Carl Roth | 6771.1 | p.a. ≥99 %, in pellets |
| di-Natriumhydrogenphosphat | Carl Roth | P030.1 | p.a. ≥99 % , water free |
| Na-dihydrogenphosphat Dihydrat | Carl Roth | T879.1 | p.a. ≥99 % |
| Hypochloric acid (6 N) | VWR International | 26,115,000 | AVS TITRINORM vol. solution |
| Bond Elut (Columns) | Agilent Tech. | 14102037 | HF Bond Elut-SI, 500 mg, 3 mL, 50/PK |
| Präparatengläser Duran | Glasgerätebau Ochs | 135215 | Ø 16 x 100 mm, plus screw cap with handy knurl and integrated PTFE/silicone gasket |
| Supelco 37 Component FAME Mix | Sigma-Aldrich | 47885-U Supelco | 10 mg/mL in methylene chloride, analytical standard |
| FlowMesh | Carl Roth | 2796.1 | Polypropylene mesh, approximately 0.3 mm thick, with 1 mm strand spacing |
| Bacterial Acid Methyl Ester (BAME) Mix | Sigma-Aldrich | 47080-U Supelco | 10 mg/mL in methyl caproate, analytical standard |
| Methyl nonadecanoate | Sigma-Aldrich | 74208 | analytical standard ≥ 98.0 % |
| Hexadecanoic acid-1-13C (Palmitic) | Larodan Fine Chemicals | 78-1600 | GC ≥ 98.0 % (13C: 99.0 %) |
| RVC 2-25 CDplus | Martin Christ Gefrier-trocknungsanlagen | Compact benchtop midi concentrator | |
| Alpha 2-4 LDplus | Martin Christ Gefrier-trocknungsanlagen | Drying manifold | |
| MZ 2C NT | Vacuubrand GMBH | Vacuum pump | |
| Roto-Shake Genie | Scientific Industries | Combined rocking and rotating device | |
| XP64 Micro Comparator | Mettler Toledo | Super high precision balance | |
| GC-System 7890A | Agilent Tech. | Gas chromatograph | |
| 7000 GC/MS Triple Quad | Agilent Tech. | Triple Quad mass spectrometer | |
| 7683B Series Injector | Agilent Tech. | Sample injector | |
| Heraeus Multifuge 3SR+ | Thermo Scientific | Centrifuge with 10 ml tube rotor |
Referanslar
- Ruess, L., et al. Application of lipid analysis to understand trophic interactions in soil. Ecology. 86 (8), 2075-2082 (2005).
- Ruess, L., et al. Lipid composition of Collembola and their food resources in deciduous forest stands - Implications for feeding strategies. Soil Biology and Biochemistry. 39 (8), 1990-2000 (1990).
- Chamberlain, P. M., Bull, I. D., Black, H. I. J., Ineson, P., Evershed, R. P. Fatty acid composition and change in Collembola fed differing diets: identification of trophic biomarkers. Soil Biology and Biochemistry. 37 (9), 1608-1624 (2005).
- Stott, A. W., Davies, E., Evershed, R. P., Tuross, N. Monitoring the routing of dietary and biosynthesised lipids through compound-specific stable isotope (delta C-13) measurements at natural abundance. Naturwissenschaften. 84 (2), 82-86 (1997).
- Ruess, L., Haggblom, M. M., Langel, R., Scheu, S. Nitrogen isotope ratios and fatty acid composition as indicators of animal diets in belowground systems. Oecologia. 139 (3), 336-346 (2004).
- Pollierer, M. M., Scheu, S., Haubert, D. Taking it to the next level: Trophic transfer of marker fatty acids from basal resource to predators. Soil Biology and Biochemistry. 42 (6), 919-925 (2010).
- Ferlian, O., Scheu, S., Pollierer, M. M. Trophic interactions in centipedes (Chilopoda, Myriapoda) as indicated by fatty acid patterns: Variations with life stage, forest age and season. Soil Biology and Biochemistry. 52, 33-42 (2012).
- Ruess, L., Chamberlain, P. M. The fat that matters: Soil food web analysis using fatty acids and their carbon stable isotope signature. Soil Biology and Biochemistry. 42 (11), 1898-1910 (2010).
- Traugott, M., Kamenova, S., Ruess, L., Seeber, J., Plantegenest, M. Empirically characterising trophic networks: What emerging DNA-based methods, stable isotope and fatty acid analyses can offer. Adv Ecol Res. 49, 177-224 (2013).
- Hammer, B. T., Fogel, M. L., Hoering, T. C. Stable carbon isotope ratios of fatty acids in seagrass and redhead ducks. Chemical Geology. 152 (1-2), 29-41 (1998).
- Budge, S. M., Iverson, S. J., Koopman, H. N. Studying trophic ecology in marine ecosystems using fatty acids: A primer on analysis and interpretation. Marine Mammal Science. 22 (4), 759-801 (2006).
- Haubert, D., et al. Trophic structure and major trophic links in conventional versus organic farming systems as indicated by carbon stable isotope ratios of fatty acids. Oikos. 118 (10), 1579-1589 (2009).
- Ngosong, C., Raupp, J., Richnow, H. H., Ruess, L. Tracking Collembola feeding strategies by the natural 13C signal of fatty acids in an arable soil with different fertilizer regimes. Pedobiologia. 54 (4), 225-233 (2011).
- Bec, A., et al. Assessing the reliability of fatty acid-specific stable isotope analysis for trophic studies. Methods in Ecology and Evolution. 2 (6), 651-659 (2011).
- Gladyshev, M. I., Makhutova, O. N., Kravchuk, E. S., Anishchenko, O. V., Sushchik, N. N. Stable isotope fractionation of fatty acids of Daphnia fed laboratory cultures of microalgae. Limnologica. 56 (Supplement C. 56 (Supplement C), 23-29 (2016).
- Gladyshev, M. I., Sushchik, N. N., Kalachova, G. S., Makhutova, O. N. Stable isotope composition of fatty acids in organisms of different trophic levels in the Yenisei river. PLoS One. 7 (3), e34059 (2012).
- Eisenreich, W., Dandekar, T., Heesemann, J., Goebel, W. Carbon metabolism of intracellular bacterial pathogens and possible links to virulence. Nature Reviews Microbiology. 8 (6), 401-412 (2010).
- Eylert, E., Bacher, A., Eisenreich, W. NMR-based isotopologue profiling of microbial carotenoids. Methods Mol Biol. 892, 315-333 (2012).
- Garton, N. J., O'Hare, H. M. Tuberculosis: feeding the enemy. Chemical Biology. 20 (8), 971-972 (2013).
- Rosenblatt, J., Chinkes, D., Wolfe, M., Wolfe, R. R. Stable isotope tracer analysis by GC-MS, including quantification of isotopomer effects. Am J Physiol. 263 (3), E584-E596 (1992).
- Fernandez, C. A., Des Rosiers, C., Previs, S. F., David, F., Brunengraber, H. Correction of 13C mass isotopomer distributions for natural stable isotope abundance. J Mass Spectrom. 31 (3), 255-262 (1996).
- Heuner, K., Eisenreich, W. The intracellular metabolism of legionella by isotopologue profiling. Methods Mol Biol. 954, 163-181 (2013).
- Willenborg, J., et al. Characterization of the pivotal carbon metabolism of Streptococcus suis serotype 2 under ex vivo and chemically defined in vitro conditions by isotopologue profiling. J Biol Chem. 290 (9), 5840-5854 (2015).
- Menzel, R., Ngosong, C., Ruess, L. Isotopologue profiling enables insights into dietary routing and metabolism of trophic biomarker fatty acids. Chemoecology. 27 (3), 101-114 (2017).
- Buse, T., Ruess, L., Filser, J. New trophic biomarkers for Collembola reared on algal diets. Pedobiologia. 56 (3), 153-159 (2013).
- Hutson, B. R. Effects of variations of the plaster-charcoal culture method on a Collembolan, Folsomia candida. Pedobiologia. 18, 138-144 (1978).
- Fountain, M. T., Hopkin, S. P. Folsomia candida (Collembola): a "standard" soil arthropod. Annu Rev Entomol. 50, 201-222 (2005).
- ISO, I. O. f. S. . Soil Quality-Inhibition of reproduction of Collembola (Folsomia candida) by soil pollutants. , (1999).
- Welch, D. F. Applications of cellular fatty acid analysis. Clin Microbiol Rev. 4 (4), 422-438 (1991).
- Dodds, E. D., McCoy, M. R., Rea, L. D., Kennish, J. M. Gas chromatographic quantification of fatty acid methyl esters: flame ionization detection vs. electron impact mass spectrometry. Lipids. 40 (4), 419-428 (2005).
- Kuppardt, S., Chatzinotas, A., Kastner, M. Development of a fatty acid and RNA stable isotope probing-based method for tracking protist grazing on bacteria in wastewater. Appl Environ Microbiol. 76 (24), 8222-8230 (2010).
- Zhang, X., He, H., Amelung, W. A GC/MS method for the assessment of 15N and 13C incorporation into soil amino acid enantiomers. Soil Biology and Biochemistry. 39 (11), 2785-2796 (2007).
- Vetter, W., Thurnhofer, S. Analysis of fatty acids by mass spectrometry in the selected ion monitoring mode. Lipid Technol. 19 (8), 184-186 (2007).
- Thurnhofer, S., Vetter, W. A gas chromatography/electron ionization-mass spectrometry-selected ion monitoring method for determining the fatty acid pattern in food after formation of fatty acid methyl esters. J Agric Food Chem. 53 (23), 8896-8903 (2005).
- Haubert, D., Haggblom, M. M., Scheu, S., Ruess, L. Effects of fungal food quality and starvation on the fatty acid composition of Protaphorura fimata (Collembola). Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology. 138 (1), 41-52 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır