Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kromozom segregasyon mitoz sırasında canlı hücre görüntüleme
Bu Makalede
Özet
Bu iletişim kuralı etiket ve canlı kromozomlar Mitotik hücre Histone2B-GFP BacMam 2.0 etiket ve bir iplik kaset confocal mikroskobu sistemi kullanarak görselleştirmek için basit ve uygun bir yöntem açıklanır.
Özet
Kromozomlar düzgün ve güvenilir bir şekilde kızı hücrelere Mitotik hücre bölünmesi sırasında ayrılmış gerekir. Kromozom segregasyon kalitesini Milli Meclis denetim noktası (SAC) içeren birden fazla mekanizma ile kontrol edilir. Bu zarın içinde durur bütün kromozom kinetochores mikrotübüller iğ bağlı sürece mitoz hücre ilerlemeyi önlenmesi için sorumlu olan bir karmaşık geribildirim sisteminin bir parçasıdır. Kromozom ahşap kaplama ve anormal kromozom segregasyon işlevsel olmayan hücre döngüsü kontrol denetim noktaları bir göstergesidir ve hücre bölünmesi genomik istikrar ölçmek için kullanılabilir. SAC deregülasyon normal bir hücre dönüştürme hataları biriktirme esnasında kromozom segregasyon aracılığıyla bir malign hücre içine neden olabilir. Kinaz ve fosfataz gibi Protein fosfataz 2A arasındaki etkileşimler tarafından sıkı bir şekilde düzenlenmiş SAC uygulanması ve karmaşık kinetochore oluşumunu (PP2A). Bu iletişim kuralı kromozomlar fare embriyonik fibroblastlar vardı bir PP2A-B56γ yasal alt birimi nakavt fareler izole içinde kalmış, canlı hücre görüntüleme açıklar. Bu yöntem yalnızca bir hücre sitokinez durumu, dinamik bir kronolojik zamanmekansal görselleştirme kromozomların yerine bir görüntüsünü sağlayan diğer hücre döngüsü kontrol görüntüleme teknikleri Akış Sitometresi veya immunocytochemistry gibi eksikliklerin üstesinden gelir. mitoz sırasında.
Giriş
Aşağıdaki iletişim kuralında, kromozom segregasyon ve fare embriyonik fibroblastlar Histon 2B-GFP ve canlı hücre görüntüleme BacMam 2.0 etiketleme kullanarak hücre döngüsü sırasında Mitotik ilerleme görselleştirmek için uygun bir yöntem açıklanmaktadır.
Hücre döngüsü kontrol denetim noktaları kromozom segregasyon izlemek ve hücre 1,2,3genetik bütünlük bakımından önemli bir rol oynamaktadır. Yanlış ayrılmış kromozomlar birikimi anöploidi için hangi en sağlam tümörleri 4özelliğidir yol açabilir. Bu nedenle, kromozomlar gerisinde kalmış algılama yöntemi olarak kromozom istikrarsızlık eğitim için kullanılabilir.
Fluorescently etiketli proteinler canlı kromozom segregasyon görselleştirmek için kullanılan ve kromozom mCherry öğesini nesil geri kalmış olabilir veya H2B GFP öğesini protein gen teslim ve moleküler biyoloji 5önemli bilgi gerektirir. Burada CellLight Histone2B-GFP BacMam 2.0 reaktif, bundan sonra basitlik uğruna CL-HB regent denilen nasıl kullanılacağını açıklar. Bu reaktif hemen kullanılabilir ve böylece vektör kalite ve bütünlüğü konusunda endişeleriniz ortadan kaldırır. Buna ek olarak, bu reaktif zararlı olabilecek tedaviler veya lipidler ve boya-yükleme kimyasalların kullanımını gerektirmez. Geleneksel floresan etiketleri farklı olarak, CL-HB regent işlev bağımsız olarak lekeleri (i.e., membran potansiyeli). CL-HB regent sadece hücrelere eklendi ve gecede inkübe protein ifade için. CL-HB regent memeli hücrelerinde çoğaltmak ve biyogüvenlik düzeyi (BSL) 1 laboratuvar ayarlarında kullanılabilir. Ayrıca, bu geçici transfection 5 güne kadar yeterli zaman gece kuluçka sonra en dinamik hücresel analizler taşımak için tespit edilebilir.
Alternatif olarak, kromozom Akış Sitometresi, immünhistokimya veya Floresans in situ hibridizasyon (balık) 6' gibi çeşitli teknikleri eğitim. Akış Sitometresi ölçülebilir DNA içeriği ve hücre hücre döngüsünün aşaması dayalı anöploidi, çalışma için kullanılabilir. Akış Sitometresi anöploidi ölçmek için kullanılabilmesine rağmen kromozom mis segregasyon üzerinde bilgi sağlamaz. Balık ve immünhistokimya teknikleri floresan problar DNA veya kromozomlar bağlamak için kullanın. Bu tekniklerin bir anlık görüntüsünü hücre bir popülasyon durumunu sağlarken, Bunlar canlı hücre böylece kronolojik zamanmekansal görselleştirme sitokinez belirli hücrelere bir süre içinde takip sırasında elde edilen herhangi bir bilgi eksik görüntüleme izin vermez.
Bu iletişim kuralı ahşap kaplama kromozomlar veya PP2A-B56γ-fareler izole kromozom mis segregasyon tedavi nocodazole fare embriyonik fibroblastlar (MEFs) de incelemek için kullanıldı. Uygulama yukarıda ek olarak, bu iletişim kuralı etiket ve hücre döngüsü Yönetmeliği okumak için kullanılan çeşitli hücre tiplerinin kromozom segregasyon veya tümör hücrelerinde kromozom istikrarsızlık görselleştirmek için basit bir araç sağlar. Buna ek olarak, bu da kromozom istikrarsızlık tarafından çeşitli ilaç tedavileri neden çalışmaya veya Kromozom mis segregasyon kaynaklanan dışarı gen knock etkilerini incelemek için kullanılabilir.
Protokol
Bu çalışmalarda yapılan tüm deneylerde gıda ve İlaç Dairesi (FDA) araştırma tesisinde kurumsal hayvan bakım ve kullanım Komitesi tarafından onaylanmış protokoller uyarınca gerçekleştirilmiştir.
1. yalıtım ve kültür fare embriyonik fibroblastlar (MEFs)
- Fare embriyonik fibroblastlar (MEFs) PP2A-B56γ-fare zorlanma ve vahşi türü littermates standart protokol 7,8,9tarafından izole et.
- ExpandMEFs için 3 pasajlar, donma ve deneyler 8için ihtiyaç kadar saklayın.
2. kodlamayla Mefs 2-şey odacıklı kapak cam için görüntüleme yaşamak
- 500 mL % 10 ile Dulbecco modifiye kartal orta (DMEM/F12) içeren MEF büyüme ortamının hazırlamak Fetal sığır Serum (FBS), 1 X penisilin/streptomisin antibiyotik, L-Glutamine (200 mM) ve 1 X non-gerekli amino asitler (NEAA) 500 mL medya şişede.
- Önceden ısıtılmış su banyosu 37 ° C'de 3 pasajda, vahşi türünden donmuş MEFs ve PP2A-B56γ-fareler şişeleri tezcan
- Transfer MEFs 15 mL tüpler çözdürülen ve yavaş yavaş DMEM/F12 medya dropwise 20 mL 10 mL pipet kullanarak 15 mL tüpler ekleyin.
- MEFs 20 mL T75 şişeler içinde DMEM/F12 büyüme ortamının yanı sıra transfer ve hücreleri % 70 birleşmesi kadar onları genişletin. Confluency 4 x veya 10 x büyütme ters bir mikroskop kullanarak tahmin edilmektedir.
- Cam mera kullanarak büyüme orta bir vakum sistemi başlıklı bağlı pipet, 3 mL % 0.25 tripsin/EDTA ekleyin ve 5 dk. Ekle 3 mL reaksiyonu durdurmak için DMEM/F12 büyüme ortamının için 37 ° C'de kuluçkaya Aspire edin.
- Düşük hızlı (300 x g) oda sıcaklığında 5 min için hücreleri santrifüj kapasitesi. Dikkatle süpernatant kaldırmak ve hücre Pelet 1 ml sıcak su banyosu içinde 37 ° C'de önceden DMEM/F12 büyüme ortamının yeniden askıya alma.
- Trypan mavi dışlama yöntemini veya diğer uygun hücre sayım yöntemi 8kullanarak hücreleri numaralandırır.
- Tohum yaklaşık 20.000 MEFs/iyi bir 2-şey odacıklı cam. 200 µL/iyi DMEM/F12 büyüme orta ekleyin ve onları gece 37 ° C ve % 5 CO2kuluçka tarafından eklemek hücre.
3. eşitleme
- MEFs DMEM/F12 büyüme medya % 0,1 içeren hücrelerde kuluçka tarafından G0/G1 aşamasında eşitlemek G0/G1 aşamasında en fazla sayıdaki hücreleri için FBS 24 h için.
Not: serum açlıktan tercih bir yöntem kullanılmıştır rağmen hangi hücreleri tutuklandı 10olmak gerekli Mitotik sahne bağlı olarak çeşitli yöntemler kullanılabilir.
4. etiketleme
- 1.5 mg/mL DMSO nocodazole stok çözeltisi hazırlamak. Nocodazole G2/M aşamasında Mikrotubul oluşumu 10engelleyerek hücrelerin tutuklama.
- Üç gün eşitleme sonrası, 200 µL (ile % 10 FCS) büyüme ortamının, 200 ng/mL nocodazole ve CL-HB vekil (Histon 2B-GFP BacMam 2.0) Ekle.
- CL-HB regent parçacıklar başına hücre (hücre için aşağıdaki gibi eklemek için PPC) hesaplamak:
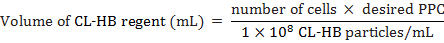
Hücre sayısı etiketleme sırasında hücre tahmini toplam sayısı nerede, PPC parçacıklar başına hücre sayısı ise 1 × 108 mL reaktif başına parçacıkları sayısı. Örneğin, etiket 20.000 hücrelere bir PPC 30 ile
Not: CL-HB regent çoğu hücre tipleri arasında 10 ve 50 PPC ile iyi çalışır. Ancak, 30 PPC en iyi bu çalışma için çalıştı. - MEFs 37 ° C ve % 5 CO218 h için kuluçkaya.
Not: geçerli deneme için hücre hapsinde nocodazole ile 18 h kromozomlar iğ derleme denetim noktası kaçan Mitotik hücrelerdeki görselleştirme oluştu.
5. görselleştirme kromozomlar ahşap kaplama
- Fare embriyonik fibroblastlar (MEFs) bir çevre odası ve bir petrol daldırma, 63 x objektif lens ile donatılmış bir iplik disk confocal mikroskop sistemi kullanarak görselleştirmek.
- Uyarma 488 nm ve emisyon dalga boyu 450 nm dalga boyu GFP kanal resim alma için kullanın.
- Motorlu tarama aşamaları yeteneği ile bir iplik disk confocal mikroskop sistemi kullanmak, Z-Piezo ekler, sahne-üst kuluçka ve fotoğraf için bu tekniği ağartma sonra doğrudan Floresans kurtarma.
- Bir gün önce görüntüleme, çevre odası güç açık açmak ve bir gecede tüm odası 37 ° C'de ısınmak.
- Güç açık mikroskop stand, fotoğraf makinesi, iplik disk birimi, ışığı, argon lazer, bilgisayar ve motorlu sahne için açın.
- Sistem için 3 dk sıcak izin; argon lazer kontak anahtarı üzerinde açarak başlayın. Argon lazer "" Çalıştır lazer için "bekleme" için açma/kapatma düğmesi geçin.
- Veri toplama ve işleme yazılımını başlatın.
- CO2 denetleyicisi sahne en iyi kuluçka makinesi için başlatmak ve CO2 konsantrasyonu %5 ayarlamak. Bu görüntüleme başlamasından önce yapılmalıdır.
- Odacıklı kapak cam görselleştirme için Sahne Alanı'nda yeri ve kuluçka kaldırın. Hücreleri bir petrol daldırma 63 x objektif lens (NA1.4) üzerinden görselleştirin.
- Oküler lensler sayesinde görüntüleme, görüntü odak ve nükleer zarf arıza (NEBD) aşamasında bir hücre tanımlamak.
- Uygun lazer (Histone2B-GFP görselleştirmek için 488 nm argon lazer) başlatın.
- Edinme denetimi penceresi açın ve çekim hızı GFP kanal için ayarlayın. NEBD içinde yer alan bir hücreye tanımlayın.
- El ile hedef hücrenin üst ve alt odak düzlemi belirlemek ve xyz optik kesit ayarları girin.
- 20 dakikadır gözlemlemek; Hücre hücre bölünmesi devam etmez, resim alma 20 dk sonra durdurmak ve NEBD içinde yer alan sonraki hücreye geçin.
- Yaklaşık 1 h hücre başına görüntü ahşap kaplama kromozomlar mitoz hücrelerdeki PP2A-B56γ-SAC kaçan sırasında gereklidir. Bir film için verileri elde etmek için her 3 dakikada fotoğraf çekmek.
Not: vahşi türü hücre tutuklayın ve nocodazole ile tedavi ederken NEBD geçmiş ilerleme değil. - Görüntüleri daha ayrıntılı bir çözümleme için zvi dosya biçiminde kaydedin.
6. görüntü işleme ve analiz
Not: üç boyutlu görüntü işleme ve analiz Axiovision sürüm 4.8.2 veya Imaris sürüm 8,2 gibi kullanılabilir herhangi bir yazılım kullanarak gerçekleştirin. Bu çalışma ImageJ için yazılım kullanıldı.
- Görüntü sırası açın. Görüntüleri zaten bir yığın biçimindeyse, sonraki adıma geçin. Aksi takdirde, tüm ilgili görüntüleri kullanarak bir yığın içine birleştirmek ' görüntü > Yığınlar > yığın görüntüleri ' menü çubuğunda.
- Herhangi bir ayarlama Parlaklık/Kontrast ve düzeyleri için gerektiği şekilde gerçekleştirin.
- Film için bir zaman damgası eklemek için:
- Gidin ' görüntü > Yığınlar > etiket...' menü çubuğunda.
- Uygun biçimi, başlangıç saat değeri ve her görüntü arasındaki zaman aralığını seçin.
- 'Önizleme' kutusunu işaretleyin ve yer ve biçim ayarlarını yapın. Zaman damgası uygulamak için "OK" tuşuna basın.
- Film için bir ölçek çubuğu eklemek için:
- Altında ölçekleme görüntü ayarla ' Analyze > ölçeği ayarla ' menü çubuğunda.
- 'Uzaklığını piksel' alanında nerede mesafe bilinmektedir piksel sayısını girin ve 'Bilinen mesafe' alanına uzaklığı girin. Örneğin, mesafe uzunluğu doğru birim µm. basın 'ölçek yığına uygulamak için Tamam' ayarlayın.
- Gidin ' Analyze > Araçlar > ölçek çubuğu ' ölçek çubuğu eklemek için. 'Genişlik µm' olarak çubuğunun boyutunu ayarlayın ve kalan biçimlendirme seçeneklerini uygun şekilde ayarlayın. Tüm destesini ölçek çubuğu eklemek için 'Tüm dilimler etiket' kutusunu işaretleyin.
- Filmin görüntü penceresinin kenarına altındaki üçgen Oynat düğmesini tıklatarak önizleme. Çerçeve oranı kullanarak ayarlayın ' görüntü > Yığınlar > animasyon > animasyon seçenekleri menü çubuğunda.
- Film dosyasına seçerek ' Dosya > Kaydet > AVI...' ve sıkıştırma ve kare hızı seçin.
- Basın kayıt seçmek için ' Tamam' konum ve dosya adı. 'Kaydet' film dosyasını kaydetmek için tuşuna basın.
Sonuçlar
MEFs vahşi türü ve PP2A-B56γ-fareler bir 2-şey odası kapak cam tohumlari ve takmak için izin. 2 günde MEFs % 0.1 kullanarak senkronize FBS 24 h için. Günde 3, MEFs medya ile 200 ng/mL üzerinde nocodazole ve 30 PPC CL-HB regentwere inkübe 37 18 h için° C ve % 5 CO2. 4 günde bir iplik disk confocal mikroskop sistemi (şekil 1) kullanarak hücreleri görüntüsü. Canlı hücre görüntüleme mitoz (Şeki...
Tartışmalar
Doğru kromozom segregasyon sağlamak hücre döngüsü kontrol denetim noktaları dönüşüm 1,2,3anöploidi ve hücre önlemek. Bu da çalışmanın, PP2A-B56γ o inactivation bulduk zayıflamış Milli Meclis denetim noktası içinde sonuçlandı. Canlı hücre görüntüleme kromozom mis ayrışma sırasında mitoz PP2A-B56γ MEFs içinde nocodazole 9ile tedavi gözlemlemek için bize izin.
Açıklamalar
Yazarlar onlar rakip hiçbir mali çıkarları var bildirin.
Teşekkürler
Dr. Guo-Chiuan Hung ve Dr Bharatkumar Joshi el yazması geliştirilmiş değerli yorum için teşekkür etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Gibco | 11320082 | |
| L-Glutamine | Gibco | 25030081 | |
| MEM Non-Essential amino acids solution (100X) | Gibco | 11140050 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Dulbecco’s Phosphate Buffered saline | Gibco | 14190144 | |
| Trypsin-EDTA | Gibco | 25300054 | |
| Fetal bovine serum | Atlanta Biologicals | S11150 | |
| DMSO | EMD Millipore | MX 1458-6 | |
| Cryogenic vial storage boxes | Fisherbrand | 10-500-28 | |
| Cryogenic vials | Corning/costar | 431416 | |
| T75 flasks | Cellstar | 658175 | |
| 2 well chambered cover glass | Nunc | 155380PK | |
| Cellometer Vision Cell Profiler | Nexcelom Bioscience LLC | Cellometer Vision Trio | |
| Nocodazole | Sigma | M1404 | |
| CellLight Histone 2B-GFP, BacMam 2.0 | Thermo Fisher Scientific Inc. | C10594 | |
| Zeiss Cell Observer Spinning Disk Confocal Microscope system | Carl Zeiss Microscopy | Zeiss Cell Observer SD | |
| Water Bath | Thermoscientific | 280 series | |
| Incubator | Sanyo commercial solutions | MCO-18AIC (UV) | |
| Class II Biological safety cabinet | The Baker Company | SterilGard | |
| Axiovision software | Zeiss | Ver.4.8.2 | |
| ImageJ software | National Institute of Health | Ver. 1.51r |
Referanslar
- Funk, L. C., Zasadil, L. M., Weaver, B. A. Living in CIN: Mitotic Infidelity and Its Consequences for Tumor Promotion and Suppression. Dev Cell. 39, 638-652 (2016).
- Etemad, B., Kops, G. J. Attachment issues: kinetochore transformations and spindle checkpoint silencing. Curr Opin Cell Biol. 39, 101-108 (2016).
- Lara-Gonzalez, P., Westhorpe, F. G., Taylor, S. S. The spindle assembly checkpoint. Curr Biol. 22, 966-980 (2012).
- Jallepalli, P. V., Lengauer, C. Chromosome segregation and cancer: cutting through the mystery. Nat Rev Cancer. (2), 109-117 (2001).
- Zhu, L., et al. Mitotic protein CSPP1 interacts with CENP-H protein to coordinate accurate chromosome oscillation in mitosis. J Biol Chem. 290 (45), 27053-27066 (2015).
- Pikor, L., Thu, K., Vucic, E., Lam, W. The detection and implication of genome instability in cancer. Cancer Metastasis Rev. 32 (3-4), 341-352 (2013).
- Varadkar, P., Despres, D., Kraman, M., Lozier, J., Phadke, A., Nagaraju, K., McCright, B. The protein phosphatase 2A B56γ regulatory subunit is required for heart development. Dev Dyn. 243 (6), 778-790 (2014).
- Jozefczuk, J., Drews, K., Adjaye, J. Preparation of Mouse Embryonic Fibroblast Cells Suitable for Culturing Human Embryonic and Induced Pluripotent Stem Cells. J. Vis. Exp. (64), e3854 (2012).
- Varadkar, P., Abbasi, F., Takeda, K., Dyson, J. J., McCright, B. PP2A-B56γ is required for an efficient spindle assembly checkpoint. Cell Cycle. 18 (12), 1210-1219 (2017).
- Rosner, M., Schipany, K., Hengstschläger, M. Merging high-quality biochemical fractionation with a refined flow cytometry approach to monitor nucleocytoplasmic protein expression throughout the unperturbed mammalian cell cycle. Nat Protoc. 8 (3), 602-626 (2013).
- Jonkman, J., Brown, C. M. Any Way You Slice It-A Comparison of Confocal Microscopy Techniques. J Biomol Tech. 26 (2), 54-65 (2015).
- Versaevel, M., Braquenier, J. B., Riaz, M., Grevesse, T., Lantoine, J., Gabriele, S. Super-resolution microscopy reveals LINC complex recruitment at nuclear indentation sites. Sci Rep. 8 (4), 7362 (2014).
- Wild, T., Larsen, M. S., Narita, T., Schou, J., Nilsson, J., Choudhary, C. The Spindle Assembly Checkpoint Is Not Essential for Viability of Human Cells with Genetically Lowered APC/C Activity. Cell Rep. 1 (8), 1829-1840 (2016).
- Iuso, D., et al. Exogenous Expression of Human Protamine 1 (hPrm1) Remodels Fibroblast Nuclei into Spermatid-like Structures. Cell Rep. 1 (9), 1765-1771 (2015).
- Ratcliffe, E., Glen, K. E., Naing, M. W., Williams, D. J. Current status and perspectives on stem cell-based therapies undergoing clinical trials for regenerative medicine: case studies. Br Med Bull. 108, 73-94 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır