Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Akciğer tüberkülozu lezyonlar lazer ilaçların kayma miktar yakalamak mikrodiseksiyon sıvı Kromatografi Kütle spektrometresi (LCM-LC/MS)
Bu Makalede
Özet
Burada, LC/MS analizi ile birleştiğinde lazer yakalama mikrodiseksiyon dağınık şekilde ölçmek-akciğer tüberkülozu granülomlar içinde uyuşturucu dağıtımı için bir iletişim kuralı'nı açıklar. Yaklaşım ilaç konsantrasyonları yüksek uzaysal detay dokularda miktarının için geniş uygulanabilirliği vardır.
Özet
Tüberküloz hala morbidite ve mortalite dünya çapında önde gelen bir nedenidir. İlerleme-e doğru mevcut uyuşturucu rejimleri ve roman therapeutics gelişimi şiddetle ihtiyaç vardır. Ulaşmak ve bakteri kötü skarların nekrotik bölgeler (caseum), pulmoner granülomlar içinde sterilize etmek için biraz dozlayıp TB uyuşturucu başarılı terapötik müdahale için çok önemli bir özelliğidir. Etkili tedavi rejimleri bu nedenle uyuşturucu ile olumlu caseum penetrasyon özellikleri içermesi gerekir. Biyolojik dokuların seviyelerinde ilaç miktarının geçerli LC/MS yöntemler sınırlı Uzaysal çözünürlük yetenekleri, doğru küçük doku bölmeleri içinde bulunanlar gibi içinde mutlak ilaç konsantrasyonu belirlemek üzere nekrotik granülomlar. Burada lazer yakalama mikrodiseksiyon (LCM) patolojik olarak farklı doku bölgeleri LC/MS miktar ile birleştiren bir iletişim kuralı mevcut. Bu teknik granuloma caseum, hücresel lezyon ve ilişki kurmadan Akciğer doku çevreleyen içinde ilaçların mutlak miktar sağlar ve bu nedenle, doğru bir şekilde bakterisidal konsantrasyonları elde olup olmadığını belirler. Tüberküloz araştırma ek olarak, teknik hastalıklı dokularda dağınık şekilde çözülmüş miktar uyuşturucu için birçok potansiyel uygulamalar var.
Giriş
Dağınık şekilde çözme ve ilaç düzeyleri ölçmek özelliğini Anti-tüberküloz ilaçlar bakteriyel altgrupları konsantrasyonları1sterilize, akciğer lezyonları içinde ulaşmak olup olmadığını belirlemek için çok önemli bir gereksinimdir. Belirli önemi uyuşturucu penetrasyon (caseum denir) lezyon genellikle basiller en yüksek sayısını içerir ve ilaçlara vaskülarizasyon yokluğu nedeniyle erişilebilir olabilir nekrotik çekirdek içine belirliyor.
Homojenizasyon eksize pulmoner lezyonların dahil lezyon penetrasyon, değerlendirmek için geleneksel yöntemleri ardından solvent ekstraksiyon ve sıvı Kromatografi Kütle spektrometresi (LC/MS) analizi, son derece hassas ve uyuşturucu için seçici faiz. Ancak, bu yöntemleri özgün homojenize doku boyutunu sınırlı yoksul mekansal bilgi sunuyoruz. Kütle spektrometresi tabanlı görüntüleme yaklaşımlar, matris yardımlı lazer desorpsiyon iyonlaşma (maldı)2,3gibi electrospray iyonlaşma (DESI)4 ya da yüzey çıkarma sıvı gelişmiş5desorption, 6 teklif görüntüleme yetenekleri son derece dağınık şekilde çözüldü, ama doğrudan miktar son derece zor ya da imkansız heterojen iyon bastırma etkileri ve çeşitli hücreden analit farklı ayıklama verimliliği nedeniyle olabilir veya doku7türleri. Ayrıca, en doğrudan doku MS görüntüleme yaklaşımlar doğal olarak daha az LC/MS iyonlaşma ve uyuşturucu dokusundan daha düşük solvent ekstraksiyon verimliliği için rekabet endojen türlerin Kromatografik ayırma eksikliği nedeniyle daha duyarlıdır.
LC/MS analizi ile kombine lazer yakalama mikrodiseksiyon (LCM) yalıtmak ve proteomik8,9 çalışmalar için farklı doku bölgeleri karakterize için rutin olarak uygulanan ve son zamanlarda uyuşturucu miktar için kullanılan içinde ilaç hayvan doku10. Burada en iyi duruma getirilmiş bir protokol farklı Granülom bölmeleri içinde anti-TB uyuşturucu ölçmek için LCM LC/MS (LCM-LC/MS) analizi ile birlikte uygulama mevcut. Lazer yakalama mikrodiseksiyon işlemi bir UV lazer ile mikroskop objektif keser ve kullanıcı tarafından tanımlanan bir yolu takip ederek istenilen doku alan izole doku bölümü üzerine odaklanmıştır. Yerçekimi destekli LCM için (Bu araştırma için kullanılan teknik), doku bölümü (PET veya kalem) bir ince polimer membran slayt monte edilir ve doku slayt oturtulmuş bir koleksiyon tüp şapkalı yakalanır. Uyuşturucu eksize dokudan ayıklanır ve standart LC/MS yaklaşımları kullanarak sayılabilir. Doku toplanması için gerekli miktarı sonuçta dokuda mevcut uyuşturucu beklenen konsantrasyonu ve LC/MS yöntemi duyarlılık belirlenir. Terapötik düzeyde ilaç ve bir rutin triple quadrupole Kütle Spektrometre, 3 milyon µm2 (3 mm2) dokusunun kullanılarak analiz ilaçların çoğu analizleri için yüzey alanı yeterlidir.
Bu iletişim kuralı kayma profil oluşturma güçlü bir kombinasyon açıklar ve mutlak ilaç konsantrasyonları TB granülomlar bütün bölümler içinde sağlayan tam miktar LCM-LC/MS tarafından sunulan. Teknik aynı zamanda birçok farklı hastalıklı dokuları hayati ilaç bulma ve geliştirme bilgi veren konsantrasyonlarda uyuşturucu belirlemek için uygulanabilir.
Protokol
Tüm hayvan çalışmaları doğrultusunda Kılavuzu bakım ve kullanım laboratuvar hayvanları Ulusal Sağlık Enstitüleri ile kurumsal hayvan bakım onayını ve kullanım Komitesi, NIAID (NIH), Bethesda, MD için yapılmıştır
1. hayvan deneyleri ve doku koleksiyonu
Bu bölümde Protokolü'nün hayvan yordamlar ve örnek koleksiyon Biyogüvenlik seviye 3 (BSL3) koşullar altında açıklanmaktadır. Protokol tavşanların Mycobacterium tüberküloz aerosol enfeksiyon yordam ve İlaç İdaresi detaylı iletişim kuralları daha önce açıklanan11,12.
- Yeni Zelanda beyaz tavşan (erkek ve kadın, 4-5 aylık) M. tuberculosis HN878 ile enfekte bir salt burun aerosol sistemi kullanarak, daha önce açıklanan11.
- Seçilen ilaçlar (burada sunulan örnekte etambutol) tercih edilen rota yönetmek ve hayvanlar 2, 6 ve 24 h yönetim takip ötenazi. İlk olarak, tavşan tarafından ketamin 5 mg/kg kas içi enjeksiyon 35 mg/kg ve Xylazine anestezi. 10 dakika bekleyin ve doğru anesthetization kuyruk pinching ve yavaşça göz dokunmadan onaylayın. Herhangi bir tepki ise, Fentobarbital ve fenitoin ( Tablo malzemelerigörmek) intravenöz yönetimi tarafından 1 mL/4.5 kg 2 mL steril serum fizyolojik içinde ötenazi.
Not: Bu timepoints farmakokinetik profil etambutol için karşılamak için en iyi durumda ve ayarlama/diğer çalışma uyuşturucu için en iyi duruma getirme gerektirebilir. - Pens, makas ve/veya skalpel kullanarak, akciğerler göğüs boşluğundan Kaldır, akciğer biyopsisi (3daha önce açıklandığı gibi) ilişki kurmadan Akciğer doku çevreleyen gömülü büyük nekrotik granülomlar içeren çıkarabileceğim. Nekrotik granülomlar görünür içinde bej renk ve genellikle biraz çıkıntı çevreleyen kırmızı/pembe renkli akciğer. Kolay cryosectioning kolaylaştırmak için biyopsiler 2 x 1.5 x 1,5 cm büyük olduğundan emin olun.
- Forseps kullanarak, önceden etiketli cryomold tepsi istenen kesme yüzeyi üzerine biyopsi tepsiyi Bankası ile doğrudan temas yerleştirin. Sonra dondurma, bu hangi cryosections keserim düz bir yüzey sağlar.
- Sıvı azot buharı biyopsiyi durdur. Bir styrofoam konteyner 2 inç derinliğe kadar sıvı azot ile doldurun ve bir metal tel tüp rafa yerleştirin. Raf düz bir yüzey üzerinde doku tepsiler yerleştirilir sağlayan sıvı azot yüzeyi üzerinde çıkıntı. Kapağı geri styrofoam konteyner üzerinde yerleştirin ve dokuları tam olarak dondurmak 10 dakika bırakın.
- Doku tepsileri kaldırın, hızlı bir şekilde alüminyum filmde sarın ve tek tek resealable plastik torbalar ve mühür etiketli yerleştirin. -80 ° C dondurucu depolama için transfer.
Not: Adımlar 1.1-1.6 (tüm hayvan iş de dahil olmak üzere ve hastalıklı organ ve dokulara işleme) BSL3 koşullarda gerçekleştirilir. Gama ışınlatayım BSL3 kapsama dışında işlemeyi etkinleştirmek IÇIN 3 Megarads, akciğer biyopsisi. Lazer yakalama mikrodiseksiyon unsterilized doku üzerinde güvenlik protokollerini onaylandığı takdirde tesis kilometresi BLS3 içinde gerçekleştirilebilir. Ancak, bu iletişim kuralını kalan BSL-2 tesiste aşağı akım işleme açıklar.
2. doku kesit
- Cryostat istenen kesme sıcaklık ayarlayın. Gama radyasyona maruz akciğer biyopsisi için cryostat-80 ° C depolama ortamından aktarmak ve doku sıcaklık equilibrate 30 dakika bekletin. Not:-22 ° C-20-TB Lezyondan biyopsi için en uygunudur.
- Cımbız kullanarak, Chuck doku Bankası bağlı kalmak için en uygun kesme sıcaklık yapıştırıcı (OCT) küçük bir miktar kullanarak cryostat Chuck biyopsi düzeltmek. Doku (yani cryomold Bankası ile temas oldu) düz yüzey kesme maruz yüzeydir gelecek şekilde yönlendirin. Bu sonraki kütle spektrometresi analizi ile girişime neden olabilir gibi OKT doku yüzeyi kontamine değil emin olun.
- Üç doku bölüm 25 µm kalınlık, kesme ve evde beslenen hayvan membran slaytlar monte. Yavaşça membran doku bölümüne dokunma ve kaldırın. Çok fazla baskı uygulanırsa, ince zar gözyaşı.
- Bu şarj edilmiş ve zavallı yapışma doku bölümlerin olma evde beslenen hayvan membran yol açar gibi montaj öncesinde slaytlar aşırı kullanımı önlemek. Membran slayt tezcan-montaj ve başarılı yapışma doku membran için etkinleştirmek için oda sıcaklığında tutulur emin olun.
- Slayt cryostat kaldırmak ve 3 dakika kurumasını bekleyin. LCM-LC/MS/MS hemen gerçekleştirilmez, slayt küçük hava geçirmez yapışmalı çanta ve diseksiyon için gerekli kadar-80 ° C depolama birimine transfer kapatın.
- 10-12 µm ve tezcan-mount Hematoksilen ve Eozin (H & E) Boyama ve referans için standart cam slayt üzerindeki bitişik bir bölüm kesmek. Ek bölümler (Mycobacterium tüberküloz (MTB) görüntülenmesi için Ziehl-Niellsen gibi) diğer istenen histochemistry lekeler için şu anda kesebilir.
3. mikrodiseksiyon
- -80 ° C depolama slayt içeren mühürlü torba kaldırmak ve oda sıcaklığında 5 dakika boyunca ulaşmak için izin verir.
Not: soğuk slayt hemen laboratuvar atmosfer yararlanılır, doku yoğunlaşma ile kaplı olmak ve ilaç kayma bütünlüğünü tehlikeye olabilir. - Mikroskop ve lazer açın (kesme başlamak önce lazer 5-10 dakika kadar sıcak gerektirir). Düz-cap 0.20 mL PCR tüpleri yuvasına yükleyin.
- Slayt çantasından çıkarın ve Düz Yataklı Tarayıcı kullanarak evde beslenen hayvan slayt üzerinde doku bölümünün bir optik görüntü al.
- Slayt Slayt tutucusuna (doku yüzü aşağı bakacak şekilde) koyun ve ayrı toplama tüpler istimal mikroskop bilgisayar yazılımı ilgi belirli Granülom bölgelerine atayabilirsiniz. Genellikle, bunlar-ecek var olmak 'ilişki kurmadan akciğer,' 'hücresel Granülomu,' ve 'caseum' (nekrotik Merkez), ama olabilir Granülom/biyopsi belirli patoloji bağlı olarak değişir.
- 5 X mikroskop objektif kullanarak doku odaklanmak. Bu büyütme dokusu hem hücresel ve nekrotik Granülom alanları içeren iyi bir bakış sağlamak. Yazılımda konum'un altında doku içine taşımak için 'caseum' belirlenmiş tüp seçin.
- İstenen diseksiyon parametrelerini girin. Lazer güç 30, hız 15 ve diyafram 35 (rasgele adet) 25 µm kalınlığında akciğer bölüm için tipik ayarlarıdır. Ancak, bunlar kullanılan mikroskop ve güç lazer yaş nedeniyle azalan potansiyel bağlı olarak farklı olacaktır.
- 'Ücretsiz-beraberlik' aracını seçin ve bir fare veya dokunmatik ekran kalemi kullanarak, istenilen bölge diseksiyon için anahat. Bölgesinin yüzey alanı-ecek var olmak göstermek içinde belgili tanımlık bilgisayar yazılımı. Seçili bölgeler daha kolay diseksiyon kolaylaştırmak için 500.000 µm2 (0,5 mm2) altında tutun. Tüp şapkalı toplam 3 milyon µm2 (3 mm2) toplanan kadar diseksiyon yineleyin.
- Bazı durumlarda, disseke bölge (örneğin statik cazibe) nedeniyle çevredeki membran için takılıp kalır ve koleksiyon kap düşmek değil. Bu bölgeler seçerek ve el ile kaldırma yazılım içinde toplu yüzey alanındaki toplam silin.
- Cap 'hücresel lezyon' için seçin ve 3 milyon µm2 adım 3.7 belirtildiği gibi aynı işlem kullanılarak doku toplamak.
- Cap 'ilişki kurmadan akciğer' için seçin ve 3 milyon µm2 adım 3.7 belirtildiği gibi aynı işlem kullanılarak doku toplamak. İlişki kurmadan Akciğer doku birçok bronchioles ve alveoler alanlarda içerdiğini unutmayın. Bunlar diseksiyon için tanımlanmış doku bölgelerden dışlamak için dikkat.
- Kapak Tutucu kaldırmak ve dikkatle Açıl, mühür ve her tüpün etiket. Hava bozuklukları (gibi) hava akışı kesintileri bir açılış kapıdan itibaren çevreleyen disseke doku korumak. Disseke dokularda hemen, analiz veya-80 ° C'de depolayın ve önceden işleme ve LCMS analiz çözülme.
4. çıkarma ve LCMS analizi
- 1:1 Asetonitril/metanol etambutol d-10 dahili standart içeren ayıklama çözüm hazırlamak. Bir iç standart seçerken, kullanım analit uyuşturucu etiketli formun kararlı bir izotop önlemek için yeterli yığın shift ile (döteryum etiketli EMB Bu gösteride kullanılan gibi) çapraz konuşma analit uyuşturucu ve standart (genellikle en az 4 Dalton) arasında .
Not: çünkü çok sınırlı denetim doku homogenate standartları oluşturmak için ilgili doku türlerinin homogenate içinde standartları oluşturmak zordur. Standartları bir çivili homogenate örnek yapma alternatif olarak, bir standart boş doku ve test bileşik birlikte ve açılan ekleyerek oluşturulabilir. Hedef birimin çalışma örnek doku bölümler eşleştirir bir homogenate kontrol doku hacmi doğrudan verilen bir konsantrasyon mevcut olurdu test bileşik bir miktar ile birleştirilmiştir. - Yüzey alanı ve doku bölümü kalınlığına göre hedeflenen doku hacmi hesaplamak ve standart ve QC örnekleri-ecek var olmak mülhak homogenate hacmi kullanarak homogenate için gerekli seyreltme faktörü belirlemek. Hesaplamalar aşağıda 3 milyon µm2 (3 mm2) disseke hedef alanı için bir 25 µm kalınlık ve homogenate hacmi 2 µL ile gösterilmiştir.
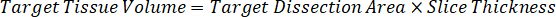
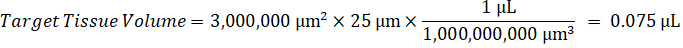
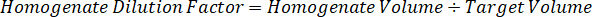

- 1 g/mL, doku yoğunluğu varsayarak hazırlamak homogenate stok kontrol doku 50 mg ağırlığında ve sulandırmak için PBS arabellek ekleme (26.67 homogenate seyreltme faktörü kullanılarak hesaplanır adım 4.2, eritici 1.283 mL). Boncuk boncuk homogenizer 1750 devirde 5 dakika akciğer dokusu ve PBS arabellek yenerek tarafından lunaparkçı.
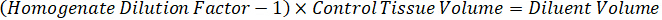
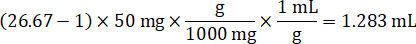
- 1 mg/mL ilaç stokları konsantrasyonu 1:1 Asetonitril/su çözümleri spiking standart eğri oluşturmak için sulandırmak. Spike birim ve hedef doku birimi temel standart konsantrasyonları spiking belirlemek. Bir 100 ng/mL için bir 10 µL spike birim için standart resimli örnektir.
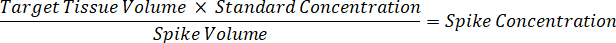
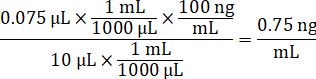
- -80 ° C depolama microdissected dokulardan içeren tüpler kaldırın ve oda sıcaklığında 5 dakika boyunca ulaşmak için izin.
- 1:1 Asetonitril/su çözüm 10 µL ve PBS arabelleğinin 2 µL microdissected doku içeren tüpler ekleyin.
- Standart eğri ve kalite kontrol tüpleri için eriyik-e doğru kontrol akciğer homogenate 2 µL spiking 10 µL ekleyin.
- Ayıklama çözüm 50 µL her tüp için ekleyin.
- Girdap her tüpün 5 dakika, 5 dakika için solüsyon içeren temizleyicide ve Pelet film ve her tüpün doku oluşturmak için 5000 devirde 5 dakika santrifüj kapasitesi.
- 96-şey derin-şey plakasına süpernatant ile 50 µL aktarmak ve bir ek 50 µL her şey deiyonize su ile sulandırmak.
- Etambutol ve etambutol-d10 iç standart (daha önce ayrıntılı12' açıklandığı gibi) için en iyi duruma getirilmiş enstrüman parametrelerini kullanarak LC/MS/MS çözümlemesi gerçekleştirin.
- Seyreltme faktörü her örnek için disseke doku miktarı için düzeltmek için kullanın.
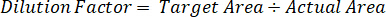
5. yöntemi doğrulama
- Bir homogenate 1 Bölüm akciğer, 2 parça PBS ve 3-4 çelik boncuk birleştirerek denetim akciğer dokusunda oluşturun. Akciğer dokusu ve PBS arabellek 1750 devirde boncuk homogenizer kullanarak 5 dakika yendi.
- Homogenate 10.000 ng/mL (10 mg/mL) ve girdap son konsantrasyon 1 dakika oluşturmak için 990 µL homogenate içine 1 mg/ml etambutol DMSO hisse senedi 10 µL ekleyerek spike.
- Tarafından homogenate bir cryomold dökme ve hızla 5 dakika kuru buza buz gibi donmuş homogenate Bloğu Oluştur.
- 2.1-2,5 adımlarda açıklandığı gibi homogenate blok 25 µm kalınlığında bölümleri hazırlayın.
- Hedef doku alan adımları 3.2-3.10 belirtildiği gibi incelemek.
- 10 µL 1:1 Asetonitril/su ve 2 µL PBS arabelleği microdissected doku içeren tüpler ekleyin.
- Ayıklama çözüm 50 µL her tüp için ekleyin. Standart bir eğri oluşturmak ve doku homogenate blok içinde ilaç konsantrasyonu belirlemek için 4,9-4.12 adımları izleyin.
- Ayıklama verimliliği aşağıdaki formülü kullanarak hesaplar:
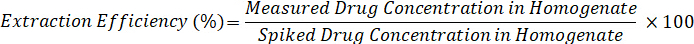
Sonuçlar
LCM-LC/MS yaklaşım genel bakış şekil 1' de gösterilen. Gama-ışın tarafından doku sterilize sonra (doku itibaren kesit) üzerinden tüm sonraki adımları BSL3 koşullar dışında gerçekleşecek. Şekil 2 lezyon öncesi ve sonrası doku yalıtım LCM tarafından biyopsisi bölümleri gösterir. TB lezyonlar nekrotik ve hücresel bölgelerin kolayca tespit ve optik görüntü (olmadan bitişik doku histolojik olarak lek...
Tartışmalar
Dağınık şekilde çözülmüş miktar akciğer TB lezyonlar içinde ilaçların ilaç pozlama sterilize konsantrasyonları bakteriyel nüfus farklı lezyon bölmeleri içinde ikamet eden ulaşır olup olmadığını belirlemek için gereklidir. Burada açıklanan LCM-LC/MS yöntemi kullanarak yalnızca 1-3 doku bölümleri toplam bakteri açısından zengin caseum de dahil olmak üzere bütün lezyon bölümler içinde anti-TB ilaçların mutlak miktar sağlar. Geleneksel doku homojenizasyon ve LC/MS yaklaşımlar iç...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Biz Paul O'Brien, Marizel Mina ve Isabella Freedman hayvan deneyleri için Jacquie Gonzalez ve Danielle Weiner NIH/NIAID dan önce lazer yakalama mikrodiseksiyon ve Jansy Sarathy tavşan doku el yazması için gama ışınlama ile yardım için teşekkür düşünce ve tavsiye. Bu eser Bill'den fon tarafından desteklendi ve Melinda Gates Vakfı (OPP1174780) ve paylaşılan NIH araçları 1S10OD018072 verin. Eliseo A. Eugenin Leica LMD 6500 mikroskop erişim sağlayan ve uzmanlık ve tavsiye paylaşımı için teşekkür ederiz. Satın alma ve devam eden desteğiyle LMD 6500 Ulusal Enstitüsü ruh sağlığı grant, MH096625, sinir hastalıkları Ulusal Enstitüsü ve kontur, NS105584, PHRI (E.A.E) finansman ve GSK katkılar (E.A.E) tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| New Zealand White rabbits | Covance | N/A | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| Acetonitrile (LC-MS grade) | Fisher | A955-212 | |
| Methanol (LC-MS grade) | Fisher | A456-212 | |
| Formic Acid (LC-MS grade) | Fisher | A117-50 | |
| Water (LC-MS grade) | Fisher | W6212 | |
| 0.2 mL flat-cap PCR tubes | Corning | 07-200-392 | |
| Steel frames, PET-membrane | Leica | 11505151 | |
| Premium Frosted Microscope Slides | Fisher | 12-544-2 | |
| 96 Deep well plate 2.0ML PP RB | Fisher | NC0363259 | |
| Zorbax SB-C8 column (4.6 by 50 mm; particle size, 3.5 μm) | Agilent | 820631-001D | |
| "Zipper” Seal Sample Bags | Fisher | 01-816-1B | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| CM1850 cryostat | Leica | Discontinued | Leica CM1860 is the current model |
| Laser Microdissection System 6500 | Leica | Discontinued | Leica LMD 6 is the current model |
| Agilent 1260 Infinity II HPLC | Agilent | ||
| API 4000 QTRAP Mass Spectrometer | Sciex |
Referanslar
- Dartois, V. The path of anti-tuberculosis drugs: From blood to lesions to mycobacterial cells. Nat Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
- Roscioli, K. M., et al. Desorption electrospray ionization (DESI) with atmospheric pressure ion mobility spectrometry for drug detection. Analyst. 139 (7), 1740-1750 (2014).
- Prideaux, B., et al. Mass spectrometry imaging of levofloxacin distribution in TB-infected pulmonary lesions by MALDI-MSI and continuous liquid microjunction surface sampling. Int J Mass Spectrom. 377, 699-708 (2015).
- Griffiths, R. L., Randall, E. C., Race, A. M., Bunch, J., Cooper, H. J. Raster-mode continuous-flow liquid microjunction mass spectrometry imaging of proteins in thin tissue sections. Anal Chem. 89 (11), 5683-5687 (2017).
- Prideaux, B., Stoeckli, M. Mass spectrometry imaging for drug distribution studies. J Proteomics. 75 (16), 4999-5013 (2012).
- Dilillo, M., et al. Mass spectrometry imaging, laser capture microdissection, and LC-MS/MS of the same tissue section. J Proteome Res. 16 (8), 2993-3001 (2017).
- Xu, B. J. Combining laser capture microdissection and proteomics: methodologies and clinical applications. Proteomics Clin Appl. 4 (2), 116-123 (2010).
- Cahill, J. F., Kertesz, V., Van Berkel, G. J. Laser dissection sampling modes for direct mass spectral analysis. Rapid Commun Mass Spectrom. 30 (5), 611-619 (2016).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: A failed host immune response. Open Biol. 1 (4), 110016 (2011).
- Zimmerman, M., et al. Ethambutol partitioning in tuberculous pulmonary lesions explains its clinical efficacy. Antimicrob Agents Chemother. 61 (9), (2017).
- Kempker, R. R., et al. Cavitary penetration of levofloxacin among patients with multidrug-resistant tuberculosis. Antimicrob Agents Chemother. 59 (6), 3149-3155 (2015).
- Zhao, Y., et al. Unraveling drug penetration of echinocandin antifungals at the site of infection in an intra-abdominal abscess model. Antimicrob Agents Chemother. , (2017).
- Pascal, J., et al. Mechanistic modeling identifies drug-uptake history as predictor of tumor drug resistance and nano-carrier-mediated response. ACS Nano. 7 (12), 11174-11182 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır