Method Article
Morfogenetik dinamiklerini analiz ve hücre iskeleti düzenleyiciler ciro sağlayan Embriyolardan teknikleri
Bu Makalede
Özet
Biz nasıl sıkı BAĞLAMAK ve photoactivation gibi mikro - ve photomanipulation teknikleri hareketliliği parametreleri belirlenmesi etkinleştirmek ve proteinler geçiş içinde kronolojik zamanmekansal dinamikleri hücreleri tanımlamak. Deneysel veriler hücre altı dinamikleri ve ciro hareketliliği düzenleyiciler veya temel aktin sitoiskeleti içerir.
Özet
Zamanmekansal dynamics proteinlerin incelenmesi çeşitli bağlamlarda fonksiyonel önemi ortaya çıkarabilir. Bu makalede, öyle sonra photobleaching (sıkı BAĞLAMAK) ve photoactivation teknikleri ele nasıl flüoresan kurtarma proteinler hücre altı yerlerde kronolojik zamanmekansal dinamiklerini incelemek için kullanılabilir. Biz de nasıl bu teknikler çeşitli parametreler aktin hücre iskeleti yönetmelik ve hücre hareketliliği için bağlı basit belirlenmesi olanaklı kılmak göstermek. Ayrıca, hücre mikroenjeksiyon Ayrıca (potansiyel olarak önceki veya söz konusu photomanipulation teknikleri tamamlayan) alternatif tedavi tetikleyici anlık etkileri translocated proteinler hücre için anlatılan morfoloji ve işlev. Embriyolardan protein enjeksiyon veya yerel uygulama plazma membran geçirgen uyuşturucu veya hücre iskeleti inhibitörleri gibi tedavisinde belirli bir hücre davranış tek hücre ve hücre altı üzerine hemen sonuçları kaydetmek için güçlü bir araç olarak hizmet verebilir düzeyi. Bu burada lamellipodial hücre kenar çıkıntı hemen indüksiyon tarafından rekombinant Rac1 protein, iğne ile bir çeyrek yüzyıl önce belirlenen örneklenir. Ayrıca, Gelişmiş yeşil flüoresan protein (EGFP) ciro belirlemek için bir protokol sağlar-VASP, belirgin B16-F1 hücrelerinin lamellipodial ipuçları biriken bir aktin filaman polimeraz sıkı BAĞLAMAK istihdam ve dahil olmak üzere ilgili veri analiz ve eğri uydurma. Ayrıca lamellipodial aktin ağ polimerizasyonu, oranları tahmin etmek için yönergeleri EGFP öğesini β-aktin ifade hücreleri tarafından olarak mevcut. Son olarak, nasıl aktin monomer hareketlilik photoactivation kullanılarak hızlı filaman derleme, lamellipodia, çıkıntılı ipuçları gibi sitelerde aktin birleşme tarafından takip hücre sitoplazma içinde oranları araştırmak talimatlar verilmiştir yaklaşıyor. Bu protokoller hiçbiri bileşenleri veya aktin sitoiskeleti düzenleyiciler için sınırlı, ama kolayca benzer moda kronolojik zamanmekansal dynamics ve çeşitli farklı hücre altı yapıları veya fonksiyonel proteinlerin işlevi keşfetmek için uzatılabilir bağlamlarda.
Giriş
Proteinler ve canlı hücreler diğer molekülleri kronolojik zamanmekansal dinamiklerini izleme hücre ve Moleküler Biyoloji alanında pek çok gerekli bir araç haline gelmiştir. Floresans mikroskobu teknikleri Floresans rezonans enerji transferi (FRET) ve (FRET-FLIM) görüntüleme FRET-floresan ömür boyu da dahil olmak üzere Gelişmiş veya sıkı BAĞLAMAK, Floresans kaybına photobleaching (fiske VURMAK) ve photoactivation gibi diğerleri izin zamansal ve mekansal protein-protein etkileşimler, konformasyon değişiklikleri izleme gibi Difüzyon kinetik ve yerelleştirme hücre1,2farklı proteinlerin belirlenmesi için. Sıkı BAĞLAMAK ve photoactivation teknikleri, özellikle, aktin sitoiskeleti ve hücre göç düzenleyiciler incelenmesi için yaygın olarak uygulanabilir. Bu teknikler tek başına veya mikroenjeksiyon3gibi ek Embriyolardan teknikleri ile birlikte uygulanabilir ve proteinlerin fluorescently etiketli ifade içerir. Onlar protein Derneği aktin zengini yapılarına Kinetik tahminine yer filopodia veya lamellipodia, Fokal yapışıklıklar4, proteinlerin ciro gibi hücre geçiş izin veya aktin ağlar5dallı. Ayrıca lamellipodial aktin polimerizasyon fiyatlar, sitozol, aktin filamentleri çıkıntılı olarak polymerizing için hücre altı aktin monomer translocation oranı içinde monomeric aktin dağılım değerlendirilmesi belirlenmesi olanağı lamellipodia6ve diğer parametreleri.
Sıkı BAĞLAMAK görselleştirme ve proteinler ilk olarak 1970'lerde Axelrod7tarafından geliştirilen canlı hücrede hareketliliğini miktarının bir yöntemdir. Faiz (ROI) fluorescently etiketli proteinler ile doldurulan bir hücrede bulunan bir bölge geçici bir lazer yüksek yoğunluk, bu bölgede mevcut bir verilen kısa dönemde fluorophore moleküllerinin ağartma neden yeterli maruz kalmaktadır. Fluorescently beyazlatma sırasında yatırım Getirisi dışında bulunan protein etiketli Ryslampa diffüz ve ağartılmış bölgeye bağlı olarak photobleached moleküller öteleme zamanla neden onların kronolojik zamanmekansal dynamics sızmak. Tabii onun devir hızı içinde sözde ağartılmış yapısı ilişkili ve ağartılmış bölgelerde Floresans kurtarma oranı boyutu ve belirli bir molekül Difüzyon oranı da dahil olmak üzere çeşitli faktörlere bağlıdır. Böylece, çözünür proteinler Floresans sıkıca odak yapışıklıklar gibi yapıları ile ilişkili proteinler ise Difüzyon yoluyla hızla ağartılmış ROI içinde kurtarma aracılık, onların Floresans kurtarma gibi-ecek-si olmak uzun ciro süreleri, hem yapısı ilişkili kesir protein ve ayrılma-dernek Kinetik çözünür kısmını Difüzyon üzerinde bağlıdır. Floresans kurtarma genellikle satın aldı ve floresan yoğunluğu öncesi çamaşır suyu başlangıç düzeyi ulaşılana kadar sayılabilir. Difüzyon tarafından doldurulan değiştiremiyor sözde hareketsiz kesir ait olduğu veya mobil oluşan moleküller çoğunluğu ile karşılaştırıldığında çok yavaş hesaplı Yenileyici ilk floresan yoğunluğu bir parçası, ancak, bu oluşmaz kesir. Protein Ciro oranı belirlemek için sıkı BAĞLAMAK eğrileri, Floresans kurtarma ölçüde zaman içinde temsil eden oluşturulur. Bu kurtarma eğrileri ortalama buçuk kat protein kurtarma hesaplanabilir. Eğri uygun ortalama sıkı BAĞLAMAK veri ve dolayısıyla matematiksel analizler oluşturarak, mobil kesir ortalama Ciro oranı bileşik moleküllerinin homojen bir nüfusun oluşturan veya bu oluşur anlamak mümkündür iki veya daha fazla altgrupları diferansiyel oranları teslim molekülleri. Kantitatif yaklaşımlar tarafından protein ciro oranları tahmin ek olarak lamellipodia bölgelerde photobleached kurtarma izleme da retrograd akışı, çıkıntı gibi lamellipodial motilite parametreleri doğru miktar için izin verebilirsiniz, ve aktin polimerizasyon oranları. Bu nedenle, sıkı BAĞLAMAK yaşam hücre yapıları içinde çeşitli parametreleri değerlendirmek için uygulanacak çok yönlü bir araç teşkil etmektedir.
Photoactivation Difüzyon ve proteinler veya belirlenmiş bir hücresel konumundan kaynaklanan molekül hareketliliğini izlemek için kullanılan bir yöntemdir. Tekniği kullanır, örneğin, bir değişken başlangıçta son derece maruz kalma üzerine arttırılması onun Floresans sağlar bir şekilde mutasyona Patterson ve Lippincott-Schwartz8tarafından geliştirilen vahşi tipi yeşil flüoresan protein (GFP), ultraviyole (UV) ışık (yaklaşık 400 nm; burada, 405 nm). Patterson ve arktarafından açıklandığı gibi., vahşi tipi GFP kromofor mevcut nüfus tarafsız fenoller ve yaklaşık 397 büyük Absorbans zirvesinde üretmek Anyonik phenolates olarak nm ve küçük bir 475, nm, anılan sıraya göre. Işınlama UV ışığıyla proteinin nüfus photoconversion, iyonik formu doğru kayması uğrar. 488 tarafından heyecanlı zaman nm, photoconverted/photoactivated protein Floresan, ayrım arasında aktif ve sigara-harekete geçirmek GFP yüksek iç arka plan Floresans nedeniyle uygulamada yetersiz içinde 3 kat artış gösteriyor. Ancak, arka plan yoğunluğu azalmasına GFP sıra (203 konumundaki histidin ikame) içine bir tek amino asit mutasyon getirerek elde edilmiştir. Elde edilen T203H mutant, photoactivatable-GFP (PA-GFP) bunun üzerine ışınlama UV ışığı ile neredeyse 100-fold 488 nm ışık tarafından daha sonra heyecanlı zaman artar küçük tepe Absorbans önemli bir azalma ile karakterize olarak da bilinir. Bu nedenle, overexpression PA GFP öğesini proteinlerin Difüzyon belirlenmesi ve motilite moleküllerin hücrenin sağlar yaygın olarak kullanılan bir yaklaşım olacaktır. Daha önce sadece keşif çıkıntılı içine onların hareketlilik sitozol, aynı zamanda onların birleşme oranı içinde izin PA GFP öğesini aktin aktin monomerleri sitozolik bölgeler, uzak dağılım oranını belirlemek için uyguladığınız lamellipodial aktin ağ6. Daha yeni edebiyat da prensip olarak benzer bir biçimde kullanılabilmesi için roman, fotoğraf-Cabrio proteinler açıklar ama zaten fotoğraf-dönüştürmeden önce görünür olmasını olası avantajı yataklık. Bu grubun floresan proteinlerin örnekler9,10,11,12Dendra2 ve mEos2.
Bu makalede, biz proteinlerin microinjecting hücrelerle metodolojisi açıklar. Daha ne kadar bu teknik ile sıkı BAĞLAMAK, photobleaching proteinlerin aktin sitoiskeleti yönetmelik ve hareketliliği, dahil tarafından birleştirilebilir ve nasıl sıkı BAĞLAMAK eğrileri ve yarı zamanlı mobil kesirler kurtarma elde edilebilir açıklamak. Buna ek olarak, biz ne kadar sıkı BAĞLAMAK teknik aktin polimerizasyon hızı lamellipodial ağlar için kullanılabilir bir örnek sağlar. Ayrıca yönergeleri ve monomeric aktin sitozolik hareketliliğini ve lamellipodia içine aktin şirketleşme oranları belirlemek için kullanılan photoactivation deneyler gerçekleştirmek ipuçları sağlar. Tabii ki, bu teknikleri değildir sadece sınırlı aktin sitoiskeleti bileşenleri izleme, ama potansiyel olarak gerekli orta adaptasyon veya en iyi duruma getirme üzerine, yaygın olarak diğer hücre tipleri için veya farklı proteinler, yapıları, araştırmak için uygulanabilir ve parametreleri.
Protokol
1. Coverslip çamaşır ve sterilizasyon
- 15 mm (çap) kapak gözlük (no.1) 40 mL % 37 HCl ve 60 mL %100 karışımı içeren bir 500 mL şişe sokmak alkol (değil daha--dan 100 coverslips 100 mL çözüm yıkama başına).
Not: taze satın almış olsanız bile, coverslips sıkı hücreleri onların yüzeyler üzerine tohum önce temizlenmesi gerekir. Yağ, macroscopically görünmez ancak verimli bir şekilde yapışma ve uygun canlı hücrelerinin yayılmasını engelleyebilir ince filmlerin içerebileceğinden bu. Gibi filmler verimli bir şekilde asit veya baz içeren çözümlerle kaldırılabilmesi için ise (bkz: Fischer vd. 13), rutin olarak yukarıda açıklanan asit/alkol karışımı kullanın. - Bir rotasyon shaker üzerinde 30 dk kapak gözlük içeren şişeyi sallayın. Serbestçe swirled ama sık kırma önlemek için yeterli yavaşlatmak için kapak gözlük sağlar bir hız seçin. Kırık cam parçaları yeniden kullanma Eğer kaldırmak için çözüm filtrate.
- En az 200 mL steril su içeren bir şişesi kapak gözlük aktarmak ve asidik koku yok oldu kadar tekrar tekrar su değiştirirken bir rotasyon shaker üzerinde kuluçkaya. Birkaç saat içinde birden çok yıkar HCL-alkol izleri tam ortadan kaldırılması için tavsiye edilir.
- Bireysel kapak gözlük bir filtre kağıt üzerine kuru.
- Filtre kağıdı ve ısı ile 10 cm (çap) Petri kabına alt kapak gözlük kaplı yer kuru-sterilize. Bu kapak bir arada gözlük neden olur ısıyla önlemek.
2. tedavi hücreleri, Transfection ve Coverslips tohum
- B16-F1 fare Melanom hücreleri % 10 fetal buzağı serum, 2 mM glutamin ve % 1 penisilin-streptomisin 37 ° c, % 7 CO2içeren standart hücre kültür koşullarında DMEM (4,5 g/M glikoz) göre büyür.
- Standart hücre kültür koşulları (37 ° c, % 7 CO2doku kültürü kuluçka) göre microinjections için NIH3T3 fibroblast hücreleri büyümek DMEM (4,5 g/M glikoz) içeren % 10 fetal sığır serum, 1 mM sodyum pyruvate, 1 x MEM esansiyel olmayan amino asitler , 2 mM glutamin ve % 1 penisilin-streptomisin.
- Transfections için 3 cm (çap) plastik çanak içine % 100 izdiham 10 cm çanak ve geçiş 1:5 oranında B16-F1 hücreleri büyümeye.
- B16-F1 hücreleri en az 6 h için bağlı kalmak için izin verildi sonra aynı gün, photoactivatable PA-GFP-aktin 500 ng/tabak ya da EGFP öğesini β-aktin plazmid DNA ile transfect. PA-GFP-aktin mCherry kodlama vektörel çizimler ile eş transfections plazmid DNA 3 cm çanak başına 1 µg toplam karıştırın.
- B16-F1 hücreleri transfection reaktifi (Malzemeler tablo) ile transfect. 3 cm çanak için 150 mm NaCl 500 içeren 200 µL mix ng DNA'ın inşa 150 mM NaCl transfection reaktif 1 µL içeren 200 µL ile (Yani, DNA (µg): 1:2 oranında reaktif (µL) kullanıldı).
- Transfection karışımı oda sıcaklığında (RT) ve damlalıklı drop-wise hücreleri içeren 3 cm çanak üzerine 20 dk için kuluçkaya. Yavaşça karıştırmak ve gecede 37 ° C, % 7 CO2kuluçkaya çanak girdap.
- 50 mM Tris, pH 7,4 ve 150 mM NaCl içeren laminin kaplama arabellek hazırlayın.
- B16-F1 hücreler için 15 mm kapak gözlük laminin (25 µg/mL laminin kaplama arabelleği) 150 µL yayarak ceket ve RT. 1 h için kuluçkaya NIH3T3 hücreler için kapak gözlük fibronektin çözüm (25 µg/mL fosfat tamponlu tuz çözeltisi (PBS)) ile ceket ve RT. 1 h için kuluçkaya
- Kapak gözlükle Laminin veya fibronektin inkübe PBS, yıkama sonra PBS Aspire edin ve transfected hücrelerinin 2 mL ekleyin.
- Transfected B16-F1 hücreleri tohum (1:30 oranı üzerinden Konfluent bir yemek), gün'den sonra laminin kaplı coverslips üzerine transfection. NIH3T3 fibroblastlar tohum (1:20 oranı Konfluent bir yemek üzerinden) fibronektin kaplı coverslips üzerine.
- Hücreleri laminin veya fibronektin kaplı kapak gözlük geceleme bir doku kültürü kuluçka mikroskobu önce 37 ° C'de yaymak izin verir. Alternatif olarak, hücre için en az 2-3 h yaymak için izin verilen bu mikroskobu deneyler aynı gün başlatılabilir.
3. montaj odası Imaging mikroskobu
- Odası (şekil 1bir) mikroskopi için Imaging ısı iletken RC-26 alüminyum kullanın. Silikon gres (şekil 1b) kullanarak plastik mühürleyen açılış kontur çevresinde smear.
- Hücreleri yan-up ile kapak cam Odası (şekil 1c) yerleştirin.
- Plastik mühürleyen cam kapak coverslip ve odası arasında güvenli bir mühür yapmak üzerine yerleştirin. (Çapraz olarak coverslip kırılma) önlemek için plastik mühürleyen kayar kıskaç (şekil 1d) sızıntı orta önlemek için odası vidalama ile düzeltmek.
- Pipet 37 ° C Önceden ısıtılmış mikroskobu orta orta alana. Autofluorescence içinde azaltılmış ve böylece mikroskopi için en iyi duruma getirilmiş ortamı için kültür yukarıda ama F12-HAM DMEM, ayrıca 20 mM HEPES yokluğunda CO2 (rakam, hücre kültürü çalışmalarının için içeren yerine ile açıklanan Orta olarak aynı reçete kullanımı 1e).
- Sıcaklık Dedektörü odasının belirlenen yuvasına takın ve elektrotlar odasının 37 ° C (şekil 1f) sabit bir sıcaklık sürdürmek bir TC-324B otomatik sıcaklık denetleyiciye bağlamak.
- Küçük bir damla daldırma yağı amacı üzerine yerleştirin ve odası üstüne yerleştirin.
- Montaj sırasında sıcaklık damla--dan kurtarmak için ve mikroskopi ortamına uyum sağlamak en az 10 – 30 dk için hücreler odası kuluçkaya.
- Mikroskopi başlatılan önce Orta bileşenleri ve serum orta buharlaşma nedeniyle uygunsuz konsantrasyon önlemek için Odası (yaklaşık 800 µL) Merkezi rezervuarı kültür ortamında değiştir. Uzun süreli mikroskobu oturumları açık odaları ile rutin buharlaşma orta değiştirme gerektirir.
4. mikroenjeksiyon yordamı
- Coverslips kat, hücreleri hazırlamak ve görüntüleme odası yukarıda açıklandığı gibi bir araya.
- Bir aliquot saf protein enjekte edilir çözülme (genellikle 10 µL veya daha az) ve uygun mikroenjeksiyon önbellekle sulandırmak.
Not: Arabellek oluşturma protein ve hücre türüne göre değişir, ama 6,95 ve 8,00 arasında bir pH kullanın ve PBS, kullanmaktan kaçının için PBS ile enjekte edilir çoğu hücre hoşlanmıyor gibi özen. - Rac1 mikroenjeksiyon için 100 mM NaCl, 50 mM Tris-HCl pH 7.5, 5 mM MgCl2, 1 mM DTT içeren arabellek hazırlayın. Mg2 + iyonları küçük GTPazlar istikrar için gereklidir.
Not: Protein konsantrasyonları normalde 0.1-1 arasında farklılık mg/mL (en fazla 2 mg/mL), protein bağlı olarak, deneme ve hücre türü yazın. - (Varsa), inert dextran (0,5 µg/mL, 70 kDa) gibi floresan boya iğne akış enjeksiyon önce varlığı teyit edebilir ve başarılı enjeksiyonları belgelerine deneme sonra izin veriyorsa protein çözüm ekleyin.
Not: Hangi sadece protein doğrudan Floresans etiketleme üzerine mümkün olacaktır enjekte Rac1, dinamikleri takip deneme amaçlı değil. Kancası ile floresan boyalar ya da füzyon floresan bir protein proteinlerin mümkün ama Sakınılan burada özellikle Rho-aile GTPazlar Rac1 gibi küçük proteinlerin sinyal işlevi ile müdahale riski limanlar (20 kDa). - 10.000 x g için en az 30 dk de protein çözüm varsa mikroenjeksiyon kılcal damar tıkanma iğne yol açabilir protein toplamları kaldırmak için santrifüj kapasitesi.
- Mikroenjeksiyon iğne (mikroenjeksiyon kapiller) 1 µL enjeksiyon karışımı ile esnek pipet ucu/microloader ucu kullanarak arka taraftan yükleyin.
- Hava kabarcıkları iğne ucu varsa, bunları kaldırmak için iğne Bankası hafifçe dokunun. İğne tıkanma neden olabilir iğne ucu kurutma önlemek için hızlı bir şekilde devam edin.
- Dikkatle iğne bağı Embriyolardan cihaz üzerinde ayarlayın. İğne yüklemeden önce faz kontrast görüntüleme için ters bir mikroskop kullanarak eğer mikroskop kondansatör tıkayan olmadan iğne yukarı ve aşağı hareket için yeterli alan olduğundan emin olun.
- Microcapillary iğne bağı üzerine vidalama üzerine basınç (20-50 inç arka plan basınç) hücre kültür orta iğne ucu translocating önce mikroenjeksiyon Hidrofor cihazı kullanarak iğne uygulanır.
Not: iğne ortamda olduğunda basınç etkinleştirme kadar kapiller Kuvvetleri tarafından sucked orta yol ve böylece ilgi çözümün enjeksiyon yasaklamak. - İğne (düşük büyütme hedefleri kullanarak kolaylaştırdı) görüş alanı yerleştirin. Bir 40 X kuru hedefi mikroenjeksiyon deneyler için burada kullanılmıştır.
- İğne ucu macroscopically (Bu iğne ucu bulma hızlanır) bir dikey konumunu objektif lens orta göre konumlandırın. Mikroskop ile faz kontrast optik görüş alanı, optik bir uçak göre yatay düzlemde iğne ucu iyi yukarıda hücre katmanı taşımak için kullanın.
Not: İğne başlangıçta bir gölge görüş alanı içinde görünür ve odak düzlem sonra ucu görselleştirmek için ayarlanabilir. İğne ucu bulunduktan sonra yavaş yavaş iğne ucu yakın hücre katmanı bir pozisyon aşağı ardından optik uçağı indir. - Floresan dextran kullanırken floresan bir kanala geçiş yaparak iğne akış kontrol ve sürekli "arka plan" akışı elde etmek için Hidrofor cihazı kullanarak akışı ayarlamak.
Not: Bu makalede, biz yolu ile hücre dokunmadan plazma zarı aracılığıyla kırarak aracılık ettiği el ile enjeksiyon tarif yüzey ve nazik iğne ucu hareketin sürekli iğne akışı sırasında. Bu otomatik enjeksiyon aygıtlardan daha yüksek hücre sayıları bir sonraki hücre nüfus tarafından takip enjeksiyon için uygundur enjeksiyon olaylar sırasında tarafından programlanmış iğne düşürerek ve iğne basınç artışı eşliğinde seçkin gerekir analiz. Burada açıklanan yöntemi tek hücre analizi için hızlandırılmış mikroskobu tarafından öncesinde, sırasında ve sonra mikroenjeksiyon optimize edilmiştir. - İlgi bir hücre bulma ve yavaş yavaş iğne hücrenin üstündeki alt.
- Microinject hazır olduğunuzda iğne yavaş yavaş micromanipulator joystick iyi pinyon odakta hücreleri tutarken kullanarak hücre perinükleer bölgenin doğru indirin.
- Mikroenjeksiyon için plazma zarı hücrenin nüfuz ya da mikroskop kurulum çok nazik mekândaki tarafından geçici membran rüptürü yardım için yeterli hücrenin hafifçe dokun.
Not: Beyaz nokta iğne ucu, plazma zarı ile temas zaman gösterecektir; membran rüptürü, iğne ucu yeniden mühürleyin, hücre içine enjeksiyon çözüm nazik bir akış tarafından eşlik etti. - Hücre içine akışı görünür enjeksiyon süreci durdurmak (0,3 içinde ideal bir konuma sahip s) iğne ucu kadar orta taşıyarak. Floresan dextran kullanırken, başarılı enjeksiyonları hemen Floresans tarafından belgelenmiş.
- İstenirse, hızlandırılmış resim alma önce veya sonra mikroenjeksiyon başlatın.
Not: Yerel uygulama uyuşturucu veya inhibitörleri mikroenjeksiyon olay başınahariç tüm adımları burada, çalıştırılabilir. Yerel uygulamalar, etkin molekül Difüzyon akış basıncı tarafından kontrol ve floresan tarafından belgelenmiş ve iğne ucu istenilen yükseklikte yerleştirilebilir. Yerel uygulama deney örnekleri için bkz: Örneğin, küçük ve Rottner14 veya Kaverina vd. 15 - Mikroenjeksiyon protein etkisi kadar bekleyin oluşur. Kuluçka kez farklı proteinler ve beklenen sonuca göre değişebilir. Küçük GTPazlar Rac1 için lamellipodium oluşumu yanıt 1 dk içinde başlatılan veya daha az olabilir, ama ortalama olarak tamamen (şekil 1g, h) geliştirmek için yaklaşık 10-15 dakika sürer.
- Mikroenjeksiyon aşağıdaki hücre canlılığı yargıç.
Not: Uygun olmayan veya zararlı enjeksiyonları sık belirsiz hücre-kenar geri çekilmesi veya plazma zarı yırtılması ile birlikte hücre hasarı neden olabilir.- Alt ve üst plazma enjeksiyonlar düz hücresel bölgelerde için oluşabilir membran, aracılığıyla poking kaçının.
Not: Enjeksiyon birimleri minimumda tutulmalıdır (ideal olarak < %5 hücresel biriminin) ve genellikle femtoliter aralığında olacak. Enjeksiyon birimleri aynı zamanda konsantrasyon değişiklikleri tarafından kontrol edilebilir ama proteinleri, konsantrasyonları unutmayın gerekli > 2 mg/mL sık iğne tıkanma nedeniyle pratik olabilir. Ancak, bu aynı zamanda kalite ve saf protein davranışını bağlıdır; örneğin, aktin fluorescently birleştiğinde enjeksiyon konsantrasyon bağımlı ve kaçınılmaz polimerizasyon için iğne İpucu tarafından karmaşık ve çok çok nadiren yürütüldüğünde bugün (bkz: küçük vd. 16).
- Alt ve üst plazma enjeksiyonlar düz hücresel bölgelerde için oluşabilir membran, aracılığıyla poking kaçının.
- Daha önce sırasında veya sonrasında mikroenjeksiyon etkisini sıkı BAĞLAMAK veya photoactivation aynı gerçekleştirilebilir (bkz: Bölüm 5 ve 6) hücre.
5. yordam sıkı BAĞLAMAK
- Faiz (burada B16-F1 hücreleri) plazmid DNA ilgi fluorescently öğesini protein kodlama ile hücre türü transfect (burada, β-aktin EGFP öğesini sürümü kullanılmıştır). Tohum hücreleri üzerine laminin kaplı coverslips (Adım 2.10).
- Görüntüleme Odası (Bölüm 3) bir araya getirin.
- Lamellipodial bölge photobleaching için aşağıdaki ayarları kullanın: 65 mW lazer güç (deneysel kurulum ve lazer kaynağı göre değişken); 10 piksel lazer ışın çapı; 1 ms çamaşır suyu Işınma Zamanı/piksel; 500 ms GFP çekim hızı; 1.500 ms zaman aralığı. Bu kağıt deneysel sonuçlar bir 100 X 1.4NA apochromatic amacı ile gerçekleştirilmiştir.
- Photobleached bölgesinin boyutta doğruluğunu sağlamak için lazer kalibrasyon gerçekleştirin. Kalibrasyon önce görüş alanı herhangi bir hücre/floresan sinyal eksik bir alanına taşıma ve resmin ekranda izleyebilirsiniz.
- Objektif büyütme ilgili büyütme düğmesini tıklatarak seçin ve lazer güç (3-5 mW) azaltmak "paneli | Yoğunluk"menü. Visiview yazılım (v2.1.4) üzerinde manuel kalibrasyon başlatmak için seçin "Configure | Sıkı BAĞLAMAK"yemek listesi ve tıkırtı üstünde" Ayarla'ya | Menü manuel ayarlama". Lazer keskin bir nokta olarak ayırt edilebilir emin olun. Aksi takdirde, yönlendirmesi veya lazer donanım ayarlayabilirsiniz.
- Kalibrasyon el ile önceden belirlenmiş yazılım XY koordinatları için lazer rehberlik ederek gerçekleştirmek. Bu yazılımın nasıl özellikle geçerli büyütmeyi için kullanıcı tanımlı bir bölgesine lazer hedef bildirir.
- Daha önce lazer tetikleme, GFP kanala geçin ve görüntü/zaman atlamalı edinme işlemini başlatın.
- El ile ekranda görüntülerken GFP kanalında photobleached olmak bölge çizin.
- Photobleaching 405 nm lazer, el ile bir tetikleyici tarafından en az 3-4 kare resim alma inisiyasyon sonra Başlat. Çerçeveler photobleaching önce edinme sonraki veri analizi görüntü normalleştirme için gereklidir.
6. Photoactivation yordamı
Not: Yazılım, mikroskop kurulum ve ayarları, lazer güç dışında sıkı BAĞLAMAK için benzer. Photobleaching, PA-GFP aynı anda photobleaching etkinleştirmek için kullanılması gerekir için istihdam 405nm-lazer gücü önemli ölçüde daha düşük olduğunu photoactivation, sıkı BAĞLAMAK, ile karşılaştırıldığında önemli bir fark da bu.
- Ortak ilgi hücre tipi transfect (B16-F1 burada hücreleri; bkz. Adım 2.5) PA-GFP-aktin ve başka bir fluorescently etiketli protein (Örneğin, mCherry veya mCherry-Lifeact) plazmid DNA ile kodlama.
Not: çoğu durumda, mCherry pozitif hücreler da PA-GFP-aktin vektör, normalde GFP kanal photoactivation önce görülen ikinci için olumlu olacaktır. MCherry pozitif hücreler de PA-GFP için olumlu olduğunu olasılığını artırmak için mCherry:PA 1:2 transfection oranında kullanın-GFP-aktin. Tabi bu iletişim kuralı, fazla % 90 mCherry ifade hücreleri başarılı PA-GFP-aktin aktivasyonu görüntülenir. - B16-F1 tohum hücreleri üzerine laminin kaplı coverslips (Adım 2.10).
- Görüntüleme Odası (Bölüm 3) bir araya getirin.
- Photoactivation deneyler işlemini başlatmadan önce gerekli, seçili amaç için (Adım 5.4-5.6) lazer kalibrasyon gerçekleştirin.
- GFP/488 nm resim alma (bağlı olarak deneysel tasarım) 500 ms pozlama ve 1.500 ms zaman aralığını ayarlayın.
-
"Dalga boyu serisi" kare işaretleme ve kanalları istediğiniz sayıyı seçerek çift kanal veya üç kanallı hızlandırılmış film edinme için yazılım ayarlarını "edinme | Dalga boyu"menü. Bu film zaman atlamalı faz kontrast ve GFP kanalları ile iktisap önerilir.
- İsteğe bağlı, ayrıca mCherry kanalı içerebilir; Ancak, çok fazla ışık hücrelerle açığa duyarlilik neden. Hücre odası sızdırmazlık etkili tedavi gerektirir, ancak bu oksijen gidericiler gibi Oxyrase17, kaçınılması.
- MCherry kanalında transfected hücreleri bulmak.
- Daha önce lazer uyarının harekete geçirilmesine karşılık, görüntü/zaman atlamalı edinme başlatmak ve el ile ekranda görüntülerken photoactivated faz kontrast kanalda olmak bölge çizin.
- Photoactivation 405 nm lazer el ile bir tetikleyici tarafından başlatmak (yoğunluk ayarla 5-15 mW arasında "paneli | Yoğunluk"menüsü), en az 3-4 kare görüntü alma başlatma sonra.
7. veri analizi ve sıkı BAĞLAMAK sonuçlarının tanıtım
Not: Bu durumda yapışma siteleri ve lamellipodia çıkıntılı ipuçları associates VASP dinamik aktin derlemenin sitelerdeki biriken proteinin ciro soruşturma için sunulan yöntemi kullanılır. Biz cirosunu lamellipodium ucundaki analiz ama analiz aynı prensipleri VASP veya herhangi bir diğer protein ve diğer hücre altı bölmeleri ciro soruşturma için uygulanabilir.
- Visiview değişebilen yazılımdan türetilen hızlandırılmış film açın. Bu makalede, değişebilen v7.8.10 kullanıldı.
- Yoğunluk değerleri photobleached bölgeler için el ile değişebilen üzerindeki ilgili bölgeleri düzeylendirme tarafından türetme yapıp yapmayacağınızı. Tüm veya photobleached alan parçası kapsar ve izleyen çerçeveler konumu el ile ayarlamak lamellipodium ucunda bir şekil (kenar çıkıntılı EğerYani, ), ihtiyaç duyulan sipariş lamellipodial yoğunluklarını değişiklikleri izlemek için beraberlik İpucu yer değiştirme sırasında ilgili bileşeni.
- Arka plan ve photobleaching edinme düzeltilmesi için bölgeler içinde ve hücre dışında analiz. Şekil 2bir ölçülen yoğunluklarını temsilcisi bölgeler için bkz.
- Bir yatırım Getirisi seçili durumdayken menüsünü kullanarak yoğunluk değerlerine değişebilen ayıklamak "ölçü | Bölge ölçümleri". "Yapılandırma" menüde "Geçen süre" ve "Ortalama yoğunluğu" seçeneklerinin seçili olduğundan emin olun. "Açık oturum"'ı tıklatın ve "Dinamik veri değişimi" seçin. Tıkırtı "OK" bir Excel elektronik tablosu açın ve tekrar değişebilen değerleri Excel yapıştırmak için "oturum aç" düğmesini tıklayın.
Not: Bu değerler Floresans kurtarma eğriler oluşturmak için kullanılır. - Floresans kurtarma eğrileri lamellipodium ucundaki photobleached bölgeler (photobleaching önce bölge yoğunluğu için normalleştirilmiş) oluşturmak için aşağıdaki denklemi uygulanır:
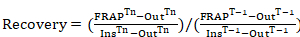 Denklem 1
Denklem 1
nerede: sıkı BAĞLAMAKTn olduğunu photobleached bölge yoğunluğu photobleaching; aşağıdaki ilgi her kare için Tn photobleaching (arka plan) hücre dışında faiz her çerçeve için alınan bir bölge yoğunluğu takip ediyor; INSTn iki bölge yoğunluklarda her karenin (satın alma photobleaching için zaman içinde normalleştirmek için kullanılır); photobleaching takip ilgi içinde ortalama olduğunu Sıkı BAĞLAMAKT-1 photobleaching önce photobleached bölge yoğunluğu olduğunu; T-1 photobleaching önce (arka plan) hücre dışında alınan bir bölge yoğunluğu olduğunu; ve InsT-1 iki bölge yoğunluklarını photobleaching önce ilgi her karenin içinde ortalama olarak. - İlgi her zaman dilimi için Denklem 1 araştırılması için tüm zamanların çerçeveler içeren bir floresan kurtarma eğrisi elde etmek için kullanın. Süre kesinlikle soruşturma altında protein bağlıdır. Bilinmeyen, protein devir hızı elde etmek için ön deneyler gerçekleştirin.
- Yarı kurtarma hesaplamak, karşılık gelen bir saat (saniye cinsinden) ile floresan kurtarma eğrisi değerlerini bir Sigma Arsa (v.12) yapıştırın ve kullanarak uygun bir eğri gerçekleştirmek "dinamik uygun Sihirbazı | Üstel artış maksimum"aracı. SELECT mono üstel (tek, 3 parametre) veya BI üstel (double, 4 parametre) işlevleri, bağlı olarak uygun en iyi eğrisi.
- Mono-Üstel fonksiyon için aşağıdaki formülü kullanın:
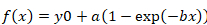 Denklem 2
Denklem 2
- BI-Üstel fonksiyon için aşağıdaki formülü kullanın:
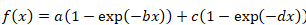 Denklem 3
Denklem 3
- Parametreleri "b" ve "d" Sigma çizmek--dan (Denklem 2 veya Denklem 3) elde edilen yarı kurtarma hesaplamak için Excel'e yapıştırın. Aşağıdaki denklemler uygulanır:
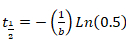 Denklem 4
Denklem 4
veya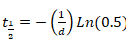 Denklem 5
Denklem 5
- Mono-Üstel fonksiyon uygun bir doğru eğri sonuçlandığında, sadece denklemi 4uygulanır.
- Mono-Üstel fonksiyon iyi eğriye uygun yol açmaz, BI üstel formülü Denklem 4 ve 5 denklemçözme tarafından uygulanır. İki farklı protein kesirleri temsil eden olarak iyileşme elde edilen iki buçuk-kat düşünün: bir hızla ve yavaş yavaş alışverişi kesir, sırasıyla.
8. Lamellipodial aktin polimerizasyon hızı tarafından belirlenmesi sıkı BAĞLAMAK
- Lamellipodial aktin polimerizasyon hızı belirlemek için EGFP öğesini β-aktin, hücrelerle B16-F1 transfect ve photobleach lamellipodial bölgesi (Adım 5,9) kullanarak 1,5 s zaman aralığı ve 500 ms GFP pozlama.
- Değişebilen, Visiview alınan hızlandırılmış film açın ve piksel/µm oranı hedefi tarafından kullanılan göre kalibre "ölçü | Mesafeler kalibre"aracı.
- Hızlandırılmış filmin gösterilmesini ve geriye doğru bir çizgi olarak lamel doğru akar, lamellipodial floresan kurtarma lamel ulaştı ve arkadaki akışı daha fazla izlenebilir karede durdur.
- µM lamellipodium ucu ve kurtarılan Floresans arkası arasındaki mesafe ölçmek. Bu mesafe retrograd akışı ve çıkıntı mesafeleri toplamı karşılık gelir.
- Alternatif olarak, çıkıntı retrograd akıştan ayırmak için bir satırı bir kare photobleaching önce lamellipodial ucuyla işaretleyin. Yolun bir referans olarak işaret lamellipodium ucunu ilk yerine photobleaching anda başvurmak için izleyen çerçeveler içinde kullanımı; referans noktası çıkıntı mesafe ve retrograd akışı ölçmek için kullanılabilir.
- Floresans kurtarma için photobleaching sonra gerçekleşmesi için gereken süreyi (saniye cinsinden) unutmayın. El ile belgili tanımlık çerçevelemek oran hesaplanan veya değişebilen tarafından görüntülenmiştir zaman "ölçü | Bölge ölçümleri"aracı.
- Aktin polimerizasyon hızı (ile değişebilen ölçümleri adımlardan 8,4 ve 8.6 dayanarak bazı denklem parametre) aşağıdaki denklemi kullanarak elde:
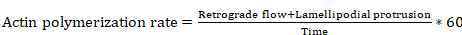 Denklem 6
Denklem 6
nerede aktin polimerizasyon hızı µm/min, retrograd akışı mesafedir µm içinde lamellipodial çıkıntı uzaklıkta olan µm ise zaman saniye içinde.
9. Protein Difüzyon ve hareketlilik üzerine Photoactivation analizi
Not: Burada sunulan yöntem görselleştirme ve miktar protein Difüzyon yoluyla sitozol tarafından gösterildiği gibi aktin PA-GFP için erimiş photoactivation istihdam ederek aktin monomer hareketlilik analizini açıklar.
- Photoactivatable aktin birikimi lamellipodial bölge içinde yanı sıra sitozolik bir bölge uzak Difüzyon ölçmek için değişebilen yoğunluğu zaman içinde aşağıdaki bölgelerde belirlemek için kullanın ( şekil 3' teresimli bir ): bir sitozolik photoactivated bölgesi (PA); hangi photoactivated proteinler (Lam); zamanla birikir beklenir bir lamellipodial bölge arka plan floresan (OUT) normalleştirme için kullanılan hücre dışında bir bölge.
- Aktin sitozol içinde hareketliliğini belirlerken, farklı sitozolik bölgeleri (bkz şekil 3bir, bölgeler R1-R5) ölçmek. Not photobleaching edinme sıkı BAĞLAMAK, benzer bir şekilde odak - ve sonunda hücre çapında Floresans etkinleştirme üzerine bir artış nedeniyle tespit edilemez.
- Yoğunluk değerleri tüm bölgeler için değişebilen 7,4 adımda anlatıldığı gibi bir Excel elektronik tablosuna transfer.
- Photoactivatable aktin photoactivation sitozolik bölge veya bir lamellipodial bölgesi (her ikisi de 0 zamanında sitozolik photoactivated bölge yüzde yoğunluğu temsil edilen) içinde birleşme hızını kendi uzak deplasman oranı incelenmesi için , Floresans eğrileri adım 9,3 verilerde oluşturmak. Aşağıdaki denklemler uygulanır:
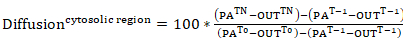 Denklem 7
Denklem 7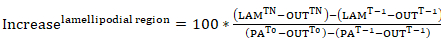 Denklem 8
Denklem 8
nerede: PATn olduğunu sitozolik photoactivated bölge photoactivation; aşağıdaki ilgi her çerçeve için yoğunluğu LAMTn photoactivation takip ilgi her çerçeve için bir lamellipodial bölge yoğunluğu olduğunu; Tn photoactivation dışında ilgi her çerçeve için hücre (arka plan) alınan bir bölge yoğunluğunu takip ediyor; PAT-1 photoactivation önce sitozolik photoactivated bölge yoğunluğu olduğunu; LAMT-1 photoactivation önce lamellipodial bölge yoğunluğu olduğunu; T-1 photoactivation önce (arka plan) hücre dışında alınan bir bölge yoğunluğu olduğunu; PAT0 sitozolik photoactivated bölge yoğunluğu 0 (Yani, ilk kare photoactivation sonra); zamanında olduğunu. veT0 (arka plan) hücre dışında alınan bir bölge yoğunluğu zaman 0 (Yani, photoactivation sonra ilk çerçeve). - İsteğe bağlı olarak, verileri daha iyi görselleştirme için photoactivation sonraki her çerçeveden sonra ilk kare yoğunluğunu çıkararak yoğunluğu eğrileri 0 normalleştirmek.
Not: Aşağıdaki analizi yöntemi (adım 9,6-9,8) ayrıca photoactivated aktin sitozol içinde sitozolik dağılım hesaplama sağlar. - Yoğunluklarda birbiri ardına klemple harekete geçirmek bölgesinden konumlandırılmış sitozolik bölgeler için ölçmek.
- Bu bölgeler yoğunluklarını photoactivated bölge yüzde yoğunluğu 0 zamanında temsil etmek için Denklem 8nerede lamellipodial yoğunluklarda sitozolik her yatırım Getirisi için yoğunluklarda ile değiştirilir, uygulamak. Bölgeler sayısı ve boyutu ölçülecek hücre boyutu ve dağılma mesafe bağlı olarak değişebilir.
- Sitozolik her bölgeye infiltre photoactivated protein oranı için ölçülebilir değeri türetmek, Sigma Arsa (Bölüm 7 sıkı BAĞLAMAK analize benzer) Zaman ve değerleri floresan yoğunluğu artış her bölge için eğrinin yapıştırın, kullanmak için Denklem 2 ve yarı zamanlı bir plato ulaşan Floresans yoğunluk türetmek için Denklem 4 . T1/2 değerleri farklı deneysel gruplar arasında karşılaştırın.
Sonuçlar
Şekil 1 g h faz kontrast görüntüleri önceden NIH3T3 fibroblast hücre ve bir küçük Rho-aile GTPazlar lamellipodia oluşumu karmaşık dalga ile etkileşimi yoluyla ikna yeteneğine sahip olan Rac1, 10 dk sonrası mikroenjeksiyon gösterir. Hücre ilk onun canlılığı ve Morfoloji, Örneğin, lamellipodia eksikliği onaylamak için mikroenjeksiyon (şekil 1g), daha önce görüntülenir. 10 dk sonrası mikroenjeksiyon, hücre açıkça bu tedaviden beklenen ve başarılı enjeksiyon (şekil 1h) gösterir morfolojisi, değişti.
Basitlik ve netlik için biz sonraki değil Ayrıca microinjected hücre analizi sıkı BAĞLAMAK ve photoactivation örnek sonuçları sağlar.
EGFP öğesini VASP lamellipodium ucundaki ciro analizi Şekil 2a-fiçinde gösterilir. VASP Ayrıca doğmakta olan ve odak yapışıklıklar, hücre iç18,19küçük ve uzatılmış noktalar hedefleyen unutmayın. Lamellipodial bölge, ucu açık bir VASP birikmesi ile floresan yoğunluğu ağartılmış ve öncesinde, sırasında ve lamellipodium ileri çıkıntı olarak beyazlatma sonra YG kontur takip ederek her zaman dilimi için ölçülen. Ağartılmış EGFP-VASP proteinler Kastarlamasız molekülleri bu sitelerdeki tarafından dönüştürülüyor gibi Floresans kademeli kurtarma (Şekil 2b) görülmektedir. Bu şekilde elde edilen ve (1 ifade edilir) öncesi çamaşır suyu yoğunluğu için normalleştirilmiş sıkı BAĞLAMAK kurtarma eğrisi Şekil 2cgörülebilir. Photobleaching verimliliği değişebilir ve değeri yaklaşık % 20, t0 değerinden belirlenen bu örnekte, beyazlatma daha önce yapıldı (photobleaching sonra ilk kare). Floresans artış ağartma önce Floresans kabaca % 80 gösterilen örnek bir plato ulaşır. Kurtarma hareketsiz kesir (Eğer, Şekil 2 ' deki kırmızı ok olarak tanımlandıktan sonra bir statik yapısı gibi Fokal adezyon deney saat süresince ön çamaşır suyu yoğunluğu ve Plato Floresans arasındaki farkı ulaştı c, e), Floresans miktarı arasında ağartma ve tam kurtarma zaman kurtarıldı, ancak olarak tanımlanır mobil kesir (yeşil çift başlı ok Şekil 2c, e). EGFP-VASP yoğunluğu buna bağlı Bilindiği gibi burada analiz lamellipodium ucu gibi bir dinamik olarak değişen yapısı, IF ölçüde sadece hareketsiz molekülleri temsil, ancak Ayrıca çıkıntı hızında azalma türetme yapıp yapmayacağınızı unutmayın parametre18. Yarı kurtarma hesaplamak için uygun bir eğri Sigma Arsa (Şekil 2d) üzerinde oluşturuldu. Bu durumda, Denklem 2 çözme çıkarılan "b" parametresinin değeri eşittir 0.0754 için hangi ne zaman Logaritmik fonksiyonu (Denklem 4) tahmini bir yarı-zamanlı sonuçlarını 9,19 kurtarılması uygulanan s (Şekil 2d , sağ paneli), hangi nispeten hızlı bu hücredeki belirli ortalama ile karşılaştırıldığında daha önce5yayımlanır. Kurtarma yarı-kez bazen önemli ölçüde hücre hücre aynı nüfus içinde değişebileceğini belirtmek gerekir. Bu nedenle, temsilci sonuçları elde etmek için en az 15-20 hücrelerden ortalama olarak bu parametre belirleme öneririz. Derece sapma aritmetik ortalamaları EGFP-VASP kurtarma için 15 hücrelerden ortalama olarak göstermek için her zaman-nokta vardı oluşturulan (Şekil 2e) ve oluşturulan ve benzer bir şekilde (Şekil 2 görüntülenen ortalama eğrisi uyuyor f).
Polimerizasyon hızı lamellipodial aktin ağının ileriye doğru ağ çıkıntı ve retrograd akışı toplamı oluşmaktadır. Sıkı BAĞLAMAK aktin polimerizasyon hızı EGFP öğesini β-aktin ve photobleaching çıkıntılı bir lamellipodial bölgesi (Şekil 2g) ile (Bu durumda B16-F1) transfecting hücreleri tarafından ölçmek için uygulanır. Lamellipodial aktin ağ polimerizasyon analiz için EGFP öğesini β-aktin ağartma üzerine Floresans kurtarma zaman içinde değerlendirilir. Aktin monomerleri ilerler (tüm hangi doğru açık20nokta) lamellipodial aktin filamentleri dikenli ucunda polimerizasyon ağ sürekli translocated rearwards ve ileri, ilerliyor hangi oranda kolayca olabilir mi Floresan photobleaching üzerine polarize kurtarılması sırasında elde edilen. En kısa zamanda ağartılmış bölge lamellipodium arka kısmı ve alt yoğunluğu daha fazla yatay düzenlenmiş filaman demetleri tarafından karakterize lamel arasındaki geçiş bölgesi ulaştı lamellipodium floresan Kurtarma tamamlandıktan Ne lamellipodium görülmektedir göre çok daha yavaş teslim. Şekil 2giçinde gösterildiği, Floresans kurtarma kenarı ve geriye doğru çıkıntı ve retrograd akışının (ayrı ayrı temsil edilen mesafeler ölçüm sağlar lamel doğru akan yatay bir çizgi olarak görüntülenmeyecektir Şekil 2g portakal ve kırmızı çift başlı ok olarak sağ panelinde sırasıyla).
Biz de photoactivation aktin monomerleri sitozol içinde hareketliliğini ve lamellipodia çıkıntılı içinde onların birleşme oranı izlemek için PA-GFP-aktin ile transfected B16-F1 hücrelerdeki başvurdum. Şekil 3a, bgösterildiği, sitozolik bir bölge 405 nm lazere maruz photoactivated, görüntüleri üzerinde GFP elde iken her 1.5 kanal s photoactivated aktin GFP Tagged with, dağıtım görüntülenmesi için. Photoactivated GFP-aktin şekil 3bsitozolik bölgede dışarı Difüzyon görülebilir. Floresan yoğunluğu photoactivated sitozolik bölge azalma oranı t0 ilk yoğunlukta yüzdesi olarak gösterilir (ilk çerçeve photoactivation sonra; Şekil 3 c). Photoactivated aktin aynı zamanda entegre lamellipodia, nerede yeni aktin monomerleri aktin filamentleri çıkıntı sırasında elongating büyüyen dikenli uçlarına eklenir ucunda. Lamellipodial birleşme oranını tahmin etmek için iki boyutlu bir kontur/bölgenin yaklaşık 5 mikron genişliği ve yüksekliği 1 µm zamanla floresan yoğunluğu şiddetindeydi; Bölge lamellipodium fırlamıştı olarak ipucu, sürekli yeniden konumlandırılmış. Aktin birleşme floresan yoğunluğu, t0 photoactivated sitozolik bölgesinin yüzdesi olarak temsil edilen (şekil 3d). Aktin filamentleri uzama ilerledikçe yeni aktin monomer lamellipodial ön tarafta dahil edilmiştir. Bu aktin monomerleri bir kısmını stochastically monomer photoactivated neredeydin sitozolik havuzdan elde edildi. Floresan lamellipodia ilk 20 içinde hızlı artış sonuçlanır s photoactivation sonra. Gibi yeni monomer lamellipodial ön, daha önce eklenen aktin monomerleri akışına filamentler lamel doğru retrograd akımını eklenmektedir. Zaman içinde yatırım Getirisini tamamen floresan monomerleri ile doldurulur ve floresan bir plato (şekil 3d) ulaşılır. Floresans kademeli bir düşüş sonra Difüzyon photoactivated monomerleri hücre boyunca ve takip zaman görülmektedir, photoactivated aktin monomerleri giderek lamellipodial önüne yeniden eklenmektedir. Bu azalma Floresans hücrenin tamamını photoactivated ve sigara photoactivated monomerleri arasında bir denge (veri gösterilmez) ulaşıldığında en kısa zamanda ulaşmak mümkün bir yeni Platosu, bulacaksınız.
Aktin monomerleri sitozol boyunca hareketliliğini Floresans yoğunluklarda klemple ( şekil 3bir renk kodlu bölgelerde etiketli tarafından üzerinde örneği photoactivated bölgesinden konumlandırılmış eşit büyüklükte bölgelerde ölçerek elde edildi R1-R5). Şekil 3egösterildiği, floresan yoğunluğu her bu bölgede uzak yavaş yavaş azalıyor cytosolically photoactivated bölgesi, photoactivated aktin monomerleri kesir olarak olur giderek seyreltilmiş ile aktif olmayan (Yani, sigara floresan) monomerleri. Ayrıca, daha sonra Floresans zirvesine ulaştı: daha uzak ölçülen photoactivated bölgesinden gelen bu bölgelere yaygın aktin monomer için gerekli uzun zaman bulunduğu bölgedir. Her bölge içine aktin monomer infiltrasyon derecesi için temsil edici bir değer yarı Floresans Yaylası ulaşma miktarının tarafından elde edilebilir. Daha uzak bölge, uzun içine yaygın photoactivated aktin geçen ve böylece daha fazla zaman sonuçta daha yüksek bir t1/2 değeri (şekil 3e) önde gelen ulaşmak, floresan Yaylası için gereklidir.

Resim 1 : Odası derleme ve mikroenjeksiyon yordamı Imaging. (bir) görüntüleme odası bileşenleri. (b) silikon gres dikkatle plastik mühürleyen açılış etrafında sürülür. (c) coverslip hücre-yüzü yukarı bakacak şekilde açılış görüntüleme odasının ortasına yerleştirilir. (d) güvenli bir mühür coverslip üstüne plastik mühürleyen konumlandırma ve yan kelepçeler sıkma belirlenir. (e) mikroskopi orta odası yuvasına pipetted. (f) görüntüleme odası mikroskop Sahne Alanı'nda yer alıyor, sıcaklık dedektörü ve elektrotlar 37 ° C için önceden ayarlanmış bir Isıtma birimine bağlı ve hücreleri mikroskobu başlatılan önce en az 30 dk için adapte izin verilir. Bu örnekte, mikroskop sahne microinjections gerçekleştirmek için bir micromanipulator ile de donatılmıştır ve mikroenjeksiyon iğne hücre katmanı görüntüleme odasında kapsayan orta içine daldırma. (g) bir NIH3T3 fibroblast hücre mikroenjeksiyon önce faz kontrast mikroskobu tarafından görüntülenmiştir. Kızıl Haç perinükleer yerde hantal çekirdeği yakınlığı nedeniyle yüksek bir sitoplazmik bölgesine karşılık gelen gelecekteki mikroenjeksiyon konumunu gösterir. (h) 10 dk takip mikroenjeksiyon ile Rac1 hücre lamellipodia (yeşil oklarla gösterilen) tüm hücre çevre etrafında belirgin oluşumu tarafından tepki verir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Resim 2: Sıkı BAĞLAMAK sağlar protein ciro veya lamellipodial aktin polimerizasyon oranlarının belirlenmesi. (bir) temsilcisi örnek B16-F1 hücre EGFP-VASP lamellipodial bölgesinin photobleaching daha önce belirtildiği gibi ifade etme. Farklı renkli kontür/şekiller hangi bölgelerine Floresans yoğunluk ölçümleri için zaman içinde kabul edildi belirtmek için etiketlenir. Not kırmızı kontur çoklu veziküller ve hücre yüzey katlar içeren bir alanda yer alan bir sitozolik bölgesi etiketleri bir ünlem işareti ile işaretlenmiş. Floresan, potansiyel olarak yanlış sonuçlara neden güçlü kısa süreli dalgalanmalar tarafından karakterize edilmektedir Bu gibi dinamik alanlarda Floresans başvuru, bölgelerinde seçmek için kaçınılmalıdır. EGFP-VASP ifade hücre önce ve photobleaching sonra (b) Lamellipodial bölgesi. Photobleaching mor olarak işaretlenmiş bölge zaman içinde görüntülenir sonra floresan sinyal kurtarma. Ok gösterir VASP için büyük olasılıkla aktin filamentleri yüksek yoğunluk nedeniyle zenginleştirilmiş bir microspike ucu polymerizing orada19. b kırmızı photobleached lamellipodium (mor kontur) floresan yoğunluğu miktarının (c) bir sıkı BAĞLAMAK örneği kurtarma eğri olarak türetilen ve sağdaki yeşil çizgiler, sırasıyla, hareketsiz ve mobil kesirler gösterir. (d) A sıkı BAĞLAMAK kurtarma eğri c (sol paneli) ve kurtarma yarım saat (doğru kapı aynası) türetmek için kullanılan hesaplama yöntemi örneği uygun. (e) bir sıkı BAĞLAMAK kurtarma örneği eğrisi SEM çubuklarla örnek nüfus içinde arasındaki değişkenlik derecesini gösteren Floresans kurtarma eğrileri 15 hücrelerin ortalama türetilmiş. (f) bir eğri uyum sıkı BAĞLAMAK kurtarma eğrisi uyan 15 hücrelerin (sol paneli) ve kurtarma yarım saat (doğru kapı aynası) türetmek için kullanılan hesaplama yöntemi örneği ortalama türetilmiş. lamellipodium önce ve sonra bir lamellipodial bölgesinin beyazlatma belirtildiği gibi Floresans kurtarma lamellipodium içinde zamanla ardından EGFP öğesini β-aktin ifade B16-F1 hücrenin çıkıntılı, hızlandırılmış panelleri (g). Sağ panelde değerleri ölçülen için çıkıntı ve retrograd mesafeler sağlanmaktadır (turuncu ve kırmızı, sırasıyla). Hesaplamalar görüntü panelleri altında ortaya çıkarmak nasıl çıkıntı ve retrograd mesafeleri toplamı polimerizasyon hızı lamellipodial aktin ağının türetmek için kullanılır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
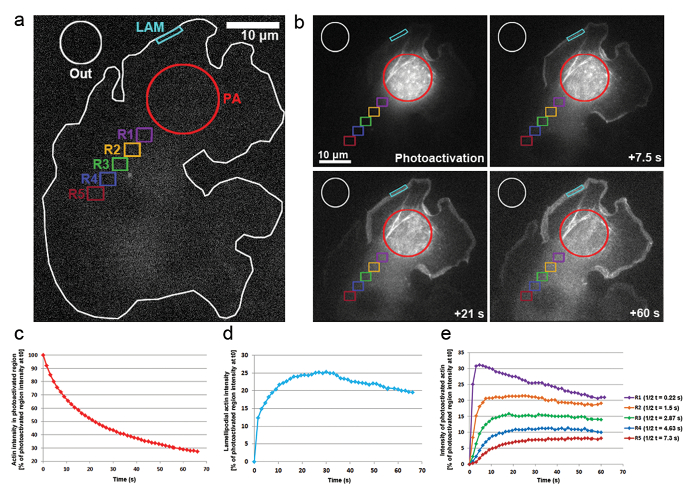
Şekil 3: PA-GFP-aktin hücre izleme monomer için Photoactivation. (bir) A temsilcisi örnek PA-GFP-aktin photoactivation sitozolik bölge kırmızı daire (PA) tarafından belirtildiği şekilde uyarının harekete geçirilmesine karşılık önce ifade B16-F1 hücre. Farklı renkli kontür hangi bölgelerine Floresans yoğunluk ölçümleri için zaman içinde kabul edildi belirtmek için etiketlenir. (b) zamansal dağıtım PA-GFP-aktin uyamayan bir örnek photoactivation. Photoactivated aktin ondan dağılır floresan photoactivated, sitozolik bölge (kırmızı daire), içinde yavaş yavaş azalma not edin. Açık ve ağ derlemeye kendi Difüzyon nedeniyle photoactivated aktin monomerleri yavaş yavaş lamellipodia (camgöbeği bölgesi) ve bir mesafe ve zaman bağımlı moda sitozol (farklı renk kodlu bölgelerde) boyunca geliştirilmiştir. Floresan photoactivated sitozolik bölgedeki (kırmızı kontur b) (c) temsilcisi, zamansal düşüş. lamellipodial bölge (camgöbeği kontur b) floresan yoğunluğu (d) Temporal değişiklikler. (e) eğrileri floresan yoğunluğu nedeniyle photoactivation alanından değişken mesafelerde konumlandırma sitozolik bölgeler (b renk kodlu) zamansal değişimler temsilcisi. Nasıl floresan ulaşma yarı-kez Plato Not (sağdaki göstergede gösterilen) ile uzaklığı artırmak photoactivation alanına bölge göz önüne alındığında büyük olasılıkla artış ile korele aktin monomerleri Difüzyon için gerekli kez ilgili bölge. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tartışmalar
Burada bu makale ve nasıl onlar farklı deneysel koşullarda uygulama için optimize açıklanan teknikleri kritik adımları tartışmak.
Mikroenjeksiyon hücrelerde tanıtan eksojen proteinler, inhibitörleri veya uyuşturucu üzerinden anlık etkilerini izlemek için uygulanan bir yöntemdir. Proteinler arasında zor işlevlerini belirlemek için özellikle yararlı olabilir hücre tipleri transfect için ya da uzun vadeli ifade değil istendiğinde durumlarda. Hayatta kalma belirli hücre tiplerinin üzerinde seribaşı hücre dışı matriks bağlı olarak değişir dikkat edilmelidir. En endotel, epitelyal veya fibroblast benzeri hücre tipleri, hatta küçük olanlar (bkz: Dang vd. balık keratocytes gibi. 21 ve Anderson ve çapraz22) başarılı bir şekilde enjekte edilebilir. Ancak, hücre göç bir mükemmel model sistemi oluşturur, ancak bilinmeyen bir nedenle bu tür terkedilemeyen bir enjeksiyon ile uyumsuz laminin üzerinde seribaşı B16-F1 hücreleri gibi özel durumları vardır. NIH3T3 fibroblast hücreler için düzenli olarak enjeksiyonları fibronektin terkedilemeyen ve ek photomanipulation teknikleri sıkı BAĞLAMAK (hatta photoactivation ile; B16-F1 hücrelerin burada gösterilen) gibi eşit derecede iyi bu fibroblastlar (bkz: gerçekleştirilebilir gerçekleştiriyoruz Örneğin, Köstler vd. 3). aynı zamanda işlevsel özellikleri ve deney hedeflerine göre farklı proteinler zaman saniye arasında değişen saat için değişiklikler neden farklı miktarda sürebilir kabul gerekir. Bir teknik eksojen Ajan dozaj/konsantrasyonu daha doğru daha örneğin, tek hücre düzeyinde plazmid transfection kullanırken denetlenebilir avantajdır. Buna ek olarak, bir protein flüoresan etiketleme eşzamanlı çok kanallı görselleştirme fluorescently öğesini diğer proteinlerin gerekliyse esneklik artırabilir hücrenin varlığını güvence altına almak için bir zorunluluk değil. Mikroenjeksiyon anlık etkileri spesifik proteinlerin veya protein karışımları hücre morfolojisi veya (Örneğin, Dang ve ark. sitoiskeleti dinamik değişiklikler üzerinde analiz etmek için özellikle yararlı olabilir 21 Arp2/3 karmaşık inhibitörü Arpin tarafından geçiş anında efektleri bir örneğin). Teknik hücre hasarı çıkarabilir veya hücre morfolojisi etkilemek onun invasiveness dezavantajdır. Bu nedenle, önemli bir göz microinjections işlemi sırasında hücre canlılığı izlemektedir. Burada tanıtılan yöntem üzerinde el ile işleme dayanıyor. Fibroblastlar fibronektin terkedilemeyen üzerinde büyüyen gibi başarılı enjeksiyonları ile uyumlu olacak şekilde test koşullarında bir çevre % 100 başarı oranı burada açıklanan el ile enjeksiyon Protokolü sağlar; Bu yaklaşım video mikroskobu veya sıkı BAĞLAMAK, daha önce yayımlanmış3olarak da dahil olmak üzere karmaşık ve zaman alıcı izleme denemeleri ile birleştirirken esastır. Bu arada sırada dışlamaz, tek tek hücreler güvenli bir şekilde ani değişiklikler, kontrast çekirdeği ve sitoplazma hücre kenar retraksiyon tarafından takip, kabul edilebilir bir mikroenjeksiyon olay muzdarip. Bu tür deneysel nadiren hariç ve böylece daha fazla analizler için kabul edilmez.
Ancak, bir yarı-otomatik yaklaşım da yaygın, örneğin hızlı istihdam kullanılır (< 300 ms) iğne sadece ilgili önce her hücrenin üstündeki konumlandırılmış olması böylece makine kontrollü iğne enjeksiyon basınç artışı ile çakışık düşürücü enjeksiyon. Tanımı sadece yukarıda açıklanan el ile bir yaklaşım daha alt tarafından yarı-otomatik enjeksiyon başarı oranı olduğunu hız için optimize edilmiştir çünkü başarıyla bu tedavi; hayatta birden çok hücre analizi tarafından takip Böylece tek bir hücre başarılı enjeksiyon dayanmaz. Bu nedenle, tek hücre analizi aksine, yarı-otomatik enjeksiyon daha birkaç yüz hücreleri, Örneğin, video mikroskobu düşük büyütmede veya hücre fiksasyon ve boyama üzerine tarafından enjeksiyon etkilerini çözümlemek için uygundur. İstihdam detaylı yaklaşım ne olursa olsun mikroenjeksiyon bir son nokta tahlil anlamına gelmez, ama teknikleri sıkı BAĞLAMAK veya photoactivation3de dahil olmak üzere, çeşitli ile kombine edilebilir.
Sıkı BAĞLAMAK tarafından protein Ciro oranı belirlerken, lazer yoğunluğunu, mikroskop kurulum ve görüntüleme koşullarına bağlı olarak optimize edilmiş olması gerekir (büyütme, hedefleri, vb, yanı sıra hücre tipi, yapısı ve floresan protein photobleaching). En iyi lazer güç, etkili beyazlatma ile en olası duyarlilik, büzülme önlemek veya geri çekme analizi (Örneğin, lamellipodia veya filopodia) veya hücresel düzeyde bile zarar altında yapısının tamamlamak için birleştirilmiştir olduğunu unutmayın. Tam beyazlatma göre hangi durumda, % 50 üstünde bir şey de kabul edilebilir olabilir protein, son derece hızlı cirosu engel, ancak ideal olarak, en az 70-%80 verimliliği ağartma, elde edilmelidir. En iyi beyazlatma güç verilen yapısı ve floresan boya için deneysel olarak test edilmelidir, bir düşük lazer güç başlayan tarafından aşamalı onun artış izledi. Tabii ki, herhangi bir floresan boya tanımı gereği ile lazer ışığı uyarma zirveye yakın ağartılmış (488 nm FITC veya EGFP gibi sık kullanılan yeşil boyalar için). Ancak, lazerler ile UV yakınındaki lazerler gibi daha kısa dalga boyları daha büyük güce teslim ve böylece aynı zamanda verimli yaygın olarak kullanılan Boyar maddeler beyazlatma için kullanılabilir. Biz rutin bir 405 nm diode lazer istihdam (120 mW) (ikinci veri gösterilmez) halinde de olsa biraz daha düşük verimlilik ile EGFP ve kırmızı floresan boyalar (örneğin mCherry), beyazlatma için. 405 nm diyot PA-GFP (aşağıya bakın) photoactivation için de kullanılabilir gibi maksimum esneklik ile bu sistem endows.
B16-F1 hücre yapıları ve floresan proteinler photobleached burada için 65-100 mW arasındaki 405 nm lazer güçler uygulandı. Photobleached bölge analiz ederken verilen yapı özgün şekli zaman dilimi üzerinde analiz korunup korunmayacağını dikkate almak önemlidir. Lamellipodia eğimi önemli ölçüde zaman içinde değişmiş olup olmadığını analiz bölgesi/kontur yoksa eğriliği değişimler yanlış sonuçlara neden Örneğin, ciro lamellipodia ucunda proteinlerin analiz ederken bakım alınmalıdır tam olarak ölçülen her çerçeve yapısında tamamını kapsayacak. Buna ek olarak, lamellipodia, microspikes gibi içine gömülü demetleri floresan yoğunluğu sapmalar neden olabilir unutulmamalıdır. Şekil 2b (9 s süre içinde beyaz ok) gösterildiği gibi microspike benzeri yapıda ölçülen photobleached bölgesi yanındaki yer almaktadır ama kişiliğiniz dışarıdaki kişiliğinizden ölçüm süresi kalır ve böylece herhangi bir neden olmaz yanlışlık. Protein ciro analizi için onların Floresans zaman içinde önemli ölçüde hücre morfolojisi veya faktörler değişiklikleri diğer--dan sert önlemek için akıttıkları ki konumunu ve boyutunu seçme bölgeleri analiz zaman önemli konusu önem taşır satın alma photobleaching. Örneğin, çözümlenen yapısı önemli kantitatif katkı sağlayan yapıları çözümlemesi sırasında dışarı ölçülen bölge taşımamalısınız; Ayrıca, ilgisiz, floresan varlıklar protein çekmek veziküler yapıları gibi ilgilendiğiniz alanı Çözümleme sırasında girmeniz gerekir değil. Bu güçlü sonuçlarının doğruluğunu etkileyecek gibi lamellipodial aktin polimerizasyon hızı belirlemek için hiçbir geri veya karıştırmaktan (yukarı katlanırYani ) lamellipodia olduğunu analiz, özen gösterilmelidir. Buna ek olarak, lamellipodial bölgelerin retraksiyon hızlı arkadaki translocation görünebilir potansiyel olarak lamellipodial aktin polimerizasyon oranları tahmindi için lider. Bir ek dikkate (edinme photobleaching düzeltilmesi için başvuru pozisyon olarak alınan) hücre içi normalleştirme bölgeler photobleaching, gerçek konumdan hangi-meli var olmak doğrudan önlemek için büyük mesafesindedir photobleached alanına göre etkiler.
PA GFP öğesini yapıları photoactivation için optimal koşullar kadar ayarlarken, anlık photoactivation sırasında ağartma önlemek için özen gösterilmelidir. Çalışmamızda, lazer güçlerle en iyi sonuçlar elde 5 - 10 kat daha normalde EGFP beyazlatma için istihdam düşük. İçin resim alma photoactivated moleküllerin çekim hızı ve çerçeveler arasındaki zaman aralığını olmalı bölgeler ve photoactivated olmak için yapıları boyutunu göz önünde bulundurarak en iyi duruma getirilmiş ve analiz, photoactivated potansiyel hareketliliğini yanı sıra proteinler hücre altı başka konumlara. Floresans görüntüleme her türlü gelince, bakım hücre canlılık fizyolojik alakalı sonuçları elde etmek için önemlidir.
Prensip olarak, yeşil kırmızı photoconversion mEos veya Dronpa modelleri12 gibi floresan proteinlerin eşit derecede güçlü bir yöntem aşağıdaki dinamikler ve ciro lamellipodium gibi hücre altı yapıları kabul ettiğiniz anlamına gelir ( Örneğin, bkz: Burnette vd. 23). PA-GFP aksine ikinci yöntemin avantajı önce ve sonra dönüştürme, ortak bir ek kırmızı floresan protein hızlı gerek kalmadan iki ayrı renk ile protein dynamics takip imkanı olacaktır. Ancak, bizim ön deneyler, kontrast değişim ölçüde ve PA-GFP photoactivation elde floresan sinyal şiddeti belki yeşil kırmızı karşı üstün spektral özellikleri nedeniyle photoconverted probları ile karşılaştırıldığında daha büyük Floresan problar (veri gösterilmez). Her durumda, aktin filaman devir oranı, lamellipodia veya vaksinia virüs kaynaklı aktin kuyrukları gibi hücre kenar çıkıntılar ayrıntılı çalışmalar defa sadece PA-GFP türevleri5,6,24kullanarak yayınlanmıştır.
Photoactivation analiz etmek için hangi hücre bölge dikkate alınarak, çeşitli faktörler dikkate, hangi (aktin monomerleri sitozol etkinleştirme üzerine cep kenarında birleşme), burada gösterilen belirli örnekte kullanarak ele alınmıştır alınması gereken ama Kesinlikle benzer çeşitli bilimsel sorunlara yaygınlaştırılması. İlk olarak, ne zaman cytosolically photoactivated proteinler, örneğin, lamellipodial birleşme oranı ayrı deneysel koşullarda (Dimchev ve ark. içinde gösterildiği gibi ölçülür 6), sitozolik bölgeler ve uzaklıkları lamellipodial kenarlarına boyutları deneysel grupları arasında yakın olabilir. Photoactivating sitozolik bölgeler, hücre kalınlığı çekirdeğine yakın konumlarda büyük olduğunda bu dikkate almak önemlidir. Verilen bu proteinin aktif olması için dağıtım rastlanılmaması sitozol içinde dağıtılır daha kalın hücresel bölgeler aktive aktive protein, yüksek miktarda neden olabilir. Son olarak, ifade düzeyleri proteinin aktif olması için kesinlikle tek tek hücreleri son derece değişken olabilir. Konuları değişkenlik nedeniyle birleşme seviyeleri hücre etkinleştirme belirli bölgelerde üzerine elde edilen toplam Floresans göre başka bir yerindeki cytosolically aktif proteinlerin karşılaştırmak önemlidir.
Biz nasıl mikroenjeksiyon proteinler hücre morfolojisi üzerindeki etkilerini araştıran için bir araç olarak kullanılabilir ve bu güçlü indüksiyon fibroblast hücreleri microinjected ile NIH3T3 lamellipodial yapıların göstererek örneği tarif var küçük GTPazlar Rac1. Hücrelerdeki yara/WAVE3C-terminal WCA etki alanı ile microinjected Arp2/3 fonksiyonlu müdahale için bu tekniği daha önce başvurdum. Microinjected hücrelerdeki çeşitli parametreler sıkı BAĞLAMAK veya photoactivation gibi diğer deneyleri tarafından çözümlenebilir. Nasıl sıkı BAĞLAMAK ve photoactivation hücre altı dinamikleri ve aktin monomerleri hareketliliğini soruşturma için istihdam edilebilir anlatmıştık. Sıkı BAĞLAMAK grubumuz tarafından kullanılan gibi VASP, Abi, cortactin, cofilin, lamellipodia için yerelleştirme ve protein kapatma proteinlerin veya Fokal yapışıklıklar huzurunda bileşenlerinde ciro elucidating için ciro araştırmak için daha önce5 ve4sinyal Rac yokluğu. Ayrıca, aktin polimerizasyon oranları ölçme photobleaching EGFP öğesini β-aktin5tarafından yapılabilir ama alternatif yöntemler adlı biri yok. Lifeact25gibi hücresel aktin filamentleri etiketleme canlı hücre görüntüleme uyumlu probları tarafından görüldüğü gibi floresan inhomogeneities izlemek de istihdam6,26olabilir. Burada β-aktin overexpression, hangi artan hücre kenar çıkıntı ve geçiş yapabilir ve böylece potansiyel olarak özel tahlil veya deneysel soru ile müdahale önlenebilir olduğunu avantajdır (bkz: Örneğin, Kage vd. 26; Peckham vd. 27). Lifeact hücrelerdeki tarafından etiketli aktin filaman yapıların ağartma bilgiler sadece sonda ciro, böylece Ancak, Lifeact sonda ayrı bir dezavantajı onun hızlı açık/kapalı Kinetik aktin filamentleri için Binding kabul ettiğiniz anlamına gelir değil için bu25bağlar aktin filamentleri ciro ama. Floresan inhomogeneities izleme önce6,istihdam26 pratik bir uzlaşma sağlamak, Floresans speckles yaygın olarak kullanılan izleme çok benzer ipliksi içine hücre iskeleti dahil (bkz: Örneğin, somon ve Waterman28) yapıları, ama kullanmak için olabildiğince düz ön ve sıkı BAĞLAMAK EGFP öğesini F-aktin yapıları olarak kesin olmayabilir. Photoactivation tarafımızdan lamellipodia yanı sıra deneysel olarak ayarlanmış sitozolik F-aktin düzeyleri6bağlamında sitozol boyunca kabiliyeti çıkıntılı içine monomeric aktin birleşme oranlarının tahmin etmek için uygulanmıştır. Hareketlilik ve dağıtım proteinlerin incelenmesi sitozolik bölgeleri gibi nispeten geniş alanlardan elde edilen teknik yararlıdır. Ancak, dağıtım proteinlerin incelenmesi nispeten küçük photoactivated yapılardan türetilmiş; Örneğin, büyüme koniler aktif floresan moleküllerinin düşük sayılar, zayıf sinyaller ve duyarlılık eksikliği nedeniyle böylece zor olabilir. Photoactivation veya photoconversion floresan (yukarı bakın), potansiyel alternatif teknikleri ters photobleaching üzerinde uzak floresan moleküllerinin hareketliliği takip ederek takip yatırım Getirisi dışında tüm hücre dayanır sıkı BAĞLAMAK içerebilir Bu bölge. Teknik photoactivatable sürümleri proteinlerin overexpressing gerektirmez, ama her zaman potansiyel olarak istenmeyen yan etkileri duyarlilik gibi neden lazer gücünün normalden daha yüksek bir doza maruz içerecektir.
Açıkça, photoactivation ve sıkı BAĞLAMAK proteinler monomerleri, dimer veya hatta küçük reaksiyonlar hareket ediyor ve ek bağlama ortakları ile birlikte hareket ayırt edemez. Bu tür bilgileri yerine Floresans korelasyon spektroskopi teknikleri29 veya FLIM-perde30, alternatif olarak, elde edilebilir. Yine de, sıkı BAĞLAMAK ve photoactivation doğrudan yerel ve küresel protein dynamics hücrelerdeki protein faiz, hücre altı konumu veya okudu hücre tipi ne olursa olsun değerlendirmek için basit yaklaşım oluşturmaktadır.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Alman Araştırma Vakfı (DFG) için mali destek (grant Nr. RO2414/5-1 KR olarak) için sana şükrediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| B16-F1 mouse skin melanoma cells | American Type Culture Collection, Manassas, VA | CRL-6323 | |
| NIH-3T3 cells | American Type Culture Collection, Manassas, VA | CRL-1658 | |
| DMEM 4.5g/L glucose | Life Technologies, Thermno Fisher Scientific, Germany | 41965-039 | |
| Ham’s F-12 medium | Sigma-Aldrich | N8641 | |
| Fetal calf serum (FCS) | PAA Laboratories, Linz, Austria | A15-102 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich, Germany | F7524 | Lot054M3396 |
| MEM Non essential amino acids | Gibco, ThermoFisher Scientific, Germany | 11140035 | |
| L-Glumatine 200mM (100x) | Life Technolgies | 25030-024 | |
| Pen-Strep 5000 U/mL | Life technologies | 15070063 | |
| Sodium Pyruvate (100 mM) | Gibco, ThermoFisher Scientific, Germany | 11360-039 | |
| Laminin | Sigma-Aldrich | L-2020 | |
| Laminin coating buffer | Self-made: 50mM Tris ph7.4, 150mM NaCl | ||
| Fibronectin from human plasma | Roche Diagnostics, Mannheim, Germany | 11 051 407 001 | |
| Jetpei | Polyplus Transfection, Illkirch, France | 101-10N | |
| JetPei buffer | Polyplus Transfection, Illkirch, France | 702-50 | 150mM NaCl |
| PA-GFP-actin plasmid DNA | described in Koestler et al.2008 | ||
| pEGFP-actin plasmid DNA | Clontech, Mountain View, CA, USA | ||
| Rac1 protein for microinjection | Purified as GST-tagged version, and cleaved from GST prior to injection | ||
| Microinjection buffer | Self-made: 100mM NaCl, 50mM Tris-HCl ph7.5, 5mM MgCl2, 1mM DTT | ||
| Dextran, Texas Red, 70,000 MW, Lysine Fixable | Molecular Probes, Thermno Fisher Scientific, Germany | D1864 | |
| Microscope circular cover glasses 15mm, No.1 | Karl Hecht, Aisstent, Sondheim, Germany | 1001/15 | |
| Eppendorf Femtotips Microloader Tips | Eppendorf, Hamburg, Germany | 5242 956 003 | |
| Eppendorf Femtotip Microinjection Capillary Tips | Eppendorf, Hamburg, Germany | 930000035 | |
| Silicone Grease | ACC Silicones, Bridgewater, England | SGM494 | |
| Aluminium Open Diamond Bath Imaging Chamber | Warner instruments | RC-26 | |
| Automatic temperature controller | Warner Instruments | TC-324B | |
| Microscope: Axio Observer | Carl Zeiss, Jena, Germany | ||
| CoolSnap-HQ2 camera | Photometrics, Tucson, AZ | ||
| Lambda DG4 light source | Sutter Instrucment, Novato, CA | ||
| Laser source | Visitron Systems | ||
| Eppendorf FemtoJet microinjector | Eppendorf, Hamburg, Germany | With built-in compressor for pressure supply | |
| Nikon Narishige Micromanipulator system | Nikon Instruments, Japan | ||
| Visiview software v2.1.4 | Visitron Systems, Puchheim, Germany | ||
| Metamorph software v7.8.10 | Molecular Devices, Sunnyvale, CA | ||
| Sigma Plot v.12 | Systat Software Inc. |
Referanslar
- Day, R. N., Davidson, M. W. The fluorescent protein palette: tools for cellular imaging. Chem Soc Rev. 38 (10), 2887-2921 (2009).
- Ishikawa-Ankerhold, H. C., Ankerhold, R., Drummen, G. P. Advanced fluorescence microscopy techniques--FRAP, FLIP, FLAP, FRET and FLIM. Molecules. 17 (4), 4047-4132 (2012).
- Koestler, S. A., et al. Arp2/3 complex is essential for actin network treadmilling as well as for targeting of capping protein and cofilin. Mol Biol Cell. 24 (18), 2861-2875 (2013).
- Steffen, A., et al. Rac function is crucial for cell migration but is not required for spreading and focal adhesion formation. J Cell Sci. 126, Pt 20 4572-4588 (2013).
- Lai, F. P., et al. Arp2/3 complex interactions and actin network turnover in lamellipodia. EMBO J. 27 (7), 982-992 (2008).
- Dimchev, G., et al. Efficiency of lamellipodia protrusion is determined by the extent of cytosolic actin assembly. Mol Biol Cell. 28 (10), 1311-1325 (2017).
- Koppel, D. E., Axelrod, D., Schlessinger, J., Elson, E. L., Webb, W. W. Dynamics of fluorescence marker concentration as a probe of mobility. Biophys J. 16 (11), 1315-1329 (1976).
- Patterson, G. H., Lippincott-Schwartz, J. A photoactivatable GFP for selective photolabeling of proteins and cells. Science. 297 (5588), 1873-1877 (2002).
- McKinney, S. A., Murphy, C. S., Hazelwood, K. L., Davidson, M. W., Looger, L. L. A bright and photostable photoconvertible fluorescent protein. Nat Methods. 6 (2), 131-133 (2009).
- Gurskaya, N. G., et al. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nat Biotechnol. 24 (4), 461-465 (2006).
- Lippincott-Schwartz, J., Patterson, G. H. Photoactivatable fluorescent proteins for diffraction-limited and super-resolution imaging. Trends Cell Biol. 19 (11), 555-565 (2009).
- Kremers, G. J., Piston, D. Photoconversion of purified fluorescent proteins and dual-probe optical highlighting in live cells. J Vis Exp. (40), (2010).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. CSH Protoc. 2008, 4988(2008).
- Small, J. V., Rottner, K. Actin-based Motility. Carlier, M. F. , Springer. Dordrecht. (2010).
- Kaverina, I., et al. Enforced polarisation and locomotion of fibroblasts lacking microtubules. Curr Biol. 10 (12), 739-742 (2000).
- Small, J., Rottner, K., Hahne, P., Anderson, K. I. Visualising the actin cytoskeleton. Microsc Res Tech. 47 (1), 3-17 (1999).
- Mikhailov, A. V., Gundersen, G. G. Centripetal transport of microtubules in motile cells. Cell Motil Cytoskeleton. 32 (3), 173-186 (1995).
- Rottner, K., Behrendt, B., Small, J. V., Wehland, J. VASP dynamics during lamellipodia protrusion. Nat Cell Biol. 1 (5), 321-322 (1999).
- Svitkina, T. M., et al. Mechanism of filopodia initiation by reorganization of a dendritic network. J Cell Biol. 160 (3), 409-421 (2003).
- Small, J. V., Isenberg, G., Celis, J. E. Polarity of actin at the leading edge of cultured cells. Nature. 272 (5654), 638-639 (1978).
- Dang, I., et al. Inhibitory signalling to the Arp2/3 complex steers cell migration. Nature. 503 (7475), 281-284 (2013).
- Anderson, K. I., Cross, R. Contact dynamics during keratocyte motility. Curr Biol. 10 (5), 253-260 (2000).
- Burnette, D. T., et al. A role for actin arcs in the leading-edge advance of migrating cells. Nat Cell Biol. 13 (4), 371-381 (2011).
- Humphries, A. C., et al. Clathrin potentiates vaccinia-induced actin polymerization to facilitate viral spread. Cell Host Microbe. 12 (3), 346-359 (2012).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nat Methods. 5 (7), 605-607 (2008).
- Kage, F., et al. FMNL formins boost lamellipodial force generation. Nat Commun. 8, 14832(2017).
- Peckham, M., Miller, G., Wells, C., Zicha, D., Dunn, G. A. Specific changes to the mechanism of cell locomotion induced by overexpression of beta-actin. J Cell Sci. 114, Pt 7 1367-1377 (2001).
- Salmon, E. D., Waterman, C. M. How we discovered fluorescent speckle microscopy. Mol Biol Cell. 22 (21), 3940-3942 (2011).
- Machan, R., Wohland, T. Recent applications of fluorescence correlation spectroscopy in live systems. FEBS Lett. 588 (19), 3571-3584 (2014).
- Becker, W. Fluorescence lifetime imaging--techniques and applications. J Microsc. 247 (2), 119-136 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır