Method Article
X-ışını kristalografisi ve biyofiziksel teknikleri immünglobulin katlanmış glikoproteinlerin karakterizasyonu
Bu Makalede
Özet
Biz glikoproteinlerin biyofiziksel ve yapısal karakterizasyonu için yaklaşımlar ile immünglobulin kat biolayer Interferometry, izotermal titrasyon Kalorimetre ve x-ışını kristalografisi tarafından mevcut.
Özet
Hücre yüzeyinde glikoproteinlerin hücresel işlevde, sinyalizasyon, yapışma ve ulaşım dahil olmak üzere önemli rol oynarlar. Lökosit üzerinde bu glikoproteinlerin çeşitli immünglobulin (Ig) kıvrımlar sahip ve bağışıklık tanıma ve düzenleme için merkezi. Burada, tasarım, ifade ve insan B hücre reseptörü CD22 ekstrasellüler etki alanının biyofiziksel karakterizasyonu için bir platform mevcut. Önerdiğimiz bu yaklaşımlar geniş IG etki alanları içeren memeli glikoprotein ectodomains karakterizasyonu için geçerlidir. İki süspansiyon insan embriyonik böbrek (HEK) hücre hatları, HEK293F ve HEK293S, glukanlardir, karmaşık ve yüksek-mannoz sırasıyla barındırmaktan glikoproteinlerin ifade etmek için kullanılır. Bu rekombinant glikoproteinlerin farklı glycoforms ile glycan boyut ve ligand taşıması kompozisyona etkisini araştıran izin. Biz kinetik ve termodinamik glikoprotein bağlamanın biyolojik ilgili ligandlar ve terapötik antikor adayları için eğitim için protokol tartışıyorlar. Rekombinant glikoproteinlerin HEK293S hücrelerinde üretilen kristalizasyon glycan homojenizasyon, azaltılmış esneklik ve endoglycosidase H tedavi duyarlılık nedeniyle mükellef bulunmaktadır. Biz ağır atomlar ve faz belirlenmesi ve ligand taşıması, analizi için küçük moleküller glikoprotein kristallerle sırasıyla iliklerine için yöntemler mevcut. Tartışılan deneysel protokoller burada sözü işlevlerine fikir vermek ve tedavi hareket mekanizması araştırmak memeli glikoproteinlerin karakterizasyonu için tutun.
Giriş
Yüzey proteinleri hücresel işlevinde önemli rol oynarlar. Ekstrasellüler etki alanları, bu zar proteinleri hücre-hücre etkileşimleri, adezyon, taşıma ve1,2sinyal modüle. Bu proteinler hücre dışı lokalizasyonu onları hastalıkları, kanser ve otoimmün hastalıklar3,4,5 de dahil olmak üzere geniş bir yelpazede tedavisinde therapeutics gelişimi için çekici hedefler yapar , 6 , 7. insan membran protein ectodomains en yaygın kıvrımları biridir yedi veya daha fazla β-iplikçikleri iki β-sayfa8,9içine düzenlenmiş tarafından kurulan immünglobulin benzeri (Ig) kat. Genellikle, Ig içeren glikoproteinlerin membran proteini10ekstraselüler kısmı üzerinde sırayla düzenlenmiş IG etki alanlarıyla çoklu etki alanı yapılardır. Özellikle N ve O bağlı glikozilasyon, bu hücre yüzeyine proteinlerin translasyonel modifikasyonlar katlama, salgı ve işlev11onların Yönetmelikte gerekli rolleri oynamak için gösterilmiştir. Teknikleri anlayışımız işlevlerine ve onları hedef olabilir daha iyi tasarım tedavi geliştirmek için gerekli olan detaylı onların Moleküler Karakterizasyonu için izin. Burada, Biyofizik için izin teknikleri bir arada mevcut (biolayer Interferometry (BLI) ve izotermal titrasyon Kalorimetre (ITC)) ve yapısal (x-ışını kristalografisi) IG içeren hücre dışı etki karakterizasyonu membran glikoproteinlerin, yalnız ve karmaşık biyolojik ilgili ligandlar ve terapötik molekülleri (Şekil 1).
N bağlı glikozilasyon memeli proteinler üzerinde en yaygın sonrası çeviri değişiklikler biridir ve endoplazmik retikulum ve Golgi12,13içinde protein olgunlaşma sırasında ortaya çıkar. Gibi insan embriyonik böbrek (HEK) 293 hücreleri, hücre hatları glikozile memeli proteinler14,15büyük miktarlarda rekombinant ifade için geliştirilmiştir. Bu hücre kültürünü protein üretim yapisan hücre hatları ile karşılaştırıldığında daha büyük miktarlar için yukarı ölçekleme kolaylığı sağlar bir süspansiyon biçimde geliştirilmiştir. Burada, biz iki HEK293 hücre satır kullanmaktadır: HEK293F ve HEK293 Gnt ben N-acetylglucosaminyl transferaz yokluğunda tarafından ben farklı- / - (HEK293S), (Gnt ben) ikinci. Buna karşılık, karmaşık glukanlardir (olarak görülen HEK293F) üretimi mümkün değildir ve bunun yerine yüksek mannoz tipi glukanlardir (ağırlıklı olarak Man5GlcNAc2) glycan N bağlantılı siteler18,19,,20 ikamet . Bu iki hücre satırları paralel olarak kullanarak glycan boyut ve karmaşıklık etkisi biyolojik fonksiyon ve terapötik hedefleme üzerine eğitim sağlar. Gerçekten, HEK293F hücrelerinde üretilen glikoproteinlerin HEK293S hücrelerinde üretilen aynı glikoprotein kıyasla daha büyük, daha karmaşık glukanlardir olacaktır. HEK293S hücrelerinde üretilen glikoproteinlerin azaltılmış kimyasal ve konformasyon heterojenite onların N bağlı glukanlardir nedeniyle daha kristalizasyon için mükellef bulunmaktadır. Crystallizability daha da geliştirmek için HEK293S (ama değil HEK293F) hücrelerinde üretilen glikoproteinlerin enzim endoglycosidase H (Endo H), yüksek mannoz glukanlardir bir bölünme gibi sonuçları ile tedavi edilebilir sadece bir tek N-peptidoglikan (GlcNAc) yan her N bağlı glikozilasyon sitesi21,22, kalır. Diğer yöntemler de N-glycan işleme glycosyltransferase inhibitörleri eklenmesi sırasında kifunensine23içeren glikoprotein ifadeler gibi hücre içinde sınırlandırmak için kullanılabilir. Alternatif yaklaşımlar (HEK293F hücrelerdeki) yerel glikoproteinlerin ifade peptid N-glycosidase F (PNGaseF) kullanarak tekrar tekrar enzimatik deglycosylation tarafından takip gerektirir. Ancak, deglycosylation PNGaseF ile yerel koşullar ve artar toplama bazı proteinlerde altında daha az etkili olduğu gösterilmiştir; protein kullanımdan sonra çözünür kaldığında durumlarda bu aspartik asit24, deamidation asparagine kalıntısı nedeniyle yüzeyinde negatif ücretleri hangi onun kristalizasyon için zararlı olabilir satın aldı. Tahmin edilen N-glikozilasyon siteler de, en sık alanin veya glutamin artıkları için N bağlı glikozilasyon bu sitelerdeki engellemek ve yüksek homojenliği glikoprotein örnekleri oluşturmak için mutasyona uğramış. Alternatif olarak, glikoproteinlerin mantar, böcek ve bitki sistemlerinde veya Çince hamster yumurtalık (CHO) hücreleri16,17gibi diğer memeli hücre satırları da dahil olmak üzere diğer ökaryotik hücre kültürlerinde üretilebilir.
PHLsec, dahil olmak üzere birçok memeli ifade vektörel çizimler, rekombinant glikoprotein ectodomains salgısı hücre orta25içine sağlar. Hücre lizis için gerek kalmadan hızlı ve kolay arıtma HEK293 hücrelerden glikoproteinlerin salgılanmasını sağlar. Arıtma Etiketler eklenmesi (Örneğin, O'nun etiketi, Strep-etiket, bayrak-etiket, Myc-etiket, HA-etiket) hedef N ve C terminus glikoprotein arıtma tek adım benzeşme Kromatografi tarafından sağlar. Daha sonra boyutu dışlama Kromatografi biyofiziksel ve yapısal karakterizasyon için monodisperse örnek verim için kullanılabilir.
Uygun koşullar altında son derece saf ve homojen glikoprotein örnek iyi diffracting kristaller neden olabilir. Bir kez tam x-ışını kırınım veri kümesi böyle kristalleri elde etti, ilk aşama glikoprotein elektron yoğunluğu hesaplamak için belirlenecek gerekir. Bir artan yapıları Protein veri Bankası (PDB) sayesinde, phasing için en sık kullanılan yöntem tarafından çok ilk aşama26elde etmek için ilgili protein yapısı kullanır moleküler değiştirme (MR), haline gelmiştir. Ancak, zaman zaman multi-IG etki alanı glikoproteinlerin27,28,29için olduğu gibi Bay faz sorunu çözmek başarısız olduğunda alternatif yöntemler gereklidir. Bu makalede, biz CD22 ectodomain28yapısını çözmek için gerekli ağır atomları (HA) kristallerle phasing için emmek için bir yöntem ayrıntı. Sağdaki HA phasing için tanımlayan belirli bir kristal kafes ve kristalizasyon çözüm30,31glikoprotein kullanılabilir atomlar HA reaktivite üzerinde bağlıdır yinelemeli bir işlemdir. Alternatif olarak, doğal kükürt atomlara sistein ve metionin artıkları varsa yeterince yüksek bir oranı, diğer atomlar için glikoprotein ve x-ışını kırınım veri yeterince yüksek artıklık32iletoplanan phasing için kullanılabilir, 33.
Membran glikoproteinlerin biyolojik işlev genellikle protein-protein etkileşimleri veya protein-ligand etkileşimleri, tarafından gibi karbonhidrat ile aracılık ettiği. Ligand glikoprotein bağlamanın sitesine kristal kafes içinde eriyik--dan yaygın küçük olduğunda, deneyler iliklerine ligand tanıma daha iyi anlamak için bir glikoprotein ligand Co kristal yapısı elde etmek için başarılı olabilir.
Burada sunulan iletişim kuralları da sentetik tedavi ligandlar34,35 ve antikor therapeutics36,37ile yüzey glikoproteinlerin etkileşimleri anlamak için ilgili. Yapısal bilgilerle birleştirildiğinde, kinetik ve termodinamik bağlama anlamak ve eylem kendi mekanizmaları geliştirmek için güçlü olabilir. Terapötik antikorlar bir glikoprotein bağlama kinetik analizi için izin veren bir BLI38,39tekniktir. Saçınıza biyosensörler sonuçta denge ayrışma sabiti (KD) belirleyen bir bağlama ortağı ile dernek ve ayrılma kinetik ölçmek için immobilize bir ligand ile kullanır. BLI değil çekici bir yaklaşım çünkü glikoproteinlerin küçük miktarlarda gereklidir (< 100 µg), deney zamanı hızlı (~ 10-15 dk başına), ve o-ebilmek var olmak otomatikleştirmek. ITC glikoproteinlerin ve bağlama ortakları40,41,42,43arasında benzeşim eğitimi için de yararlıdır. ITC daha fazla zaman ve reaktif yoğun olmakla birlikte, etkileşim (ΔG, ΔH, ΔS ve stoichiometry) Termodinamiğin ile ilgili değerli bilgiler elde edilebilir. ITC de çok sık sık ligandlar için yüzey glikoproteinlerin geçici bağlama ile ilişkili zayıf etkileşimler çalışmak için yararlıdır. Ayrıca, bu tekniklerin birlikte bağlama çeşitli yapıları, değerlendirmek ve farklı hücre hatlarında glikoprotein ifade elde farklı N bağlı glycoforms etkisini değerlendirmek için kullanılabilir. HEK293F, HEK293S üretilen ve Endo H ile tedavi glikoproteinlerin ile saçınıza ve ITC performans glukanlardir rolünün ayrıntılı bir görünümünü biyolojik aktivite ve terapötik nişan sağlar.
Biz başarıyla uygulanan ekstrasellüler etki alanı (ECD) özelleştirmek için bu iletişim kuralları insan CD2228, B hücreli homeostazı44 bakımı için önemlidir sialik asit bağlama IG benzeri lektinlerinin (Siglecs) ailesinin bir glikoprotein üye . Kristalizasyon kolaylaştırmak için derinlemesine yapı tasarımı gerçekleştirilen ve Hg ile iliklerine HA X-ray DataSet'in aşamalı. Biz de onun ligand sialik bağışıklık reseptör-ligand kompleks bir yapı elde etmek için asit (α2-6 sialyllactose) kristallerle CD22 batırılmış ve böylece planları glycan mimetics45,46yapısı destekli tasarım için sağlanan. Buna ek olarak, biz anti-CD22 tedavi antikor epratuzumab - terapötik aday Şu anda Faz III klinik denemeler için non-Hodgkin Lenfoma47- parça antijen bağlayıcı (Fab) onun bağlama benzeşme BLI tarafından belirlemek için oluşturulan ve ITC differentially glikozile için CD22 ECD oluşturur. Bu çalışmalar epratuzumab nişan, N bağlı glikozilasyon için kritik bir rol işlevsiz B hücreleri üzerinde CD22 tanıma için potansiyel etkileri ile saptandı.
Protokol
1. yapı tasarım glikoprotein ECD için
- İnsan CD22 amino asit dizisini değerlendirmek (Uniprot) yer alan içinde protein48,49öngörülen etki alanı öğeleri ve sınırları tanımlamak için InterPro ve Phyre2 sunucuları kullanarak.
- Sinyal peptid transmembran ve sitozolik etki alanlarına (artıkları 20-687, bundan sonra CD22 ekstrasellüler etki alanı, CD22 ECD) enzimleri AgeI ve KpnI (kullanarak pHLsec memeli ifade vektör25 eksik insan CD22 dizi klon Resim 2 A) 50.
Not: PHLsec vektör çözünür, salgılanan proteinler memeli hücreleri25overexpression için optimize edilmiştir. Bu vektör çözünür glikoproteinlerin ekstraselüler salgılanması için izin vermek için bir salgı sinyal içerir. pHLsec immobilize metal benzeşme Kromatografi yöntemleri kullanarak hücre supernatants üzerinden benzeşme arıtma kolaylaştırmak için C-terminal (onun)6 x etiketi içeriyor. - CD22 ECD kesilmiş yapıları C-terminal IG etki alanlarının sıralı silme işlemi yapılan clone: etki 1-6 (artıkları 20-687), etki alanları 1-5 (artıkları 20-592), 1-4 (artıkları 20-504) etki alanları ve etki alanları 1-3 (artıkları 20-330) (Şekil 2B ve 2 C)50 .
- CD22 ECD öngörülen N bağlı glikozilasyon siteleri inşa etmek51de mevcut tanımlamak için NetNGlyc server kullanarak birincil sırasını değerlendirmek.
- Site yönettiği mutagenesis kullanarak, standart protokolleri52 veya PCR53, üst üste her öngörülen N bağlı glikozilasyon site (Asn Gln için ve/veya Asn ala) tek bir veya birkaç içeren yapıları, CD22 ECD oluşturmak için mutasyona N bağlı glikozilasyon mutasyonlar.
- Sonra sıra doğrulama klonlanmış yapıları, yetkin E. coli dönüştürmek DH5α hücreleri54 ve maxi-prep (göre üretici yönergelerine) DNA transfection için hazırlamak için.
2. HEK293F ve HEK293S hücre kuruluş
Not: Gerekli reaktifler ve donanımı ile HEK293F veya HEK293S hücrelerinin tüm işleme uygun Biyogüvenlik kabini Biyogüvenlik seviye 2 tesisinde gerçekleştirilmelidir. Tüm öğeleri dış yüzeyinin % 70 etanol çözüm ya da eşdeğer reaktif ile sterilize gerekir.
- (Bkz: Malzemeler tablo) HEK293F ve HEK293S süspansiyon hücreleri elde etmek ve kullanmak için hazır kadar-80 ° C'de depolayın.
- ( Tablo malzemelerigörmek) sıcak ortam için 1 h 37 ° C su banyosu içinde. 24 mL ılık medya bir 125 mL şaşkın hücre kültür şişesi Bacalı bir kap ile aktarın.
- 1 mL hücre aliquot-80 ° C ve buz için transfer elde etmek.
- Kısmen hücreleri çözülmesi için yaklaşık 1 dakika, 37 ° C su banyosu hücrelerde kuluçkaya. Hücre 1 mL flakon ortamı içeren 125 mL şaşkın hücre kültür şişeye aktarın.
- Hücre kültür şişesi Bacalı kapaklı ve 37 ° C, 130 d/d, %70 nem ve % 8 CO2ayarla bir shaker yer şişeye kapatın.
3. HEK293 Hücre bakım
Not: Hücre yoğunluğu ve canlılığı hücre olmalıdır çözdürme sonra yaklaşık 24 saat kontrol ettim. Bu adım hücreleri aşılama kurtarma sağlar; ilk canlılık-meli var olmak > % 80.
- Dikkatle ve steril 1.5 mL microtube transfer hücre 10 µL taze süspansiyon hücreleri içeren 125 mL balonun çıkarın. Şişeye kapatıp da kuluçka için dönün.
- Trypan mavi çözüm 10 µL hücreleri içeren 1.5 mL microtube pipet, iyice karıştırın ve 10 µL sayım slayt odasına aktar.
- Sayım slayt bir otomatik hücre sayaç koymak ve değerleri hücre yoğunluğu (birimleriyle hücreleri mL-1) ve hücre canlılığı (yüzde) olarak almak için.
- ~0.8 x 106 hücre mL-1 aşağıdaki denklemleri kullanarak son yoğunluğu bir taze 200 mL kültür aşılamak için gerekli olacaktır hücre hacmi hesaplamak:
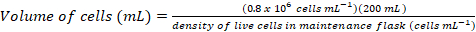 (1)
(1)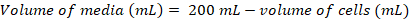 (2)
(2)
Not: O-ebilmek almak ~ 200 mL kültür içine aşılama için uygun hücre yoğunluğu elde etmek için 5 d. - Hücre yoğunluğu 200 mL kültür aşı için yeterli olduğunda, 37 ° C'de 1 h için ısınma medya banyo su ve Biyogüvenlik kabini ısıtılmış medya aktarmak.
- Serolojik pipet kullanarak, dikkatli bir şekilde medya (olarak hesaplanan 2 denklemdeki) gerekli hacmi Bacalı bir kap ile 500 mL şaşkın hücre kültür şişesi içine aktarın.
- Serolojik pipet kullanarak, gerekli birim (denklem 1 hesaplanır) süspansiyon hücre ortamı içeren başka 500 mL şaşkın hücre kültür balonun aktarın.
- Yeni 200 mL bakım stok kap ve kuluçka makinesi için dönmek. Hücreleri bir yoğunluk yaklaşık 3 x 106 hücre mL-1için büyümek. Hücreleri bir yoğunluk 106 hücre mL-1 x 0,8, istikrarlı bir kültür (3,4-3.7 bölümünde anlatıldığı gibi) hücreleri korumak için her 2-3 d geçiş. ~ 4 x 106 hücre mL-1yoğunluğu aşmayı hücreleri izin vermez.
4. transfection HEK293 hücre glikoprotein ifade için
- Birimin hesaplamak hücreleri ve transfection 0.8 x 10 için bir 200 mL kültür için gerekli olan medya6 mL-1 (Bölüm 3.4 denklemler 1 ve 2 kullanarak) hücreler.
Not: Gerçekleştirilen 200 mL transfections bakım hisse senedi hücre yoğunluğuna bağlıdır. - Medya ve hücreler transfection için gerekli hacmi Bacalı bir kap ile yeni bir 500 mL hücre kültür şişesi içine transfer ve hücre hisse senedi için kuluçka dönün.
- Hücreler hücreleri bölme takip parkenizin izin vermek için transfection önce 1 h için kuluçkaya.
- DNA'ın 50 µg steril 50 mL konik tüp içine aktarmak ve medya ile 5 mL seyreltik. Vakum başka bir steril tüp 0,22 µm filtrasyon sistemi kullanarak seyreltilmiş DNA filtre.
- Mix seyreltilmiş, DNA transfection reaktif ile 1:1 kitle: hacim oranı filtrelenmesi. Yavaşça karıştırın ve çözüm için 10 dakika oda sıcaklığında kuluçkaya DNA: transfection reaktif çözüm girdap.
- DNA: transfection reaktif çözüm doğrudan hücrelere ekleme. 37 ° C, 130 d/d, %70 nem ve % 8 CO2 için 5-7 d bir shaker, transfected hücreleri kuluçkaya.
5. hücre Transfection koşulları iyi duruma getirilmesi
Not: cep transfection koşulları en fazla glikoprotein verim için en iyi duruma getirmek için hücreleri ilk hücre yoğunluğu çeşitli transfect ve protein verim zaman (Şekil 3A) içinde değerlendirmek. 4 bölümde açıklandığı gibi hücreleri transfect, ilk hücre yoğunluğu 0,5 x 10 arasında değişen,6 2 x 106 mL-1 55hücreler. Deneme transfections 25 mL toplam hacmi (125 mL şaşkın hücre kültür şişesi) alanı ve Kimyasalları kaydetmek için DNA 6 µg ile ölçeklendirilebilir. DNA miktarı da en iyi duruma getirilmiş55olabilir.
- Her gün sonrası transfection (gün 1-7), steril 1.5 mL microtube (Biyogüvenlik dolabında) içine hücre kültürü 500 µL aliquot aktarın.
- 5 dakika içinde bir microcentrifuge için 12.000 x g de bölünmemeli hücreleri hemen toplandıktan sonra spin. Tüm örnekleri elde edilen kadar süpernatant yeni 1.5 mL microtube ve mağaza 4 ° C'de aktarın.
- Dansitometresi tarafından salgılanan glikoprotein quantitate
- Bir kez tüm örneklerini elde edilen, her aliquot 20 µL yeni bir 1.5 mL microtube örnek ve 4 x Laemmli örnek arabellek azaltma 6 µL ile karıştırın.
- Örnekleri Termo Blok 95 ° C'de 5 dakika kaynatın. Bir microcentrifuge 12.000 x g, 1 dk. için örnekleri spin.
- 10-iyi 4-%15 degrade SDS-sayfa jel bir kuyu başına her örneğinin 20 µL yükleyin. Tek şeritli protein boyutu işaretleri içerir. Jel 250 V 20 dk Tris/glisin/SDS arabellekte için çalıştırın.
- Çalışma tamamlanmasını takiben, jel Coomassie için transfer ( Tablo malzemelerigörmek) için 20 dk. leke GKD2O 20 dk. görüntü jel için jel de-leke.
- ImageJ, standart protokolleri57,58takip ile Dansitometresi gerçekleştirin.
- Derlemek ve x ekseni üzerinde çiz veri ile 'gün sonrası transfection' ve 'Dansitometresi değerleri' y ekseni (Şekil 3A) üzerinde.
Not: Western Blot gibi teknikleri alternatif olarak, kullanılan56protein ifade tarafından SDS-sayfası görüntüleme için yeterli değilse, olabilir.
- Saçınıza tarafından salgılanan glikoprotein quantitate
- Ni-NTA biyosensörler kullanarak, salgılanan glikoprotein BLI59kullanarak miktarı quantitate.
- Derlemek ve x ekseni üzerinde çiz veri ile 'gün sonrası transfection' ve 'protein konsantrasyonu (µg/mL)' (Şekil 3A) y ekseni üzerinde.
6. HEK293 süpernatant dan çözünür glikoprotein saflaştırılması
- Santrifüjü için 4 ° C'de 20dk 6,371 x g de tarafından hücre hasat Salgılanan CD22 ECD içeren süpernatant korumak ve 0,22 µm filtre kullanarak filtre uygulama.
- Yük süpernatant önceden denge üzerinde 4 mL min-1 adlı bir benchtop Kromatografi Sistemi kullanarak (20 mM Tris pH 9.0, 150 mM NaCl, 5 mM imidazole) Ni-NTA sütunu (5 mL cilt).
Not: Diğer arıtma benzeşme tabanlı teknikleri, Bölüm 1'deki yapı tasarım dahil benzeşme Etiketler dayalı kullanılabilir. - Süpernatant yükleme, aşağıdaki benzeşme sütun 3-4 sütun birimler (CV) yıkama arabelleği (20 mM Tris pH 9.0, 150 mM NaCl, 5 mM imidazole) ile yıkayın.
- Kesirler (Şekil 3B) toplanırken elüsyon arabelleği (20 mM Tris pH 9.0, 150 mM NaCl, 500 mM imidazole) 4-%100 degrade (4 CVs) kullanarak sütundan arıtılmış glikoprotein elute.
- 4000 x g 4 ° C'de 15 dakika veya örnek bir hacmi 500 µL ulaşıncaya kadar centrifuging tarafından eluted tepe 10 kDa nominal moleküler ağırlık sınırı (NMWL) ve konsantre bir santrifüj filtrasyon cihazın içeren havuzu kesirler.
- Konsantre glikoprotein bir 500 µL örnek döngü ve 0.5 mL min-1 ön denge (20 mM Tris, pH 9.0, 150 mM NaCl) üzerine yükte içine enjekte yüksek performanslı boyutu dışlama sütun (yaklaşık 24 mL cilt) hızlı protein sıvı kromatografi (FPLC) Sistem 4 ° C'de kesirler (Şekil 3C) toplarken.
- SDS-sayfa jel glikoprotein içeren kesirleri tanımlamak için eluted kesirler, çalıştırın ve karşılık gelen kesirler havuz. SDS-sayfa jel Bölüm 560içinde açıklandığı gibi çalıştırabilirsiniz.
7. Deglycosylation arıtılmış glikoprotein
- Boyutu dışlama Kromatografi 280 absorbans kullanarak takip saf protein konsantrasyonu ölçmek nm bölünmüş tarafından geçersiz kalma katsayısı (Örneğin, 1.418 M-1 cm-1 CD22 ECD için).
Not: Proteinler ilgi teorik tükenme katsayısı ExPASy ProtParam61gibi sunucuları kullanılarak hesaplanabilir. - Endo H ile saf protein saf protein ticari enzim (göre üretici yönergelerine) 1 X Endo H arabelleğinde 10 µL için 1 mg oranında 37 ° C'de 1 h için kuluçkaya.
Not: Üretilen yüksek mannoz glukanlardir Endo H cleaves her glikozilasyon sitesi21, tek bir GlcNAc yan HEK293S içinde bırakarak. Diğer enzimler (Örneğin,PNGaseF24) bu amaç için kullanılabilir ancak Endo H glukanlardir HEK293F hücreleri22yılında, üretilen protein üzerinde ayırmak değil. - Deglycosylated ECD 500 µL için konsantre ve jel filtrasyon Kromatografi 0.5 mL min-1 Endo H kaldırmak ve herhangi bir sonuçta elde edilen toplamları ayırmak için bir FPLC, yüksek performanslı boyutu dışlama sütun (yaklaşık 24 mL cilt) çalıştırın.
- Aşağı akım deneyler kullanımda kadar deglycosylated protein 4 ° C'de depolayın.
8. glikoproteinlerin kristalleşme
Not: ticari olarak mevcut ekranları kullanarak kristalizasyon denemeler gerçekleştirmek ve kristalizasyon robot kullanarak açılan deneyleri oturarak ayarlayın.
- Konsantre saf, deglycosylated ECD için istenen konsantrasyonu elde edilir kadar 10 kDa NMWL, 4.000 x g (4 ° C) ile bir santrifüj filtreleme aygıtı kullanarak 10 mg mL-1 .
- 280 absorbans kullanarak protein konsantrasyonu belirlemek nm ve yok olma katsayısı tarafından bölme.
- Santrifüj örneği kristalizasyon denemeler istenmeyen toz veya diğer kirletici örneğinden kaldırmak için önce 4 ° C'de 5 min için 12.000 x g '.
- Rezervuar doldurun wells 96-iyi oturan bir ticari kristalizasyon ekrandan kristalizasyon pilakalar ve kristalizasyon çözüm 80 µL bırak.
Not: Biz PDB'de yatırılır yapıları açısından en başarılı kristalizasyon koşullara göre tasarlanmış seyrek matris ticari ekranlarını kullanın. - Kristalizasyon robot kullanarak 200 toplam damla hacmi ile kristalizasyon kalıbının kuyuya damla dağıtmak nL saf protein: kristalizasyon çözüm 1:1 oranında.
- Teyp ve yer ile plaka, bir kez tüm plaka reçete, görünür ve ultraviyole ışık tarafından muayene için bir plaka Imager kapatın.
- Kristalizasyon tabak hemen ardından Kur ve aşağıdaki haftalarda ilk glikoprotein kristal sayısı vermek koşulları tanımlamak için görünür ve ultraviyole ışık kullanarak kontrol edin.
- Kristalleri ince ekranlar kristal vurmak veya rasgele matris mikro-tohum yöntemleri62,63,64,65koşula bağlı kullanarak ilk kristalizasyon sayısı elde daha fazla en iyi duruma getirme.
- Cryo-korumak yeterli cryo-koruyucu kristalizasyon koşul içinde anne kristal ıslatarak eksik herhangi bir kristalleri likör %20 (v/v) gliserol çözüm ile desteklenen çözüm (ya da eşdeğer cryo-koruyucu, etilen glikol gibi veya Polietilen glikol 400).
- Cryoloops ve flash Mount kristaller onları bir eve kaynak diffractometer veya sinkrotron radyasyon kullanarak veri toplama önce sıvı azot dondurma.
9. ağır Atom Derivatization kullanarak aşamalı
Not: daha önce herhangi bir manipülasyon HA bileşiklerin Emanet yönleri dikkate alınmalıdır. HA protein kristalografisi içinde kullanılan bileşikler biyolojik moleküller üzerine çalışmaları için onların güçlü benzeşimi için seçilir ve uzun süreli maruz kalma insan sağlığı için risk teşkil. Onların malzeme güvenlik bilgi formları belirtildiği gibi HA bileşikler için uygun güvenlik önlemleri.
- Farklı HA bileşikler sınamak için Bölüm 8'de 24-şey kristalizasyon tabakta asılı bırak buhar difüzyon yöntemi66kullanarak elde edilen iyi diffracting kristalleri konsantrasyonları ve kuluçka süreleri, yeniden.
- HA olacak karar kristal derivatization için kullanılır. Sunucuları (Örneğin, ağır atom veritabanı sistemi67) HA bileşik seçim ile onlar protein ve kristalizasyon koşul için uygun sağlayarak size yardımcı olabilir.
Not: HA ekranlar da ticari phasing için en etkili HA bileşiklerin kolay tarama için mevcuttur. "Sihirli yedi" HA bileşikleri bir dizi daha önce tarif edilmiş yüksek olasılık HA derivatization68için başarı için. - İş istasyonu kadar (Şekil 4A) iliklerine HA için ayarlayın. Bir cryoloop kullanarak, hızlı bir şekilde kristalleri µL bırak öyle ki HA son konsantrasyonu 1-20 mM arasında değişmektedir kristalizasyon durumda seyreltilmiş HA solüsyon içeren 22 mm kapak notu üzerindeki bir 0,2 aktarın. Damla mühür ve zaman (Şekil 4B) farklı uzunlukları için kuluçkaya. İyi bir başlangıç noktası 5, 10, 60 ve 90 dk ve geceleme var.
- Kristalleri olası çatlaklar veya glikoprotein kristal veya kristal derivatization yan etkileri gösteren renk değişiklikleri tanımlamak için bir ışık mikroskobu ile kontrol edin.
- Cryoloops kristaller ve arka-sıvı kristaller 30 için mount üç ardışık 0.2 µL s damla % 20 (v/v) gliserol (veya alternatif cryo-koruyucu ile) takıma içeren anne içki çözüm69. Kristalleri geri iliklerine kadar özel olarak sigara bağlandı ve kısmi doluluk zayıf HA bağlama tarafından neden azaltan HA bileşik kaldırır. Donma kristalleri sıvı azot (Şekil 4B) flash.
- Veri toplama, işleme, yapı çözüm ve arıtma için yukarıda açıklanan protokoller26,70,71,72kullanın.
10. kendi Ligand kristallerle glikoprotein iliklerine
- Bölüm 8'de 24-şey kristalizasyon tabakta asılı bırak buharı difüzyon yöntemi kullanılarak elde edilen iyi diffracting kristalleri yeniden.
- 50 mM ligand 20 mM Tris, pH 9.0, 150 mM NaCl içinde stok çözeltisi hazırlamak.
Not: Göre benzeşimi için onun glikoprotein ligand konsantrasyonu hazırlanmalıdır. Affinity bilinmiyorsa, benzeşim deneyler iliklerine başlayan önce belirlemek için ITC (Bölüm 12,2) gibi bir yöntem kullanmak için gerekli olabilir. Ligand gerekli arabellek istenen konsantrasyon, çözünür olduğundan emin olun. - Değişen ligand konsantrasyonları damla içeren ECD kristalleri için ekleyin ve 5 d 5 dk arasında değişen zaman uzunluklarında kuluçka için açılan mühür.
- Görsel olarak kristalleri morfoloji olası değişiklikleri tanımlamak için bir ışık mikroskobu ile izlemek.
- Cryoloops ve soğutucu kristaller mount-%20 (v/v) gliserol (veya diğer cryo-koruyucu etilen glikol veya düşük moleküler ağırlıklı Polietilen glikol 400 gibi) ile takıma anne içki çözümde korumak69.
- Veri toplama, işleme, yapı çözüm ve arıtma için yukarıda açıklanan protokoller73,74,75kullanın.
11. parça antijen (Fab) bağlama imalatı
- Fab ağır zincir (HC) ve anti-ECD antikorlar, Örneğin,epratuzumab hafif zincir (LC) dizileri karşılık gelen genlerin subclone.
Not: Alternatif olarak, IgG Fab parçaları76oluşturmak için enzim papain tarafından i ciddi. - Hücreleri aşağıdaki değişiklikleri ile Bölüm 4'te açıklandığı gibi transfect:
- DNA'ın toplam bir kitle kültürünün 200 mL başına 90 µg Fab parçalarını transfection için kullanın.
- HC ve LC plazmidleri LC dimer oluşumunu azaltmak için 2:1 oranında transfect.
- 7 d, kuluçka sonra hücre hasat, süpernatant korumak ve 0,22 µm elektrikli tahrik filtreleme aygıtı ile filtre.
- Anti-LC (kappa veya lambda) benzeşme benchtop Kromatografi Sistemi kullanarak PBS Arabellek sütunda equilibrate.
Not: LC dimer oluşumu arıtma sırasında bir sorun olursa, Protein G benzeşme Kromatografi kappa/lambda LC benzeşme arıtma alternatif olarak kullanılabilir. - Benzeşme sütun 4 mL min-1adlı süpernatant yükleyin. Örnek yükleme sonrasında sütun 3-4 CVs PBS ile yıkayın.
- 100 mM glisin, pH 2.2, hemen eluted fraksiyonları % 10 (v/v) 1 M ile nötralize ile bir isocratic elüsyon kullanarak sütun protein elute Tris, pH 9.0 her kesir.
Not: Eluted Fab daha fazla İyon Kromatografi ve/veya boyutu dışlama Kromatografi bir FPLC 4 ° C'de kullanarak saf
12. glikoprotein için bağlama Fab ve küçük molekül karakterizasyonu
- Biolayer Interferometry
- 50 mL 1 x kinetik arabellek (1 x PBS, %0,002 (v/v) ara-20, %0.01 (w/v) BSA) hazırlayın.
- 1 x kinetik arabelleği için bir ön ıslatma plaka 10 dk 200 µL altı Ni-NTA biyosensörler hidrat.
- 1 ml 1 x kinetik arabellek 25 ng µL-1son bir konsantrasyon, O'nun öğesini ECD sulandırmak. Pipet arıtılmış Fab seri dilutions içine 1 kinetik arabellek, x 200 µL 500 nM yüksek konsantrasyon ve sonraki seri dilutions 250 nM, 125 nM ve 62.5 nM.
- Burada her şey 200 µL belirtilen çözüm içeren aliquot reaktifler siyah düz dipli Polipropilen 96-şey Mikroplaka Şekil 5A, gösterildiği gibi içine.
- 38,39,77 (Şekil 5A) daha önce açıklandığı gibi kinetik deneyleri içinde veri toplama yazılımı kullanarak veri toplamak.
- Kısaca, 1 x 60 için bir temel kinetik arabelleğe içeren kuyu içine biyosensörler transfer 25 ng µL-1 glikoprotein 240 için yükleme önce s s (veya bir eşik 1.0 kadar nm ulaşıldığında) 1000 rpm.
- Sonra ikinci bir temel 60 s 1 x kinetik arabellek, aktarım biyosensörler Fab seri seyreltme içeren kuyu. 180 s Derneği faz daha sonra 180 s ayrılma adımda 1 x kinetik arabellek izler.
Not: Yukarıdaki protokolü, arabellek (PBS ile 500 mM imidazole) sıyırma, biyosensörler yıkama üç devir oluşan bir yenilenme adım izlediyseniz biyosensörler 5 için yeniden kullanılabilir s 5 tarafından takip s kinetik arabellek nötralizasyon için x 1. Biyosensörler ~ 10-20 kadar yeniden olabilir kez aynı gün boyunca veya zayıf veriler kadar kaliteli görülmektedir.
- Analiz yazılımı (Şekil 5A) kullanarak verileri çözümleyin:
- Sekme 1, alma ve verileri seçme altında.
- Sekme 2, 1. adım altında: veri seçimi, select 'sensör seçimi' ve vurgulamak başvuru wells (satırlar E ve F, Şekil 5A), doğru tıkırtı ve de başvurmak için belirleyin. Adım 2: Çıkarma altında Seç 'başvuru Wells'. Adım 3 altında: y ekseni Hizala, 'Temel' 0.1-59.8 zaman aralığından seçin s. Adım 4 altında: arası adım düzeltme 'Ayrılma için Hizala.' seçin Adım 5 altında: işlem, select 'Çetinkaya-deniyordun filtreleme' ve basın işlem veri.
- Sekme 3 altında 'Derneği ve ayrılma' analiz adıma altında bir 1:1 modeli ile seçin. 'Küresel uygun' ve 'Grubu' tarafından renk seçin. Doğru tıkırtı eğrileri, "renk değişikliği" seçin, tüm eğrileri sizin seçtiğiniz renge ayarlayın. 'Eğrileri Sığdır' seçin. Veri iyi donatılmış bir rapor 'Raporu' Kaydet'i seçerek dışa aktarılabilir.
- Deney Fab tanıma farklı glycoforms, HEK293F ve HEK293S hücrelerinde (Bölüm 5) üretilen ve Endo H tedavi etkisi varsa, değerlendirmek için (Bölüm 7) aşağıdaki glikoprotein ile yineleyin. Ayrıca, etki alanı içgörü sağlamak için ECD truncations ile deneme tarafından Fab bağlı yineleyin.
- İzotermal titrasyon Kalorimetre Fab-glikoprotein etkileşim
Not: burada açıklanan ITC deneyler otomatik ITC enstrüman kullanarak gerçekleştirilir. Deney 1 mL yuvarlak alt 96-iyi blok içinde devam etmektedir.- ECD ve Fab 20 mm Tris, pH 8.0, 150 mM NaCl bir heyecan çizgiyle gecede 4 ° C'de tek bir 4 L ölçek diyaliz.
- Diyaliz ECD ve Fab 5 mikron ve 50 µM, sırasıyla konsantre, santrifüj filtre 10 kDa NMWL ile kullanarak, Yoğunlaştırıcı membranlar 3 kez 5 mL de diyaliz ile yıkamak için sağlanması arabellek 4.000 x g 4 ° C kullanmadan önce 5 min için de.
Not: Hücre ve şırınga örnekleri arasında tampon herhangi bir uyuşmazlıkla ITC deney ve veri sonucu kalitesiz sırasında yayımlanması istenmeyen ısı neden olabilir. - Deney 1: 400 µL ECD için A1 hücresinde yüklenecek ve Fab şırıngada yüklenecek iyi A2 için 120 µL ekleyin. İyi A3 karışık örnek aşağıdaki deneme tamamlama dönmek için boş bırakılır. Sonraki her deney aynı sırada plaka eklenebilir (Yani, deney 2: hücre - A4, şırınga - A5, boş iyi - A6; Şekil 5 B).
Not: arabellek arabellek denetimlere (araç iyi davranıyor onaylamak için) dahil, başında ve sonunda (şırınga içinde) ligand seyreltme şırınga örnek için ısı hesaplamak için arabellekte (hücre) denetimleri içine yanı sıra her Çalıştır. Bu hesaplanan seyreltme ısı daha sonra ham deneysel verilerden veri analizi (Şekil 5B) sırasında düşülen. - Toplam 16 enjeksiyonları her enjeksiyon için 2.5 μL hacmi ile çalıştırın. Enjeksiyon süresi 5. s ile iğne arasındaki 180 s aralığı. Karıştırma 750 rpm hızında ve filtre dönemi 5 ile 25 ° c hücre sıcaklığı ayarlamak s.
Not: benzeşme ve termodinamik ECD:Fab etkileşimin temel alınarak, örnek konsantrasyon, iğne veya hücre sıcaklık sayısını değiştirmek gerekli olabilir. - Veri analiz yazılımı ile40,41,43 (Şekil 5B) daha önce açıklandığı gibi analiz.
- Denemeyi en az ortalama KD değerleri ve standart hataları hesaplama çiftleri içinde tekrarlamak. Fab: glikoprotein etkileşim termodinamik üzerinde glycoforms, farklı glycoforms (Eğer herhangi bir etkisi, değerlendirmek için Bölüm 5 ve 6) ECD ile denemeyi tekrarlamak.
- İçin izotermal titrasyon Kalorimetre ligand-glikoprotein etkileşimlerin ITC deneme bölümü 12,2 aşağıdaki değişikliklerle açıklandığı gibi ayarlayın:
- ECD içinde 4 L diyaliz arabelleği gecede diyaliz. Diyaliz tamamlanmasının ardından diyaliz tampon kullanarak ligand geçiyoruz.
- ITC deneyler düşük-benzeşme etkileşimleri tespit edebilmek için önemli ölçüde daha yüksek konsantrasyonlarda gerçekleştirin. ECD ve ligand etkileşim için ITC deneyler ECD 100 µM konsantrasyonları, hücre ve şırınga ligand 1 mM sağlamak.
Sonuçlar
CD22 ECD olan birkaç yapılar başarılı bir şekilde pHLsec ifade vektör klonlanmış ve memeli HEK293F ve HEK293S hücre hatlarında (Şekil 2 ve 3A) overexpressed. Tüm yapıları boyutu homojenliği için boyut dışlama Kromatografi tarafından saf ve kristalizasyon çalışmalar (Şekil 3B ve 3 C) için son derece saf bir örnek vermiştir. HEK293S hücreleri, böyle sadece beş altı öngörülen N bağlı glikozilasyon sitelerin Asn Ala (N67A, N112A, N135A, N164A ve N231A), mutasyona uğramış d1-d3 kesme (artıkları 20-330), üretilen iyi diffracting kristal liderliğindeki CD22 yapısı yapıldı Glikozilasyon sitesi konumunda N101 muhafaza (bu yapıyı CD22 adlı20-330, 5A). Kristalleri MCSG-1 seyrek matris ekran çeşitli koşullarda elde edildi, ama en iyi kristaller bir durum içeren %30 (w/v) Polietilen glikol 4000, 0.2 M Lityum klorür ve 0.1 M Tris pH 8,5 vardı. Bu doğal kristaller 2.1 Å çözünürlük için diffracted; ilgili Siglec proteinlerin IG etki alanlarının bilinen yapıları kullanarak herhangi bir çözüm Bay aramalarında vermemiştir.
Aşamalı bilgi almak için yerel bir panel ha bileşik bir kuluçka süresi 5 dk dan 1 d (Şekil 4) için 1-20 mM arasında değişen konsantrasyonlarda Hg, Pt, işletim sistemi, Ta ve Br dahil HA bileşiklerin kristallerle batırılmış. Biz kristalleri morfoloji değişimler için izlenen ve bulundu kristalleri ile HA 20 mM bileşik batırılmış hızlı çatlama ve kristal eriterek sonuçlandı. Tantal bromür küme, platin klorür, cıva asetat ve Merkuris klorür ile sırılsıklam set kuluçka kez takip onların şekil muhafaza 63 kristalleri toplam dondu. Kristalleri Merkuris klorür 30 dk (Saskatoon, Kanada) Kanadalı ışık kaynağı (CLS) 08-BM beamline adlı bir floresan taramasında anormal sinyal gösterdi için 7 mM ile ıslatılmış ve çoklu dalga boyu anormal dağılımı tek bir x-ışını veri toplama için izin Kristal. Bu veri kümeleri bize CD22 Merkür altyapı çözmek izin ücretsiz bir sistein pozisyonda C308 bağlı ve sonuçta bize CD22 yapısını oluşturmak için izin tek Merkür atom ortaya20-330, 5A,20-330, 5A aşamalı içine AutoBuild78elektron yoğunluğu eşlem'i kullanma.
Unliganded yapısı çözüldü sonra biz onun ligand α2-6 siallylactose bağlı CD22 yapısını çözmek için ilgi vardı. Biz ilk CD22 benzeşme α2-6 sialyllactose ITC etkileşim bağlama termodinamik karakterize etmek için kullanarak doğru hesaplanır. ~ 280 µM bir ilgi gözlenen ve bu bilgileri bir başlangıç konsantrasyonu tanımlamak için kullanılan (~ 100 KDx) ligand yerel bizim CD2220-330, 5A kristalleri iliklerine için kullanmak için bir. Biz 25 mM siallylactose 5 dk, 2 h, 14 h, 40 h ve 5 d için CD2220-330, 5A kristallerle batırılmış ve kristal morfoloji değişimler için izlenir. ~ 75 kristalleri toplam çeşitli zaman puan donmuş ve CLS sinkrotron beamline 08-ID (Saskatoon, Kanada) uzaktan veri toplama için gönderdi. Toplam altı X-ray veri kümeleri iyi diffracting kristalleri toplanan. Her x-ışını veri kümesi yapısından bir ilk arama model olarak unliganded CD2220-330, 5A yapısı kullanarak MR tarafından çözüldü. Tüm veri kümeleri için elde edilen elektron yoğunluğu sonra olumlu yoğunluk α2-6 sialyllactose CD22 sitenin bağlama bağlı karşılık gelen Fo-Fc harita için kontrole tabi tutuldu. Dikkat çekici, tüm veri kümeleri toplanan, hatta sadece 5 dk kuluçka süresi, içerdiği sonra olumlu yoğunluğu ligand bağlayıcı sitedeki karşılık gelen batırılmış kristalleri dan. Unliganded ve liganded CD22 genel yapıları α2-6 sialyllactose ile iliklerine deneyler başarısını açıklayabilir en az konformasyon değişiklikleri ile çok benzer.
Biz sonraki terapötik antikor epratuzumab saçınıza ve ITC deneylerde (Şekil 5) tarafından tanınan CD22 antijenik yüzey ile karakterize. CD22 yapıları farklı glycoforms ile epratuzumab Fab bağlama kinetik ve Termodinamik profilleri ile azaltılmış N bağlı glycan büyüklük, CD22 için artan bir ilgi ile daha küçük glukanlardir (327 nM vs 24 nM için ilgi 14-fold bir düzelme kadar ortaya BLI; 188 nM vs 58 nM ITC içinde). Erişimi kısıtlama CD22 N bağlı glycan onun epitope için antikor, tek-noktaya mutantlar CD22, kullanarak saçınıza ve epratuzumab Fab-CD22 d1-d3 Co kristal yapısı28çözme tarafından tespit edilmiştir.
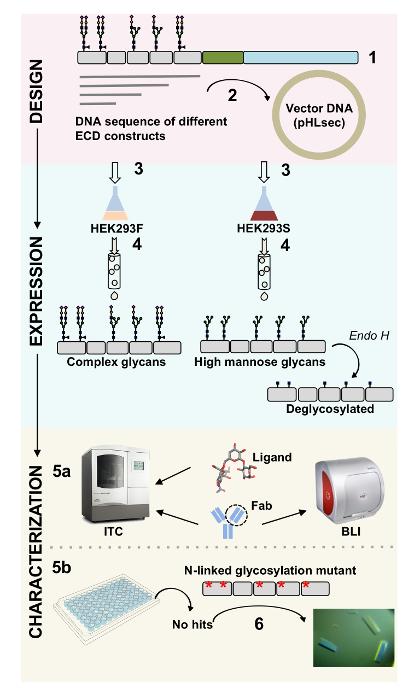
Resim 1 . Biyofiziksel ve yapısal karakterizasyon için yapı tasarım glikoprotein karakterizasyonu bakış. (1) temsilcisi glikoprotein birincil dizi analizi. Grey, ekstrasellüler etki alanı (ECD); yeşil transmembran (TM) kesimi; ve mavi, glikoprotein sitozolik etki. Tahmin edilen glukanlardir N bağlı olarak etiketlenmiştir. ECD yapıları, (2) klonlama. (3) ifade ECD memeli hücrelerinde oluşturur. (4) glikoprotein arıtma. Proteinlerin HEK293F içinde karmaşık glukanlardir içerirken, proteinlerin HEK293S içinde-ecek-si olmak yüksek mannoz glukanlardir. Enzimatik glikoproteinlerin tedavisinde HEK293S hücrelerde glikoproteinlerin ile sadece bir GlcNAc yan N bağlı glikozilasyon sitelerdeki sonuçlarında Endo H ile üretilen. (5a) glikoproteinlerin antikorlar için kendi bağlama için biolayer Interferometry (BLI) ve izotermal titrasyon Kalorimetre (ITC) tarafından test edilir. Küçük ligandlar benzeşimi da ITC tarafından ölçülebilir. (5b) kristalizasyon denemelerin glikoproteinlerin olanlar HEK293S ve deglycosylated bazı durumlarda, Endo H. (6) ile ifade gibi homojen N bağlı glukanlardir ile mutasyon N bağlı glikozilasyon sitelerin kristalleri elde etmek gereklidir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Resim 2 . DNA yapıları ifade memeli hücrelerinde CD22 ectodomain tasarımını. A) CD22 ECD yapıları, geçici transfection için kullanılan pHLsec plazmid gösterimi. AgeI ve KpnI siteleri klonlama için kullanılan kırmızı kutuları ile gösterilir. B) CD22 ECD yedi IG etki alanları (d1-d7) ve 12 öngörülen N bağlı glikozilasyon siteleri (mavili) içerir. Dört yapıları CD22 ECD tasarlanmıştır. C) % 1'özel jel CD22 ECD PCR amplicons gösterilen oluşturur pHLsec memeli ifade vektör klonlama için. İlk lane 1 kb DNA işareti içerir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
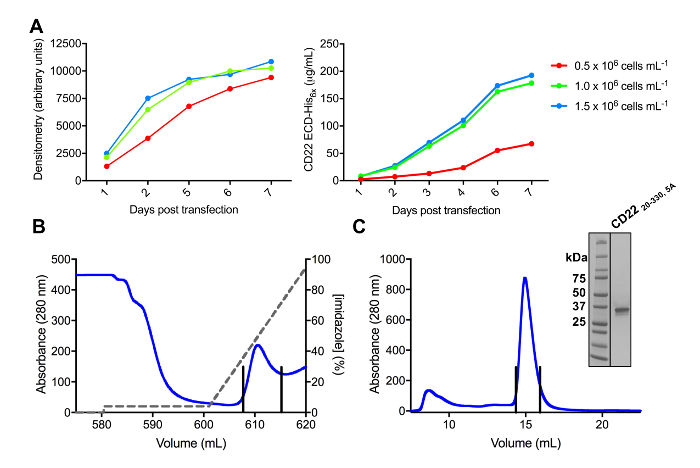
Şekil 3 . İfade ve glikoproteinlerin saflaştırılması. A) hücre yoğunluğu ifade verim üzerine etkisi. Küçük ölçekli 25 mL kültür glikoprotein ifadede HEK293F süspansiyon hücre hücre (0.5 x 106 hücre mL-1, 106 hücre mL-1x 1.0 ve 1.5 x 106 hücre mL üç farklı başlangıç yoğunlukları kullanarak transfected -1). Miktar sol panelinde SDS-sayfasından Dansitometresi ve nicel BLI içinde doğru kapı aynası tarafından gerçekleştirilen. Bir glikoprotein hazırlık temsilcisi değerlerdir. B) için ilk arıtma adımının kromatografik inşa CD2220-330, 5A Ni-NTA benzeşme sütun kullanarak süpernatant 600 mL üzerinden. Glikoprotein % 100 500 mM imidazole içerir elüsyon arabelleğin kaynakçalara imidazole (gri hat), bir degrade kullanarak eluted. Havuza alınan kesirler dikey çizgiler ile tasvir edilir. C) boyutu-dışlama kromatografik için inşa CD22 yüksek performanslı kullanarak20-330, 5A jel filtrasyon sütun. Havuza alınan kesirler elüsyon pik üzerinden dikey çizgiler ile tasvir edilir. İç metin: glikoprotein saflığı gösterilen Coomassie lekeli SDS-sayfa jel. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 4 . Kristal ile Ağır atomları iliklerine. A) örnek iş istasyonu yerel HA bileşikler kristallerle iliklerine için. Gerekli tüm araçları olarak etiketlenmiştir. B) adımları kristalleri emmek için takip inşa CD2220-330, 5A HA bileşikler ile. 1. adımda, aç de kristaller ve öyle ki HA son konsantrasyonu 1-10 mM arasında değişmektedir kristalizasyon durumda seyreltilmiş HA solüsyon içeren bir kapak notu üzerindeki bir 0.2 µL damla için bir döngü kullanarak transfer kristaller. 2. adımda, kristalizasyon plaka içinde belgili tanımlık damla mühür ve farklı süreler için bileşik HA kristallerle kuluçkaya. Adım 3, döngü sırılsıklam kristal dağ ve arka-emmek için 30 üç ardışık 0.2 µl damla bir kapak fişinde reçete %20 (v/v) gliserol ile takıma anne içki solüsyon içeren s. 4. adımda, flaş sıvı azot ile beraber bir döngü monte kristal dondurma ve sinkrotron beamline için sevkıyatın Pak yerleştirebilirsiniz. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
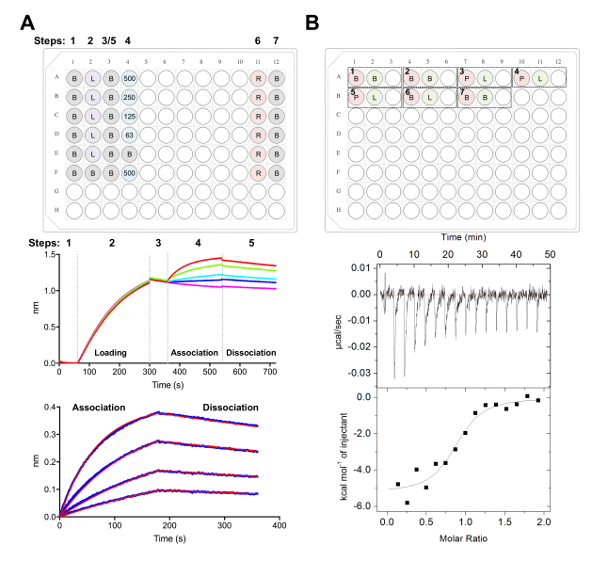
Şekil 5 . Biolayer Interferometry ve İzotermik titrasyon Kalorimetre ölçümleri. A) temsilcisi BLI deney. Üst panel: plaka kurulum nerede şu etiketlenir bir kinetik deney örneği: 1 x kinetik tampon (B), onun6 x-tagged glikoprotein (L) yükleme, temsilcisi Fab konsantrasyonları (500, 250, 125, 62.5 nM), PBS + 500 mM rejenerasyon tampon (B) arabellek (R) ve kinetik nötralizasyon x 1. Her şey 200 µL çözüm içerir. Adım numarası kinetik deney için plaka üst kısmında gösterilir. Orta paneli: Ni-NTA biyosensörler kullanılarak gerçekleştirilen BLI deney ve üst paneldeki açıklanan plaka temsilcisi ham veri. Adım sayılar temel (1),6 x glikoprotein (2) yükleme, temel (3), seri seyreltme Derneği Fab (4) ve ayrılma (5) için karşılık gelir. Yeniden oluşturma işlemi adımlar değildir (adım 6-7) temsil. Alt paneli: Temsilcisi analiz veri ham Derneği ve buna karşılık gelen ile ayrılma (mavi çizgi) gösterilen 1:1 (kırmızı çizgi) uygun. B) üst panel: temsilcisi plaka Kur'u tek bir ITC için otomatik bir ITC cihazda bir 96-kuyu alt blok yuvarlak yedi deneyler ile. Her deney üç kuyu oluşur. İlk kuyu (kırmızı) karşılık gelen hücre (400 µL) için örnek, örnek şırınga (120 µL) için ikinci iyi (yeşil) karşılık gelir. Üçüncü de boş bırakılır ve karma örnekleri için de deney tamamlanmasının ardından iade edilecektir. Deneyler 1, 2 ve 7 arabellek arabellek denetimlere uygulanır. Deney 3-5 onaylatılacak deneyler glikoprotein (P) ile hücre ve Fab veya ligand (L) içinde belgili tanımlık tenkıye temsil eder. Deney 6 bir ligand ısı seyreltme denetiminin temsil eder ve 3-5 deneylerden veri çözümlemesi sırasında düşülen. Alt paneli: Temsilcisi ham (üst) ve CD22 ECD için bağlama Fab (epratuzumab) gösterilen işlenmiş (alt) ITC verileri HEK293F hücrelerinde üretilen. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tartışmalar
Glikoproteinlerin membran bağlantılı hücre işlevi için kritik olan ve çekici tedavi hedefleridir. Burada, biz hem tek başına hem de karmaşık küçük molekül ligandlar ile bir protokol membran glikoproteinlerin, ECD yapısal ve biyofiziksel karakterizasyonu için mevcut ve Fab parçaları. Üç N-terminal-çoğu IG etki alanları insan CD2228, kritik bir eş reseptör B hücreleri humoral bağışıklık onay79' tutmak için ilgili ekstraselüler bölümünün kristal yapısını belirlemek için bu iletişim kuralı başarıyla kullanmıştır. Ayrıca CD22 bağlama site onun doğal ligand α2-6 sialyllactose ile karakterize ve terapötik bir antikor insan CD22 doğru tanıma modu tanımlanır. Bu sonuçlar anahtar ifade B hücreleri ve yeni CD22 hedeflenen küçük molekül ve antikor tabanlı geliştirme doğru moleküler bir yol haritası üzerinde sınırlı sahip Siglecs ailesi üyesi yapısı-işlev ilişki içine anlayışlar sağlar tedavi. Bu iletişim kuralı başarıyla IG içeren B hücre reseptörü için kullanılan iken, bizim yaklaşım herhangi bir membran glikoprotein ayrı etki alanı organizasyon ile yapısal ve biyofiziksel karakterizasyonu için uygulanabilir öneriyorum. Bu gibi durumlarda, tasarım ve kombinatorik glycan N bağlı mutasyonlar (ya Gln veya Ala) bir yapı kristal büyüme ve yüksek çözünürlüklü kırınımı için uygun bulmak için değerlendirilebilir oluşturmak.
Homojen ve saf glikoprotein örnek alma kristal büyüme ve x-ışını kırınım, yanı sıra aşağı akım biyofiziksel karakterizasyonu için kritik önem taşıyor. N bağlı glukanlardir glikoproteinlerin üzerinde mevcut doğal olarak heterojen ve konformasyon ve kimyasal heterojenite kristal oluşumu caydırmak olabilir glikoprotein içinde neden olabilir. Bu mikro-heterojenite azaltmak için nokta mutasyonlar N bağlı glukanlardir veya endoglycosidases (örneğin, EndoH) ile tedavi ardından mutant hücre hatları (örneğin, HEK293S) kullanarak liman tahmin Asn artıkları kaldırmak için tanıtmak stratejileri önemli ölçüde yapabilirsiniz kristalizasyon başarı15,21,22geliştirmek. Bu protokol için biz çözünür glikoproteinlerin ve süpernatant hücreye salgılanan Fabs arıtma tartışıyorlar. Glikoprotein salgı saflık, hücre lizis ihtiyacını veya sert kimyasallar veya deterjanlar ilavesi olmadan doğru nispeten basit bir yol sağlar. Hücre süpernatant olarak elde edilen aşağıdaki hücre hasat daha sonra doğrudan faiz (Örneğin, Ni-NTA glikoproteinlerin O'nun öğesini veya LC benzeşme Fab parçaları için) protein için ilgi olan bir sütun üzerinde çalıştırın. Ancak, kullanım ve hücre süpernatant (Örneğin, pH) koşullarının sütun bağlı olarak protein ilgi sütun bağlama özelliğiyle etkilenip etkilenmedikleri sınanmamıştır. Bu durumda ise, konsantre ve arabellek sütuna bağlama geliştirmek için exchange süpernatant hücre gerekli olabilir. Ayrıca, kalite kontrol adımları arıtma sırasında protein saflık değerlendirmek yardımcı olmak için istihdam edilmelidir önerilir. SDS-sayfa jel veya Western blot (önce sırasında ve sonrasında arıtma adımları) tüm örneklerinin çalışan önerilen arıtma düzeni faiz protein için uygun olup içine anlayışlar yol açabilir. Bulaşıcı bantları SDS-sayfasında görünür durumdaysa veya çeşitli türlerin arıtma sırasında aldıysanız (Örneğin, boyut dışlama üzerinde birkaç tepeler), ek arıtma adımları kabul edilmelidir, Örneğin, İyon Kromatografi elde etmek için saflık ve artış bir şansa aşağı akım kristalizasyon80.
Makromoleküllerin kristalizasyon için uygun kristal bulmak için çok sayıda potansiyel kristalizasyon koşullarında yüksek protein konsantrasyonları tarama için izin ilgi protein yüksek verim elde etmek için önemlidir. Genel olarak, burada ele HEK293 hücre hatları (HEK293F ve HEK293S) güçlü ifade sistemlerdir ve kolayca daha fazla örnek gerekli üretmek için ölçeklendirilebilir. Ancak, faiz protein yeterince bu hücre satırları içinde ifade değil mümkündür. Bu durumda Expi293 hücreleri81,82gibi diğer hücre hatları protein ifade üstün düzeyde göstermek için bulduk ve alternatif olarak düşünülmelidir.
İyi, diffracting kristalleri protein yüksek saflıkta rağmen ilgi çeşitli yapıları, test takip elde değil, kristal oluşumu tanıtmak için kristalizasyon teknikleri genişletmek için gerekli olabilir. Bu antikorlar ve nanobodies Fab parçaları mükemmel kristalizasyon arttırıcılar olması ve iyi sipariş edilen Kristal83,84,85ambalaj teşvik gösterilmiştir. Bu parçaları dile getirdi ve homojenliği için saflaştırılmış ve protein ilgi ile birlikte kristalizasyon tanıtmak için kullanılır. Önemlisi, Bölüm 10'açıklandığı gibi üretilen Fab parçaları işlevsel olmayan LC dimer86oluşturmak için bir eğilim olabilir. Bu dimer kirletici vardır ve arıtma sırasında kaldırılmalıdır. Bizim deneyim, LC dimer kez farklı saklama birimi boyutu dışlama üzerinde veya İyon Kromatografi üzerinde farklı bir zirve olarak elute ve bu her zaman böyle değildir ancak Fab arıtma - böylece kaldırılabilir. Bu teknikler LC dimer Fab arıtma kaldırmak yetersiz ise, Protein G benzeşme arıtma gibi ek arıtma yöntemleri saflık geliştirmek için istihdam edilebilir.
Seçimli-e doğru co-complexation Fab parçaları ile rastgele matrix microseeding gibi iyi belgelenmiş teknikleri iyi kristalleri63,70elde etme şansını artırabilir. Bu yöntem, ezilmiş, suboptimal kristalleri az miktarda ek bir kristal kristal büyümeyi desteklemek için nucleate sağlayan kristalizasyon durum içine içerir. Bu ilgi, ya da olanlar benzer etki alanı mimarisi ve üçüncül yapısı ile protein kristalleri kullanılarak gerçekleştirilebilir. Ayrıca, rasgele matris microseeding yalnız protein kristalize girişimlerini veya karmaşık bir Fab parçası veya ilgi küçük molekül ile gerçekleştirilebilir. Cryo-elektron mikroskobu son gelişmeler de bu tekniği uygun özellikleri87,88moleküller için yüksek çözünürlüklü yapısal bilgi elde etmek için x-ışını kristalografisi için cazip bir alternatif yapmak, 89,90,91.
X-ışını kırınım datasets phasing Bay tarafından başarısız olduğunda, iliklerine kadar HA faz sorunu çözmek için anormal dağılım veya isomorphous yedek tarafından gerekli olabilir. Proteinin amino asit dizisi incelenmesi HA derivatization, bağlama için optimum pH da dahil olmak üzere için strateji hakkında ipuçları sağlar. Özellikle, protein içinde unpaired katıldı özellikle cıva içeren HA bileşikler bağlayabilirsiniz. HA bileşikler ile yerel kristalleri iliklerine kadar en iyi HA bileşik kimliğinin, onun konsantrasyonu ve gerekli kuluçka zamanı belirlemek için yinelemeli bir işlemdir. İlk iliklerine girişimleri iyi diffracting kristalleri HA phasing için uygun içeren pes ediyor musun, amino asit oyuncu değişikliği HA bağlama olasılığı geliştirmek ve anormal sinyal artırmak için tanıtmak için gerekli olabilir. Örnek verilebilir mutasyonlar için kapsamlı bir şekilde anormal phasing için kullanılıyor anormal E. coli seleno-metiyonin desteklenen medyada phasing Hg, Au, Pt veya ifade Pb. proteinlerin verimli bir şekilde bağlamak için ücretsiz sistein kalıntıları içerir ancak bir güvenilir seleno-metionin içerir eşdeğer sistem süspansiyon92,93memeli hücrelerinde için değildir ve gelecekteki gelişme alanıdır.
Faiz glikoprotein unliganded yapısını alındıktan sonra küçük molekül ligandlar kristallerle iliklerine bağışıklık reseptör-ligand kompleks bir yapı elde etmek için gerçekleştirilebilir. Bu veriler bir plan küçük molekül tedavi kullanılabilir yanı sıra yüksek çözünürlüklü anlayışlar glikoprotein biyolojik fonksiyonu sağlar daha belirli ve yüksek-benzeşme ligandlar rasyonel tasarım sağlar. Küçük molekül ligandlar ilgi kristallerle glikoprotein emmek çalışırken, unliganded kristal yapısı incelenmesi iliklerine kadar mümkün olup olmayacağını belirtebilirsiniz. Eğer yakın kristal ambalaj kişiler ligand bağlayıcı sitenin etrafında bulunur veya konformasyon değişiklikleri ligand bağlayıcı üzerine geçmesi beklenen bölgeler muhtemelen iliklerine kadar sorunlu. Bu durumda, eş kristalizasyon protein-ligand kompleks gibi diğer yöntemleri uygulanmalıdır.
Açıklamalar
Yazarlar hiçbir rakip ilgi bildirin.
Teşekkürler
X-ışını kırınım deneyler Bu yazıda açıklanan gerçekleştirilen beamlines 08-ID ve 08-BM Kanada ışık yenilik, Doğa Bilimleri ve Mühendislik Araştırma Konseyi Kanada Kanada Vakfı tarafından desteklenen, kaynakta, kullanma Saskatchewan Üniversitesi, Saskatchewan, Kanada Batı ekonomik çeşitlendirme, Ulusal Araştırma Konseyi Kanada ve Kanada Sağlık araştırma enstitüleri hükümeti. Yapısal ve biyofiziksel çekirdek tesis, hastane hasta çocuklar için erişim ITC ve saçınıza aletler için kabul etmek istiyoruz. J.E.O. tarafından Banting doktora sonrası bursu BPF-144483 Kanada Sağlık araştırma enstitüleri desteklenmiştir. T.S. olduğunu bir alıcı bir Kanada Yüksek Lisans Burs Master'ın ödülü ve Kanada Sağlık araştırma enstitüleri Vanier Kanada Yüksek Lisans Burs. Bu eser hibe Kanada Sağlık araştırma enstitüleri PJT-148811 (J.-P.J.) işletim tarafından desteklenmiştir. Bu araştırma, kısmen, Kanada araştırma sandalye program (J.-P.J.)fon sayesinde yapılmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 μm Steritop filter | EMD Millipore | SCGPS02RE | |
| 10 well 4-15% gradient SDS-PAGE gel | Bio-Rad | 4561084 | |
| 10x glycobuffer 3 | New England Biolabs | P0702S | Comes with Endo H reagent |
| 10x Kinetics Buffer | PALL FortéBio | 18-1092 | |
| 10x Tris/Glycine/SDS Buffer | Bio-Rad | 1610732 | |
| 1 mL round bottom 96 well block | ThermoFisher | 260251 | |
| 22 mm cover slip | Hampton research | HR3-231 | |
| 4x Laemmli Sample Buffer | Bio-Rad | 1610747 | |
| 96-3 well INTELLIPLATE low volume reservior | Art Robbins Instruments | 102-0001-03 | |
| AgeI | New England Biolabs | R0552S | |
| ÄKTA Pure | GE Healthcare | ||
| ÄKTA Start | GE Healthcare | ||
| Amicon Ultra 15 centrifugal filtration device 10KDa MWCO | Millipore | UFC901008 | |
| Amicon Ultra 4 centrifugal filtration device 10KDa MWCO | Millipore | UFC801008 | |
| Auto-iTC200 | Malvern | ||
| Axygen MaxyClear Snaplock 1.5 mL microtubes | Fisher Scientific | MCT150C | |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| CryoLoop 18 x 0.05-0.1 mm | Hampton research | HR4-945 | |
| CryoLoop 18 x 0.1-0.2 mm | Hampton research | HR4-947 | |
| CryoLoop 18 x 0.2-0.3 mm | Hampton research | HR4-970 | |
| Digital Dry Bath | Bio-Rad | 1660562EDU | |
| E. coli DH5α | Invitrogen | 18258012 | |
| Endo H | New England Biolabs | P0702S | |
| Erlenmeyer flask (baffled base), polycarbonate, sterile, 500 mL, DuoCAP | TriForest Labware | FBC05000S | |
| Erlenmeyer flask 125 mL (baffled base), polycarbonate, sterile, 125 mL with vented cap | VWR | 89095-258 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 10 mL | Greiner Bio-One | 607180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 25 mL | Greiner Bio-One | 760180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 5 mL | Greiner Bio-One | 606180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 50 mL | Greiner Bio-One | 768180 | |
| FectoPRO DNA Transfection Reagent, Polyplus | VWR | 10118-842 | |
| Freestyle 293F cells | Thermo Fisher Scientific | R79007 | |
| Freestyle Expression medium | Thermo Fisher Scientific | 12338001 | |
| Heavy Atom Screens Au | Hampton research | HR2-444 | |
| Heavy Atom Screens Hg | Hampton research | HR2-446 | |
| Heavy Atom Screens M1 | Hampton research | HR2-448 | |
| Heavy Atom Screens M2 | Hampton research | HR2-450 | |
| Heavy Atom Screens Pt | Hampton research | HR2-442 | |
| HEK 293S | ATCC | ATCC CRL-3022 | |
| HisTrap Affinity Column | GE Healthcare | 17525501 | |
| HiTrap KappaSelect Affinity Columns | GE Healthcare | 17545811 | |
| HiTrap LambdaSelect Affinity Columns | GE Healthcare | 17548211 | |
| KpnI | New England Biolabs | R0142S | |
| MCSG-1 Crystal Screen 1.7 mL block | Anatrace | MCSG-1 | |
| MCSG-2 Crystal Screen 1.7 mL block | Anatrace | MCSG-2 | |
| MCSG-3 Crystal Screen 1.7 mL block | Anatrace | MCSG-3 | |
| MCSG-4 Crystal Screen 1.7 mL block | Anatrace | MCSG-4 | |
| Mercuric chloride | Sigma | 1044170100 | |
| Microplate, 96 well, polypropelene, flat bottom, black | Greiner Bio-One | 655209 | |
| Minstrel DT UV | Formulatrix | ||
| Multitron Pro shaker | Infors HT | MP25-TA-CO2HB | |
| Nanodrop 2000/2000c Spectrophotometer | Thermo Fisher Scientific | ND-2000 | |
| Nanosep 3K Omega centrifugal device | PALL Life Science | OD003C33 | |
| Ni-NTA biosensors | PALL FortéBio | 18-5102 | |
| Octet RED96 | PALL ForteBio | ||
| Oryx 4 crystallizaiton robot | Douglas Instrument | ORY-4/1 | |
| Platinum chloride | Sigma | 520632-1g | |
| Precision Plus Protein Standard | Bio-Rad | 161-0374 | |
| PureLink HiPure Plasmid Maxiprep Kit | Invitrogen | K210006 | |
| Quick Coomassie Stain | Protein Ark | GEN-QC-STAIN-1L | |
| Steriflip Sterile 50 mL Disposable Vacuum Filtration System 0.22 µm Millipore Express | EMD Millipore | SCGP00525 | |
| Superdex 200 Increase 10/300 GL | GE Healthcare | 28990944 | |
| Superose 6 10/300 GL | GE Healthcare | 17517201 | |
| Tantalum bromide cluster | Jena bioscience | PK-103 | |
| Top96 Crystallization Screen | Rigaku Reagents | 1009846 | |
| Tryphan Blue | Thermo Fisher Scientific | T10282 | |
| VDX 24-well with sealant | Hampton research | HR3-172 | |
| α2-6 sialyllactose | Sigma Aldrich | A8556-1mg |
Referanslar
- Sachs, J. N., Engelman, D. M. Introduction to the membrane protein reviews: The interplay of structure, dynamics, and environment in membrane protein function. Annu Rev Biochem. 75 (1), 707-712 (2006).
- Cournia, Z., et al. Membrane protein structure, function, and dynamics: A perspective from experiments and theory. J Membr Biol. 248 (4), 611-640 (2015).
- Macauley, M. S., et al. Antigenic liposomes displaying CD22 ligands induce antigen-specific B cell apoptosis. J Clin Invest. 123 (7), 3074-3083 (2013).
- Hyde, C. A. C., et al. Targeting extracellular domains D4 and D7 of vascular endothelial growth factor receptor 2 reveals allosteric receptor regulatory sites. Mol Cell Biol. 32 (19), 3802-3813 (2012).
- Tai, W., Mahato, R., Cheng, K. The role of HER2 in cancer therapy and targeted drug delivery. J Control Release. 146 (3), 264-275 (2010).
- Zarei, O., Benvenuti, S., Ustun-Alkan, F., Hamzeh-Mivehroud, M., Dastmalchi, S. Strategies of targeting the extracellular domain of RON tyrosine kinase receptor for cancer therapy and drug delivery. J Cancer Res Clin Oncol. 142 (12), 2429-2446 (2016).
- Rosman, Z., Shoenfeld, Y., Zandman-Goddard, G. Biologic therapy for autoimmune diseases: an update. BMC Med. 11 (1), 88(2013).
- Lander, E. S., et al. Initial sequencing and analysis of the human genome. Nature. 409 (6822), 860-921 (2001).
- Barclay, A. N. Membrane proteins with immunoglobulin-like domains - A master superfamily of interaction molecules. Semin Immunol. 15 (4), 215-223 (2003).
- Barclay, A. N. Ig-like domains: evolution from simple interaction molecules to sophisticated antigen recognition. Proc Natl Acad Sci. 96 (26), 14672-14674 (1999).
- Aebi, M. N-linked protein glycosylation in the ER. Biochim Biophys Acta - Mol Cell Res. 1833 (11), 2430-2437 (2013).
- Ohtsubo, K., Marth, J. D. Glycosylation in cellular mechanisms of health and disease. Cell. 126 (5), 855-867 (2006).
- Lodish, H., Berk, A., Zipursky, S., Al, E. Glycosylation in the ER and Golgi complex. Mol Cell Biol. (4), Section 17.7 (2000).
- Thomas, P., Smart, T. G. HEK293 cell line: A vehicle for the expression of recombinant proteins. J Pharmacol Toxicol Methods. 51 (3), 187-200 (2005).
- Lee, J. E., Fusco, M. L., Ollmann Saphire, E. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nat Protoc. 4 (4), 592-604 (2009).
- Betenbaugh, M. J., Tomiya, N., Narang, S., Hsu, J. T. A., Lee, Y. C. Biosynthesis of human-type N-glycans in heterologous systems. Curr Opin Struct Biol. 14 (5), 601-606 (2004).
- Yang, Z., et al. Engineered CHO cells for production of diverse, homogeneous glycoproteins. Nat Biotechnol. 33 (8), 842-844 (2015).
- Bláha, J., Kalousková, B., Skořepa, O., Pažický, S., Novák, P., Vaněk, O. High-level expression and purification of soluble form of human natural killer cell receptor NKR-P1 in HEK293S GnTI-cells. Protein Expr Purif. 140, 36-43 (2017).
- Bláha, J., Pachl, P., Novák, P., Vaněk, O. Expression and purification of soluble and stable ectodomain of natural killer cell receptor LLT1 through high-density transfection of suspension adapted HEK293S GnTI- cells. Protein Expr Purif. 109, 7-13 (2015).
- Chaudhary, S., Pak, J. E., Gruswitz, F., Sharma, V., Stroud, R. M. Overexpressing human membrane proteins in stably transfected and clonal human embryonic kidney 293S cells. Nat Protoc. 7 (3), 453-466 (2012).
- Chang, V. T., et al. Glycoprotein structural genomics: Solving the glycosylation problem. Structure. 15 (3), 267-273 (2007).
- Davis, S. J., Crispin, M. Solutions to the glycosylation problem for low- and high-throughput structural glycoproteomics. Funct Struct Proteomics Glycoproteins. , 127-158 (2011).
- Elbein, A. D., Tropea, J. E., Mitchell, M., Kaushal, G. P. Kifunensine, a potent inhibitor of the glycoprotein processing mannosidase I. J Biol Chem. 265 (26), 15599-15605 (1990).
- Zheng, K., Bantog, C., Bayer, R. The impact of glycosylation on monoclonal antibody conformation and stability. MAbs. 3 (6), 568-576 (2011).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta Crystallogr Sect D Biol Crystallogr. 62 (10), 1243-1250 (2006).
- Adams, P. D., et al. The Phenix software for automated determination of macromolecular structures. Methods. 55 (1), 94-106 (2011).
- May, A. P., Robinson, R. C., Vinson, M., Crocker, P. R., Jones, E. Y. Crystal structure of the N-terminal domain of sialoadhesin in complex with 3' sialyllactose at 1.85 Å resolution. Mol Cell. 1 (5), 719-728 (1998).
- Ereño-Orbea, J., et al. Molecular basis of human CD22 function and therapeutic targeting. Nat Commun. 8 (1), 764(2017).
- Yu, X. -L., et al. Crystal structure of HAb18G/CD147: implications for immunoglobulin superfamily homophilic adhesion. J Biol Chem. 283 (26), 18056-18065 (2008).
- Garman, E., Murray, J. W. Heavy-atom derivatization. Acta Crystallogr - Sect D Biol Crystallogr. 59 (11), 1903-1913 (2003).
- Agniswamy, J., Joyce, M. G., Hammer, C. H., Sun, P. D. Towards a rational approach for heavy-atom derivative screening in protein crystallography. Acta Crystallogr Sect D Biol Crystallogr. 64 (4), 354-367 (2008).
- Rose, J. P., Wang, B. C., Weiss, M. S. Native SAD is maturing. IUCrJ. 2 (20), 431-440 (2015).
- Olieric, V., et al. Data-collection strategy for challenging native SAD phasing. Acta Crystallogr Sect D Struct Biol. 72 (3), 421-429 (2016).
- Rillahan, C. D., et al. Disubstituted sialic acid ligands targeting Siglecs CD33 and CD22 associated with myeloid leukaemias and B cell lymphomas. Chem Sci. 5 (6), 2398-2406 (2014).
- Mesch, S., et al. From a library of MAG antagonists to nanomolar CD22 ligands. ChemMedChem. 7 (1), 134-143 (2012).
- Chiu, M. L., Gilliland, G. L. Engineering antibody therapeutics. Curr Opin Struct Biol. 38, 163-173 (2016).
- Elgundi, Z., Reslan, M., Cruz, E., Sifniotis, V., Kayser, V. The state-of-play and future of antibody therapeutics. Adv Drug Deliv Rev. 122 (2016), 2-19 (2017).
- Yang, D., Singh, A., Wu, H., Kroe-Barrett, R. Determination of high-affinity antibody-antigen binding kinetics using four biosensor platforms. J Vis Exp. (122), e55659(2017).
- Kamat, V., Rafique, A. Designing binding kinetic assay on the bio-layer interferometry (BLI) biosensor to characterize antibody-antigen interactions. Anal Biochem. 536, 16-31 (2017).
- Brautigam, C. A., Zhao, H., Vargas, C., Keller, S., Schuck, P. Integration and global analysis of isothermal titration calorimetry data for studying macromolecular interactions. Nat Protoc. 11 (5), 882-894 (2016).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J Vis Exp. (55), e2796(2011).
- Livingstone, J. R. Antibody characterization by isothermal titration calorimetry. Nature. 384 (6608), 491-492 (1996).
- Freyer, M. W., Lewis, E. A. Isothermal titration calorimetry: Experimental design, data analysis, and probing macromolecule/ligand binding and kinetic interactions. Methods Cell Biol. 84, 79-113 (2008).
- Macauley, M. S., Crocker, P. R., Paulson, J. C. Siglec-mediated regulation of immune cell function in disease. Nat Rev Immunol. 14 (10), 653-666 (2014).
- Zaccai, N. R., et al. Structure-guided design of sialic acid-based Siglec inhibitors and crystallographic analysis in complex with sialoadhesin. Structure. 11 (5), 557-567 (2003).
- Pantophlet, R., et al. Bacterially derived synthetic mimetics of mammalian oligomannose prime antibody responses that neutralize HIV infectivity. Nat Commun. 8 (1), 1601(2017).
- Leonard, J. P., et al. Epratuzumab, a humanized anti-CD22 antibody, in aggressive non-Hodgkin's lymphoma: phase I/II clinical trial results. Clin Cancer Res. 10 (16), 5327-5334 (2004).
- Finn, R. D., et al. InterPro in 2017-beyond protein family and domain annotations. Nucleic Acids Res. 45, 190-199 (2017).
- Kelley, L. A., Mezulis, S., Yates, C. M., Wass, M. N., Sternberg, M. J. E. The Phyre2 web portal for protein modeling, prediction and analysis. Nat Protoc. 10 (6), 845-858 (2015).
- Lessard, J. C. Molecular cloning. Methods Enzymol. 529, 85-98 (2013).
- Gupta, R., Jung, E., Brunak, S. NetNGlyc: Prediction of N-glycosylation sites in human proteins. , (2004).
- Liu, H., Naismith, J. H. An efficient one-step site-directed deletion, insertion, single and multiple-site plasmid mutagenesis protocol. BMC Biotechnol. 8, 91(2008).
- Heckman, K. L., Pease, L. R. Gene splicing and mutagenesis by PCR-driven overlap extension. Nat Protoc. 2 (4), 924-932 (2007).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J Vis Exp. (6), e253(2007).
- Akula, I., Julien, J. -P. Optimization of glycoprotein expression by transient transfection in HEK293 F/S suspension cells. , Available from: https://www.polyplus-transfection.com/wp-content/uploads/2015/09/FectoPRO-Technical-Note-031716.pdf (2015).
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Mol Biotechnol. 55 (3), 217-226 (2013).
- Tan, H. Y., Ng, T. W. Accurate step wedge calibration for densitometry of electrophoresis gels. Opt Commun. 281 (10), 3013-3017 (2008).
- Gassmann, M., Grenacher, B., Rohde, B., Vogel, J. Quantifying Western blots: pitfalls of densitometry. Electrophoresis. 30 (11), 1845-1855 (2009).
- Jonnalgadda, K., Markley, L., Estes, S., Prajapati, S., Takkar, R., Kumaraswamy, S. Rapid, reliable quantitation of Fc-fusion protein in cell culture supernatants. , Available from: https://www.fortebio.com/documents/ForteBio_App_Note_13.pdf (2018).
- JoVE Science Education Database. Basic methods in cellular and molecular biology: Separating protein with SDS-PAGE. J Vis Exp. , (2018).
- Wilkins, M. R., et al. Protein identification and analysis tools in the ExPASy server. Methods Mol Biol. 112, 531-552 (1999).
- Till, M., et al. Improving the success rate of protein crystallization by random microseed matrix screening. J Vis Exp. (78), e50548(2013).
- Obmolova, G., Malia, T. J., Teplyakov, A., Sweet, R., Gilliland, G. L. Promoting crystallization of antibody-antigen complexes via microseed matrix screening. Acta Crystallogr Sect D Biol Crystallogr. 66 (8), 927-933 (2010).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallogr Sect F, Struct Biol Commun. 70 (9), 1117-1126 (2014).
- Luft, J. R., et al. Efficient optimization of crystallization conditions by manipulation of drop volume ratio and temperature. Protein Sci. 16 (4), 715-722 (2007).
- Dessau, M. A., Modis, Y. Protein crystallization for X-ray crystallography. J Vis Exp. (47), e2285(2011).
- Sugahara, M., Asada, Y., Ayama, H., Ukawa, H., Taka, H., Kunishima, N. Heavy-atom Database System: A tool for the preparation of heavy-atom derivatives of protein crystals based on amino-acid sequence and crystallization conditions. Acta Crystallogr D Biol Crystallogr. 61 (9), 1302-1305 (2005).
- Boggon, T. J., Shapiro, L. Screening for phasing atoms in protein crystallography. Structure. 8 (7), 143-149 (2000).
- Vera, L., Stura, E. A. Strategies for protein cryocrystallography. Cryst Growth Des. 14 (2), 427-435 (2014).
- Pichlo, C., Montada, A. A., Schacherl, M., Baumann, U. Production, crystallization and structure determination of C. difficile PPEP-1 via microseeding and Zinc-SAD. J Vis Exp. (118), e55022(2016).
- Leslie, A. G. W., et al. Automation of the collection and processing of X-ray diffraction data - a generic approach. Acta Crystallogr Sect D Biol Crystallogr. 58 (11), 1924-1928 (2002).
- Pike, A. C. W., Garman, E. F., Krojer, T., Von Delft, F., Carpenter, E. P. An overview of heavy-atom derivatization of protein crystals. Acta Crystallogr Sect D Struct Biol. 72 (3), 303-318 (2016).
- Cooper, D. R., Porebski, P. J., Chruszcz, M., Minor, W. X-ray crystallography: Assessment and validation of protein-small molecule complexes for drug discovery. Expert Opin Drug Discov. 6 (8), 771-782 (2011).
- Hassell, A. M., et al. Crystallization of protein-ligand complexes. Acta Crystallogr Sect D Biol Crystallogr. 63 (1), 72-79 (2006).
- Muller, I., et al. Guidelines for the successful generation of protein-ligand complex crystals. Acta Crystallogr Sect D Struct Biol. 73 (2), 79-92 (2017).
- Zhao, Y., et al. Two routes for production and purification of Fab fragments in biopharmaceutical discovery research: Papain digestion of mAb and transient expression in mammalian cells. Protein Expr Purif. 67 (2), 182-189 (2009).
- Shah, N. B., Duncan, T. M. Bio-layer interferometry for measuring kinetics of protein-protein interactions and allosteric ligand effects. J Vis Exp. (84), e51383(2014).
- Terwilliger, T. C., et al. Iterative model building, structure refinement and density modification with the PHENIX AutoBuild wizard. Acta Crystallogr Sect D Biol Crystallogr. 64 (1), 61-69 (2008).
- Walker, J. A., Smith, K. G. C. CD22: An inhibitory enigma. Immunology. 123 (3), 314-325 (2008).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Jain, N. K., et al. A high density CHO-S transient transfection system: Comparison of ExpiCHO and Expi293. Protein Expr Purif. 134, 38-46 (2017).
- Fang, X. T., Sehlin, D., Lannfelt, L., Syvänen, S., Hultqvist, G. Efficient and inexpensive transient expression of multispecific multivalent antibodies in Expi293 cells. Biol Proced Online. 19 (1), 11(2017).
- Löw, C., et al. Nanobody mediated crystallization of an archeal mechanosensitive channel. PLoS One. 8 (10), 77984(2013).
- Hunte, C., Michel, H. Crystallization of membrane proteins mediated by antibody fragments. Curr Opin Struct Biol. 12 (4), 503-508 (2002).
- Ereño-Orbea, J., Sicard, T., Cui, H., Carson, J., Hermans, P., Julien, J. -P. Structural basis of enhanced crystallizability induced by a molecular chaperone for antibody antigen-binding fragments. J Mol Biol. 430 (3), 322-336 (2018).
- Spooner, J., et al. Evaluation of strategies to control Fab light chain dimer during mammalian expression and purification: A universal one-step process for purification of correctly assembled Fab. Biotechnol Bioeng. 112 (7), 1472-1477 (2015).
- Elmlund, D., Le, S. N., Elmlund, H. High-resolution cryo-EM: The nuts and bolts. Curr Opin Struct Biol. 46, 1-6 (2017).
- Merk, A., et al. Breaking cryo-EM resolution barriers to facilitate drug discovery. Cell. 165 (7), 1698-1707 (2016).
- Bai, X. C., McMullan, G., Scheres, S. H. W. How cryo-EM is revolutionizing structural biology. Trends Biochem Sci. 40 (1), 49-57 (2015).
- Wlodawer, A., Li, M., Dauter, Z. High-resolution cryo-EM maps and models: A crystallographer's perspective. Structure. 25 (10), 1589-1597 (2017).
- Bartesaghi, A., et al. 2.2 Å resolution cryo-EM structure of β-galactosidase in complex with a cell-permeant inhibitor. Science. 348 (6239), 1147-1151 (2015).
- Hendrickson, W. a, Horton, J. R., LeMaster, D. M. Selenomethionyl proteins produced for analysis by multiwavelength anomalous diffraction (MAD): A vehicle for direct determination of three-dimensional structure. EMBO J. 9 (5), 1665-1672 (1990).
- Walden, H. Selenium incorporation using recombinant techniques. Acta Crystallogr Sect D Biol Crystallogr. 66 (4), 352-357 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır