Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Çekirdek ve sitoiskeleti mekanik bütünleşmesi ölçmek için bir doğrudan kuvvet sonda
Bu Makalede
Özet
Bu protokol için doğrudan bir yaşam Hücre çekirdeğinde kontrollü bir kuvvet uygulamak için micropipette yöntemi açıklanmaktadır. Bu tahlil sorgulama yaşayan, yapisan hücredeki nükleer mekanik özellikleri sağlar.
Özet
Çekirdeği mekanik özellikleri mekanik Kuvvetleri hücrelerinde üretilen onun yanıt belirler. Çekirdek ile sitoiskeleti tatlı sürekli olduğundan, yöntemleri mekanik davranışını yapisan hücrelerdeki soruşturma için ihtiyaç vardır. Burada, doğrudan gücü probun (DFP) doğrudan bir yaşam yapisan Hücre çekirdeğinde kuvvet uygulamak için bir araç olarak tartışmak. Emme nükleer yüzeye dar bir micropipette ekleyin. Micropipette deforme ve çevirmek çekirdek neden olan çekirdek uzak çevrilir. Geri yükleme kuvvetleri emiş gücüne eşit olduğunda, çekirdek ayırır ve Melosun rahatlatır. Emiş basıncı kesin olarak bilindiğinden, güç nükleer yüzeyi bilinir. Bu yöntem nano ölçekli güçleri deforme ve yapışık Hücre çekirdeğinde çevirmek için yeterli ve kuvvetler direnmeye çekirdek etkinleştirmek hücre iskeleti elemanlar ortaya koymuştur. DFP hücresel ve nükleer bileşenleri nükleer mekanik özellikleri canlı hücreler'katkılarıyla incelemek için kullanılabilir.
Giriş
Patolojiler kanser gibi nükleer şekli ve yapısı1,2, genellikle bir 'yumuşama' çekirdek3,4tarafından yayımlanır değişiklikleri içerir. Nükleer mekanik deformasyon direnci genellikle izole çekirdeği5' e bir kuvvet uygulayarak karakterize.
Hücre çekirdeğinde tatlı sitoiskeleti için bağlayıcı Nucleoskeleton ve sitoiskeleti (LINC) karmaşık6,7,8,9tarafından bağlanır. Sonuç olarak, çekirdek mekanik sitoiskeleti ile ve hücre-terkedilemeyen yapışıklıklar, hücre dışı matriks ile entegre edilmiştir. Mekanik yapışık hücreleri içinde çekirdek sondalama mekanik Bu entegrasyon içgörü sağlayabilir. Micropipette aspirasyon10,11ve atomik kuvvet mikroskobu12,13,14çekirdeği canlı hücreler içinde işlemek için yöntemler içerir. Biz son zamanlarda bir yaşam yapisan hücre15çekirdeğinde doğrudan mekanik Kuvvetleri uygulandığı bir doğrudan kuvvet sonda (DFP) nitelendirdi.
Burada, mikroskobu tesislerinde doğrudan yapisan bir hücre çekirdeğinde için bilinen, nano ölçekli mekanik kuvvet uygulamak için yaygın olarak kullanılabilir bir mikroenjeksiyon sistemi kullanan yordamı anahat. Bir femtotip (0.5 µm çapı micropipette tıp) monte ve bir tüp tarafından mikroenjeksiyon sisteme bağlı. Kültür çanak yüzeyine göre 45 ° açıyla konumlandırılmış uç, bitişik kadar nükleer yüzeye indirilir. Tüp sonra bağlantısı kesilen ve nükleer yüzeyinde negatif bir emme basınç oluşturur ve nükleer yüzeye karşı micropipette ipucu mühürler atmosfere açtı. Çeviri micropipette uç çekirdeği deforme ve sonunda (büyüklüğü yük bağlı olarak), micropipette ilişkisi kesildi. Bu dekolmanı çekirdek ve hücre, tarafından sarf geri yükleme (dirençli) kuvvetleri micropipette tarafından uygulanan emiş gücü eşit oluşur. Çözümleme yapılır çekirdeği, deplasman ölçerek uzunluğu zorlanma (denklem 1) veya alan zorlanma (Şekil 1A).
Protokol
1. hücre görüntüleme için hazırlanması
Not: Doğrudan gücü probun (DFP) herhangi bir yapisan hücre türü için kullanılabilir. Burada, NIH 3T3 fare fibroblastlar modeli hücre satır olarak bu iletişim kuralı için kullanılır.
- Kültür NIH 3T3 fibroblast hücreleri içinde Dulbecco'nın modifiye kartal Orta (% 10 donör Sığır serum ve % 1 ile DMEM) penisilin-streptomisin 35-mm cam alt çanağı kadar istenen confluency. 37 ° C ve % 5 CO2hücreleri korumak.
- Tüm 35-mm cam alt yemekler 5 µg/mL fibronektin (veya benzer ECM protein) ile NIH 3T3 hücreleri görüntüleme için tohum önce kat emin olun.
Not: Tam hücreleri yaymak gerekir ve yemek için deneme üzerinde yapışık. DFP yöntemin işe yaraması confluency açısından herhangi bir kısıtlama yoktur.
- Tüm 35-mm cam alt yemekler 5 µg/mL fibronektin (veya benzer ECM protein) ile NIH 3T3 hücreleri görüntüleme için tohum önce kat emin olun.
- Deney hemen önce hücreleri iki kez tam büyüme orta ile tek bir yıkama ardından PBS ile yıkayın.
- Tam büyüme orta 3 mL Cam alt yemek için ekleyin.
2. mikroskobu ve resim alma
Not: Bir ters floresans mikroskobu (veya eşdeğeri) ile üreticinin önerilerini göre yan kol için yüklü micromanipulator. Mikroskop da 37 ° C sıcaklıkta ve % 5 CO2 düzeyinde korumak için çevre bir odası ile outfitted. Bir micromanipulator ve microinjector için mikroskop bağlı gereklidir de. Bir petrol daldırma 40 x / 1.3 NA veya 60 x / 1,49 NA (ya da eşdeğer hedefleri) deneyler için tavsiye edilir. Mikroskop bir titreşim yalıtım masaya monte edilmelidir.
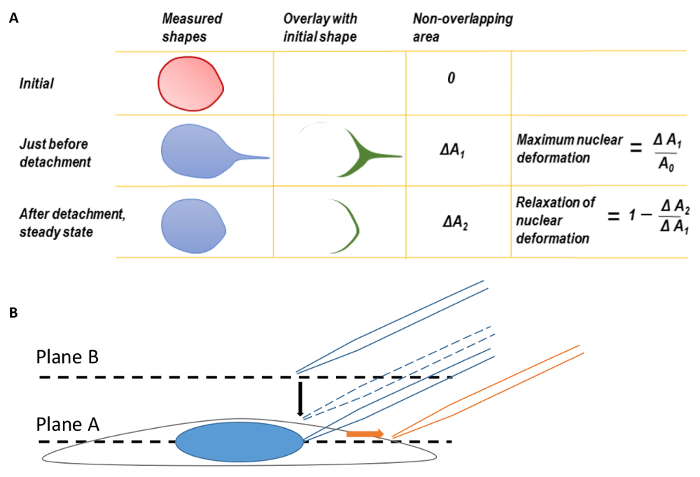
Resim 1 . Nükleer deformasyon ve mikroskop odaklanarak
A. en büyük nükleer deformasyon ve nükleer deformasyon gevşeme. En büyük nükleer deformasyon hesaplamadan önce nükleer şekillerin arka kenarları ilk deforme çekirdeği çeviri için düzeltmek için çakıştı. Micropipette ipucu dekolmanı Şu anda çekirdeğin şekli ilk nükleer şeklin üzerine çekerek önce overlaid. Alan iki şekil arasındaki farkı Δ ölçülmüştürbir1. En büyük nükleer deformasyon ΔA1 orijinal nükleer alanına göre bölünmüş olarak tanımlanmıştır. Benzer şekilde, ikinci bir parametre, ΔA2, son kararlı duruma nükleer şekli özgün nükleer şeklindeki micropipette dekolmanı sonra overlaying tarafından tanımlı. B. hücre uçak A'da odaklanmak ve odak düzlemi micropipette ipucu bulmak için uçak B kadar hareket ettirin. Görüntüleme sırasında micropipette sağa (turuncu ok yönünü) çevrildi. Bu rakam Neelam ve arkdeğiştirildi. 15. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
- Üreticinin iletişim kuralı başına microinjector açın.
- Bir daldırma yağ damlalık kullanmak, Daldırma yağ objektif lens üzerinde tek bir damla uygulanır.
- Çanak sıkıca çanak tutucusuna klamp ve çanak tutucu sahne alanı'na yük.
Not: Hücreleri 37 ° C ve % 5 CO2 deneme boyunca muhafaza edilmelidir. - Hücreleri (Uçak A, Şekil 1B) odak haline getirmek için hedefi yüksekliğini ayarlayın.
- Mikroskop sahne alanı ilgi bir hücreyi bulmak için hareket ederler.
- Oyun çubuğu damlalıklı tutucu üst konuma taşımak için micromanipulator üzerinde döndürün. 0.5 µm çapı uç micropipette damlalıklı tutucu üzerine yükleyin.
- Micropipette için hücre adezyon önlemek için oda sıcaklığında 0.3 mg/mL PLL-g-PEG çözüm 1 h için micropipette ucuyla önceden tedavi. Yapışma için emme herhangi bir baskı olmadan çekirdeği için micropipette dokunmadan da çekirdek uzak micropipette çeviri sınayın. Yapışma yokluğu nükleer deformasyon ve çeviri tam bir eksikliği ayırt edilebilir.
Not: Lütfen paketi açmak için üretim önerileri uygulayın.
- Micropipette için hücre adezyon önlemek için oda sıcaklığında 0.3 mg/mL PLL-g-PEG çözüm 1 h için micropipette ucuyla önceden tedavi. Yapışma için emme herhangi bir baskı olmadan çekirdeği için micropipette dokunmadan da çekirdek uzak micropipette çeviri sınayın. Yapışma yokluğu nükleer deformasyon ve çeviri tam bir eksikliği ayırt edilebilir.
- Objektif odak düzlemi uçak A ve uçak b hücrenin üstüne üzerinde daha iyi denetim ayarlayarak yükseltmek (Şekil 1B, bkz: adım 2.4).
- Micromanipulator kaba denetimine ayarlayın. Tamamen odak haline gelene kadar micropipette micropipette, siluet için izleyerek micropipette uçak B aşağı yavaşça.
- Micropipette ipucu odak olduğunda, micromanipulator iyi denetimine ayarlayın.
- (Uçak A, Şekil 1B) hücrenin Ekvator uçak amaca daha düşük ve micropipette yaklaşık 15 µm (Şekil 1B, kesik micropipette) Uçak A yukarıda için daha düşük.
- Tazminat basınç (Pc) istenilen basınç için microinjector olarak ayarlayın; Basıncı dengelemek için birkaç saniye bekleyin.
Not: Optimum basınç ayar noktası hücre türüne ve denemenin belirli hedeflere göre değişir. Çoğu durumda, 300 hPa iyi bir başlangıç noktası olur. - Micropipette micromanipulator panelde temiz ayarı kullanarak ve hava kabarcıkları micropipette ucundan ortaya emin olmak için kontrol tıkalı değil emin olun.
- Ucu ucunu hafifçe nükleer yüzey dokunuyor kadar yavaş yavaş micropipette düşürerek hücreye yerleştirin.
Not: ne zaman micropipette düşürücü, micropipette ucunu silüeti odak haline gelir olarak açık olacak. Micropipette çekirdek dokunamaz önce objektif odak yükseltmek ve micropipette çekirdeği (aynı x-y koordinatı, daha yüksek z-uçak) ile hizalayın. Odak (uçak A, Şekil 1B) çekirdeği Ekvator uçağa geri dönmek ve yavaş yavaş micropipette ucunu alt. - Bir mühür micropipette uç ve nükleer membran arasında böylece atmosfer micropipette Tüp sonuna açılış mikroenjeksiyon sisteminden basınç kaynağı tüp keserek oluşturun. Bu adım bir negatif basınç nükleer yüzeyde eşit Pc oluşturur.
- Mikroskoplar resim koleksiyonu yazılımı ile görüntüleri elde etmek. AVI-edinme (video) veya nd-edinme (görüntüleri) görüntü collection yazılım ayarlayın.
Not: yazılım edinme herhangi bir görüntüleme için gerçek zamanlı video görüntüleme veya Hızlandırılmış görüntü satın almalar ile bir kısa süre aralığı ayarlayın. - Kanal görüntüleme karşılık gelen floresan için geçiş (Yani, GFP, RFP, vb) ve görüntüleme başlar.
- Micropipette İpucu (sağa doğru Şekil 1B) hücre gövdesinden çekin çevirmek kadar çekirdek micropipette ayırır.
Not: ucu pozitif x-yön boyunca (görüş alanı sağa) çekin. Programlanmış ve bilgisayar tarafından kontrol çekme oranı veya joystick el ile hareket edebilir. Biz çekerek arasında herhangi bir korelasyon bulunmadı oranı ve nükleer deformasyon15 zorlamak için öncelikle elastik bir yanıt düşündüren.
3. veri analizi
- Herhangi bir temel görüntü işleme yazılımı ile görüntü analizi gerçekleştirin. Nükleer deformasyon ölçüde uzunluğu zorlanma (Ɛ) ya da (Şekil 1A) alan zorlanma sayılabilir. Denklem 1, kullanarak uzunluğu zorlanma ölçmek nerede L ve M0 temsil eden en fazla deformasyon ve ilk konum, çekirdeği uzunlukları sırasıyla.
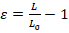 (Denklem 1)
(Denklem 1)
Sonuçlar
Şekil 2A bir NIH 3T3 fare fibroblast çekirdeği zorlayarak gösterir. Micropipette ucunu sağa çevrilir, çekirdeği deforms ve sonunda micropipette ucundan ayırır. Çekirdek uzunluğu suşu emiş gücü (Şekil 2B) ile artacaktır görülmektedir. Çekirdeği (kenar çekerek micropipette) ön kenarındaki nükleer bir çıkıntı oluşturan ve trailing edge özgün konumundan yerinden olduğunu. Çıkıntı uzunluğu çekir...
Tartışmalar
(Çekirdek nerede sitoiskeleti bilgisini iletmiyor) her iki izole çekirdeği gerektirdiğinden sitoiskeleti çekirdekle mekanik entegrasyonu ölçme micropipette aspirasyon16gibi en yeni yöntemleri için bir meydan okuma olduğunu veya çekirdekleri askıya alınmış hücrelerindeki (hücre dışı güçleri, çekiş güçleri gibi eksik durumda). Güç çekirdeğine hücre yapışık bir membran17,18biaxial baskı uygulayarak uygulanm?...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu eser NIH R01 EB014869 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| FluoroDish | WPI | FD35 | |
| SYTO 59 | ThermoFisher Scientific | S11341 | |
| Femtotips | Eppendorf | 930000043 | |
| InjectMan NI2 | Eppendorf | NA | discontinued, current equivalent model: InjectMan 4 |
| FemtoJet | Eppendorf | NA | Current model FemtoJet 4i |
| Plan Fluor oil immersion 40x | Nikon | NA | |
| Apo TIRF oil immersion 60x | Nikon | NA | |
| Donor Bovine Serum (DBS) | ThermoFisher Scientific | 16030074 | NIH 3T3 serum |
| Dulbecco's Modification of Eagle's (DMEM) | Mediatech cellgro | MT10013CVRF | NIH 3T3 medium |
| Penicillin-Streptomycin | Mediatech | MT30004CIRF | NIH 3T3 medium supplement |
| Immersion Oil Type LDF Non-Fluorescing | Nikon | 77007 | Immersion oil for objective lens |
Referanslar
- Chow, K. H., Factor, R. E., Ullman, K. S. The nuclear envelope environment and its cancer connections. Nature Reviews Cancer. 12 (3), 196-209 (2012).
- Zink, D., Fischer, A. H., Nickerson, J. A. Nuclear structure in cancer cells. Nature Reviews Cancer. 4 (9), 677-687 (2004).
- Bank, E. M., Gruenbaum, Y. The nuclear lamina and heterochromatin: a complex relationship. Biochemical Society Transactions. 39 (6), 1705-1709 (2011).
- Lammerding, J., et al. Lamins A and C but not lamin B1 regulate nuclear mechanics. Journal of Biological Chemistry. 281 (35), 25768-25780 (2006).
- Dahl, K. N., Engler, A. J., Pajerowski, J. D., Discher, D. E. Power-law rheology of isolated nuclei with deformation mapping of nuclear substructures. Biophysical Journal. 89 (4), 2855-2864 (2005).
- Crisp, M., et al. Coupling of the nucleus and cytoplasm: role of the LINC complex. Journal of Cell Biology. 172 (1), 41-53 (2006).
- Sosa, B. A., Rothballer, A., Kutay, U., Schwartz, T. U. LINC complexes form by binding of three KASH peptides to domain interfaces of trimeric SUN proteins. Cell. 149 (5), 1035-1047 (2012).
- Tapley, E. C., Starr, D. A. Connecting the nucleus to the cytoskeleton by SUN-KASH bridges across the nuclear envelope. Current Opinion in Cell Biology. 25 (1), 57-62 (2013).
- Arsenovic, P. T., et al. Nesprin-2G, a Component of the Nuclear LINC Complex, Is Subject to Myosin-Dependent Tension. Biophysical Journal. 110 (1), 34-43 (2016).
- Rowat, A. C., Lammerding, J., Ipsen, J. H. Mechanical properties of the cell nucleus and the effect of emerin deficiency. Biophysical Journal. 91 (12), 4649-4664 (2006).
- Rowat, A. C., Foster, L. J., Nielsen, M. M., Weiss, M., Ipsen, J. H. Characterization of the elastic properties of the nuclear envelope. Journal of the Royal Society Interface. 2 (2), 63-69 (2005).
- Pagliara, S., et al. Auxetic nuclei in embryonic stem cells exiting pluripotency. Nature Materials. 13 (6), 638-644 (2014).
- Liu, H., et al. In situ mechanical characterization of the cell nucleus by atomic force microscopy. ACS Nanotechnology. 8 (4), 3821-3828 (2014).
- Krause, M., Te Riet, J., Wolf, K. Probing the compressibility of tumor cell nuclei by combined atomic force-confocal microscopy. Physical Biology. 10 (6), 065002 (2013).
- Neelam, S., et al. Direct force probe reveals the mechanics of nuclear homeostasis in the mammalian cell. Proceedings of the National Academy of Sciences of the United States of America. 112 (18), 5720-5725 (2015).
- Pajerowski, J. D., Dahl, K. N., Zhong, F. L., Sammak, P. J., Discher, D. E. Physical plasticity of the nucleus in stem cell differentiation. Proceedings of the National Academy of Sciences of the United States of America. 104 (40), 15619-15624 (2007).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. Journal of Clinical Investigation. 113 (3), 370-378 (2004).
- Chancellor, T. J., Lee, J., Thodeti, C. K., Lele, T. Actomyosin tension exerted on the nucleus through nesprin-1 connections influences endothelial cell adhesion, migration, and cyclic strain-induced reorientation. Biophysical Journal. 99 (1), 115-123 (2010).
- Neelam, S., Dickinson, R. B., Lele, T. P. New approaches for understanding the nuclear force balance in living, adherent cells. Methods. 94, 27-32 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır