Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Periferik kan ve lenf dokusu birincil insan T hücre sinaptik arabirimi değerlendirilmesi
Bu Makalede
Özet
Protokol düzlemsel lipid bilayers kullanarak sinaptik arabirimleri oluşturmak için birincil poliklonal insan T hücreleri yeteneklerini çalışmaya bir teknik anlatılmaktadır. İnsan birincil T hücreler lenf düğümleri ve periferik kan elde fark synapse oluşumu yeteneğini göstermek için bu tekniği kullanın.
Özet
Dynamics mevcut anlayış ve yapısal özellikleri T-hücre sinaptik arayüzlerin düzlemsel bilayers Cam destekli ve vitrokullanımı ile büyük ölçüde kararlı olmuştur-türetilmiş T-Hücre klonlar ya da hatları1,2 ,3,4. Bu bulgular birincil insan T hücrelerine kan gelen izole veya lenfoid uygulamak nasıl dokular bilinmemektedir, hücre Analizi5için yeterli sayıda almak üzere kısmen önemli zorluklar nedeniyle. Burada bu bir teknik etkinleştirme ve adezyon molekülleri içeren düzlemsel lipid bilayers oluşturmak için çok kanallı akışı slaytlar istismar geliştirilmesi yoluyla ele. Akış slaytlar düşük yüksekliği hızlı hücre sedimantasyon hücre: bilayer eki, böylece araştırmacılar sinaptik arabirimi oluşumu dinamik ve granül yayın kinetik çalışmaya izin eşitlemek için teşvik etmektedir. Biz az 10 olarak sinaptik arabiriminin analiz etmek için bu yaklaşım uygulamak4 ' e 105 birincil cryopreserved T hücreler lenf düğümleri (içinde) ve periferik kan (PB) izole. Sonuçları ortaya çıkarmak roman düzlemsel lipid bilayer tekniği birincil insan T hücreleri kan ve doku bağlamında sağlık ve hastalık, türetilmiş biyofiziksel özelliklerini sağlar.
Giriş
T-hücre bağışıklık sinapslarda ve T hücrelerinin fonksiyonel etkinlik onların bağlantı yapısal özelliklerinden bilimsel bilgi öncelikle hücre hatları kursundan üretti ve PB türetilmiş klonlar. Bu bulgular için birincil T hücreleri arasında bir ilişki ne derece elde kan veya insan lenfoid doku kalır belirsiz, lenfoid ve diğer dokularda bulunan T hücre sinaptik arabirimleri şu ana kadar analiz değil gibi. Önemlisi, gelişmekte olan verileri doku yerleşik ve lenfoid organ elde T hücreleri fenotip ve fonksiyonel etkinlik bu PB6,7göre önemli farklılıklar olabileceğini göstermektedir. Bu daha fazla daha iyi birincil insan T hücreleri T-hücre sinaptik arabiriminde özelliklerini anlamak gerek katılaşmış.
Bu amaçla, biz bize insan PB ve LN. izole az 105 birincil T hücreleri ile T-hücre/bilayer arayüzleri görüntüleme gerçekleştirmesini sağlayan çok kanallı akışı slaytlar içine yerleştirilmiş lipid bilayers istismar bir roman mini ölçek yaklaşım geliştirdik Bu roman tekniği daha iyi model ve in vivo hücre-hücre etkileşimleri anlamak için birincil insan T-hücre sinaptik arabirimleri biyofiziksel özelliklerini sağlar.
Protokol
Bu çalışma Helsinki Bildirgesi uygun olarak yapılmıştır. Tüm katılımcılar Yazılı onam alındı ve kan ve lenf nodu (IRB #809316, IRB # 815056) Pennsylvania Üniversitesi Kurumsal İnceleme Kurulunun onayı ile satın alınan. Tüm insan denekler yetişkindi. Kordon kan örnekleri nazikçe işçi ve kadın Doğum bölümü & Thomas Jefferson Üniversitesi'nde kadın hastalıkları teslim tarafından temin edilmiştir. Tüm örneklerini de-tespit edildi.
1. yalıtım CD4+ T hücreleri bir görüntü analizi için
-
107 dondurulmuş periferik kan mononükleer hücreler (PBMCs) veya lenf nodu mononükleer hücreler (LNMCs) toplanan örnekleri içeren 1 mL aliquot çözülme. Steril bir başlık, penisilin/streptomisin ve glutamin ile RPMI 9 mL çözdürülen hücreleri ekleyin.
- Centrifugate 300 x g 4 ° C'de 10 dakika için hücreleri süpernatant Aspire edin ve 5 mL ilave RPMI % 10 içeren hücrelerde resuspend FBS (tam orta). CO2 kuluçka 37 ° C'de gecede hücrelerde kuluçkaya
- Ertesi gün, CD4 arındırmak+ T hücreleri tarafından olumsuz immunomagnetic üreticinin yönerge göre piyasada bulunan bir seti kullanarak sıralama.
- Taze arıtılmış CD4 sayısı ölçmek için+ T hücreleri, hücre süspansiyon 5 µL bir trypan mavi çözüm eşit bir hacmi ile karıştırın. Bir hemasitometre hücre trypan ile yük mavi karışımı ve hemasitometre 5 bölümlerini içinde canlı hücreleri saymak.
- Hücre sayı ortalamasını almak ve özgün hücre süspansiyon hücre sayısı belirlemek: hücreler/1 mL sayısı = x 2 x 104ortalama sayısı. İzole hücre toplam sayısı çok küçük ise, hücre sayım olmadan olduğu gibi kullanın.
- Hücreleri vasıl 300 x g 10 dk santrifüj kapasitesi ve onları arabellekte bir tahlil (20 mM HEPES, pH 7.4, 137 mM NaCl, 2 mM Na2HPO4, 5 mM D-glikoz, 5 mM KCl, 1 mM MgCl2, 2 mM CaCl2ve % 1 insan serum albümin) 105 resuspend < /C13 > hücreler/50 µL veya daha az ve hücreleri (için 1-2 h) 4 ° C'de deneylerde kullanıma hazır kadar tutun.
- Tüm biyolojik atık ilgili kurumsal yönergelere uygun bir biçimde atın.
- Denetimi hücre nüfus isterseniz, kordon kanı PBMC aktif CD8 T hücrelerden hazırlamak, 5 mL anti-CD3 ve anti-CD28 antikorları 10 µg/mL ve 1 µg/mL karışımı ile kaplı bir T25 kültür şişesi tam orta de 107 hücreleri yer , sırasıyla.
- Ertesi gün, aktif kordon kanı hücreleri balonun kaldırmak için onları yıkamak ile taze 1 x tamamlamak orta ve rekombinant IL-2 huzurunda hücreleri genişletin (100 U/mL) 2 hafta boyunca.
- Kordon kanı CD8 arındırmak+ T hücreleri üreticinin yönerge göre piyasada bulunan kit kullanarak negatif immunomagnetic sıralayarak. Hücreleri saymak ve tahlil arabellek medyaya LN ve PB CD8 için 1.3-1.6 adımlarda açıklandığı gibi döviz+ T hücreleri.
2. düzlemsel Lipid Bilayers hazırlanması için bileşenler
- Başka bir yerde5açıklandığı gibi lipozomlar 3 tür hazırlamak: (a) 0.4 mM DOPC (1,2-dioleoyl -sn- glycero-3-phosphocholine) lipozomlar, (b) 0.4 mM DOPC lipozomlar 33 mol % köpekler-NTA içeren (1,2-dioleoyl -sn- glycero - 3-[(N-(5- amino-1-carboxypentyl) iminodiacetic asit) succinyl] (amonyum tuz)) lipidler, 4 mol % Biotinyl-Cap-PE içeren (c) 0.4 mM DOPC lipozomlar (1,2-dioleoyl -sn- glycero-3-phosphoethanolamine - N-(kap biotinyl) (sodyum tuzu)).
-
%5 kazein çözüm yukarıda açıklanan5olarak hazırlayın.
- 5 g kazein tozu Ultrasaf Su 100 ml dağıtılması ve 10 M sodyum hidroksit 350 µL ekleyin. Her şey üzerinde düzenli bir manyetik karıştırıcı, oda sıcaklığında 2 h için kullanılabilir ölçeğine göre yavaş hızda karıştırın ve sonra 4 ° C'de gece 7.3 ve ultracentrifuge 100.000 x g 4 ° C'de 2 h için çözüm pH ayarlama Süpernatant 0,22 µm steril filtre ile filtre ve çözüm aliquots-80 ° C'de depolayın
Dikkat: Sodyum hidroksit çözüm kimyasal yanıklara neden ve gözlerle temas üzerine kalıcı körlüğe neden olabilir. Lastik eldiven, Emanet giyim ve göz koruması bu kimyasal ya da çözümleri işlerken kullanır.
- 5 g kazein tozu Ultrasaf Su 100 ml dağıtılması ve 10 M sodyum hidroksit 350 µL ekleyin. Her şey üzerinde düzenli bir manyetik karıştırıcı, oda sıcaklığında 2 h için kullanılabilir ölçeğine göre yavaş hızda karıştırın ve sonra 4 ° C'de gece 7.3 ve ultracentrifuge 100.000 x g 4 ° C'de 2 h için çözüm pH ayarlama Süpernatant 0,22 µm steril filtre ile filtre ve çözüm aliquots-80 ° C'de depolayın
-
Etiket anti-CD3 antikor ile mono-bionylated antikor molekülleri ile yukarıda açıklanan yaklaşım8üretmek için biotin.
- Dimetil sülfoksit (DMSO) 0.1 mg/mL, Biotin-PEO4-NHS çözeltilerine hazırlayın. Antikor fosfat tamponlu tuz (PBS) 100 mM sodyum bikarbonat içeren 0.5 ml 1 mg Biotin-PEO4-NHS çözüm 3.7 µL ekleyin.
- Karışımı oda sıcaklığında 2 h için kuluçkaya. Alexa Fluor 488 NHS ester adlı 10 mg/mL DMSO çözeltisi hazırlamak. Alexa Fluor 488 NHS ester çözüm Biotin-PEO4-NHS tarafından 10 kat molar aşırı etiketli antikor ekleyin.
- Karışımı yavaş karıştırma üzerinde düzenli bir manyetik karıştırıcı ile Oda sıcaklığında 1 h için kuluçkaya. İlişkisiz boya boyutu-dışlama Kromatografi kullanarak ayırın.
- 280, antikor çözümün optik yoğunluk ölçerek antikor konsantrasyonu belirlemek nm (bir280). 577, etiketli antikorlar optik yoğunluğunu ölçmek nm (bir577).
- Boya antikor oranı aşağıdaki denklemi kullanarak belirleyin:
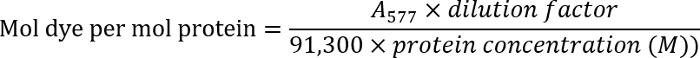
Not: ek ayrıntılar üreticinin iletişim kuralı'nda bulabilirsiniz.
-
Rekombinant çözünür ICAM-1 protein3,4,9,10daha önce açıklandığı gibi bir Drosophila ifade sisteminde hızlı.
- Klon cDNA kodlama ile ICAM-1 ectodomain içine Drosophila ifade vektör DEVRESEL_ÖDEME/V5-O'nun bir His ile eklenmiş bir Rekombinant protein üretmek için bir indüklenebilir metallothionein organizatörü ile6 etiketi C-terminal ucunda.
- S2 hücreleri elde edilen ICAM-1 içeren plazmid ve G418 ifade vektör Co transfect. Kararlı transfectants % 10 fetal buzağı serum (FCS) ve 0,5 mg/mL G418 ile 3 hafta boyunca takıma Schneider'ın Drosophila medya kullanarak seçin. Serum içermeyen böcek orta hücrelerde genişletin ve bir protein ifade ile 0,5 mM CuSO4 3 d için teşvik.
- Kültür süpernatant 10 x konsantre ve PBS üzerinden karşı teğet akışı yoğunlaştırıcı yukarıda açıklanan11olarak diyaliz.
- Süpernatant konsantre kültür Sepharose ile kovalent immobilize bir anti-ICAM-1 monoklonal antikor içeren bir sütun için geçerli ve ilişkili ICAM-1 50 mM glisin arabelleği, pH 3.0 ile elute. Hemen eluted ICAM-1 protein 2 M Tris arabelleği, pH 8.0 ile etkisiz hale getirin.
- PBS, pH 8.0 karşı eluted malzeme diyaliz ve bir sütun içeren Ni-NTA özel diyaliz malzeme ekleyin. Çözünür ICAM-1 200 mM imidazole, pH 8.0 ile elute. PBS arabellek, pH 8.0 karşı eluted malzeme diyaliz.
- Arıtılmış ICAM-1 Cy5 NHS ester göre üreticinin yönerge ile etiketleyin.
Not: En iyi son boya protein oranı 1: 1'dir.
- Fab üretmek papain sindirim tarafından bir anti-CD107a antikor parçaları ve Fab arındırmak parçaları3daha önce açıklandığı gibi İyon Kromatografi tarafından. Etiket Alexa Fluor 568 NHS ester göre üreticinin yönerge ile Fab parçaları.
3. düzlemsel Lipid Cam destekli Bilayers oluşumu
- Bir taze asidik piranha çözüm 140 mL konsantre sülfürik asit ve % 30 hidrojen peroksit 60 mL karıştırarak hazırlayın. Cam coverslips akışı slaytlar için onları 30 dk. tutun asit piranha çözümde cam coverslip Polipropilen makas tipi forseps ile ıslatarak yıkayın.
Dikkat: Son derece güçlü bir oksitleyici Piranha çözümdür. Aşınma koruyucu gözlük ya da gözlük ya da kalın lastik eldiven ile birlikte tam yüz bir kalkan çözüm işleme sırasında her zaman unutmayın. Piranha çözüm bir duman başlık altında sadece çalışmak. Patlayabilir o olabilir gibi Isıtma, taşıma veya herhangi bir anında kullanım, sallıyorum kaçının. Piranha atık kurşun içeren çukur bir cam şişe içine toplamak. Kurumsal Güvenlik Komitesi uygun atık kullanımı hakkında başvurun. -
Yıkanmış coverslips 7 durulama taze su içeren şişeler sırayla aktarmadan tarafından Ultrasaf Su ile x. Su kalan izin vermek bir yana coverslips ıslak kuru cam geride bırakarak temiz cam kapalı rulo seti.
- Alternatif olarak, bir vakum pompa bağlı bir pipet ucu dikkatle kalan su damlacıkları coverslips kaldırmak için kullanın.
- Steril başlık, lipozom mix bilayers yapmak için üretmek için çeşitli lipitler dilutions gerçekleştirin. İlk olarak, DOPC lipozomlar 37 µL ve Biotinyl-Cap-PE lipozomlar 3 µL birleştirir. İkinci olarak, DOPC lipozomlar 14 µL ve köpekler-NTA lipozomlar 15 µL karıştırın. Üçüncü olarak, ilk Mix 1 µL son lipozom karışımı imal etmek ikinci mix 29 µL için ekleyin.
-
Steril başlık, bir çalışma alanı tarafından kuru coverslips yakın ile ayarlayın. Aliquot 2 µL son lipozom karışımı (bkz. Adım 3.3) tam olarak kendinden yapışkanlı slayt kanal merkezinde. Hemen ve çok hassas bir temiz ve kuru coverslip slayt ile hizalayın ve slayt yapışkan tarafındaki coverslip yavaşça indirin.
- Birden fazla slayt hazırlama, iş bir slayt üzerinde teker teker beri lipozom karışımı hızla buharlaşır. Slayt çevirin ve polipropilen makas tipi forseps dış halkasındaki kaydıraklı, slip kaçağı önlemek için slayda sıkıca bağlı olduğundan emin yapma coverslip periferik kişiye hafif bir basınç uygulamak için kullanın.
Not: kırılma veya coverslip çatlama önlemek için slayt kanalları karşı basın değil. - Slayt üzerinde yeniden açın ve derleme dış slayt tarafındaki bilayer çevresinde kalıcı bir kalem ile çizim 4 nokta tarafından bir damla coverslip ve kanal slayt arasında gibi görünüyor kurulan bilayer konumunu işaretleyin.
- Birden fazla slayt hazırlama, iş bir slayt üzerinde teker teker beri lipozom karışımı hızla buharlaşır. Slayt çevirin ve polipropilen makas tipi forseps dış halkasındaki kaydıraklı, slip kaçağı önlemek için slayda sıkıca bağlı olduğundan emin yapma coverslip periferik kişiye hafif bir basınç uygulamak için kullanın.
- Kanal içine ilk enjeksiyon bir sıvı önce kanalın bir bağlantı noktası giriş bağlantı noktası diğer çıkış bağlantı noktası olarak atayın ve bu atama deneme boyunca korumak.
- Kabarcıklar oluşturan önlemek için doğrudan kanal giriş liman damlalıklı ucu ucunu bağlayın. Yavaş yavaş slayt kanalları sıcak 50 µL ile doldurun (en azından oda sıcaklığı) tahlil arabellek (bkz. Adım 1.5 arabellek oluşturma için).
- 0, 5 M nickel(II) klorür çözüm hazırlamak. 2 mL aliquot su banyosu için 30 dk 37 ° C'de çözümde kazein, çözülme ve bir nikel klorür çözüme 200 µM son bir konsantrasyon ile ek.
- Bilayers ilk kanal giriş limanında kazein çözeltinin 100 µL enjekte ve sonra hemen dışarı slayt çıkış noktasındaki 100 µL pipetting tarafından kaldırarak yıkayın. Aynı çözüm ile bilayers 100 µL kazein çözümün her kanal giriş portuna enjekte ve slayt için 45 dakika oda sıcaklığında kuluçka engelleyin.
- Aliquots Cy5-ICAM-1-O'nun6 ve streptavidin proteinlerin çözülme. 2 µg/mL her son konsantrasyonu, tahlil arabellekte proteinleri birleştirir. Belgili tanımlık eriyik için 20.000 x g ve herhangi bir toplamları kaldırmak için 4 ° C'de 30 dk santrifüj kapasitesi.
- Engelleme çözüm geri kalanı pipetting tarafından slayt kanal çıkış bağlantı noktasından çıkarın. 100 µL ICAM-1 ve streptavidin giriş portuna içeren çözüm enjekte.
- Slayt 45 dakika oda sıcaklığında için kuluçkaya. Herhangi bir aşırı protein çözüm çıkış bağlantı noktasından çıkarın. Bilayer 2 yıkama x ilk kanal giriş limanında tahlil tamponunun 100 µL enjekte ve sonra hemen çıkış bağlantı noktası dışında 100 µL kaldırarak.
- Alexa-Fluor-488-etiketli bir anti-CD3 antikor tahlil arabelleği için 2 µg/mL nihai bir konsantrasyon ile sulandırmak. Antikor çözeltinin 100 µL slayt giriş portuna enjekte ve oda sıcaklığında 45 dk için kuluçkaya. Herhangi bir aşırı protein çözüm çıkış bağlantı noktasından çıkarın. Bilayer 2 yıkama x 100 µL olduğu gibi adım 3.11 tahlil arabelleği ile.
4. düzlemsel Bilayer ile T hücreleri etkileşim görüntüleme
-
Sahne ve confocal veya toplam iç yansıma (TIRF) Floresan mikroskop amacı sıcaklığı 37 ° C'de equilibrated kadar onceden Bilayer(s) slaytla ısıtmalı sahnede ayarlayın. Sahne mürekkep işaretleri göre uygun bir konuma taşımak ve floresan Cy etiketli ICAM-1 moleküllerin istihdam bilayer odaklan.
- 61 X amaç confocal mikroskop için veya 100 X amaç TIRF mikroskopla uygun filtre ayarlarını kullanın.
-
Granül için görüntüleme TIRF mikroskobu tarafından serbest, Alexa-Fluor-568-etiketli anti-CD107a eklemek için 4 µg/mL giriş noktalarına hücreleri enjekte önce son bir konsantrasyon, hücre süspansiyon parçaları antikor Fab.
- Hazırlanan CD4 resuspend+ T hücreleri izole LN veya PB veya kordon kan ve hücre süspansiyon 50 µL bilayer içeren slayt kanalı giriş bağlantı noktası enjekte.
- Alanları istediğiniz sayıda ve kayıt görüntüleri her alanının 1 x 30 dk için her 2 dk sonra enjeksiyon seçin.
- Alan parlak, yansıyan ışık ve floresan kanal (Alexa 488 ve Cy5) görüntüleri elde etmek için confocal mikroskop yararlanmak. Alexa-Fluor-488 ve Alexa-Fluor-568 floresans ve widefield Cy5 floresan, hem de TIRF mikroskop üzerinde parlak alan görüntüleme için TIRF modunu kullanın.
5. görüntü analizi
- Uygun yazılımı kullanarak alınan görüntüleri analiz. Hücre morfolojisi iletilen ışık görüntü, kümelenmiş ve gözle görülür hasar dışlama veya analiz apoptotik hücreler içinde gözlemlemek. Analizde sadece üretken bilayer yüzey (Örneğin, Alexa-Fluor-488 Floresan (anti-CD3 antikor) arayüz biriken hücreler) ile etkileşim hücreler içerir.
- 20 dk hücre adezyon alanının boyutu hücre bilayer etkileşim başlandıktan sonra belirleyin.
Not: Parazit yansıması mikroskobu (IRM) resim hücre bilayer arabirimde geliştirilen karanlık alan yapışma alandır. - Cy5-ICAM-1 floresans herhangi bir birikimi ve yüzük kavşak bir oluşum tarafından ayrılmış Cy-ICAM-1 moleküller hücre bilayer arayüz gözlemlemek. Birikmiş ICAM-1 molekülleri bir yapışma halkası kavşak en az iki ardışık görüntülerde oluşan isterseniz bu tür hücrelerin periferik supramolecular aktive küme (pSMAC)12gelişmekte olan hücreler olarak belirleyin.
- Granül sürümü hücre yakın temas bölgesinin dışında arka plan floresans üzerinde T hücre bilayer arabirimi Alexa-Fluor-568 floresans yoğunlukta ölçerek değerlendirin. Alexa-Fluor-568 sinyal-için-arka plan en az 1,3 oranında hücreleri degranulating hücreler olarak belirleyin.
Sonuçlar
İlk olarak, biz aktif kordon kanı türevi CD8 tarafından kurulan sinaptik arabirimi yapısını göre+ T hücre lipid bilayers maruz inşa ikisinden biri içinde geleneksel büyük ölçekli akışı (bkz: ayrıntılı bilgi için Malzemeler tablo ) hücre sistemleri1 ,2,3,4 veya çok kanallı akışı slaytlar. Bilayers floresan ...
Tartışmalar
Burada açıklanan roman tekniği konvansiyonel akışı hücre5 düzlemsel bilayers oluşturmak için gerekli benzer reaktifler kullanır ve başarıyla birincil insan T hücre – bilayer arabirimleri3,4 görüntüleme gerçekleştirmek için uygulanabilir ,15. Teknik floresan molekülleri kullanımı önemli bir azalma sunmaktadır ve 10-20 daha az T hücreleri ile karşılaştırıldığında birinci...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu eser desteklenmiştir Michael R. Betts için R01AI118694 NIH grant tarafından alt Ödülü 566950 Yuri Sykulev içerir. Sidney Kimmel Kanser Merkezi Bioimaging paylaşılan kaynak mükemmel desteklerinden dolayı teşekkür ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| CD4 T cell isolation kit, human | Miltenyl Biotec | 130-096-533 | |
| CD8 T cells Isolation Kit, human | Miltenyl Biotec | 130-096-495 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| DOGS NTA | Avanti Polar Lipids | 790528C | |
| Biotinyl Cap PE | Avanti Polar Lipids | 870273C | |
| Human Serum Albumin | Octapharma USA | NDC 68982-643-01 | |
| sticky-Slide VI 0.4 | ibidi | 80608 | |
| Coverslips for sticky-Slides | ibidi | 10812 | |
| Bioptech FCS2 Chamber | Bioptech | 060319-2-03 | |
| anti-CD3 antibody | Thermo Fisher Scientific | 16-0037-81 | OKT3 clone, hybridoma cells are available from ATCC |
| anti- CD28 antibody | Genetex | GTX14664 | 9.3 clone |
| Casein | Sigma | C5890 | |
| Biotin-PEO4-NHS | Thermo Fisher Scientific | 21329 | |
| DMSO | Sigma | D2650-5 | |
| Alexa Fluor 488 protein labeling kit with column for labeled protein purification | Thermo Fisher Scientific | A10235 | |
| Alexa Fluor 568 protein labeling kit with column for labeled protein purification | Thermo Fisher Scientific | A10238 | |
| Amersham Cy5 NHS Ester | GE Life Science | PA15101 | |
| pMT/V5-His A, B, C Drosophila Expression Vectors | Thermo Fisher Scientific | V412020 | |
| pcopneo, G418 Drosophila expression vector for positive selection | ATCC | 37409 | |
| Serum free Drosophial media Insect-XPRESS | Lonza | 12-730Q | |
| Hybridoma YN1/1.7.4 | ATCC | CRL1878 | The hybridoma secrets antibody against ICAM-1. |
| Cyanogen bromide-activated-Sepharose 4B | Sigma-Aldrich | C9142 | Utilized for preparation of Sepharose with covelently bound anti-ICAM antibody. |
| MasterFlex tangential flow concentrator | Cole-Parmer | 77601-60 7592-40 | Used for ICAM-1 containing supernatant concentration and dialysis of ICAM-1 containing supernant |
| Centramate Lab Tangential Flow Systems | Pall Laboratory | FS002K10 OS010T12 FS005K10 | Used for ICAM-1 containing supernatant concentration and dialysis of ICAM-1 containing supernant |
| Ni-NTA Agarose | QIAGEN | 30210 | |
| Dialysis tubing | Spectra/Por | 131384 | |
| Papain from papaya latex | Sigma | P3125 | |
| mouse anti-human antibody against CD107a | BD Bioscences | 555798 | Clone H4A3 |
| Ansell Natural Blue Gloves | Fisher Scientific | 19-014-539 | |
| Nalgene Polypropylene Scissor-Type Forceps | Thermo Fisher Scientific | 6320-0010 | |
| Streptavidin | ProZyme | SA10 | |
| Confocal microscope | Nikon | Nikon TiE inverted microscope equipped with PFS for long-term image stability control, 60X oil objectives, 4 lasers with excitation lines at 405, 458, 488, 514, 561, and 640 nm, 2 GaAsP detectors and 2 high sensitivity PMTs, DIC transmitted light, Programmable X,Y,Z stage for multiple positions and stitching of large areas, time lapse functions, Tokai-Hit temperature and CO2-controlled chamber for live imaging, and anti-vibration isolation table | |
| TIRF microscope | Andor | Andor Revolution XD system equipped with Nikon TIRF-E illuminator, Lasers with 405,488,561 and 640 lines, DIC transmitted light, Yokogawa CSU-X1 spinning disk head for confocal imaging, 100/1.49 NA objective, Andor iXon X3 EM-CCD camera, objective heater, and a piezoelectric motorized stage with Perfect Focus System (PFS) | |
| MetaMorph Premier Image Analysis Software | Molecular devices |
Referanslar
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Somersalo, K., et al. Cytotoxic T lymphocytes form an antigen-independent ring junction. Journal of Clinical Investigation. 113, 49-57 (2004).
- Beal, A. M., et al. Protein kinase C theta regulates stability of the peripheral adhesion ring junction and contributes to the sensitivity of target cell lysis by CTL. The Journal of Immunology. 181, 4815-4824 (2008).
- Beal, A. M., et al. Kinetics of early T cell receptor signaling regulate the pathway of lytic granule delivery to the secretory domain. Immunity. 31, 632-642 (2009).
- Dustin, M. L., Starr, T., Varma, R., Thomas, V. K. Supported planar bilayers for study of the immunological synapse. Current Protocols in Immunology. , (2007).
- Reuter, M. A., et al. HIV-Specific CD8(+) T Cells Exhibit Reduced and Differentially Regulated Cytolytic Activity in Lymphoid Tissue. Cell Reports. 21, 3458-3470 (2017).
- Buggert, M., et al. Limited immune surveillance in lymphoid tissue by cytolytic CD4+ T cells during health and HIV disease. PLoS Pathogens. 14, e1006973 (2018).
- Carrasco, Y. R., Fleire, S. J., Cameron, T., Dustin, M. L., Batista, F. D. LFA-1/ICAM-1 interaction lowers the threshold of B cell activation by facilitating B cell adhesion and synapse formation. Immunity. 20, 589-599 (2004).
- Anikeeva, N., et al. Distinct role of lymphocyte function-associated antigen-1 in mediating effective cytolytic activity by cytotoxic T lymphocytes. Proceedings of the National Academy of Sciences of the United States of America. 102, 6437-6442 (2005).
- Steblyanko, M., Anikeeva, N., Campbell, K. S., Keen, J. H., Sykulev, Y. Integrins Influence the Size and Dynamics of Signaling Microclusters in a Pyk2-dependent Manner. The Journal of Biological Chemistry. 290, 11833-11842 (2015).
- Anikeeva, N., Lebedeva, T., Sumaroka, M., Kalams, S. A., Sykulev, Y. Soluble HIV-specific T-cell receptor: expression, purification and analysis of the specificity. Journal of Immunological Methods. 277, 75-86 (2003).
- Monks, C., Freiberg, B., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Riddell, S. R., Greenberg, P. D. The use of anti-CD3 and anti-CD28 monoclonal antibodies to clone and expand human antigen-specific T cells. Journal of Immunological Methods. 128, 189-201 (1990).
- Lin, S. J., Yu, J. C., Cheng, P. J., Hsiao, S. S., Kuo, M. L. Effect of interleukin-15 on anti-CD3/anti-CD28 induced apoptosis of umbilical cord blood CD4+ T cells. European Journal of Haematology. 71, 425-432 (2003).
- Anikeeva, N., Sykulev, Y. Mechanisms controlling granule-mediated cytolytic activity of cytotoxic T lymphocytes. Immunologic Research. 51, 183-194 (2011).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature. 463, 963-967 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır