Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Gerçek zamanlı görüntüleme ve miktar iki aşamalı dolaşım akış sistemi kullanarak mantar biyofilm gelişimi
Bu Makalede
Özet
Biz derleme işlemi, tarif ve gerçek zamanlı akış iken altında görüntü mantar biyofilm oluşumu için bir akış cihazları temizlik tasarlanmış. Biz de sağlamak ve elde edilen görüntülerde kullanılmak üzere sayısal algoritmalar tartışıyorlar.
Özet
Oropharyngeal kandidiyazis içinde Candida cinsinin üyeleri uygun ve süre tükürük akışı etkileri altında oral mukozal yüzeyinde büyümek gerekir. Akış altında büyüme modellerinde geliştirilmiş olsa da, bu sistemlerin pek çok pahalı veya hücreleri akış altında iken görüntüleme izin vermiyor. Büyüme ve gelişme Candida albicans hücre akışı altında ve gerçek zamanlı görüntü için bize izin verir yeni bir cihaz geliştirdik. Burada, derleme ve bu akışı cihaz kullanımı yanı sıra oluşturulan veri miktar için protokolü ayrıntılı. Biz bu hücreleri ekleyin ve slayttan slayt üzerinde biyokütle ölçüsü zaman içinde belirlemek için, de ayırmak oranları ölçmek edebiliyoruz. Ve bu sistem hem ekonomik hem çok yönlü, ışık mikroskoplar, ucuz benchtop mikroskoplar, dahil olmak üzere birçok türleri ile çalışma yeteneğine sahip olan diğer akış sistemlerine göre kez Imaging genişletilir. Genel olarak, bu son derece ayrıntılı gerçek zamanlı bilgi akışı altında mantar türlerinin biyofilm büyüme sağlayabilen bir düşük işlem hacmi sistemdir.
Giriş
Candida albicans (C. albicans) bir fırsatçı mantar patojen oral mukozal yüzeyler de dahil olmak üzere, oropharyngeal kandidiyazis neden ve daha düşük bir yaşam kalitesi için etkilenen bireylerin1sonuçlanan birçok doku türler, enfekte olabilir insanlar var. Biyofilm oluşumu için C. albicanspatogenezinde önemli bir özelliğidir ve oluşumu ve işlev C. albicans biyofilmler2,3,4çok sayıda çalışma yapılmıştır, 5birçoğu gerçekleştirdik statik (akımı) vitro kullanarak, modelleri. Ancak, C. albicans uygun ve ağız boşluğu tükürük akışında huzurunda büyümek gerekir. Çok sayıda akış sistemleri canlı hücre görüntüleme6,7,8,9,10için izin vermek için geliştirilmiştir. Bu farklı akış sistemleri farklı amaçlar için tasarlanmıştır ve bu nedenle her sistem farklı güçlü ve zayıf yönleri vardır. Bulduk çok akış sistemleri C. albicans için uygun maliyetli, gerekli karmaşık parçaları, fabrikasyon veya değil olabilir akışı sırasında yansıma ve görüntüleme önce durdurulması gerekiyordu. Bu nedenle, C. albicans biyofilm oluşumu akışı11altında çalışmaya bir roman akışı aparatı geliştirdik. Akış cihazlarımızı tasarım sırasında bu önemli konuları takip ettik. İlk olarak, biyofilm büyüme ve gelişme içinde birden çok yönlerini ölçmek mümkün istedim floresan hücreleri (bize çalışma mutant suşları ve değiştirilmemiş klinik yalıtır kolayca izin) kullanımı gerektiren olmadan gerçek zamanlı. İkinci olarak, biz hiçbir değişiklik için çok az ile ticari olarak kullanılabilir olması için tüm parçaları istedim (i.e., hiçbir özel imalat), diğerleri daha kolayca sistemimiz yeniden sağlayan ve kolay onarımlar için izin. Üçüncü olarak, aynı zamanda genişletilmiş için izin istedim zaman makul yüksek akış oranları görüntüleme. Son olarak, döneminden sonra hücre yüzey akışı altında için ekleme bir genişletilmiş bir zaman içinde biyofilm büyüme yeni hücre tanıtımı olmadan izlemek edebilmek için istedik.
Bunu göz önünde iki şişeye dolaşım akış sistemi Şekil 1' de gösterildiği geliştirmek için bize yol. İki şişe deney iki aşama, hücre numaralı seribaşı eki balonun çizer bir eki faz ve biyofilm büyüme yeni hücreler ek olmadan devam etmek için medya boş hücre kullanır bir büyüme aşamasında içine bölmek sağlamak. Bu sistem (2-5 Şekil 1) inkübatör içinde konuyor kendisinden önce boru ve slayt ile mikroskop için bir kuluçka odası ile çalışacak şekilde tasarlanmıştır ve tüm diğer bileşenleri yerleştirilen dışında büyük bir ikincil kap içinde mikroskop. Ayrıca, bir Pinar karıştırıcı bir ekli sıcaklık probu ile 37 ° C'de eki şişeyi mantar hücreleri korumak için kullanılır Sirkülasyon gibi bu sistem (36 h üzerinden koşullara bağlı olarak olabilir) akışı sırasında sürekli görüntüleme yeteneğine sahiptir ve dik veya ters benchtop mikroskoplar dahil olmak üzere çoğu standart mikroskoplar kullanılabilir. Burada, biz derleme işlemi, ele ve akış aparatı temizlik, de gibi videoları bir deneyden sonra analiz etmek için bazı temel ImageJ nicel algoritmalar sağlar.
Protokol
1. montaj akışı aparatı
- Şekil 1 ' deki şematik Malzemeler tablo aşağıda ele dikkat edilecek noktalar ile listelenen bölümleri yapılandırın.
Not: kolaylık sağlamak için cihazı bölünmüş iki taraf, yeşil tarafı (medya şişeler için slaydın her akıntıya karşı) ve turuncu akışı yan (her şeyi aşağı slayt medya şişeler için).- Tüm akışı aparatı hava medya şişeler (Şekil 1, 1) tek istisna ile sızıntıları önlemek için sıkı olduğundan emin olun. Bunu yapmak için tesisatçılar bant herhangi bir erkek nabız sönümleyici (PD) ve 2 µm filtre şişe (FB), dışında montaj önce iş parçacığı için kauçuk contalar onları hava geçirmez engellemek gibi tesisatçılar bant gerektirmeyen uygulanacağı.
- Normal çalışma sırasında pozitif basınç altında olduğunu her dikenli uydurma, kulak kelepçeler uygulamak (yani, pompanın akış aşağı).
- Kullanım renk kodlu bir A ya da G Vana konumlarıyla etiketlemek için laboratuvar bantlar (Eki ve büyüme, sırasıyla), pompa konumu, slayt bağlantı yerleri ve 0.2 µm filtre bağlantısı.
- Kullanılacak boru uzunluğu akış sistemi ve tüm akışı cihazlar downstream pompa şişeler (turuncu yan çoğunluğu) için İkincil çevreleme olmalıdır akılda tutmak mikroskop arasındaki mesafe bağlı olarak belirler. Yaklaşık 1 m ilave boru eklemek ve slayt (tercihen kabarcık tuzak) Bu slayt ulaşan tüm medya doğru sıcaklıkta olacaktır sağlar gibi mikroskop kuluçka odası içinde yerleştirmek için ters yönde.
- Yer makul bir deney sırasında kuluçka odası tercihen içinde slayt için mümkün olduğunca yakın kabarcık tuzak (genellikle form boru duvar boyunca bubbles); Ancak, bu olmalıdır unutmayın bir vakum için çalışmasına bağlı.
- FB ve 0.2 µm tek kullanımlık filtredir 0,5 m uzun arasında boru sağlamak.
- Ekle bir yaklaşık 2 cm manyetik heyecan bara her medya cep şişesi.
- Bir çeşit boru kelepçeleri (hemostats kullanılabilir) kapama vanaları gibi davranmaya edinin.
- Kolay kullanım için akışı aparatı autoclavable sepet içinde tutun. Daha büyük bir yeşil yan ve turuncu yan kolay ayrılması izin vermek için ikinci bir küçük sepete için yararlı olabilir.
- 4 mm matkap kullanarak eki şişesi için termal prob (başka bir delikten gitmemeye özen) karşılamak için kauçuk tıpa ekstra bir delik matkap. Tüp bağlantı noktası aracılığıyla almak için tüp cımbızla doğru itin; bir kez, yerde ve cımbız geri çekme tutmak için boru kelepçe.
Not: kauçuk tıpa ekstra delik eklemek mümkün değilse, dört bağlantı noktası vida kapaklı geniş ağız vidalı şişe şişe ve kauçuk tıpa yerine çalışabilir.
- Akış sistemi tamamen monte edilmiştir sonra her iki yeşil ve turuncu yan büyüme şişeler valfleri kapatın. Peristaltik pompa üretici yönergelerine göre ayarlamak için ek şişesi boru ve mezun silindir ile su kullanın.
2. deney gerçekleştirmek
- Deneme, önceki gün mikroskop kuluçka odası 37 ° c ön ısıtma başlar ve bir gecede kültür mantar zorlanma hazırlamak (floresan gerekli değildir).
- Tek Kişilik Kullanım bileşenleri ve pompa toplamak ve steril bir Biyogüvenlik kabini koyun.
- Kabarcık tuzak kaldırmak ve sıcaklık akışı cihazlar yoklama ve bunların Biyogüvenlik kabini içinde yer.
- Detangle ve kablo kanalları, gerekirse düzenleyebilirsiniz.
- Otoklav heyecan kalasları kısırlık emin olmak 30 dk da dahil olmak üzere akışı aparatı; ne zaman tamamlanmak, Biyogüvenlik kabini aktarın.
- Kabarcık tuzak, sıcaklık probu ve tüm Tek Kişilik Kullanım bileşenleri (hariç slayt) Şekil 1' de gösterildiği gibi takın.
- 0.2 µm filtre (Şekil 1, 11) için bir "bağdaştırıcısı" olarak yapmak için 1 mL şırınga pistonu çıkarın. FB üzerinden boru içine bu amaçla zorlamak ve büyüme şişeye önde gelen boru 0.2 µm filtre ekleyin.
- Bu yardımcı olur sisteme hava kaçağı önlemek gibi silikon vakum yağ barb slayt bağdaştırıcısının (herhangi bir yağ içeriden değil almak için özen) çevresinde bağlamadan önce uygulanır.
- %1 (w/v) maya ekstresi, %2 (w/v) pepton ve %2 (w/v) glikoz (YPD) 100 mL ile eki şişeye doldurun ve büyüme şişeye YPD 200 mL ile doldurulması. Yeşil yan boru her şişeyi medyada ulaştığından emin olmak.
- Bütün vanaları açık olduğundan emin olun. Kabarcık tuzak bir vakum için iliştirin ve pompa yeşil yan boru bağlamak kabarcık tuzak aşağı.
- Sıvı tamamen yeşil yan doldurun, sonra dağıtmak ve mililitre ilk birkaç kez ölü hücreleri veya rasgele enkaz içerdiğinden yaklaşık 1-2 mL medya atmak için 3,3 mL/dk debi pompa. Tüp, yeşil tarafı kitle iletişim araçları ile dolu ve hava kabarcığı yok aşağı devam etmeden önce kabarcık tuzak olduğundan emin olun.
- Kanal slayt ve havzanın kabarcıklar tanıtmak değil dikkat çekici YPD ile doldurun.
- Slayt turuncu tarafında, yaklaşık 0,5 m arabellek oluşturmak için daha fazla sıvı akışı aparatı ve pompa bağlayın. Bu yanlışlıkla slayt geri tepme durumunda havada yakalama önlemek içindir.
- Akış aparatı mikroskop taşımaya hazırlamak: kelepçe kapalı giriş ve çıkış kabarcık tuzak ve yeşil ve turuncu yan eki şişesi vanaları kapalı kelepçe. Onlar ısıyla sırasında gevşetin gibi vidalı kapakları PD ve FB için sıkı olduğundan emin olun.
- Pompa taşıma kolaylaştırmak için boru üzerinden bağlantısını kesin. O zaman mikroskop yanında ikincil bir kaba Pinar karıştırıcı dahil olmak üzere tüm bileşenleri taşımak.
- Akış cihazı görüntüleme için hazır olun.
- Pinar karıştırıcı sıcaklık probu takın ve eki şişeye 37 ° C'ye ısınma başlar Medya 300 devir / dakikada karıştırın ve bunu korumak için bütün deneyin.
- Mikroskobunun slaydı bağlayabilir ve eğer sıkıca güvenli için gerekli bant kullanın.
- Kabarcık tuzak bir vakum için eklemek (kelepçe henüz geri alabilirim).
- Pompa akış aparatı, Şekil 1' de belirtilen konumda bağlayın.
- 3.3 mL/dk akış hızında pompa başlatmak, yaklaşık 5-10 s için çalışmasına izin vermek ve kabarcık tuzak giriş/çıkış kelepçe kaldır.
- Pompa eki şişeye ısınır iken çalıştırmaya devam etmek izin verir. Medya akış sistemi dolaşan bir kez normal çalışma için kontrol.
- Bağlantı parçaları, hava içinde sızıntı için kontrol pompası (bazı kabarcık oluşumu normaldir) veya aşağı sızdırma sıvı akış yukarı.
- (Bu tıkanmış bir filtre veya bir overtightened kulak kelepçe gösterebilir değil, Eğer) büyüme medya flask, PD ve FB tüm damlama medya giriş tüp olduğundan emin olun.
- Mikroskop kullanarak ekli veya çalışırken hücre kanal slayt üzerinde denetimi. Hücreleri aşırı sayıda kurulum sırasında kontaminasyon gösterebilir veya kabarcık politetrafloroetilin (PTFE) membran tuzak değiştirilmesi gerekir.
- Eki şişesi ve kuluçka odası 37 ° C de olduğunda yeterli gecede kültür mantar hücrelerinin 1 x 106 hücre/mL ulaşmak için ek şişeye ekleyin.
Not: µL içinde eklemek için birim şu formül kullanılarak hesaplanır: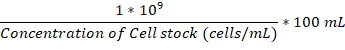
- Hücreleri alışmana izin vermek için 15 dakika bekleyin.
- Hücreleri akışını başlatmak için her iki büyüme şişesi vanalar kapatılması sırasında her iki yeşil ve turuncu yan eki şişesi vanaları açın.
- Hücreleri slayt ulaşmak izin vermek yaklaşık 5 dakika bekleyin ve ilk (Bu kez yeşil yan boru uzunluğu bağlı olarak ayarlanması gerekebilir) mikroskop odaklama için bekleyin. Bu süre içinde mikroskop için önceki deneylerde kullanılan aynı görüntü parametreleri ayarlayın. Bu ilk çalıştırma ise, aşağıdaki adımları izleyin:
- Bir düşük büyütme hava amaca geçin.
- Bulmak ve bir bağlı hücre veya küçük tomurcuklanma hücre odaklanmak.
- Kondansatör Köhler aydınlatma için yapılandırmak sonra darkfield için geçin.
- Çekim hızı 300 ms için ayarlayın.
- Küçük hücreli dim kadar henüz açıkça görülebilir (arka plan oranı yaklaşık 7-8'in bir sinyal bir tomurcuklanma kızı hücre için makul bir değerdir) arka plan aydınlatma yoğunluğunu ayarlayın. Not/aydınlatıcı yoğunluğu gelecekteki deneyler için işareti.
- Görüntüyü her 2 dakikada 2 h üzerinden elde etmek için yazılım yapılandırın.
- Resim alma ek faz için başlar. Geri yaklaşık 5 sonra kontrol edin ve bu odak sağlamak için 10 dk korunmuştur. Eğer değilse, hemen sonraki resme kazanılır sonra odak ayarlamak deneyin.
- Hemen eki aşaması tamamlandıktan sonra dosyayı kaydedin ve sonra her iki ek şişesi vanalar kapatılması sırasında her iki yeşil ve turuncu yan büyüme şişesi vanaları açın. Eğer herhangi bir boru içinde kuluçka odası sahne çarpmamayınasıl için dikkat ediniz.
- Termometre sonda gelen Pinar karıştırıcı çıkarın.
- Eki şişeye Pinar karıştırıcı çıkarın ve büyüme şişeyi onun yerine yerleştirin.
- Görüntüyü her 15 dk 22 h üzerinden elde etmek ve resim alma büyüme aşaması için başlamak belgili tanımlık bilgisayar yazılımı yapılandırın. Yeniden odaklanarak gerekli olmamalı, ama birkaç saat sonra akışı cihazlar kontrol için önerilir.
- Bağlantı parçaları, hava içinde sızıntı için kontrol pompası (tekrar bazı kabarcık oluşumu normal) veya aşağı sızdırma sıvı akış yukarı
- (Bu tıkanmış bir filtre, bir overtightened kulak kelepçe veya kullanılan hücreler flocculate Eğer, dikenli teller uygun bir takunya gösterebilir değil, Eğer) büyüme medya flask, PD ve FB tamamı onay medya damlama.
- FB sıvı düzeyini denetleyin. Medya şişe (üzerinde 1,5 cm yukarıda üst kısmındaki filtre) üst yaklaşılıyorsa (Bu şişeyi baskı altında olduğu gibi gevşetin değil) her iki screwcaps sıkın. Onlar daha fazla sıkın değil, (Bu bir sızıntı neden olabilir rağmen) deneme devam ve sonraki temizlendikten sonra PD ve FB kauçuk contalar yerine.
- Büyüme aşaması alma tamamlandığında, dosyayı kaydedin ve bir ses basınç turuncu tarafında bültenleri gibi yazdırmaz yeşil ve turuncu yan eki şişesi vanaları açın. Onlar medya üzerinde en az birkaç santimetre kadar her iki medya şişeler gelen yeşil yan boru üzerinde yukarı çekin. Pompa tüm medya çok daha kolay temizlik yapar boru üzerinden kaldırmak için yüksek hızda (yaklaşık 100 mL/dak veya tutun pompa hızlı ileri butonuna) çalıştırın. Ne zaman boşluk, akış aparatı pompası kesin ve çıkarmak o--dan mikroskop.
3. temiz akışı aparatı
- Tüm autoclavable bileşenleri (Tek Kişilik Kullanım bileşenleri, kabarcık tuzak ve sıcaklık probu) kaldırın ve otoklav akışı cihazları 30 dk. atmak için kullanılan tek kullanımlık bileşenleri, temiz sonda ile % 70 etanol ve bir kenara koyun bubble tuzak.
- Isıyla bittikten sonra medya, atmak ve durulama ve medya şişeler bir kenara. Kabarcık tuzak yeniden bağlanın, (yeniden) temizlik için kullanılacak bir ibidi kanal slayt bağlayın ve Şekil 1' de gösterilen yeri pompa akış sistemi bağlayın.
- Kelepçe turuncu yan büyüme şişesi kapak kapalı.
- Yaklaşık 200 mL su katılmamış çamaşır suyu kabı yerleştirin. Kauçuk stoper çamaşır suyu yerleştirin ve çamaşır suyu akışı aparatı (hariç tüm filtreleri) boyunca dolaşmaya yüksek hızda pompa başlatın. Pompa yüksek bir hızda bırakarak giymek ve tüp kırmak çamaşır suyu ile dolu bir kez durdurmak pompa.
- 15 dakikadır beyazlatma sonra lastik stoper kabı tutun ve pompa çamaşır suyu akışı cihazlar kaldırmayı yeniden başlatın.
- 3.4 ve 3.5 akış sistemi durulama için çamaşır suyu yerine aşırı su ile iki kez yineleyin. Diğer temizlik maddeleri zarar veya filtreler yapışmasına neden olabilir çünkü bu süre içinde sadece su ile filtreleri temizle.
- Normalde (2 µm FB gelen) 0.2 µm medya filtre kabı suya kauçuk stoper ile 3,6 adımı bağlanmak boru yerleştirin.
- Giriş genellikle kulak kelepçe rağmen kolaylıkla ayrı çekilebilir 20 µm inline filtresinin bağlı hortum çıkarın.
- Bir vakum filtre şişesi ve boru bir yedek 3 delikli tıpa ile uzun bir bölümünü akışı cihazlar bağlayabilirsiniz bir vakum sistemi oluşturmak için kullanın.
- Bu vakum sistemi 20 µm filtre koya koya bağlanın ve vakum başlatın; Bu ölü hücreleri çıkarmadan ters yönde filtrelerden su çeker.
- Çekme en az 200 mL su filtreleri, sonra Kaldır su filtre satırları boşaltmak için su boru aracılığıyla.
- 20 µm filtresinden vakum sistemi söküp filtrenin normal tüp takın.
4. miktarının videoları
Not: Tüm dosyaları çalışmak için etiket görüntü dosya (TIF) biçimine dönüştürülmesi gerekir. Ayrıca, deneyler arasında karşılaştırmak için yukarıda da açıklandığı gibi tüm görüntüleri görüntüleme parametreleri ve aynı mikroskop ile alınır çok önemlidir.
- Download ve ImageJ zaten yüklü değilse yükleyin.
- Tamamlayıcı makro dosyasını indirin ve ImageJ\macros klasörüne yerleştirin.
- Sağlanan makro ayarlayın:
- ImageJ önceki bir denemede üzerinden görüntü yığını açıp hücreleri mevcut olan bir saat noktasına seçin.
- Menü aracılığı ile arasından seçim "görüntü | Türü | 8-bit".
- Menü aracılığı ile arasından seçim "görüntü | Ayarlamak | Eşik". "Koyu arka plan" kutuyu kontrol et. Sağ tarafta açılan menüden set kırmızı.
- Tüm hücreleri kırmızı (bazı sigara hücreli speckling yolunda ve dışarı makro tarafından işlenir) en az aşırı gürültü ile kaplıdır kadar daha düşük değerini ayarlayın. Bu daha düşük değerini not alın.
- Eşik pencere ve görüntü aç kapatın.
- Menü aracılığı ile arasından seçin yapın "Eklentiler | Makrolar | Düzenle". Bir dosyayı açmak isteyip istemediğiniz sorulduğunda: "bir klasör düzey yukarı taşımak", sonra makrolar klasörü seçin ve akış biyofilm miktar makro dosyayı açın.
- 4.3.4. adımda belirlenen değere "setThreshold (15, 255);" tüm örneklerini 15 değeri değiştirin. Dosyayı kaydedin ve bu pencereyi kapatın.
- Menü aracılığı ile arasından seçin yapın "Eklentiler | Makrolar | Install"ve akış biyofilm miktar dosyası seçin.
- Şimdi, altında "eklentileri | Makrolar" menüsü, çeşitli video quantifications için altı yeni seçenekler görüntülenir. Tam çözümleme ve elde edilen veriler üzerinde tüm kullanılabilir çözümlemesi ve otomatik olarak çıktı dosyaları oluşturmak isteyip istemediğiniz sorulduğunda eki ve büyüme video dosyaları seçin.
Sonuçlar
Temsili resim normal bir gecede hızlandırılmış deney vahşi-türü C. albicans kullanarak hücreleri 37 ° C'de Şekil 2A ve Tamamlayıcı Video 1' de görülebilir. Görüntüleri görünürlüğünü artırmak için gelişmiş kontrast olmuştur. Miktar özgün verilerin gerçekleştirilmiş ve temsilcisi grafikler Şekil 2' deBgörülebilir. Bu grafikler oluştur...
Tartışmalar
Akış sistemi kullanarak yukarıda belirtildiği gibi nicel hızlandırılmış videoları mantar biyofilm büyüme ve gelişme üretimi için izin verir. Deneyler arasında karşılaştırmalar için izin vermek için görüntüleme parametreleri aynı kalmasını sağlamak için kritik öneme sahiptir. Bu mikroskop için Köhler aydınlatma (birçok kılavuzları online Bu işlem için kullanılabilir) her deneme için ayarlanır sağlanması içerir. Parametreleri görüntüleme bir yana, akış aparatı ile çalış...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Yazarlar Dr. Wade Sigurdson değerli giriş akışı aparat tasarımı sağlamak için kabul etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Pump | Cole Parmer | 07522-20 | 6 |
| Pump head | Cole Parmer | 77200-60 | 6 |
| Tubing | Cole Parmer | 96410-14 | N/A |
| Bubble trap adapter | Cole Parmer | 30704-84 | 3 |
| Bubble trap vacuum adapter for 1/4” ID vacuum line | Cole Parmer | 31500-55 | 3 |
| In-line filter adapter (4 needed) | Cole Parmer | 31209-40 | 8,9 |
| Orange-side Y | Cole Parmer | 31209-55 | 7 |
| Green-side Y | ibidi | 10827 | 2 |
| * Slides | ibidi | 80196 | 4 |
| * Slide luers | ibidi | 10802 | 4 |
| Vacuum assisted Bubble trap | Elveflow/Darwin microfluidics | KBTLarge - Microfluidic Bubble Trap Kit | 3 |
| Media flasks | Corning | 4980-500 | 1 |
| 0.2 µm air filter | Corning | 431229 | 1 |
| Threaded glass bottle for PD and filter flask (2 needed) | Corning | 1395-100 | 5,10 |
| Ported Screw cap for PD and filter flask (2 needed) | Wheaton | 1129750 | 5,10 |
| Screwcap tubing connector | Wheaton | 1129814 | 5,10 |
| Tubing connector beveled washer | Danco | 88579 | 5,10 |
| Tubing connector flat washer | Danco | 88569 | 5,10 |
| Clamps for in-line filters and downstream Y (7 needed) | Oetiker/MSC Industrial Supply Company | 15100002-100 | 7,8,9 |
| Clamp tool | Oetiker/MSC Industrial Supply Company | 14100386 | N/A |
| 20 μm in-line media filter | Analytical Scientific Instruments | 850-1331 | 8 |
| 10 μm in-line media filter | Analytical Scientific Instruments | 850-1333 | 9 |
| 2 μm inlet media filter | Supelco/Sigma-Aldrich | 58267 | 10 |
| * 0.22 µm media filter | Millipore | SVGV010RS | 11 |
| * 0.22 µm media filter “adapter” | BD Biosciences | 329654 | 11 |
| Rubber stopper | Fisher Scientific | 14-131E | 1 |
| Hotplate stirrer with external probe port | ThermoFisher Scientific | 88880006 | N/A |
| Temperature probe | ThermoFisher Scientific | 88880147 | N/A |
Referanslar
- Pankhurst, C. L. Candidiasis (oropharyngeal). BMJ clinical evidence. 2012, 1304 (2012).
- Ramage, G., Vandewalle, K., Wickes, B. L., López-Ribot, J. L. Characteristics of biofilm formation by Candida albicans. Revista iberoamericana de micología. 18 (4), 163-170 (2001).
- Nobile, C. J., Mitchell, A. P. Regulation of cell-surface genes and biofilm formation by the C. albicans transcription factor Bcr1p. Current biology: CB. 15 (12), 1150-1155 (2005).
- Blankenship, J. R., Mitchell, A. P. How to build a biofilm: a fungal perspective. Current opinion in microbiology. 9 (6), 588-594 (2006).
- Araújo, D., Henriques, M., Silva, S. Portrait of Candida Species Biofilm Regulatory Network Genes. Trends in microbiology. 25 (1), 62-75 (2017).
- Lane, W. O., et al. Parallel-plate flow chamber and continuous flow circuit to evaluate endothelial progenitor cells under laminar flow shear stress. Journal of visualized experiments. (59), e3349 (2012).
- Bakker, D. P., van der Plaats, A., Verkerke, G. J., Busscher, H. J., van der Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Applied and environmental microbiology. 69 (10), 6280-6287 (2003).
- Zhang, W., Sileika, T. S., Chen, C., Liu, Y., Lee, J., Packman, A. I. A novel planar flow cell for studies of biofilm heterogeneity and flow-biofilm interactions. Biotechnology and bioengineering. 108 (11), 2571-2582 (2011).
- Uppuluri, P., Lopez-Ribot, J. L. An easy and economical in vitro method for the formation of Candida albicans biofilms under continuous conditions of flow. Virulence. 1 (6), 483-487 (2010).
- Diaz, P. I., et al. Synergistic interaction between Candida albicans and commensal oral streptococci in a novel in vitro mucosal model. Infection and immunity. 80 (2), 620-632 (2012).
- McCall, A., Edgerton, M. Real-Time Approach to Flow Cell Imaging of Candida albicans Biofilm Development. Journal of fungi. 3 (1), 13 (2017).
- Zhang, B., Zerubia, J., Olivo-Marin, J. -. C. Gaussian approximations of fluorescence microscope point-spread function models. Applied optics. 46 (10), 1819-1829 (2007).
- Tati, S., et al. Candida glabrata Binding to Candida albicans Hyphae Enables Its Development in Oropharyngeal Candidiasis. PLoS pathogens. 12 (3), 1005522 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır