Method Article
Üç boyutlu Timik Kültür Sistemi Murine indüklenen Pluripotent Kök Hücre kaynaklı Tümör Antijen-spesifik Timik Emigrants oluşturmak için
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu makalede, üç boyutlu (3D) timik kültür sistemi tarafından tümör antijene özgü indüklenen pluripotent kök hücre kaynaklı timik göçmenler (iTE) oluşturmak için yeni bir yöntem açıklanmaktadır. iTE, proliferasyon, hafıza oluşumu ve tümör baskılanması kapasitesine sahip naif T hücreleri ile yakından ilişkili T hücrelerinin homojen bir alt kümesidir.
Özet
Önceden yeniden düzenlenmiş T hücre reseptörlerinin kalıtım (TCB) ve epigenetik gençleştirme indüklenen pluripotent kök hücre yapmak (iPSC) türetilmiş T hücreleri benimseyen T hücre tedavisi için umut verici bir kaynak (ACT). Ancak, iPSC'den rejenere T hücreleri üretmek için klasik in vitro yöntemler, fenotipik ve işlevsel olarak naif T hücrelerinden farklı olan doğuştan benzer veya ölümcül farklılaşmış T hücrelerine neden olur. Son zamanlarda, yeni bir üç boyutlu (3D) timik kültür sistemi CD8αβ homojen bir alt kümesi oluşturmak için geliştirilmiştir+ antijene özgü T hücreleri saf T hücre benzeri fonksiyonel fenotip ile, çoğalma kapasitesi de dahil olmak üzere, bellek oluşumu , ve in vivo tümör baskılanması. Bu protokol, iPSC kaynaklı timik göçmenler (iTE) olarak belirlenen klinik olarak ilgili iPSC türetilmiş T hücrelerinin üretimine olanak sağlarken, aynı zamanda sonraki işlevleri açıklamak için güçlü bir araç sağlayarak, anormal gelişimsel kaderleri önler timik seçimden sonra T hücre olgunlaşması için.
Giriş
Benimseyen T hücre tedavisi (ACT) ileri kanserli bazı hastalar için etkili bir tedavi olabilir. Ne yazık ki, birçok hasta tümör regresyon deneyimi yok, ve transfer hücreleri infüzyon sonra devam etmek için başarısız. Bu infüzyon T hücrelerinin kalitesi nedeniyle olabilir. Bir ACT fare modeli naif veya daha az farklılaştırılmış merkezi bellek T hücreleri ile karşılaştırıldığında gösterdi, terminaldidi diferansiye edici hücreler daha az güçlü canlı lık zayıf nedeniyle1, bir gözlem de klinik veriler tarafından desteklenen2, 3 .
Mevcut ACT etkinliğini artırmak için bir çaba, T hücre kaynaklı pluripotent kök hücreleri (T-iPSC) kapsamlı 4 çalışılmıştır4,5. T hücreleri T-iPSC'ye yeniden programlandığında ve T hücrelerine yeniden farklılaştırıldığında, TCR genlerinin yeniden düzenlenmiş yapılandırması T-iPSC ve daha sonra yeniden farklılaştırılmış T hücreleri tarafından devralınır. Bu nedenle, T-iPSC'nin sınırsız in vitro genleşmeden geçme kapasitesi, tümör antijene özgü T hücrelerinden üretildiğinde neoantijene özgü T hücre reseptörlerini (TCR) taşıyan olgunlaşmamış T hücrelerinin verimli bir şekilde çoğaltılmasını sağlar6 ,7. Ancak, olgun T hücrelerine T-iPSC farklılaşması için kesin yöntem, hangi daha az farklılaştırılmış fenotip ve daha iyi anti-tümör potens ile kanser antijene özgü T hücrelerinin üretimine izin verecek, açıklanmış olmaya devam etmektedir.
T-iPSC farklılaşma OP9 murine stromal hücrelerin in vitro6,7T hücreleri üretmek için iyi kurulmuş bir yöntemdir ifade insan Notch ligand DLL1 co-kültür istihdam . Fareler de ve insanlarda, bu co-kültür sistemi sürekli iPSC ayırt edebilirsiniz, böylece immature T hücre soy aşamasına kadar blastosist aşamasından gelişimsel olayları özetleme6,7. Bu biyoteknolojik gelişmelere rağmen, CD4 +CD8 +çift pozitif (DP) aşamasından sonra fizyolojik farklılaşmaya ulaşmak hala zordur. Bunun nedenlerinden biri, in vivo CD4+CD8- ve CD4-CD8+ tek pozitif (SP) T hücrelerinin timus, yabancı antijen özgüllüğü olan T hücrelerinin olgunlaşmave seçiminden sorumlu bir organ, ancak oluşturulur otomatik reaktivite8değil. Bu seçici süreçler sırasıyla pozitif ve negatif seçim olarak tanımlanır. Ancak timustaki T hücrelerini olgunlaştırmak için gerekli moleküler mekanizmaların çoğu hala tam olarak anlaşılamamıştır ve bu da bu süreci in vitro olarak yeniden yapılandırmayı zorlaştırmaktadır. Bu fizyolojik engeli aşmak amacıyla, çeşitli gruplar anti-CD3 antikorları veya agonist peptidler kullanarak TCR kompleksini uyarmışlardır. Bu in vitro teknikler, cd3, CD8αβ, TCRαβ ve CD62L gibi anahtar T hücre belirteçlerini ifade eden hücre ürünleri üretirken tümör antijen özgüllüğünü korur. Ne yazık ki, bu ekstratimik yöntemlerle üretilen T hücreleri eksik pozitif seçilim, doğuştan benzer özellikler, TCR non-spesifik öldürme, hafıza oluşumu için yetersizlik ile karakterize hücrelerin geniş bir heterojen popülasyon u vivo8,9,10,11kalıcı olmayan anti-tümör etkileri . Bu anormallikler, bu tür hücrelerin lenfoma ve hem deri hem de kemik anormallikleri de dahil olmak üzere çeşitli yan etkileri tetikleyebileceği endişeleri yükseltti, terapötik uygulamalar için kullanılırsa12,13,14 .
Mevcut in vitro diferansiyasyon sistemlerinde eksik olan fizyolojik sinyalleri yeniden oluşturmak için tümör antijene özgü T-iPSC hasat timus kullanılarak farklılaştırılmıştır. T hücrelerinin intra-timmik gelişimini incelemek üzere tasarlanan klasik fetal timus organ kültürü (FTOC) sistemi, timik eğitimi başarıyla tamamlayan T hücrelerini başarıyla üreten 3Boyutlu kültür sistemi kullanılarak geliştirilmiştir. IPSC kaynaklı timik göçmenler (iTE) olarak belirlenen bu post-timik T hücreleri, naif benzeri özellikler sergiledi15. iTE, kurulan B16 melanom tümörlerine karşı bir fare modelinde proliferasyon, hafıza oluşumu ve yeterli anti-tümör etkileri gösterdi. Bu makalede, 3B kültür sistemi (Şekil 1) kullanılarak buyeni FTOC sisteminin protokolü ayrıntılı olarak açıklanmaktadır.
Protokol
Tüm hayvan deneyleri Ulusal Kanser Enstitüsü (NCI) Kurumsal Hayvan Bakım ve Kullanım Komiteleri tarafından onaylandı ve NIH kurallarına uygun olarak yapıldı.
1. OP9/DLL1 Hücrelerinin iPSC ile Ortak Kültür için hazırlanması
- OP9 ortamda Kültür OP9/DLL1 hücreleri (α-minimum esansiyel orta [α-MEM] + 20% ısı sızdırmaz fetal sığır serumu [FBS] + 1x penisilin-streptomisin + askorbik asit [50 ng/mL] ve mono-tiyogliserol [100 nM]) 37 °C. OP9/DLL1 hücreleri %80-95 biraraya geldiğinde, 1x magnezyum, kalsiyum ve fenol kırmızısı serbest fosfat tamponlu salin (bundan böyle PBS olarak anılacaktır) ile bir kez yıkayın.
- 37 °C'de %0,05 tripsin ve 5 dk inkübatör olmak için 4 mL ekleyin. Daha sonra 4 mL OP9 ortam ekleyin, tek bir hücre süspansiyonu yapmak için pipetleme yaparak hücre tabakasını ayırın.
- Hücre süspansiyonuna 100 μm'lik bir süzgeçten 50 mL konik bir tüpe aktarın. 4 °C'de 5 dk için 300 x g'de santrifüj, supernatant aspire ve OP9 media 12 mL resuspend.
- Yeni bir 10 cm hücre kültürü Petri kabı üzerine OP9/DLL1 hücre süspansiyon plaka 2 mL ve OP9 medya ek 8 mL ekleyin. Her 2-3 günde bir geçişi tekrarlayın.
NOT: FBS ve kültür koşullarının kalitesi, OP9/DLL1 hücrelerinin iPSC farklılaşmasını destekleme yeteneklerini kaybetmeden genişlemesini sağlamak için çok önemlidir. Bu nedenle, hücre farklılaşmasını ve yaşlanmayı önlemek için FBS ve geçişin %80'inde tutarlı bir şekilde önceden değerlendirilmesi önerilir. Ayrıca OP9/DLL1 hücrelerinin yeterli dondurulmuş stok yapmak ve her 4-6 haftada yeni bir stok çözülmek önemlidir.
2. In Vitro Farklılaşma iPSC Immature T Hücrelerine
-
0. günde, OP9/DLL1 uyumlu yemeklerinde iPSC ortak kültürüne başlayın.
- Trypsinizasyon ile tek hücreli süspansiyon olarak hasat iPSC (37 °C'de %0,05 tripsin içinde 5 dk), hücreleri toplayın ve 4 °C'de 5 dk için 300 x g'da santrifüj.
- OP9 ortamının 10 mL'si başına 1,0 x 105 iPSC'de süpernatant ve resuspend hücreleri aspire edin. Plaka 1.0 x 105 iPSC bir confluent OP9/DLL1 10 cm çanak üzerine.
NOT: OP9/DLL1 10 cm'lik yemekler % 90-100 biraraya geldiklerinde iPSC farklılaşması için kullanılır. Birleşim farklılıkları iPSC farklılaşmasının verimliliğini etkileyebilir.
- 3. günde, eski medyayı aspire edin ve 10 mL taze OP9 ortamla değiştirin.
-
6. günde, geçit hücreleri.
- Her 10 cm'lik op9 kabını 10 mL PBS ile yıkayın. Çanak başına %0,05 tripsin 3 mL ekleyin ve oda sıcaklığında 3-5 dakika (RT) kuluçkaya yatırın.
- 4 mL OP9 ortam ekleyin ve hücreleri nazik pipetleme ile toplayın. Hücreleri 100 μm'lik bir hücre süzgecive santrifüjden 300 x g'de 4 °C'de 5 dk geçirin. Supernatant atın.
- 10 mL farklılaşma ortamındaki hücreleri (OP9 media, 5 ng/mL fare Flt3 ligand [FLT3L] ve 5 ng/mL fare IL-7) ve plaka hücresi süspansiyonu yeni 10 cm OP9/DLL1 konakıcı çanak üzerine uzaklaştırın.
- 9. günde, eski medyayı aspire edin ve 10 mL taze farklılaşma ortamı ile değiştirin.
-
IPSC kolonilerinde kardiyomiyositler gözlendiğinde 11. 4 °C'de 5 dk için 300 x g'da döndürün.
- Süpernatant aspire ve farklılaşma ortamının 24 mL resuspend. Plaka iPSC bir confluent OP9/DLL1 6-well plaka (4 mL /iyi).
-
15. günde, tüm yapışık olmayan hücreleri toplayın ve 40 μm'lik hücresüzden süzün.
- 4 °C'de 5 dk için 300 x g'da döndürün.
- 2.5.1 adımLarını tekrarlayarak her 3-4 günde bir yapışık olmayan hücreleri geçirmeye devam edin.
3. 3D Timik Organ Kültürü iTE oluşturmak için
- Hasat fare fetal timik loblar ve deoksiguanozin tarafından endojen lenfositlerin dağıtmak (dGUO) daha önce açıklandığı gibi16.
- DGUO tedavisinin 7. (MEM-NEAA) + 1x penisilin-streptomisin + [1:1000] 2-mercapto etanol).
- Timik loblar ile tüm nitroselüloz membranları 10 cm'lik bir tabağa aktarın. Tek tek lobları membrandan forceps ile ayırArak ortama daldırılmalarını bekleyin. Zarları atın. RT'de 1 saat kuluçka.
- Timik lobları tam ortamlı 10 cm'lik yeni bir tabağa aktarın ve RT'de 1 saat kuluçkaya yatırın.
- Forseps kullanarak, çanak (birer bir) için timik loblar düzeltmek ve diğer taraftan merkezinde 100-200 μm derin kesi yapmak ve lob t hücre atası göçü kolaylaştırmak için lob çapının yarısını genişleterek.
- Timik lobları tam bir farklılaşma ortamıyla dolu yeni bir 10 cm'lik bir tabağa aktarın (tam ortam + 5 ng/mL fare IL-7 + 5 ng/mL fare FLT3L + 5 ng/mL SCF).
- İsteğe bağlı olarak, alt ve üst düzey ızgaralara sahip 3B kültür plakaları kullanıyorsanız, asılı damlaların buharlaşmasını ve kurumasını önlemek için her iki ızgarayı da steril PBS ile doldurun.
- Adım 3.6'dan 3D kültür plakasının her kuyuya bir dGuo-treated timik lob içeren tam 30 μL'lik tam ortam aktarın.
- OP9/DLL1 eş kültüründen (16-21 gün) (adım 2.6.2) yapışık olmayan T soy hücrelerini (iPSC kaynaklı olgunlaşmamış T hücreleri) toplayın ve 20 μL ortam başına 2-5 x 103 T soy hücrelerinde yeniden askıya alın.
- 3B kültür plakasındaki her bir timik loba 20 μL T soy hücresi süspansiyonu ekleyin. Bir gecede %5 CO2 ile 37 °C'de kuluçkaya yatırın.
- P200 pipetini 30 μL'ye ayarlayın ve timik lobları çevreleyen tüm hücreleri temizlemek için her kuyudan birkaç kez pipetleme yaptıktan sonra ortamı aspire edin. Ortamı atın ve 30 μL tam ortam ekleyin. Loblara göç etmeyen ekstra olgunlaşmamış T hücrelerini çıkarmak için bu işlemi 5-7 kez tekrarlayın. Bundan sonra her gün 25-30 μL'lik bir ortam değiştirin.
- Işık mikroskobu ile 4-5 gün başından itibaren lobların etrafında iPSC kaynaklı timik göçmenlerin (iTE) bir hale oluşumunu doğrulayın.
- Lob kesintisi olmadan medya borulama tarafından günlük iTE toplamak. Ortamı her gün değiştirin ve yaklaşık 12 güne kadar toplamaya devam edin.
- Hasat edilen iTE moleküler analizler(Şekil 2, Şekil 3, Şekil 4ve Şekil 5) veya in vivo transplantasyon deneyleri için kullanıma hazırdır.
4. Antijen Sunum Hücrelerinin Hazırlanması (APC)
- Servikal çıkış ve yukarıda açıklandığı gibi bir laboratuvar soaker mat üzerine yerleştirin tarafından bir C57BL/6 fare kurban.
- Dalağını çıkarın ve 100 μm'lik bir hücre süzgecinin üzerine yerleştirin. Tek hücreli süspansiyon yapmak için 12 mL şırınga pistonkullanarak dalağını süzgeçüzerine sıkıştırın.
- Hücre süspansiyonuna steril 40 μm hücreli süzgeçten aktarın. Hücreleri peletlemek için 4 °C'de 5 dk için 300 x g'de süspansiyonu santrifüj edin.
- Kırmızı kan hücrelerini (RBC) dışlamak için amonyum-klorür-potasyum (ACK) lisis tamponunun 2 mL'lik kısmını aspire edin ve hücre peletini yeniden askıya alın. RT 5 dakika kuluçka.
- 10 mL PBS ekleyerek ACK lisis tamponu söndürün. 4 °C'de 5 dk için 300 x g'da santrifüj ile hücreleri pelet.
- Supernatant aspire ve tam medya 10 mL hücre pelet resuspend ve 10 cm steril Petri kabına aktarın.
- Hücre çoğalmasını önlemek için bir ışınlama cihazı (γ-radyasyon) kullanarak 3500 rad ile splenositışınışın.
- Hemen ışınlanan hücreleri bir gecede 37 °C'lik bir kuluçka makinesine ve kültüre geri döndürün.
- Işınlanmış hücreleri APC olarak kullanın veya hücre bankerinde dondurun.
5. Antijen ile APC Pulsing
- Neubauer hemositometre ve trypan mavi boya kullanarak Canlı ışınlanmış APC sayMak. 37 °C'de 30 dakika boyunca peptidler (hgp100) veya nükleoprotein ile Incubate APC.
- Herhangi bir ekstra peptid kaldırmak için 10 mL PBS ile APC'yi iki kez yıkayın.
- 100 IU IL-2 ve 5 ng/mL IL-7 ile tam ortamda 1:1 oranında iTE'yi sayın ve APC ile karıştırın. Aliquot 100 μL hücre karışımı (toplam konsantrasyon: 1 x 106 hücre/mL) ultra-düşük eki U alt 96 iyi plaka ve kültür her kuyu içine 48 h için 37 °C.
- 48 saat sonra, çok kanallı pipet ve geçiş kullanarak yeni bir plaka için daha sonra her 2-3 gün hücreleri aktarın.
-
3. günde, hücreleri hücre içi antikorla boyanarak sitokin sekresyon profilinianaliz edin ve akış sitometrisi ile analiz edin (Şekil 3).
- 0.67 μL/mL protein taşıma inhibitörü (örneğin, GolgiStop) ekleyin ve sitokinlerin hücre içi birikimini artırmak için 37 °C'de 6 saat kuluçkaya yatırın. 10 mL PBS ile yıkayın.
- 3 mL soğuk (4 °C) PBS'deki hücreleri yeniden askıya alın ve yavaş yavaş 1 mL soğuk %4 paraformaldehit (PFA) çözeltisi ekleyin.
- 10 dakika sonra hücreleri 300 x g'de 4 °C'de 5 dk'da aşağı doğru çevirin, süpernatant atın ve 10 mL PBS ile yıkayın.
- 1 mL PBS + %1 FBS + %0.1 niyonik yüzey aktif maddedeki hücreleri yeniden askıya alın ve 10-15 dk boyunca 4 °C'ye yerleştirin.
- Antikorekleyin, numuneleri ışıktan koruyun ve 4 °C'de 30 dakika boyunca yerleştirin.
- 4 °C'de 5 dakika boyunca 300 x g'de hücreleri aşağı doğru çevirin, süpernatantatın ve 10 mL PBS ile yıkayın.
- 4 °C'de 5 dakika boyunca 300 x g'de hücreleri aşağı doğru çevirin ve 1 mL PBS'de hücreleri yeniden askıya alın. Hücreler akış sitometresinde analiz edilmeye hazırdır.
Sonuçlar
Co-kültürlü fetal timuslar iPSC kaynaklı T soy hücrelerinin timik loblara göç edip edemeyeceğini analiz etmek için kesitlenmiştir. Tohumsuz kontrol lobları bir astrosit benzeri timik epitel web17ile karakterize bir doku mimarisi vardı 17 , endojen CD3+ hücrelerin konuşlandırılmış. Öte yandan, iPSC kaynaklı immatür T hücreleri ile tohumlanmış timik loblar CD3+ mononükleer hücreler le doldurularak iPSC kaynaklı olgunlaşmamış T hücrelerinin loblara geçişini gösterir (Şekil 2A).
Timik mikroortama göç eden ve olgunlaştırılan T hücreleri daha sonra iTE olarak ortaya çıkış alameti olarak ortaya çıkan t hücreleridir. Henotik karakterizasyonlarını test etmek için C57BL6 timositlerinin akış sitometrik analizi, Pmel iPSC kaynaklı immatür T hücreleri (ekstratimik) ve timik loblardan (iTE) çıkan hücreler yapıldı. OP9/DLL1'deki ekstratimik T hücreleri, pozitif seçim belirteci MHC-I ekspresyonu olmaksızın CD4+CD8+ (DP) T hücreleri ve CD8αSP T hücrelerini gösterirken, iTE'de cd8αSP MHC-I+ T hücre fenotiplerinin net bir popülasyonu vardı. timik loblardan çıkmadan önce pozitif seçilim yoluyla başarılı bir geçiş. iTE sürekli yüksek proliferatif yetkinlik, sitokin üretimi, periferik sağkalım ve lenfoid homing18,19,20ile ilişkili belirteçleri olan MHC-I ve CD62L ifade . Bu fenotip timus20tek pozitif T hücrelerinin en olgun popülasyonu olan M2 SP timositleri ile uyumludur , bu da iTE'nin normal timik gelişimsel programdan geçtiğini göstermektedir (Şekil 3). ITE neslinin verimliliğini izlemek için, bireysel timik loblardan çıkan hücreler izole edildi. 7. günde, timik loblar günde ortalama 1 x 103 canlı CD8SP CD45.1+ CD3+ iTE (Şekil3B)üretilmiştir. Benzer bir iTE üretim hızı 3D timik ko-kültürün 6 gün 12'den güne kadar görülmektedir.
Timtik olarak eğitilmiş iPSC kaynaklı immatür T hücrelerinin fonksiyonel özelliklerini gözlemlemek için antijene bağımlı aktivasyon ve sitokins salgıları analiz edildi. Alakasız bir peptit (nükleoprotein) varlığında, Pmel-iTE önemli miktarda TNF-α, IL-2 veya IFN-γ salmadı. Pmel T hücreleri (hgp100) için bilandıran peptid ile uyarıldığında, Pmel-iTE sağlam miktarlarda TNF-α ve IL-2 salgılarken, aynı zamanda düşük miktarlarda IFN-γ (Şekil4)üretirken, timolojik olarak eğitilmiş iTE'nin biliş peptidlerini tanıyabilir ve doğal son timik göçmenlerin (RTE) benzer bir profil ile efektör sitokinler salgılar.
OP9/DLL1'de timik eğitim li veya iltizorolmayan iPSC türetilmiş T soyu hücreleri arasındaki transkripsiyonel farklılıkları incelemek için (yani iTE karşı ekstratimmik T hücreleri), bu iki popülasyonüzerinde RNA-seq analizi yapıldı ve karşılaştırıldı OP9/DLL1 (DP) ve primer naif CD8+ Pmel T hücreleri kullanılarak farklılaşan DP T soy hücrelerine. T hücre ontojeninde önemli rol oynayan 102 genin ekspresyonu, timosit aktivasyonu ve hafıza oluşumu15,20,21,22olarak analiz edilmiştir. İncelenen bu dört popülasyonun temel bileşen analizi, iTE saf T hücrelerine daha yakın kümelenmiş halde yken, ekstratimikolarak üretilen DP ve CD8SP T hücrelerinin bir araya toplanmış olduğunu göstermiştir (Şekil 5). Bu veriler, iTE'nin naif T hücrelerine ekstratimik yöntemlerle üretilen T soy hücrelerinden daha yakın bir fenotip olduğunu göstermektedir.
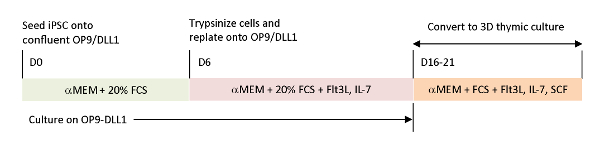
Şekil 1 : OP9/DLL1 ve 3D timik kültürü kullanarak iPSC'nin iTE'ye farklılaşmasına şematik genel bakış. Protokol üç ayrı farklılaştırma adımı içerir; (Sol) op9/DLL1 üzerinde hematopoetik soy hücrelerine (gün 0-6), (Orta)hematopoetik soy hücrelerinden OP9/DLL1 üzerinde sitokinler ile immatür T hücrelerine (gün 6-16-21) ve (Sağ) olgunlaşmamış T hücrelerinden (gün 16-21) 3D timik kültür sistemi kullanarak iTE. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
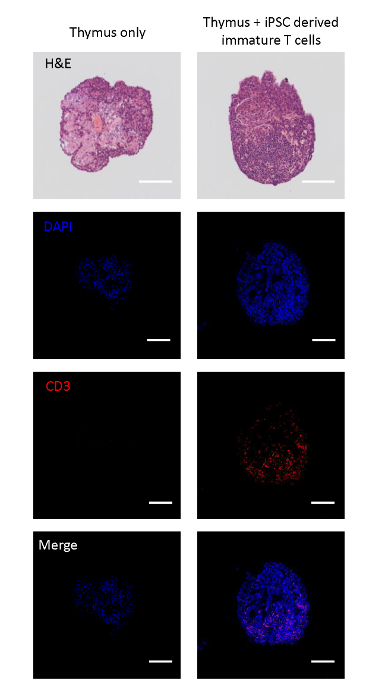
Şekil 2 : IPSC kaynaklı immatür T hücreleri ile tohumlanmış timik lobların immüno-histokimyası. Üst: IPSC kaynaklı olgunlaşmamış T hücrelerinin tohumlama ve olmadan bir timik lob H & E boyama. İkinci yukarıdan aşağıya: DAPI (çekirdek), CD3 (T hücresi) ile boyanmış kesitli lobların konfokal görüntüleri ve birleştirme. Ölçek çubukları = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
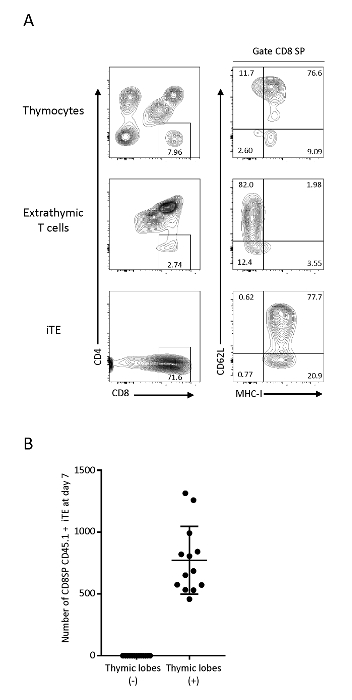
Şekil 3 : iTE post-timik T hücre fenotip gösterir. (A) Timositlerin FACS analizleri, ekstratimik T hücreleri (OP9/DLL1 eş kültür sistemi) ve Pmel-iTE. Canlı hücreler konjenik CD45+. CD8 SP popülasyonları CD62L ve MHC-I ekspresyonu için daha fazla analiz edildi. (B) Cd8SP CD45.1 iTE ortalama sayısı lob başına gecede üretilen 7 gün ön tohumlama sonra. Veriler 12 bağımsız deneyden toplandı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
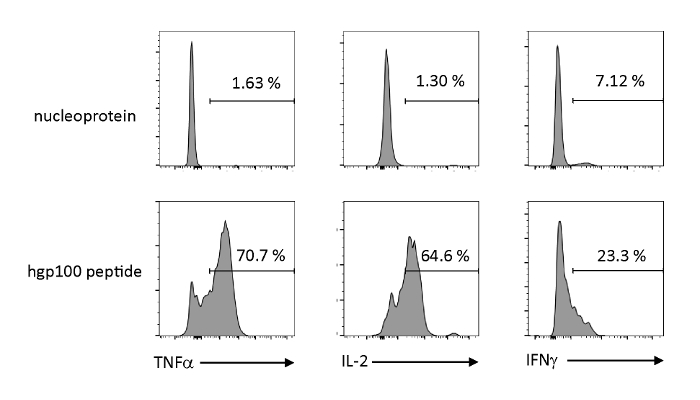
Şekil 4 : iTE antijene özgü stimülasyon ile çeşitli sitokinler üretir. ITE ile sitokinlerin hücre içi üretiminin FACS analizleri. iTE, üç gün boyunca alakasız (nükleoprotein) veya bilangül (hgp100) peptid ile önceden yüklenmiş AKO'larla birlikte kültürlendi. Sağ üst kadranlarda gösterilen sayılar sitokin üreten iTE yüzdelerini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
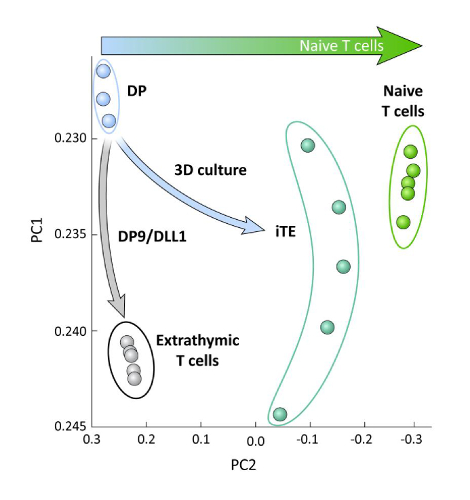
Şekil 5 : Tüm transkriptom analizi, iTE gen ekspresyonunda naif bir CD8'e doğru bir kayma olduğunu ortaya koymaktadır + T hücre programı. DP, extrathymic CD8 SP, iTE ve naif T hücrelerinden RNA-seq verilerinin ilke bileşen analizi (PCA). (GSE105110 genel veritabanı kullanılarak timik farklılaşmaile ilgili 102 genin analizi) 15. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Tümör antijene özgü T hücrelerini yenilemek için T-iPSC kullanarak gelişmiş kalıcılık ile genç hücreler üreterek ACT mevcut engellerin birçok üstesinden gelebilir. OP9/DLL1 co-kültür sistemini kullanarak çeşitli yöntemler CD8 SP hücreleri üretmek için bildirilmiştir rağmen6,7,10,13 bu ifade CD8 molekülleri ve tümör antijen-spesifik TUK, küresel gen ekspresyon desenleri ve fonksiyonel analizler, bu ekstratiyetik olarak yenilenen CD8SP hücrelerinin naif T hücrelerinden farklı olduğunu göstermektedir (Şekil 4). Burada, murine T-iPSC'den yüksek sadakat ve homojenlik ile iPSC kaynaklı timmik göçmenler (iTE) üretebilen 3Boyutlu bir timik kültür sistemini tanımlıyoruz. iTE, küresel gen ekspresyonu deseni ve bellek oluşumu ve in vivo anti-tümör etkisi gibi işlevsellikte naif T hücrelerine benzemektedir15.
Klasik FTOC sistemi in vitrotimik seçimi yeniden özetlemek için bir yoldur. Bu timositlerin intra-timik gelişimi için kullanılan23, ve RTE oluşturmak için kullanılan FTOC birkaç rapor vardır24. Ancak, FTOC sisteminin çeşitli sınırlamaları vardır. Yapay bir organ kültüründe oksijen eksikliği ile başa çıkmak için, çeşitli gruplar ya yarı kuru membran tabanlı kültür23kullandık , ya da yüksek oksijen daldırma kültür sistemleri25. Ancak, hiçbir akım yöntemi sürekli post-timik T hücrelerinin homojen bir popülasyon oluşturabilirsiniz. Klasik FTOC sisteminin sınırlamalarını aşmak için, geleneksel yöntemlere göre teknik iyileştirmeler sağlayan bir 3D timik kültür sistemi tasarladık15. Örneğin, 3D timik kültür yöntemimizi kullanarak, maksimal oksijen değişimi ve yüzey-lob mekanik stres yokluğu daha fizyolojik bir ortamda timik loblar tutun. Ayrıca, uzun vadeli kültür, olgun T hücrelerinin timik loblardan doğal olarak çıkışını izin verir. Son olarak, gerçek zamanlı gözlem ve mikro-manipülasyon, timik lobları fiziksel olarak rahatsız etmeden ortam alışverişini ve sürekli bir iTE toplamasını sağlar. Böylece, 3D timik kültür yöntemi önemli teknik iyileştirmeler yanı sıra daha önce mevcut değildi timik seçilmiş naif T-hücreleri çalışma için bir cadde sağlar.
Bu 3D timiç kültür sistemini kullanarak iTE başarılı nesil için birkaç önemli nokta vardır. FBS ve kültür koşullarının kalitesi, OP9/DLL1 hücrelerinin iPSC farklılaşmasını destekleme yeteneklerini kaybetmeden genişlemesini sağlamak için çok önemlidir. Bu nedenle, FBS çok ön değerlendirme yanı sıra sürekli hücre farklılaşması ve senescence önlemek için% 80 birleşimi ile passaging öneririz. Ayrıca, bir araya gelmesi farklılıkları verimliliklerini etkileyebilir gibi, bir confluent OP9/DLL1 kültürü, iPSC'nin olgunlaşmamış T hücrelerine in vitro farklılaşması için gereklidir. Son olarak, timik lobların embriyonik yaşı iTE üretimi için çok önemlidir. E14.5 - 15.5 timik loblar kullanmanızı öneririz.
Her yeni protokolde olduğu gibi, bu yöntemin de sınırlamaları vardır ve iyileştirmeye tabidir. Burada sunulan kültür tekniği iki haftalık bir süre için günde timik lob başına yaklaşık 1000 iTE üretir. Oksijen konsantrasyonunun optimizasyonu, ortam hacmi ve 3D kültür plakası tipi de dahil olmak üzere daha fazla değişiklik le iTE üretimi artırılabilir. Sitokinlerin eklenmesi veya çıkarılmasının yanı sıra sitokin konsantrasyonundaki değişiklikler de iTE veriminin artmasına katkıda bulunabilir.
Burada sunulan 3D timik kültür sisteminin tamamen ekstrem vivo bir sistemde timik göçmenler üretebildiği göz önüne alındığında, bu teknik T dahil olmak üzere çeşitli immünolojik ve benimsive hücre transferi araştırma projelerine uygulanabilir, ancak bunlarla sınırlı değildir hücre farklılaşması, post-timik T hücre olgunlaşması ve hematopoetik ataveya kök hücrelerden antijene özgü T hücrelerinin üretimi. Bu yöntem insan örnekleri için doğrudan geçerli olmasa da, iTE ve 3D timik kültür sistemi pozitif ve negatif seçilimin moleküler mekanizmalarını açıklamak için büyük bir potansiyele sahip olup, bir kültür sisteminin oluşturulmasını kolaylaştırabilir. ACT için klinik olarak ilgili tümör antijenspesifik naif benzeri T hücrelerinin üretimi.
Açıklamalar
Yazarlar Raul Vizcardo, Nicholas D. Klemen ve Nicholas P. Restifo bekleyen uluslararası patent başvurusu PCT/US2017/65986, başlıklı 13 Aralık 2017, "Thymic Göçmen Hücrelerinin İzole veya Saflaştırılmış Nüfus Hazırlama Yöntemleri mucitler vardır ve Tedavi Yöntemleri Aynı kullanarak."
Teşekkürler
Biz lütfen OP9/DLL1 hücre hattı sağlamak için Hiroshi Kawamoto ve Kyoko Masuda teşekkür ederiz. Alan B. Hoofring ve Erina Z.'ye teşekkür ederiz. O grafik yardım için. Bu araştırma, ABD Ulusal Kanser Enstitüsü (ZIA BC010763) Intramural Araştırma Programı ve NCI, NIH Hücre Tabanlı Tedavi Merkezi için Kanser Moonshot programı tarafından desteklenmiştir. Çalışma milstein Aile Vakfı tarafından da desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Chemicals, Peptides and Recombinant Proteins | |||
| 2-deoxyguanosine | Sigma-Aldrich | 312693-72-4 | |
| 2-Mercaptoethanol (1,000x) | Thermo Fisher Scientific | 21985-023 | |
| ACK Lysing Buffer | Gibco | A1049201 | |
| Ascorbic acid | Sigma-Aldrich | A8960 | |
| Blasticidin | Thermo Fisher Scientific | R21001 | |
| FBS | Gemini | 100-500 | |
| Flt-3 ligand | R&D Systems | 427-FL | |
| GlutaMAX (100x) | Thermo Fisher Scientific | 35050-061 | |
| hgp100 | Genscript | 282077-1, KVPRNQDWL | |
| Interleukin-2 | R&D Systems | 402-ML | |
| Interleukin-7 | R&D Systems | 407-ML | |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| MEM powder | Gibco | 61100061 | |
| Monothioglycerol | Sigma-Aldrich | M-6145 | |
| Nucleoprotein | Global Peptides | ASNENMETM | |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | |
| Phosphate buffered saline pH 7.4 (1x) | Thermo Fisher Scientific | 10010-023 | |
| Puromycin | Thermo Fisher Scientific | A1113803 | |
| RPMI 1640 | Gibco | 11875093 | |
| Sodium Pyruvate | Thermo Fisher Scientific | 11360-070 | |
| Stem Cell Factor (SCF) | R&D Systems | 455-MC | |
| Stemfactor LIF, Mouse Recombinant | STEMGENT | 03-0011-100 | |
| Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300-062 | |
| Cell Culture Vessels and others | |||
| 10 cm dish | Corning, Inc. | 353003 | |
| 12 mL Syringe | Covidien Monoject | 22-652-090 | |
| 6 well plate | Corning/Coster | 3516 | |
| Cell strainer 100 μm | Fisher Scientific | 22-363-549 | |
| Cell strainer 40 μm | Fisher Scientific | 22-363-547 | |
| Forceps | DUMONT | 0108-5PO | |
| Lab soaker mat | Versi-Dry | Cat. EF2175CX 74018-00 | |
| Membrane filters ( 0.8 μm, 47diam) | Whatman | WHA7408004 ALDRICH | |
| Perfecta3D Hanging Drop Plate | Sigma-Aldrich | HDP1096 | |
| U Bottom 96 well plate | Corning/Coster | 3799 | |
| Experimental Cell lines | |||
| CD3-iPSC | Vizcardo et al., Cell Report 2018 | N/A | |
| MEF-iPSC | Vizcardo et al., Cell Report 2018 | N/A | |
| Mouse Embryonic Fibroblasts (MEF) | ATCC | SCRC-1040; RRID:MGI:5007926 | |
| OP9/N-DLL1 | Riken Bioresource center | Cat# RCB2927; RRID:CVCL_B220 | |
| Pmel-iPSC | Vizcardo et al., Cell Report 2018 | N/A | |
| Experimental mouse models | |||
| B6.SJL-PtprcaPepcb/BoyCrCrl | Charles River | Strain Code 564; RRID:IMSR_CRL:564 | |
| C57BL/6N | NCI/Charles River | N/A | |
| Pmel-1 mice | Overwijk et al. | J Exp Med 198(4):569-80 | |
| Antibodies | |||
| Anti-aTCR | Biolegend | 109202; RRID:AB_313425 | |
| Anti-CD3 | abcam | ab11089; RRID:AB_369097 | |
| Anti-CD4 | BD Biosciences | 553730; RRID:AB_395014 | |
| Anti-CD44 | BD Biosciences | 559250; RRID:AB_398661 | |
| Anti-CD45.1 | BD Biosciences | 553775; RRID:AB_395043 | |
| Anti-CD45.2 | BD Biosciences | 553772; RRID:AB_395041 | |
| Anti-CD62L | BD Biosciences | 560516; RRID:AB_1645257 | |
| Anti-CD69 | BD Biosciences | 552879; RRID:AB_394508 | |
| Anti-CD8a | BD Biosciences | 557959; RRID:AB_396959 | |
| Anti-CD8b | BD Biosciences | 550798; RRID:AB_393887 | |
| Anti-H-2Kb | BD Biosciences | 553570; RRID:AB_394928 | |
| Anti-IFN-g | BD Biosciences | 557998; RRID:AB_396979 | |
| Anti-IL-2 | BD Biosciences | 554428; RRID:AB_395386 | |
| Anti-TCRb | Thermo Fisher Scientific | 35-5961-81; RRID:AB_469741 | |
| Anti-TCRVb13 | BD Biosciences | 553204; RRID:AB_394706 | |
| Anti-TNFa | BD Biosciences | 557644; RRID:AB_396761 |
Referanslar
- Gattinoni, L., et al. Wnt signaling arrests effector T cell differentiation and generates CD8+ memory stem cells. Nature Medicine. 15 (7), 808-813 (2009).
- Rosenberg, S. A., et al. Durable complete responses in heavily pretreated patients with metastatic melanoma using T-cell transfer immunotherapy. Clinical Cancer Research. 17 (13), 4550-4557 (2011).
- Singh, N., Perazzelli, J., Grupp, S. A., Barrett, D. M. Early memory phenotypes drive T cell proliferation in patients with pediatric malignancies. Science Translational Medicine. 8 (320), 320-323 (2016).
- Crompton, J. G., Clever, D., Vizcardo, R., Rao, M., Restifo, N. P. Reprogramming antitumor immunity. Trends of Immunology. 35 (4), 178-185 (2014).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Vizcardo, R., et al. Regeneration of human tumor antigen-specific T cells from iPSCs derived from mature CD8(+) T cells. Cell Stem Cell. 12 (1), 31-36 (2013).
- Nishimura, T., et al. Generation of rejuvenated antigen-specific T cells by reprogramming to pluripotency and redifferentiation. Cell Stem Cell. 12 (1), 114-126 (2013).
- Takada, K., Kondo, K., Takahama, Y. Generation of Peptides That Promote Positive Selection in the Thymus. Journal of Immunology. 198 (6), 2215-2222 (2017).
- Yamagata, T., Mathis, D., Benoist, C. Self-reactivity in thymic double-positive cells commits cells to a CD8 alpha alpha lineage with characteristics of innate immune cells. Nature Immunology. 5 (6), 597-605 (2004).
- Themeli, M., et al. Generation of tumor-targeted human T lymphocytes from induced pluripotent stem cells for cancer therapy. Nature Biotechnology. 31 (10), 928-933 (2013).
- Serwold, T., Hochedlinger, K., Inlay, M. A., Jaenisch, R., Weissman, I. L. Early TCR expression and aberrant T cell development in mice with endogenous prerearranged T cell receptor genes. Journal of Immunology. 179 (2), 928-938 (2007).
- Lei, F., et al. In vivo programming of tumor antigen-specific T lymphocytes from pluripotent stem cells to promote cancer immunosurveillance. Cancer Research. 71 (14), 4742-4747 (2011).
- Maeda, T., et al. Regeneration of CD8alphabeta T Cells from T-cell-Derived iPSC Imparts Potent Tumor Antigen-Specific Cytotoxicity. Cancer Research. 76 (23), 6839-6850 (2016).
- Serwold, T., et al. T-cell receptor-driven lymphomagenesis in mice derived from a reprogrammed T cell. Proceedings of the National Academy of Sciences of the United States of America. 107 (44), 18939-18943 (2010).
- Vizcardo, R., et al. Generation of Tumor Antigen-Specific iPSC-Derived Thymic Emigrants Using a 3D Thymic Culture System. Cell Reports. 22 (12), 3175-3190 (2018).
- Jenkinson, W., Jenkinson, E., Anderson, G. Preparation of 2-dGuo-treated thymus organ cultures. Journal of Visualized Experiments. (18), (2008).
- Hamazaki, Y., Sekai, M., Minato, N. Medullary thymic epithelial stem cells: role in thymic epithelial cell maintenance and thymic involution. Immunological Reviews. 271 (1), 38-55 (2016).
- Vivier, E., et al. Innate or adaptive immunity? The example of natural killer cells. Science. 331 (6013), 44-49 (2011).
- Rosen, S. D. Ligands for L-selectin: homing, inflammation, and beyond. Annual Review of Immunology. 22, 129-156 (2004).
- Hogquist, K. A., Xing, Y., Hsu, F. C., Shapiro, V. S. T Cell Adolescence: Maturation Events Beyond Positive Selection. Journal of Immunology. 195 (4), 1351-1357 (2015).
- Best, J. A., et al. Transcriptional insights into the CD8(+) T cell response to infection and memory T cell formation. Nature Immunology. 14 (4), 404-412 (2013).
- Schmitz, I., Clayton, L. K., Reinherz, E. L. Gene expression analysis of thymocyte selection in vivo. International Immunology. 15 (10), 1237-1248 (2003).
- Nitta, T., Ohigashi, I., Takahama, Y. The development of T lymphocytes in fetal thymus organ culture. Methods in Molecular Biology. 946, 85-102 (2013).
- Ueno, T., et al. Role for CCR7 ligands in the emigration of newly generated T lymphocytes from the neonatal thymus. Immunity. 16 (2), 205-218 (2002).
- Watanabe, Y., Katsura, Y. Development of T cell receptor alpha beta-bearing T cells in the submersion organ culture of murine fetal thymus at high oxygen concentration. European Journal of Immunology. 23 (1), 200-205 (1993).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır