Method Article
Rekombinant füzyon protein flüoresan proteaz tahlil Platform ve onların jel Renaturation kullanımı
Bu Makalede
Özet
Burada, N-terminal hexahistidine/maltoz-bağlayıcı protein ve nikel-nitrilotriacetic yüzeye bağlı floresan protein erimiş rekombinant yüzeylerde kullanan bir son zamanlarda geliştirilen proteaz tahlil platform ayrıntılı yordam mevcut asit manyetik özel boncuk. Bir sonraki jel analiz Sodyum Lauryl Sülfat-polyacrylamide jel elektroforez tarafından ayrılmış tahlil örnekleri de sunulmaktadır.
Özet
Proteaz canlıların çeşitli biyolojik yollar ve patogenezinde önemli rolleri nedeniyle çalışılmış enzimlerdir; Bu nedenle, onlar önemli uyuşturucu hedefleridir. Rekombinant füzyon protein yüzeylerde kullan seçeneğine göre proteolitik aktivite incelenmesi için bir tahlil manyetik özel-boncuk-tabanlı platform geliştirdik. Bu tahlil sistem kullanımını göstermek için bir protokol 1 (HIV-1) proteaz tipi virüs, insan immün yetmezlik örneği sunulmaktadır. Proteaz, mutagenesis, kinetik, inhibisyon veya özgüllük çalışmaları, enzim aktivitesi ölçümleri gibi biyokimyasal karakterizasyonu tanıtılan tahlil platformu verimli bir şekilde kullanılabilir ve yüksek-üretim için uygun olabilir substrat tarama veya diğer proteolitik enzimler için adapte.
Bu tahlil sistemde virüs (TEV) ve HIV-1 proteaz ve C-terminal floresan protein bölünme siteler için tütün etch, N-terminal hexahistidine (onun6) ve maltoz bağlayıcı protein (MBP) Etiketler uygulanan yüzeylerde içerir. Yüzeylerde Escherichia coli hücrelerinde etkin bir şekilde üretilebilir ve nikel (Ni) - chelate - boyalı boncuk kullanarak kolayca saf. Tahlil sırasında fluorimetry tarafından ölçülebilir floresan bölünme parçaları sürümü boncuk bağlı yüzeylerde proteolitik bölünme yol açar. Ayrıca, bölünme reaksiyonlar Sodyum Lauryl Sülfat-polyacrylamide jel elektroforez (SDS-sayfa) tarafından çözümlenebilir. Kısmi renaturation floresan Proteinlerin moleküler ağırlık ve floresan dayalı algılama sağlar gibi jel renaturation tahlil bileşenleri için bir iletişim kuralı da tanımlanmıştır.
Giriş
Proteolitik enzimler metabolik yollar ve endüstriyel uygulamalar, de önemleri nedeniyle en yoğun olarak incelenen enzim grubuna da ait. Onların rol viral hastalıklarda, kan pıhtılaşma, kanser, düzenlenmesi ve kardiyovasküler ve nörodejeneratif hastalıklar uyuşturucu keşif alanında önemli hedefleri proteaz yapar. Bu nedenle, substrat özgüllüğü detaylı karakterizasyonu ve inhibitörü faiz proteaz (PR) profil oluşturma çok önemli ve tercihen hızlı, maliyet-etkin ve güçlü biyokimyasal deneyleri1,2tarafındangerçekleştirilir, 3.
Günümüzde, homojen, floresan peptid tabanlı ve yüksek işlem hacmi tarama (HTS) bileşik profil oluşturma için ilaç keşif alanında uygulanan tüp bebek proteaz deneyleri büyük çoğunluğu vardır-uyumlu platformlar4. Ayrıca, etiketli peptidler sadece Kütüphane tarama için uygun değildir, ama aynı zamanda seçilen yüzeyler üzerinde kinetik parametrelerin enzim tayini için harika araçlar sunuyoruz. Nereye belgili tanımlık substrate etiketleme mümkün değil, diğer durumlarda, ayrılık tabanlı deneyleri proteolitik reaksiyonlar3kinetik özelliklerini değerlendirmek için olası bir çözüm sağlayabilir.
Genel olarak, tüp bebek proteaz deneyleri substrat iki tür kullanımını temel alan: kısa peptidler veya tüm proteinler. Nerede bölünme kısa peptid sıralarının yeterince bölünme özelliklerini yansıtmak, bu gibi durumlarda, aşağıdaki standart yaklaşımları tabidir: (i) oksitlenmiş insülin B-zinciri, (ii) gibi standart protein yüzeylerde test İnceleme Kombinatorik Kimya veya (iv) tarafından oluşturulan sentetik ve fluorescently etiketli Peptid kitaplıklarının eleme piyasada bulunan yüzeyler diğer proteaz, (III), genetik yöntemler kullanarak, örneğin, biyolojik görüntüleme teknolojileri5, 6. Yanı sıra geleneksel sınıflandırma, roman diğer platformlar da substrat üretimi için kullanılabilir (örneğin, oluşumu Proteom kaynaklı peptid kütüphaneler7 veya özel alt türlerinden rekombinant füzyon gibi genetik Yöntemler protein bazlı yüzeylerde8,9,10,11,12).
Tüm yukarıda belirtilen substrat türleri ve deneyleri kendi avantaj ve sınırlamalar vardır ve birleştirme ve/veya bilinen platformları avantajları iyileştirilmesi tahlil biçimleri geliştirilmesi hala rağbet görmektedir. Burada bir protokol rekombinant yüzeylerde kullanır bir floresan proteaz ayrılık tabanlı tahlil için açıklamak. 6 ve TEV PR, C-terminal floresan protein (FP) (Şekil 1A) için doğrudan bağlı faiz substrat dizisi tarafından izlenen bir denetim bölünme siteye erimiş MBP Etiketler Bu füzyon proteinler oluşur. Bir DNA dizisi için ilgi bir bölünme sitesi 'klonlama kaset' kodlama klonlama bir tek tüp ligasyonu tepki içine daha önce restriksiyon tarafından Doğrusallaştırılmış hangi ifade plazmid tarafından gerçekleştirilebilir.
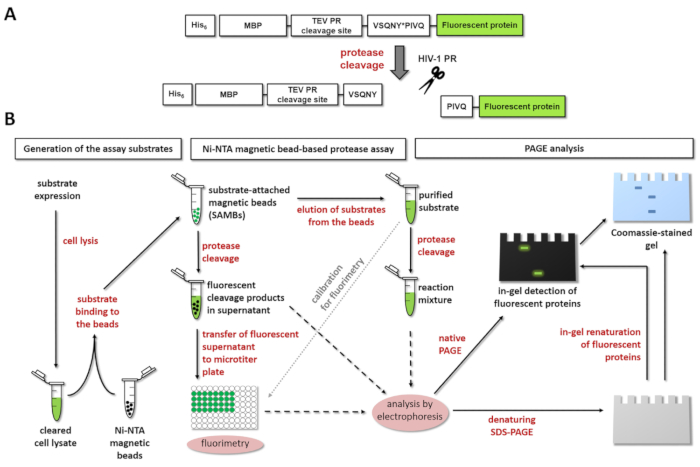
Şekil 1: Floresan proteaz tahlil prensibi. (A) şematik temsili bir floresan substrat ve onun bölünme tarafından insan immün yetmezlik virüsü tip 1 (HIV-1) proteaz gösterilir. Oku HIV-1 proteaz matris/kapsid bölünme sitesi dizisi içinde bölünme konumunu gösterir (VSQNY * PIVQ). (B) Floresan yüzeylerde enzim reaksiyonları manyetik boncuk-tabanlı Ni-NTA tahlil ve polyacrylamide Jel Elektroforez, de, iş akışı diyagramda gösterildiği gibi analiz etmek için kullanılabilir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Proteolitik deneyleri benzer Rekombinant protein yüzeylerde içeren-bir benzeşme etiketi, proteolitik bölünme site ve floresan protein-si olmak zaten kullanarak tarif edilmiştir, ancak8,9,10, sistem sunulan burada bütünleştirmek ve bu yöntemlerin avantajları geliştirmek niyetinde. Önemli bir fark olan füzyon protein yüzeylerde bu tahlil platform MBP protein çözünürlük13 geliştirmek ve TEV PRs için bir denetim bölünme sitede bulunması ile donatılmıştır. Ayrıca, yüzeylerde son derece istikrarlı ve substrat toplama önlemek için monomeric bir forma sahip yeni nesil floresan proteinleri içerir. Yanı sıra daha önce yayımlanmış uygulama formları14mTurquoise2 ve mApple erimiş işte ayrıca Sarı floresan protein (mEYFP) Floresan etiketi bir monomeric içeren rekombinant bir substrat tarafından verilen sonuçları gelişmiş göstermektedir. Bu vesile ile sistem uyumluluğunu floresan diğer proteinler ile göstermek ve proteaz tahlil tarafından elde edilebilir sonuçlar genel bazı türleri temsil eder.
Rekombinant füzyon protein E. coli BL21(DE3) hücrelerde ifade edilir ve yüzeyler tahlil bir nikel-nitrilotriacetic asit (Ni-NTA) için kullanılır-kaplı manyetik-özel-boncuk-ekli formu. C-terminal bölünme ürünleri içine süpernatant bölünme üzerine boncuk yüzeyinden faiz proteaz tarafından kurtulmuş olan. Ayrılması (enzim ve bölünme ürünleri içeren) Süpernatant sonra gelen manyetik boncuklar, floresans enzim bölünme özelliklerini belirlemek için ölçülebilir. Aksine önceden açıklanan yöntemleri, burada anlatılan sisteminde substrat ve C-terminal bölünme ürünleri miktarda benzersiz olarak bir detaylı substrat kalibrasyon prosedürü dayalı sayısal. Tahlil sistem bir SDS-sayfa analiz tahlil örnekleri tarafından desteklenebilir; bir sonraki floresan jel görselleştirme Elektroforez hemen sonra veya jel renaturation nondenatured ve denatüre floresan bileşenleri, sırasıyla14sonra uygulanabilir.
Esneklik ve 'klonlama kaset' yapısını dizileri yapı içine çeşitli zaman ve maliyet-etkin bir ekleme izin ve böylece, substrat kütüphanelerin üretimi teşvik etmektedir. Tüm tahlil adımları Otomasyon ve HTS uyumlu, olduğundan sistem Örneğin, proteaz özgüllük ölçümleri ve mutagenesis çalışmaları ya da aynı zamanda etkin bir şekilde endüstriyel proteaz inhibitörü tarama için kullanılmak için özellikle çekici olabilir ve/veya antiviral ilaç geliştirme, de.
Enzim kinetik parametrelerin (kkedi, Km) tarafından geliştirilen ayırma tabanlı tahlil belirlenebilir; Bu nedenle, o zaman tabii ki substrat-bağımlı ve inhibisyon çalışmaları gibi bireysel enzim kinetik ölçümleri gerçekleştirmek uygun olabilir. Bu rekombinant füzyon protein yüzeylerde iyi alternatifler için sık kullanılan sentetik chowing yüzeylerde sağlamak ve polyprotein yüzeylerde onların yüksek benzerliği nedeniyle, temsil ettikleri doğal olarak meydana gelen kanıtlıyor enzim-substrat etkileşimleri daha doğru.
Protokol
1. substrat-kodlama ifade plazmid nesil
- PDest O'nun6- MBP-FP ifade plazmid tarafından PacI ve NheI restriksiyon linearize. PDest O'nun6- MBP-FP üretimi için bkz. Bozóki ve ark.14.
- PDest O'nun6- MBP-FP ifade plazmid 1.500-2.000 µg, 2 µL her PacI ekleyin ve NheI restriksiyon, 10 x arabelleği 10 µL (bkz. Tablo reçetesi) ve su (NFW) bir microcentrifuge tüp 100 µL nükleaz ücretsiz.
- 37 ° C için 1 h reaksiyon karisimin kuluçkaya.
- 6 DNA mor boya tepki karışıma yükleme x 20 µL ekleyin ve bölünme ürünleri kullanarak % 1'özel jel elektroforez ile ayırın. 1 kB DNA merdivenle standart olarak uygulanır.
- 20 mL TAE arabellek (40 mM Tris, 20 mM asetik asit, 1 mM EDTA, pH 8,5) içeren 20 µL SYBR yeşil çözüm 15dk için jel durulama ve keskin bir araç kullanarak özel jel dışarı Doğrusallaştırılmış plazmid grubun tüketim.
Not: bir karanlık-okuma mavi transilluminator (DRBT) tarafından jel aydınlatıcı süre, yaklaşık 7-8 KB ayrık ve parlak bir grup olarak Doğrusallaştırılmış pDest O'nun6- MBP-FP plazmid görünür. - Doğrusallaştırılmış ifade plazmid jel dilim üzerinden bir jel ekstraksiyon kiti üreticinin talimatlarına göre kullanarak arındırmak.
- Substrat sıra Doğrusallaştırılmış pDest O'nun6- MBP-FP ifade plazmid yerleştirin.
- (FWD) ileri ve geriye doğru (REV) E. coli kodon optimize oligonükleotid astar faiz substrat dizisi için kodlama tavlamak.
Not: Tavlanmış astar PacI ve NheI kısıtlama endonükleaz bölünme sitelere (Şekil 2) karşılık gelen yapışkan uçlar tarafından çevrili.- Doğrusallaştırılmış ifade plazmid 200 ile mix 150 ng ng ileri sar ve 200 astar 0.2 mL polimeraz zincir tepkimesi (PCR) içinde tüp ve 17 µL için NFW ekleyerek ses seviyesini REV oligonükleotid ng.
- Karışım 2 min için 65 ° C'de ve sonra en az 2 min için 4 ° C'de kuluçkaya.
- Tavlanmış astar ekleme Doğrusallaştırılmış plazmid tarafından tüp ligasyonu gerçekleştirin.
- T4 ligaz arabelleği (10 x) 2 µL ve T4 ligaz 1 µL Doğrusallaştırılmış plazmid ve tavlanmış astar içeren karışıma ekleyin.
- 16 ° C 16 h için ligasyonu karisimin kuluçkaya.
- (FWD) ileri ve geriye doğru (REV) E. coli kodon optimize oligonükleotid astar faiz substrat dizisi için kodlama tavlamak.

Resim 2 : Proteolitik bir bölünme için kodlama oligonükleotid astar sıra site. İleriye ve geriye doğru astar kodlamak VSQNY * PIVQ bölünme sitesi sıra HIV-1 PR Tamamlayıcı oligonükleotid astar tavlama sonra kısa çift iplikçikli DNA buna PacI ve NheI restriksiyon karşılık gelen yapışkan biter, içerir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
- BL21(DE3) yetkili hücreleri 100 µL ligasyonu karışımı 5 µL tarafından dönüşümü ve lysogeny suyu (LB) ağar kaplamalar ampisilin içeren hücrelerin yayıldı.
Not: Floresan proteinler sadece başarılı bir ligasyonu sonra N-terminal füzyon etiketlerle aynı açık okuma çerçevesi içinde olacak. Birkaç gün sonra dönüştürme, (ilgi eklenen bölünme sitesi için kodlama ifade plazmid içeren) koloniler görünür floresans bile kullanarak veya kullanmadan bir DRBT gösterir. - Gliserol stok görülen kolonilerden hazırlayın.
- Ampisilin (, son bir konsantrasyon olarak 100 µg/mL) içeren LB orta 5 µL içeren bir 50 mL santrifüj tüpü içine ayrı bir koloni yıkayın.
- 8 h 37 ° C'de sürekli olarak 220 devir / dakikada sallayarak süre kuluçkaya; o zaman, hücreleri tarafından Santrifüjü 1000 x g oda sıcaklığında 5 min için de hasat.
- Yavaşça 1 mL % 80 gliserol çözeltisi (distile su ile seyreltilmiş) hücrelerde askıya alma ve askıya alınmasına 500 µL 10 mm MgCl2 çözüm ekleyin.
- Süspansiyon için dondurucu bir tüp aktarın ve hisse senetleri-70 ° C'de depolayın
- Oluşturulan plazmid dizi DNA sıralama tarafından doğrulayın.
- (1,7 adımda hazırlanan) gliserol stokunun 10 µL 5 mL 50 mL santrifüj tüpü içinde 100 µg/mL ampisilin içeren LB orta de ekleyin.
- 16 h için 37 ° C'de süspansiyon sürekli olarak 220 devir / dakikada sallayarak süre kuluçkaya; o zaman, 2.000 x g 4 ° C'de 10 dakika için de Santrifüjü tarafından hücreleri hasat
- Hücre Pelet plasmid miniprep tarafından gelen ifade plazmid kiti ( Tablo malzemelerigörmek) izole etmek için üreticinin yönergelerini according ve arıtılmış plazmid DNA sıralama için kullanın.
Not: için sıralama, 5'-GATGAAGCCCTGAAAGACGCGCAG-3' (ileri) ve 5'-GCAAGGCGATTAAGTTGGGTAACGC-3' (ters) oligonükleotid astar kullanılabilir.
2. ifade floresan yüzeylerde
- Starter kültür hazırlamak.
- (1,7 adımda hazırlanan) gliserol stokunun 10 µL 5 mL 50 mL santrifüj tüpü içinde 100 µg/mL ampisilin içeren LB orta de ekleyin.
- 15 h için 37 ° C'de süspansiyon sürekli olarak 220 devir / dakikada sallayarak süre kuluçkaya.
- 50 mL taze LB orta bir 500 mL steril Erlenmeyer şişesi 100 µg/mL ampisilin içeren için bakteriyel Kültür (5 mL) aktarın.
- 37 ° C'de hücreler bir absorbans 0,6-0,8 adlı bir 600 nm dalga boyu sürekli olarak 220 devir / dakikada sallayarak süre için büyür.
Not: tetrasiklin tedavi 2.5 adımda uygulanacak ise, bu 600 den fazla 0,6 bir absorbans için hücreleri büyümek için tavsiye edilmez nm. - İzopropil β-D-1-thiogalactopyranoside (IPTG) 1 mM son konsantrasyon için protein ifade ikna etmek için ekleyin.
- Tetrasiklin tedavi uygulanmazsa, sürekli olarak 220 devir / dakikada sallayarak süre kültür 37 ° C'de 3 h için kuluçkaya ve iletişim kuralı adım 2.6 ile devam edin. Tetrasiklin tedavi uygulanırsa, iletişim kuralı adımları 2.5.1-2.5.3 ile devam edin.
Not: Daha uzun bir olgunlaşma süresi E. coli hücreleri tarafından üretilen bazı FPs olabilir (bkz. önceki çalışma)16,17; Bu gibi durumlarda, protein çeviri isteğe bağlı olarak ile tetrasiklin tedavi, substrat çözeltisi floresan verimini artırmak için tutuklanabilirsin.- 37 ° C'de 2 h hücre süspansiyon sürekli olarak 220 devir / dakikada sallayarak süre kuluçkaya; daha sonra tetrasiklin çözüm (, son bir konsantrasyon olarak 200 µg/mL) ekleyin.
- Göre sürekli olarak 220 devir / dakikada sallayarak süre olgunlaşma zamanı tercih 37 ° C'de floresan proteinin hücre kültürü kuluçkaya.
- 2 x 25 mL 50 mL santrifüj tüpleri temiz ve hücreleri tarafından Santrifüjü 4.000 x g 4 ° C'de 15 dakika de hasat kültür aktarım
- Süpernatant atmak ve bakteri hücre topakları en az 1 h için-70 ° C'de depolayın.
Not: görünür floresans bile kullanarak veya kullanmadan bir DRBT ifade floresan yüzeylerde içeren hücreleri gösterir.
3. hücre bozulması
- Donmuş hücre Pelet buza koyun ve 15 tezcan için izin verin.
- Pelet lizis arabellek (50 mM NaH2PO4, 300 mM NaCl, 10 mM imidazole, %0.05 Ara 20, pH 8) 2 mL ekleyin ve hücreleri askıya alma.
- Taze hazırlanmış phenylmethanesulfonyl-florür (PMSF) proteaz inhibitörü çözüm (8,7 mg/mL, etanol içinde çözünmüş) 10 µL süspansiyon için ekleyin.
- Askıya alma ve lizozim 2 mg ve 20 birim DNaz süspansiyon için ekleyin.
- Buz 15dk ve girdap için kızağa kuluçkaya ara sıra kullananlar.
- 2 x 1 mL süspansiyon 1.5 mL microcentrifuge tüpler için aktarmak ve süspansiyonlar 10 turda 3 min için solüsyon içeren temizleyicide sonication ve 5 s s dinlenme.
- 10.000 x g oda sıcaklığında 20 dakika için de tüpler santrifüj kapasitesi; o zaman ve yeni microcentrifuge tüpler için transfer floresan süpernatant (temizlenmiş bakteri hücre lysate) dikkatle her tüpünden çıkarın.
Not: temizlenen lysates floresan substrat içeren görünür floresans bile kullanarak veya kullanmadan bir DRBT göstermek ve 4 ° C'de 2 haftaya kadar saklanabilir. O dondurma değil. Temizlenen lysates numune hazırlama proteaz tahlil (bakınız Bölüm 4.1) için doğrudan kullanılan veya substrat arıtma için de kullanılabilir (bkz. Adım 4.5.1).
4. Ni-NTA manyetik boncuk-tabanlı proteaz tahlil
Not: tahlil platform esnekliği nedeniyle, bu çalışmalar birçok farklı türleri için optimize edilebilir. Bu nedenle ve seçim enzim aktivite oranı farkı nedeniyle (nerede belirtilir) tahlil parametrelerden bazıları açıkça tarif edilemez ama bireysel amaçları ve deneysel tasarım için optimize edilmiş olması gerekir. Bir yönerge olarak çalışmalar bazı tür parametreleri belirli adımları belirtilir.
- Numune hazırlama
- Manyetik boncuklar substrat bağlı nesil
- Yeni içeren veya (4.7 bölümüne bakın) Ni-NTA manyetik özel boncuk Manyetik parçacık yoğunlaştırıcı (MPC) olarak geri dönüştürülmüş bir kapalı 2 mL düşük protein bağlayıcı (bakınız Tablo reçetesi) microcentrifuge tüpü yerleştirin.
Not: Uygulamalı boncuk süspansiyon üzerinde deneysel tasarım göre ayarlanacak miktarıdır. Her deneme 1 mL manyetik boncuk çözeltisi (%5, v/v) kullanılan. - Boncuk duvara ve/veya microcentrifuge tüpün kapağı içine sopa; Bu nedenle, MPC ters tüm boncuk toplanır emin olmak için her yöne çevirmek.
- Süpernatant kaldırmak ve o atın.
- Boncuk lizis arabellek yıkayın.
- 1,8 mL lizis arabellek için boncuk ekleyin ve kapalı tüp MPC kaldırın.
- Boncuk tüp sallayarak ve/veya örnek tamamen homojen olana tüpler ters çevirerek tarafından askıya alma.
- Tüp geri MPC yerleştirin ve boncuk toplamak için ters çevir.
- Tüp açın ve süpernatant atın.
- 1.0-1.8 (3.7 adımda hazırlanan) mL temizlenen lysate için boncuk ekleyin ve MPC tüpü çıkarması.
- Boncuk tamamen homojen ve yavaş yavaş bir rotator, oda sıcaklığında 30 dakika tarafından tüp döndürmek kadar kapalı tüp ters çevirin.
- MPC yerleştirin ve temizlenen hücrenin lysate boncuk ve kapağı kaldırmak.
Not: Lysate temizlenen hücrenin olabilir atılan ya da daha fazla için kaydedilmiş (-den sonra adım 3.7 nota bakın). - %1 eklemek ara 20 (pH 7) substrat bağlı Manyetik boncuklar (SAMBs) için.
Not: SAMBs görünür floresans bile kullanarak veya kullanmadan bir DRBT göster.
- Yeni içeren veya (4.7 bölümüne bakın) Ni-NTA manyetik özel boncuk Manyetik parçacık yoğunlaştırıcı (MPC) olarak geri dönüştürülmüş bir kapalı 2 mL düşük protein bağlayıcı (bakınız Tablo reçetesi) microcentrifuge tüpü yerleştirin.
- SAMBs yıkama
- SAMB süspansiyon ile tüp MPC yerleştirin ve süpernatant atın.
- 3 SAMBs yıkama x her arabellek ile: %1 i) 1,8 mL Tween 20 (pH 7); II) 1,8 mL çamaşır arabelleği (50 mM NaH2PO4, 300 mM NaCl, 5 mM imidazole, %0.05 Ara 20, pH 7); III) bölünme arabellek (50 mM NaH2PO4, 300 mM NaCl, %0.05 Ara 20, pH 7) 1,8 mL.
Not: adım 4.1.1.4 çamaşır yordamı için bkz. Bölünme arabellek deneysel ihtiyaçlarına göre değiştirilebilir ancak uyumluluk belirlemek için Ni-NTA manyetik boncuklar manuel kontrol için önerilir.
- SAMB hisse senedi çözüm hazırlanması
- Bir bölünme arabellek SAMB hisse senedi çözüm oluşturmak için yıkanmış SAMBs ekleyin.
Not: Arabellek ek sonra don't sallamak veya tüp ters çevirmek. Bölünme arabellek hacmi bireysel deneysel tasarım üzerinde bağlıdır ve manyetik boncuklar (bkz. Adım 4.1.1.1) sayısı ve 4.1.4.2 adımda kullanılacak birimleri göre hesaplanmalıdır. 2 mL tüpler için ilâ 1.900 µL uygulanan birimdir (bkz. Tablo 1). % 2-% 10 (v/v) SAMB hisse senedi çözüm önerilen manyetik boncuk yoğunluğudur.Çalışma türü Bölünme arabellek (µL) hacmi S-bağımlı ölçümleri (Şekil 4) 1600 Zaman-sahası ölçüleri (incir 5A) 1600 İnhibisyon çalışma (incir 5B) 1900 pH bağımlılığı çalışma (Şekil 6) 1400
Tablo 1: Hacim ölçüleri farklı türde SAMB hisse senedi çözümde hazırlamak için kullanılan bölünme arabellek. - Kapalı tüp MPC kaldırın. SAMB hisse senedi çözüm hemen kullanın veya en fazla 24 saat için 4 ° C'de saklayabilirsiniz.
- Bir bölünme arabellek SAMB hisse senedi çözüm oluşturmak için yıkanmış SAMBs ekleyin.
- SAMB hisse senedi çözüm kullanarak tahlil örnekleri nesil
Not: Bu bölümü testin ayrıntılarını şiddetle bireysel deneysel tasarım (türleri Tablo 2' de gösterilen örnek) bağlıdır.Örnek türü Notlar Reaksiyon örnek (R) -bölünme özellikleri değerlendirmek için kullanılır
-enzim substrat bölünme tampon içerirSubstrat boş örnek (B) -spontan substrat ayrılma değerlendirmek için kullanılır (bkz. Adım 4.6.2)
-Sadece substrat bölünme tampon içerirSubstrat denetimi örneğini (C) -detemining substrat konsantrasyonu için (bkz. Adım 4.6.3)
-Sadece substrat elüsyon tampon içerir
Tablo 2: Örnek Ni-NTA manyetik boncuk-tabanlı proteaz tahlil türleri.- Düşük protein bağlayıcı microcentrifuge tüpler 2 mL tahlil örnekleri için hazırlayın.
Not: plastik mallar bağlama diğer düşük protein de kullanılabilir. Yuvarlak veya düz alt tüpler SAMBs serbest dolaşımı sağlamak için kullanın. Tablo 3tüplerde önerilen sayısını görmek için.Çalışma türü R B C S-bağımlı ölçümleri (Şekil 4) 5 5 2 Zaman-sahası ölçüleri (incir 5A) 6 6 2 İnhibisyon çalışma (incir 5B) 7 7 1 pH bağımlılığı çalışma (Şekil 6) 5 5 1
Tablo 3: Gerekli 2 mL microcentrifuge tüpler için gösterdiği çalışmalarda her örnek türü sayısı. - SAMB hisse senedi eriyik homojenliği kadar askıya alma ve hemen içine örnek şişeleri reaksiyonlarda analiz edilecek substrat miktarı transfer. Önerilen birim 25-300 µL, ama bireysel deneysel tasarım (Tablo 4) göre ayarlanacak.
Not: tüm SAMBs tüpler dibine ölçülür Eğer kontrol edin. SAMBs tahlil sonuçlarını deforme edebilirsiniz tüp duvara yapışabilir. Farklı birimler ardışık olarak ölçülecek ise, aliquoting yüksek güç ile başlatın ve Pipetler ve/veya pipet ipuçları değişimin en aza indirmek deneyin.Çalışma türü R B C S-bağımlı ölçümleri (Şekil 4) 25 – 50 – 100 – 150-250 25 – 50 – 100 – 150-250 25 Zaman-sahası ölçüleri (incir 5A) 25 25 25 İnhibisyon çalışma (incir 5B) 120 120 120 pH bağımlılığı çalışma (Şekil 6) 100 100 100
Tablo 4: SAMB çözüm hacmi gösterdiği çalışmalarda her örnek türünün örnek şişeleri ölçülür. - MPC bölünmemeli SAMB süspansiyon içeren örnek tüpler yerleştirin ve hafifçe MPC ileri geri hareket ettirin.
- Dikkatle süpernatant SAMBs kaldırmak ve bu.
- Tüpler MPC kaldırın ve reaksiyon arabellek (bölünme veya elüsyon tampon [100 mM EDTA, %0.05 Ara 20, pH 7]) hesaplanan hacmi dikkatle SAMBs için ekleyin.
Not: arabellek birim bireysel deneysel tasarım (Tablo 5) göre hesaplar. 2 mL tüpler için 50-150 µL. tüm SAMBs eklenen arabellekte yıkanır emin olun (Bu adımda eklenecek tepki arabellek hacmi + 4.2.3 adımda eklenecek çözüm hacmi) tepki karışımı önerilen son hacim var. Elüsyon arabellek bölünme arabellek substrat kontrol (C) örnekleri durumlarında yerine kullanılır. Bir inhibisyon çalışma için seçim inhibitörü Bu adımda eklenecek önerilir.Çalışma türü Reaksiyon arabellek (µL) hacmi S-bağımlı ölçümleri (Şekil 4) 68 µL bölünme arabellek Zaman-sahası ölçüleri (incir 5A) 68 µL bölünme arabellek İnhibisyon çalışma (incir 5B) Stok çözüm * 67,3 µL bölünme tampon + 0.7 µL inhibitörü pH bağımlılığı çalışma (Şekil 6) 69,5 µL bölünme arabellek **
Tablo 5: tepki gösterdiği çalışmalar arabellekte hacmi. * Amprenavir dimetil-sülfoksit içinde çözüldü; amprenavir hisse senedi çözümleri (1 arasında 1 µM konsantrasyonları nM) için inhibitör çalışma uygulandı (bkz. Şekil 5B). ** PH 6.0-8.5 arasında değişiyordu uygulanan bölünme tamponunun pH. - Tüpler kapakları kapatın. Artık örnekleri tahlil için hazırsınız.
Not: Örnekleri için en fazla 24 saat 4 ° C'de depolanabilir, ancak depolama yalnızca SAMB hisse senedi çözüm hemen sonra hazırlık kullandıysanız geçerlidir (bkz. Adım 4.1.3.2).
- Düşük protein bağlayıcı microcentrifuge tüpler 2 mL tahlil örnekleri için hazırlayın.
- Manyetik boncuklar substrat bağlı nesil
- Proteolitik reaksiyonlar inisiyasyon
- Proteolitik enzim çözüm deneysel ihtiyaçlarına göre hazırlayın.
Not: Bu bir bölünme arabellek dağıtılması ve/veya enzim sulandırmak için kullanmak için tavsiye edilir. İletişim kuralları HIV-114 ve TEV PRs18 arıtma için daha önce yayınlanmış. - Thermoshaker'ın ajitasyon oranı (600 rpm) ve inkübasyon sıcaklığı (Tablo 6) ayarlayın.
Çalışma türü İnkübasyon sıcaklığı (° C) S-bağımlı ölçümleri (Şekil 4) 37 Zaman-sahası ölçüleri (incir 5A) 37 İnhibisyon çalışma (incir 5B) 37 pH bağımlılığı çalışma (Şekil 6) 30
Tablo 6: farklı çalışma türleri uygulanan kuluçka sıcaklıklar. 30 ° C TEV PR için önerilir HIV-1 PR için 37 ° C, önerilir - Enzim çözüm proteolitik reaksiyonlar başlatılıyor tepki örnekleri ekleyin.
Not: substrat boş (B) ve C örnekleri söz konusu olduğunda, bölünme tampon (enzim arabellek) ve elüsyon tampon, sırasıyla ekleyin. Deneysel gereksinimlerine göre (Tablo 7) hesaplanacak birimdir. 2 mL tüpler için önerilen son tepki karışımı (4.1.4.5 basamaktaki tepki arabellek hacmi + bu adımda eklenecek çözüm hacmi) 50-150 µL birimdir.Çalışma türü Enzim çözüm/enzim arabellek/elüsyon arabellek (µL) hacmi S-bağımlı ölçümleri (Şekil 4) 2 Zaman-sahası ölçüleri (incir 5A) 2 İnhibisyon çalışma (incir 5B) 2 pH bağımlılığı çalışma (Şekil 6) 0,5
Tablo 7: Tahlil örnekleri gösterdiği çalışmalar söz konusu olduğunda başlatma sırasında eklenen enzim çözüm/enzim arabellek/elüsyon arabellek hacmi. - Tüpler yavaşça hareket ettirerek boncuklarını dikkatlice karıştırın ve tüpler hemen zaten sallayarak thermoshaker yerleştirin.
Not: Elle numune fesih (bkz: 4.3) başlatılması daha fazla zaman alır; Bu nedenle, en az 2 dk kayıtlı bir gecikme arasında reaksiyonlar girişimlerine önerilir. - Örnekleri deneysel tasarım (Tablo 8) göre kuluçkaya.
Çalışma türü Kuluçka kez (dk) S-bağımlı ölçümleri (incir 4A) 7 S-bağımlı ölçümleri (incir 4B) 120 Zaman-sahası ölçüleri (incir 5A) 0 – 2,5 – 5 – 10 – 15-20 İnhibisyon çalışma (incir 5B) 10 pH bağımlılığı çalışma (Şekil 6) 60
Tablo 8: kuluçka kez tahlil örnekleri farklı ölçümlerde uygulanır.
- Proteolitik enzim çözüm deneysel ihtiyaçlarına göre hazırlayın.
- Termination proteolitik tepkiler
- Shaker, 30 s önceden kuluçka, sonuna çöpten örnek alın ve derhal sıralayacağız.
- Tüp MPC üzerine yerleştirin, 15 için stand izin s, ve hafifçe MPC ileri geri hareket ettirin.
- Kapağı açın ve süpernatant dikkatle bir tabak ya da yeni bir tüp aktarmak.
Not: pipet ucu ile konsantre boncuk dokunmayın. Toplanan süpernatant C örnekleri ve R örnekleri dekolte yüksek derecesi ile görünür floresans bile kullanarak veya kullanmadan bir DRBT gösterebilir.
- Floresan algılama
- 2 x 30 µL ayrılmış örnek supernatants, siyah bir yarı-alan Mikroplaka aktarın.
- Uygun uyarma ve emisyon filtreleri kullanarak floresans ölçmek.
Not: bölünme arabellek ve elüsyon arabellek temel floresans ölçün. Filtre birleşimleri seçilmesi gerek ölçülen floresan protein (Tablo 9) temel.Floresan protein Uyarma filtreler (nm) Emisyon filtreler (nm) mTurqiouse2 355/40 460/25 mEYFP 544/15 590/10 mApple 544/15 590/10
Tablo 9: farklı floresan proteinler algılamak için kullanılan uyarma ve emisyon filtreleri.
- Kalibrasyon
Not: adım 4.6.1, floresans yoğunluk değerleri, bölünme - veya elüsyon-tampon-çözüldü kalibrasyon eğriler oluşturmak için farklı konsantrasyonlarda arıtılmış yüzeylerde ölçülecek gerekir.- Floresan yüzeylerde arındırmak.
Not: arıtma, örneklerin proteaz tahlil toplanabilir sonra substrat boş (B) SAMBs veya yeni bir SAMB için süspansiyon Ayrıca (bkz: bölümler 4.1.1 ve 4.1.2) hazırlanabilir.- Bir tüp içinde bölünme arabelleğe (% 2-% 10; v/v) MPC 1 mL SAMBs yerleştirin ve MPC ters her yöne çevirerek manyetik boncuklar toplamak.
- Tüp açın ve bölünme arabellek, hem tüp ve kapağı kaldırın.
- Tüp MPC kaldırın ve 400-600 µL elüsyon arabelleği için SAMBs ekleyin.
- Yavaş yavaş 5 min için oda sıcaklığında bir rotator ile kapalı tüp döndürün.
- Tüp MPC üzerine yerleştirin ve MPC ters çevirerek boncuk toplamak.
- Ve yeni bir düşük protein bağlayıcı microcentrifuge tüp transfer arıtılmış sağlam floresan substrat (eluate) içeren süpernatant çıkarın.
Not: Eluate açıkça görünür floresans bile kullanarak veya kullanmadan bir DRBT gösterir.
- Paralel arabellek Satım iki 0.5 mL 10 K Ultrafiltrasyon cihazları kullanarak gerçekleştirin.
- Hazır eluate (200-300 µL) yarım hacmi içine her Ultrafiltrasyon aygıt ölçmek.
- Sonra her Santrifüjü adımda, sırasıyla ilk ve ikinci Ultrafiltrasyon cihazları tarafından elüsyon tampon ve bölünme tampon, konsantre eluate sulandırmak.
- Sonra kurtarma, 120-200 µL arasında aynı birime farklı arabelleklerindeki çözüldü konsantre örnekleri ayarlayın.
Not: Şimdi bölünme arabellek çözüldü substrat protein içeriği arabellek çözüldü elüsyon substrat aynıdır; Bu nedenle, protein konsantrasyonu ölçmek için kullanılan yöntemi EDTA ile müdahale Eğer ikinci bir adımda 4.5.3, içerik protein belirlemek gerekli değildir.
- Yüzeylerde protein içeriği 280 absorbans ölçerek elüsyon veya bölünme tampon birinde çözünmüş belirlemek nm.
Not: Diğer Yöntemler (örneğin, Bradford veya bicinchoninic asit (BCA) deneyleri) protein konsantrasyonu ölçmek için de kullanılabilir, ancak olası girişim EDTA (elüsyon arabelleğindeki) veya floresan substrat absorbans ile olması gerekir kabul. Adım 4.5.4 uygulanacak substrat çözeltisi ilk protein içeriği 0,4-2.0 arasında olmak tavsiye edilir mg/mL bir kalibrasyon oluşturmak için uygun bir dizi eğrisi. Geçersiz kalma katsayıları için bkz: Tablo 10 .Substrat Molekül ağırlığı
(Da)Geçersiz kalma katsayısı
(M-1 cm-1, 280 nm suda ölçülen)Onun6- MBP-VSQNY * PIVQ-mTurquoise2 72101.7 96845 Onun6- MBP-KARVL * AEAM-mTurquoise2 72042.7 95355 Onun6- MBP-VSQNY * PIVQ-mEYFP 72367.1 94325 Onun6- MBP-VSQNY * PIVQ-mApple 72145.9 105200
Tablo 10: moleküler ağırlık ve yok olma katsayıları farklı rekombinant floresan füzyon protein yüzeylerde. - İki kat seri seyreltme en az sekiz adım, elüsyon- ve bölünme arabellek çözüldü substrat çözümlerinden elüsyon veya bölünme arabellek seyreltme için sırasıyla kullanarak hazırlayın.
- Her seyreltme noktasının 30 µL siyah bir yarı-alan Mikroplaka aktarın.
- 4.4.2. adımda uygulanan ayarı kullanarak bir fluorimeter ile floresan ölçmek.
Not: bölünme ve elüsyon arabellek temel floresans ölçün.
- Floresan yüzeylerde arındırmak.
- Tahlil değerlendirilmesi
- Kalibrasyon eğriler çizmek.
- 4.5.3. adımda belirlenen protein içerik dayalı konsantrasyon (mM) (4.5.4 adımda kullanılan), saflaştırılmış substrat çözümleri hesaplayın.
- Göreli floresans yoğunluk değerleri (RFU) seri seyreltme noktaları uygulanan seyreltme arabellek (bölünme arabellek veya elüsyon arabellek) temel RFU değerlerle düzeltin.
- Düzeltilmiş RFU değerler bölünme - veya elüsyon-tampon-çözüldü arıtılmış yüzeylerde molar konsantrasyonu karşısında arsa ve doğrusal regresyon (kuvvet sıfır kesme noktası) gerçekleştirin.
Not: Yüksek R2 değeri (˃0.97) floresan ve floresan protein konsantrasyonu arasında iyi bir doğrusal ilişki gösterir. Bu durumda, regresyon çizgisinin eğimini tahlil bileşenleri adım 4.6.2 ve 4.6.3 muayene aralıktaki konsantrasyonu değerlendirmek için kullanılabilir. Deneysel hataları ve veri noktası dağıtım kalibrasyon güvenilirliğini etkileyebilir; Böylece, bir grafik değerlendirme zoom (gösterildiği gibi Şekil 3), grafikler yardımı ile R2 ve eğim değerleri veri tarafından etkilenmiştir olup olmadığını denetlemek için gerçekleştirilebilir.
- C-terminal floresan bölünme ürün tepki örneklerinde tutarını hesaplar.
- Her R örnek RFU değerleri ile ilgili B örnek RFU değerleri düzeltin.
- Göğüs arası ürün konsantrasyon (mM) tepki örneklerinde düzeltilmiş bölerek hesaplamak RFU değerlere göre bölünme-arabellek tabanlı kalibrasyon eğimi eğrinin (bkz. Adım 4.6.1.3).
- Reaksiyon örneklerinde uygulanan substrat konsantrasyonu hesaplayın.
- C örnek RFU değerleri ile temel elüsyon arabellek RFU değerini düzeltin.
- Onların düzeltilmiş bölerek C örnek supernatants içinde (mM) olarak eluted substrat konsantrasyonu hesaplayın elüsyon arabellek esaslı kalibrasyon eğimi değerlerle RFU eğri (bkz. Adım 4.6.1.3).
- Aşağıdaki denklemi temel adım 4.1.4.2, tahlil örnekleri oluşturmak için kullanılan SAMB hisse senedi çözüm substrat konsantrasyonu (mM) olarak belirleyin:
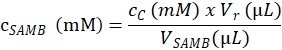
CSAMB bölümüne 4.1.3 hazırlanan SAMB hisse senedi çözüm molar konsantrasyonu işte; cC C örnek 4.6.3.3 adımda hesaplanan eluted substrat molar konsantrasyonu olduğunu; Vr olan ek adım 4.1.4.5 tepki arabellekte ve adım 4.2.3 enzim arabellekte yarattığı tepki karışımı hacmi.; ve VSAMB C örnek (adım 4.1.4.2) SAMB hisse senedi çözümde birimdir. - Her reaksiyon örnek tüp adımda 4.1.4.2 ölçülen SAMB hisse senedi çözümde (mM) (içinde µL) hacmine göre molar konsantrasyonu dayalı her R örnek yüzeylerde molar konsantrasyonu hesaplayın.
- Veri işleme gerçekleştirin.
Not: Veri analizi üzerinde denemenin amacı bağlıdır. Video veri işleme için bir substrat-bağımlı kinetik çalışma üzerinde HIV-1 PR onun6- MBP-VSQNY kullanarak gösterilmiştir * PIVQ-mTurquoise2 substrat. İlk hız değerleri C-terminal bölünme parça sayısı hesaplanır ve karşı uygulanan substrat konsantrasyonu çizilir. Kinetik parametrelerin Michaelis-Menten doğrusal olmayan regresyon analizi ile belirlenir.
- Kalibrasyon eğriler çizmek.
- Manyetik boncuklar geri dönüşüm
Not: bir tahlil yaptıktan sonra manyetik özel boncuk toplanan geri dönüşümlü ve.- MPC ile kullanılan manyetik boncuklar toplamak ve süpernatant atın.
- Boncuk aşağıdaki arabelleklerinin 1,8 mL ile verilen sırada yıkama: rejenerasyon arabellek A (% 0.05 Ara 20, 0.5 M NaOH), yenilenme arabellek B (% 0.05 Ara 20), yenilenme arabellek C (%0,05 Ara 20, 100 mM EDTA, pH 8), yenilenme tampon B, rejenerasyon arabellek D () %0,05 Ara 20, 100 mM NiSO4, pH 8), yenilenme tampon B ve rejenerasyon tampon E (%0,5 ara 20, % 30 etanol, pH 7).
Not: adım 4.1.1.4 çamaşır yordamı için bkz.
- Boncuk aşağıdaki arabelleklerinin 1,8 mL ile verilen sırada yıkama: rejenerasyon arabellek A (% 0.05 Ara 20, 0.5 M NaOH), yenilenme arabellek B (% 0.05 Ara 20), yenilenme arabellek C (%0,05 Ara 20, 100 mM EDTA, pH 8), yenilenme tampon B, rejenerasyon arabellek D () %0,05 Ara 20, 100 mM NiSO4, pH 8), yenilenme tampon B ve rejenerasyon tampon E (%0,5 ara 20, % 30 etanol, pH 7).
- Geri dönüşümlü boncuk rejenerasyon arabellek E 4 ° C'de depolayın
- MPC ile kullanılan manyetik boncuklar toplamak ve süpernatant atın.
5. sayfa Analizi
-
Numune hazırlama
Not: Ni-NTA manyetik boncuk-tabanlı tahlil yaptıktan sonra tahlil supernatants sayfa tarafından çözümlenebilir. Bu durumda, 5.1.1 ve 5.1.2 adımları atlayın. Ancak, faiz proteaz ile çözüm sindirim sonra saf floresan yüzeylerde çözüm ve/veya onların bölünme parçaları analiz etmek mümkündür. Bu durumda, adım 5.1.1 protokolüyle devam edin.- Adım 4.5.1 göre arıtılmış floresan substrat çözeltisi hazırlamak.
- Çözüm sindirim gerçekleştirin.
- Elüsyon arabellek 0.5 mL 10 K Ultrafiltrasyon aygıt ve aliquot bölünme arabelleği ile 1.5 mL microcentrifuge tüpler içine sindirmek için örnekleri değişimi.
Not: sayfa analiz, biz bölünmemeli için her substrat, ama bölünmemeli olmak substrat çözeltisi hacmi ve örnek tüpler sayısı 68 µL bireysel deneysel tasarım göre optimize edilebilir. - Enzim çözüm örnekleri için ekleyin.
Not: sayfa analizi için biz HIV-1 PR, Bozóki ve ark.14tarafından açıklandığı gibi hazırlanan 2 µL uyguladım, ancak birim bireysel deneysel tasarım göre optimize edilmiş. Bu bölünme arabellek dağıtılması ve/veya enzim sulandırmak için kullanmak için tavsiye edilir. - Örnekleri deneysel tasarım göre kuluçkaya.
Not: sayfa analizi için biz tepki karışımı 37 ° C, ancak kuluçka süresi 45 dakika inkübe ve sıcaklık deneysel tasarım göre ayarlanması gerekir. - Tepki adım 5.1.3 gerçekleştirerek sonlandırın.
- Elüsyon arabellek 0.5 mL 10 K Ultrafiltrasyon aygıt ve aliquot bölünme arabelleği ile 1.5 mL microcentrifuge tüpler içine sindirmek için örnekleri değişimi.
- Örnek sayfa için hazırlayın.
Not: Floresan substrat içeren örnekleri sayfa için bir nondenaturing veya denaturing yöntemi hazır olun. Nondenaturing veya denaturing koşulları kullanım için adım 5.1.3.1 ya da 5.1.3.2, sırasıyla izleyin.- Nondenatured bir örnek hazırlamak: 30 µL örnek nondenaturing örnek yükleme arabellek (300 mM Tris, % 20 gliserol, % 0.05 bromophenol mavi, pH 6.8) x 6 6 µL karıştırın.
- Denatüre örnek hazırlamak: örnek denaturing örnek yükleme arabellek (300 mM Tris, % 20 gliserol, % 0.05 bromophenol mavi, % 12'si SDS, 100 mM β-mercaptoethanol, pH 6.8) x 6 6 µL ile 30 µL mix ve örnekleri 10 min için 95 ° c ısı.
-
SDS-sayfa Analizi
Not: nondenatured (hazırlanan adım 5.1.3.1) örnekleri analiz edilecek olan yalnızca, isteğe bağlı olarak, yerel bir sayfa da gerçekleştirilebilir. Bu durumda, Bölüm 5.3 atlayın.- SDS-polyacrylamide jel (kullanım ayıran % 14 ve % 4 yığın jel) hazırlamak ve tank Elektroforez arabellek (2.5 mM Tris, 19.2 mM glisin, % 0,01 SDS) ile doldurun.
- Polyacrylamide jel wells için (adım 5.1.3.1 ya da 5.1.3.2 hazırlanan) örnekleri eklemek ve Elektroforez, 120 V gerilim gerçekleştirin.
- Jel kaset çalışan modülünden çıkarın ve jel yıkama tankı yerleştirin.
Not: Nondenatured örnekleri zaten jel, çıplak gözle tarafından bile veya bir DRBT ile görünür.
-
Jel renaturation ve floresan proteinlerin algılama
Not: floresan proteinler denatüre örneklerinde DRBT üzerinde (5.1.3.2 adımda hazırlanan) algılamak için SDS jel olmak yıkamak için kısmen renature proteinler gerekiyor.- Jöleye ~ 100 mL distile su ekleyin ve jel en az 30 dk için durulayın.
Not: SDS kaldırma geliştirmek için her 10 min su değiştirin veya 60 dakikaya kadar yıkayın. - Floresan proteinler bir DRBT kullanarak, veya UV görüntüleme görselleştirin.
- Jöleye ~ 100 mL distile su ekleyin ve jel en az 30 dk için durulayın.
-
Geleneksel Coomassie jel boyama
- Jel nonfluorescent proteinler görselleştirmek için Coomassie parlak mavi boya ile leke.
Sonuçlar
Şekil 1A , belirli bölünme sitesi sıra HIV-1 PR tarafından işlenebilir bir temsilcisi floresan Rekombinant protein substrat şematik yapısı gösterilmektedir. Şekil 1B substrat üretim ve proteaz deneyleri, Ni-NTA manyetik boncuk-tabanlı tahlil ve/veya sayfa dahil olası uygulamaları temsil eder.
Fluorimetry tarafından güvenilir veri elde etmek için bir kalibrasyon prosedürü, floresan yüzeylerde ve bölünme ürünleri miktarlarını belirlemek için gereklidir. Bunun için floresans yoğunluk değerleri farklı tampon koşullarında farklı yüzeylerde, ölçülen gerekir ve onların konsantrasyonları (Şekil 3) bölümü konsantrasyon aralığındaki ilişkili olması gerekir. Eğim değerleri kalibrasyon eğrilerinin yüzeylerde ve tahlil örnekleri ürünlerinde bölünme miktarlarını belirlemek için uygulanır. Kalibrasyon eğrileri yamaçları yüzeylerde (Tablo 11) eklenen bölünme sitesi sıralarının bağımsızdır ve floresan protein aynı tür erimiş yüzeylerde bir dizi için kullanılabilir. Zum grafikler daha düşük konsantrasyon aralıkları de büyütmek için tüm doğrusal regresyon için (Şekil 3) gösterilir. Kalibrasyon veri noktalarının uygun bir dağıtım için güvenilir bir kalibrasyon gerekli olduğundan dikkatli bir şekilde gerçekleştirilmesi gerektiğini unutmamak gerekir. R2 değeri floresan protein konsantrasyonu ve floresan Eğer yeterli sayıda veri noktası arasında iyi bir korelasyon gösterir çünkü, bu nedenle, iki kat seri seyreltme örnekleri için kalibrasyon, hazırlamak için uygulanır tüm konsantrasyon aralığı kapsayacak şekilde kullanılmıştır. Ayrıca, deneysel hataları son derece kalibrasyon doğruluğunu etkileyebilir; Bu nedenle, regresyon çizgi grafik değerlendirilmesi de gerekli olabilir.
Enzimatik ölçümler çeşitli incelenmesi substrat konsantrasyonu reaksiyon hızı (Şekil 4A) üzerinde etkisi de dahil olmak üzere proteaz tahlil tarafından gerçekleştirilebilir. Doğrusal olmayan regresyon tarafından verileri enzim kinetik parametreleri (örneğin, vmax ve Km) belirlemek için kullanılabilir. Bir yetersiz boncuk süspansiyon ve dağılım ve bir yanlış tepki fesih güvenilir enzim kinetik değerleri hesaplamak için uygun değildir suboptimal sonuçlar (Şekil 4B) neden olabilir.
Bir bağımlılık zamanında ürün oluşumu tahlil (Şekil 5A) tarafından (örneğin, optimizasyon bölünme tepki parametrelerin sırasında) belirlenebilir. Enzim aktivite varlığında bir inhibitörü de olabilir (Şekil 5B) etkin enzim konsantrasyon ve inhibitör sabit belirlenmesi için soruşturma. Aynı yöntemi kullanarak, diğer inhibitörlerinin etkileri de tahlil tarafından ekranlı.
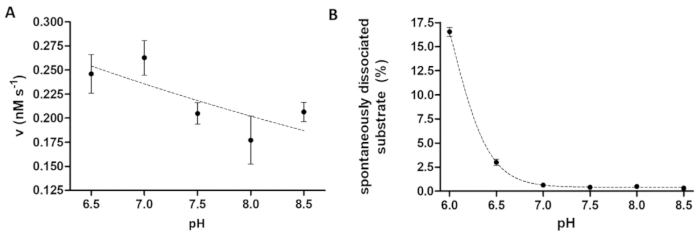
Proteaz tahlil pH enzim aktivite üzerindeki etkilerini araştıran yararlı olacaktır. Şekil 6A enzim aktivitesi bağımlılığını pH TEV PR, geniş optimum pH aralığı (pH 6-9) olan örneği tarafından temsil eder. Eğer pH bağımlılığı enzim aktivitesinin okudu (ya da ölçülecek enzimler Asidik pH en uygun olması gerekir), boncuk için rekombinant yüzeylerde benzeşme bağlama hafif Asidik pH sınırlı olabilir düşünün gereklidir. Boncuk (Şekil 6B) üzerinden yüzeylerde yükseltilmiş bir ayrılma bir bozulma tahlil sonuçlarının neden olabilir. Boncuk gelen spontan substrat ayrılma düşünün için tepki örnekleri için ölçülen değerleri bu B örnekleri göre düzeltilmesi gerekir.
Şekil 7 nondenatured floresan proteinler kendi renklerini, temel jel içinde farklılaşmış mavi ışık transillumination (7A rakam) kullanarak gösterir. Moleküler Ağırlık yüzeylerde/bölünme parçalarının belirlenmesi gerekli ise, floresan proteinler kısmen renatured jel içinde olabilir ve UV aydınlatma tarafından tespit edilebilir çünkü koşulları denaturing de numune hazırlama için kullanılabilir (Şekil 7B) veya Coomassie (Şekil 7C) boyama. R örnekleri analiz edilir, N-terminal bölünme parçaları ve uncleaved yüzeylerde boncuk için bağlı kalır görünür (Şekil 7C), sadece C-terminal bölünme ürünleri vardır. Zaman zaman, proteinler kısmen nondenaturing koşulları (Şekil 7C) kullanarak rağmen denatüre ve nondenatured proteinler daha bol olsa da, denatüre formları da örnek tespit vardır. Bu olay algılama proteolitik dekolte etkilemez ama nondenatured örnekleri nicel Dansitometresi durumunda dikkate alınması gerekiyor.
Ayrıntılı açıklama sadece bir 2 mL tüp dayalı tahlil için gösterilmiş olsa da, tahlil için hangi zaten başarıyla (gösterilmez) bizim laboratuvar test edilmiş bir 96-şey plaka-esaslı (Şekil 8), adapte edilebilir. 96-şey plaka uyarlanmış biçimi fluorimetric ve de, elektroforetik analizleri ile tam olarak uyumludur ve bu makalede açıklanan yöntemleri temel alan elde edilen veri ayrıca değerlendirilir.
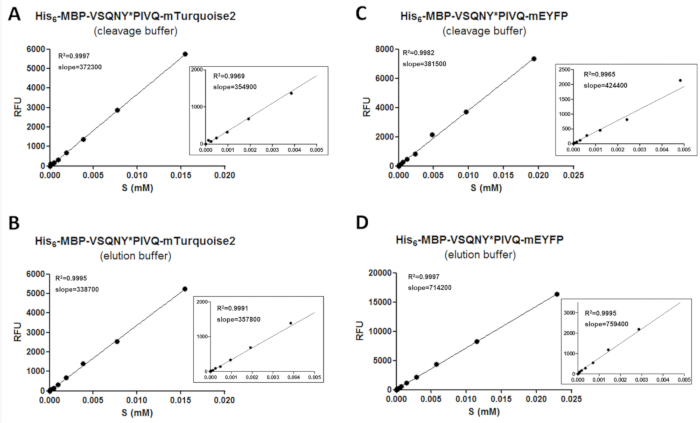
Şekil 3 : Kalibrasyon eğrileri. Temsilcisi substrat kalibrasyon eğrileri farklı C-terminal floresan Etiketler için erimiş iki rekombinant yüzeylerde örneği ile gösterdi: (A ve B) onun6- MBP-VSQNY * PIVQ-mTurquoise2 ve (C ve D ) Onun6- MBP-VSQNY * PIVQ-mEYFP. Yakınlaştırma rakamları da 0-0.005 veri noktalarının doğrusal regresyon temsil etmek için gösterilen mM substrat konsantrasyonu aralığı. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
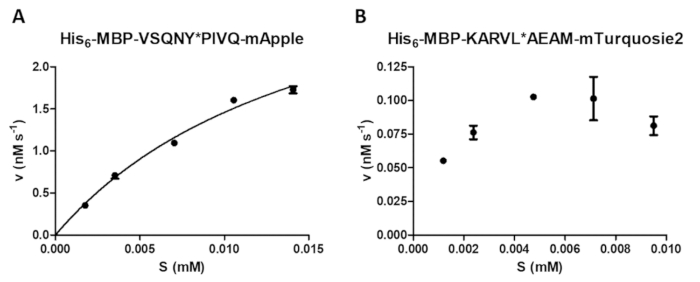
Şekil 4 : Enzim kinetik parametrelerin belirlenmesi. Substrat-bağımlı kinetik ölçümleri HIV-1 PR tarafından gerçekleştirilen (41,2 son etkin yoğunluğuna, nM). İlk hız değerleri karşı substrat konsantrasyonu çizildi ve Michaelis-Menten doğrusal olmayan regresyon çözümlemesi gerçekleştirildi. Hata çubukları SD temsil (n = 2). (A) A temsilcisi en iyi sonucu onun6- MBP-VSQNY örnekle gösterildiği * PIVQ-mApple füzyon protein substrat. (B) A temsilcisi suboptimal sonucu da gösterdiği için onun6- MBP-KARVL * AEAM-mTurquoise2 substrat, nerede uygun substrat konsantrasyonu ayarını SAMB hisse senedi çözüm yetersiz bir homojenizasyon nedeniyle sorunlu , süre nispeten yüksek hataları yanlış tepki fesih tarafından neden oldu. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
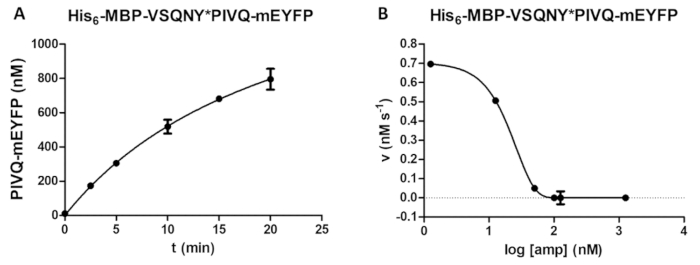
Şekil 5 : Zaman-ders ve inhibitör çalışma. (A) Onun 6- MBP-VSQNY * PIVQ-mEYFP rekombinant füzyon protein substrat (0.00326 mM son bir konsantrasyon), HIV-1 PR tarafından i ciddi (41,2 son etkin yoğunluğuna, nM), ve belgili tanımlık serbest bırakmak, floresan PIVQ-mEYFP proteolitik parçacıkları için ölçüldü bir zaman ders çözümlemesi gerçekleştirin. Ölçümler beş farklı zaman noktadan gerçekleştirildi. Hata çubukları SD temsil (n = 2). (B) onun6- MBP-VSQNY * PIVQ-mEYFP substrat (0.0015 mM) de olarak amprenavir inhibitör etkisi HIV-1 PR etkinliği belirlemek için kullanılan (163.8 Toplam bir konsantrasyon, nM). Veri, yarım maksimal inhibitör konsantrasyonu (IC50) değerlendirildi komplo ve etkin enzim konsantrasyon tarafından (41,2 son etkin yoğunluğuna nM) uygulanan HIV-1 PR ayrıca inhibisyon eğri üzerinde temel alınarak hesaplanmasını. Hata çubukları SD temsil (n = 3). Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Şekil 6 : Bağımlılık enzim aktivitesi ve spontan substrat ayrılma üzerinde doktora eğitimi (A)onun6- MBP-VSQNY * PIVQ-mTurquoise2 substrat (içinde 0,033 mM) TEV PR enzim aktivitesini ölçmek için kullanılan (91.42 bir son toplam konsantrasyon, nM) içinde bölünme tampon farklı bir pH 6,5-8,5 Aralık için ayarlayın. Hata çubukları SD temsil (n = 2). Çizilen veri oldu daha önce14yayınlandı. (B) substrat boş örnekleri, onun spontan ayrılma göreli floresan yoğunluğu değerlerine göre6- MBP-VSQNY * PIVQ-mTurquoise2 substrat (0,033 mM) manyetik boncuklar üzerinden okudu bölünme arabellek kullanarak farklı pH ile 6.0-8.5 arasında. Çizilen veri oldu daha önce14yayınlandı. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
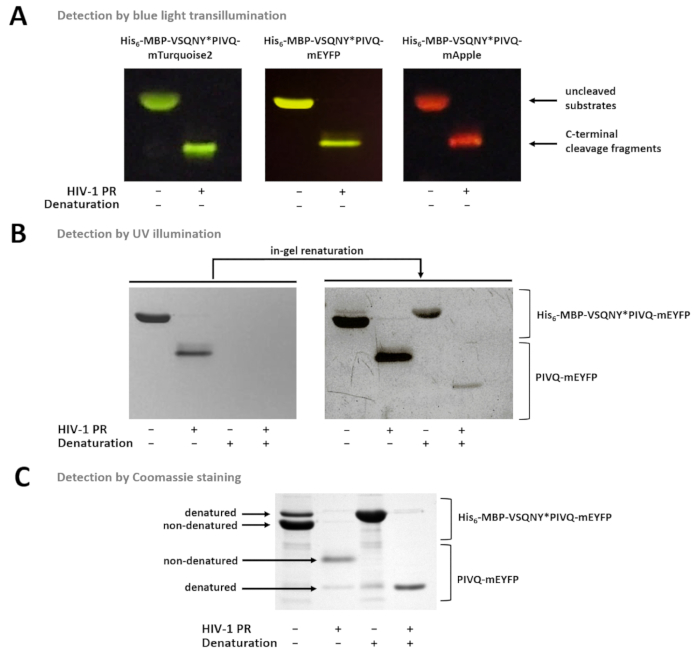
Şekil 7 : Protein jel içinde farklı yöntemlerle tespit. (A)Uncleaved ve HIV-1 PR sindirilmiş füzyon protein yüzeylerde nondenaturing numune hazırlama sonra SDS-sayfa sonra mavi ışık transillumination tarafından görüntülenmiştir. Bölünme tepki çözüm sindirim tarafından gerçekleştirildi. (B) sayfa hemen sonra sadece nondenatured proteinler tespit jel içinde iken SDS, çıkarıldıktan sonra UV aydınlatma tarafından daha önce denatüre floresan proteinler oldu kısmen renatured ve algılanabilir. Örnekleri Ni-NTA manyetik boncuk-tabanlı tahlil supernatants hazırlanmıştır. (C) Coomassie boyama da kullanılabilir jel renaturation sonra protein algılama için. SDS-günümüz jel-Mayıs ayında neden yerli protein kısmi denatürasyon, ancak yerel örnekleri, nondenatured formları daha boldur. Örnekleri Ni-NTA manyetik boncuk-tabanlı tahlil supernatants hazırlanmıştır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 8 : 96-şey plaka tabanlı uyarlaması tahlil platformu. (A) tahlil sadece 2 mL tüpler ama Wells bir 96-şey plaka, de yapılabilir. Burada hayali bir proteaz özgüllük vahşi-türü (wt) veya mutasyona uğramış (mut-1-mut-4) içerebilir floresan yüzeylerde bir dizi kullanarak eğitim tahlil uygulanması için şematik gösterim göstermek bölünme sitesi dizileri. Manyetik boncuk işleme için deneylerde kullanılmak üzere bir 96-şey uyumlu Manyetik parçacık yoğunlaştırıcı (MPC) olduğunu. Belirtilen birimlerin tümü için tek bir iyi ilişkilidir. Farklı yüzeylerde bölünme verimliliğini karşılaştırmak için substrat dönüşüm substrat-boş-düzeltilir RFU değerleri substrat-boş-düzeltilir RFU değerleri ilgili göz önüne alındığında tepki örnekleri arasında yüzde tespit edilebilir substrat kontrol örnekleri 100. (Fluorimetry, tahlil örnekleri de analiz sayfası ve floresan protein bileşenleri tarafından ayrılmış supernatants doğrudan veya jel renaturation nondenaturing ve denaturing örnek durumunda sonra analiz edilebilir sonraB) hazırlık, anılan sıraya göre. Üç farklı tahlil örnek türü de her şekilde gösterildiği: C yüzey kontrol, B = substrat boş ve R = reaksiyon =. Substrat kontrol örnekleri içinde belgili tanımlık substrate boş süre elüsyon tampon ve bölünme arabellekte tepki örnekleri vardır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| Arabellek | Floresan protein | MF % pistlerinin (%) |
| Elüsyon | mTurquoise2 | 6.04 |
| Göğüs arası | 9,11 | |
| Elüsyon | mApple | 10.92 |
| Göğüs arası | 12.68 |
Tablo 11: Varyans (CV %) değerleri pistlerinin substrat kalibrasyon eğrilerinin katsayısı. Rekombinant protein yüzeylerde floresans eklenen bölünme sitede bağımlı olup olmadığını sınamak için Kalibrasyonlar mApple ve mTurquoise2 erimiş yüzeylerde (farklı bölünme site içeren altı çeşitleri, her biri için bir dizi tarafından gerçekleştirilmiştir dizileri HIV-1 proteaz), elüsyon ve bölünme arabellekleri her ikisi de. Biz CV % değerleri pistlerinin altında bir tek substrat kalibrasyon aynı floresan etiketi içeren substrat türevleri tarafından gerçekleştirilen farklı ölçümlerin değerlendirilmesi için yararlı olabilir ima %15 her durumda bulunur.
Tartışmalar
Proteolitik enzim yoğun endüstriyel ve akademik araştırmalar ve ivedi ve uygun fiyatlı HTS-uyumlu proteaz tahlil platformlar için sürekli talep nedeniyle buna göre manyetik-boncuk-based floresan proteaz geliştirdiğimiz tahlil. Tahlil için yaygın olarak kullanılan sentetik peptid yüzeylerde yeni alternatifler olabilir rekombinant füzyon protein kullanımı temel alır.
Gelişmiş tahlil biçiminde füzyon protein yüzeyler manyetik özel Ni şelat kaplı boncuk yüzeyler için immobilize. Substrat eki onun6 benzeşme etiket doğrudan katlanır kolaylaştırmak ve substrat13su çözünürlük geliştirmek üzere bir MBP etiketi eritilmiş olan füzyon proteinin N-terminal tarafından sağlanır. MBP TEV PR sitelerin bölünme ve bir proteaz ilgi takip eder. Proteaz tarafından araştırılması için ikinci işlenebilir ise eski denetim bölünme site tahlil olarak hizmet verebilir. Göğüs arası değiştirilebilir sitesidir; bir kısa dsDNA sıra ilgi bölünme sitesi için kodlama esnek 'klonlama 've kaset ifade plazmid tüp ligasyonu tarafından eklenebilir. Rekombinant füzyon protein C-Terminal, proteolitik bölünme ( serbest enzim kurtarılmış, floresan C-terminal bölünme ürünleri son nokta tespiti sağlar son derece kararlı, monomeric floresan protein etiketi Şekil 1A). Farklı arabellekleri çözüldü arıtılmış floresan olduğu gibi yüzeylerde de kalibrasyon için yüzeyler ve bölünme ürünleri, molar konsantrasyonlarının değerlendirmek için kullanılır. Ayrıca, fluorimetry sonra tahlil bileşenleri SDS-PAGE tarafından de analiz edilebilir. Her iki yerli (nondenatured) ve denatüre floresan proteinler görselleştirildiği jel elektroforez hemen sonra veya sonraki jel renaturation sonra sırasıyla. Bu ek prosedür-in ile birlikte bir geleneksel Coomassie parlak mavi boyama-Mayıs verimli bir şekilde tahlil sonuçları (Şekil 1B) doğrulaması için kullanılması.
Basit, kolay yürütme adımları tam olarak bir yüksek-den geçerek otomatik ortamına adapte olabilir bir düşük hacimli biçimde tahlil özetlenebilir. Ancak, bağımsız olarak el ile veya bir otomasyon sistemi ile tahlil gerçekleştirmesini, tahlil aşağıdaki bölümlerini çok önemli ve özel ilgi yordamı gerçekleştirmeniz gerekir kabul edilir. i) manyetik boncuk çözüm polimerlerin. Homojen manyetik boncuk çözüm yöntemi, arıtma ve adımları yıkama hem de boyunca kullanılmalıdır. Özellikle, proteaz deneyleri güvenilirliğini güçlü manyetik boncuk (SAMB) substrat iliştirilmiş stok çözümleri üzerinde düzgün aliquoting bağlıdır. Süspansiyon ve dağılım etkinliğini artırmak için bu boncuk konsantrasyonu % 2 ve % 10 (v/v) arasında ayarlamak için tavsiye edilir. Numune hazırlama, kullanım sırasında arabellek (Triton X-100 veya ara 20 gibi) Noniyonik deterjan ile ilâ takıma % 2'de plastik yüzeyler manyetik boncuklar bağlılığı düşebilir. Boncuk süspansiyonlar dikkatle yerine şişeleri örnek tüplerinin duvarlar üzerine dipleri uygulanır eğer boncuklar bağlılığı örnek şişeleri duvarlarının önlenebilir. Enzimatik reaksiyon sırasında manyetik boncuklar polimerlerin da kritik ve sürekli kuluçka sırasında örnekleri 600 devir / dakikada sallayarak sağlanmış olur. V-alt tüpleri kullanımı tavsiye edilmez ise boncuk düzgün yuvarlak veya düz oturaklı plastik mallar içinde dağılmış. Uygunsuz boncuk homojenizasyon tarafından neden olduğu bir suboptimal sonuçlar Şekil 4B' temsil edilir. II) tepki örnekleri sona ermesi. Başka bir yöntem enzimatik reaksiyon ısıl denatürasyon veya herhangi bir potansiyel olarak müdahale kimyasal maddeler15kullanımı olmadan sonlandırılabilir avantajdır. Fesih geleneksel manyetik parçacık yoğunlaştırıcı kullanarak tepki karışım, manyetik boncuklar ayırarak yürütülen olabilir. Kaldırılan tepki arabellek etkin enzim ve oluşturulan C-terminal floresan bölünme ürünleri içerirken, uncleaved yüzeylerde boncuk için bağlı kalır. Etkin enzim reaksiyon arabellekte varlığı nedeniyle, ayrılık yordamı güvenilir bitiş noktası algılama için dikkatle yapılması gerekiyor. Örnek şişeleri yoğunlaştırıcı yerleştirmeden önce bu bir kısa spin Santrifüjü uygulamak için tavsiye edilir. Tüpler yoğunlaştırıcı koyduktan sonra en az 15 sağlamak için toplanacak boncuk s. Geri ve ileri ayırıcının solunda hafif hareket boncuk topluluğu kolaylaştırabilir. El ile gerçekleştirilen bir ayırma sırasında fesih genellikle tepkiler inisiyasyon daha fazla zaman alır, göz önünde bulundurun. Bu nedenle, aynı kuluçka süresi için tüm örneklerini uygulanması gerekiyorsa bir yaklaşık 2 dk kayıtlı gecikme arasında girişimlerine önerilir.
Açıklanan proteolitik tahlil nispeten basit bir kuraldır; Ancak, sistem çok yönlülük esnek ve sağlam alt yapısı tarafından garanti edilir. Testin bireysel optimizasyonu yalnızca tarafından benzeşme boncuk uyumluluk uygulanan koşullar, reaktifler ve katkı maddeleri ile sınırlı olabilir. Üreticinin protokolü ile anlaşma yüzeylerde Ni-NTA boncuk yüzeyler için benzeşme bağlama 6.515önemli ölçüde pH ≤ zayıflatır de bulduk. Bu nedenle, bu substrat boş örnekleri tepki örnekleri için paralel uygulamak için tavsiye edilir ve spontan substrat ayrılma oranını sonuçlarının değerlendirilmesi sırasında dikkate alınması gerekiyor.
Nerede manyetik boncuk-tabanlı deneyleri boncuk-uyumsuz bileşenleri veya düşük pH kullanımı nedeniyle gerçekleştirilemiyor, bu gibi durumlarda, çözüm hazım saflaştırılmış rekombinant yüzeylerde de uygulanabilir. Bu gibi durumlarda, reaksiyon karışımları Elektroforez tarafından analiz edilebilir ve proteinler açıklanan protokolüne dayanan jel içinde görüntülenir. Proteolitik aktivite araştırmak için çözüm sindirim ve jel algılama proteinlerin fluorimetry alternatif araçları de kullanabilirsiniz. Bir yenilik tasarlanmış substrat sisteminin SDS-sayfa denaturing sonra bir jel renaturation adım uygulamadır. Yerel (nondenatured) Floresan proteinlerinin Elektroforez sırasında onların floresans korumak iken, floresan özelliği denatürasyon (Şekil 7B) kaldırıldı. Ancak, floresans denatüre protein kısmen SDS kaldırılması jel tarafından elde edilebilir. Böylece, denaturing koşul kullanma tepki bileşenlerinin ayrılması sadece floresan tabanlı ama moleküler ağırlık-tabanlı kimlik sağlar. Başka bir Coomassie lekeli jel analizine göre floresan jel algılama (yerel ya da renatured) Floresan proteinler kolayca onların floresans dayalı jel olarak tanımlanabilir avantajdır (bkz. Şekil 7). Bu bölünme tepkiler nonfluorescent kirletici maddeleri içeren örneklerinde gerçekleştirilmesi durumunda veya yüksek moleküler ağırlıkları birbirine benzeyen proteinler önemli olabilir.
Proteaz deneyleri benzer şekilde tasarlanmış yüzeylerde kullanma-si olmak zaten be8,9,10, daha önce yayınlanan ve bu durumlarda ilgi bölünme sitesi da bir benzeşme etiketi arasında yer alan olmasına rağmen ve bir Floresan protein, sunulan tahlil sistemi burada sadece açıklanan fikirler tekrarlar ama önceki platformlar farklı avantajlarını birleştirir ve aynı zamanda onları daha fazla iyileştirmeler ile tamamlar: i) bir MBP füzyon ortak kullanımı II) Denetim bölünme bir TEV PR site III varlığı) yeni mühendislik monomeric FPs ve IV) benzersiz substrat kalibrasyon prosedürü uygulanması. Tahlil kendisi özellikle enzim özgüllük ve güvenli, pahalı araçları gerek kalmadan zaman ve maliyet-etkin şekilde kinetik çalışmalar için yararlı olacak şekilde tasarlanmıştır. Yönteminin uygun ve ekonomik araç her iki endüstriyel ve akademik araştırma amaçlı olması hedefleniyor. İfade plazmid ve 'klonlama kaset' esneklik nedeniyle sistem rekombinant substrat kütüphaneler hızlı ve ucuz üretimi için uygun olabilir. Burada açıklanan tahlil substrat özgüllüğü, enzim mutagenesis, uygulanması için uygun bir araçtır ve inhibisyon çalışmalar ve ayrıca, enzim kinetiği gerçekleştirmek için alternatif bir araç sağlar. Tahlil platformdan (kinetik parametrelerin belirlenmesi için bakteri hücre bozulması) HTS ve otomasyon dayalı bir ortama adapte edilebilir ve büyük olasılıkla, endüstriyel proteaz inhibitörü tarama ve/veya antiviral ilaç uygulanabilir geliştirme. Buna ek olarak, tahlil için rekabetçi proteolizis uyarlaması da gelecekte bizim laboratuvar kapsamıdır. Böyle rekabetçi bir tahlil, iki farklı yüzeylerde her içeren farklı bölünme site bir farklı C-terminal floresan etiket-aynı anda aynı bölünme tepki olarak okudu tercihi araştırmak için kullanılmak amacıyla are için erimiş verilen hedef sıralarının bir enzim. Ayrıca, bir 96-şey plaka adapte tahlil form (Şekil 8) kullanımını da mutasyonu tarama için değiştirilmiş bölünme sitesi serileri sistein proteaz durumunda ile yüzeylerde bir dizi kullanarak iyileştiriliyor.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu eser kısmen GINOP-2.3.2-15-2016-00044 "PHARMPROT ekip" projesi tarafından desteklenen ve, Ayrıca, çerçevesinde Yükseköğretim kurumsal mükemmellik programı, Bakanlığı insan kapasiteleri Macaristan, tarafından finanse Debrecen Üniversitesi biyoteknoloji tematik program. Yazarlar laboratuvar Retroviral Biyokimya bilimsel yardımlarına tahlil geliştirme sırasında hem de (özellikle için Norbert Kassay, Krisztina Joóné Matúz ve Vanda Toldi, tahlil çekimleri sırasında sabırları için üyeleri için minnettarız kim video arka planda görünmüyor). Yazarlar ayrıca özel sayesinde Gedeon Richter Plc., özellikle Beáta Bozóki'nın iş bölümü Biyokimya ve moleküler biyoloji misafir araştırmacı olarak izin vermek için Dr Zoltán Urbányi söylemek istiyorum. Yazarlar ayrıca ses ve video profesyonel yardım Multimedya ve E-öğrenme Teknik merkezi Debrecen Üniversitesi György Zsadányi, Balázs Tőgyi, Balázs Pöstényi ve Zoltán Király için onların Şükran diyoruz. üretim.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10K Amicon tubes | Merck-Millipore | UFC501096 | |
| 2-Mercaptoethanol (β-ME) | Sigma-Aldrich (St Louis, MO, USA) | M6250 | |
| 40% Acrylamide/Bis solution 37.5:1 | Bio-Rad | 1610148 | |
| Acetic acid | Merck | 100063 | |
| Agarose | SERVA | 11404.04 | |
| Alpha Imager HP gel documentation system | ProteinSimple | ||
| Ammonium persulfate (APS) | Sigma-Aldrich (St Louis, MO, USA) | A3678 | |
| Ampicillin sodium salt | Sigma-Aldrich (St Louis, MO, USA) | A9518 | |
| Beckman Coulter Allegra X-22 centrifuge | Beckman Coulter | 392185 | |
| Black half-area plates | Greiner bio-One | 675086 | |
| Bromophenol blue | Sigma-Aldrich (St Louis, MO, USA) | B0126 | |
| CutSmart buffer (10x) | New England Biolabs | B7204S | For plasmid linearization (step 1.1.1) |
| Dark Reader transilluminator | Clare Chemical Research | DR-45M | |
| DNase I | New England Biolabs | M0303L | |
| Dynamag-2 magnetic particle concentrator | Thermo Fischer Scientific | 12321D | |
| Escherichia coli BL21(DE3) competent cells | Thermo Fischer Scientific (Invitrogen) | C600003 | |
| Ethanol | Merc-Millipore | 100983 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich (St Louis, MO, USA) | 798681 | |
| Gel Loading Dye, Purple (6X) | New England Biolabs | B7024S | |
| Glycerol | Merck | 356350 | |
| Glycine | Sigma-Aldrich (St Louis, MO, USA) | G7126 | |
| High-Speed Plasmid Mini Kit | GeneAid | PD300 | |
| Imidazole | Sigma-Aldrich (St Louis, MO, USA) | 56750 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fischer Scientific (Invitrogen) | AM9464 | |
| Jouan CR 412 centrifuge | Jouan | CR412 | |
| Labinco LD-76 Rotator | Labinco | 7600 | |
| Luria-Bertani (LB) broth | Sigma-Aldrich (St Louis, MO, USA) | L3022 | |
| Lysozyme | Sigma-Aldrich (St Louis, MO, USA) | L6876 | |
| Magnesium chloride | Scharlau | MA0036 | |
| MERCK eurolab ultrasonic bath | MERCK | USR54H | |
| Millifuge Eppendorf spin centrifuge | Millipore | CT10 | |
| Mini-PROTEAN 3 Electrophoresis Cell | Bio-Rad | ||
| N,N,N′,N′-Tetramethylethylenediamine (TEMED) | Sigma-Aldrich (St Louis, MO, USA) | T9281 | |
| NanoDrop 2000 | Thermo Fischer Scientific | ||
| NheI-HF restriction endonuclease | New England Biolabs | R3131L | |
| Nickel(II) sulfate (NiSO4) | Sigma-Aldrich (St Louis, MO, USA) | 656895 | |
| Ni-NTA magnetic agarose beads | Qiagen | 36113 | |
| Orbital shaker | Biosan | OS-20 | |
| PacI restriction endonuclease | New England Biolabs | R0547L | |
| PageBlue Protein Staining Solution | Thermo Fischer Scientific | 24620 | |
| Phenylmethanesulfonyl-fluoride (PMSF) | Sigma-Aldrich (St Louis, MO, USA) | P7626 | |
| Protein Lobind Micro-centrifuge tubes | Eppendorf | 22431102 | |
| QIAquick Gel Extraction Kit | QIAGEN | 28704 | |
| Snijders Press-to-Mix shaker | Gemini | 34524 | |
| Sodium-acetate trihydrate | Sigma-Aldrich (St Louis, MO, USA) | S7670 | |
| Sodium-chloride | Sigma-Aldrich (St Louis, MO, USA) | S9888 | |
| Sodium-hydroxide | Sigma-Aldrich (St Louis, MO, USA) | S5881 | |
| SYBR Green I Nucleic Acid Gel Stain | Thermo Fischer Scientific | S7563 | |
| T4 DNA ligase | Promega | M180A | |
| Thermo shaker | Biosan | TS-100 | with SC-24 accessory block |
| Tris | Sigma-Aldrich (St Louis, MO, USA) | T1503 | |
| Tween 20 | Sigma-Aldrich (St Louis, MO, USA) | P2287 | |
| WALLAC VICTOR2 1420 multilabel counter | Wallac Oy, Turku, Finland |
Referanslar
- Meldal, M. Smart Combinatorial Assays for the Determination of Protease Activity and Inhibition. Molecular Informatics. 24 (10), 1141-1148 (2005).
- Rao, M. B., Tanksale, A. M., Ghatge, M. S., Deshpande, V. V. Molecular and biotechnological aspects of microbial proteases. Microbiology and Molecular Biology Reviews. 62 (3), 597-635 (1998).
- Zhang, G., Sittampalam, G. S., et al. Protease assays. The Assay Guidance Manual. , (2012).
- Woelcke, J., Hassiepen, U., Chen, T. Fluorescence-based biochemical assay formats. A Practical Guide to Assay Development and High-Throughput Screening in Drug Discovery. , (2010).
- Richardson, P. L. The determination and use of optimized protease substrates in drug discovery and development. Current Pharmaceutical Design. 8 (28), 2559-2581 (2002).
- Diamond, S. L. Methods for mapping protease specificity. Current Opinion in Chemical Biology. 11 (1), 46-51 (2007).
- Schilling, O., Overall, C. M. Proteome-derived, database-searchable peptide libraries for identifying protease cleavage sites. Nature Biotechnology. 26 (6), 685-694 (2008).
- Askin, S. P., Morin, I., Schaeffer, P. M. Development of a protease activity assay using heat-sensitive Tus-GFP fusion protein substrates. Analytical Biochemistry. 415 (2), 126-133 (2011).
- Chaparro-Riggers, J. F., Breves, R., Michels, A., Maurer, K. H., Bornscheuer, U. A GFP based assay for the determination of hydrolytic activity and substrate specificity of subtilisins under washing conditions. Journal of Molecular Catalysis B: Enzymatic. 35, 74-77 (2005).
- Patel, D., Frelinger, J., Goudsmit, J., Kim, B. In vitro assay for site-specific proteases using bead-attached GFP substrate. Biotechniques. 31 (5), 1194-1198 (2001).
- Branchini, B. R., et al. Sequential bioluminescence resonance energy transfer-fluorescence resonance energy transfer-based ratiometric protease assays with fusion proteins of firefly luciferase and red fluorescent protein. Analytical Biochemistry. 414 (2), 239-245 (2011).
- Zhou, C., Yan, Y., Fang, J., Cheng, B., Fan, J. A new fusion protein platform for quantitatively measuring activity of multiple proteases. Microbial Cell Factories. 13 (1), 44 (2014).
- Fox, J. D., Waugh, D. S. Maltose-binding protein as a solubility enhancer. Methods in Molecular Biology. 205, 99-117 (2003).
- Bozóki, B., et al. A recombinant fusion protein-based, fluorescent protease assay for high throughput-compatible substrate screening. Analytical Biochemistry. 540-541, 52-63 (2018).
- Mótyán, J. A., Miczi, M., Bozóki, B., Tözsér, J. Data supporting Ni-NTA magnetic bead-based fluorescent protease assay using recombinant fusion protein substrates. Data in Brief. 18, 203-208 (2018).
- Balleza, E., Kim, J. M., Cluzel, P. Systematic characterization of maturation time of fluorescent proteins in living cells. Nature Methods. 15, 47-51 (2018).
- Hebisch, E., Knebel, J., Landsberg, J., Frey, E., Leisner, M. High variation of fluorescence protein maturation times in closely related Escherichia coli strains. PLoS One. 8, e75991 (2013).
- Kapust, R. B., et al. Tobacco etch virus protease: mechanism of autolysis and rational design of stable mutants with wild-type catalytic proficiency. Protein Engineering, Design and Selection. 14, 993-1000 (2001).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır