Method Article
Probiyotik çalışmalar yenidoğan farelerde sonda ile besleme kullanarak
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu çalışmada yenidoğan fareler için Probiyotikler gavaging kesin miktarda işlem ayrıntıları. Deneysel ayarı içerecek şekilde optimize edildi ama dozaj, yönetim yöntemleri ve bakterilerin bağırsak quantification probiyotik sınırlı değildir.
Özet
Yetişkin fare modelleri insanlarda hastalık ilerleme arkasında mekanizmasını anlamak için yaygın olarak kullanılmaktadır. Yetişkin fare modelleri Yenidoğan hastalıkları için yapılan çalışmalar uygulanabilirliği sınırlıdır. Hastalığın ilerlemesi, ana bilgisayar yanıt ve uzun vadeli etkisi ventilasyon müdahalelerin daha iyi anlamak için büyük olasılıkla bir yenidoğan fare modeli daha iyi bir seçimdir. Yenidoğan fare modelleri seyrek kullanımını kısmen bu küçük hayvanlarla çalışma teknik zorluklar bağlanabilir. Yenidoğan fare modeli gençliği yönetiminde probiyotik etkilerini belirlemek için ve özellikle yeni doğmuş fare bağırsak kolonizasyon kurmak yeteneği değerlendirmek için geliştirilmiştir. Özellikle, probiyotik kolonizasyon yenidoğan Mouse değerlendirmek için Lactobacillus plantarum (LP) yenidoğan fare gastrointestinal sistem doğrudan teslim edildi. Bu amaçla, LP fareler için Intra-yemek borusu (IE) sonda ile besleme besleme tarafından yönetiliyordu. Son derece tekrarlanabilir bir yöntem travma, bir yönü özellikle önemli kırılganlık yeni doğan farelerin verilen en aza indirirken bir doğru in probiyotik dozlarda yönetiminin IE gavaj sürecini standartlaştırmak için geliştirilmiştir. Sınırlamaları bu sürecin gavaged Eğer özofagus tahriş veya hasar ve aspirasyon olanakları içerir yanlış. IE gavaj distal yemek borusu içine aspirasyon azaltır çünkü bu yaklaşım mevcut uygulamaları üzerinde bir iyileştirme temsil eder. Sonda ile besleme nicel polimeraz zincir reaksiyonu (qPCR) ayıklanan bağırsak DNA ile LP belirli primerler kullanılarak probiyotik kolonizasyon profil takip ettiler. Farklı çöp ayarları ve kafes yönetim teknikleri kolonizasyon-yayılma potansiyeli değerlendirmek için kullanılmıştır. Protokol IE yenidoğan fare sonda ile besleme ve sonraki kolonizasyon miktar LP ile inceliklerini ayrıntılarını verir.
Giriş
Bebeklerde, erken probiyotik poz azaltılmış enterokolit, atopik dermatit ve sepsis1,2,3, Nekroze edici gibi hastalıkların insidansı önde gelen immunomodulatory etkileri ile ilişkili olduğu düşünülmektedir 4 , 5. ancak, bu immunomodulatory yanıt arkasında mekanizması keşfetmek için örnekleme için sınırlama yeni doğan insan denemeler (yani, sıralı kan berabere ve biyopsi) verilen zordur. Yenidoğan fare modelleri etki mekanizması probiyotik kullanımı ve bağırsak microbiota değişimler ile ilişkili neonatal bağışıklık yönetmelikte yer alan çalışma yardımcı olabilir. Ne yazık ki, çoğu fare modelleri için Probiyotikler büyük ölçüde yetişkin fareler üzerinde odaklanmıştır; Ancak, probiyotikler etkisini modelleri bu yaş grubu için belirli yararlı3,6olacak düşündüren hayatta erken yüksek olması muhtemeldir. Buna ek olarak, yenidoğan fare modelleri daha iyi hastalıklar ve uygulama, insan bebeklerin erken yaşamda daha yakından bir gelişmekte olan bağışıklık ve mikrobiyal sistem7,8 taklit etmek için beklendiği yönelik müdahaleler çalışmaya uygundur ,9,10. Ev sahibi ve onun microbiome arasında mekanik etkileşim odaklı bir yenidoğan farelerin probiyotik kolonizasyon desenleri ve ölçüde çalışmaya amacı oldu. Yeni doğan modelleri uygun açıklamaları literatürde bulunamadı ve böylece sağlam ve standart bir yöntem geliştirilmesi ihtiyacını ele alındı.
Yeni doğan fareler için çeşitli bileşiklerin sözlü yönetim kurulan yöntemleri anne sütü yoluyla istenen bileşikler transferini hamile barajlar11 için su kaynağı tedavi veya yönetimini kolaylaştırmak için besleme iğneleri kullanarak içerir istenen bileşenleri içine mastoidi12. Bu yöntemleri bu hassas dozaj gereksinimleri yoktur, nerede tedavi kolayca alıcı fare ile yutulur deneyleri için yararlıdır. Probiyotikler sık sık galactooligosaccharide ve fructooligosaccharide (FOS) bir probiyotik bakteriler için besin kaynağı olarak hizmet gibi bir prebiyotik ile birlikte uygulanmaktadır; Bu katkı bileşiklerin viskoz ve zorlu yolu ile yukarıda belirtilen yöntemleri yönetmek için çözüm olun. Prebiyotik ve probiyotikler kesin tutarları gerekli yaşam (DOL) ilk günkü gibi erken başladı yeni doğan fareler için yönetmek için bir yöntem oluşturulması. (Tedavi ve kontrol silah13,14,15,16arasında diğer probiyotik çalışmalarda gözlemlediği gibi) gavaj tekniği, kolonizasyon-yayılma olasılığı geliştirme süreci test edildi ve kolonize Lactobacillus plantarum (LP) ve yavrularını farklı sonda ile besleme programları ile bağırsak göreli bolluk değerlendirildi. Deneylerde kullanılan probiyotik hazırlık FOS (prebiyotik) ve maltodekstrin (kurtuluşu) ile son insan deneme3' te açıklandığı gibi karışık LP (ATCC 202195 zorlanma), gavaj başına 109 koloni oluşturan ünite (CFU) oluşuyordu. Probiyotik teslim IE sonda ile besleme kullanarak başarılı oldu ve işlem protokolü aşağıdaki ayrıntılı. Probiyotik kolonizasyon profil LP belirli primerler kullanılarak tüm bağırsaklar çıkarılan DNA amplifikasyon gerçek zamanlı kullanılarak değerlendirilmiştir.
Protokol
Tüm yordamları için destek personeli hayvan bakım tesisi British Columbia Üniversitesi tarafından kurulan yönergeleri ile ilgili yapılmıştır ve tüm yordamları UBC hayvan bakımı Komitesi tarafından kabul edildi.
1. quantification yönetilen Probiyotikler
Not: Probiyotik tek bir doz yönetilebilen CFU tam miktarını belirlemek için bu adım önerilir. Probiyotikler ve araç (FOS ve Maltodekstrin) sayısını çözüm doygunluk koşulları belirle. Herhangi bir daha fazla hacim aspirasyon riskini arttıkça--dan deneyim, farelere DOL 2 fazla 30 µL (kg başına ~ 20 mL) sıvı yönetilebilir.
- Altı 1.5 mL microcentrifuge tüpler için seri dilutions 180 µL steril % 5 Dekstroz tuz içeren her tüp ile hazırlayın.
- Tartmak 0.2 g aliquot probiyotik prebiyotik karışımı ve %5 Dekstroz tuz 1 mL steril bir şekilde çözülür.
- 30 saniye ve pipet kümeleri kırmak için girdap. Görünür hiçbir kümeleri gözlenen kadar yineleyin.
Not: Maltodekstrin çözüm viskoz hale getirir ve çözüm doygunluk için katkıda bulunmak. - 1.1. adımda hazırlanan borular kullanarak bir seri seyreltme gerçekleştirin. Girdap karıştırmak için.
- 40 µL etiketli bir kadran üzerine her seyreltme MRS agar plaka, plaka. Yinelenen her seyreltme plaka.
- Anaerobik altında kuluçkaya (ya da mikroaerofilik) 48 h vakum kavanozda bir gaz Pack'i kullanmak için 37 ° C'de koşullar.
- Her plaka 20-70 kolonileri çeyrek başına bir Aralık içinde saymak. Ortalama plaka ile aynı seyreltme sayar ve istenen birimlerine hesaplayın.
2. sonda ile besleme için hazırlık prebiyotik ve probiyotikler
Not: Uygun fesih probiyotik ve prebiyotik sıvı yumuşak enjeksiyon besleme iğne sonda ile besleme sırasında sağlamak gereklidir.
- Prebiyotik ve steril microcentrifuge tüp içinde araç istenilen miktarda probiyotik liyofilize organizma gerekli miktarda birleştirin.
- Probiyotik prebiyotik karışımı çözülmeye solvent (%5 Dekstroz serum) uygun miktarda ekleyebilirsiniz.
Not: Limited tarafından prebiyotik ve kullanılan araç nın kapasitesidir. Deneyim, (FOS ve maltodekstrin ile) synbiotic birlikte yaklaşık 0.3 g/mL, 1 mL çözücü kullanarak bir 2 mL microcentrifuge tüp içinde eriterek süre doygunluk ulaştı. - Girdap tüm katı eriyene kadar karıştırın. Bir damlalıklı globüller çözücü katı parçacıkların yukarı ve aşağı pipetting tarafından bölmek için kullanın.
- Çözüm için 20 dk 37 ° C su banyosunda kuluçkaya.
Not: probiyotik prebiyotik çözüm canlı bir kültür oluşturduysanız Bu adım atlanır olabilir. - Beş bir dizi plaka MRS ağar kaplamalar doğru probiyotik ölçmek için sonda ile besleme önce üzerinde 10 kat seyreltme yönetilen yavru için. Doğru CFU sayısını gerekmiyorsa bu adım-ebilmek var olmak kaptan.
3. kabin Biyogüvenlik hazırlanması
- Biyogüvenlik kabini probiyotikler ile çalışırken aseptik teknik korumak için kullanın. Belgili tanımlık kafes baraj ve pups üzerinde bir Isıtma battaniye (yaklaşık 38 ° C ayarlı) ile bire ayarla battaniye yarısı. Temiz, boş hayvan kafes Isıtma battaniye diğer yarısı yerleştirin.
- Dezenfekte ya da steril, emici Ped sonda ile besleme sırasında fare eğilimi Isıtma paket üzerinde bir yer.
- Varolan, baraj tarafından oluşturulan yuva tepesinden yavrular için iç içe geçmiş malzeme toplamak ve yeni bir konik iç içe geçmiş fincan % 70 etanol kullanarak dezenfekte ve kurutulmuş eldivenli ellerini kullanarak oluşturun. Bu yeni yuva temiz, boş holding kafese koyun. Bu yuvayı kokusu transfer eldivenli ellere kolaylaştırır ve böylece onları yordamı markada riskini azaltmak için taşıma sırasında giriş diğer kokuları yavru fok üzerinde en aza indirir.
- Belgili tanımlık pups kafes tutan konik yuvaya taşıyabilir ve belgili tanımlık kafes baraj ile kabine kaldırabilirsiniz. Bu işlem sırasında belgili tanımlık pups işitme engelleyerek baraj için stres azaltır.
Not: probiyotik fare bağırsaklar bilinen bir sömürge ise, tedavi koşulları kafes veya bile farklı Biyogüvenlik tarafından dolapları kolonizasyon çapraz olasılığını önlemek için ayrılmalıdır.
4. yenidoğan fare içi özofagus sonda ile besleme
- Kolay erişim için şırınga ambalaj açın. Ambalaj iğne steril bir şekilde açın ve şırınga başına ekleyin. İğne % 70 etanol ve yordamı önce otoklav ile yıkayın. İğneler, tedavi ve kontrol grubu için farklı ayarlar kirlenmesini önlemek için kullanın.
- Biraz daha fazlasını probiyotik-boya çözüm istenilen miktarda şırınga çizin. Şırınga yukarı bakacak şekilde tutun. Sonra daha da aşağı çekin ve kabarcıklar çıkarmak ve pistonu üzerinde istediğiniz birimin ulaşılana kadar kabarcıklar ve ekstra sıvı birimi çıkarmak için itmek için parmağınızla hafifçe vur. Bu iğneyi hava boşluk olduğunu sağlar. DOL 2 fare için sonda ile besleme hacmi 30 µL aşmamalıdır.
- Yavru steril emici Ped ısıtma yastığını üzerine üzerine yerleştirin. Besleme iğne (24 ölçüm, 1" iğne uzunluğu, 1,25 mm topu çapı) dışarıdan topu hemen altında xiphoid işlem (göğüs kemiğinin alt ucuna) iğne yerleştirerek özofagus uzunluğunu ölçmek için kullanın. İğne iğne (Şekil 1) ekleme sınırı Not burun düzeyde işaretleyin. Düzenli nefes ve deri pembe rengi içerir sağlık işaretleri için yavru gözlemlemek.
- Daldırma solvent (%5 Dekstroz serum veya - orta kullanılan probiyotik çözülmeye ve önceden biyotik) içinde iğne ucu daldırma besleme iğne dış yüzeylerinin yağlamak için. Bu fare yemek borusu içine iğne pürüzsüz girişini kolaylaştırır.
- Yavru scruff veya hafifçe baş ve vücut başparmak ve işaret parmağı arasında tutarak kaldırın. Baş, boyun emin olun ve vücut düz durumda tutulur. Yavru fok için scruff tarafından 60 uzun tutmayın s gibi orada boğulma için önde gelen nefes borusu tıkanıklığı bir risk olduğunu. Yavru fok nefes olun. Scruffing çok zor belirtisi yetersizlik nefes için önemli nefes nefese ve ağız genişletilmiş dil içerebilir. Monitör pups renk ve bütün prosedür sırasında nefes.
- Boğaz arkası ulaşıncaya kadar iğne ampul gövde uçağa 45 ° açıyla yavru ağzı ortasına takın.
- Yavaşça iğneyi ampul üzerinde tutamacın iğne açısını değiştirmek ve şırınga (yavru fok dorsal tarafına doğru) gavaging kişi bu kadar uzak pups vertebral sütunun uçağa paralel taşınmasıdır. Scruffing yavru fok iğne boğaz arkasında yerde tutmanıza yardımcı olur ve Ayrıca fareyi Kıvranmayı üzerinden engeller. Top iğne ilerlemek değil ya da açı değişikliği sırasında boğaz arkasına karşı herhangi bir baskı emin olun.
- Fare iğne yutmak girişiminde bulunursa, doğal olarak aşağı doğru kaydırın ve ne zaman iğne üzerinde işaretleme burnu ile hizalar hareketi tutuklamak izin. Şırınga ve iğne nedeniyle aşağı için yeterince ağır genellikle yerçekimi. İğne kolayca yemek borusu aşağıya doğru baskı ile aşağı sonda ile besleme taşıyan kişiden slaytlar bu yüzden iğne ağırlığını her zaman destek.
- İğne direnç boğaz arkasında karşılıyorsa, biraz topu iğne ve yeniden açı çıkarmak için sonda ile besleme iğne iğne fare (işleyicisi'nın sağ) yavaş yavaş küçük, 1 mm aralıklarla sola doğru ağız içinde geri alıyorum. İğne kolayca yemek borusu kaymaya başlayacaktır.
- İğne üzerinde işaretleme ağız ulaşmadan önce iğneyi durdurursa, çözüm enjekte değil.
- Fazla 20 için eklenen iğne tutmak değil s. Bu durumda iğne yavaş yavaş şırınga için gövde paralel tutarken geri çekmek ve dinlenme için 30 kağıt havlu üzerinde yavru izin iğne çözücü ile dış yüzeyine yağlama sonra tekrar 1 dk. deneyin gavaging s.
Not: fare yanıt sonda ile besleme başarısını ölçmek gerekli olduğu gibi anestezi yordamı için kullanılmaz.
- Ne zaman beslenme iğne üzerinde işaretleme burun ve burun ucu ile uyumlu, taşıma veya herhangi bir daha fazla ilerlemek iğne izin vermeyin. Yavaş yavaş istediğiniz birimin bir sıvı enjekte et. Sıvı Aspire veya kabarcık burundan gözlenen, enjeksiyon hemen bırak ve yavaşça iğneyi geri çek.
- Yavru fok onun kurtarma yardımcı olmak için ısıtma yastığını kağıt havluda dik yerleştirin. Devam eden solunum sorunları için yakından izlemek veya aspirasyon gösteren pup rengini değiştirme. Hemen emişli pups ötenazi.
- Sonda ile besleme tamamlandıktan sonra yavaşça bu eklenmiş aynı açıda besleme iğne geri alıyorum. Yavru fok ılık ısıtma yastığını üzerine kağıt havlu üzerine yerleştirin. Bekle 10 s normal aktivite ve nefes desen yeniden elde etmek pup için. Sağlıklı bir pembe renk tonu pups vücut üzerinde görünür ve boya sadece mide bölümünde görünür olmalıdır. Geri taşımak belgili tanımlık kafes ile diğer yavrular için.
Not: Gavaging mavi gıda renklendirme yukarıda özetlenen yordamı uygulama için mükemmel bir yoldur. Sonda ile besleme başarılı olursa, mide fare mavi bir renk tonu görünür. Mavi boya yavru (boyun, göğüs veya aksiler bölge) mide dışında bulunursa, bu yemek borusu veya aspirasyon bir kopma gösterir gibi hayvan insancıl (hayvan bakımı kurallarına), ötenazi.
5. intestional örnekleri kolonizasyon analiz için topluluğu
- Sonraki izleme veya gavaging sırasında--dan belgili tanımlık pups fekal microbiome örnekler toplamak.
Not: Yavru köpek sık sık idrara ve gavaged ne zaman ı ve bu sefer microbiome analiz için dışkı örnekleri toplamak için bir fırsat olarak kullanılabilir. - Deneyler sona ermesi için bağırsak oniki parmak bağırsağı--dan belgili tanımlık pups ötenazi sonra Rectuma toplamak. Yavru bir cerrahi kurulu pin ve cilt % 70 etanol ile dezenfekte. Deri dört çeyrek daire içine % 70 etanol ve sıcak boncuk sterilizasyon 250 ° C'de ile sterilize araçlarını kullanarak periton tabakası zarar vermeden kes gitsin
- Steril araçları farklı bir dizi periton dört çeyrek daire kesme ve viseral organlar maruz kalan bir şekilde merkezinden taşımak için kullanın.
- Mide bulun ve pilor sfinkter aşağıda ve rektum sonunda çimdik için bir mengene kullanın. Bağırsak verimlilik düzeyini artırmak ve bağ dokusu ve mezenterik doku ücretsiz bir künt aracını veya forseps kullanarak bağırsak uzunluğu çalıştırın. Bağırsak tüm uzunluğu bağ dokusu boşaltıldıktan sonra klempe uçları kesti.
- Alüminyum folyo ile bağırsak yönünü işaretle, güvenli bir şekilde sarın ve-80 ° C'de dondurmak
Not: Bu noktada olmadan buz gibi DNA ekstraksiyon işlemi yapılabilir. Mavi boya da bağırsak 24 h üzerinden geçmek görülmüş ve örneklerin kolonizasyon analiz bağırsak en az 24 saat toplandığında en iyi için nakletmek son sonda ile besleme. Sinyalleri geçici sonda ile besleme karışımı ile geçen sigara yapıştırılır bakteriler tarafından o timepoint önce güçlendirilmiş.
6. DNA çekme--dan bağırsak kolonizasyon analizi için
Not: DNA ekstraksiyon yapılır bağırsak DNA ekstraksiyon için protokol yapılan değişiklikler en iyi duruma getirme ile ticari bir seti kullanarak. Isıtma cihazları için istenilen sıcaklığı ayarlamak ve değişiklikler veya öncesi ısınma gerekir çözümleri uygun şekilde hazırlanmış olun.
- Enzimatik lizis arabellek (ELB) aşağıdaki gibi hazırlamak: bir çözüm 20 mM Tris-Cl, 2 mM sodyum EDTA ile % 1.2 olun Triton X-100. 8,0 pH ayarlayın. Hemen ELB kullanmadan önce lizozim 20 mg/mL nihai bir konsantrasyon için ekleyin.
- Garnet boncuk tüpler analitik denge kaldırıldı kapaklar ile önceden tartmak.
Not: Eğer gerekli ağırlık kaçırdı, bağırsak içeriği kaldırmak daha kolaydır böylece bu yapılır. - Bağırsak tek kullanımlık steril neşter kullanarak küçük parça halinde kesilmiş ve istenilen parçaları önceden ağırlığını garnet boncuk tüpler içine oymak.
Not: DNA her yerde ve PCR sonuçları etkileyebilir neşter her örnek arasında değiştirmek emin olun. - ELB 1 mL (Kimden adım 6.1) lizozim her tüp ile ekleyin, vortexing boncuk çırpıcı üzerinde yerleştirin ve 5 dakika boyunca en yüksek ayarda (14) çalıştırın.
- Doku bozulur, tüpler 37 ° C su banyosu için aktarım ve 30 dakika için kuluçkaya.
Not: Bu adımı lizozim etkinleştirmek ve gram-pozitif bakteri hücre duvarı peptidoglikan dökümünü ikna etmek için yapılır. - Her örneği bir konsantrasyon mL başına 600 mAU'İndinavir k 20 µL tüplerini hazırlayın.
- 400 x g de tüpler santrifüj kapasitesi 10 dakika boyunca. Lysate bazı doku kalıntı üstüne boncuklar ile temizleyin görünmelidir.
- (Üst aşama) süpernatant ile 180 µL İndinavir K içeren bir tüpün içine aktarmak ve 200 µL AL tampon tüp ekleyin. 15 için girdap karışımı s.
- Tüpleri Isıtma blok 56 ° C'de 10 dakika yerleştirin.
- 200 µL % 100 etanol tüp ekleyip karıştırın by vortexing 15 s.
- Yaklaşık 600 µL lysate, spin sütununu (kit) ekleyin.
- Santrifüj 8.000 x gde 1 dakika. İle akışı atmak.
- Tüm lysate çetik kadar sütunu boyunca 6.12 tekrarlayın.
- Yeni bir koleksiyon tüp sütununda bir yer. AW1 arabellek ve santrifüj 500 µL de 8000 x g 1 dakika için ekleyin.
- Aracılığıyla akış atmak. 500 µL AW2 arabellek ve santrifüj 8.000 x g 3 dakika için ekleyin.
- Aracılığıyla akış atmak ve bir boş koleksiyon tüp 8.000 x g 3 dk de sütununda santrifüj kapasitesi.
- Sütun DNA elüsyon tüp için transfer. 60 µL PCR sınıf Ultrasaf Su doğrudan membran üzerine ekleyin ve 2 dakika oda sıcaklığında kuluçkaya.
- Elute için 37 ° C'de önceden ısıtılmış elüsyon su kullanın. Elüsyon yarı final elüsyon birim için yapılabilir iki kez ve yinelenen adım 6.15 iki kez verim artışı.
- DNA elute için 8000 x g de 1 dakika santrifüj.
- İstenen quantification yöntemiyle eluted DNA konsantrasyonu ölçmek. Ayıklama işlemi verimi 10-40 ng/µL DNA aralığında bulunmaktadır.
- -20 ° C'de eluted DNA depolamak
7. qPCR Kur
- PCR koşulları
- Üstünde belgili tanımlık makine açmak ve Tablo 1 programı bir gerçek zamanlı qPCR makineye yüklemek.
- Adım 3-5 Tablo 1 ' deki 40 döngüleri için döngü ve reaksiyon sonunda 4 ° C'de örnek tutun.
- PCR deneysel Kur
- Astar ve Tablo 2' de bulunan sıcaklık kullanın. Tablo 3' te bulunan tepki koşul ve konsantrasyonları kullanın. Nüsha her reaksiyon yordam varyasyon için denetimine ayarlayın.
- QPCR sistem ve içine belgili tanımlık sistem--dan adım 7.1 yüklü program çalıştır PCR reaksiyon tüpler/plaka yeri.
- Çalışmanın sonunda tüpü çıkarması, bu 4 ° C üzerinde yerleştirip yükleme jel için hazırlamak.
8. miktar LP kolonizasyon
- QPCR karışımları 10 µL veya Tablo 3göre 20 µL reaksiyonlar hazırlanın.
- LP genomik DNA standart eğri 107 ' ye 101 kopya/µL
Not: her seyreltme 4 µL kaplama beri 4 µL 107 kopya veya 2.5 x µL başına 106 kopya gerekli başlangıç stokta. Aynı prensip eğri geri kalanı için kullanın.- 1:4 seyreltme hazırlamak: 107 kopya başına 50 µL µL.
LPDNA + dH2O 46.85 µL 3.147 µL = 2. 5 x 106 kopya başına µL - Seri olarak sulandırmak 10 kat: 5 µL 45 µL dH2O 1,25 x 105 kopya/µL için ekleyin.
- Seyreltme iyi başına başına 4 µL plaka.
- 1:4 seyreltme hazırlamak: 107 kopya başına 50 µL µL.
- LP amplicons görselleştirme
- Net bir ayrım ulaşmak için % 2 özel jel kullanımı ~ 197 bp LP güçlendirilmiş parçası.
- 9 µL PCR ürünleri jel içinde yük.
- Jel 120 V 30 dakika çalıştırın.
Sonuçlar
Bu yöntem benzersizliğini boyutuna gavaging tekniği, adaptasyon ve neonatal fare zaaf aittir. Önceki bölümde açıklanan bir DOL 2 fare üzerinde başarılı sonda ile besleme yordamı yürütmek önemli adımları. İyi miktar ölçek kurmak için standart bir eğri üç teknik çoğaltır (Şekil 2) ile saf LP DNA kullanılarak oluşturulan. Standart eğri LP DNA tespiti dinamik bir dizi primerler kullanılarak sağlanan. Kameranın dinamik alanı 7 ve 28 döngüleri arasında 10 bir dizi nerede yapıldı1 LP DNA 107 kopya olarak algılandı. Standart eğri sürekli eğimi etkinliği ve ölçeklenebilirliğini tepki temsil.
IE sonda ile besleme yordamı göreli kolaylıkla yetişkin fareler kullanılmıştır. Ancak, üst gastrointestinal sistem yenidoğan fareyi kırılgandır ve sonda ile besleme gerekli kalibre edilmiş hareketleri işlem sırasında iğne. Tekrarlanan gavages işleme nedeniyle baraj tarafından içi yemek borusu tahriş, yaralanma ve başarısızlık veya reddedilme şansını artırmak olabilir. Bu nedenle, iki farklı gavaging zamanlamaları test edildi ve bağırsak kolonizasyon bütün bağırsak homogenates DNA'yı kullanarak sayısal. Fareler her gün ya da iki günde (Şekil 3) yönetilen probiyotik ile DOL 2 ile DOL 8 gavaged. Her örnek bir teknik REPLICATE bulunan ve her koşulda en az iki biyolojik çoğaltır vardı. Belgili tanımlık pups gavaged iki günde 4 doz ile yaklaşık 105 kopya belgili tanımlık pups gavaged her gün 7 dozlarda LP yaklaşık 103 kopyalarını bulunuyordu. Sonuçları çoğaltır arasında tutarlılık hassas teknik olarak kredi ekleyin. Daha fazla LP ve yavrularını gavaged bağırsaklarında her gün gavaged pups ile karşılaştırıldığında iki günde tespit edildi. Ayrıca yavrular için stres indirgeyerek bu göz önüne alındığında, sonraki deneyler her geçen gün bir sonda ile besleme programı ile kurulmuştur.
Intra-çöp probiyotik önlemek önemlidir çapraz bulaşma probiyotikler ile çalışırken. Aynı anneden ve iç içe geçmiş çevre payı olarak benzer şekilde littermates microbiome bekleniyor. Probiyotik organizma microbiota bir parçası olma potansiyeline sahip olarak tedavi ve kontrol koşullar aynı çöp içinde mevcut olsaydı bu probiyotik çalışmaları için bir sorun kanıtlıyor ("yaymak kolonizasyon '). Bir probiyotik kontamine ve tedavi edilmezse littermates kolonize Eğer belirlemek için bir çöp yarısı yukarıda olarak gavaged ve bağırsak qPCR için toplanmıştır. Bağırsak qPCR analiz DOL 10 farelerin gavaged farelerde, aynı zamanda, gavaged sigara littermates (Şekil 4) daha az bir ölçüde beklenen LP DNA amplifikasyon gösterdi. Tedavi edilmemiş bir kafes üzerinden aynı DOL fareler bağırsağından hiçbir amplifikasyon veya döngüsü sırasında en az amplifikasyon 32 den büyük gösterdi. Bu microbiome bir çöp bir kafes içinde toplumsal paylaşım için kanıt sağladı. Böylece, probiyotikler ile deneyler için tedavi grupları kafesleri çapraz bulaşma değişkenliği için denetime tarafından ayrılmalıdır. Koruyucu baraj kullanımı bir deney içinde kurulmuş olması ise bir çöp ayar, ancak etkileri semptomlarıdır koruyucu baraj azalmış bakım gibi ve ret değerlendirilecek ve iyimserlik için kabul edilebilir. Ne zaman fare DOL 8 kalmıştı kadar gavaged altı gün boyunca tedavi edilmezse ve bağırsak DNA DOL 14, analiz, LP yaklaşık 10 kopya (Şekil 5) bulunamadı. Böylece, LP kolonizasyon geçici bulundu ve zaman içinde tespit nüfus azaldı.
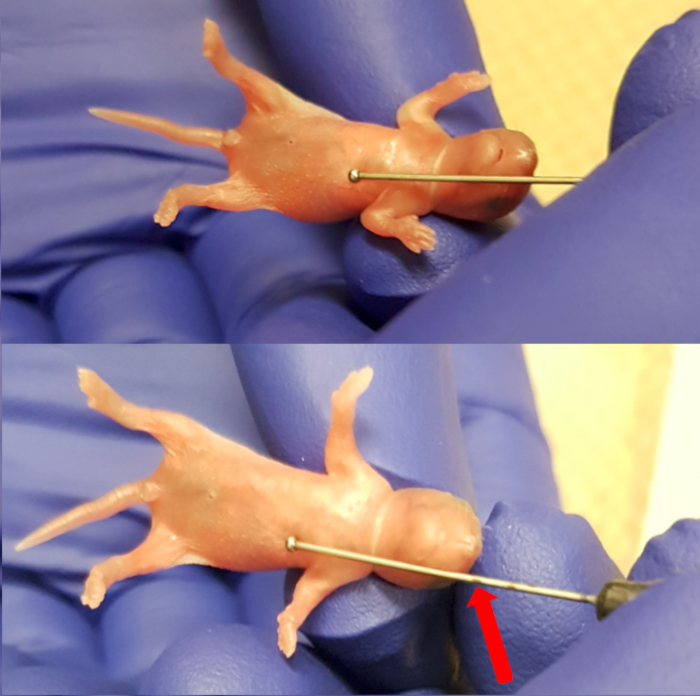
Resim 1 . Xiphoid işlem (göğüs kemiğinin alt son) maksimum ekleme için iğne işaretleme yapmak için burun arasındaki Uzunluk ölçme. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
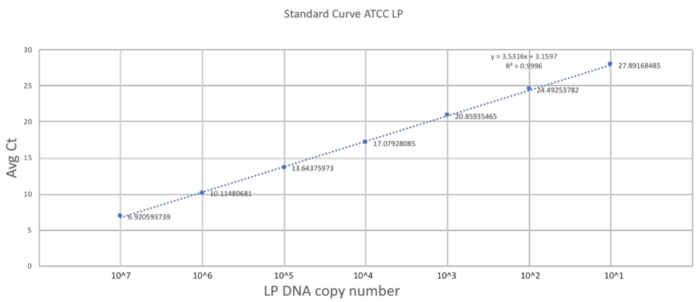
Resim 2 . Standart eğri LP astar ve ATCC LP DNA kullanarak kurdu. Bir seri seyreltme ATCC LP DNA algılanamaz dinamik çalışmada kullanılan astar için kurmak için yapıldı. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
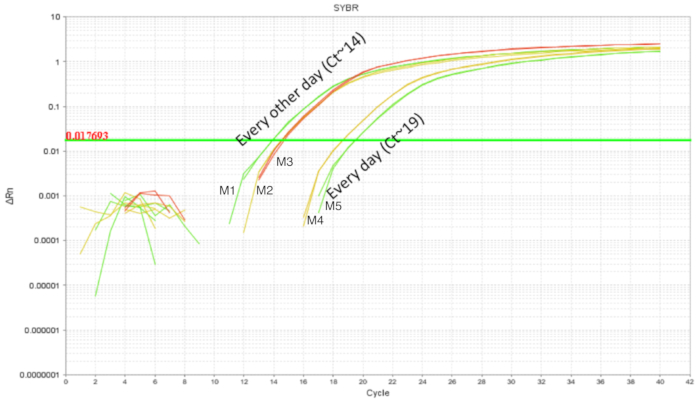
Şekil 3 . DOL 10 pups bağırsak DNA amplifikasyon LP tedavi DOL 2 ve DOL 8 arasında zamanlanmış gavages her gün (7 doz) ve her geçen gün (4 doz). Gavaging her gün her gün gavaging ile karşılaştırıldığında daha yüksek bağırsak LP gösterdi. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
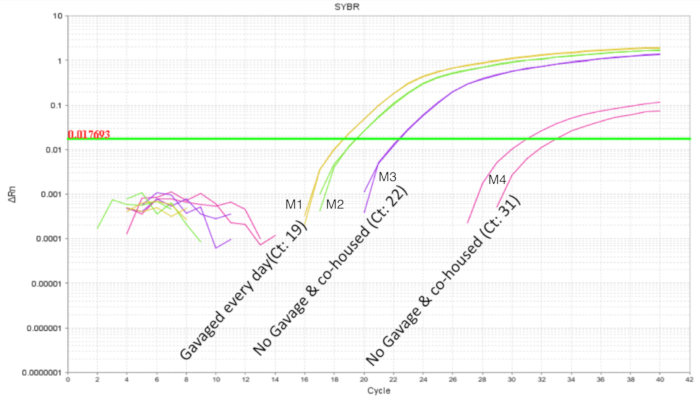
Şekil 4 . DOL 10 yavru 2 tedavi ve 2 ile gelen bağırsak DNA amplifikasyon LP 4 yavru bir çöp içinde tedavi edilmezse. Sonda ile besleme DOL 2 ve DOL 8 arasında zamanlanmış gavages her gün (7 doz) oldu. İki probiyotik pups Haritayı beklenen amplifikasyon profil tedavi. Tedavi edilmemiş pups probiyotik organizma bir çöp içinde ortak paylaşımını gösteren değişken LP amplifikasyon göster. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
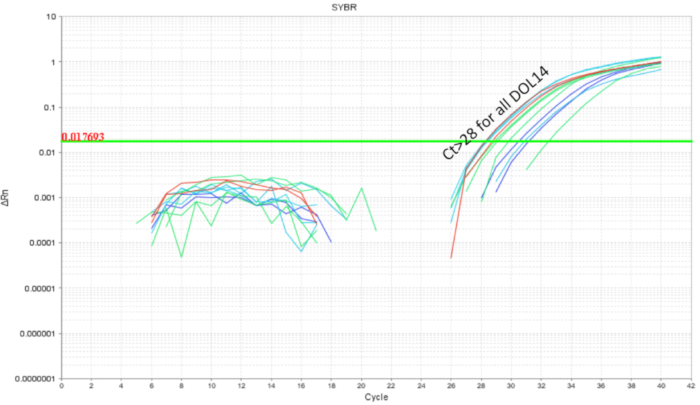
Şekil 5 . DOL 14 pups bağırsak DNA amplifikasyon LP tedavi DOL 2 ve DOL 8 arasında zamanlanmış gavages her gün (7 doz) ve her geçen gün (4 doz). LP yük damla LP döngüsü 28 gösteren izni 6 gün boyunca aşağıda son probiyotik sonda ile besleme sonrası. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| Adım | Sıcaklık | Zaman |
| 1 | 50 ° C | 2 dakika |
| 2 | 95 ° C | 3 dakika |
| 3 | 95 ° C | 30 saniye |
| 4 | 58 ° C | 30 saniye |
| 5 | 72 ° C | 30 saniye |
Tablo 1. qPCR amplifikasyon koşullar. Sıcaklık ve PCR reaksiyon için döngüsü koşulları sayısı.
| Hedef | 16s-23S intergenic spacer bölge |
| Beklenen parça boyutu | 144 bp |
| Astar Tm | 58˚C |
| İleri astar (FP) | LPN-1: TGG ATC ACC TCC TTT CTA AGG AAT |
| Ters astar (RP) | LPN-2: TGT TCT CGG TTT kedi TAT GAA AAA ATA |
Tablo 2. QPCR reaksiyon bileşenlerinin ayrıntılarını. Astarlar, onların tavlama sıcaklığı ve beklenen parça boyutu PCR reaksiyon ayrıntılar.
| Konsantrasyon | 10 µL tepki | 20 µL tepki | |
| Şablon DNA | 200 pg/µL | 1 ΜL | 1 ΜL |
| SYBR Master Mix | - | 5 ΜL | 10 ΜL |
| FP | 10 ΜM | 0.3 ΜL | 0.6 ΜL |
| RP | 10 ΜM | 0.3 ΜL | 0.6 ΜL |
| dH2O | - | 3.4 ΜL | 8,8 ΜL |
Tablo 3. Her reaksiyon birimleri ve konsantrasyonları. Reaktifler ve birimler reaksiyonlar için konsantrasyon.
Tartışmalar
IE sonda ile besleme yordamı bir probiyotik belirli bir doz yenidoğan fareler için güvenli bir şekilde yönetmek için geliştirilmiştir. Az miktarda sıvı besleme iğne aspirasyon dozajı teslimini güven sağlanması sırasında önlemek için kullanarak üst gastrointestinal sistem teslim edilir. Fareler bağırsağından kolonizasyon analiz iki için toplanmıştır ve altı gün sonda ile besleme sonrası. Yordamı DNA ekstraksiyon için probiyotik gram-pozitif organizmanın yüksek verim sağlamak için güncellenmiştir. QPCR analiz DNA'ın iki gün sonrası son gösterdi sonda ile besleme nispeten daha yüksek kolonizasyon LP farelerde gavaged fare gavaged ile karşılaştırıldığında her iki günde DOL 2-8 arasında her gün ayıklanır. Orada was da LP miktarında azalma altı gün boyunca, fare bağırsağından geçici bir organizmada olmak Bu probiyotik gösterilen. Bu deneylerin sonuçlarını araştırma bu yaş grubunda yüksek titizlik ile koşullarını oluşturmak.
Probiyotikler yenidoğan farelerde uzun vadeli etkileri gözlemlemek için yenidoğan farelere DOL 2 verildi; benzer bir başlangıç saatini insan mahkemeye gelin. Oropharyngeal yenidoğan fareler besleme literatürde daha önce açıklanan ve aspirasyon riski nedeniyle iyi gelişmiş bir yutma mekaniği düşük olduğunda daha DOL 5-812,17 sonra yapılmıştır. Aspirasyon daha yüksek oranda pilot çalışma (veri gösterilmez) gözlendi gibi ancak, oropharyngeal besleme DOL 2 fareler için uygun değildir. Viskoz doğa probiyotik ve prebiyotik çözüm aspirasyon riski ekledi. IE gavaging yordamı uygulamak istediğiniz birimin üst gastrointestinal sistem doğrudan teslim DOL 2 farelerde aspirasyon riskini en aza indirgemek. Yordamı başarısını ilk probiyotik sonda ile besleme infüzyon gıda boyası kullanarak doğrulandı. Gıda boyası yavru köpek deri yoluyla görünür bir işaretçi görevi görür. Olumsuz bir etkisi gavaged fareler yiyecek renklendirici gözlendi ve büyük ölçekli deneyler başlamadan önce bu şekilde gavaging yordam doğrulamak için önerilir. Gasping refleks görülme sonrası sonda ile besleme hızlı çözüm, başarılı bir sonda ile besleme için ek gösterge olarak da kullanılabilir. Fare Isıtma battaniye var yerleştirilen bir kez sonrası sonda ile besleme, gasping refleks azalacak ve 20 saniye içinde nefes frekans artış gözlenir. 30 saniye daha uzun süre gasping refleks devamı başarısız bir sonda ile besleme gösterir. Başarılı sonda ile besleme beslenme iğne uygun ekleme üzerinde şu mide kalp sfinkter açılış yukarıda oturan ampul ile de bağlıdır. Bu xiphoid süreci ve burun ucu arasındaki Uzunluk ölçme iğne üzerinde işaretleme gitmez ki fare burun sonda ile besleme sırasında sağlayarak kolaylaştırılabilir. Bu fare için yaralanma olasılığını en aza indirir. Sonda ile besleme sıklığı deneysel sonuçlar üzerinde önemli bir etkisi olabilir. Sık sık gavaging-ebilmek da yaratmak belgili tanımlık pups ve belgili tanımlık kafes ve yuva sürekli pertürbasyon nedeniyle anne için daha fazla stres. En uygun sonda ile besleme gavages az sıktır ve zaman daha kısa bir süre içinde içinde belgili tanımlık sistem beklenen etkiyi kaybetmeden zamanlamadır. Emniyeti ve kısırlık yordam sonda ile besleme için iğne çamaşır ve ısıyla arasında kullanım tarafından sterilize gerekir. Bir fırçalayın ve iç su ısıyla gerekli olmadan kullanarak iğne herhangi bir kalan parçacıklar zorlama tarafından iğne ısıyla sırasında encrust ve gavaging yordam ile müdahale dış kullanarak üzerinde titizlikle yıkama.
Daha yüksek LP kolonizasyonu gavaged pups içinde gözlenen her gün pups gavaged her gün karşılaştırıldığında. Bu yavrular gavaged üzerinde azaltılmış stres nedeniyle her gün ve potansiyel olarak daha fazla besin yoluyla bu pups tarafından yutulur nispeten daha fazla süt elde probiyotik olabilir. Doz bağımlılık probiyotik tedavi daha önce fare modelleri18,19 ' okudu ve böylece doğru dozaj önemli bir ilçedir. Hazırlanan probiyotik çözüm doğru bir yönetilen CFU sayısını almak için her sonda ile besleme önce kaplama. Probiyotik organizma anaerobik ise, ne zaman tükenmesiyle veya anaerobik kültürlü CFU fark olup olmadığını görmek önemlidir. LP fakültatif anaerobe olduğu için her iki yöntem kullanarak kültürlü ve CFU hiçbir fark gözlendi.
Sonrası sonda ile besleme bağırsak LP yük analizi yapıldı qPCR ve yüksek kaliteli DNA örnekleri kullanarak. LP DNA kirlenme tedavi ve kontrol grubu arasında en aza indirmek için farklı iğneler, besleme Biyogüvenlik kabinleri ve cerrahî donanımlar en yüksek kaliteli örnekleri sağlamak için kullanılmıştır. Bağırsakta probiyotik doğru ölçüm en iyi duruma getirilmiş bir DNA ekstraksiyon yöntemi gerekli. Dışkı DNA'ın çıkarılması için en verimli yöntem birden çok boncuk adımları20,21,22yenerek içerir. Bu yöntem bağırsak bakterileri boncuk atan kullanarak çıkarma için kabul ve azalmış temsil gözlenen (< kurtarılan 102 kopya) bütün bağırsak DNA ekstraksiyon plağın. LP bir Gram pozitif organizma peptidoglikan hücre duvarındaki önemli bir miktar ile olduğu gibi protokol peptidoglikan dağılması adımla lizozim23,24 enzimatik lizis arabelleğe eklendi kullanarak optimize edildi. Bu LP temsilciliği aynı bağırsak örnek iki kat daha büyük artış. Adım atan boncuk organizmanın lizis kolaylaştırır süre lizozim tedavi dış tabaka dağılması sağlar. Doku miktarını duruma getirilmesi, türü garnet boncuk ve boncuk kullanarak bozulma süresi PCR analizi yapmak için en uygun DNA ürünler elde etmek için gereklidir.
Profilaksi veya tedavi öncesi terim ve terim ventilasyon olarak yönetilen Probiyotikler olumlu etkisini son çalışmalar25,26,27,28içinde olduğunu göstermiştir. Probiyotikler için uygun yenidoğan fare modeli kurulması Probiyotikler koruyucu etkisi açmak için garanti kapsamındadır. Burada özetlenen bu protokolü yabancı araştırmacılar için bir rehber ile yenidoğan mouse iş Probiyotikler kullanarak temsil eder. İnsan sağlığı ve Hastalıkları Eğitim sırasında kemirgen microbiota sorunları rağmen bu yöntem microbiome Probiyotikler nedeniyle değişiklikleri anlamayla ilgili odaklı araştırma için genişletilebilir. Bu model ayrıca host-mikrop etkileşim ve bağışıklık yanıtı farklı gelişim dönemleri boyunca çalışmaya bir platform sağlar.
Açıklamalar
İfşa etmek hiçbir çatışma.
Teşekkürler
Hayvan bakım tesisi personeli sayesinde ve BC Çocuk Hastanesi Araştırma Enstitüsü Eğitim ve fare yardımcı olmak için UBC veterinerler iş. British Columbia Üniversitesi ve bölümü deneysel çalışma finansmanı için Tıp Fakültesi sayesinde.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL tuberculin syringe with slip tip | BD | 309659 | |
| 1.2% Triton X-100 | Millipore-Sigma | X100-100ML | |
| 2 mM sodium EDTA | Thermo Fisher Scientific | 15575020 | |
| 20 mM Tris·Cl | Thermo Fisher Scientific | 15568025 | |
| 5% dextrose and 0.9% NaCl injection solution | Baxter Corp. | JB1064 | |
| Alphaimager | Alpha Innotech | N/A | Gel imaging system |
| Anaerobic jar | Millipore-Sigma | 28029-1EA-F | 2.5 L |
| BD GasPak EZ anaerobe container system sachets | BD | 260678 | |
| BD Difco Lactobacilli MRS Broth | BD | 288130 | |
| Disruptor Genie | Scientific Industries Inc. | SI-D236 | |
| Feeding/oral gavage needles for newborn mice and rats | Cadence Science Inc. | 01-290-1 | 24 Gauge, 1” needle length, 1.25 mm ball diameter |
| Fructooligosaccharides | Millipore-Sigma | F8052 | from chicory |
| Garnet bead tubes 0.70 mm | Qiagen | 13123-50 | |
| iTaq Universal SYBR Green Supermix | BioRad | 172-5120 | |
| Lactobacillus plantarum (Orla-Jensen) Bergey et al. | ATCC | BAA-793 | for qPCR standard curve |
| Lyophilized probiotic bacteria | N/A | N/A | |
| Lysozyme | Thermo Fisher Scientific | 89833 | |
| Maltodextrin | Millipore-Sigma | 419672 | dextrose equivalent 4.0-7.0 |
| Mini-Sub Cell GT Cell | BioRad | 1704406 | Gel chamber |
| Nanodrop 1000 | Thermo Fisher Scientific | N/A | |
| QIAamp Blood and Tissue kit | Qiagen | 51504 | |
| StepOnePlus Real-Time PCR System | Thermo Fisher Scientific | 4376600 | |
| UltraPure Agarose | Invitrogen | 16500-500 | |
| Ultrapure dH2O | Invitrogen | 10977023 |
Referanslar
- Reid, G. Probiotics and prebiotics – Progress and challenges. International Dairy Journal. 18 (10-11), 969-975 (2008).
- Lin, H. C., et al. Oral probiotics reduce the incidence and severity of necrotizing enterocolitis in very low birth weight infants. Pediatrics. 115 (1), 1-4 (2005).
- Panigrahi, P., et al. A randomized synbiotic trial to prevent sepsis among infants in rural India. Nature. 548 (7668), 407-412 (2017).
- Amenyogbe, N., Kollmann, T. R., Ben-Othman, R. Early-Life Host–Microbiome Interphase: The Key Frontier for Immune Development. Frontiers in Pediatrics. 5, 111 (2017).
- Ofek Shlomai, N., Deshpande, G., Rao, S., Patole, S. Probiotics for Preterm Neonates: What Will It Take to Change Clinical Practice?. Neonatology. 105 (1), 64-70 (2014).
- Elazab, N., et al. Probiotic administration in early life, atopy, and asthma: a meta-analysis of clinical trials. Pediatrics. 132 (3), e666-e676 (2013).
- Arrieta, M. C., et al. Early infancy microbial and metabolic alterations affect risk of childhood asthma. Science Translational Medicine. 7 (307), 307ra152 (2015).
- Arrieta, M. C., Walter, J., Finlay, B. B. Human Microbiota-Associated Mice: A Model with Challenges. Cell Host and Microbe. 19 (5), 575-578 (2016).
- Qi, F., et al. Combined effect of BCG vaccination and enriched environment promote neurogenesis and spatial cognition via a shift in meningeal macrophage M2 polarization. Journal of Neuroinflammation. 14 (1), 32 (2017).
- Yang, J., et al. Neonatal BCG vaccination of mice improves neurogenesis and behavior in early life. Brain Research Bulletin. 120, 25-33 (2016).
- Deshmukh, H. S., et al. The microbiota regulates neutrophil homeostasis and host resistance to Escherichia coli K1 sepsis in neonatal mice. Nature Medicine. 20 (5), 524-530 (2014).
- Butchbach, M. E. R., Edwards, J. D., Schussler, K. R., Burghes, A. H. M. A novel method for oral delivery of drug compounds to the neonatal SMNDelta7 mouse model of spinal muscular atrophy. Journal of Neuroscience Methods. 161 (2), 285-290 (2007).
- Hickey, L., Garland, S. M., Jacobs, S. E., O’Donnell, C. P. F., Tabrizi, S. N. Cross-colonization of infants with probiotic organisms in a neonatal unit. Journal of Hospital Infection. 88 (4), 226-229 (2014).
- Costeloe, K., et al. A randomised controlled trial of the probiotic Bifidobacterium breve BBG-001 in preterm babies to prevent sepsis, necrotising enterocolitis and death: the Probiotics in Preterm infantS (PiPS) trial. Health Technology Assessment. 20 (66), 1-94 (2016).
- Kitajima, H., et al. Early administration of Bifidobacterium breve to preterm infants: randomised controlled trial. Archives of Disease In Childhood. Fetal and Neonatal Edition. 76 (2), F101-F107 (1997).
- Millar, M. R., Bacon, C., Smith, S. L., Walker, V., Hall, M. A. Enteral feeding of premature infants with Lactobacillus GG. Archives of Disease In Childhood. 69 ((5 Spec No)), 483-487 (1993).
- Preidis, G. A., et al. Probiotics stimulate enterocyte migration and microbial diversity in the neonatal mouse intestine. The FASEB Journal. 26 (5), 1960-1969 (2012).
- Kirjavainen, P. V., El-Nezami, H. S., Salminen, S. J., Ahokas, J. T., Wright, P. F. A. The effect of orally administered viable probiotic and dairy lactobacilli on mouse lymphocyte proliferation. FEMS Immunology & Medical Microbiology. 26 (2), 131-135 (1999).
- Gill, H. S., Rutherfurd, K. J. Viability and dose–response studies on the effects of the immunoenhancing lactic acid bacterium Lactobacillus rhamnosus in mice. British Journal of Nutrition. 86 (2), 285-289 (2001).
- Yu, Z., Morrison, M. Improved extraction of PCR-quality community DNA from digesta and fecal samples. BioTechniques. 36 (5), 808-812 (2004).
- Holland, J. L., Louie, L., Simor, A. E., Louie, M. PCR detection of Escherichia coli O157:H7 directly from stools: evaluation of commercial extraction methods for purifying fecal DNA. Journal of Clinical Microbiology. 38 (11), 4108-4113 (2000).
- Müller, A., et al. A powerful DNA extraction method and PCR for detection of microsporidia in clinical stool specimens. Clinical and Diagnostic Laboratory Immunology. 6 (2), 243-246 (1999).
- Pitcher, D. G., Saunders, N. A., Owen, R. J. Rapid extraction of bacterial genomic DNA with guanidium thiocyanate. Letters in Applied Microbiology. 8 (4), 151-156 (1989).
- Bollet, C., Gevaudan, M. J., de Lamballerie, X., Zandotti, C., de Micco, P. A simple method for the isolation of chromosomal DNA from gram positive or acid-fast bacteria. Nucleic Acids Research. 19 (8), 1955 (1991).
- Thomas, C. M., Versalovic, J. Probiotics-host communication. Gut Microbes. 1 (3), 148-163 (2010).
- Tancredi, D. J. Probiotic prevents infections in newborns. Nature. 548 (7668), 404-405 (2017).
- Bernardo, W. M., et al. Effectiveness of Probiotics in the Prophylaxis of Necrotizing Enterocolitis in Preterm Neonates: A Systematic Review and Meta-analysis. Jornal de Pediatria. 89 (1), 18-24 (2013).
- Aceti, A., et al. Probiotics for prevention of necrotizing enterocolitis in preterm infants: systematic review and meta-analysis. Italian Journal of Pediatrics. 41 (1), 89 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır