Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Woodboring Böceği uzantıları için Tarama ve İletim Elektron Mikroskobu Örnek Hazırlama Yöntemi
Bu Makalede
Özet
Çalışmada böcek sensillasının ultrayapısını gözlemlemek amacıyla tarama ve iletim elektron mikroskobu (sırasıyla SEM ve TEM) örnek hazırlama protokolü sunulmuştur. SEM.Floresan mikroskopide örnek deformasyonu önlemek için fiksatife ara 20 eklenmiştir.
Özet
Bu rapor, elektron mikroskobu gözlemlerinin her iki tip elektron mikroskobu için de chlorophorus caragana Xie & Wang (2012) adlı ekinin hazırlanmasıyla ortaya çıkan tarama ve iletim elektron mikroskobu gözlemlerini tanımlamıştır. Taramalı elektron mikroskobu (SEM) numune hazırlama protokolü örnek kimyasal fiksasyon, bir dizi etanol banyosunda dehidratasyon, kurutma ve püskürtme kaplamaya dayanıyordu. Fiksatif ve yıkama çözeltisine Tween 20 (Polioksietilen sorbitan laurate) eklenerek, odun böceğinin böcek gövde yüzeyi SEM'de daha temiz bir şekilde yıkandı. Bu çalışmanın iletim elektron mikroskobu (TEM) örneklem hazırlama, fiksasyon, etanol dehidratasyonu, reçine gömme, floresan mikroskopi ile konumlandırma, kesit ve boyama gibi bir dizi adımı içeriyordu. Tween ile Fixative 20 woodboring böceğiböcek vücut duvarı daha kolay Tween 20 olmadan olurdu daha nüfuz sağladı, ve daha sonra daha iyi vücutta ki doku ve organları sabit, böylece böcek sensilla ultrastructures net iletim elektron mikroskop gözlemler ilerlemiş. Bu hazırlık bir sonraki adım hedef sensilla konumlandırma hassasiyetini artırmak için floresan mikroskopisi kullanarak reçine blok gömülü örnekböcek sensilla konumlarını belirlemek oldu. Bu gelişmiş dilimleme doğruluğu.
Giriş
Taramalı elektron mikroskobu birçok morfoloji çalışmalarında önemli bir araçtır, SEM yüzey yapıları gösterir1,2. İletim elektron mikroskobu'nun cazibesi, hücre mimarisinden organellerin ultrayapısına, makromoleküler komplekslerin ve proteinlerin yapısına kadar nanometre ölçeğinde çok çeşitli biyolojik yapıları incelemek için kullanılabilmedir. TEM iç yapılarıgösterir 3,4,5.
Coleoptera yaklaşık 182 aile ve 350.000 tür de dahil olmak üzere böceklerin en büyük grubudur. Coleopteran böceklerin çoğu, özellikle odun böceği, bitkilerle beslenirler, bunların çoğu ormanların ve meyve ağaçlarının önemli zararlılarıdır,ağaçlarayıkıcı zarar lar ve 6. Şu anda, kimyasal ekoloji teorisine dayalı zararlıların önleme ve kontrol popülasyonu artan ilgi almış7. Verimli, düşük toksik, kirlilik içermeyen feromon kontrol yöntemleri etkili bir yol haline gelmiştir8. Böceklerin sensilla morfolojisi ve ultrayapı incelenmesi böcek kimyasal ekolojisi araştırmalarının önemli bir parçasıdır. Tarama ve iletim elektron mikroskobu (SEM ve TEM, sırasıyla) morfolojisi ve iç anatomisi çalışmada büyük etkisi için kullanılır. Ancak, elektron mikroskobu (EM) için böcek örneklerinin hazırlanması sırasında, gözlem alanının nesnelliği ve orijinalliği etkilenebilir9. Genel olarak, böceklerin SEM örnek hazırlanması temizlik, doku fiksasyonu, dehidratasyon, metatez, kurutma ve püskürtme kaplamagerektirir 10. Hangi woodboring böceği canlı karmaşık ortam nedeniyle, vücut yüzeyi genellikle çeşitli kirleticiler ve uzantıları genellikle çok ince uzun sensilla veya kıllar var. Özellikle, bazı woodborers doğrudan alanında toplanan laboratuvar yetiştirme, mevcut değildir ve daha sonra tazelik sağlamak için sıvı sabitleme koymak ve daha sonra laboratuvarda yıkanır. Eğer numune önce sabitlenir ve yıkanırsa, glutaraldehit numuneye güçlü bir şekilde sabitlediği için enkazı çıkarmak çok daha zordur. Tween 20 bir yüzey aktif madde11,12,13,14, hangi yıkama işleminde önemli bir rol oynar, su yüzey gerilimini azaltmak ve çamaşır yüzeyinde su ıslaklığını artırmak da dahil olmak üzere. Bu çalışmada, Sıvının yüzey gerilimini azaltmak ve kirin, vücut yüzeyini SEM'de temiz yapan odun böceğinin vücut yüzeyine birikmesini önlemek için sabitleme solüsyonuna ve PBS temizleme solüsyonuna Tween 20 eklenmiştir.
TEM kullanılarak, böceklerin farklı organları üzerinde sensilla içlerindeki açık yapıları ortaya çıkarmak için dilimlenebilir, böylece sensilla fonksiyonları analiz için bir temel sağlar. Ne zaman konu böcek, woodboring böceği gibi, büyük, ve vücut duvarı sclerotization önemli bir derecesine sahip, bu nedenle fiksatif tam böcek vücut içinde organ dokuları doygunluk olmayabilir. Tween 20 kirin dağılım ve süspansiyon kapasitesini artırabilir. Bu çalışmada, Tween 20 fiksatif woodboring böceğiböcek vücut duvarına fiksatif sıvı penetrasyon geliştirmek için eklendi, epidermi deformasyon ve çöküşü kaçınarak11,12,13. Buna ek olarak, genel dilimleme teknolojisini kullanarak, doğru sensilla farklı bulmak zordur, bazı küçük sensilla için özellikle15. Geleneksel TEM numune hazırlamasına dayanan bu çalışma, gömülü bloktaki böcek sensillasının konumunu belirlemek için floresan mikroskopi ve SEM'i birleştirerek dilimleme doğruluğunu artırabilmektedir.
Protokol
DİkKAT: Reaktiflerin malzeme güvenlik veri sayfalarını kullanmadan önce danışın. Numune hazırlama sırasında kullanılan kimyasalların bir çoğu toksik, mutajenik, kanserojen ve/veya reprotoksiktir. Kişisel koruyucu ekipman (eldiven, laboratuvar önlüğü, tam uzunlukta pantolon ve kapalı ayak ayakkabıları) kullanın ve numuneyi kullanırken duman kaputunun altında çalışın.
1. SEM Örnek Hazırlama ve Görüntüleme
- Örnek Fiksasyon ve Temizlik
- C. caragana meydana gelen bir alanda çalışma, isophorone16gibi bitki çekiciler ile yemli alan tuzakları içine yetişkinler çekmek. Yetişkin C. caragana temiz organları korumak 0.1 mol L-1 fosfat-tamponlu salin (PBS, pH 7.2), 2.5% (wt / vol) glutaraldehit (Anhidroz EM Grad), ve 0.06% (vol / vol) Tween 20. Hafta sonu 4 °C'de numuneyi sabitle.
- Koruma sıvı sından organları çıkarın ve fosfat tampon durular. Stereomikroskop kullanarak, uzantıları kaldırın ve ultrasonik (40 kHz) 0,1 mol L-1 fosfat tamponlu salin (pH 7,2) ile temiz 0.06% (vol/ vol) Tween 20 (PBST). 100 s temizledikten sonra, temiz olup olmadığını kontrol etmek için mikroskopa örnek aktarın. Normal şartlar altında, numunenin gözlemlemek için yeterince temiz olduğundan ve zarar görmediğinden emin olmak için 400'ler için temiz.
- Örnek Dehidratasyon, Montaj ve Kurutma
- %50, %60, %70, %80, %85, %90, %95, %100 ve %100 (tüm vol/vol) etanolte 20 dk ardışık tedaviler kullanarak numuneleri dehydrate. Stereomikroskop altında, saplamaüzerine 3 gözlem yüzeyini (dorsal ventral ve lateral) ayrı ayrı sabitlemek için karbon çift taraflı yapışkan bant kullanın. Tüm görüntüleme yüzeylerinin temiz ve kontaminasyondan arındırılmış tutulması gerektiğini unutmayın. Örnek sahnesini 48 saat boyunca silika jel kurutucu içeren bir petri kabına yerleştirin.
- Sputter-coat ve Örnek Ekleme
- Hitachi Koki (E-1010) iyon püskürtme aleti kullanarak ANA VALM'i OPEN konumuna döndürün, numune haznesinin kapağını çıkarın ve numuneyi odaya koyun. POWER düğmesini açın ve READY ışığı yanıyordu. Püskürtme süresini 45 saniye, kaplama kalınlığını 70.875 Å olarak ayarlayın. Mekanik pompa vakum kadran indeksi 7'nin altına düştükten sonra DISCHARGE tuşuna basın ve platin püskürtmeye başlayın. Deneyin sonunda, güç kaynağını kapatın ve numuneyi odasından alın. Püskürtme filmi kalınlığı: d = KIVt ("d" " Å "; " ünitesinde filmin kalınlığıdır. K" püskürtülen metal ve gaza bağlı olarak sabittir. Örneğin, K hava0,07; "I" plazma akışının birim mA'si; "V", "KV" ünitesinde uygulanan gerilimdir. "t" saniye cinsinden zaman.
- Örneği içeren saplamayı SEM aşamasına takın. Örnek saplama ile örnek aşamasında iyi bir görüntü sağlamak için yeterli yüksekliğe sahip olduğundan emin olun. SEM yazılımını açın ve 20 kV'dan başlayan istediğiniz çalışma gerilimini seçin.
2. TEM Numune Hazırlama ve Görüntüleme
- 1.1.1 ve 1.1.2 adımlarında olduğu gibi örneği alın ve düzeltin.
- Temizlik, İkincil Fiksasyon ve Dehidratasyon
- Yetişkin C. caragana'yı koruma sıvısından çıkarın. Stereomikroskop kullanarak uzantıları çıkarın, pbst'deki numuneleri 3 saat boyunca yıkayın ve pbs'de %1 (wt/vol) osmiyum tetroksit ile 25 °C'de 1 saat sonra düzeltin. %50, %60, %70, %80, %85, %90, %95, %100 ve %100 (tüm vol/vol) etanolte oda sıcaklığında 20 dk ardışık tedaviler kullanarak numuneleri dehydrate.
- Reçine Katıştırma ve Polimerizasyon
- Örnekleri düz bir katıştırma kalıplarına rezene gömün. Örnek plakanın alt kısmında ydı ve gömme oluğun kenarına mümkün olduğunca yakın bir yere yerleştirildi. Etiketi boş ave yerleştirin ve numuneyi içeren plakayı 72 saat boyunca 60 °C'ye yerleştirin. Kapsülü kuvözden çıkarın ve resenin polimerize olduğunu doğrulayın.
- Örnek Kesit ve Boyama
- Numunenin katılaştırıldığından emin olduktan sonra, her reçine bloğu floresan mikroskobun altına yerleştirin ve mavi ışık altında fotoğraflayın. Mikroskobun floresan ışık kaynağını hareket ettirin ki numuneyi yukarıdan ışınlayabilsin. Resin bloğundaki sensillanın net bir şekilde gözlemlemesini sağlar. Fotoğraflandı ve sensilla hedef mesafeleri ölçmek (Şekil 1).
- Palps SEM görüntü bakın (Şekil 2A), ve hedef reseptörü kapatmak için bir jilet ile kabaca rezorb bloğu kesilmiş (Şekil 2B).
- Daha sonra, mavi ışık floresan mikroskopisi kullanarak, kabaca kesilmiş reçin bloğunun fotoğrafını çekerek, ışık kaynağını yukarıdan ayarlayarak, sensillanın net bir şekilde gözlemlendiğini görebilmeniz için. Mavi ışıkla heyecanlanan yeşil ışık olumlu bir gözlem oluşturdu. Görüntüleme yapılırken, floresan mikroskobu aşamasına objektif mikrometre (DIV 0.01mm) eklendi ve daha sonra hedefin mesafesi ImageJ yazılımı (ABD Ulusal Sağlık Enstitüsü) ile ölçüldü (Şekil 2C). Görüntü cetveli Adobe Photoshop CS5 (Adobe Systems, Inc., San Jose, CA, USA) tarafından yapılmıştır. Daha sonra, ultramikrotom dilimleme için, hedef konuma ulaşılAna kadar, 50-60 nm dilim kalınlıkları kullanarak kesme mesafesi ayarlayın. Hedef reseptörü saptamak için floresan mikroskobu kullanın.
- Formvar kaplı, 100 örgülü bakır ızgaralar, uranyl asetat ve kurşun sitrat ile çift boyanmış bölümleri monte.
- İlk olarak, % 50 metanol 50 mL 3.75 g uranyl asetat ekleyin. 10 dk. Oda sıcaklığında uranyal asetat doymuş çözeltisi filtrelenmiş (0,45 μm) şırınga ile leke ızgaraları. Durulama 2x 50% metanol; 2x filtrelenmiş gazdan arındırılmış su.
- İkinci olarak, santrifüj tüp içinde gazdan arındırılmış distile su 10 mL 0.02 g kurşun sitrat ekleyin. 10 N sodyum hidroksit 0,1 mL ekleyin, mühür ve eritmek için sallayın. Kullanmadan önce 8 dk. Santrifüj için kurşun sitrat çözeltisi ile leke ızgaraları. Kurşun karbonat çökeltilerinin oluşmasını önlemek için karbondioksitsiz bir ortamda boyama yapılmalıdır. Plastik petri kapları kareler üzerine leke damlaları yerleştirin. Gazdan arındırılmış filtrelenmiş suda durulayın ve kuru17. 80 kV'da çalışan TEM üzerinden gözlemleyin.
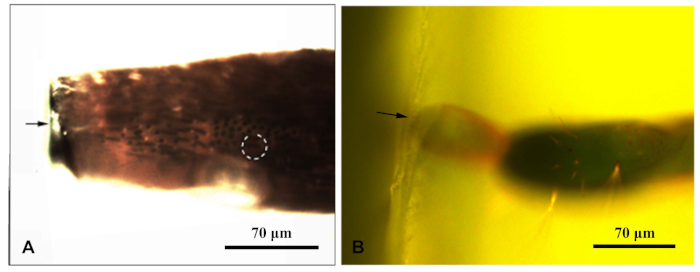
Şekil 1: Bir floresan mikroskop Klorofor karaganaek çevreleyen bir rezors blok fotoğrafladı. (A) Anten reşin bloğu; (B) Ovipozitörün ucundaki reçin bloğu. Ok reşin bloğunun kenarını gösteriyordu; noktalı daire hedef sensilla gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
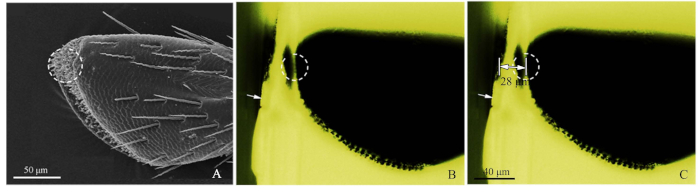
Şekil 2: Hassas sensilla konum yönteminin prosedürleri. (A) Kloroforkaramakbir maksiller palp 4 alt segmenti , noktalı daire SEM tarafından hedeflenen sensilla gösterdi. (B) C. caragana bir maksiller palp 4 alt segmentfloresanmikroskop mikroskopisi tarafından görüntülenen. Beyaz ok, reşin bloğunun kabaca kesilmiş kenarını, noktalı daire ise doğru konumu gösterdi. (C) Rezorin bloğunun kenarından maksiller palp hedef konumuna (bu örnekte 28 m) işaretli uzaklık. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Tween 20 ile temizlik ve fiksatif çözelti kullanılarak, Daha temiz SEM görüntü Tween 20 olmadan gözlenmiştir(Şekil 3). Tween 20 sabitleme çözeltisi dokuiçine glutaraldehit sabitleme çözeltisi nüfuz etti. Mikrotübül yapısı açıkça görüldü. Örneğin iç yapısının TEM görüntüsü Tween 20 olmadan bulanıklaşmıştır (Şekil 4).
Tartışmalar
Bu makalede, odunböceği için tarama ve iletim elektron mikroskobu için bir numune hazırlama şeması sunulmuştur. Böcek ekini temsili bir çalışma konusu olarak kullanarak, geleneksel numune hazırlama yöntemlerine göre çeşitli iyileştirmeler gösterdik.
Katı yüzeyden ayrılan sıvı yağ, nesnenin yüzeyinde yeniden depolamayı azaltmak için yıkama ortamına iyi dağılabilen ve askıya alınabilen küçük damlacıklara emülsifiye edilir. Yüzey aktif madde yıkama perform...
Açıklamalar
Açıklayacak bir çıkar çatışmamız yok.
Teşekkürler
Pekin Tarım Meslek Yüksekokulu, Atom Enerjisi Uygulama Enstitüsü (Çin Tarım Bilimleri Akademisi), Pekin OrmanCılık Üniversitesi Biyoaraştırma Merkezi ve Profesör Shan-gan'ın cömert yardımlarını takdir ediyoruz. Zooloji Enstitüsü'nden Zhang, Çin Bilimler Akademisi. Bu araştırma, Çin Ulusal Temel Ar-Ge Programı (2017YFD0600103), Çin Ulusal Doğa Bilimleri Vakfı (Grant No. 31570643, 81774015), Çin Kamu Refahı Orman Bilimsel Araştırması (201504304), İç Moğolistan tarafından desteklenmiştir. Tarım Üniversitesi Yüksek Seviyeli Yetenek Araştırma Başlangıç Planı (203206038) ve İç Moğolistan Özerk Bölgesi Yüksek Öğretim Araştırma Projesi (NJZZ18047), İç Moğolistan Özerk Bölgesi Linxue "Çift Birinci Sınıf" İnşaat Projesi (170001).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Anatomical lens | Chongqing Auto Optical limited liability company | 1425277 | |
| Carbon adhesive tape | SPI Supplies, Division of Structure Probes, Inc. | 7311 | |
| Carbon tetrachloride | Sigma | 56-23-5 | |
| Copper grids | GilderGrids | G300 | |
| Disodium hydrogen phosphate | Sinopharm group chemical reagent co., LTD | 10039-32-4 | |
| Ethanol | J.T. Baker | 64-17-5 | |
| Flat embedding molds | Hyde Venture (Beijing) Biotechnology Co., Ltd. | 70900 | |
| Fluorescence microscope | LEICA | DM2500 | |
| Glutaraldehyde | Sigma-Aldrich | 111-30-8 | Anhydrous EM Grade |
| Isophorone | Sigma | 78-59-1 | |
| Lead citrate | Sigma | 512-26-5 | |
| Methanol | Sigma | 67-56-1 | |
| Monobasic sodium phosphate | Its group chemical reagent co., LTD | 7558-80-7 | |
| Objective micrometer | Olympus | 0-001-034 | |
| Osmium tetroxide | Sigma | 541-09-3 | |
| Petri dish | Aldrich | 1998 | |
| Razor blade | Gillette | ||
| Resin | Spurr | ERL4221 | |
| Scalpel | Lianhui | GB/T19001-2008 | |
| SEM | Hitachi | S-3400 | |
| Silica gel desiccant | Suzhou Longhui Desiccant Co., Ltd. | 112926-00-8 | |
| Small brush | Martol | G1220 | |
| Sodium hydroxide | Sigma | 1310-73-2 | |
| Sputter ion instrument | Hitachi Koki Co. Ltd., Tokyo, Japan | E-1010 | |
| Stereo microscope | Leica | EZ4 HD | |
| TEM | Hitachi | H-7500 | |
| Tween 20 | Tianjin Damao Chemical Reagent | 9005-64-5 | |
| Ultramicrotome | Leica | UC6 | |
| Ultrasonic cleaner | GT Sonic | GT-X1 | |
| Uranyl acetate | Sigma | 6159-44-0 |
Referanslar
- Song, Y. Q., Dong, J. F., Sun, H. Z. Scanning Electron Microscope Technology of Insect Material. Hubei Agricultural Sciences. 52, 1064-1065 (2013).
- Liu, C. The development of the scanning electron microscopy (sem) and its application in polymer materials research. Journal of the Graduates Sun Yat-Sen University (Natural Sciences Medicine). 34, 7-12 (2008).
- Gan, L., Jensen, G. J. Electron tomography of cells. Quarterly Reviews of Biophysics. 45, 27-56 (2011).
- Lucic, V., Rigort, A., Baumeister, W. Cryo-electron tomography: the challenge of doing structural biology in situ. The Journal of Cell Biology. 202, 407-419 (2013).
- Trepout, S., Bastin, P., Marco, S. Preparation and Observation of Thick Biological Samples by Scanning Transmission Electron Tomography. Journal of Visualized Experiments. (121), e55215 (2017).
- Zhang, X. J., Sun, W., Zhang, J., Zuo, T. T., Wang, Z. Q., Zhao, H. W. Research progress of coleopteran insect species antennal sensilla. Journal of Anhui Agricultural Sciences. 41, 2932-2935 (2013).
- Aldrich, J. R., Bartelt, R. J., Dickens, J. C., Knight, A. L., Light, D. M., Tumlinson, J. H. Insect chemical ecology research in the United States Department of Agriculture-Agricultural Research Service. Pest Management Science. 59, 777-787 (2003).
- Thomas, C. B., Marlin, E. R. Pheromone mating disruption: Novel, non-toxic control of the European corn borer. Leopold Center. 8, 57-60 (1999).
- Chen, X. F., Hu, M. Y. Studies on the specimen preparation techniques of scanning electron microscope of Ficus simplicissima Lour. Journal of Zhongkai Agrotechnical College. 14, 68-70 (2001).
- Zhou, W., Apkarian, R., Wang, Z. L., Joy, D. Fundamentals of Scanning Electron Microscopy (SEM). Scanning Microscopy for Nanotechnology. , 1-40 (2006).
- Kothekar, S. C., Ware, A. M., Waghmare, J. T., Momin, S. A. Comparative Analysis of the Properties of Tween-20, Tween-60, Tween-80, Arlacel-60, and Arlacel-80. Journal of Dispersion Science and Technology. 28, 477-484 (2007).
- Chai, J. L., Liu, N., Bai, T. T., Zhang, H. M., Liu, N. N., Wang, D. D. Compositions and Physicochemical Properties of Tween Type Surfactants-Based Microemulsions. Journal of Dispersion Science and Technology. 35, 441-447 (2014).
- Zhang, L. D., Zhao, L., Han, F., Xu, B. C. Performance and applications of surfactants (XV) Detergency of surfactants and its applications. China Surfactant Detergent and Cosmetics. 45, 132-137 (2015).
- Waghmare, P. R., Das, S., Mitra, S. K. Under-water superoleophobic glass: unexplored role of the surfactant-rich solvent. Scientific Reports. 3, 1-25 (2013).
- Zhang, Y. R., Ren, L. L., Luo, Y. Q. Microtomy of insect sensilla embedded in resin blocks for transmission electronic microscopy. Chinese Journal of Applied Entomology. 50, 1479-1483 (2013).
- Zong, S. X., Liu, X. H., Cao, C. J., Luo, Y. Q., Ren, L. L., Zhang, H. Development of semiochemical attractants for monitoring and controlling Chlorophorus caragana. Zeitschrift für Naturforschung. 68, 243-252 (2013).
- Sumner, M. J. Epoxy resins for light and transmission electron microscopy. Plant Microtechniques and Protocols. , 83-101 (2015).
- Schneider, D. Insect antennae. Annual Review of Entomology. 9, 103-122 (1964).
- Zacharuk, R. Antennae and sensilla. Comprehensive Insect Physiology, Biochemistry and Pharmacology. 6, 1-69 (1985).
- Zacharuk, R., Albert, P., Bellamy, F. Ultrastructure and function of digitiform sensilla on the labial palp of a larval elaterid (Coleoptera). Canadian Journal of Zoology. 55, 569-578 (1977).
- Shanbhag, S., Müller, B., Steinbrecht, R. Atlas of olfactory organs of Drosophila melanogaster: 1, Types, external organization, innervation and distribution of olfactory sensilla. International Journal of Insect Morphology and Embryology. 28, 377-397 (1999).
- Tarumingkeng, R. C., Coppel, H. C., Matsumura, F. Morphology and ultrastructure of the antennal chemoreceptors and mechanoreceptors of worker Coptotermes formosanus Shiraki. Cell Tissue Res. 173, 173-178 (1976).
- Zacharuk, R. Y. Ultrastructure and function of insect chemosensilla. Annual Review of Entomology. 25, 27-47 (1980).
- Li, Y. Z., Zhong, G. Q. Screening of detergents and floating carriers for treating potato golden nematode cysts to improve the original appearance of electron microscopy. Plant quarantine. 8, 72-75 (1994).
- Marzio, L. D., Marianecci, C., Petrone, M., Rinaldi, F., Carafa, M. Novel pH-sensitive non-ionic surfactant vesicles: comparison between tween 21 and tween 20. Colloids and Surfaces B: Biointerfaces. 82, 18-24 (2011).
- Ren, L. L., Wu, Y., Shi, J., Zhang, L., Luo, Y. Q. Antenna morphology and sensilla ultrastructure of Tetrigus lewisi Candèze (Coleoptera: Elateridae). Micron. 60, 29-38 (2014).
- Ren, L., Shi, J., Zhang, Y., Luo, Y. Antennal morphology and sensillar ultrastructure of Dastarcus helophoroides (Fairmaire) (Coleoptera: Bothrideridae). Micron. 43, 921-928 (2012).
- Teng, X. H., Liu, X. L., Xie, G. Y., Tang, Q. B., Li, W. Z., Zhao, X. C. Morphology and distribution of ovipositor sensilla of female Helicoverpa armigera (Lepidoptera: Noctuidae). The 11th Henan Plant Protection Society, the 10th Henan Insect Society, and the 5th Member Congress and Academic Symposium of Henan Plant Pathology Society. , 138-142 (2017).
- Yang, R., Zhang, L. N., Fan, J. W., Wang, J. L., Fang, K. F., Yu, T. Q., Wang, S. H., Du, Y. L. Insect specimens for scanning electron microscopy. Journal of Beijing University of Agriculture. 29, 33-36 (2014).
- Zhang, Y. R., Ren, L. L., Zhang, L., Wang, R., Yu, Y., Lu, P. F., Luo, Y. Q. Ultrastructure and distribution of sensilla on the maxillary and labial palps of Chlorophorus caragana (Coleoptera: Cerambycidae). Journal of Morphology. 279, 574-588 (2018).
- Harrison, J. D. G. Cleaning and preparing adult beetles (Coleoptera) for light and scanning electron microscopy. African Entomology. 20, 395-401 (2012).
- Xiao, Y., Liu, W., Wang, Y., Zuo, Y. X., Hu, R., Li, T. T., Cui, Z. B. Drying methods of biological sample preparation for scanning electron microscope. Research and Exploration Laboratory. 32, 46-53 (2013).
- Graef, M. D. . Introduction to Conventional Transmission Electron Microscopy. , 1 (2003).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır