Method Article
CRISPR/Cas9 ribonucleoprotein-boru Elektroporasyon tarafından aracılı hassas gen düzenleme
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada sunulan verimli CRISPR/Cas9 ribonucleoprotein aracılı gen düzenleme meme hücrelerinde tüp Elektroporasyon kullanarak bir protokoldür.
Özet
CRISPR ilişkili protein 9 (Cas9) tarafından temsil edilen gen düzenleme nükller, biyomedikal araştırmalarda ana araçlar haline gelmektedir. CRISPR/Cas9 öğelerinin transfeksiyon yoluyla hedef hücrelere başarılı bir şekilde teslimi, verimli gen düzenleme için bir önkoşuldur. Bu protokol, tüp Elektroporasyon (te) makine aracılık teslim Crispr/Cas9 ribonukleoprotein (RNP), tek-telli oligodeoxynucleotide (ssodn) bağışçı şablonları mammalin hücrelerin farklı türleri ile birlikte gösterir, sağlam yol açar kesin gen düzenleme olayları. İlk olarak, te, tavşan fibroblast hücrelerinde interlöşin 2 reseptör altbirim Gama (IL2RG) geni ve Sepiapterin Redüktaz (SPR) geni içinde hastalığa neden olan mutasyonları teşvik etmek için Crispr/Cas9 RNP ve ssodns sunmak için uygulandı. % 3.57%-20 ' si hassas mutasyon oranları, bakteriyel TA klonlama sıralaması ile belirlendiği şekilde elde edilmiştir. Aynı strateji daha sonra insan iPhone 'larda epidermal büyüme faktörü reseptörü (EGFR), miyosin bağlayıcı protein C, kardiyak (MYBPC3 genlerindeki mutasyonlar) ve hemoglobin altbirim Beta (HBB) dahil olmak üzere çeşitli klinik olarak ilgili genler üzerinde kullanılmıştır. Sürekli olarak, son derece hassas mutasyon oranları elde edildi (11.65%-37,92%) derin sıralamanın (DeepSeq) belirlediği şekilde. Bu çalışma, CRISPR/Cas9 RNP 'nin tüp electroporasyonu, memelinin hücrelerinde gen düzenlemesi için verimli bir transfeksiyon protokolünü temsil ettiğini göstermektedir.
Giriş
CRISPR/Cas9 gen düzenleme için en sık kullanılan programlanabilir çekirdektir. Tek Kılavuzlu RNA (sgRNA) ile çalışır-hem hedef sıralarının hem de genomdaki bitişik protospacer bitişik motif (PAM) dizisinin aracılı tanınması. Cas9 nükleaz, Pam dizisi1' in upstream üç nükleotid bulunan bir çift telli DNA Break (DSB) oluşturur. DSN 'Ler, hataya eğilimli olmayan Homologous uç birleştirme (NHEJ) veya Homoloji yönlendirilmiş onarım (HDR) yolları aracılığıyla onarılır. HDR yolu ile kesin gen düzenleme elde etmek için, donör şablonları genellikle plazmid DNA (pDNA) veya tek telli oligodeoxynucleotide (ssODN) biçiminde sağlanır.
Crispr/Cas9 ve sgrna üç formatta hücrelere teslim edilebilir: Cas9 protein ve Grna ribonukleoprotein (RNP) kompleksi2,3; Cas9 mRNA ve sgrna4,5; veya Plasmid DNA (pdna) gerekli Promoters içerir, Driven sgrna, ve Cas9 kodlama bölgesi6,7,8. Birçok grup, CRISPR/Cas9 RNP olarak teslim edildiğinde, gen düzenleme verimliliği genellikle pDNA veya mRNA formatlarında elde ettikleri, nüklik asitler9ile karşılaştırıldığında çok daha küçük RNP boyutuna atşabilir olduğunu göstermiştir. Ayrıca, daha önce bir roman tüp Elektroporasyon (te) makine özellikle birkaç hücre türleri gen düzenleme uygulamalarında etkili olduğunu gösterilmiştir9.
Mevcut çalışma sunulan bir adım-adım protokol çeşitli klinik olarak ilgili loci farklı türlerin memeliler hücrelere CRISPR/Cas9 RNP teslimi için TE kullanarak. Bu roman TE transfeksiyon tekniği ve yüksek HDR oranı fenomen Biyomedikal araştırma geniş uygulamalar bulabilirsiniz.
Protokol
Tüm hayvan bakım, bakım ve kullanım prosedürleri Michigan Üniversitesi Kurumsal hayvan bakımı ve kullanım Komitesi (ıAYUC) tarafından incelendi ve onaylanmıştır.
1. hücrelerin hazırlanması
-
Amerikan tür kültür koleksiyonu 'ndan (ATCC) insan IPhone 'ları (ACS-1030) edinin. Kültür IPhone 'ları, besleyici içermeyen hücre kültürü ortamına sahip yapay ekstrellüler matrisinde (bkz. malzeme tablosu) bir hücre kültürü kuluçkanında (5% CO2 at 37 °c) tedarikçinin talimatlarını izleyerek.
- transfeksiyondan 2 h önce, ıpscs 'yi 10 μM Rho ile ilişkili, helezon-Coil içeren protein kinaz (rock) inhibitörü Y27632 (kullanımı, disikülli insan hippilerinin apoptoz 'i azaltır onların pluripotency etkileyen).
- Transfeksiyon sırasında, 37 ° c 'de tek hücrelere 5 dakika boyunca hücre dekolmanı çözeltisi (bkz. malzeme tablosu) Ile ıpscs ayırmak. hücre numarasını say.
-
Daha önce10açıklandığı gibi, tavşan kulak cilt dokusu biyopsilerin birincil kültürü kullanarak bir tavşan fibroblast hücre kültürü kurmak.
- A 0,5 cm x 0,5 cm kulak cilt biyopsisi tavşan kulağı ucunda elde edilir. Kulak dokusunun saçlarını tıraş et.
- 5% penisilin-streptomisin ile Dulbecco fosfat-tamponlu tuz (DPBS) ile 2x durulayın. Kulak dokusunu yeni bir 6 cm doku kültürü yemine aktarın, sonra dokuyu küçük parçalara ayırın (~ 1,0 mm x 1,0 mm). Dokusunun kurumasını önlemek için birkaç damla fetal sığır serumu ekleyin.
- 10 cm doku kültürü çanak için rendelenmiş doku Spread, sonra kültür orta 10 mL ekleyin. Tavşan fibroblast hücreleri Dulbecco 'nun modifiye kartal Orta (DMEM)% 10 fetal sığır serumu ile kültürlü. Doku kültürü çanak hücre kültürü kuluçinatör koyun (5% CO2 at 37 °c).
- Kaplamandan üç ila beş gün sonra, 37 ° c 'de hücreleri sindirmek için Trypsin-EDTA kullanın 2 dakika. hücre numarasını say.
2. gRNAs ve bağış oligos tasarım ve sentezi
- Her gen için, online bir araç kullanarak hedeflenen Locus sırasına göre tasarım kılavuzu RNA (örneğin, < http://crispor.tefor.net/>).
- İlgi DNA dizisi yapıştırın.
- Bir genom ve protospacer bitişik motif (PAM) seçin. Giriş DNA dizileri olası kılavuz sıraları çıktı sayfasında görüntülenir. Daha yüksek öngörülen verimlilik ve düşük hedef potansiyelleri ile gRNA seçmek için tavsiye edilir.
- GRNAs transkripsiyonu için ticari bir satıcı tarafından DNA sentezlemek. Üreticinin talimatlarına göre bir gRNA sentezi kiti kullanarak gRNA in vitro transkripsiyon gerçekleştirin.
- Grna sentezi setine dahil edilen RNA arıtma mikro sütununu kullanarak gRNA 'yı arındırın. Konsantrasyonu ölçün, ardından gRNAs 'ı-80 °C ' ye saklayın.
- Her mutasyon sitesi için bir ssODN bağış Şablonu Tasarla. SsODNs ıDT gibi ticari satıcılar tarafından sentezlenmiş olabilir. Genel olarak, her ssODN 120-160 nükleotidler (NT) uzunluğundadır, sol Homoloji kolunda 60-80 NT 'den oluşan ve sağ Homoloji kolunda 60-80 NT 'dir. Düzenlenmiş DNA 'nın geri çekilmesini önlemek için, PAM 'de sessiz bir mutasyon mümkün olduğunda ssODN 'de tanıtılmalıdır. CRıSPR kesim sitesi, mümkün olduğunca amaçlanan genomik değişikliğe yakın olarak bulunmalıdır.
3. Cas9 RNP ve ssODNs tüp Electroporation
- Hücreleri Bölüm 1 ' de açıklandığı şekilde hazırlayın.
- 20 μL Elektroporasyon tamponunda resuspend 2-3 x 105 hücre. Tek hücreli süspansiyon üretmek için dikkatle yukarı ve aşağı pipet.
- Cas9 RNP transfeksiyon için, 10-15 dk için oda sıcaklığında (RT) 0,67 μg Grna ile Premiks 2 μg Cas9-NLS protein. Ardından, biçimlendirilmiş RNP kompleksini, hücrelerle birlikte 2 μg ssODN ile hafifçe karıştırın.
- Hücre karışımını, tüp Elektroporasyon kiti tarafından sağlanan Universal fit pipet uçları kullanılarak 20 μL Elektroporasyon tüpüne aktarın. Daha iyi Electroporation elde etmek için, Transfer sırasında hava kabarcıklarının oluşumunu önlemek için deneyin.
- Elektroporasyon tüpünü elektroporator yuvasına yerleştirin ve bitirmek için "git" tuşuna basın. Her hücre türü için üreticinin önerilen parametrelerini izleyin. Örneğin, insan iPSCs ve tavşan fibroblast hücreleri için, voltaj seti 420 V ve nabız süresi 30 ms. electroporator ekran ekranında nabız raporu ile başarılı bir Elektroporasyon döngüsü belirtilir.
- Electroporation sonra, hücre kültürü bölümünde açıklanan önceden ısıtılmış Y-27632-içeren kültür ortamı 1 mL insan IPS hücreleri aktarın. Tavşan fibroblast hücreleri için,% 10 fetal sığır serumu ile DMEM 'e aktarın.
- Plaka resuspended hücreler bir iyi bir 12 iyi hücre kültürü plaka.
- Kültür ortamını her gün değiştirin. Y-27632 insan iPSC kültür orta kaldırılır 24 h sonrası Elektroporasyon.
4. Analizi gene düzenleme olayları
- Hasat hücreleri 72 Elektroporasyon sonra h. İnsan IPhone 'ları için tavşan fibroblast hücreleri veya hücre dekolmanı çözümü için Trypsin-EDTA kullanarak kültür plakasının Özet hücreleri. Santrifüjden sonra, 350 ml liziz tamponu ile pelletini hücreleri (1 m Tris HCL, 5 m NaCl, 0,5 m EDTA; pH 8,0,% 10 SDS, 1 ml Liz tampon başına 20 μl 20 mg/ml proteinaz K stoğu ekleyin), sonra bir gecede 55 °c ' de inküreme yapın.
- Standart prosedürler kullanılarak fenol-kloroform ile genomik DNA ayıklayın.
- Yüksek doğruluk DNA Polymerase kullanarak hedeflenen bölge içeren BP DNA parçaları 100-200 yükseltmek, daha sonra bir jel ekstraksiyon kiti kullanarak veya doğrudan PCR SV mini kiti kullanarak jeller DNA parçalarını arındırır.
- Bakteriyel koloni sıralaması ile gen düzenleme verimliliğini belirlemek için, saflaştırılmış PCR ürünlerini bir TOPO TA klonlama kiti kullanarak bir pCR4-TOPO vektörüne yerleştirin. Rasgele bakteriyel klonlar almak, sonra TOPO TA klonlama kiti tarafından sağlanan evrensel bir sıralı astar kullanarak ekler sıra.
- Derin sıralamanın gen düzenleme verimliliğini belirlemek için, saf PCR ürünlerini (~ 100-200 BP), bir DNA sıralı çekirdeğinde Crispr amplikon sıralaması için 4,3 adımından gönderin.
Sonuçlar
TE Cas9 RNP ve ssODNs tavşan fibroblast hücreleri için
Cas9 RNP 'nin meme hücrelerinin TE-aracılı tesliminin genel süreci Şekil 1' de gösterilmiştir. IL2RG gende ilk olarak C231Y ve Q235X mutasyonları üretildi ve R150G mutasyonu tavşan fibroblast hücrelerinde SPR geni içinde üretildi. IL2RG ve SPR genlerinde fonksiyon kaybı mutasyonları birincil immünyetmezlik11 ve motor ve bilişsel açıkları12, sırasıyla neden olduğu bilinmektedir.
Özel sgRNA tasarımları Şekil 2a'da gösterilmiştir. Hedeflenen bölgeleri yükseltmek için kullanılan astar Tablo 3' te listelenir. SsODNs dizileri Tablo 1' de gösterilir. Gen düzenleme oranları bakteriyel TA klonlama ile belirlendi (Şekil 2B). IL2RG C231 Locus 'ta, sıralanmış 28 klonların dışında bir (% 3,57) hassas C231Y mutasyonu, dört (% 14,28) taşınan yapılan ekleme veya silme (İndel) mutasyonları ve kalan 23 (% 82) vahşi tiptir. IL2RG Q235 Locus 'ta, sıralanmış 27 klonların dışında, iki (% 7,41) hassas Q235X mutasyonu, üç taşınan INDEL mutasyonları (% 11,11) taşınır ve kalan vahşi türüdür. SPG R150 Locus 'ta, 20 klonların sıralı, beş (% 25) hassas R150G mutasyonu, 10 (% 50) taşınan INDEL mutations taşınan ve kalan vahşi türüdür.
TE Cas9 RNP ve ssODNs insan iPSCs için
TE daha sonra insan ıpscs için Cas9 RNP ve ssODNs teslim etmek ve EGFR, Mybpc3 genlerindeki mutasyonlar ve HBB genler klinik olarak ilgili loci hedef kullanıldı. EGFR T790 proksimal bölgedeki nokta mutasyonları, EGFR13' ün aktifleştirmeyi etkinleştiren küçük hücreli olmayan akciğer kanseri (NSCLC) HASTALARıNDA EGFR Tirozin kinaz inhibitörlerine karşı direnç göstermektedir. MYBPC3 genlerindeki mutasyonlar yılında eXoN 16 ' da mutasyonu mutasyonu hipertrofik kardiyomiyopati14' te karışmış durumdadır. HBB geni E6V nokta mutasyonu orak hücre hastalığına yol açar15.
Özel sgRNA tasarımları Şekil 3A'da gösterilmiştir. Hedeflenen bölgeleri yükseltmek için kullanılan astar Tablo 3' te listelenir. SsODNs dizileri Tablo 1' de gösterilir. Gen düzenleme oranları DeepSeq (Şekil 3B) tarafından belirlendi. EGFR Locus,% 15,68 alelleri doğru nokta mutasyonları (6.315 okur),% 22,75 taşınan INDEL mutasyonlar (9.162 okur), ve kalan% 61,57 vahşi türü (24.797 okur) taşınır. MYBPC3 genlerindeki mutasyonlar Locus 'ta,% 37,92 hassas 4-BP tgaa silinmesini (11.654 okur),% 2,24 ' si (410 okur) taşınan INDEL mutasyonları ve kalan% 59,84 ' i vahşi tiptir (18.692 okur). HBB Locus 'ta% 11,65 hassas E6V mutasyonu (6.565 okur),% 23,35 ' si taşınan INDEL mutasyonları (13.163 okur) ve kalan% 65 ' ü vahşi tiptir (36.644 okur).

Şekil 1: Cas9 RNP tüp Elektroporasyon akış çizelgesi.

Şekil 2 : Tavşan fibroblast hücrelerinin gene düzenleme. (A) hedef sıraları Illustration. Kutular hedeflenen loci gösterir. Altı çizili harfler gRNA dizilerine karşılık gelir. Kırmızı renkli harfler PAM dizileri gösterir. (B) gen düzenleme olayların sonuçları klonlama. Kutular tam olarak mutasyona uğramış loci gösterir. Gösterilen INDEL sırası sadece bir allel türünün temsilcisidir. Diğer INDEL dizileri gösterilmez. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
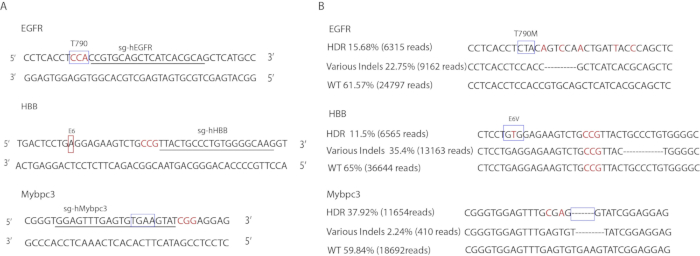
Şekil 3 : Insan iPSCs 'Nin gene düzenlenmesi. (A) hedef sıraları Illustration. Kutular hedeflenen loci gösterir. Altı çizili harfler gRNA sırasına karşılık gelir. Kırmızı renkli harfler PAM dizileri gösterir. (B) gen düzenleme etkinliklerinin deepseq sonuçları. Kutular tam olarak mutasyona uğramış loci gösterir. Kırmızı renkli harfler donör şablonlar tanıtıldı Sessiz mutasyonlar gösterir. Gösterilen INDEL sırası sadece bir allel türünün temsilcisidir. Diğer INDEL dizileri gösterilmez. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
| Odağı |
Oligo dizisi | |||||||
| (hedeflenen mutasyon) | ||||||||
| Tavşan IL2RG (C231Y) | AGCGTGGATGGGCAGAAACTCTACACGTTCCGAGTCCGGAGCCGTTTTAACCCTTTGTATGGGAGTGCTCAGCATTGGAGT EMRE k............ | |||||||
| Tavşan IL2RG (Q235X) | AGCGTGGATGGGCAGAAACTCTACACGTTCCGALTCCGGAGCCGTTTTAACCCTTTGTGTGGGAGTGCTTAGCATTGGAGT EMRE k............ | |||||||
| Tavşan SPR | gacctccatgctctgcctgacctcctgcatcctgaaggcgtttcctgccagtcctggCctcagcgggactgtggtgaacatctcgtcgctgtgtgccctgcagcccttcaagggctggg cgctgtac | |||||||
| (R150G) | ||||||||
| İnsan EGFR | ACGTGATGGCCAGCGTGGACAACCCCCACGTGTGCCGCCTGCTGGGCATCTGCCTCACCTCTACAGTCCAACTGATTACCC AGCTCATGCCCTTCGGCTGCCTCCTGGACTATGTCCGGGAACACAAAGACAATATTGGCTCCCAGTAC | |||||||
| (Nokta mutasyonları T790) | ||||||||
| İnsan Mybpc3 genlerindeki mutasyonlar | GCCCCCTGTGCTCATCACGCGCCCCTTGGAGGACCAGCTGGTGATGGTGGGGCAGCGGGTGGAGTTTGCGAGGTATCGGA Bu da benim için çok ıyı bir şeydi, değil mi?... | |||||||
| (4-BP silme) | ||||||||
| İnsan HBB | CTGACACAACTGTGTTCACTAGCAACCTCAAACAGACACCATGGTGCATÇTGACTCCTGTGGAGAAGTCTGCAGTTACTGCC BIR daha DEĞIL, bır daha....... | |||||||
| (E6V) | ||||||||
Tablo 1: ssODNs dizileri.
| Adım | Sorun | Olası nedenler | Çözümleri |
| 2,1 | Düşük INDEL oranı | Kötü kılavuz RNA tasarımı, kılavuz RNA stokları > 6 ay, düşük kılavuz RNA konsantrasyonu | Yeniden tasarım kılavuzu RNA, üretmek/sipariş yeni kılavuz RNA. |
| 2,3 | Düşük PGE verimliliği | kötü donör DNA tasarımı, düşük verimli Kılavuzu RNA, donör DNA veya düşük kaliteli DNA miktarı yanlış | Homoloji kol uzunluğunu artırın, PAM mutasyonunu tanıtın, donör DNA 'sına sessiz mutasyonları tanıtın, daha verimli bir kılavuz RNA kullanın, Cas9 protein oranını optimize edin. |
| 3,4 | Başarısız transfeksiyon | Hücre aktarımı sırasında oluşan hava kabarcıkları-Elektroporasyon tüpüne tampon karışımı, yanlış voltaj/süre ayarı | Hava kabarcıklarının oluşumunu önlemeye çalışın, voltaj/süre ayarını ayarlayın. |
| 3,6 | Elektroporasyon sonra düşük hücreli canlılığı | Tek insan IPSC düşük hayatta kalma | Elektroporasyon sonrası kaya inhibitörü ekleyin, hücre sayısını artırın. |
| 4,1 | Başarısız PCR | Yüksek GC içeriği veya tekrarlayan sıra | Optimize PCR durumu, PCR sisteme DMSO ekleyin. |
Tablo 2: sık karşılaşılan sorunlar için kılavuzları sorun giderme.
| Primer adı | Sıra | Not |
| RB-IL2RG-F | GÜLDEN | Tavşan IL2RG DNA parçası yükseltmek için |
| RB-IL2RG-R | (CAĞAK) | |
| RB-SPR-F | Bu BIR | Tavşan SPR DNA parçasını güçlendirerek |
| RB-SPR-R | Bu BIR | |
| H-EGFR-F | Bu BIR | İnsan EGFR DNA parçasını güçlendirerek |
| H-EGFR-R | Bu BIR | |
| H-Mybpc3 genlerindeki mutasyonlar-F | (ATGCCCCGTGCTTCTGGAAC) | İnsan Mybpc3 genlerindeki mutasyonlar DNA parçasını yükseltmek için |
| H-Mybpc3 genlerindeki mutasyonlar-R | TCAGGGGAGCCAACCCTCAT | |
| H-HBB-F | TANER k | İnsan HBB DNA parçasını güçlendirerek |
| H-HBB-R | CATTTGCTTCTGACACAACT |
Tablo 3:4,3 adımda kullanılan astar.
Tartışmalar
Tüp Elektroporasyon yöntemi tavşan ve insan hücrelerine Crispr/Cas9 RNP ve ssodns teslim etkili oldu, sağlam hassas gen düzenleme (PGE) önde gelen. TE ve diğer konvansiyonel Elektroporasyon cihazları arasındaki birincil fark, iki elektrotların tüpün üst ve alt kısmında olduğu bir tüpün kullanımı ve örnek, Elektroporasyon üzerine mühürlenmiş olarak tam olarak yüklenir (Şekil 1). Buna karşılık, geleneksel bir küvette, elektrotlar yanlarda ve numune Elektroporasyon sırasında tamamen mühürlenmez. Bu yeni tasarım, hava balonu üretimini azaltır ve hava balonu boyutunu sıkıştırır ve dolayısıyla elektrik voltajının bile dağılımını geliştirir ve sonuç olarak düşük hücre ölümü ve yüksek transfeksiyon verimliliği9' a yol açar. Mevcut çalışma, yüksek PGE oranları (% 15-37%) insan iPSCs 'de EGFR, Mybpc3 genlerindeki mutasyonlar ve HBB genlerini hedeflemede elde edildi. Bu sonuçlar, insan kök hücrelerinde yüksek PGE oranlarının elde edildiği önceki bir rapor ile tutarlı9.
Hastalık neden mutasyonlar tavşan hücrelerinde IL2RG ve SPR genleri hedeflenmiştir. Son zamanlarda, IL2RG-Knockout tavşan insan X bağlantılı şiddetli kombine immünyetmezlik (scid-x1)16,17için modeller olarak üretilmektedir. Mevcut çalışma, hasta IL2RG mutasyonları (örn., C231Y ve Q235X) tavşan hücrelerinde verimli bir şekilde oluşturulabilir ve hasta mutasyonları taşıyan SCID-x1 tavşan modelleri yaratmanın fizibilitesini göstermektedir. Ayrıca SPR R150G mutasyonların tavşan hücrelerinde verimli bir şekilde oluşturulduğunu göstermiştir. Bu mutasyon12çocuklarda motor ve bilişsel açıkları neden olur. Bu IL2RG ve SPR mutasyon tavşan modelleri, bir kez oluşturulan, translasyonel çalışmalar için değerli preklinik modeller olarak hizmet verebilir. Onlar da bu monojenik hastalıklar için gen düzenleme tabanlı terapi kurmak için kullanılabilir.
CRISPR/Cas9-aracılı gen düzenleme uygulamaları için bir endişe off-Target düzenleme olaylardır. INDEL oranları, bu çalışmada (tablo S1) kullanılan sgRNAs için önceden öngörülen üst off-Target sitelerinde, daha önce9' da açıklanan yöntemleri kullanarak incelenmiştir. Toplam olarak, yedi potansiyel üst off-Target loci SG-RB-IL2RG-01, beş SG-RB-spr için, yedi SG-hegfr için, beş SG-hMybpc3 ve yedi SG-hhbb için), tablo S2listelenen astarlar kullanarak incelendi. Bu sgrnas 'ı kullanarak Crispr/Cas9 aracılı gen düzenleme için en az hedef dışı riskleri gösteren T7E1 deneyleri (Şekil S1) tarafından hiçbir hedef dışındaki ındels ortaya çıkarıldı. Ayrıca, tüp Elektroporasyon yönteminin kendisini hedef olmayan düzenlemeleri neden veya artırmadığını da gösterir. Yine de, çabaları azaltmak veya istenmeyen hedef dışı düzenlemeleri ortadan kaldırmak için adanmış olmalıdır. Tüm genom sıralaması, klinik uygulamalarda kullanılmak üzere tasarlanan hücreler için bu tür olayları dışlamak için gerekli olabilir.
Teknik düzeyde, aşağıdaki CRISPR/Cas9 RNP tüp Electroporation tarafından verimli hassas genom düzenleme elde etmek için önemli faktörler olarak kabul edilir. İlk olarak, öngörülen düşük hedef potansiyele sahip verimli bir sgRNA seçmeniz tavsiye edilir. Peg uygulamaları için kullanmadan önce seçilen sgrna 'nın INDEL verimliliğini doğrulamak önemlidir. Bir yazılım iyi sgRNA doğrulama adımda başarısız tahmin nadir değildir.
İkinci olarak, yüksek PGE elde etmek için, mümkün olduğunda ssODN donör bir PAM mutasyonu teşvik etmek için tavsiye edilir. Mantık bu şekilde yaparak, CRISPR/Cas9 yeniden kesme donör şablon entegrasyonu engellenir sonra. Bazı durumlarda, PGE 'nin kendisi PAM mutasyonları tanıtır. Diğer durumlarda, PAM sırasına Sessiz mutasyonlar tanıtmak mümkündür. Bir PAM mutasyonu mümkün olmadığından, sgRNA serisine karşılık gelen donörde birkaç sessiz mutasyon dahil etmeye çalışmaları tavsiye edilir.
Üçüncüsü, özellikle te ile alakalı, hücre ve RNP karışımı Elektroporasyon tüpüne aktarırken hava kabarcıklarının oluşumunu önlemek önemlidir. Bir TE tüp tasarımı zaten hava kabarcık oluşumu en aza indirirken, dikkatli kullanım daha da azaltır ve hatta hava kabarcık oluşumu önlemek tamamlamak olabilir. Crispr/Cas9 ribonukleoprotein aracılı hassas gen düzenleme için tüp Elektroporasyon uygulamada karşılaşılabilir sık sorunlar için bir sorun çekim Kılavuzu Tablo 2sağlanır.
Sonuç olarak, burada tüp Elektroporasyon yüksek PGE oranları elde etmek için memeli hücrelere CRISPR/Cas9 RNP ve ssODNs teslimi için etkili bir araç olduğunu gösterilmiştir. Bu yeni TE transfeksiyon tekniği ve sağlam hassas gen düzenleme oranı, gen düzenleme uygulamalarının gelişimini kolaylaştırabilir.
Açıklamalar
J. C. Celetrix LLC, tüp elektroporatör üreticisi çalışır. L. M., L. J., J. S., D. Y., J. Z., Y. E. C. ve J. X. rakip ilgi alanlarını beyan etmez.
Teşekkürler
Bu çalışma Ulusal Sağlık Enstitüleri (R21OD023194-JX) tarafından destekleniyordu. Bu çalışma, Michigan Tıp Merkezi Üniversitesi 'nde translasyonel Bilimler ve Therapeutics (CAMTraST) için gelişmiş modeller Merkezi tarafından desteklenen çekirdek hizmetler kullanılmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Accutase | STEMCELL Technologies | 792 | Cell detachment solution for human iPSCs, first used in Step 1.1.2. |
| Cas9 Nuclease 3NLS | IDT | 1074182 | Cas9 protein, first used in Step 3.3. |
| DMEM | Thermo Fisher | 11965092 | For cell culture, first used in Step 1.2.3. |
| DPBS | Thermo Fisher | 1708075 | For preparing cell culture, first used in Step 1.2.2. |
| EDTA | Lonza | 51201 | For making lysis buffer, first used in Step 4.1. |
| Electroporation buffer | Celetrix | 13–0104 | The electroporation buffer, first used in Step 3.2. |
| Electroporation tubes | Celetrix | 20 μL: 12–0107; 120 μL: 12–0104 | The electroporation tube, first used in Step 3.4. |
| Electroporator | Celetrix | CTX-1500A LE | The tube electroporation machine, first used in Step 3.5 |
| Fetal bovine serum | Sigma Aldrich | 12003C | For cell culture, first used in Step 1.2.2. |
| Forma CO2 Incubators | Thermo Fisher | Model 370 | For cell culture, first used in Step 1.1. |
| Gel Extraction Kit | Qiagen | 28115 | For gel purification, first used in Step 4.3. |
| Human induced pluripotent stem cells | American Type Culture Collection | ACS-1030 | Human iPSCs, first used in Step 1.1. |
| Matrigel | Corning | 354277 | Artificial extracellular matrix; for precoating cell culture plate, first used in Step 1.1. |
| mTeSR 1 medium | STEMCELL Technologies | 85850 | Feeder-free cell culture medium for human iPSCs, first used in Step 1.1. |
| PCR SV mini | GeneAll | 103-102 | For PCR product purification, first used in Step 4.3. |
| Penicillin-Streptomycin | Thermo Fisher | 15140163 | For preparing cell culture, first used in Step 1.2.2. |
| Phenol-chloroform | Thermo Fisher | 15593031 | For DNA extraction, first used in Step 4.2. |
| Precision gRNA Synthesis Kit | Invitrogen | A29377 | For the generation of full length gRNA (guide RNA), first used in Step 2.4. |
| Proteinase K Solution | Thermo Fisher | AM2548 | For DNA extraction, first used in Step 4.1. |
| Q5 high-fidelity DNA polymerase | NEB | M0491 | For PCR amplification, first used in Step 4.3. |
| Sodium dodecyl sulfate | Sigma Aldrich | L3771 | For making lysis buffer, first used in Step 4.1. |
| TA Cloning Kit | Thermo Fisher | K457502 | For TA clone sequencing, first used in Step 4.4. |
| Tissue Culture Dish (10 cm) | FALCON | 353003 | For cell culture, first used in Step 1.2.3. |
| Tissue Culture Dish (12 well) | FALCON | 353043 | For cell culture, first used in Step 3.7. |
| Tissue Culture Dish (6 cm) | FALCON | 353004 | For cell culture, first used in Step 1.2.2. |
| Tris HCl | Thermo Fisher | BP1757-500 | For making lysis buffer, first used in Step 4.1. |
| Trypsin-EDTA | Thermo Fisher | 25200056 | For cell digestion, first used in Step 1.2. 4. |
| Universal Fit Pipette Tips | Celetrix | 14-0101 | For electroporation, first used in Step 3.4. |
| Y27632 | LC Labs | Y-5301 | The apoptosis inhibotor, first used in Step 1.1.1. |
Referanslar
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Mout, R., et al. Direct Cytosolic Delivery of CRISPR/Cas9-Ribonucleoprotein for Efficient Gene Editing. ACS Nano. 11 (3), 2452-2458 (2017).
- Zuris, J. A., et al. Cationic lipid-mediated delivery of proteins enables efficient protein-based genome editing in vitro and in vivo. Nature Biotechnology. 33 (1), 73-80 (2015).
- Miller, J. B., et al. Non-Viral CRISPR/Cas Gene Editing In Vitro and In Vivo Enabled by Synthetic Nanoparticle Co-Delivery of Cas9 mRNA and sgRNA. Angew Chem Int Ed Engl. 56 (4), 1059-1063 (2017).
- Finn, J. D., et al. A Single Administration of CRISPR/Cas9 Lipid Nanoparticles Achieves Robust and Persistent In Vivo Genome Editing. Cell Reports. 22 (9), 2227-2235 (2018).
- Liang, C., et al. Tumor cell-targeted delivery of CRISPR/Cas9 by aptamer-functionalized lipopolymer for therapeutic genome editing of VEGFA in osteosarcoma. Biomaterials. 147, 68-85 (2017).
- Luo, Y. L., et al. Macrophage-Specific in Vivo Gene Editing Using Cationic Lipid-Assisted Polymeric Nanoparticles. ACS Nano. 12 (2), 994-1005 (2018).
- Wang, H. X., et al. Nonviral gene editing via CRISPR/Cas9 delivery by membrane-disruptive and endosomolytic helical polypeptide. Proceedings of the National Academy of Sciences of the United States of America. 115 (19), 4903-4908 (2018).
- Xu, X., et al. Efficient homology-directed gene editing by CRISPR/Cas9 in human stem and primary cells using tube electroporation. Scientific Reports. 8 (1), 11649 (2018).
- Du, F., et al. Beneficial effect of young oocytes for rabbit somatic cell nuclear transfer. Cloning Stem Cells. 11 (1), 131-140 (2009).
- Allenspach, E., Rawlings, D. J., Scharenberg, A. M., Adam, M. P., et al. . GeneReviews(R). , (1993).
- Friedman, J., et al., Adam, M. P., et al. . GeneReviews(R). , (1993).
- Hidaka, N., et al. Most T790M mutations are present on the same EGFR allele as activating mutations in patients with non-small cell lung cancer. Lung Cancer. 108, 75-82 (2017).
- Ma, H., et al. Correction of a pathogenic gene mutation in human embryos. Nature. 548 (7668), 413-419 (2017).
- Vakulskas, C. A., et al. A high-fidelity Cas9 mutant delivered as a ribonucleoprotein complex enables efficient gene editing in human hematopoietic stem and progenitor cells. Nature Medicine. 24 (8), 1216-1224 (2018).
- Song, J., et al. Bacterial and Pneumocystis Infections in the Lungs of Gene-Knockout Rabbits with Severe Combined Immunodeficiency. Frontiers in Immunology. 9, 429 (2018).
- Song, J., et al. Production of immunodeficient rabbits by multiplex embryo transfer and multiplex gene targeting. Scientific Reports. 7 (1), 12202 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır