Method Article
İn Vivo Monosit Kemotaktik Aktivitenin Ölçülmesi ve Kan Monosit Türevi Makrofajların Karakterizasyonu
Bu Makalede
Özet
Burada fare modellerinde kan monositlerinin kemotaktik aktivitesini ölçmek, beslenme, farmakolojik ve genetik müdahalelerin kan monositi üzerindeki etkilerini değerlendirmek ve kan monositlerinden elde edilen makrofajları karakterize etmek için bir protokol sıyoruz. monosit-kemoattractant protein-1 (MCP-1) yüklü bazal membran kaynaklı jel fişleri kullanarak fare modelleri.
Özet
Doku homeostazis ve onarım kritik monosit kaynaklı makrofajlar işe bağlıdır. Monosit kaynaklı makrofajların hem yetersiz hem de aşırı işe alınması yara iyileşmesini bozabilir. Biz yüksek yağ ve yüksek şeker diyetler monosit priming ve disfonksiyon teşvik gösterdi, hiper kemotaktik fenotip içine sağlıklı kan monositleri dönüştürme disregulated aktivasyon profilleri ve bozulmuş fenotipik ile makrofajlar ayırt etmeye hazır Plastisite. Monosit kaynaklı makrofajların aşırı işe alınması ve disregulated aktivasyon profilleri ile makrofajların işe alınmasının metabolik bozukluklarla ilişkili kronik inflamatuar hastalıkların gelişimine önemli bir katkıda bulunmuştur. ateroskleroz ve obezite de dahil olmak üzere. Bu protokolün amacı, monosit astar ve disfonksiyon için bir biyomarker olarak kan monositlerinin kemotaktik aktivitesini ölçmek ve makrofaj fenotip kan monositlerini karakterize etmek tir. Tek hücreli Batı leke analizi ni kullanarak, farelere enjekte edilen MCP-1 yüklü bazal membran kaynaklı jel fişlerine alınan hücrelerin %24 saat 33'ünün monosit ve makrofaj lar olduğunu; 3. günden sonra %58. Ancak 5. günde monosit ve makrofaj sayılarında anlamlı olarak azalmıştır. Son olarak, bu tahliller aynı zamanda cerrahi olarak alınan bazal membran türetilmiş jel fişlerden canlı makrofajların izolasyonuna olanak sağladığını gösteriyoruz, bu da tek hücreli Batı leke analizi ile sonraki karakterizasyona tabi tutulabilir.
Giriş
Monosit kaynaklı makrofajların işe alınması, ateroskleroz ve obezite1,2,3, metabolik bozukluklar ile ilişkili kronik inflamatuar hastalıkların gelişimi için gereklidir, 4 . Doku yaralanması bölgelerinde monosit kaynaklı makrofajların sayısı ve plastisite doku homeostaz ve onarım için önemlidir. Monosit kaynaklı makrofajların hem altında hem de aşırıişe alınması yara iyileşmesini bozabilir 5. Yerel doku iltihabı tetikleyen, örneğin, birikimi ve oksidasyonu ile düşük yoğunluklu lipoprotein (LDL) aort duvarında veya yağ asitleri veya bakteriyel lipopolisakkarit tarafından adipositinflamatuar aktivasyonu bağırsak yoluyla sızıntı monosit kemoattractant protein-1 (MCP-1/CCL2) gibi kemokinler de dahil olmak üzere inflamatuar mediatörlerin salınımına yol açar. MCP-1 C-C kemokin ailesinin bir üyesi ve doku iltihabı ve yaralanma sitelerine monosit kaynaklı makrofajların işe sorumlu önemli bir kemoattractant6,7,8, 9,10. Vasküler endotel inflamatuar aktivasyonu, hücreler arası yapışıklık molekülü 1 (ICAM-1) ve vasküler hücre adezyon molekülü 1 (VCAM-1)11,12gibi yapışıklık moleküllerinin ekspresyonuna neden olur, boyunca rulo MCP-1 tarafından aktive monositler dolaşan, sıkıca uymak ve daha sonra subendothelial uzaya transmigration12. İnfiltrasyon monositler makrofajlar içine ayırt, hangi bir proinflamatuar fenotip içine aktive edilebilir, akut inflamatuar süreci sürüş. Mikroçevre tarafından yönlendirilen pro-inflamatuar makrofajlar, inflamatuar hücrelerin temizlenmesinde, pro-inflamatuar sinyallerin çıkarılmasında ve doku onarımı ve yaranın tamamlanmasında kritik rol oynayan inflamasyon çözümlü makrofajlara dönüşebilir. şifa12,13.
Kronik metabolik stres kemo-çekici ve artan monosit işe dramatik gelişmiş duyarlılık için monositler asal, ve biz astarlı monositded disregulated aktivasyon programları ve polarizasyon ile makrofajlar neden olduğunu gösterdi devletler14,15,16. Monosit priming ateroskleroz teşvik, obezite, ve muhtemelen diğer kronik inflamatuar hastalıklar steatohepatit gibi metabolik bozukluklar ile ilişkili, böbrek hastalıkları ve muhtemelen kanser. İnsan hastalıklarının fare modellerinde monosit astarını değerlendirmek ve ölçmek için, in vivo14,15,16'daki kemotaktik aktiviteyi ölçerek kan monositlerinin astar durumunu değerlendirmek için yeni bir teknikgeliştirdik. 17. yıl. Yaklaşımımız ya bir kemoattractant yüklü bodrum membran türetilmiş jel enjeksiyonu içerir - biz yaygın OLARAK MCP-1 kullanın - ya da araç sol ve sağ kanadı içine, sırasıyla, farelerin. Subkutan olarak dikkatlice enjekte edildiğinde, bodrum zarından elde edilen jel, kemokinlerin yayıldığı ve çevrenin metabolik veya inflamatuar durumundan etkilenmeyen tanımlanmış bir kemotaktik gradyan oluşturabileceği tek bir fiş oluşturacaktır. doku veya alıcı fare.
Bizim çalışma için kullandığımız bazal membran türetilmiş jel Engelbreth-Holm-Swarm (EHS) fare sarkomu, bu tür ekstrasellüler matriks (ECM) proteinleri açısından zengin bir tümör çıkarılan bir çözünürbazbaz membran hazırlık. Bu kompleks protein karışımı laminin (%60), kollajen IV (%30), köprü molekülü entaktinini (%8) ve bir dizi büyüme faktörünü içerir. Bazal membran matris fiş tonu başlangıçta çeşitli büyüme faktörleri 18yanıt olarak anjiyogenez araştırmak için geliştirilmiştir,19. Ancak, monosit kemotaksis çalışma için, endotel hücre alımı ve anjiyogenez en aza indirmek için büyüme faktörü tükenmiş bazal membran kaynaklı jel kullanmak önemlidir. Matrigel'i (bundan böyle bazal membrandan elde edilen jel olarak anılacaktır) benzersiz ve özellikle yararlı kılan şey, 10 °C'nin altındaki sıcaklıklarda sıvılaşması ve kemokinlerin erimesine izin verilmesidir. 22 °C'nin üzerindeki sıcaklıklarda, bazal membrandan elde edilen çözelti hızla faz geçişinden geçer ve hızla bir hidrojel oluşturur. Fişler cerrahi olarak çıkarılabilir, temizlenebilir ve tek hücreli süspansiyonlar elde etmek için bacillus kaynaklı nötr metalloprotaz ile çözülebilir, bu da rnaseq, tek hücreli RNA ve çeşitli diğer floresan aktive hücre ayırıcısı (FACS) üzerinde analiz edilebilir. omics teknikleri. Burada, enjeksiyondan bir, üç veya beş gün sonra, bodrum zarından elde edilen jel takılır içine işe hücre popülasyonlarının karakterizasyonu için tek hücreli Batı leke analizi nin kullanımını açıklıyoruz.
Protokol
Bu protokolde açıklanan tüm yöntemler Wake Forest Tıp Fakültesi Kurumsal Hayvan Bakım ve Kullanım Komitesi tarafından onaylanmıştır.
1. MCP-1 yüklü Büyüme Faktörü azaltılmış Bodrum Membran-türetilmiş Çözelti hazırlanması
NOT: Bu steril bir prosedürdür.
- Hücre kültürünü, bazal membran türetilmiş çözeltiyi (örneğin, Matrigel) hazırlamadan önce dezenfektanile temizleyin.
- Ayrı ayrı paketlenmiş steril 1 mL şırınga hazırlayın ve şırınga içine yüklemeden önce bir alkol bezi ile bodrum membran türetilmiş çözelti şişe üst silin.
- Buz üzerinde büyüme faktörü azaltılmış bazal membran kaynaklı çözelti tamamen çözülür.
DİkKAT: Eğer bodrum membran matrisi oda sıcaklığında (RT) çözülürse, çözeltinin jellemesini önlemek için küçük bir buz parçacığının kaldığından emin olun. - Bir kez çözülmüş, şişe açın ve hücre kültürü başlık% 0.1 BSA ile MCP-1 veya 1xPBS karıştırın.
- Steril şırıngadan 1 mL'lik bir 26 G iğne ile hazırlayın ve buz üzerinde soğutun.
- MCP-1'i %0,1 BSA ile 1x PBS'de 50 g/mL'lik son konsantrasyona eriterek MCP-1'in stok çözeltisini hazırlayın.
- 5 mL soğuk bodrum membranından elde edilen çözeltide 500 ng/mL'lik son konsantrasyona seyreltilmiş MCP-1. Sadece araçla eşit miktarda bodrum membranından türetilmiş çözelti hazırlayın (1x PBS %0,1 BSA içerir).
- Soğuk 1 mL şırıngada 500 μL'lik bodrum membrandan türetilmiş çözelti (MCP-1'li veya MCP-1'siz) yükleyin.
- Tek tip bir fiş oluşumunu sağlamak için enjeksiyon yapmadan önce bodrum membrandan türetilen çözelti yüklü şırıngadan tüm hava kabarcıklarını çıkarın.
2. İnjeksmembran Türevi Çözelti enjeksiyonu
- Çevreyi dezenfekte etmek için enjeksiyonlardan önce ve sırasında işlem alanının etrafına %70 etanol püskürtün.
- Anestezi yi yerleştirmek için fareyi bir anestezi odasına yerleştirin ve O2 akış ölçerini 1 litre/dk'ya ayarlayın ve buharlaştırıcıyı %2 izofluran'a ayarlayın.
- Solunum hızı (hız/dk), kornea refleksi ve bıyık ların hareketini izleyerek anestezinin derinliğini izleyin.
- Tüm işlem sırasında, bir burun konisi kullanarak anestezi korumak.
- İşlem sırasında anestezi derinliğini doğrulamak için solunum hızı (oran / dk), kornea refleks ve bıyık hareketi izleme tutun.
- Ayak sıkışmasına yanıt eksikliğini doğruladıktan sonra, sırasıyla sağ (MCP-1 ile) ve sol (MCP-1 ile) sol (MCP-1 ile) içine alttan (mcP-1) bazal olarak bazal olarak bazal olarak bazal olarak bazal olarak bazal olarak membrandan elde edilen çözeltiyi yavaşça enjekte edin. Enjeksiyon çok yavaş ise, bodrum membran kaynaklı jel fişleri düzensiz şekilli olabilir, hatta parçalanmış, ve kaldırmak zor.
- Çözeltinin kaçmasını önlemek ve tek bir pürüzsüz jel fişinin oluşmasını sağlamak için enjeksiyondan sonra şırıngayı 20-30 s tutun.
- Enjeksiyondan sonra, kurtarma kadar izleme ile ısınma yastığı üzerinde fare yerleştirerek.
- Fare tamamen kurtarıldıktan sonra fareyi orijinal kafese geri döndürün.
3. Hasat Bodrum Membran türetilmiş Jel Fişler
- Her fare için iki ayrı 1,5 mL mikrosantrifüj tüpü tartın ve etiketleyin.
- Üç gün sonra bodrum membran türetilmiş çözelti enjeksiyon, anestezi klüeti kullanarak fare ötanazi 3% izofluran ve servikal çıkış takip.
- Saç makası kullanarak farenin sırt kürkü çıkarın veya 5 dakika boyunca pamuk uçlu çubuklarla saç sökücü krem uygulayın ve silin.
- Fare derisini alt torasik ve üst lomber vertebra etrafında ki forceps kullanarak tutun ve cilde 2 mm uzunluğunda bir kesi yapın.
- Farenin arka çizgisini servikal vertebraya kadar yapılan bir kesiden ve cerrahi makas kullanarak kaudal vertebra kavşağının (kuyruk kavşağı) 1 cm yukarısına kadar kesin.
- Cildi kas tabakasından ayırın ve cildi polistiren köpük platformunda sabitleyin.
- Dikkatle ince forceps kullanarak bodrum membran türetilmiş jel fiş içeren fibröz kapsül tutun ve fişi temizlemek için ince makas kullanarak fibröz kapsül kaldırın.
- Temizlenmiş bazal membrandan türetilen jel fişini çıkarın ve 1,5 mL mikrosantrifüje aktarın (bkz. 3.1).
- Temizlenmiş bodrum membran türetilmiş jel fişi ile mikrosantrifüj tüp tartmak ve bodrum membran türetilmiş jel fiş ağırlığını hesaplamak.
4. Bodrum Membran Türevi Jel Fişleri Sindirin
- Buz üzerinde çözülme dezpase (10 mL).
- Temiz ince makas kullanarak mikrosantrifüj tüp bodrum membran türetilmiş jel fiş kıyma.
- Bodrum membrandan elde edilen jel fişi içeren her mikrosantrifüj tüpüne 800 μL dispase ekleyin.
- 10 s için maksimum hız ile Girdap fişi bozmak için.
- Mikrosentrifüj tüplerini 37 °C'de 1.400 rpm'de bir termmikserin içinde 2 saat boyunca kuluçkaya yatırArak bodrum membrandan elde edilen jel fişini tamamen eritin.
- 2 saat sonra, 400 x g'de RT'de 10 dk.
- Ters çevirerek veya dokunarak peleti 1 mL 1x PBS'de yeniden askıya alın.
- 200 x g'de 10 dk.'da santrifüjün tekrarlayın.
- PBS 300 μL pelet resuspend.
- Ayrı bir mikrosantrifüj tüpte 50 μL hücre süspansiyonu alın.
- Hücre süspansiyonuna 0,5 μL calcein (1 M) ekleyin.
NOT: Calcein sadece canlı hücrelerde birikir yeşil floresan hücre canlılık boya. - Hücreleri 37 °C'de 10 dakika boyunca CO2 kuluçka makinesinde kuluçkaya yatırın.
- Otomatik bir hücre sayacı kullanarak yeşil floresan (canlı) ve floresan olmayan (ölü) hücreleri sayın.
5. Tek Hücreli Batı Blot (scWB) Analizi Kullanılarak Hücre Süspansiyonundaki Hücre Bileşiminin Belirlenmesi
- ScWB çipini 15 mL 1x süspansiyon tamponunda kullanmadan önce bir Petri kabında en az 10 dakika RT'de rehydrate edin.
- Rehydrated çipe seyreltilmiş tek hücreli süspansiyonun (10.000-100.000 hücre/mL) 1 mL'sini ekleyin. Yüzeyi 10 cm Petri kabının dibine yerleştirin. Yüzeyin düz olarak ayarlandığından emin olun.
- Petri kabını kurumasını önlemek için bir kapakla kapatın ve hücrelerin degrade ile 5-15 dakikaya yerleşmesine izin verin.
- Çipi parlak alan mikroskobu altına yerleştirin ve kuyuları 10x büyütme de inceleyin.
NOT: Yaklaşık %15-20 mikrowell tek hücreli olarak işgal edilmeli, kuyuların %2'sinden azı 2 veya daha fazla hücre içermelidir. - Çipi içeren 10 cm Petri kabını 45 derece yatırın.
- Fiş üstten dibine hafif borular atarak yakalanan hücreleri yongayüzeyinden çıkarmak için çipi 1x süspansiyon tamponuyla yıkayın. 3 kez tekrarlayın.
- Tek hücreli Batı aletihazırlayın.
- Lizis süresini, elektroforez süresini ve UV yakalama süresini ayarlayın. Bodrum membranından türetilmiş jel fişinden çıkarılan makrofajları analiz etmek için aşağıdaki ayarları kullanın: lysis zamanı: 0 s; elektroforez süresi: 160 s; UV yakalama süresi 240 s.
- Çipi tek hücreli Batı aletinin elektroforez hücresine dikkatlice yükleyin. Çipin jel tarafına zarar vermemek için dikkatli olun.
- Odaya lysis / çalışan tampon dökün ve tamamen tüm tek hücreli Batı çip kapağı. Hücre lisisini başlatın.
- 5.8'de listelenen ayarı kullanarak scWB cihazını çalıştırın.
- Çalışma tamamlandıktan sonra, çipi 10 cm Petri kabına aktarın ve talaşı 10 dakika BOYUNCA 1x yıkama tamponuyla iki kez yıkayın.
- Birincil antikor seyreltmehazırlamak (anti-vinkülin: 1:10; anti-CD45: 1:15, anti-CD11b: 1:20, anti-F4/80: 1:10) antikor dilüent toplam hacmi (mix 8 μL antikor 1 artı 8 μL antikor 2 artı 64 μL).
- Ana antikor solüsyonunun 80 μL'sini antikor yoklama odasına ekleyin ve çipi jel tarafını aşağı indirin, böylece antikor çözeltisi talaş boyunca fitil.
- RT'de 2 saat için birincil antikor çözeltisi ile inkübat.
- Shaker üzerinde 1x yıkama tampon 10 dakika boyunca üç kez talaş yıkayın.
- Jeli tuzdan arındırmak için talaş üzerinde 10 dakika suda bir kez talaşyı yıkayın.
- Toplam 80 μL hacimde sekonder antikor 1:20 seyreltme (mix 2 μL ikincil antikor artı 78°L seyreltici).
- Çipi ışıktan korunan RT'de 1 saat boyunca ikincil antikorla kuluçkaya yatırın.
- Shaker üzerinde 1x yıkama tampon ile 10 dakika boyunca üç kez talaş yıkayın.
- Kalan yıkama tamponu kaldırmak için bir slayt spinner kullanarak çip spin.
- Fişi, ikincil antikorlarla birleşen florofor spektral kanalında 5 μm çözünürlükte çift lazer mikrodizi tarayıcısı üzerinde tarayın.
- scWB'ye özgü yazılımları kullanarak verileri analiz edin.
6. ScWB Çipin sıyırılması
- Taranmış talaşı soymaya hazır olana kadar yıkama tamponunda saklayın.
- Bir duman başlık içinde su banyosu yerleştirin.
- 50 mL'lik bir tüp rafı su banyosuna, rafın sadece 1 cm yukarısında su ile yerleştirin ve su sıcaklığını 60 °C'ye ayarlayın.
- Sıyırma tamponu hazırlayın. 1 L sıyırma tampon çözeltisi için 9,85 g Tris-HCl (pH 6,8) ve 20 g SDS'yi 900 mL distile suda çözün ve pH'ı ayarlayın. Daha sonra 1L'ye distile su ile doldurun.
- İlk tama dan sonra, sıyırma önce 10 cm Petri kabına çip yerleştirin.
- Her talaş için 40 mL sıyırma tamponu alın ve 320 μl β-ME ekleyin.
DİkKAT: β-ME zehirlidir ve insan ve çevre için tehlikelidir. Aşağıdaki işlem bir duman başlık yapılmalıdır. - Çipi kutuya yerleştirin ve kutuya su sızmasını önlemek için kutuyu parafilmile kapatın.
- Önceden ısıtılmış su banyosunda tüp raf içine teneke kutu yerleştirin.
- 90 dk kuluçka.
- Dikkatle teneke kutudan çip çıkarın ve taze bir Petri kabına yerleştirin.
- Çipi 1x yıkama tamponuyla bir kez kısaca yıkayın. Sonra Petri kabına 1x yıkama tampon15 mL ekleyin.
- Bir shaker üzerinde 15 dakika boyunca talaşyı yıkayın. Yıkama adımını dört kez tekrarlayın.
NOT: Çip bir sonraki birincil antikor için hazırdır (bkz. 5.12 - 5.21. adımlar).
Sonuçlar
Kan monositlerinin kemoforanlara duyarlılığına erişmek için, her farenin sol ve sağ yanlarına araç yüklü ve MCP-1 yüklü bazal membran kaynaklı solüsyon enjekte ettik. İnjektüllerden 1, 3 ve 5 gün sonra bazal membran dan elde edilen jel fişleri çıkarılmış, çözünmüş ve her fişe alınan hücreler sayılmıştır (Şekil1A). McP-1 yüklü fişteki (kapalı çubuklar) araç yüklü fişteki hücre sayısını (açık çubuklar) çıkararak, MCP-1'e (Δ Hücre Numarası, Şekil 1B)yanıt olarak özel olarak işe alınan hücre sayısını elde ettik. 5 günlük dönemde hızlandırılmış bir MCP-1-spesifik hücre alımı ve birikimi gözlemledik ve bu oranlar 31.000 hücre/gün (Gün 1)'den 78.000 hücre/güne (Gün 3) ve günde 136.000 hücre/gün'e yükselmiş (Şekil1B).
Bazal membrandan türetilen jel fişlerine giren hücre tiplerini belirlemek için, her fişten izole edilen hücreleri tek hücreli Batı leke analizine (scWB) tabi takındık, monositleri tanımlamak için CD45, CD11b ve F4/80 ifadesini probing (CD11b+F4/80 -), makrofajlar (CD11b+F4/80+ artı CD11b-F4/80+) ve kalan monositik olmayan lökositler (CD45+CD11b-F4/80-) (Şekil 2). ScWB yongaları daha sonra her jel üzerinde toplam hücre sayılarını belirlemek ve scWB çip üzerinde mikrowells tek hücreli doluluk onaylamak için vinkülin için probed edildi. MCP-1 yüklü bazal membran dansı jel fişlerindeki monosit yüzdesi 1.gün%20'de düşüktü, gün 3'te %47 ile zirveyaptı, 5. MCP-1 yüklü bodrum membrandan türetilen jel fişlerindeki makrofaj sayıları 1.gün %13'ten 3.günde %22'ye ve 5. MCP-1 yüklü fişler için, izole hücre popülasyonu içindeki monosit ve makrofaj yüzdesi 3 gün, araç yüklüfişlerde %31 ve MCP-1 yüklü fişlerde %58 (Şekil3B)en yüksek seviyedeydi ve 3 gün sonra MCP-1 bağımlı kemotaksis tarafından işe hücrelerin büyük çoğunluğu monositler ve makrofajlar vardır. Toplam hücre popülasyonundaki monosit ve makrofaj oranının anlamlı olarak yüksek olması nedeniyle, toplam monosit ve makrofaj sayısı 5. ve B), gün hücre sayısı 3 daha doğru kan monosit kemotaksis ve işe yansıtır. Bu nedenle, hayvanları kurban etmeden üç gün önce rutin olarak temel membrandan elde edilen solüsyonu enjekte ediyoruz. MCP-1 tarafından işe alınan tüm makrofajların monosit türetilmiş mi yoksa komşu dokulardan alınan yerleşik makrofajlar mı olduğu belirlenmemiştir.
Burada gösterilen verilerin istatistiksel analizi analiz yazılımı (örneğin, SigmaPlot 14) ile gerçekleştirilmiştir. ANOVA ve ardından Fischer LSD testi, ortalama değerleri deneysel gruplar arasında karşılaştırmak için kullanıldı. Tüm veriler en az 3 bağımsız deneyin ortalama ± SD'si olarak sunulur. Sonuçlar P < 0.05 düzeyinde istatistiksel olarak anlamlı olarak değerlendirildi.
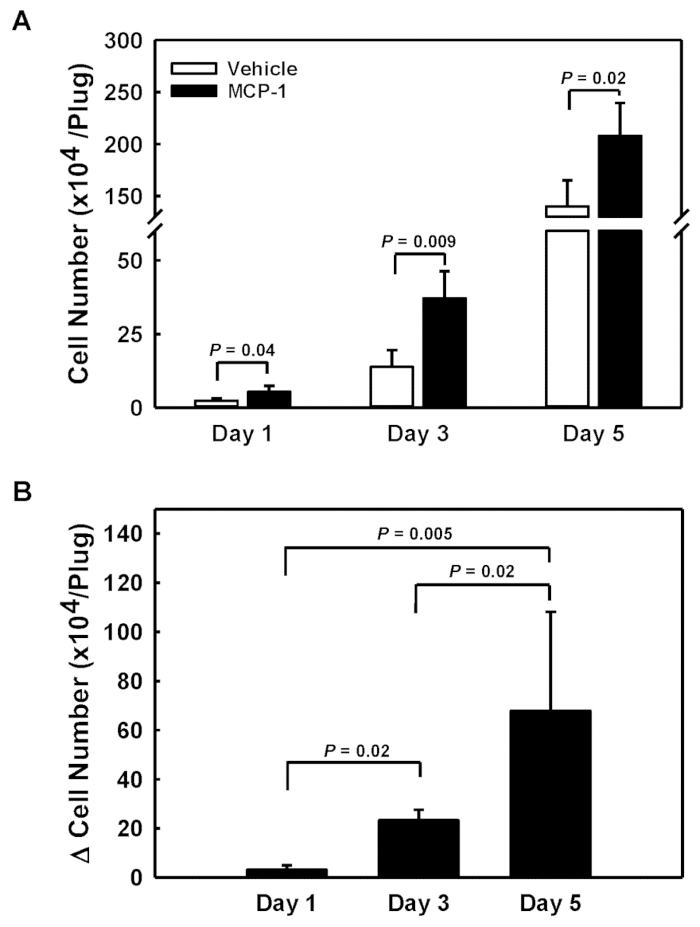
Şekil 1 : Deri altı bazal membran dan elde edilen jel fişler içine işe hücrelerin quantitation. (A) Araç yüklü (açık çubuklar) ve MCP-1 yüklü bodrum membran türetilmiş jel fişleri (kapalı çubuklar) için mutlak hücre numaraları. (B) MCP-1 tarafından bazmembrandan türetilmiş jel fişlerine alınan hücre sayısı, MCP-1 yüklü ve araç yüklü fişler arasındaki hücre sayıları farkı olarak hesaplanır. Sonuçlar ortalama ± SD (n=4) olarak gösterilir bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
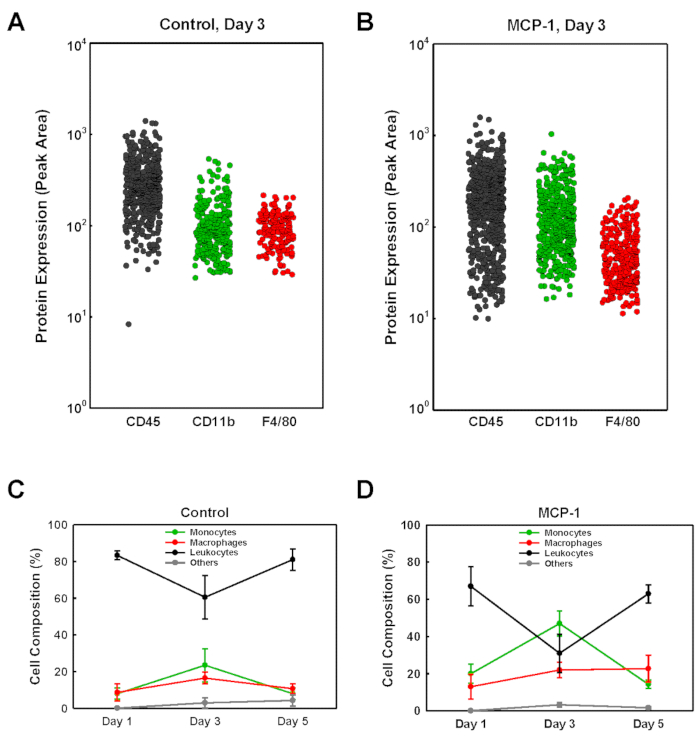
Şekil 2 : Tek hücreli batı leke analizi ile bazal membran kaynaklı jel fişleri içine işe hücre popülasyonlarının analizi. (A+B) Temsili örnekler, enjeksiyondan üç gün sonra birfareden izole edilmiş bir araç yüklü (Control) ve MCP-1-kurşunlu fişin(MCP-1)scWB analizi için gösterilmiştir. CD45, CD11b ve F4/80'e yönelik antikorlarla etiketlenmiş yongaları ve ardından Protokol'de açıklandığı gibi floresan sekonder antikorlar. Her bir hücre için etiketli bandın floresan yoğunluğu tepe alanı olarak gösterilir. (C+D) Hücre popülasyonları monosit (CD11b+F4/80  -, ), makrofajlar (CD11b+F4/80+ artı
-, ), makrofajlar (CD11b+F4/80+ artı  CD11b-F4/80+, , ) veya monositik olmayan lökosit (CD45 + olarak tanımlanmıştır. ,
CD11b-F4/80+, , ) veya monositik olmayan lökosit (CD45 + olarak tanımlanmıştır. ,  ). Kalan hücreler "diğer" (
). Kalan hücreler "diğer" ( ) olarak etiketlendi. Sonuçlar ortalama ± SD (n = 3) olarak gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
) olarak etiketlendi. Sonuçlar ortalama ± SD (n = 3) olarak gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
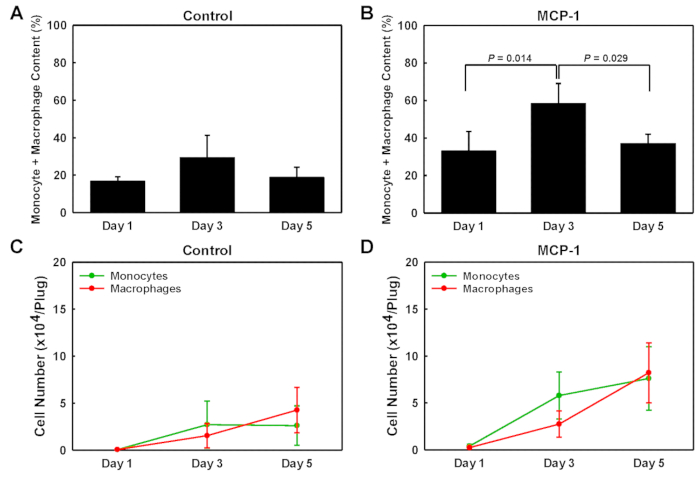
Şekil 3 : Bazal membran dan elde edilen jel fişlerin monosit ve makrofaj içeriği. Araç yüklü ve MCP-1 yüklü fişlerde işe alınan monosit ve makrofaj içeriğinin 1, 3 ve 5 enjeksiyon sonrası günde kaldırılan kantitatif analizi. Değerler toplam hücre popülasyonunun yüzdesi(A +B) olarak ve fiş başına mutlak hücre sayılarında (C+D) olarak gösterilir. Sonuçlar ortalama ± SD (n = 3) olarak gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
İn vivo kemotaksis titreci geliştirdik, bazal membrandan elde edilen matrisin eşsiz fiziksel özelliklerinden ve bu eşsiz matrisi kemokinlerle yükleyip farelere enjekte etme yeteneğinden yararlanarak. Tsa bize mcp-1 için burada gösterildiği gibi, monositler (ve makrofajlar) monositlerin duyarlılık ve monosit üzerinde ya genetik manipülasyon veya farmakolojik, diyet ve diğer çevresel maruz ilerletme etkilerini canlı farelerde değerlendirmek için izin verir kemotaksis. Çünkü bu farelerde oluşturduğumuz kemokin gradyan aslında genetik, farmakolojik, diyet ya da çevresel maruziyetten etkilenmez, monosit kemotaktik aktivitesindeki değişiklikler aslında bu monositlerde fonksiyonel değişiklikleri yansıtır ve gösterdiğimiz gibi daha önce, aynı zamanda protein ve transkripsiyonel düzeyde hem de yeniden programlama17,20. Farelerdeki metabolik stresin kemotorete monosit duyarlılığını artırdığını ve bu hiper-kemotaktik aktivitenin artmış protein S-glutatyonilasyon, geri dönüşümlü, redoks bağımlı posttranslational ile ilişkili olduğunu bildirdik. protein modifikasyonu, çoğu durumda enzimatik ve protein fonksiyonu kaybına yol açar21,22, ve bazı durumlarda bile protein bozulması teşvik16,23.
Bu prosedürü başarıyla uygulamak ve bu tahkikat ile en iyi sonuçları elde etmek için, tekil bir iyi biçimlendirilmiş fiş oluşturmak için doğru hacimleri bodrum membrantif türetilmiş çözelti yavaş yavaş enjekte edilmesi ve fibröz kapsüller kaldırılması önemlidir tamamen hasat bodrum membran kaynaklı jel fişleri temiz fişler almak için, dispase çözeltisi tüm fişin çözülmesini kolaylaştırır. Verilerimiz, fişi hayvanlarda üç gün boyunca bırakmanın 1) sinyal yoğunluğunu, yani her fişe alınan monosit ve makrofaj ların sayısını, 2) sinyalin seçiciliğini, yani içindeki monosit ve makrofajların içeriğini optimize ettiğini göstermektedir. toplam hücre popülasyonları ve 3) sinyalin özgüllüğü, yani mcp-1'e yanıt olarak monosit ve makrofajların artması araca göre. Son olarak, bodrum membrantöyonu türetilmiş jel fişi ile birlikte son teknoloji tek hücre bazlı yaklaşımların fişlere alınan monositleri karakterize etmek ve böylece potansiyel fenotipin bir anlık görüntüsünü elde etmek için nasıl kullanılabileceğini gösteriyoruz. monosit kaynaklı makrofajlar belirli genetik, farmakolojik, diyet veya çevresel müdahalelere yanıt olarak herhangi bir fare modelinde yaralanma sitelerine işe alınıyor.
Dikkate alınması gereken tsay sınırlamaları vardır. İlk olarak, anestezi, bazal membrandan elde edilen çözelti enjeksiyonu ve cerrahi diseksiyon dahil olmak üzere fare kullanımı, tek fişler ve tekrarlanabilir veriler oluşturmak için pratik gerektirir. İkinci olarak, MCP-1 yüklü fişler içine işe en hücreleri monositler ve makrofajlar iken, önemli bir sayı değildir. Bu, bu hücre popülasyonu üzerinde yapılan diğer, tek hücreli olmayan analitik tahlillerin yorumlanmasını etkileyebilir. Son olarak, scWB için hücre lisis koşulları hafif olduğundan, proteinlerin göç mesafeleri standart WB'den farklı olabilir ve protein büyüklüğü ile ilişkili olmayabilir. Bu nedenle, her hücre lisis ve çalışma süreleri test edilmesi ve kullanılan her birincil antikor için doğrulanması gerekir.
Açıklamalar
Hiçbiri.
Teşekkürler
Bu proje NIH'den (AT006885) R.A.'ya yapılan bağışlarla desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 cm petri dish | griner bio-one | 664 160 | |
| 10x suspension buffer | proteinsimple | R101 | |
| 15 cm petri dish | Falcon | 353025 | |
| 2-Mercaptoethanol | MP BIOMEDICALS | 2194705 | |
| 5% washing buffer | proteinsimple | R252 | |
| Antibody diluent | proteinsimple | 042-203 | |
| Bench Top Centrifuge | Beckman Coulter | Microfuge 22R Centrifuge | |
| Bovine Serim Albumin | Sigma-Aldrich | A7906-100G | |
| Calcein AM | ThermoFisher | C3099 | 1 mL |
| CD11b | Novus Biologicals | NB110-89474 | |
| CD45 (D4H7K) rabbit mAb | Cell Signal Technologies | 727987S | |
| CD68/SR-D1 (FA-11) | Novus Biologicals | NBP2-33337SS | |
| Cellometer Vision | Nexcelom | ||
| Dispase | BD | 354235 | 100 mL |
| Dissecting sissor | |||
| Donkey anti-Rabbit IgG secondary antibody [NL557] | Novus Biologicals | NL004 | NL 557 conjugate |
| Donkey anti-Rat IgG (H+L) secondary antibody [DyLight 650] | Novus Biologicals | NBP1-75655 | DyLight 650 conjugate |
| F4/80 (CI-A3-1) | Novus Biologicals | NB600-404SS | |
| Heat Block | effendorf | 22331 | Thermomixer |
| Lysis/Running buffer | proteinsimple | R200 | |
| Matrigel Matrix (Grwoth Factor Reduced) | BD | 354230 | 10 ml |
| Microarray scanner | PerkinElmer | ScanArray Gx | |
| Microcentrifuge tube | Fisher Scientific | 05-408-129 | |
| Microscope | ThermoFisher | Evos fl | |
| Milo | proteinsimple | Single cell western | |
| Needle | BD | 305111 | 26 G |
| Parafilm | |||
| Probing chamber | proteinsimple | 035-020 | |
| Recombinant mouse CCL2/JE/MCP-1 protein | R&D | 479-JE-050 | |
| scWEST chip | proteinsimple | C300 | |
| Shaker | Bioexpress | Gene mate orbital shaker | |
| Single cell western chip canister | proteinsimple | 035-118 | |
| Slide spinner | Labnet | C1303-T | |
| Sodium Dodecyl Sulfate (SDS) | Fisher Scientific | BP 166-500 | |
| Syringe | BD | 309602 | 1 mL |
| Tris-Hydrochloride | Fisher Scientific | BP 153-500 | |
| Tweezer | proteinsimple | 035-020 | |
| Water bath | ThermoFisher |
Referanslar
- Moore, K. J., Tabas, I. Macrophages in the pathogenesis of atherosclerosis. Cell. 145 (3), 341-355 (2011).
- Chawla, A., Nguyen, K. D., Goh, Y. P. Macrophage-mediated inflammation in metabolic disease. Nature Reviews Immunology. 11 (11), 738-749 (2011).
- McNelis, J. C., Olefsky, J. M. Macrophages, immunity, and metabolic disease. Immunity. 41 (1), 36-48 (2014).
- Akiyama, T., et al. Genistein, a specific inhibitor of tyrosine-specific protein kinases. Journal of Biological Chemistry. 262 (12), 5592-5595 (1987).
- Nahrendorf, M., Pittet, M. J., Swirski, F. K. Monocytes: protagonists of infarct inflammation and repair after myocardial infarction. Circulation. 121 (22), 2437-2445 (2010).
- Gosling, J., et al. MCP-1 deficiency reduces susceptibility to atherosclerosis in mice that overexpress human apolipoprotein B. Journal of Clinical Investigation. 103 (6), 773-778 (1999).
- Fantuzzi, L., et al. Loss of CCR2 expression and functional response to monocyte chemotactic protein (MCP-1) during the differentiation of human monocytes: role of secreted MCP-1 in the regulation of the chemotactic response. Blood. 94 (3), 875-883 (1999).
- Boring, L., Gosling, J., Cleary, M., Charo, I. F. Decreased lesion formation in CCR2-/- mice reveals a role for chemokines in the initiation of atherosclerosis. Nature. 394 (6696), 894-897 (1998).
- Han, K. H., Tangirala, R. K., Green, S. R., Quehenberger, O. Chemokine receptor CCR2 expression and monocyte chemoattractant protein-1-mediated chemotaxis in human monocytes. A regulatory role for plasma LDL. Arteriosclerosis Thrombosis Vascular Biology. 18 (12), 1983-1991 (1998).
- Kanda, H., et al. MCP-1 contributes to macrophage infiltration into adipose tissue, insulin resistance, and hepatic steatosis in obesity. Journal of Clinical Investigation. 116 (6), 1494-1505 (2006).
- Davies, M. J., et al. The expression of the adhesion molecules ICAM-1, VCAM-1, PECAM, and E-selectin in human atherosclerosis. Journal of Pathology. 171, 223-229 (1993).
- Anderson, T. J., et al. The effect of cholesterol-lowering and antioxidant therapy on endothelium-dependent coronary vasomotion (see comments). New England Journal of Medicine. 332 (8), 488-493 (1995).
- Herold, S., Mayer, K., Lohmeyer, J. Acute lung injury: how macrophages orchestrate resolution of inflammation and tissue repair. Frontiers in Immunology. 2, (2011).
- Qiao, M., et al. Thiol Oxidative Stress Induced by Metabolic Disorders Amplifies Macrophage Chemotactic Responses and Accelerates Atherogenesis and Kidney Injury in LDL Receptor-Deficient Mice. Arteriosclerosis Thrombosis Vascular Biology. 29, 1779-1786 (2009).
- Ullevig, S., et al. NADPH Oxidase 4 Mediates Monocyte Priming and Accelerated Chemotaxis Induced by Metabolic Stress. Arteriosclerosis Thrombosis Vascular Biology. 32 (2), 415-426 (2012).
- Kim, H. S., Ullevig, S. L., Zamora, D., Lee, C. F., Asmis, R. Redox regulation of MAPK phosphatase 1 controls monocyte migration and macrophage recruitment. Proceedings of the National Academy of Science. 109 (41), E2803-E2812 (2012).
- Kim, H. S., Tavakoli, S., Piefer, L. A., Nguyen, H. N., Asmis, R. Monocytic MKP-1 is a Sensor of the Metabolic Environment and Regulates Function and Phenotypic Fate of Monocyte-Derived Macrophages in Atherosclerosis. Scientific Reports. 6, 34223(2016).
- Ponce, M. L. Tube formation: an in vitro matrigel angiogenesis assay. Methods in Molecular Biology. 467, 183-188 (2009).
- Auerbach, R., Lewis, R., Shinners, B., Kubai, L., Akhtar, N. Angiogenesis assays: a critical overview. Clinical Chemistry. 49 (1), 32-40 (2003).
- Kim, H. S., Ullevig, S. L., Nguyen, H. N., Vanegas, D., Asmis, R. Redox regulation of 14-3-3zeta controls monocyte migration. Arteriosclerosis, Thrombosis, and Vascular Biology. 34 (7), 1514-1521 (2014).
- Short, J. D., Downs, K., Tavakoli, S., Asmis, R. Protein Thiol Redox Signaling in Monocytes and Macrophages. Antioxidants and Redox Signaling. 25 (15), 816-835 (2016).
- Tavakoli, S., Asmis, R. Reactive oxygen species and thiol redox signaling in the macrophage biology of atherosclerosis. Antioxidants and Redox Signaling. 17 (12), 1785-1795 (2012).
- Ullevig, S. L., et al. Protein S-Glutathionylation Mediates Macrophage Responses to Metabolic Cues from the Extracellular Environment. Antioxidants and Redox Signaling. 25 (15), 836-851 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır