Method Article
Tekrarlayan eylem potansiyel kayıtlar için Multiwell mikro elektrot diziler üzerinde insan iPSC-türetilen Kardiyomiyoksit ağları
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu makale, insan kaynaklı pluripotent kök hücre türevi kardiyomiyosit (hiPSC-CM) ağlarının gelişimi için bir dizi protokolün yanı sıra, hücre membranı hareket potansiyeli ölçümleri için ters şekilde electroporate etmek için multiwell MEA plakaları üzerinde kültürlü bir set içerir. Yüksek verimlilik kayıtları aynı hücre sitelerinden gün içinde tekrar tekrar elde edilir.
Özet
Kalp güvenliği taraması, ilaç keşfi ve terapi için önemli öneme sahiptir. Bu nedenle, hiPSC-türev kardiyomiyosit (hiPSC-CM) preparatları için yeni yüksek verim elektrofizyolojik yaklaşımların geliştirilmesi, verimli ilaç testi için çok gereklidir. Multielektrot dizileri (Meas) sıklıkla heyecanlı hücrelerin alan potansiyel ölçümleri için istihdam edilir rağmen, Joshi-Mukherjee ve meslektaşları tarafından yeni bir yayın açıklanan ve tekrarlayan eylem potansiyeli (AP) kayıtları için uygulama doğrulandı gün içinde aynı hiPSC-CM hazırlık. Burada amaç, CMs 'yi tohumlamak ve yüksek hassasiyetle elektroporasyon yoluyla AP dalga formlarını ölçmek ve 1 μs temporal çözünürlüğü için ayrıntılı adım adım yöntemler sağlamaktır. Bu yaklaşım, güvenilir elektrofizyolojik araştırmalar için yüksek verimlilik AP ölçümleri için hücre içi erişim elde etmek için kullanımı kolay metodolojisi eksikliği giderir. Multiwell MEA plakaları üzerinde hiPSC-CMs kaplama için ayrıntılı bir iş akışı ve Yöntemler, ilgili her yerde kritik adımları vurgulayarak tartışılmaktadır. Buna ek olarak, hızlı veri işleme, ekstraksiyon ve analiz için özel olarak oluşturulmuş bir MATLAB komut dosyası, dalga formu analizinin kapsamlı bir şekilde incelenmesi için, morfolojideki çeşitli AP süresi parametreleri için ince farklılıkları ölçmek üzere raporlanır Aritmi ve kardiyotoksisite.
Giriş
İnsan kaynaklı pluripotent kök hücre türevi kardiyomiyositler (hipsc-CMS), artan sayıda laboratuar için altın standarttır1,2,3,4,5,6 ,7,8,9,10. Embriyoid organları11,12,13 ve tek tabakalı3,7,10,11,12, dayak 13,14,15,16,17 farklılaşma kardiyomiyosit üretimi için tercih edilen yöntemlerdir ve multielektrot dizisi (MEA) ortak bir modalite haline gelmiştir Bu ağların elektrodinamiklerini izlemek için18,19,20. Alan potansiyelleri (FPs) gibi dayak oranı, genlik, süre ve RR aralıkları elde edilebilir parametreleri kendiliğinden dayak monolayers temel elektrofizyolojik tepkiler vardır18,21, 22,23, bu ekstreküler FP sinyallerinin temelindeki eylem potansiyeli (AP) bileşenleri24' ü ortaya çıkarması zordur. Doğrudan tekrarlayan AP ölçümleri için MEAs uygulamasının keşfi hakkında yapılan son yayınımız, birden fazla çeşitli repolarizasyon aşamalarında geniş bir dalga formu analizi ile örnek hücre içi AP okumaları için metodoloji kanıtı sağlar hiPSC türevi kardiyomiyosit ağları3gruplar. Çalışmada, electroporating pulsların hiPSC-türev kardiyomiyositlerin ağlara teslimini AP kayıtları için hücre içi erişim sağlar göstermiştir. Bu geçici AP kayıtları, yaralanma sitesi3,25,26ile gözlenen transmembran potansiyel kurtarmalara bağlıdır. MEA ile kaydedilmiş dalga formları ve bizim çalışmamızda yama-kelepçe benzer AP morfolojileri böylece yaklaşım güvenilirliği doğrulama gösterdi3.
Birkaç laboratuar, özel yapılı Meas18,21,26,27,28,29 kullanarak çeşitli elektrojenik hücrelerden APS ölçme bildirdi 30, ancak tutarlı ve tekrarlayan AP ölçümleri Için MEAs kullanmanın güvenilirliği değerlendirilmiyor. Şu anda, altın standart yama-kelepçe tekniği Terminal kayıtları7,31 ise, MEA tabanlı AP ölçümleri geçici ve bu nedenle aynı hücrede birden çok kez yapılabilir sınırlıdır. Ayrıca en az filtreleme gerektiren milivolt aralığında yüksek kaliteli AP sinyalleri kolayca kaydedebilirsiniz gösterir. Araştırmacılar bu nedenle sadece akut değil, aynı zamanda kronik ilaç çalışmaları MEAs kullanarak aynı preparatlarda yürütebilecek. Ayrıca, bu teknoloji, kısa bir süre içinde electro-biome kitaplıkları üreten eşzamanlı FP/AP ölçümüne izin verir. Aritmi tahmin ve ilaç ilişkili kardiyotoksisite artan vurgu verilen24,32,33,34,35, AP ölçümü entegrasyonu yaklaşımlar ilaç güvenliği ve etkinlik değerlendirmelerini artıracaktır.
Burada, biz 1 için protokoller mevcut) ön-kaplama için kriokonservirovannogo hipsc-CMS olgunlaşma, 2) bunalımları ve kaplama hipsc-CMS multiwell Meas, 3) FPs ve APS kayıt hipsc-cm ağlar, 4) segment ve analiz için veri ayıklama, ve 5) birden çok yeniden kullanmak için diziler geri yükleme. Her adım, ilgili her yerde kritik adımları vurgulayarak optimize edilmiştir. Hücre eki için gereksinimler bir dayak sinsityal Tek tabakalı ele almak ve tekrarlayan elektrofizyolojik çalışmalar için multiwell MEA restorasyon prosedürleri açıklanmıştır. Son olarak, laboratuvarda geliştirilen özel bir GUI, AP parametrelerini ölçmek ve analiz etmek için AP sinyal çıkarma, kalite güvencesi ve segmentasyon iş akışı için sunulur.
Protokol
1. çözeltiler ve malzemelerin hazırlanması (bkz. malzeme tablosu)
-
6-Iyi doku-kültür plaka substrat-kaplama
- Kaplama substrat buzun veya 4 °C ' de çözüyor.
- Soğuk DMEM/F12 orta bir 1:100 kaplama substrat seyreltme hazırlayın. Çözümü yavaş pipetleme ile karıştırın.
- Taşıma 2 mL kaplama substrat çözeltisi (adım 1.1.2) başına bir 6-kuyu doku kültürü plaka.
- Kaplı doku kültürü plakasını hemen 37 °C ve% 5 CO2 ' ye en az 7 saat ve 7 gün içinde kullanın.
-
hiPSC-CM kültür orta
- 4 °C ' de 500 mL CM taban ortamına kadar çözülmüş 10 mL CM 'lik medya takviyesi ekleyin. 2 haftaya kadar 4 °C ' de saklayın.
- Aliquot gün için medya miktarı gerekli ve kullanmadan önce oda sıcaklığına getirmek.
- hiPSC-CM çözme ortamı: hiPSC-CM kültür ortamını (adım 1,2)% 10 fetal sığır serumu (FBS) ile karıştırarak taze hazırlayın. Süspansiyon için CMs Çözüleme öncesi oda sıcaklığına medya getirin.
- Fibronectin 1 mg/mL stok çözeltisi: aliquot 200 μL 1,5 mL steril mikrofuge tüpleri içine ve daha sonra kullanılmak üzere 4 °C ' de saklanır. 50 μg/mL konsantrasyonunun çalışma çözümünü buzda taze hazırlayın.
- Multiwell Temizleme çözümü: 50 mL steril çift distile su (ddH2O) ile enzimatik deterjan 0,5 g 'yi birleştirin. İçeriği karıştırmak için Vortex. Bir haftaya kadar 4 °C ' de filtreleyin ve saklayın.
2. olgunlaşma için ağoplanmış hiPSC-CM ön kaplama (Şekil 1)
Not: Bu bölüm, 1-2 milyon hücreli/şişede sıvı nitrojen 10 gün sonrası farklılaşması ile besleyici içermeyen tek tabakalı yöntemi3,16 ve kriokonservirovannogo kullanılarak ayırt edilen hipsc-CMS ' i çözme ve kültürleme için tasarlanmıştır. Bir şişedeki hücreler, 6-well doku kültürü plakasının iki substrat kaplı kuyusuna kaplamadır. Kardiyomiyositler tüpün altına yerleşmek eğilimindedir, böylece ön kaplama sırasında nazik karıştırma, kuyular arasında bile hücre yoğunluğunu elde etmek için önemlidir.
- 15 mL konik tüp içine çözülür ve oda sıcaklığına getirmek hiPSC-CMs şişe başına FBS 2 mL aliquot.
- 37 °C ' lik su banyosuna yerleştirerek ve 3 dakikadan fazla olmayan bir şekilde bile çözülüyor şekilde yavaşça kıvrılma
- Hemen FBS içeren tüp için şişe içeriğini aktarmak (bkz. Adım 2,1), karıştırmak ve Santrifüjden 200 x g 5 dk.
- Süpernatant aspirate ve 1 ml hipsc-cm çözme Orta hücre Pelet pelletini (bkz adım 1,3) her şişe çözülmüş. Yumuşak triturasyon ile Pelet yeniden pelletini için bir transfer pipet kullanın. Hücre viability değerlendirmek.
- Adım 2,4 yılında çözülmüş hiPSC-CM şişe başına ek 3 mL çözme orta ekleyin ve hücre kümeleri daha fazla ayırmak için bir transfer pipet kullanarak yavaşça askıya.
- 2 mL hücre süspansiyonunu, substrat kaplı 6-kuyu plakalarının her bir kuyunda yavaşça dağıtın (bkz. Adım 1,1). 37 °C ve% 5 CO2' de hücre kültürü kuluçvörü yerleştirin.
- 24 saat sonra taze hiPSC-CM kültür ortamı ve 20 gün sonra haftalık 3 kez değiştirin.
Not: hücreler, 24 saat substrat kaplamasına uymalı ve 48 h Post-kaplama olarak kendiliğinden yendi (bkz. video 1 ve video 2).
3. multiwell MEA plaka sterilizasyon ve kaplama (Şekil 2 ve şekil 3)
Not: burada açıklanan protokol, hiPSC-CM kaplama için cam üzerinde 12 mikro altın PEDOT kaplı elektrotlar ile 24-Well MEA plakaları hazırlamak için. Bu elektrotlara zarar verebilir gibi plakanın alt dokunmadan kaçının.
- Hücre kaplamasını iki gün önce, 0,5 mL hiPSC-CM kültür orta ekleyin (bkz: adım 1,2) her iyi ve MEAs kalite kontrol için sinyal-gürültü oranı doğrulamak için bir temel kayıt gerçekleştirin.
- Medyayı aspirate, steril ddH2O ile durulayın ve bir gecede bir laminar akış kaput içinde UV ışığı altında sterilize.
- Hücre kaplamasını önceki gün, MEA yüzeylerinin hidrofilik tedavisi için her iyi FBS 0,1 mL ekleyin. Oda sıcaklığında 30 dakika boyunca inküye yapın. Bu adım, hücre eki için gereklidir.
- FBS aspirate ve steril ddH2o iyi başına 0,5 ml ile durulayın. Bir kez daha tekrarlayın.
- Bir gecede laminar akış kaput kuru plaka bırakın.
- 50 μg/mL fibronektin ile stoktan soğuk DMEM/F12 ortamında çalışma seyreltmesi hazırlayın (bkz. Adım 1,4). Çözümü buzda tut.
- Çalışma fibronektin seyreltme 5 μL pipet (bkz. 3,6) ve tüm 12 elektrotları kapsayacak şekilde her bir kuyu ortasına damlacık dikkatle dağıtın. Damlacık kurumasını önlemek için 24 kuyu boyunca hızlı bir şekilde çalışmak önemlidir.
- Hemen tüm çanak yüzeyi kapsayacak şekilde steril ddH2O içeren bir nemlendirme odası içinde yükseltilmiş bir yüzey üzerinde fibronektin kaplı MULTIWELL MEA plaka yerleştirin. Hücre kültürü kuluçk 3 h için multiwell MEA plaka ile Oda yerleştirin.
Not: 24 iyi MEA plakasını nemlendirme odasına yerleştirmek, fibronektin damlacıkları kuluçak döneminde kurumasını önlemek için önemlidir.
4. hipsc-cm ayrışma ve multiwell MEA plaka kaplama (Şekil 3)
Not: Bu adımı, MEA fibronektin inkübasyon öncesinde 1 saat önce başlatın. Hücre dağılma çözeltisi 37 °C ' de olduğundan ve IPSC-CM çözme ortamının oda sıcaklığında olduğundan emin olun. Dissociation yöntemleri 30 gün sonrası farklılaşmış hiPSC-CMs için optimize edilmiştir substrat kaplı 6-kuyu plakaları üzerinde kültürlü (bkz adım 2) MEA kaplama için% 90 uygun CMs hakkında elde etmek. Bakım hücre ölümü önlemek için toz iken hava kabarcıkları tanıtmak için değil alınmalıdır.
- 30 gün sonrası farklılaşan hiPSC-CM kültürü ile 6-well doku kültürü çanak her kuyudan kültür ortamı aspirate (bkz: adım 2,7) ve 2 mL steril D-PBS için iyi başına yıkayın.
- 1 mL önceden ısıtılmış hücre dağılma çözeltisi ekleyin ( malzeme tablosunabakın) ve 37 °c ' de 4 dakika boyunca inküye yapın. Dağılma için hücreleri gevşetmek için hafifçe triturate bir transfer pipet kullanın. Hücrelerin çoğu hala bağlı ise, başka bir 3 dakika 37 °C ve triturate tekrar için inkübe. Bu ek inkübasyon maksimal hücre kurtarma için yardımcı olmalıdır. Bu düşük hücreli viability neden olabilir gibi 7 dakikadan fazla inkük etmeyin.
- Bir transfer pipet kullanarak, tüm bölünmüştür hücreleri hiPSC-CM çözme orta içeren bir konik tüp içine havuz (bkz. Adım 1,3). Hücre dağılma çözeltisi etkinliğini engellemek için en az iki kez medya hacmi (2 mL her iyi hasat) içinde hücreleri askıya alınması önerilir.
- 200 x g 'de 5 dakika Santrifüjü
- Pelet gevşek yüzeye bağlı ve 0,1 ml hipsc-cm çözme orta pelletini olarak çözümü dikkatle aspirate. Hafif trituration ile Pelet birkaç kez yeniden pelletini için bir transfer pipet kullanın.
- Aliquot 2 μL ayrılmış hücreler ve 1,5 mL mikrofuge tüpünde 18 μL medya ile seyreltilmiş. 20 μl tripan mavi ekleyin ve hücre sayısı ve canlılığı değerlendirme için karıştırın.
- Hücre yoğunluğunu 6.000, hiPSC-CM çözme ortamının uygun hacmini ekleyerek Cells/μL 'ye ayarlayın. Birkaç kez yumuşak Flicking tarafından Pelet askıya. HiPSC-CMs, özellikle yüksek yoğunluklarda kaplama yapılırken cam yüzeylerden kolayca ayırabilirsiniz. 15 gün elektrik kaydı elde etmek için tohumlama yoğunluğu ve kaplama koşullarını optimize ettik.
- Hazır olduğunda, hücre tohumlama için multiwell MEA plakasını laminar akış kaputu içine getirin. Fibronektin kurutulması önlemek için bir kerede aşağıdaki iki adım bir iyi gerçekleştirmek için önemlidir.
- Elektrotlara dokunmadan bir P10 pipet kullanarak fibronektin damlacık dikkatle çıkarın.
- Tüm 12 elektrotları kapsayan MEA plakasının kuyu merkezine hemen 5 μL hücreli damlacık (30.000 hücre) dağıtın. Tüm 24 kuyular kaplamana kadar adımı tekrarlayın. Aralıklı hücre süspansiyonunun Flicking ile karıştırma önerilir.
- Multiwell MEA plakasını geri gevşek kapsanan nemlendirme odasına yerleştirin ve 37 °C ' de hücre kültürü inkükokosu ve hücre eki için 3 saat için% 5 CO2 ' ye dönün.
- P200 pipet kullanarak hücreleri rahatsız etmeden her bir kuyu için 200 μL hiPSC-CM çözme ortamını dikkatlice ekleyin. Kuyu tarafına medya dropwise ekleyin.
- Multiwell MEA plakasını geri hücre kültürü kuluçevine yerleştirin.
- 24 saat sonrası kaplama taze hiPSC-CM kültür ortamı ile değiştirin. Kardiyomiyositlerin spontan dayak bu noktada gözlemlenebilir (bkz. video 3).
- Deneylerin sonuna kadar her 2 günde bir medyayı değiştirin.
5. hipsc-cm Elektroporasyon ve sinyal alımı (rakamlar 4 – 6)
Not: Bu protokol, yüksek verimlilik elektrot sinyallerinin eşzamanlı kaydı içindir (24 kuyuların her biri için 12 site). 24-iyi multiwell MEA sistemi satın alma yazılımı ile kullanılır (bkz. malzeme tablosu). Tüm MEA kayıtları 37 °C ' de gerçekleştirilir.
- Arayüz kartını açın ve edinme yazılımını başlatın. Multiwell MEA baş aşamasının 37 °C sıcaklığa ulaşması için yeterli zaman verin ( Şekil 4' teki ok No. 1 ' e bakın).
- 4. adımda multiwell MEA plakasını, kayıt platformunun kapağına yerleştirerek çok iyi MEA kafa aşamasına yerleştirin ve Ekle düğmesine tıklayın ( Şekil 4' te ok No. 2 ' ye bakın). Kayıtları başlatmadan önce sıcaklığın stabilizasyonu için izin verin.
-
Edinme ve Elektroporasyon ayarlarını ayarlama
- Deneysel akış tanımla simgesine tıklayın ( Şekil 4' te ok No. 3 ' e bakın) ve kayıt süresini 2 dakika veya istediğiniz gibi ayarlayın.
- Veri edinme kurulumu simgesine tıklayın ( Şekil 4' te ok No. 4 ' e bakın) ve örnekleme hızını 20 kHz 'ye ayarlayın, 0,1 Hz 'ye yüksek geçiş filtresi ve 3500 Hz 'ye düşük geçişli filtre.
- Stimulator ayarlar simgesine tıklayın (bkz. Şekil 5). Stimulus Definition sekmesi altında, 1 mV, 1 MS ve 1 Hz 'nin biphasik simetrik voltaj darbeleri olarak stimülasyon tanımlayın. Stimülasyon elektrotları sekmesinin altında, ilgili tüm elektrotlar vurgulanarak Elektroporasyon sitelerini seçin.
- Tüm kuyularda sinyalleri görselleştirmek için keşfet düğmesini tıklayın. Sinyal kalitesini ve istikrarlı durum koşullarını doğrulayın. MV aralığında FP sinyalleri ile elektrotlar hakkında not alın. Keşfi durdurmak için aynı düğmeyi tıklatın. Bu noktaya kadar veri kaydedilmedi.
- Go! düğmesine tıklayarak kaydetmeye başlayın. Her bir kuyu elektrotları ham veri penceresinde FP sinyalleri gösterecektir (Şekil 6). 30 s kayıt sonra, teşvik düğmesine tıklayın ve Elektroporasyon 30 s için seçilen sitelerde yer almak için izin; sonra, uyarmayı durdurmak ve kalan 60 s için kaydetmeye devam etmek için aynı düğmeye tıklayın.
Not: kaydedilmiş dosya ' uygulama ' açılır menüsünde ' Replayer modu ' geçiş yaparak geri çalınabilir.
6. yeniden kullanım için multiwell MEA plaka temizliği
- Son deneylerden sonra, her iyi ve dikkatle elektrot yüzeyine dokunmadan kaçınarak tüm medya içeriğini duman çekiş multiwell plaka tüm kuyuları temizleyin.
- 1 mL steril ddH2o iyi başına ekleyin. Aspirate ve bir kez tekrarlayın.
- Eklemek 0,3 mL multiwell temizleme çözeltisi (bkz adım 1,5) başına iyi. Hücre ve enkaz yerinden etmek için oda sıcaklığında bir gecede inkübe.
- Ertesi sabah, solüsyonu Aspire ve 1 ml steril DDH2O ile durulayın. 5-7 dk ve Aspire için inküye. 5 kez tekrarlayın.
- Eklemek 0,5 mL steril ddH2O başına iyi. Temizlenmekte olan MEAs 'ın kalite kontrolü için temizlenmiş multiwell plakanın taban çizgisini kaydedin (Şekil 7).
- Kullanıma hazır olana kadar 4 °C ' de saklayın.
7. veri dosyası dönüştürme ve ihracat
Not: her kayıt için dört veri dosyası oluşturulacaktır: MWR, MWC, MWD ve MWS dosyaları. Dönüştürücü yazılımını kullanarak, MWD dosyası, özel olarak oluşturulmuş komut dosyası kullanarak sonraki analiz için H5 dosyasına dönüştürülebilir (bkz. ek dosya 1).
- Dönüştürücü yazılımını başlatın (bkz. malzeme tablosu).
- Dosya menüsünden giriş yolunu ayarla 'yı seçin. İlgi veri dosyalarını içeren klasörü seçin.
- Dosya menüsünden Çıkış yolunu ayarla 'yı seçin. Dönüştürülen dosyaların kaydedileceği klasörü seçin.
- İlgi MWD dosyasını vurgulayın.
- HDF5 Için dışa aktar düğmesine tıklayın.
8. veri segmentasyon ve analiz (rakamlar 8-10)
Not: MATLAB tabanlı özel yazılım, çeşitli FP ve AP veri parametrelerini segmentlere ayırmak ve ayıklamak için kullanılır. Yazılım talep üzerine mevcuttur.
- MATLAB kullanarak Waveform çözümleme kodunu ÇALıŞTıRıN (GUI 'nin ana penceresinin görünümü için bkz. Şekil 8 ).
- Dosyayı tıklatın ve Process. H5seçin.
- Yukarıdaki adım 7 ' ye göre oluşturulan MWD. H5 dosyasını bulup seçin.
- Çıkış dosyalarının depolama konumunu değiştirmek için dizini kaydet düğmesini tıklatın.
- İlgili elektrot/iyi kombinasyonları seçip Queue düğmesine tıklayarak bir sinyal işleme kuyruğu oluşturun. Kuyruğa işlenmek üzere daha fazla elektrot/iyi kombinasyonlar eklemek için bu adımı yineleyin.
- Hücrelerin ilaç ile tedavi edilmediği takdirde doğrudan Med adı/Med konsantrasyon üzerine tıklayarak sırayı düzenleyin (Şekil 8).
- Sıra son olduğunda, Başlat dalga formları düğmesini tıklatın. Bu, sinyallerin belirlendiği ve segmentasyon için ayıklandığı ön işleme başlayacaktır.
- Zoom ın düğmesine tıklayın ve imleç ile ilgilendiğiniz eylem potansiyel alanını seçin (Şekil 9).
- Keep düğmesine tıklayın ve panelleri gözden geçirin. Dorukların (kırmızı ' x ') ve dallar (sarı daireler) her dalga için algılanır ve normalleştirilmiş eylem potansiyelleri üst üste. Koru düğmesini tıklatın ve sıradaki sonraki izlemede hareket edin (Şekil 10).
- Kuyruktaki elektrot/kuyu kombinasyonu sinyallerinin geri kalanı için 8.8-8.9 arasındaki adımları yineleyin.
Not: bir . csv dosyası, her dalga formu için ölçülen APD parametreleriyle oluşturulur. Her . H5 dosyası için A . mat dosyası da bölümlenmiş verilerin ek işleme izin vermek için kaydedilir.
Sonuçlar
Sonrası çözülen hipsc-CMS ' i k i canlılığı ve kaplama yoğunluğu çok iyi MEA kültürü için önemlidir. Pre-Kaplama 1-2 milyon hipsc-CMS/şişenin iki kuyu içine bir 6-iyi doku kültürü plaka ile 50% veya daha fazla olabilirlik spontan dayak ile sağlıklı bir tek tabakalı kültürü üretecek 48 h. yüksek bir yüzde ile kültürler neden olacak CMS zayıf miyosit olmayan nüfus. Çok iyi MEA kaplama için Disosiye bu monolayers genellikle tutarsız sonuçlar ve kötü kalite sinyalleri üretmek ve bu nedenle atılmalıdır. Şekil 1 48 h sonrası kaplama en optimum vs alt-optimum Hipsc-CMS kültürler örnekleri gösterir. Multiwell MEAs doğrudan yerine substrat kaplı doku kültürü plakaları üzerinde CMs çözme, hücre kurtarma ve olgunlaşma için izin verir3. Tutarsız sonuçlar üretildiği için dizi üzerinde kriokonservirovannogo CMS doğrudan kaplama önerilmez.
Ayrılmış CMs 'nin kalitesine ek olarak, multiwell MEA 'daki hücre eki hücre yoğunluğuna ve fibronektin kaplama tekniğine oldukça bağımlıdır. Fibronektin damlacık büyüklüğü, CMs 'nin fibronektin kaplı alanın sınırlarına uygun olması açısından önemlidir. Bu nedenle, sadece 5 μL fibronektin çözeltisi doğrudan elektrot dizi alanı üzerinde dağıtılır. Damlacık dağılmadığından emin olmak için, kuyu yüzeyi kaplama sırasında tamamen kuru olmalıdır. Şekil 2 , optimum hazırlık için adım adım ön tedavi şemaları ile MULTIWELL MEA plakasının düzenini gösterir. Ayrıca, fibronektin çok güzel MEA plakaları kurutmak önlemek için bir nemlendirme odası içinde en fazla 3 saat süren inkübasyon döneminde yerleştirilmelidir (bkz. Adım 3,8). Kuluçka süresi tamamlandıktan sonra, her iyi sadece CM kaplama önce ve sadece o zaman sonraki iyi kaplama devam fibronektin damlacık kaldırmak için önemlidir. CMs 'nin hızla ve dikkatlice dağıtımı çalışma başarılı hücre ataşmanı için anahtardır.
hiPSC-CM kültürlerinde 30 gün sonrası farklılaşma, enzimatik hücre ayrışma yöntemini kullanarak multiwell MEA kaplama için ayrılır (bkz. Adım 4). CMS, fibronektin-kaplamalı MEA yüzeylere 3 h ve diziler kapsayan bir tek tabakalı, 24 h sonrası kaplama (Şekil 3) sonrasında görünür olacaktır. Tek tabakalı senkron dayak 24-48 saat içinde gözlemlenir. hücre damlacık dispersiyon kültür yoğunluğu etkileyecek hatta kurutma ve hücre ölümü neden olur. Doğrudan dizi üzerinde hassas hücre yerleşimi son derece önemlidir ve bu nedenle tekniği optimum kaplama için uygulanmalıdır. Referans elektrot hücre yapışma elektrik sinyali üretim engel olacaktır. Bkz. Şekil 3 en iyi cm yerleşimi ve kültür görüntüleri için 24 saat sonra.
Multiwell MEAs üzerinde kültür CMs 48 h sonrası kaplama elektrik aktivitesi için kalite kontrol tabi tutulur. Genellikle, FP sinyal genliği μV aralığından mV 'ye yaklaşık 4 gün3olarak artar. Eğer bir ağ içindeki elektrotların% 50 ve toplam ağların% 70 ' i FP sinyalleri üretemiyorsanız, ağ veya kültür yetersiz ve atılmalıdır. Sadece kalite denetimi geçiren kültürler, FP ve AP analizi için işlenir. Şekil 6 iyi ve alt standart FP sinyallerinin örneklerini gösterir.
Electroporation-mediated AP kayıtları, kültür 48 h Post-MEA kaplamandan birden çok kez alınabilir. Electroporation istihdam, biz birden fazla hiPSC türetilen kardiyomiyoksit ağları yüksek çözünürlüklü APs kaydetmek için hücre içi erişim kazanmıştır. FP 'nin AP 'ye dönüşümlü dönüşümü için 30 s 'lik düşük voltaj darbeleri (1 V, 1 MS, 1 Hz) teslim edildi. Elektroporasyon, elektrotların yaklaşık% 75 ' inde AP ölçümü için başarılı hücre içi erişime izin verir. Elektrik sinyalleri 30 s pre-Elektroporasyon, 30 s sırasında ve 1 dak sonrası Elektroporasyon içeren 2 dakika için kaydedilir. 10 s AP dalgası ile 10 ' dan fazla elektroporasyonu olan bir tren, sinyal kalitesi ve analizi için tüm sitelerde değerlendirilir. Saf AP sinyaline uygun olmayan herhangi bir iz atılır. AP genlikleri FP sinyaliyle ilişkilendirilmiş olup olmadığını araştırmak için tüm 288 siteleri aynı anda dalga formlarını kaydetmek için electroporated. İki farklı elektrotdan aynı hücre sitesinden kaydedilen temsilci FP ve AP sinyalleri Şekil 11A'da gösterilir. Aynı hücre sitesinden kaydedilen FP genlikleri ve Elektroporasyon sonrası AP amplitütler arasında hiçbir korelasyon izlenmemiştir. Ayrıca, 0, 24, 48, 72 ve 96 h 'de aynı hücre sitesinin birden çok electroporations zaman içinde AP şekli üzerinde önemli bir etkisi yoktu (Şekil 11B).
Sistemin yüksek verimlilik niteliği göz önüne alındığında, RR aralığı, anlık frekans ve diferansiyel eylem potansiyel süresi gibi ilgi parametrelerini ayıklamak ve ölçmek için manuel bir teknik verimsiz ve zaman alıcıdır. Araştırma topluluğuna talep üzerine kullanılabilen özel olarak oluşturulmuş bir MATLAB komut dosyası, 1 μs çözünürlüğe sahip dalga formu ölçümleri yapmak için kullanılmaktadır. Elektroporasyon zaman noktaları, sinyal çıkarma, kalite güvencesi ve segmentasyon iş akışını gerçekleştirmek için 10 s AP sonrası elektroporasyonu belirlemek üzere çıkarılan sinyalle kaplanmış edilir (Şekil 8, Şekil 9, Şekil 10). Kullanıcı arayüzü, bir kılavuz olarak kaplanmış Elektroporasyon göstergelerini kullanarak istenilen segmentin seçilmesi için izin verir. Segmentlere ayrılmış dalga formu, bireysel AP dalga formlarını daha fazla belirlemek için alt yordamlar tarafından işlenir. Bu, her döngü için en yüksek ve en düşük voltajın belirlendiği tepe algılama yoluyla tamamlanır. Bu işlem tamamlandıktan sonra genlikleri normalleştirilmiş ve ilişkilendirme zaman vektörler 1 en yüksek değeri sıfır zaman tanımlamak için kaydırılır. APD ölçümlerini belirlemek için bireysel döngüleri boyunca kesişme noktalarının interpolasyonu kullanılmıştır. Bu nedenle, AP dalga biçimli segmentasyon için kısmi Otomasyon iş akışı, kısa bir süre içinde birden çok kültürden çeşitli APD parametreleri için verimli veri analizine olanak sağlar. Gerçek zamanlı veri analizi için FPs ve APs için dahil etme ve dışlama kriterlerinin daha fazla Otomasyonu devam etmektedir.
Multiwell MEA plakasının önemli bir avantajı, birden çok kez yeniden kullanılabilir olmasıdır. Bu restorasyon, maliyet-etkin ve tutarlı veri toplama için tekrarlayan elektrofizyolojik çalışmalar sağlar. 6 restorasyonlar sonra aynı dizideki APS kayıtları Şekil 12' de gösterilir. Sinyal-gürültü oranı birden fazla reuses arasında benzer. Tekrarlanan elektrofizyolojik çalışmalar için dizinin güvenilirliğini göstermek için, toplam 3815 AP dalga formları üç restorasyon toplu işleminden havuzlanır ve sonuçların tekrarlanabilirliği incelemek için AP süresi verileri ayıklanır. Bireysel dalga formu için dağıtım çizimleri APD30, APD80, Nirengi (APD80— APD30) ve kesirli kısaltma ((APD80— APD30)/(APD80)) görüntülenir (Şekil 13).

Şekil 1: olgunlaşma için kriokonservirovannogo hipsc-cm ön kaplama. (A) Pre-Kaplama için hücre işleme 1 şişe 10 gün sonrası farklılaşma üzerinden Hipsc-CMS. (B) başarılı (sol) ve başarısız (sağ) hipsc kültürlerinin faz kontrast görüntüleri. Ölçek çubuğu: 275 μm. Bkz. video 1 ve video 2 başarılı 14 ve 24 gün sonrası farklılaşma kültürü örnekleri için. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 2: Multiwell MEA plaka kurulumu ve hazırlanması. (A) MULTIWELL MEA plaka şemaları: plaka, 12 mikroelektrot dizileri ve 4 periferik referans elektrotları içeren 24 kuyudan (A1-D6) oluşur. Elektrot çapı: 30 μm/elektrot mesafesi: 300 μm. kayıtlar 288 elektrotlardan aynı anda elde edilebilir. (B) hipsc-cm kaplama işleminden önce sterilizasyon ve hidrofilik tedavi adımları yapılmalıdır. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 3: hipsc-cm ayrışma ve multiwell MEA plaka kaplama. (A) her kuyu Için hipsc-cm MEA kaplama adımlarının şematikleri. (B) 4 referans elektrotlara yayılmadan tüm 12 elektrotları kaplayan doğru hücre damlacık yerleşimi gösteren mikroskobik görüntü. (C) bir örnek (sol) ve en uygun (sağ) HIPSC-cm Platting, 24 saat sonrası kaplama ile faz kontrast mikroskobik görüntüler. Ölçek çubuğu = 275 μm. Başarılı MEA kaplama örneği için video 3 ' ü görün. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 4: Multiwell-ekran edinme yazılımı. Oklar, metinde başvurulan önemli özelliklerin ve işlevlerin konumunu gösterir: sıcaklık kontrolü (1) paneli, deney boyunca gerçek zamanlı sıcaklık izlemesi sağlar. Ekle/çıkar (2) düğmesine basın ve Multiwell MEA plaka bırakın. Deneysel akış tanımla (3) işlevi, kullanıcının kaydın süresini ayarlamasına izin verir. Veri edinme kurulumu (4) işlevi, kullanıcının örnekleme hızını ve edinme filtresi ayarlarını ayarlamanızı sağlar. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 5: Hipsc-cm Elektroporasyon ve sinyal edinme . Stimulus Definition Tab, kullanıcının electroporating Pulse parametrelerini tanımlamasına olanak tanır. Stimülasyon elektrotları sekmesi, kullanıcının electroporating elektrotlar seçmesine olanak sağlar. 288 elektrotların herhangi bir kombinasyonu seçilebilir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 6: elektrik aktivitesi Için Multiwell MEAs kalite kontrol. Optimum (A) ve alt standart (B) FP sinyallerinin temsili örnekleriyle ham veri pencereleri gösteren multiwellekran edinme yazılımı. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 7: yeni ve restore edilen DIZININ FP ve AP sinyalleri. Multiwell MEA Enzimatik temizlik adımları (A). Yeni dizinin temel sinyali, en az sinyal gürültü oranı (B) ve FP sinyallerinin şebeke (C) elektrik aktivitesini gösterir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 8: veri segmentasyon ve analiz. Dalga formu Analiziiçin GUI 'nin ana penceresinin görünümü. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 9: veri segmentasyon ve analiz. Segmentasyon IÇIN AP dalga formlarını tanımlamak ve ayıklamak ve hareket potansiyeli alan ilgi alanını seçerek yakınlaştırma ve ön işleme başlamak Için dalga formları düğmesini başlatın. Kırmızı çemberler Elektroporasyon göstergeleridir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 10: veri segmentasyon ve analiz. Zirveler (kırmızı ' x ') ve dallar (sarı daireler) her dalga için algılanır ve normalleştirilmiş APs dalga formları kalite kontrol için üst üste. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 11: aynı hücre sitesinden birden çok kayıt IÇIN FP SINYALINE AP genliği bağımlılığı. İki bağımsız elektrotdan kaydedilen μV aralıklardaki (a, sol üst panel) veya mV aralıkları (a, sağ üst panel) içinde FP genliği MV aralığında AP genliği üretir (a, alt sol ve sağ paneller) FP genlikleri arasında hiçbir korelasyon gösteren ve Elektroporasyon sonrası AP genlikleri. Her kayıt için normalleştirilmiş AP dalga formları, her kayıt için gösterildiği gibi üst üste eklenir. Aynı hücre sitesinin birden fazla electroporations 0 için 96 h yüksek kaliteli AP dalga formları membran elektrodinamik (B) izleme sağlayan üretilen. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
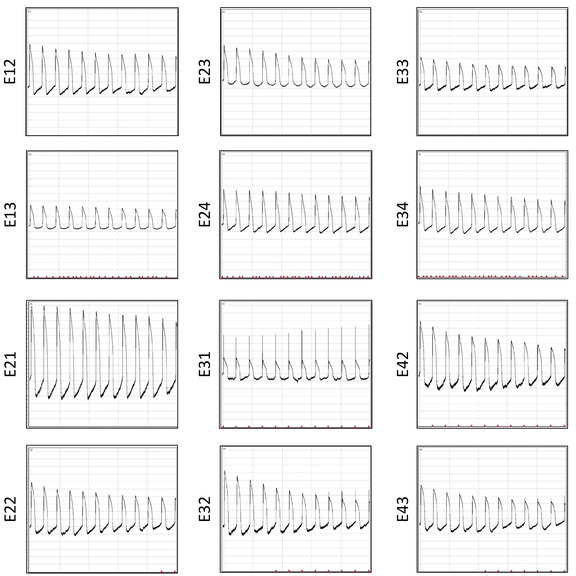
Şekil 12: altı restorasyondan sonra AP kayıtları. Aynı anda 12 elektrotlar arasında aynı zamanda 10 ' dan daha fazla Elektroporasyon kaydedilen AP dalga formları görüntülenir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 13: birden çok restorasyondan APD parametre histograları. Bireysel dalga formu için dağıtım çizimleri APD30 (A), APD80 (B), Nirengi (APD80— APD30) (C) ve kesirli kısaltma ((APD80— APD30)/(APD80)) (D) görüntülenir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Tamamlayıcı dosyalar. Videolar 1-3. Bu dosyayı indirmek Için lütfen buraya tıklayın.
Tartışmalar
Yıllar içinde, Meas uygulaması onların elektrofizyolojik özellikleri36,37,38,39çalışmak için heyecanlı hücrelerin FP ölçümleri yürütmek için sınırlı olmuştur. Sadece birkaç grup özel MEA tabanlı teknoloji18,29,30kullanarak elektrojenik hücrelerden AP izleri bildirdi. Ancak, bu yaklaşımlar aynı preparatlardan tekrarlanan kayıtlar için araştırılmamıştır. Birden fazla hiPSC-CM ağlarında aynı hücre sitesinden gün içinde aynı anda3APS okumak için yenilikçi ve doğru bir metodoloji geliştirdik. Yayınlanan çalışmamızda, yüksek hassasiyetle ve 1 μs temporal çözünürlüğe sahip birden fazla hiPSC-CM kültüründen AP dalga formu kitaplıkları oluşturmak için çok iyi bir mikro altın MEA platformu kullanıldı. Burada açıklanan protokol, yüksek verim AP kayıtları için sinsityal cm ağlarının verimli gelişimi için dizi üzerinde hipsc-CMS ' i kekilde açıklar. Protokolde çeşitli kritik adımlar şunlardır: 1) çoklu yüksek saflıkta toplu üretim için kalite kontrollü CMS için kriyoprezervasyonu bankacılık, 2) son derece uygun Post-çözülebilir CMS Pre-Kaplama ve olgunlaşma, 3) cm için multiwell MEA plaka tedavisi tohumlama, 4) hiPSC-CM kültür dağılma 30 gün MEA kaplama için farklılaşma sonrası, ve 5) çoklu yeniden kullanım için MEAs restorasyonu.
HiPSC farklılaşması toplu-toplu varyasyon deneysel sonuçları etkileyebilir dikkat etmek önemlidir. Farklılaşma Tek tabakalı yöntemi yüksek yüzde kardiyomiyosit üretimi için-evde optimize edildi3,40. Kültürlerimizin MLC2v ve TNNT2 belirteçleri FACS Analizi bir ≥ 90% ventrikül benzeri fenotip3göstermektedir. Bu kalite kontrollü kültürlerin deneysel çalışmalar için kriokonservirovannogo vardır. Mevcut farklılaşma yaklaşımlar nodal-, atriyal-ve ventrikül benzeri hücrelerin heterojen bir karışımı verim3,16,17,41. Bu nedenle, CM alt nüfus zenginleştirme için kullanılan stratejiler daha da kültürlerin özgüllüğü artırabilir. Ayrıca, doku mühendisliği yaklaşımlar olgunlaşma geliştirmek için istihdam edilebilir. Burada önerilen yöntemler, diğer CM kaynakları için kolayca uygulanabilir.
Mea kullanılarak kaydedilen AP dalga formları, optik haritalama42,43, tamamlayıcı metal oksit yarıiletken bazlı MEA18,21ve simüle AP ile kardiyomiyositlerin ağlarından kaydedilmiş olanlara benzer FP kayıtlarını kullanarak20. MEA Hai ve Spira25 ile AP ölçümlerinin mekanizmasını ele almak için electropore-elektrot arayüzünün kurulan keskin cam mikroelektrot tekniğini taklit ettiğini göstermiştir. Ancak, MEA sistemlerindeki electropore-elektrot arayüzünün kalibre edilmediğini ve amplitüün hassasiyet ve çözünürlüğün bir fonksiyonu olduğunu göz önüne alındığında, çalışmamızda istirahat membranı potansiyeli ve gerçek genlik değerleri kurulamaz. Tekniği. Yaklaşım, AP genliği söz konusu olduğunda optik eşlemede benzer sınırlamaları paylaşır.
Çok iyi MEA tabanlı FP/AP okumları burada bildirilen ilaç güvenliği değerlendirmesi için yeni olanaklar açık. Spontan olsa da, bu hiPSC-CM monolayers sürekli oranlarda yendi. Birden fazla ağda APD parametrelerinin analizi, elektrik heterojenliği hakkında bilgi sağlar (Şekil 13). Ancak, kapsamlı APD Restitüsyon analizlerinin önceki diyastolik aralıkları içermesi gerekir. Ayrıca, 96 h (Şekil 11B) üzerinden aynı hücre sitesinden kaydedilen yüksek kaliteli AP dalga formları, zaman içinde, gelişmede ve hastalıklarda değer olacak membran elektrodinamiklerini takip eden ilk rapordan biridir.
AP parametrelerini ölçmek için burada açıklanan protokol, test bileşikleri için doz-yanıt eğrileri oluşturmak için kullanılabilir. Son zamanlarda Edwards ve al.3tarafından bildirilen, norepinefrin doz tepkisi, isoproterenol ve E 4031 çeşitli repolarizasyon AŞAMALARıNDA APD için çizilir. Yayınlanmış çalışma, AP dalga formlarındaki doz bağımlı ince değişikliklerin gerçek zamanlı olarak tanımlanması için yaklaşımın doğruluğunu ve güvenilirliğini göstermiştir. Bu teknik, çeşitli elektrofizyolojik tepkiler anlamak için diğer bileşikler veya küçük molekül kütüphaneler için kolayca uzatılabilir.
Bu çalışmada sunulan AP ölçümleri için MEA merkezli yaklaşım sadece elektrofizyolog değil, aynı zamanda hücre biyologlar ve in-silico modelleyiciler için de ilgi olacaktır. Ayrıca, hipsc-CMS aynı hücre sitesinden FP/AP kayıtları araştırmacılar kısa bir süre içinde geniş bir dizi heyecanlı hücresel ağlar biyoelektrik veri kitaplıkları oluşturmak için sağlayacaktır. Bu kaynakların kullanılabilirliği ilaç keşifleri ve hastalık modelleme için değerli olacaktır.
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
Hiçbiri
Malzemeler
| Name | Company | Catalog Number | Comments |
| Accutase | Sigma Aldrich | A6964-100ML | cell dissociation solution |
| Acquisition software | Multichannel Systems | Multiwell-Screen v 1.9.2.0 | |
| B27 Supplement | ThermoFisher | 17504-044 | CM media supplement |
| Converter software | Multichannel Systems | MultiChannel DataManager | |
| DMEM/F12 | ThermoFisher | 11330-032 | |
| D-PBS | ThermoFisher | 14190-250 | |
| FBS | Fisher Scientific | SH3007103HI | |
| Fibronectin | Sigma Aldrich | F1141-5MG | |
| Geltrex | ThermoFisher | A1413202 | coating substrate |
| Interface board | Multichannel Systems | MCS-IFB 3.0 Multiboot Interface Board | |
| Multiwell MEA Plate | Multichannel Systems | 24W300/30G-288 | |
| RPMI 1640 | ThermoFisher | 11875-093 | CM base medium |
| Terg-a-zyme | Sigma Aldrich | Z273287-1EA | enzymatic detergent |
| Transfer pipettes, individually wrapped | Fisher Scientific | 1371148 | |
| Trypan Blue | Sigma Aldrich | T8154-100ML | |
| Ultrapure sterile water | ThermoFisher | 10977-023 | |
| 6-well tissue-culture treated plates | Fisher Scientific | 08-772-1B |
Referanslar
- Dambrot, C., Passier, R., Atsma, D., Mummery, C. L. Cardiomyocyte differentiation of pluripotent stem cells and their use as cardiac disease models. Biochemical Journal. 434 (1), 25-35 (2011).
- Dunn, K. K., Palecek, S. P. Engineering Scalable Manufacturing of High-Quality Stem Cell-Derived Cardiomyocytes for Cardiac Tissue Repair. Frontiers in medicine. 5, (2018).
- Edwards, S. L., et al. A Multiwell Cardiac muGMEA Platform for Action Potential Recordings from Human iPSC-Derived Cardiomyocyte Constructs. Stem Cell Reports. 11 (2), 522-536 (2018).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Huebsch, N., et al. Miniaturized iPS-Cell-Derived Cardiac Muscles for Physiologically Relevant Drug Response Analyses. Scientific Reports. 6, 24726(2016).
- Lundy, S. D., Zhu, W. Z., Regnier, M., Laflamme, M. A. Structural and functional maturation of cardiomyocytes derived from human pluripotent stem cells. Stem Cells and Development. 22 (14), 1991-2002 (2013).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), H2006-H2017 (2011).
- Sharma, A., et al. Use of human induced pluripotent stem cell-derived cardiomyocytes to assess drug cardiotoxicity. Nature Protocols. , (2018).
- Zhang, D., et al. Tissue-engineered cardiac patch for advanced functional maturation of human ESC-derived cardiomyocytes. Biomaterials. 34 (23), 5813-5820 (2013).
- Zhang, J., et al. Extracellular matrix promotes highly efficient cardiac differentiation of human pluripotent stem cells: the matrix sandwich method. Circulation Research. 111 (9), 1125-1136 (2012).
- Burridge, P. W., Holmstrom, A., Wu, J. C. Chemically Defined Culture and Cardiomyocyte Differentiation of Human Pluripotent Stem Cells. Current Protocols in Human Genetics. 87, (2015).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Burridge, P. W., Zambidis, E. T. Highly efficient directed differentiation of human induced pluripotent stem cells into cardiomyocytes. Methods in Molecular Biology. , 149-161 (2013).
- Laflamme, M. A., et al. Cardiomyocytes derived from human embryonic stem cells in pro-survival factors enhance function of infarcted rat hearts. Nature Biotechnology. 25 (9), 1015-1024 (2007).
- Sharma, A., et al. Derivation of highly purified cardiomyocytes from human induced pluripotent stem cells using small molecule-modulated differentiation and subsequent glucose starvation. Journal of Visualized Experiments. (97), (2015).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), (2014).
- Zhang, J., et al. Functional cardiomyocytes derived from human induced pluripotent stem cells. Circulation Research. 104 (4), e30-e41 (2009).
- Jans, D., et al. Action potential-based MEA platform for in vitro screening of drug-induced cardiotoxicity using human iPSCs and rat neonatal myocytes. Journal of Pharmacological and Toxicological Methods. 87, 48-52 (2017).
- Strauss, D. G., Blinova, K. Clinical Trials in a Dish. Trends in Pharmacological Science. 38 (1), 4-7 (2017).
- Tertoolen, L. G. J., Braam, S. R., van Meer, B. J., Passier, R., Mummery, C. L. Interpretation of field potentials measured on a multi electrode array in pharmacological toxicity screening on primary and human pluripotent stem cell-derived cardiomyocytes. Biochemical and Biophysical Research Communications. 497 (4), 1135-1141 (2018).
- Braeken, D., et al. Open-cell recording of action potentials using active electrode arrays. Lab Chip. 12 (21), 4397-4402 (2012).
- Otsuji, T. G., et al. Progressive maturation in contracting cardiomyocytes derived from human embryonic stem cells: Qualitative effects on electrophysiological responses to drugs. Stem Cell Research. 4 (3), 201-213 (2010).
- Shinozawa, T., Imahashi, K., Sawada, H., Furukawa, H., Takami, K. Determination of appropriate stage of human-induced pluripotent stem cell-derived cardiomyocytes for drug screening and pharmacological evaluation in vitro. Journal of Biomolecular Screening. 17 (9), 1192-1203 (2012).
- Raphel, F., et al. Identification of Ion Currents Components Generating Field Potential Recorded in MEA From hiPSC-CM. IEEE Transactions on Biomedical Engineering. 65 (6), 1311-1319 (2018).
- Hai, A., Spira, M. E. On-chip electroporation, membrane repair dynamics and transient in-cell recordings by arrays of gold mushroom-shaped microelectrodes. Lab Chip. 12 (16), 2865-2873 (2012).
- Xie, C., Lin, Z., Hanson, L., Cui, Y., Cui, B. Intracellular recording of action potentials by nanopillar electroporation. Nature Nanotechnology. 7 (3), 185-190 (2012).
- Cohen, A., Shappir, J., Yitzchaik, S., Spira, M. E. Reversible transition of extracellular field potential recordings to intracellular recordings of action potentials generated by neurons grown on transistors. Biosensors and Bioelectronics. 23 (6), 811-819 (2008).
- Ojovan, S. M., et al. A feasibility study of multi-site,intracellular recordings from mammalian neurons by extracellular gold mushroom-shaped microelectrodes. Scientific Reports. 5, 14100(2015).
- Shmoel, N., et al. Multisite electrophysiological recordings by self-assembled loose-patch-like junctions between cultured hippocampal neurons and mushroom-shaped microelectrodes. Scientific Reports. 6, 27110(2016).
- Lin, Z. C., Xie, C., Osakada, Y., Cui, Y., Cui, B. Iridium oxide nanotube electrodes for sensitive and prolonged intracellular measurement of action potentials. Nature Communications. 5, 3206(2014).
- Stett, A., Burkhardt, C., Weber, U., van Stiphout, P., Knott, T. CYTOCENTERING: a novel technique enabling automated cell-by-cell patch clamping with the CYTOPATCH chip. Receptors Channels. 9 (1), 59-66 (2003).
- Kanda, Y., Yamazaki, D., Osada, T., Yoshinaga, T., Sawada, K. Development of torsadogenic risk assessment using human induced pluripotent stem cell-derived cardiomyocytes: Japan iPS Cardiac Safety Assessment (JiCSA) update. Journal of Pharmacological Sciences. 138 (4), 233-239 (2018).
- Yang, X., Papoian, T. Moving beyond the comprehensive in vitro proarrhythmia assay: Use of human-induced pluripotent stem cell-derived cardiomyocytes to assess contractile effects associated with drug-induced structural cardiotoxicity. Journal of Applied Toxicology. 38 (9), 1166-1176 (2018).
- Sala, L., Bellin, M., Mummery, C. L. Integrating cardiomyocytes from human pluripotent stem cells in safety pharmacology: has the time come. British Journal of Pharmacology. 174 (21), 3749-3765 (2017).
- Zlochiver, V., Edwards, S., Joshi-Mukherjee, R. Longitudinal Cardiotoxic Effect of Doxorubicin in a Multicellular Cardiac Model. Biophysical Journal. 116 (3), (2019).
- Del Alamo, J. C., et al. High throughput physiological screening of iPSC-derived cardiomyocytes for drug development. Biochimica et Biophysica Acta. 1863 (7 Pt B), 1717-1727 (2016).
- Clements, M. Multielectrode Array (MEA) Assay for Profiling Electrophysiological Drug Effects in Human Stem Cell-Derived Cardiomyocytes. Current Protocols in Toxicology. 68, 21-22 (2016).
- Navarrete, E. G., et al. Screening drug-induced arrhythmia [corrected] using human induced pluripotent stem cell-derived cardiomyocytes and low-impedance microelectrode arrays. Circulation. 128 (11 Suppl 1), S3-S13 (2013).
- Harris, K., et al. Comparison of electrophysiological data from human-induced pluripotent stem cell-derived cardiomyocytes to functional preclinical safety assays. Toxicological Sciences. 134 (2), 412-426 (2013).
- Zlochiver, V., Edwards, S. L., Joshi-Mukherjee, R. Longitudinal Cardiotoxic Effect of Doxorubicin in a Multicellular Cardiac Model. Biophysical Journal. 116 (3), (2019).
- Waas, M., et al. Are These Cardiomyocytes? Protocol Development Reveals Impact of Sample Preparation on the Accuracy of Identifying Cardiomyocytes by Flow Cytometry. Stem Cell Reports. , (2019).
- Gorospe, G., et al. Automated grouping of action potentials of human embryonic stem cell-derived cardiomyocytes. IEEE Transactions on Biomedical Engineering. 61 (9), 2389-2395 (2014).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics & Molecular Biology. 120 (1-3), 3-17 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır