Method Article
Hücre Dışı Matriks Proteinlerine Hücre Yanıtlarını İncelemek Için Mikro-Desenleme için PRIMO Sistemini Kullanan Proteinlerin Işık Kaynaklı Moleküler Adsorpsiyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Genel amacımız, hücrelerin yönlendirilmiş aksonal büyümeye yol açan hücre dışı ipuçlarını nasıl algıladığını anlamaktır. Burada, akson büyümesini ve yol bulmayı yöneten belirli olayları incelemek için hücre dışı matriks bileşenlerinin tanımlanmış mikro desenlerini üretmek için kullanılan Proteinlerin Hafif Kaynaklı Moleküler Adsorpsiyon metodolojisini açıklıyoruz.
Özet
Hücreler, hücre dışı matrisin bileşimi ve geometrisi de dahil olmak üzere, hücrelerin kendileri tarafından sentezlenen ve yeniden biçimlendirilen çeşitli hücre dışı ipuçları nı hissederler. Burada, tek veya bir protein kombinasyonu kullanarak mikro desenli hücre dışı matriks (ECM) yüzeyleri üretmek için primo sistemini bir desenleme tekniği olarak Kullanarak Proteinlerin Işık Kaynaklı Moleküler Adsorpsiyon (LIMAP) yöntemini sunuyoruz. Yöntem, ECM desenlerinin mikron çözünürlükte, mükemmel tekrarlanabilirlik ile yazdırılmasını sağlar. Biz bir adım-adım protokol sağlamak ve nasıl nöronal yol bulma süreçlerini incelemek için uygulanabilir olduğunu göstermektedir. LIMAP, birden fazla bileşenin desenlenme kolaylığı ve herhangi bir geometri veya degradeye sahip bir desen oluşturma becerisi açısından mevcut mikro yazdırma yöntemlerine göre önemli avantajlara sahiptir. Protokol, hemen hemen her kimyasal bileşenin hücre kaderi ve hücre davranışına olan katkısını incelemek için kolayca uyarlanabilir. Son olarak, ortaya çıkabilecek ortak sorunları ve bunların nasıl önlenebileceğini tartışıyoruz.
Giriş
Son yıllarda biyolojik bilimler, malzeme bilimlerinin sağladığı gelişmelerden giderek daha fazla yararlanmış durumdadır. Önemli bir örnek, hücre çoğalması gibi hücresel yanıtları incelemek için kullanılabilen substratların mikro-desenleme1,2Farklılaşma3,4,5,6, hücre geçişi7,8,9ve yol bulma10,11. Multifoton heyecanlı fotokimya gibi yüzeylerin mikro desenleme sağlayan teknikler vardır12, AFM dip-kalem nanolitografi13, pin ve mürekkep püskürtmeli doğrudan baskı14, elektron ışını litografisi15veya mikroakışkan16. Ancak, biyolojik alanda yaygın olarak kullanılan iki teknik mikrotemas baskı17,18,19veya lazer destekli desenleme3(Şekil 1). Lazer destekli desenleme, mikrotemas baskıya kıyasla, desenlerde protein ve PEG stabilitesi ve hücre hapsi açısından daha güvenilir sonuçlar elde etmek için kabul edilir.20. Burada açıklanan mikro-desenleme için daha yeni bir yaklaşım Proteinlerin Işık Kaynaklı Moleküler Adsorpsiyon kullanımı21(LIMAP,Şekil 1 D) ticari olarak kullanılabilen bir sistem (PRIMO,Malzeme Tablosu). Yöntemlerin her biri aşağıda kısaca açıklanan avantajları ve sınırlamaları vardır. Microcontact baskı, litografili ustalardan oluşturulan istenilen mikro özelliklere sahip PDMS kalıplarını (pulları) kullanır. Pullar, daha sonra hücre kültürü substratına aktarılır (damgalı) seçilmiş bir protein ile kuluçkaya yatırılır.18(Şekil 1 A). Lazer destekli desenleme bir anti-faul film cleave UV ışığı kullanır22,23,24,25, daha sonra ilgi proteini ile kaplanabilir bölgeleri açığa (Şekil 1 B). Fotoğraf desenleme yaklaşımları ile elde edilen çözünürlük mikron aralığında iken25,26, Bu tekniklerin çoğu, örnekle temas halinde veya mikroskop hedefinin nesne düzleminde yer alan bir fotoğraf maskesi gerektirir23,27,28. Hem mikrotemas baskı hem de fotoğraf desenlemede maske gereksinimleri bir sınırlama olabilir; özel maskeler her geometrik desen ve boyut için gereklidir, hangi pahalı ve oluşturmak için zaman alıcı olabilir. Bu tekniklerin aksine, LIMAP bir maske gerektirmez (Şekil 1 D). LIMAP için PRIMO sisteminin kullanılması başlangıçta maliyet yoğun olabilir, çünkü ekipman satın alınması gerekir. Ancak, açık kaynak yazılım çok daha fazla özgürlük veren ve protein konsantrasyongradientleri kullanımı da dahil olmak üzere daha karmaşık deneyler sağlayan, herhangi bir istenilen geometri desenleri tasarlamak için kullanılır. PRIMO lazer, kullanıcı tarafından tanımlanan geometrilerin herhangi bir sayıda desenler oluşturmak için dijital kontrollü mikroayna cihazı (DMD) tarafından kontrol edilir ve yönetilir. LIMAP, kültür yüzeyinin hücre bağlanmasını engelleyen moleküllerle kaplanmasını gerektirir. Polietilen glikol (PEG) en sık böyle bir "antifouling" reaktif olarak kullanılır; bu cam veya plastik yüzey üzerinde yoğun bir anti-yapışkan film oluşturur29. Daha sonra, PEG filminin bir fotosisyon mekanizması aracılığıyla yüksek hassasiyetle kaldırılmasını sağlayan bir fotoğraf başlatıcısı eklenir30DMD kontrolü altında UV ışığına lokal maruz kalma ile. Bu PEG içermeyen bölgeler, lazerle kazınmış yüzeye adsorb proteinleri ile kaplanabilir ve mikro desen oluşturur. Lazer gücünü değiştirerek, farklı miktarlarda PEG kullanıcıprotein gradyanlar oluşturmak için izin yüzeyden kaldırılabilir. PEG kaldırma ve kaplama prosedürü aynı mikro-kuyuda iki veya daha fazla farklı protein ile desenler oluşturmak için tekrarlanabilir21. Oluşturulan mikro desenler hücreler için yapışkan yüzeyler sağlayarak hücre davranışlarının incelenmesine olanak sağlar. Çalışmalarımızda, nöronal hücre hattının (CAD (Cathecholaminergic-a diferansiye) hücrelerinin neurite veya akson yol bulma sını incelemek için mikro-desenleme kullanıyoruz.31) veya primer sıçan dorsal-kök ganglion (DRG) nöronlar, sırasıyla. Burada, LIMAP için adım adım bir protokol anahat (Şekil 2) ticari olarak mevcut PRIMO sistemini ve beraberindeki Leonardo yazılımını kullanarak. Aksonal yol bulgularını incelemek için kullandığımız tanımlanmış geometriler ve çoklu proteinler içeren örüntülerin üretimi için nasıl kullanılabileceğini gösteriyoruz. Ortaya çıkabilecek ortak sorunları ve bunların nasıl önlenebileceğini tartışıyoruz.
Protokol
1. Desen şablonlarının tasarımı
NOT: Desenleme şablonları dijital çizim yazılımı(Tablo Malzemeler)ile oluşturulur. Farklı gri seviyelerde çizim lazer yoğunlukları belirleyecektir. Desen şablonları tasarlamak için yazılım kullanmak, istenilen geometri ve degradelerle hızlı desenlerin oluşmasını sağlar(Şekil 3).
- Çizim yazılımını kullanarak istenen desen şablonu dijital olarak çizin. 1824 piksel uzunluğunda ve 1140 piksel genişlikte bir görüntü boyutu seçin (bu çalışmada 415 μm uzunluk ve 260 μm genişliğe karşılık gelir). Desen şablonu 8 bittiff dosyası olarak kaydedin.
NOT: Şablon oluşturmak için adım adım protokol, mikro desenleme ekipmanını(Malzeme Tablosu)ticarileştiren markanın isteği üzerine kullanılabilir.
2. Plazma temizliği
NOT: Optimal sonuçlar, desenleme den önce yüzeylerin plazma temizliğini gerektirir, bu da tüm organik maddeleri temizler ve yüzeyi aktive eder. Bu durumda, ortam havası yüzey aktivasyonu için yeterlidir. Plazma temizleyici(Malzeme Tablosu)1000-1300 mTorr proses basıncı ve 1-5 dakika için 29,6 W güç ile kullanıldı.
- 20 mm iç kuyu boyutuve 0,16-0,19 mm cam kalınlığına sahip cam alt çanak/es kullanın. Birden fazla koşulu test etmek için, 6-iyi cam alt çanak kullanın. Aksi takdirde, tek bir iyi cam alt çanak kullanın(Malzeme Tablosu).
NOT: Plazma temizleme ekipmanı(Tablo Malzemeler)ticarileştiren markanın isteği üzerine plazma temizliği için adım adım protokol mevcuttur.
3. Pasifasyon
NOT: Bu adım, cam yüzeye protein adsorpsiyonunu önleyen bir antifouling film oluşturur. PEG, bir antifouling ajan olarak protein adsorpsiyon29 yüksek direnç sunuyor. LIMAP, UV fotosisyonu aracılığıyla PEG'i yerel olarak kaldırmak için bir fotoğraf başlatıcısı kullanır. Protein/s ilgi daha sonra bu PEG içermeyen yüzeylere adsorb21, mikro desenler üreten olacaktır.
- PLL-PEG ile pasifasyon
- Steril koşullarda, iç cam alt kısma iyi sığdığından emin olmak için PDMS şablonlarını (Bkz. Şekil 4A,B ve Malzeme Tablosu)kesin ve steril koplarla iç mikro kuyu dolgularını çıkarın. Cama kalıplar yapıştırın ve çiller kullanarak.
- Şablonların cam kuyusu üzerinde sıkıca yapışarak pasifasyon işlemi sırasında sızıntılara neden olabilecek hava kabarcıklarının oluşmasını engelledi.
NOT: PDMS şablonları da yayınlanan protokolleri18,32kullanılarak şirket içinde imal edilebilir. - Fosfat tamponlu salinde (PBS) PLL-PEG çözeltisi(Tablo, 0.1 mg/mL) hazırlayın. Her mikro kuyuya 20 μL PLL-PEG çözeltisi ekleyin ve oda sıcaklığında 1 saat boyunca kuluçkaya yatırın.
- Mikro kuyulardan 15 μL PLL-PEG çıkarın ve kurumasına izin vermeden 20 μL PBS(Malzeme Tablosu)ile beş kez yıkayın.
NOT: Her zaman yaklaşık 5 μL PBS'yi yıkıntıların arasında bırakın. Küçük hacimleri göz önüne alındığında, mikro kuyular özellikle kurumaya karşı hassastır. Kurutma düşük kalitede mikro desenler neden olacaktır. - Kültür yemeğini PBS'de (kuyu başına 3 mL) 4 °C'de 3 güne kadar saklayın veya bir sonraki adıma devam edin (adım 3.1.5).
- Tek bir mikro kuyudan 18 μL PBS çıkarın (örneğin, sol üst mikro kuyu, Bkz. Şekil 4D),5 μL fotoğraf başlatıcı (PLPP, Malzeme Tablosu)ekleyin ve kalan mikro kuyularda 20 μL PBS bırakın. PLPP ile bu mikro-iyi bir referans deseni oluşturmak için kullanılacaktır (Şekil 4D,Ebakınız) sistem kalibrasyon adımı sırasında (adım 4). PLPP'yi ışıktan koruyun.
- Uzun ömürlü PEG-SVA ile pasifasyon
NOT: Anti-yapışkan yüzey oluşturmak için bir kullanabilirsiniz: 1) Bir PEG Poly-L-Lizin bağlı (PLL-PEG, adım 3.1) veya 2) bir PEG-succinate N-hidroksisksinimid (PEG-SVA). Birini veya diğer geçiş seçeneğini seçme kararı depolama seçeneklerine bağlıdır (bkz. adım 10). PEG-SVA ile kuluçkaya yatan kültür yemekleri iki kat pasivasyon ve fotodesen süresi gerektirir.- Adım 3.1.1'de açıklandığı gibi şablonlar hazırlayın.
- Her mikro kuyuya %0,01 Poli-L-L-Lizin (PLL, Malzeme Tablosu)20 μL ekleyin ve 30 dakika boyunca oda sıcaklığında pll ile ön kata inkülayın.
- Mikro kuyulardan 15 μL PLL çıkarın ve kuyuların kurumasına izin vermeden 20°L 1 HEPES tampon(Malzeme Tablosu)ile üç kez yıkayın.
NOT: Yıkıntıların arasında her zaman yaklaşık 5 μL HEPES veya PBS bırakın. Küçük hacimleri göz önüne alındığında, mikro kuyular özellikle kurumaya karşı hassastır. Kurutma düşük kalitede mikro desenler neden olacaktır. - PEG-SVA çözeltisi hazırlayın. PEG-SVA çözeltisi (HEPES tampon 1M'de 50 mg/mL) kullanımdan hemen önce her seferinde taze olarak hazırlanmalıdır. Mikro kuyu başına 20 μL PEG-SVA hazırlayın.
- HEPES tampon8-8.5 arasında bir pH olmalıdır. PEG-SVA çözeltisini pH kağıdı ile hazırlamadan önce HEPES pH'ı test edin. Peg-SVA'yı hassas bir ölçek kullanarak bir santrifüj tüpte tartın. Çözünene kadar HEPES tampon ve girdap 30 s ekleyin. Çözelti saydam olduğunda PEG-SVA tamamen çözülür.
NOT: SVA, PEG'in önceden kaplanmış PLL'ye bağlanmasını sağlayan esterdir. HEPES tamponu PEG-SVA'ya eklendikten sonra, SVA'nın yarı ömrü 15 dk dır ve hemen kullanılmalıdır. - Her mikro kuyuya 20 μL PEG-SVA çözeltisi ekleyin ve oda sıcaklığında kuluçkaya yatın, çünkü 1 saat boyunca 15 μL PEG-SVA'yı mikro kuyulardan çıkarın ve kuyuların kurumasına izin vermeden 20°L PBS(Malzeme Tablosu)ile beş kez yıkayın.
- Kültür yemeğini uzun süreli depolama için hazırlayın (1 aya kadar, 10.2 adıma bakın) veya bir sonraki adıma geçin (adım 3.2.8).
- Tek bir mikro kuyudan 18 μL PBS çıkarın (örneğin, sol üst mikro kuyu, Şekil 4D'yebakın), 5 μL PLPP(Malzeme Tablosu)ekleyin ve kalan mikro kuyularda 20 μL PBS bırakın. Bu mikro-kuyu bir referans deseni oluşturmak için kullanılacaktır (Bkz. Fi gure 4D, E). PLPP'nin mikro kuyunun tüm yüzeyinde homojen olduğundan emin olun. PLPP'yi ışıktan koruyun.
4. Sistem kalibrasyonu
NOT: Bu adımlarda, lazerin odağı belirli kültür çanak türüne göre ayarlanır (adım 4.1). Bir referans deseni sadece bir mikro-kuyu (adım 4.2) bir protein çözeltisi (adım 4.3) ile kuluçka lazer (adım 4.4), keskin ve tanımlanmış desenler elde etmek için gerekli optimum odak koşulları sağlamak için takip oluşturulur.
- Lazer kalibrasyonu
NOT: Kalibrasyon işlemi sırasında, bir kalibrasyon lazer görüntü floresan vurgulu cam yüzeye yansıtılır (kalibrasyon iyi, bir floresan vurgulayıcı ile işaretlenmiş, Şekil 4C), hangi odaklanmak için konulması gereken Mikroskop.- Boş bir iç cam kuyusu işaretlemek için floresan vurgulayıcı(Malzeme Tablosu)kullanın.
NOT: Kalibrasyon, mikro desenlerin üretileceği kültür çanağı ile aynı cam kalınlığına (0.16-0.19 mm) sahip olmalıdır. 6 kuyulu cam alt çanak kullanılıyorsa, kalibrasyon için boş bir kuyu kullanılabilir ve steril koşullarda floresan vurgulayıcı ile işaretlenmelidir. - Mikroskobu, sahneyi ve bilgisayarı açın. PRIMO mikro desenleme ekipmanını, Micro-manager'ı ve Leonardo yazılımını açın. Leonardo yazılım Eklentilerialtında Micro-manager aracılığıyla işletilmektedir. Malzeme Tablosu'nda ekipman ve yazılımın marka/katalog numaralarını kontrol edin.
- Leonardo'nun ilk menüsünde Kalibrasyon'useçin. Özel PRIMO filtre küpü filtre taretinde doğru konumda (optik yol) olup olmadığını kontrol edin; hem mikroskopta hem de Leonardo yazılımında 20X hedefini (0,75 DIC S Plan Flor, faz halkası yok) seçin.
NOT: Bu protokol Leonardo sürüm 4.4'e göre ayarlanmıştır. Protokolün diğer sürümler için ayarlanması gerekebilir. - Daha önce vurgulanan kalibrasyonu(Şekil 4C)hedefin üzerine yerleştirin. Kamera yolunu seçin. Hem PRIMO logosunun hem de etiket çizgisinin lazer projeksiyonu hücrelerinizin odaknoktası olana kadar objektif odağı ayarlayın.
- 25 ms'de varsayılan kamera pozlama süresini bırakın.
- Daha sonra kalibrasyonzasyonzin Z konumu olarak adlandırılan odak düzleminin Z konumunu (hedefin numuneye yüksekliği) kaydedin. Bu, referans desen oluşturmadan sonra elde edilen en uygun odaklama yaklaşık olacaktır (bkz. adım 4.2-4.4).
- Boş bir iç cam kuyusu işaretlemek için floresan vurgulayıcı(Malzeme Tablosu)kullanın.
- Başvuru deseni
- Kültür çanasını, fotoğraf başlatıcısını (referans deseni mikro-kuyusu, Şekil 4D)içeren mikro kuyuyla hedefin üzerine yerleştirin ve Leonardo yazılımında Desen'i seçin.
- Kamera aracılığıyla aktarılan ışıkla mikro kuyunun kenarını görselleştirin ve sağ menüden Yatırım Getirisi simgesini seçin. Yatırım getirisi çemberinin çapını 4000 μm'ye ayarlayın ve dijital yatırım getirisinin kenarını mevcut mikro kuyunun kenarıyla hizala.
- Sahneyi mikro kuyunun kenarlarında hareket ettirerek dijital Yatırım Getirisi ile mevcut mikro kuyu arasında doğru bir çakışma olduğundan emin olun. YG konumu sahne hareketleri ile birleştiğinde olacaktır.
- RoI'yi istenilen konumda kilitlemek için Leonardo yazılımında Kilitle'yi seçin. İletilen ışığı kapatın.
- Tasarım birimi olarak Yatırım Getirisi'ne yansıtılacak istenilen desen şablonu şablonuna yüklemek için PRIMO'yu seçin (bkz. Şekil 5). Desenler, Eylemler olarak adlandırılan ve yazılımdaki Eylemler menüsünde gösterilen açılır listede görünür.
NOT: Desen şablonlarının daha önce tasarlanması (bkz. adım 1) ve şablonu yazılıma yüklemeden önce 8 bittiff dosyası olarak kaydedilmesi gerekir. - Başvuru deseni için yalnızca küçük bir desen gereklidir; örneğin, 3 satır, 1 sütun (bkz. Şekil 4E ve Şekil 5B). Çoğaltma menüsünde, istenilen sayıda sütun ve satır (Leonardo yazılımındakisatırlar) ayarlayın. Desen tasarımının dijital önizlemesini izlemek için Yenile'yi tıklatın.
- Çoğaltma menüsünde lazer dozu ayarlayın. Bu ayarda ve PLL-PEG kullanılarak en uygun lazer dozu1390 mJ/mm 2'dir.
NOT: Lazer gücü 5-7,5 mW/mm2arasında değişebilir. Bu durumda, 7.5 mW/mm2, hangi 1390 mJ / mm2bir lazer dozu kullanarak, her tasarım birimi desen yaklaşık 30 s sürer. Kültür çanak yüzeyi PEG-SVA ile pasifite edilirse daha yüksek lazer dozları gerekebilir (PLL-PEG'e göre yaklaşık iki kat lazer dozu). Bunun önceden test edilmesi gerekiyor. - Mikro kuyunun çevresel bölgesine (örneğin, üst kısım) mikro kuyunun desen üretimi (merkezi bölge) için ana ilgi bölgesinden uzağa gidin (Şekil 4E'yebakın) ve Kilit'iseçin. Desen görüntülenene kadar bekleyin.
- Odağı kalibrasyonun Z konumuna ayarlayın (bkz. adım 4.1.6).
NOT: Başka bir kullanıcı fotodesenleme turları arasında aynı mikroskop kullanıyorsa ek bir sistem kalibrasyon adımı yapmanız önerilir. - Desenlemeye başlamak için Oynat simgesini seçin. Lazerin yazılımda açık olduğundan emin olun. Desenleme işlemi bitene kadar bekleyin. Desenleme süresi Tahmini Zaman panelinde görüntülenir. Leonardo yazılım sürümünde 4.4 desenleme tüm Eylemler Visualization menüsündemavi göründüğünde tamamlanır.
- Referans deseninde protein kuluçka
- Steril koşullarda, PLPP'yi çıkarmak için referans desenini 20 μL PBS ile üç kez yıkayın.
- Referans deseni mikro-kuyuya floresan etiketli ECM proteininin (PBS'de 10 μg/mL laminin, fibronektin veya fibrinojen) 20 μL'lik kısmını ekleyin, Malzeme Tablosu'na bakın ve adım 6'ya ekleyin. 10-20 dakika oda sıcaklığında inkübül (proteine bağlı olarak) ışıktan korunur (çanak alüminyum folyo sarın).
- Kuluçkadan sonra 18 μL protein çözeltisini çıkarın ve 20 μL PBS ile üç kez yıkayın; bir referans deseni oluşturmak için kullanılmayan mikro kuyuları saklayın (Bkz. Şekil 4D,E)PBS'nin 20 μL'sinde.
- Görselleştirme ve optimum lazer odağı ayarlama
- Bir epifloresan mikroskobu, 20X objektif ve uygun yazılım (Malzeme Tablosubu çalışmada kullanılan yazılım kontrol) kullanarak referans deseni görselleştirin. Başvuru deseni, başvuru deseninin oluşturulduğu çevresel bölgede (örneğin, üst kuyu bölgesi) görünür olmalıdır (bkz. Şekil 4E).
- Kamera yolundaki desen kenarlarına odaklanmayı ayarlayın. Z konumunu referans desenine en iyi şekilde odaklanın. Bu ayarlanmış Z pozisyonu sonraki desenleme için kullanılan en uygun lazer odak noktası olacaktır.
5. Yazılım kurulumu ve fotodesenleme
NOT: Sistemin kalibrasyonu sağlandıktan sonra (adım 4), kullanıcı her birinde bir veya birden fazla protein için desen oluşturma seçeneğiyle, fotoğraf desenleme için istenilen desen şablonlarını (şablon yapılandırması, Şekil 5)yükler. mikro-iyi. Mikro-desenleme işlemi fotodesenleme ve protein kuluçka adımlarını içerir (Bkz. Şekil 2).
- Steril koşullarda, tüm mikro kuyulardan 18 μL PBS çıkarın ve her mikro kuyuya 5 μL PLPP ekleyin. PLPP'nin mikro kuyuların tüm yüzeyinde homojen olduğundan emin olun.
- Kültür çanasını referans deseni mikro-kuyusu(Şekil 4D,E)ile hedefin üzerine yerleştirin ve Leonardo yazılımında Desen'i seçin.
- Kamera yolu üzerinden aktarılan ışıkla mikro kuyuyu görselleştirin ve Yatırım Getirisi simgesini seçin. Yatırım getirisinin çapını 4.000 m'ye ayarlayın ve dijital yatırım getirisinin kenarını mevcut mikro kuyunun kenarına kadar örtüştürün. Kilit'iseçin.
NOT: YG'nin şekli ve çapı, kullanılan PDMS şablonunun tasarımına ve boyutuna bağlıdır. Örneğin, 5.000 x 5.000 μm PDMS kareli şablonlar kullanıyorsanız, 5.000 x 5.000 μm kareli yatırım getirisi kullanın. - Yemeğin her mikro kuyusu için çakışan adımı (adım 5,3) tekrarlayın. Tamamlandıktan sonra, iletilen ışığı kapatın.
- Referans deseni mikro-iyi merkezine gidin, uzak referans desen bölgesinden ve istenen desen şablonu yüklemek için PRIMO seçin, hangi bir tasarım birimi olarak Yatırım Getirisi yansıtılan olacak (Şekil 5'ebakın). Desenler, Eylemler olarak adlandırılan ve yazılımdaki Eylemler menüsünde gösterilen açılır listede görünür.
NOT: Desen şablonlarının denemeden önce tasarlanıp şablonu yazılıma yüklemeden önce 8 bittiff dosyası olarak kaydedilmesi gerekir. - Tüm mikro-kuyu boyunca bir desen oluşturmak için, tasarım biriminin çoğaltılması gerekir. Bir tasarım ünitesi mikro kuyu alanının yaklaşık 0,1 mm2'sini kaplar. Çoğaltma menüsünde, istenilen sütun ve satır sayısını ayarlayın (Yazılımdakisatırlar) (Bkz. Şekil 5).
- Sürekli bir desen oluşturmak için, sütunlar ve satırlar arasındaki aralığı ayarlayın; Bu çalışmada, kolonlar arasında -20 ila -35 m aralık (negatif boşluk) kullanılarak sürekli çizgilerin desenleri elde edilir. Bu negatif aralık tasarım birimleri arasında bir çakışma oluşturur(Şekil 5B,C).
- Çoğaltma menüsünde lazer dozu ayarlayın. Bu ayarda ve PLL-PEG kullanılarak en uygun lazer dozu1390 mJ/mm 2'dir. Desenleme süresi Tahmini Zaman panelinde görüntülenir.
NOT: Bu durumda lazer gücü 7,5 mW/mm2, 1390 mJ/mm2doz kullanarak, her tasarım ünitesi desen yaklaşık 30 s alarak. Örneğin, 4 kolveve 4satır (yaklaşık 1,6 mm2)çoğaltılan bir tasarım ünitesinin desenli olması 8 dakika sürer. Kültür çanak yüzeyi PEG-SVA ile pasifite edilirse daha yüksek lazer dozları gerekebilir (PLL-PEG'e göre yaklaşık iki kat lazer dozu). - Kilitle'yi seçin ve desen görüntülenene kadar bekleyin.
- Bir desenin parametrelerini güncelleştirmek için, ilgili Eylem'itıklatın, ardından parametrelerin kilidini açın ve güncelleştirin. Desen güncelleştirmesi tamamlandığında yeniden Kilitle'yi seçin.
- Aynı mikro kuyuda birden fazla proteinin (sıralı mikro desenleme turları) desenlerinin doğru bir şekilde hizalanmasını gerektirir. Bu tür bir hizalama elde etmek için, aynı anda istenen desen şablonları (birinci ve ikinci fotodesen lisalar) tüm setleri yükleyin.
- Desen şablonlarının çoğaltma ve doz parametrelerini ayarlayın. Parametreler ayarlandıktan sonra desenler Eylemler listesinde eylemler olarak görünür. Bu şablon yapılandırmayı yazılımda bir dosya olarak kaydedin (bkz. Şekil 5D).
- Eylemler listesinde, yalnızca ilk desenleme turunda desenlenecek belirli eylemleri seçin ve ikinci desenleme turunda desenlenecek eylemleri seçin (Bkz. Şekil 5D).
- Referans deseninin adım 4.2'de üretildiği alana gidin (örneğin, referans deseninin en üst bölgesi mikro-kuyu, bkz. Şekil 4E). Odağı en uygun Z pozisyonuna ayarlayın (adım 4.4'te elde edilen).
NOT: Kullanılan mikroskoba (varsa) mükemmel odaklama sistemi seçilmesi şiddetle tavsiye edilir ve bu da desenleme için en uygun Z pozisyonunun tüm fotodesenleme işlemi boyunca korunmasını sağlar. - Desenlemeye başlamak için Oynat simgesini seçin. Desenleme süresi Tahmini Zaman panelinde görüntülenir. Leonardo yazılım sürümünde 4.4 desenleme tüm Eylemler Visualization menüsünde mavi göründüğünde tamamlanır.
6. Protein kuluçka
NOT: Mikro kuyular ECM proteinleri ile kuluçkaya yatırılır (tercihen floresan etiketli). Bunlar yalnızca 5. Her kuyu, 4 mikro kuyulu bir PDMS şablonu içerir ve bu şablon, aynı anda 4 farklı koşulun test edilmesine olanak sağlar, örneğin, her mikro kuyuda farklı bir proteinin kuluçkaya yatılması (Bkz. Şekil 4D).
- Mikro desenleri görselleştirmek için floresan etiketli proteinler (örneğin, kırmızı veya yeşil floresanlara konjuge laminin, fibronektin veya fibrinojen) kullanın (bkz. adım 6.7 ve 9.4). Alternatif olarak, adsorbe edilmemiş proteinler immünoresans kullanılarak daha sonraki aşamalarda görselleştirilebilir.
NOT: ECM proteinleri (örneğin, fibronektin) mevcut protokoller33 ve ticari olarak kullanılabilir floresan etiketleme kitleri (yani, Alexa 488 etiketleme kiti) kullanılarak etiketlenebilir veya kolayca etiketlenmiş (örneğin, konjuge fibrinogen-488 veya laminin-kırmızı floresan rhodamine, Malzeme Tablosubakınız). - Steril koşullarda, istenilen ECM protein konsantrasyonu (PBS'de 10 μg/mL laminin, fibronektin veya fibrinojen, Bkz. Malzeme Tablosu ve adım 4.3).
NOT: Floresan etiketli ECM proteinleri ışığa duyarlıdır ve ışıktan korunmalıdır (alüminyum folyo yakar) ve her zaman buzüzerinde tutulmalıdır. - Steril koşullarda, PLPP'yi çıkarmak için mikro kuyuları 20 μL PBS ile üç kez yıkayın.
- Tüm mikro kuyulardan 18 μL PBS çıkarın ve her mikro kuyuya 20 μL ECM protein çözeltisi ekleyin. 20-30 dakika oda sıcaklığında kuluçka ve ışıktan koruyun.
NOT: Optimal kaplama kuluçka süreleri proteinlerin türüne ve konsantrasyonuna bağlı olarak değişebilir. - Kuluçkadan sonra 15 μL ECM protein çözeltisini çıkarın ve mikro kuyuları 20 μL PBS ile üç kez yıkayın.
NOT: Her zaman yaklaşık 5 μL PBS'yi yıkıntıların arasında bırakın. - Eğer sadece bir protein (mikro desenleme bir tur) ile desenleme, kültür çanak depolama (adım 10) ya da hücre kaplama (adım 11 ve Şekil 2bakın) devam edin. Aynı mikro kuyuda farklı bir proteinle ikinci bir mikro desenleme turu yapıyorsanız, ya kültür çanağının depolanmasına (adım 10) ya da spesifik olmayan bağlama alanlarını engellemeye devam edin (adım 7 ve Bkz. Şekil 2).
- İsteğe bağlı kalite kontrol adımı: hücreleri kaplamadan önce epifloresan mikroskobu kullanarak yazdırılan desenleri görselleştirin ve görüntülendi. Uygun floresan kanalları seçin ve pozlama sürelerini buna göre ayarlayın.
NOT: Deneyler arasındaki desenlerin floresan yoğunluğunu karşılaştırmak için, aynı proteinler için aynı maruz kalma sürelerini kullanmak esastır.
7. Spesifik olmayan bağlanma bölgelerinin engellenmesi (sadece birden fazla protein delemi için)
NOT: Aynı mikro kuyuda birden fazla protein içeren mikro desenleme sıralı desenleme adımlarını içerir (bkz. Şekil 2). İkinci kuluçkaproteininin (adım 9) ilk kuluçkaya yatan proteine (adım 6) bağlanması yla oluşan çapraz bağlanmayı önlemek için mikro kuyulara bir bloke edici madde (PLL-PEG veya BSA) eklenir ve böylece desenler içindeki proteinlerin karışımından kaçınılır.
- Steril koşullarda, çapraz bağlanması önlemek için bir engelleme adımı olarak 20 μL PLL-PEG (PBS'de 0.1 mg/mL) veya BSA (PBS'de %1 BSA) ekleyin.
NOT: Engelleme verimi kullanılan proteinlerin doğasına ve aralarındaki yakınlığa bağlı olarak değişebilir. Hem PLL-PEG hem de BSA'nın önceden bloke edici ajanlar olarak test etmesi önerilir (Şekil 10D-I). - 1 saat oda sıcaklığında inkübasyon engelleme maddesi ve ışıktan koruyun. 15 μL'lik blokaj ı çıkarın ve 20 μL PBS ile tüm mikro kuyuları üç kez yıkayın. Her zaman yaklaşık 5 μL PBS'yi yıkıntıların arasında bırakın.
- Tüm mikro kuyulardan 18 μL PBS çıkarın ve her mikro kuyuya 5 μL PLPP ekleyerek PLPP'nin mikro kuyuların tüm yüzeyinde homojen olmasını sağlar.
8. İkinci tur fotodesenleme (sadece birden fazla protein deseni için)
NOT: Fotodesenleme ve protein kuluçkasının ilk turundan sonra bir mikro desen oluşturulur. Fotodesenlemenin ikinci turunda, ikinci proteinin deseni aynı mikro kuyuda üretilecektir (Bkz. Şekil 2C ve Şekil 5D). Yazılımda, bu turda desenlenecek doğru desen şablonlarını (eylemler) seçin (Bkz. Şekil 5D).
- İlk mikro kuyuya gidin (Şekil 4D). Dijital Yatırım Getirisi ile mikro kuyu arasında uygun örtüşme olduğundan emin olun.
- Daha önce kaydedilmiş şablon yapılandırmasını yükleyin (adım 5.12) ve ikinci fotodesen leme turunda desenlenecek eylemleri seçin (ilk turdaki eylemleri seçin, Bkz. Şekil 5D).
- Desenlemeye başlamak için Oynat simgesini seçin. Lazerin yazılımda açık olduğundan emin olun.
9. İkinci protein kuluçka turu (sadece birden fazla protein paterni için)
NOT: Protokolün bu bölümünde, floresan etiketli protein/s fotodesenlemenin ikinci turundan sonra kültür kabına kuluçkaya yatılacaktır.
- Steril koşullarda, PLPP'yi çıkarmak için mikro kuyuyu 20 μL PBS ile üç kez yıkayın. 18 μL PBS çıkarın ve her mikro kuyuya 20 μL ECM protein çözeltisi ekleyin. 20-30 dakika oda sıcaklığında kuluçka ve ışıktan koruyun.
NOT: Optimal kaplama kuluçka süreleri proteinlerin türüne ve konsantrasyonuna bağlı olarak değişebilir. - Kuluçkadan sonra 15 μL ECM protein çözeltisini çıkarın ve mikro kuyuları 20 μL PBS ile üç kez yıkayın. Her zaman yaklaşık 5 μL PBS'yi yıkıntıların arasında bırakın.
- Kültür çanağının (adım 10) veya hücre kaplamasının depolanmasına devam edin (adım 11 ve Bkz. Şekil 2).
- İsteğe bağlı kalite kontrol adımı: epifloresan mikroskobu kullanarak, hücreleri kaplamadan önce yazdırılan desenleri görselleştirin ve görüntüleyin. Uygun floresan kanalları seçin ve maruz kalma süresini ayarlayın.
NOT: Deneyler arasındaki desenlerin floresan yoğunluğunu karşılaştırmak için, aynı proteinler için aynı maruz kalma sürelerini kullanmak esastır.
10. Mikro desenlerin depolanması
NOT: Adsorbe proteiniçeren mikro desenler protokolün farklı adımlarında saklanabilir (Bkz. Şekil 2). Birden fazla proteinle mikro desenleme varsa, mikro desenler mikro desenlemenin ilk turundan sonra veya mikro desenlemenin iki sıralı turu tamamlandıktan sonra depolanabilir (bkz. Şekil 2B).
- PLL-PEG ile pasifolarak etkinleştirildiğinde, mikro desenleri PBS'de (kuyu başına 3 mL) 4 °C'de 3 güne kadar saklayın.
- Kültür çanak PEG-SVA ile pasifleştirilmiş ise, mikro desenler 1 aya kadar saklanabilir. Bunu yapmak için, mikro desenleri çift distile deiyonize su ile yoğun bir şekilde durulayın ve steril bir argon veya azot tabancası ile kurulayın, ancak normal hava da kullanılabilir. Kuruduktan sonra mikro desenler 4 °C'de 1 aya kadar saklanabilir (PRIMO sistem destek ekibi, kişisel iletişim).
11. Kaplama hücreleri
NOT: Sonraki adımlarda hücreler hazırlanan mikro desenli kültür çanak/es üzerine kaplanır. Bu çalışmalarda nöronal hücre hattı (CAD hücreleri) kullanılır31. Ancak bu protokol, diğer hücre ilgi türlerini incelemek için ayarlanabilir (hücre kaplama protokolünü gerektiği gibi ayarlayın).
- Farklılaşma ortamı kullanarak 48 saat için CAD hücrelerini ayırt edin (DMEM %1 Glutamin ile desteklenir, serumsuz, ve %1 Kalem/Strep ile bkz.
- Tüm mikro kuyuları kaplayan ve kültür çanamasını 37 °C, %5 CO2 kuluçka makinesine yerleştiren, iç cam kuyudaki hücrelerle orta plaka 1 mL.
Sonuçlar
Yukarıdaki protokolün ardından mikro desenli yüzeyler, ECM protein / s ilgi ile kaplı sonuçları. Bu desenleri nöronal yol bulmayı izlemek için kullanıyoruz.
Oluşturulan desenler şablonun kesin bir temsili olmalıdır. Bir tasarım birimini (Şekil 5 B) temsil eden dijital desen şablonunun(Şekil 5B)20 ila 2 μm genişliğinde, etiketli olarak kaplanmış olarak tanımlanmış mikro desenlerle sonuçlandığı Şekil 6'da bir örnek gösterilmiştir. Fibrinojen (Şekil 6B). ImageJ kullanılarak, floresan yoğunluk ölçümleri hem dikey(Şekil 6C)hem de yatay olarak(Şekil 6E)şerit boyunca ve her şeritten 15 μm yukarıdan ilgili bir arka plan bölgesinden elde edildi. Arka plan ölçümleri, her şerit genişliği için desen ölçümlerinden çıkarıldı.
Sistemin bir sınırlaması, baskı özellikleri ≥20 μm iken, merkeze göre desen kenarlarında daha yüksek yoğunluklu sinyal(Şekil 6D, ilk tepe noktası) bir kenar efekti gözlemlenebildiğidir. floresan yoğunluk profili). Deneylerimizde çözünürlük sınırı yaklaşık 2 μm idi; bu genişlikte önemli bir azalma gözlemledik (%yaklaşık %50) fibrinojen floresan yoğunluğunda daha geniş çizgilerin yoğunluğuna göre(Şekil 6F,G). PRIMO sistemi ve burada özetlenen protokol kullanılarak yapılan desenler, dört ayrı çoğaltılmış tasarım biriminden 2 μm genişlik için ölçülen ortalama floresan yoğunluğunun en yüksek standart sapması ile tekrarlanabilir desenler üretilmiştir(Şekil 6 G). Desenli çizgiler arasındaki varyasyonda da düşük olduğu tespit edilmiştir; varyasyon katsayısı %3 ile %10 arasında değişmekteydi ve 20 μm ve 2 μm şeritler en büyük iç varyasyona sahipti. Bu, sırasıyla kenar efektinin ve sistemin çözünürlük sınırının bir sonucu olabilir. Bu ölçümler için, bu görüntüleri elde etmek için kullanılan hedeften kaynaklanan düzensiz aydınlatmayı önlemek için sadece çizgilerin merkezindeki yoğunluğu ölçtük (vinyet, Şekil 6E).
Bazı deneyler, tanımlanmış protein konsantrasyonları gerektiren sorular içerebilir, bu da iki şekilde elde edilebilir: 1) protein konsantrasyonu değişen(Şekil 7A,B). Farklı laminin konsantrasyonları ile kuluçka, önemli ölçüde farklı floresan yoğunlukları ile sonuçlanır, yüksek protein konsantrasyonları ile artan(Şekil 7B). 2) Anti-yapışkan film (PEG) cleave için kullanılan lazer dozu çeşitli olabilir. Daha yüksek lazer dozları daha büyük ölçüde antifouling film kaldıracak, ilgi proteinleri için daha bağlayıcı siteler üreten(Şekil 7C,D) önemli ölçüde farklı floresan yoğunlukları ile sonuçlanan, yüksek lazer ile artan dozlar (Şekil 7D).
Lazer dozu değişen aynı desen içinde protein gradyanların nesil sağlar. Bu şekil 8Agörüntülenir , bir degrade şablonu farklı greyscale düzeyleri kullanılarak tasarlanmıştır, siyah (hiçbir lazer gücü) beyaz (maksimum lazer gücü).
Lazer yoğunluğu şablonun gri tonlama düzeyiyle orantılıdır (8 bitlik bir görüntüde 0 ile 255 arasında değişen), UV aydınlatma degradeleri oluşturur. Degrade şerit boyunca floresan yoğunluk profilinin ölçümü desen şablonunda(Şekil 8B) ve oluşturulan degrade deseninde(Şekil 8C,D)doğrusaldır. Bu, aynı şablon ve degrade deseni içindeki tüm degrade çizgileri arasında tekrarlanabilir(Şekil 8B,D). Bu tür degradelerin üretimi son derece yararlıdır ve hücrelerin genellikle biyoaktif proteinlerin degradelerine yanıt verebildiği in vivo ortamları taklit etmeye yardımcı olur34,35,36,37.
Hücreler hücre dışı ortamları değiştirmeyi hissederler, ancak hücreler bu tür değişikliklerle karşılaştığında hücre davranışının incelenmesini sağlayan tahliller sınırlıdır. LIMAP aynı mikro-kuyuda birden fazla protein ile mikro-desen için kullanılabilir. Örnekler Şekil 9'da fibronektin (yatay) ve laminin (dikey) şeritleri ile çapraz desenler oluşturulduğunda gösterilmiştir. Birden fazla proteiniçeren desenler oluştururken, proteinlerin çapraz bağlanmasını önlemek için birinci ve ikinci protein kuluçka arasında bir engelleme adımı kullanmak çok önemlidir (bkz. adım 7). Kaplama için kullanılan proteinlerin biyokimyasal özelliklerine bağlı olarak blokaj verimi değişebilir ve PLL-PEG (0.1 mg/mL) ve BSA (%1) dahil olmak üzere çeşitli blokaj tamponlarının test edilmesinizi tavsiye ederiz. Bu çapraz bağlama etkisini değerlendirmek için ImageJ (Şekil 9) kullanarak floresan yoğunluk ölçümleri yaptık ve fibronektin ve laminin için PLL-PEG tamponu (0.1 mg/mL) kullanılarak çapraz bağlamanın önemli ölçüde azaltılabilen bir şekilde çapraz desenler (Şekil 9D,H).
Oluşturulan çapraz desenler CAD hücreleri ile hücresel tahliller için kullanılmıştır (Şekil 10A,B) veya sıçan dorsal kök ganglion (DRG) nöronlar (Şekil 10C). Onların nöritler (CAD) ve aksonları (DRG) farklı çizgiler boyunca büyür. CAD hücreleri, primer nöronlara göre benzer bir integrin ekspresyonu profili gösterdikleri ve kültürde 48 saat sonra aktin açısından zengin büyüme konileri sergiledikleri için nöronal model olarak kullanılırlar(Şekil 10B),onları yol bulmak için uygun hale getirirler. Çalışmaları.
Primer nöronlara doğru oluşturulan mikro desenlerin olası sitotoksik etkilerini araştırmak için, DRG nöronlar izole edildi ve daha önce yayınlanmış bir protokol38aşağıdaki mikro desenler kültürlü . Sonuçlar, primer nöronların mikro desenli ortamı tolere ettiğini göstermektedir (Şekil 10C). Şu anda çeşitli ECM proteinlerinin aksonal (neurite) yol bulmayı nasıl etkilediğini inceliyoruz. CAD hücrelerinde bulunan kavramların ön kanıtı DRG nöronlar kullanılarak daha fazla araştırılacaktır. Oluşturulan mikro desenlerin kalitesini doğrulamak için, hücre kaplamasına geçmeden önce desen kenarlarının iyi tanımlanmış olduğundan emin olmak için floresan mikroskopi ile görüntü desenleri istenir. Görüntüleme işlemi sırasında, verilerin arka analizini ve yorumlanmasını etkileyen çevresel kararma etkisinden (vinyet) kaçınmak için mikroskop ve kamera arasındaki optik ayarlamanın sağlanması önemlidir. Ayrıca, desenleri görüntülemek ve bu görüntüyü desen görüntüsünden çıkarmak için kullanılacak aynı pozlama sürelerini kullanarak desensiz bir bölgenin görüntüsünü elde edin.
Özetle, kaliteli mikro desen üretimi için protein konsantrasyonu(Şekil 7A,B), lazer dozlarının(Şekil 7C,D),protein arka plan düzeylerinin(Şekil 6E,F,H)ve birden fazla protein kullanırken etkili engelleme adımı(Şekil 9) Kesin olarak, LIMAP ile oluşturulan mikro desenlerin kalitesi hücresel tahlillerden güvenilir ve tekrarlanabilir veriler elde etmek için gereklidir.

Şekil 1: Mikro-desenleme teknikleri şeması: mikrotemas baskı ve lazer destekli desenleme. (A) Microcontact baskı ilgi proteini ile kuluçka ya da bir PDMS damgaoluşturmak için tanımlanmış mikro özelliklere sahip bir litografili ana kullanır. Bu protein daha sonra bir cam yüzeye aktarılır (damgalı) protein mikro desenleri üreten. (B) Lazer destekli desenleme teknikleri fotodesen ve doğrudan lazer desenleme içerir. (C) Çoğu fotodesenleme yaklaşımı, PEG antifouling yüzeyini belirli konumlarda bırakmak için istenilen geometrilerle uv ışık kaynağı ve fotomaske (substrat yüzeyi ile temas halinde veya hedefin odak düzleminde) kullanır, tanımlanmış bir desen oluşturma. Sonraki protein kuluçka adımı sadece lazer-yarık bölgelere protein adsorpsiyon sonuçları. (D) LIMAP substrat (yani, maskesiz ve temassız bir yaklaşım) ile temas halinde bir fotomaske gerektirmeyen bir fotomodelleme tekniğidir. LIMAP, peg'in ışığa maruz kalan bölgelerini yarıklayan bir lazerin düşük dozlarda aktive edildiği bir fotoğraf başlatıcısı kullanır. Bu sıralı protein adsorpsiyon için ek siteleri oluşturur. (E) Doğrudan lazer desenleme doğrudan PEG film aşındırmak için yüksek enerjili ışık kullanır, bu kazınan bölgelerde protein bağlayıcı izin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
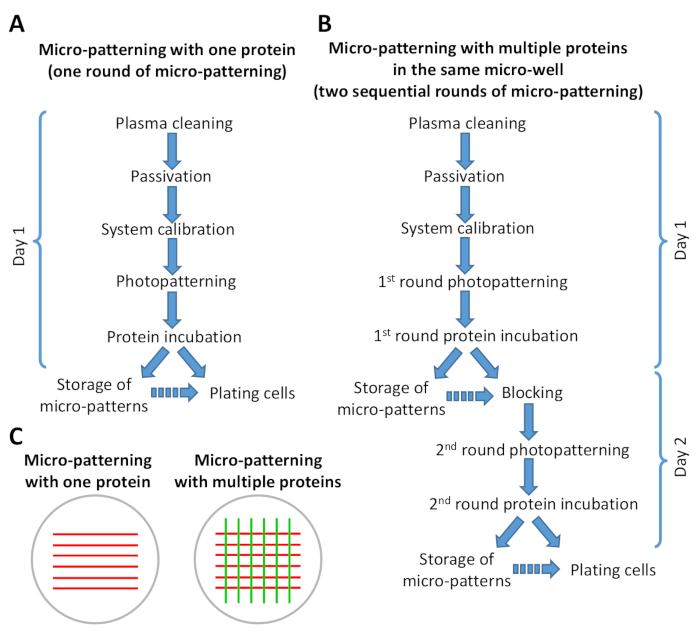
Şekil 2: Mikro desenleme protokolündeki adımların özetini gösteren şema. (A) Bir protein ile mikro-desenleme mikro-desenleme sadece bir tur içerir (fotodesen ve protein kuluçka) ve altında yapılabilir 8 h. (B) Birden fazla protein ile mikro-desenleme iki ardışık tur gerektirir mikro desenleme ve hazırlanan mikro desen sayısına bağlı olarak, 1-2 gün içinde tamamlanabilir. Protokolün B versiyonundan 1 günlük çalışma ile geçmek mümkündür. Sürekli oklar protokoldeki adımların doğrudan akışını gösterir. Kesintili oklar, bir adımla diğeri arasında önemli bir zaman farkı olduğunu gösterir (bkz. adım 6.6 ve 9.3). (C) Bir tur mikro desenleme (kırmızı çizgiler) veya iki sıralı mikro desenleme (kırmızı ve yeşil çizgiler) sonrası elde edilen örnek desenlerin şematik görünümü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Desen şablonu oluşturma LIMAP ile çok yönlüdür. (A,B) ImageJ (A yaylı tüfek, B harfleri) ile tasarlanmış desen şablonları örnekleri. Beyaz adabına çizilen şekiller maksimum lazer gücüyle yansıtıldı ve siyaha çizilmiş şekiller yansıtılmadı. (C,D) 10 μg/mL fibrinojen (yeşil) ile kuluçka sonrası şablonlardan LIMAP ile elde edilen mikro desenler. (C) Yaylı tüfekler 50 m genişliğinde ve 50 m yüksekliğinde yatay olarak 75 m, dikey olarak 50 m yüksekliktedir. (D) Harfler 80 μm genişlik te ve 85 m yüksekliğindedir. C ve D'deki ölçek çubukları 50 μm'yi temsil eder.

Şekil 4: LIMAP protokolü için gerekli malzemeler. (A) Bu protokolde kullanılan şablonlar 20 mm çapında, ince dairesel şekilli PDMS parçaları (250 μm kalınlıkta) 4 mikro-kuyu (her biri 4 mm çapında) içerir. Mikro kuyularda kullanılan hacimler 5 ile 20 μL arasında değişmekte ve her deney için gerekli reaktif ve protein miktarını önemli ölçüde azaltır. (B) Şablonlar zaten her kuyuda yerleştirilmiş olan 6 kuyu cam alt çanak. Mikro kuyular görünür hale getirmek için 20 μL PBS içerir. (C) İç cam kuyusu lazer odak kalibre etmek için kullanılacak yeşil bir vurgulayıcı ile işaretlenmiş olan kalibrasyon çanak. (D) Üst şematik görünümü b 6-iyi cam alt çanak iyi sol (kesikli kırmızı daire ile özetlenmiştir). İç cam alt kuyusu beyaz ve şablon gri gösterilir temsil edilir. Şablon 4 farklı deneysel koşulların (örn. farklı protein konsantrasyonları, desen geometrileri, protein kombinasyonları, vb.) test edilmesi için 4 mikro kuyu (1-4 numaralı) içerir. Yıldız, referans deseni içeren mikro kuyuyu temsil eder. (E) Üst kısımda bir referans deseni oluşturulduğu mikro kuyunun şematik görünümü (ok ucu dolu ok). Bu referans deseni desenleme için en uygun lazer odağı elde etmek için gereklidir (adım 4 bakınız). Boş ok ucu olan ok, sistem kalibrasyonundan sonra sonraki desenler için kullanılacak olan mikro kuyunun merkezi alanını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
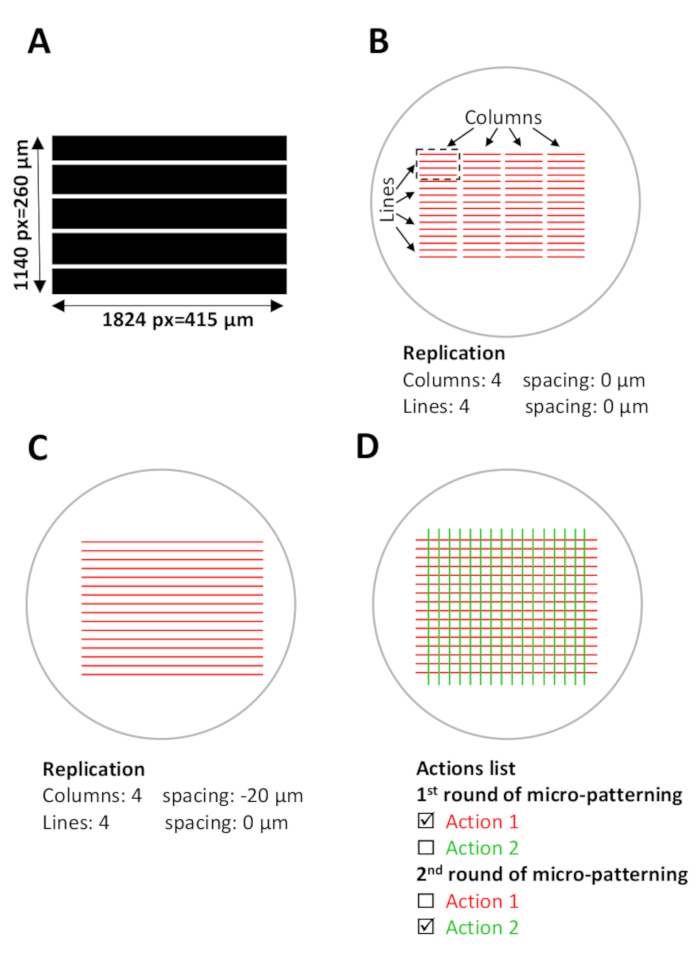
Şekil 5: Mikro desenleme için yazılım kurulumu. (A) ImageJ ile tasarlanan ve 8 bittiff dosyası olarak kaydedilen paralel çizgili desen şablonu. (B-D) Mikro desenler üretilecek mevcut mikro-kuyular ile örtüşen dijital ROI'ların (ilgi bölgeleri) şematik görünümü. (B) Kullanılacak desen şablonu (uzunluk 1824 piksel=415 μm, genişlik 1140 piksel=260 m) Leonardo'ya seçilir ve roi'de bir tasarım birimi olarak (siyah çizgili dikdörtgendeki kırmızı çizgiler) yansıtılır ve bu şablon un yaklaşık 0,1 mm2'sini kapsayacak mikro-iyi alan. Tasarım birimi Çoğaltma menüsünde (şablon yapılandırması) 4 sütun ve 4 satır da çoğaltılır ve mikro kuyuda bir desen oluşturur. Sütunlar arasındaki alana dikkat edin. (C) Sürekli çizgileri desenlemek için sütunlar arasındaki aralığın ayarlanması gerekir. Bu durumda, tasarım birimleri arasında bir çakışma elde etmek için sütunlar arasındaki boşluk negatif aralıkolarak çoğaltma menüsünde ayarlanır , -20 μm. (D) Aynı mikro-kuyuda birden fazla protein desen için, desenlerdoğru bir hizalama Gerekli. Yazılım kurulum adımı (adım 5) sırasında, istenen tüm desen şablonlarını aynı anda yükleyin. Eylemler listesinde, yalnızca her desenlendirme turunda desenlenecek belirli eylemleri seçin ve eylemlerin geri kalanını (adım 5.12, 5.13 ve 8.2) seçin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
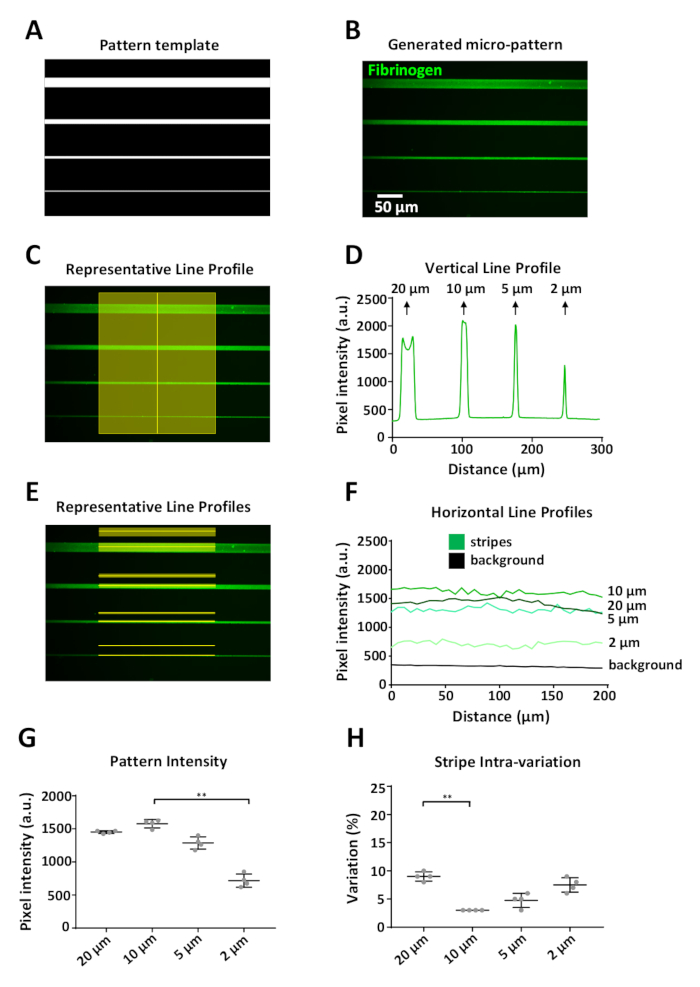
Şekil 6: LIMAP kullanılarak desen değişkenliğinin analizi. (A) ImageJ ile tasarlanan desen şablonu, değişen genişlikte (20, 10, 5, 2 μm, yukarıdan aşağıya) dört şeridi mikro desenle birlikte kullanır. (B) 10 μg/mL floresan etiketli fibrinojen (yeşil) ile kuluçka sonrası elde edilen mikro desen. (C) Mikro desenin çizgilerini geçen dikey bir çizgi boyunca yoğunluk ölçümleri. (D) (C) ölçümden elde edilen dikey floresan yoğunluk profili. Daha geniş genişliklerde (20 μm) dikey profilde, şerit kenarlarında protein birikiminin neden olduğu bir varyasyon olduğunu ve bunun sonucunda iki farklı floresan yoğunluğu nun (kenar etkisi) olduğunu unutmayın. Bu etki sadece çizgi genişliklerinde görülür ≥20 μm. (E) Tasvir edilen yatay çizgiler (floresan ve arka plan) boyunca yoğunluk ölçümleri. (F) (E) ölçümlerinden elde edilen yatay floresan yoğunluk profilleri. (G) Dört ayrı çoğaltılmış tasarım biriminden (desenler arası varyasyon) ölçülen her şerit genişliğinin ortalama yoğunluğunu gösteren grafik. 2 μm şerit genişliğinde desenler için azaltılmış protein adsorpsiyon dikkat edin. (H) Desenli şeritler (varyasyon katsayısı) içindeki varyasyon tüm şerit genişlikleri için düşüktü, %3 ile %10 arasında değişmekteydi. G ve H'de ortalama ± SD olarak gösterilen veriler G ve H'de istatistiksel analiz, çoklu karşılaştırmalarla tek yönlü ANOVA (Kruskal-Wallis) olmayan parametrik test kullanılarak gerçekleştirildi. P değeri <0.001 ** önemi içindir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
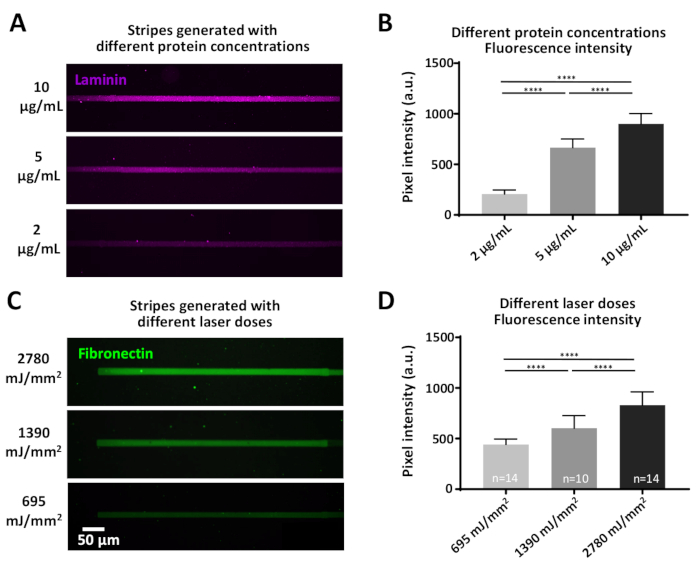
Şekil 7: Protein adsorpsiyon verimliliği için lazer gücü ve protein konsantrasyonu varyasyonlarının etkisi. (A) PLL-PEG yüzeyi sabit bir lazer dozu (1390 mJ/mm2)ile lazer leziz ve floresan etiketli laminin (macenta) konsantrasyonları ile inkübe edildi. (B) (A)'daki laminin çizgilerinin floresan yoğunluğunun ölçülmesi. (C) Farklı endike lazer dozları uygulandı ve ardından aynı konsantrasyonda (10 μg/mL) floresan etiketli fibronektin (yeşil) kuluçka ya da (D) Fibronektin çizgili floresan yoğunluğunun nicelikselleştirilmesi (C) yüksek lazer dozlarının daha yüksek adsorbe protein düzeyleriyle ilişkili olduğunu gösterir. Tüm ölçümler arka plan çıkarılır. Örnek sayılar sütunların alt kısmında gösterilir; veriler ortalama ± SEM olarak gösterilmiştir. İki kuyruklu hesaplama ile parametrik olmayan Mann-Whitney testi kullanılarak istatistiksel analiz yapılmıştır. P değeri <0.0001 **** önemi içindir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
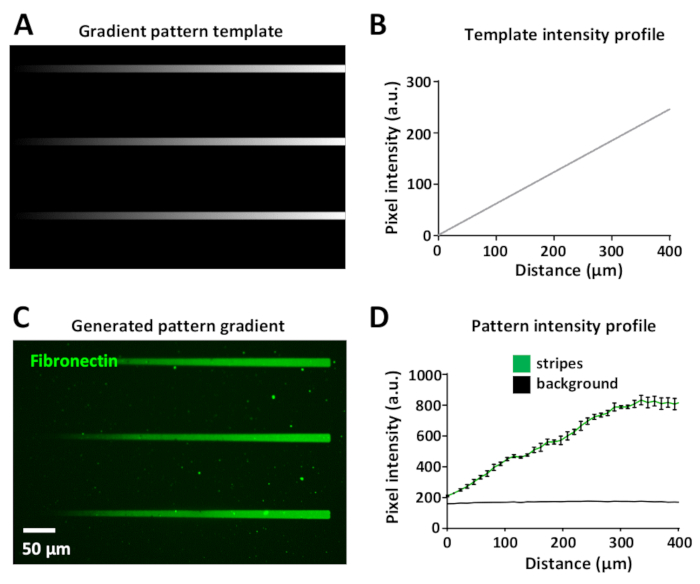
Şekil 8: Bir mikro-desen içinde bir protein konsantrasyongradient iã§inde nesil. (A) Gri tonlamada degrade desen şablonu. (B) Floresan yoğunluk profili (A) ile ölçülür. (C) Floresan etiketli fibronektin (yeşil) 10 μg/mL ile kuluçka sonrası (A) desen şablonundan LIMAP ile elde edilen desen. (D) N = 3 çizgili floresan yoğunluk profili ve ortalama ± SEM olarak gösterilen arka plan, protein gradyan yoğunluğunda doğrusal artış gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
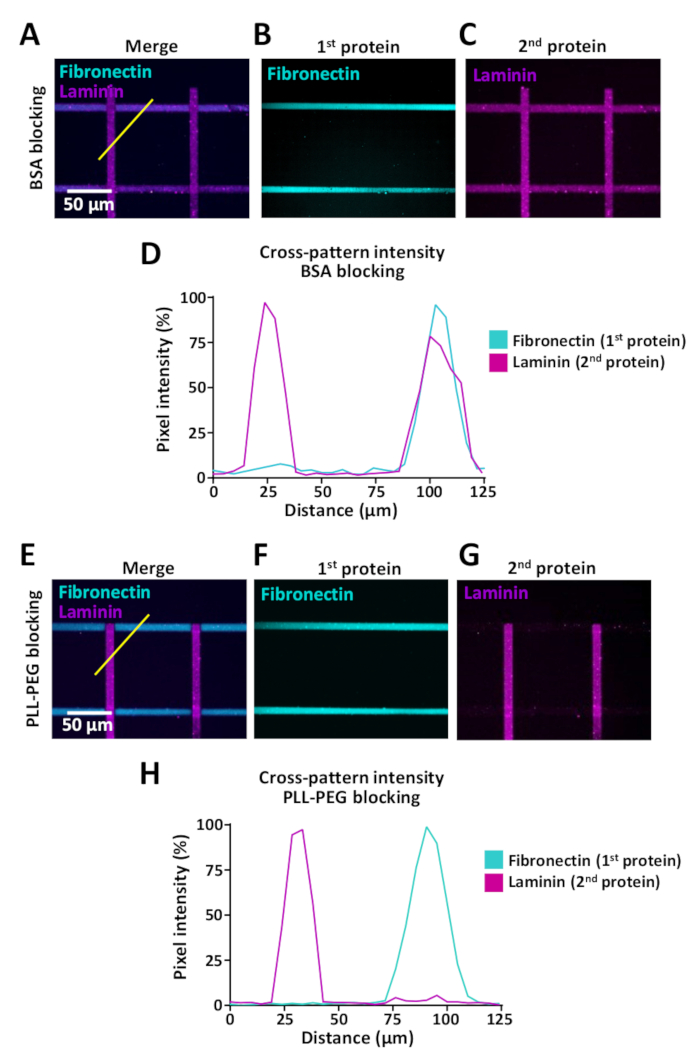
Şekil 9: Birkaç proteini sırayla desenleme yaparken çapraz bağlama etkisi. (A-C, E-G) Floresan etiketli fibronektin (siyan, yatay) ve floresan etiketli laminin (magenta, dikey) 10 μm çizgili çapraz desenler. (A-C) BSA engelleme tamponu ile tedavi edilen örnekler. (E-F) Spesifik olmayan bağlama sitelerini engellemek için PLL-PEG ile tedavi edilen numuneler (adım 7). (A,E) Hem fibronektin hem de laminin gösteren birleştirilmiş floresan kanalları. (B,F) Sadece fibronektin gösteren görüntü. (C,G) Yalnızca laminin gösteren görüntü. C için, BSA ile boş bağlayıcı sitelerin etkisiz engelleme nedeniyle yatay fibronektin pozitif şeritler de laminin varlığı na dikkat edin. G için, PLL-PEG ile engellemenin laminanın fibronektin çizgilerine verimli bir şekilde bağlanmasını engellediğini unutmayın. (D,H) A ve E'de belirtilen ölçümlerden (diyagonal sarı çizgi) elde edilen floresan yoğunluk profilleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
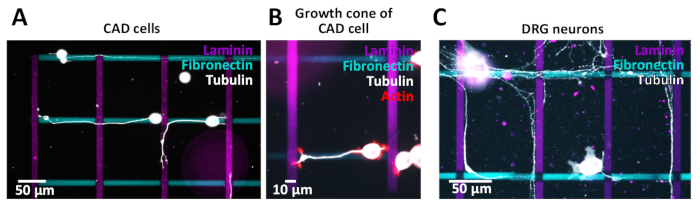
Şekil 10: Neurit/akson yol bulma sını araştırmak için çapraz desenler. (A-C) Floresan etiketli fibronektin (siyan, yatay) ve floresan etiketli laminin (magenta, dikey) 10 μm çizgili çapraz desenler. (A,B) Mikro desenler boyunca büyüyen nöritler ile CAD hücrelerinin floresan görüntüleri. Nöritleri görselleştirmek için hücreler 48 saat kültürlü, %4 PFA ile sabitlenmiş ve tubulin (A) veya tubulin ve aktin (B) için boyanmıştır. (C) Mikro desenler boyunca büyüyen aksonlu sıçan dorsal kökü ganglion (DRG) nöronları. Aksonları görselleştirmek için DRG nöronlar 72 saat kültürlü, %4 PFA ile sabitlendi ve tübulin için lekelendi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
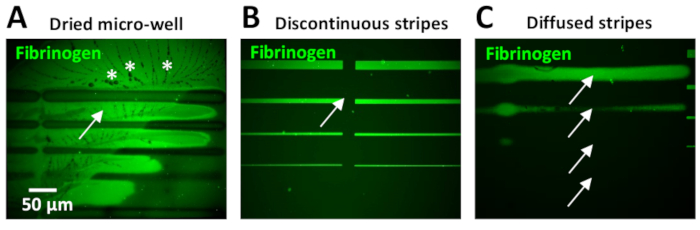
Şekil 11: LIMAP ile mikro desenler oluştururken elde edilen yaygın negatif sonuçlara örnekler. (A-C) Farklı koşullar altında elde edilen 10 μg/mL floresan etiketli fibrinojen (yeşil) alt-optimal desenli şeritler. (A) Mikro-iyi desen üretimi sırasında kurudu. Arka planda (ok) ve PBS kristallerinin (yıldız) varlığındaki yüksek floresan düzeylerine dikkat edin. (B) Çizgiler arasındaki dikişler, tasarım birimleri arasında boşluklar (ok) olan sürekli çizgilerle sonuçlanan yazılım kurulumu sırasında düzgün bir şekilde ayarlanmadı (bkz. adım 3.4.7). (C) Lazer odağı, desen şablonunun gerçek şerit genişliklerini temsil etmeyen, yukarıdan aşağıya doğru 20, 10, 5, 2 μm olmalıdır,(B)gibi alt-optimal neden dağınık şeritler (oklar) idi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
LIMAP (PRIMO) mikro desenleme avantajları ve mikrotemas baskı ile karşılaştırma
Mikrotemas baskı muhtemelen biyolojik alanda en yaygın olarak kullanılan mikro-desenleme tekniği iken39, LIMAP teknolojisi40kullanarak araştırmacıların artan sayıda var gibi görünüyor40,41,42 ,43,44. Burada, LIMAP için ticari olarak kullanılabilen bir sistem olan PRIMO'u kullanarak bir protokol sunduk. Aşağıda mikrotemas baskı ve LIMAP fotoğraf desenleme potansiyel avantajları ve sınırlamaları kısaca tartışmak.
Microcontact baskı bir cam veya silikon gofret üzerine bir fotoğraf maskesi (genellikle SU-8) spin kaplama tarafından üretilen litografili ustalar gerektirir, daha sonra lazer istenilen mikro özellikleri ile kazınmış. Bu ustalar bir PDMS damgası oluşturmak için şablon olarak kullanılır45. Pul, ona adsorbs seçilmiş bir protein ile kuluçka, ve daha sonra hücre kültürü çanak üzerine aktarılır (damgalı). PdMS damgasına proteinin adsorpsiyon işlemi protein konsantrasyonu, tampon ve kuluçka süresine bağlıdır. Bu parametrelerin en iyi sonuçlar için önceden test edilmesi gerekir46.
Ustalar, doğru şekilde korunursa aylarca hatta yıllarca süren önemli sayıda deneyde kullanılabilir. Ancak, bu teknolojinin sınırlayıcı bir faktör her istenilen değişiklik için yeni litografili ustalar yeniden tasarlamak için gerekliliktir. Deneysel tasarımlardaki değişiklikler, yeni ustaların zaman alan üretimine (birkaç haftaya kadar) neden olabilir ve böylece deneyler geciktirilebilir. Buna karşılık, LIMAP photopatterning fiziksel bir ana gerektirmez; mikro desenlerin istenilen geometrilerini değişen araştırma sorularına esnek bir şekilde uyarlamak için kullanılabilecek yazılım tarafından oluşturulan desen şablonları kullanır. LIMAP aynı mikro-desen içinde protein gradyanları oluşturmak için de kullanılabilir (Şekil 8), hangi mikrotemas baskı kullanarak tekrarlanabilir bir şekilde elde etmek zordur47.
Ayrıca, LIMAP ile elde edilen mikro desen çözünürlüğü, bizim durumumuzda 2 μm 'dir (Şekil 6B).
Bu çözünürlüğe yaklaşırken, desen içi ve inter-detektifi arttı. 10 μm genişliğinde veya üzerinde desenler üretmek son derece tekrarlanabilirdi (Şekil 6G,H). Tam tersine, mikrotemas baskısı ile sürekli olarak 10 μm'nin altındaki çözünürlükleri elde etmek zordur ve küçük özellikleri damgalarken (veriler gösterilmez) eserler bulmak yaygındır.
LIMAP'in aynı mikro kuyuiçinde birden fazla proteini(Şekil 9)mikro-desenlemede kullanılabileceğini ve deneylere daha fazla karmaşıklık düzeylerinin eklenmesini sağladığını gösterdik. Bu mikrotemas baskı ile elde edilebilir olsa da, yüksek hassasiyet ile farklı proteinlerin hizalanması teknik olarak oldukça zorlu olabilir. LIMAP kullanılarak birden fazla proteinin desenlenmesi doğrudan ileri ye dönük görünse de, proteinlerin sıralı kaplama prosedürleri ile çapraz bağlanmasının reaktiflerin bloke edilmesi yle azaltılabildiği, ancak tamamen ortadan kaldırılamayacağı ndan bahsetmek gerekir(Şekil 9).
Bir veya diğer tekniğin maliyeti ile ilgili olarak, LIMAP burada açıklandığı gibi mikro-desenleme ekipman (PRIMO) farklı floresan mikroskoplar üzerine monte edilebilir ve motorlu sahne gerektirir satın gerektirir. Bu yatırım başlangıçta maliyet yoğun olmasına rağmen, LIMAP ile ilişkili uzun vadede sarf malzemeleri (şablonlar, PEG ve PLPP) dışında ek satın alma lar yoktur. Alternatif olarak, PDMS şablonları da yayınlanan protokolleri18,32aşağıdaki kendi deneyci tarafından laboratuvarda üretilebilir. Mikrotemas baskı için en büyük maliyetler, denemeler yeni desenler gerektiriyorsa önemli hale gelebilen yeni ustaların üretimiyle ilişkili olabilir.
LIMAP bir dezavantajı bu tekniğin nispeten düşük iş bölümü yaklaşımıdır. Microcontact baskı, LIMAP ile gerekli sıralı lazer mikro desenleme ile karşılaştırıldığında, aynı anda damgalama adımlarında çok sayıda mikro desen üretebilir. Örneğin, PDMS pulları (pul hazırlama hariç) kullanılarak mikrotemas baskı ile yaklaşık 2 saat içinde 6 damgalı cam kapak lar üretmek mümkündür; limap ile benzer bir alan (6-iyi çanak) desenleme yüzey pasifasyon prosedürü hariç, yaklaşık 4 saat sürer (adım 5.12 açıklanan desen şablonu yapılandırması dikkate alınarak ve Şekil 5Bbakın).
LIMAP teknolojisinin bir diğer hız sınırlayıcı faktörü, geniş alanların desenlendirmesi için gereken uzun aydınlatma süresidir (7,5 mW/mm2 lazerile tasarım birimi başına 30 s). Bu gibi durumlarda, mikrotemas yazdırma tercih edilen bir seçenek olabilir. Yeni kullanılabilir bir fotoğraf başlatıcısı (PLPP jel, Malzeme Tablosu)desenleme için alınan süreyi önemli ölçüde azaltarak, geniş alanlarda yüzlerce mikro örüntünün (8 mm2'yekadar) sadece birkaç dakika içinde üretilmesine olanak sağlayacaktır.
Hücre kültürü için mikro desenleme yüzeyleri dikkate alınması gereken bir diğer önemli faktör, mikrotemas baskı ile elde edilen değişkenliğe kıyasla, farklı deneysel tekrarlar arasında mikro desenlerin tekrarlanabilirliğidir. Örneğin, Şekil 7B,D'de gösterilen grafikler, çok benzer sonuçlara sahip üç bağımsız deneysel tekrarın temsili verileridir (veriler gösterilmez). Deneyimlerimize ve önceki yayınlarımıza dayanarak, bu düzeyde tekrarlanabilirlik48,49,50,51,52mikrotemas baskı ile elde etmek zordur.
Genellikle çok biyouyumlu olmayan3,Limap (PLPP) (PLPP) foto-sensitizers, mühendis ya da fotoğraf duyarlılaştırıcıların kullanımı için özel kimya gerektiren diğer fotoğraf desenleme teknikleri aksine ) biyouyumludur ve hücreler tarafından iyi tolere edilir21; elimizde CAD, DRG nöronlar(Şekil 10),fibroblastlar, epitel hücreleri ve melanom hücreleri (veriler gösterilmedi) dahil olmak üzere çeşitli hücrelerde herhangi bir sitotoksisite yaşamamıştır. LIMAP'in PRIMO kullanımının diğer fotoğraf desenleme tekniklerine kıyasla bir diğer avantajı da fotomaskeye gerek olmamasıdır. Mikrotemas lı baskıya benzer şekilde, yeni fotoğraf maskelerinin istenilen her desen için tasarlanıp üretilmesi gerekir.
Mikrotemas baskı için yukarıda belirtilen tüm sınırlamalar, tekniğin manuel yaklaşım bakın. Ancak, pul yükü ve basınç kontrolü53ile otomatik bir cihaz kullanarak mikrotemas baskının masını ve tekrarlanabilirliğini artırmak mümkündür.
PRIMO kullanarak LIMAP için protokolün temel adımları ve sorunları çözme
Bu protokol sırasında en sık karşılaşılan sorunlardan biri mikro desenler içinde arka plan floresan yüksek düzeyde yaşıyor. Bu genellikle küçük hacimli nedeniyle meydana gelen mikro-kuyuların kuruması nedeniyle olabilir. Bu durumda, PBS kristalleri genellikle ECM desenleri çevreleyen görünür (Şekil 11A).
Protein inkübasyonu sonrası yetersiz veya verimsiz yıkama adımları da arka plan floresan yüksek düzeyde neden olabilir. Bu durum özellikle 10 μg/mL(Şekil 11B)veya daha yüksek protein konsantrasyonları kullanılarak görülebilir. Arka planda protein fazlalığı PBS ile ek yıkama adımları dahil edilerek azaltılabilir.
Her deneyde protein arka planının varlığı ölçülmeli ve karakterize edilmelidir, arka plan floresan yoğunluğu(Şekil 6E) hesaplanır ve mikro-desen yoğunluğundan çıkarılmalıdır (Şekil 6F-H ve Şekil 7B,D). Yüksek protein arka plan ek ve CAD hücrelerinin filizlenme bir etkisi olabilir, sonuçların yorumlanması ödün.
Tasarım birimleri arasında boşluklar olması, kullanıcıların desenler arasında yetersiz çakışma sonucu ortaya çıkan sınırlı deneyime(Şekil 11B)sahip olması sık karşılaşılan bir sorundur. Leonardo yazılımındaki iki parametre bunun üstesinden gelmek için ayarlanabilir: 1) desenin tasarımına bağlı olarak sütunlar arasında negatif bir boşluk gerekebilir (adım 5.7 ve bkz. Şekil 5B,C). Alternatif olarak, 2) sütunları dikmek için Uzman menüsündeki degrade seçeneğini kullanın. En uygun aralık parametrelerini belirlemek için hızlı bir test UV yapıştırıcı(Tablo Malzemeler)kullanılarak yapılabilir. Bu yapıştırıcıküçük bir damla daha sonra bir film yapma, bir cam kapak ile kaplıdır bir cam slayt, uygulanır. Gömülü UV yapıştırıcısı, düşük lazer dozu (30 mJ/mm2)kullanılarak ilgi desen şablonu ile fotopatlanır. Gömülü yapıştırıcının UV maruz kalan bölgeleri tedavi edilse de parlak alan mikroskobu altında görünür hale gelecektir. Test sonuçları, desen içinde elde edilen aralığı değerlendirmek için görselleştirilmiştir. Nöronal deneylerimizde, çizgiler arasındaki bir boşluk hücre davranışını olumsuz yönde etkileyebilir ve büyüme dinamiklerinde (azalmış hız veya yolun terk edilmesi) farklılıklar alabilirsiniz.
Leonardo yazılımının en son güncellemesinde (yayın sırasında, Leonardo 4.11), mikro-kuyu yüzeyinin çok daha büyük bir alanı (20X hedefi kullanılarak 8 mm2'ye kadar) kapsayan daha önce tasarlanmış daha büyük desen şablonlarını yüklemek mümkündür. tasarım birimi başına mevcut 0,1 mm2 ile karşılaştırıldığında, daha küçük tasarım ünitelerinin bir araya dikilmesi gereği ortadan kaldırılır. Tanımlanmamış kenarlar desen oluşturma sırasında lazer odaka ayar eksikliğinden kaynaklanabilir (Şekil 11C). Bu nedenle lazeri kalibre etmek ve desenlemeden önce referans desen adımlarını (bkz. adım 4) gerçekleştirmek çok önemlidir. Kötü tanımlanmış çizgiler, şerit genişliğinde farklılıklara neden olarak akson büyüme dinamiği ile şerit genişliği arasındaki ilişkiyi zorlaştırır. Aksonlar da dağınık kenarları olan şeritler terk eğilimindedir. Ayrıca, kenarlarda değişkenlik de 10-20 μm genişlik veya daha yüksek çizgili baskı bulunabilir, desenlerin merkezi bölgelere göre kenarlarında daha yüksek bir protein içeriği ile sonuçlanan(Şekil 6B,D). Bu kenar efekti, fotodesenleme işlemi sırasında fotoğraf başlatıcısının homojen olmayan bir difüzyonu ile üretilir. Fotosisyon reaksiyonu oksijene bağımlıdır, bu da kenarlarda daha fazla yayılır. Bu kenar efekti, fotodesenleme işlemi sırasında mikro kuyuda bir pipet ile fotoğraf başlatıcısını homojenleştirerek en aza indirilebilir. Ayrıca, yeni bir ticari fotoğraf başlatıcısı (PLPP jel), aynı zamanda kenar efekti azaltabilir (PRIMO sistem destek ekibi, kişisel iletişim).
Birden fazla proteinin mikro-baskı çapraz bağlanmasına neden olabilir(Şekil 9A-D). Bu iki farklı protein için kuluçka adımları arasında spesifik olmayan bağlama siteleri işgal etmek için kullanılan engelleme verimliliği artırarak en aza indirilebilir. Proteinlerin çapraz bağlanması deneysel sonuçların tekrarlanabilirliğini zorlaştırabilir ve her proteinin akson büyüme dinamiklerine ve diğer hücre davranışlarına katkısını belirlemek zor olduğundan, verilerin yanlış yorumlanmasına yol açabilir.
Sonuç
LIMAP kullanılarak sağlanan protokolün PRIMO sisteminin kullanımı yoluyla protein mikro-desenlerinin oluşumunu kolaylaştırdığını umuyoruz. Protokolümüz 2D cam yüzeylerde mikro desenlerin güvenilir bir şekilde nasıl üretilene odaklanılabildiğini odaklarken, diğerleri yumuşak yüzeylerin mikro desenlemeiçin LIMAP'i kullanmanınmümkün olduğunu göstermiştir 54 , ve 3D kültürler için mikroyapılı yüzeyler42. Bu mikro desenler, mikro ortamlarındaki değişikliklere hücresel tepkileri incelemek için çok yönlü bir araç olabilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma BBSRC, EPSRC, MRC ve Wellcome Trust tarafından desteklenir. C.B. laboratuvarı, Manchester Üniversitesi Hücre-Matrix araştırma merkezi Wellcome Trust'ın bir parçasıdır ve Wellcome Trust'ın (hibe numarası 088785/Z/09/Z) çekirdek finansmanı ile desteklenir. Yazarlar, Biyoteknoloji ve Biyolojik Bilimler Araştırma Konseyi (BBSRC) tarafından C.M., K.J. (BB/M020630/1) ve P.A. (BB/P000681/1) ve Mühendislik ve Fizik Bilimleri Araştırma Konseyi (EPSRC) ve Tıp Bakanlığı'na sağlanan fonu kabul etmek istiyor. Araştırma Konseyi (MRC) A.K. Rejeneratif Tıp Doktora Eğitimi Merkezi (EP/L014904/1). Yazarlar yazışmaları ve satış sonrası destek ekibi için Alvéole teşekkür ederim. Yazarlar Peter March ve Roger Meadows Biyogörüntüleme Tesisi, Manchester Üniversitesi'nden mikroskop ile yardım için teşekkür ederiz. Bu çalışmada kullanılan Biyogörüntüleme Tesisi mikroskopları BBSRC, Wellcome Trust ve University of Manchester Strategic Fund'dan hibe lerle satın alınmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alexa 488 protein labeling kit | Invitrogen | A10235 | Working concentration: N.A. |
| Alexa 647 protein labeling kit | Invitrogen | A20173 | Working concentration: N.A. |
| CAD cells | ECACC | 8100805 | Working concentration: N.A. |
| Conjugated fibrinogen-488 | Molecular Probes | F13191 | Working concentration: 10 μg/ml |
| DMEM culture medium | Gibco | 11320033 | Working concentration: N.A. |
| Epifluorescence Microscope** | Nikon | Eclipse Ti inverted | Working concentration: N.A. |
| Fibronectin | Sigma | F4759 | Working concentration: 10 μg/ml (after labelling with Alexa 488 protein labeling kit, see above) (diluted in PBS) |
| Fiji-Image J | www.imagej.nih.gov | Version 2.0.0-rc-54/1.51f | Working concentration: N.A. |
| Fluorescent highlighter | Stabilo | Stabilo Boss Original | Working concentration: N.A. |
| HEPES | Gibco | 15630080 | Working concentration: 1M |
| Inkscape software | Inkscape | Check last update | Working concentration: N.A. |
| Laminin-red fluorescent rhodamine | Cytoskeleton, Inc. | LMN01 | Working concentration: 10 μg/ml (diluted in PBS) |
| Leonardo software | Alvéole | version 4.11 | Working concentration: N.A. |
| L-Glutamine | Sigma | G7513 | Working concentration: 1% |
| Micro-manager software | Open imaging | Check last update | Working concentration: N.A. |
| Motorized x/y stage | PRIOR Scientific | Proscan II | Working concentration: N.A. |
| NIS Elements Software | Nikon | NIS Elements AR 4.60.00 64-bit (With Nikon jobs) | Working concentration: N.A. |
| PBS (without Ca2+, Mg2+) | Sigma | D8537 | Working concentration: 1X |
| PDMS Stencils | Alvéole | visit www.alveolelab.com | Working concentration: N.A. |
| PEG-SVA | Laysan bio, Inc. | MPEG-SVA-5000-1g | Working concentration: 50 mg/ml |
| Phalloidin 405 | Abcam | ab176752 | Working concentration: 1:1000 |
| Photo-initiator (PLPP) | Alvéole | Classic PLPP | Working concentration: 14.5 mg/ml |
| Photo-initiator (PLPP gel) | Alvéole | PLPP gel | Working concentration: 4.76% diluted in ethanol |
| Plasma cleaner | Harrick Plasma | PDC-32G (115V) | PDC-32G-2 (230V) | Working concentration: N.A. |
| PLL-PEG | SuSoS (also distributed by Alvéole) | www.alveolelab.com | Working concentration: 0.1 mg/ml (diluted in PBS) |
| Poly-L-Lysine | Sigma | P4707 | Working concentration: 0.01% |
| Primo equipment | Alvéole | www.alveolelab.com | Working concentration: N.A. |
| Pen/Strep | Thermo Fisher | 15140122 | Working concentration: 1% |
| Tubulin anti-alpha antibody | Abcam | DM1A | Working concentration: 1:1000 CAD cells |
| Tubulin anti-beta 3 antibody | Sigma | T8660 | Working concentration: 1:500 DRG neurons |
| UV adhesive | Norland Products | NOA81 | Working concentration: N.A. |
| 1 well glass bottom dish | Cellvis | D35-20-1.5-N | Working concentration: N.A. |
| 6 well glass bottom dish | Cellvis | P06-20-1.5-N | Working concentration: N.A. |
| 20x objective** | Nikon | no phase ring (check updated catalogue) | Working concentration: N.A. **Epifluorescence microscope: images were acquired and patterns were generated on an Eclipse Ti inverted microscope (Nikon), coupled to PRIMO micro-patterning equipment (Alvéole), using a 20x objective (0.75 S Plan Fluor (nophasering, Nikon). Nikon specific filter sets for GFP, mCherry and Cy5 were used and fluorescent light source was LED (Lumencor) although other fluorescence sources and filter sets can be used. The microscope has an automated x/y stage (PRIOR Scientific) for the printing of multi-field patterning and Nikon Perfect Focus to prevent focus drift. The images were collected using a Retiga R6 (Q-Imaging) camera. |
Referanslar
- Alamdari, O. G., Seyedjafari, E., Soleimani, M., Ghaemi, N. Micropatterning of ECM Proteins on Glass Substrates to Regulate Cell Attachment and Proliferation. Avicenna Journal of Medical Biotechnology. 5 (4), 234-240 (2013).
- Sunami, H., Yokota, I., Igarashi, Y. Influence of the pattern size of micropatterned scaffolds on cell morphology, proliferation, migration and F-actin expression. Biomaterials Science. 2 (3), 399-409 (2014).
- Thery, M. Micropatterning as a tool to decipher cell morphogenesis and functions. Journal of Cell Science. 123 (Pt 24), 4201-4213 (2010).
- Marino, A., et al. Two-photon polymerization of sub-micrometric patterned surfaces: investigation of cell-substrate interactions and improved differentiation of neuron-like cells. ACS Applied Materials & Interfaces. 5 (24), 13012-13021 (2013).
- Joo, S., et al. Effects of ECM protein micropatterns on the migration and differentiation of adult neural stem cells. Scientific Reports. 5, (2015).
- Morgani, S. M., Metzger, J. J., Nichols, J., Siggia, E. D., Hadjantonakis, A. K. Micropattern differentiation of mouse pluripotent stem cells recapitulates embryo regionalized cell fate patterning. Elife. 7, (2018).
- Javaherian, S., O'Donnell, K. A., McGuigan, A. P. A Fast and Accessible Methodology for Micro-Patterning Cells on Standard Culture Substrates Using Parafilm (TM) Inserts. Plos One. 6 (6), (2011).
- Smirnov, M. S., Cabral, K. A., Geller, H. M., Urbach, J. S. The effects of confinement on neuronal growth cone morphology and velocity. Biomaterials. 35 (25), 6750-6757 (2014).
- Albert, P. J., Schwarz, U. S. Dynamics of Cell Ensembles on Adhesive Micropatterns: Bridging the Gap between Single Cell Spreading and Collective Cell Migration. PLOS Computational Biology. 12 (4), (2016).
- Evans, A. R., et al. Laminin and fibronectin modulate inner ear spiral ganglion neurite outgrowth in an in vitro alternate choice assay. Developmental Neurobiology. 67 (13), 1721-1730 (2007).
- Nichol, R. H., Hagen, K. M., Lumbard, D. C., Dent, E. W., Gomez, T. M. Guidance of Axons by Local Coupling of Retrograde Flow to Point Contact Adhesions. Journal of Neuroscience. 36 (7), 2267-2282 (2016).
- Burdick, J. A., Khademhosseini, A., Langer, R. Fabrication of gradient hydrogels using a microfluidics/photopolymerization process. Langmuir. 20 (13), 5153-5156 (2004).
- Schwartz, P. V. Molecular transport from an atomic force microscope tip: A comparative study of dip-pen nanolithography. Langmuir. 18 (10), 4041-4046 (2002).
- Barbulovic-Nad, I., et al. Bio-microarray fabrication techniques--a review. Critical Reviews in Biotechnology. 26 (4), 237-259 (2006).
- Shafagh, R. Z., Vastesson, A., Guo, W. J., van der Wijngaart, W., Haraldsson, T. E-Beam Nanostructuring and Direct Click Biofunctionalization of Thiol-Ene Resist. Acs Nano. 12 (10), 9940-9946 (2018).
- Kobayashi, J., Yamato, M., Itoga, K., Kikuchi, A., Okano, T. Preparation of microfluidic devices using micropatterning of a photosensitive material by a maskless, liquid-crystal-display projection method. Advanced Materials. 16 (22), (2004).
- Bernard, A., et al. Printing patterns of proteins. Langmuir. 14 (9), 2225-2229 (1998).
- Ruiz, S. A., Chen, C. S. Microcontact printing: A tool to pattern. Soft Matter. 3 (2), 168-177 (2007).
- Qin, D., Xia, Y., Whitesides, G. M. Soft lithography for micro- and nanoscale patterning. Nature Protocols. 5 (3), 491-502 (2010).
- Fink, J., et al. Comparative study and improvement of current cell micro-patterning techniques. Lab Chip. 7 (6), 672-680 (2007).
- Strale, P. O., et al. Multiprotein Printing by Light-Induced Molecular Adsorption. Advanced Materials. 28 (10), 2024-2029 (2016).
- Belisle, J. M., Correia, J. P., Wiseman, P. W., Kennedy, T. E., Costantino, S. Patterning protein concentration using laser-assisted adsorption by photobleaching, LAPAP. Lab Chip. 8 (12), 2164-2167 (2008).
- Belisle, J. M., Kunik, D., Costantino, S. Rapid multicomponent optical protein patterning. Lab Chip. 9 (24), 3580-3585 (2009).
- Heinz, W. F., Hoh, M., Hoh, J. H. Laser inactivation protein patterning of cell culture microenvironments. Lab Chip. 11 (19), 3336-3346 (2011).
- Azioune, A., Carpi, N., Tseng, Q., Thery, M., Piel, M. Protein Micropatterns: A Direct Printing Protocol Using Deep UVs. Microtubules: In Vivo. 97, 133-146 (2010).
- Vignaud, T., Ennomani, H., Thery, M. Polyacrylamide hydrogel micropatterning. Methods in Cell Biology. 120, 93-116 (2014).
- Waldbaur, A., Waterkotte, B., Schmitz, K., Rapp, B. E. Maskless projection lithography for the fast and flexible generation of grayscale protein patterns. Small. 8 (10), 1570-1578 (2012).
- Kang, J., Choi, J. C., Kim, M., Jung, H. R., Doh, J. Photopatterning with a printed transparency mask and a protein-friendly photoresist. Methods in Cell Biology. 119, 55-72 (2014).
- Falconnet, D., Csucs, G., Grandin, H. M., Textor, M. Surface engineering approaches to micropattern surfaces for cell-based assays. Biomaterials. 27 (16), 3044-3063 (2006).
- Morlat, S., Gardette, J. L. Phototransformation of water-soluble polymers. Part II: photooxidation of poly(ethylene oxide) in aqueous solution. Polymer. 44 (26), 7891-7897 (2003).
- Qi, Y., Wang, J. K., McMillian, M., Chikaraishi, D. M. Characterization of a CNS cell line, CAD, in which morphological differentiation is initiated by serum deprivation. Journal of Neuroscience. 17 (4), 1217-1225 (1997).
- Shrirao, A. B., et al. A Versatile Method of Patterning Proteins and Cells. Journal of Visualized Experiments. (120), (2017).
- Pankov, R., Momchilova, A. Fluorescent labeling techniques for investigation of fibronectin fibrillogenesis (labeling fibronectin fibrillogenesis). Methods in Molecular Biology. 522, 261-274 (2009).
- Dertinger, S. K., Jiang, X., Li, Z., Murthy, V. N., Whitesides, G. M. Gradients of substrate-bound laminin orient axonal specification of neurons. Proceedings of the National Academy of Sciences of the United States of America. 99 (20), 12542-12547 (2002).
- Chelli, B., et al. Neural cell alignment by patterning gradients of the extracellular matrix protein laminin. Interface Focus. 4 (1), (2014).
- Tang, Y., Qiu, Q. F., Zhang, F. L., Xie, M., Huang, W. H. Quantifying orientational regeneration of injured neurons by natural product concentration gradients in a 3D microfluidic device. Lab Chip. 18 (6), 971-978 (2018).
- Srinivasan, P., Zervantonakis, I. K., Kothapalli, C. R. Synergistic effects of 3D ECM and chemogradients on neurite outgrowth and guidance: a simple modeling and microfluidic framework. PLoS One. 9 (6), (2014).
- de Luca, A. C., Faroni, A., Reid, A. J. Dorsal root ganglia neurons and differentiated adipose-derived stem cells: an in vitro co-culture model to study peripheral nerve regeneration. Journal of Visualized Experiments. (96), (2015).
- Khadpekar, A. J., Khan, M., Sose, A., Majumder, A. Low Cost and Lithography-free Stamp fabrication for Microcontact Printing. Scientific Reports. 9 (1), (2019).
- Delepine, C., et al. Altered microtubule dynamics and vesicular transport in mouse and human MeCP2-deficient astrocytes. Human Molecular Genetics. 25 (1), 146-157 (2016).
- Decock, J., Schlenk, M., Salmon, J. B. In situ photo-patterning of pressure-resistant hydrogel membranes with controlled permeabilities in PEGDA microfluidic channels. Lab Chip. 18 (7), 1075-1083 (2018).
- Stoecklin, C., et al. A New Approach to Design Artificial 3D Microniches with Combined Chemical, Topographical, and Rheological Cues. Advanced Biosystems. 2 (7), (2018).
- Toraille, L., et al. Optical Magnetometry of Single Biocompatible Micromagnets for Quantitative Magnetogenetic and Magnetomechanical Assays. Nano Letters. , (2018).
- Theodoly, O., et al. Live nanoscopic to mesoscopic topography reconstruction with an optical microscope for chemical and biological samples. PLoS One. 13 (12), (2018).
- Ermis, M., Antmen, E., Hasirci, V. Micro and Nanofabrication methods to control cell-substrate interactions and cell behavior: A review from the tissue engineering perspective. Bioactive Materials. 3 (3), 355-369 (2018).
- von Philipsborn, A. C., et al. Microcontact printing of axon guidance molecules for generation of graded patterns. Nature Protocols. 1 (3), 1322-1328 (2006).
- Ricoult, S. G., Kennedy, T. E., Juncker, D. Substrate-bound protein gradients to study haptotaxis. Frontiers in Bioengineering and Biotechnology. 3, (2015).
- Bietsch, A., Michel, B. Conformal contact and pattern stability of stamps used for soft lithography. Journal of Applied Physics. 88 (7), 4310-4318 (2000).
- Hui, C. Y., Jagota, A., Lin, Y. Y., Kramer, E. J. Constraints on microcontact printing imposed by stamp deformation. Langmuir. 18 (4), 1394-1407 (2002).
- Sharp, K. G., Blackman, G. S., Glassmaker, N. J., Jagota, A., Hui, C. Y. Effect of stamp deformation on the quality of microcontact printing: theory and experiment. Langmuir. 20 (15), 6430-6438 (2004).
- Delamarche, E., Schmid, H., Michel, B., Biebuyck, H. Stability of molded polydimethylsiloxane microstructures. Advanced Materials. 9 (9), 741-746 (1997).
- Perl, A., Reinhoudt, D. N., Huskens, J. Microcontact Printing: Limitations and Achievements. Advanced Materials. 21 (22), 2257-2268 (2009).
- Chakra, E. B., Hannes, B., Dilosquer, G., Mansfield, C. D., Cabrera, M. A new instrument for automated microcontact printing with stamp load adjustment. Review of Scientific Instruments. 79 (6), (2008).
- Pasturel, A., Strale, P., Studer, V. Tailoring 3D cell culture templates with common hydrogels. bioRxiv. , (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır