Method Article
Prostat Kanseri Biyobankacılık Için Örnekleme Prosedürleri Kılavuzu manyetik rezonans görüntüleme ve biyopsi verilerinin kullanımı
Bu Makalede
Özet
Bu yöntem, radikal prostatektomi sonrası biyobankacılık dokusunda örnekleme prosedürlerini yönlendirmek amacıyla prostat kanseri hastaları için klinik tanı salk›r›m verilerinin kullan›m›n› kapsamaktadır. Bu, daha geniş bir akış aşağı uygulama yelpazesi için taze dokunun verimliliği ve kullanılabilirliği etrafında daha önce yayınlanmış yöntemlerle ilgili sorunların üstesinden gelir.
Özet
Radikal prostatektomi sonrası biyobankacılık prostat dokusu için önceki yöntemler genellikle rastgele örnekleme içeriyordu. Verimliliği artırmak ve daha geniş bir aşağı akım uygulaması aralığına olanak sağlamak için, prostat dokusunu örneklemede daha hedefli bir yöntem geliştirilmiştir. Burada örnekleme için organın belirli alanlarını hedeflemek için hem manyetik rezonans görüntüleme (MRG) hem de biyopsi verilerini kullanıyoruz. Bu yöntem, prostatın önceden belirlenmiş bir bölgesinden 5 mm'lik enine dilimi kaldıran daha önce yayınlanmış bir prostat dilimleme cihazının kullanımını ve ardından bu dilimin önceden belirlenmiş bölgelerinden 6 mm yumruk biyopsisinin çıkarılmasını içerir. Bu numuneler dondurulmuş veya biyobankacılık amacıyla sabit saklanabilir veya rastgele örnekleme yaklaşımından % 10 güven ile karşılaştırıldığında, tümör içeriği% 70 güven ile hemen taze kullanılabilir. Bu genomik, proteomik veya histolojik çalışma gibi tüm standart downstream tekniklerinin kullanımını sağlar, ama aynı zamanda canlı doku görüntüleme veya ex vivo kültür gibi taze doku gerektiren iş.
Giriş
Yüksek kaliteli insan prostat kanseri dokusuna erişim alanında etkili araştırma sürüş için önemli bir gerekliliktir. Radikal prostatektomi sonrası prostat dokusunu örneklemek için çeşitli yöntemler vardır. Tipik olarak bunlar, prostat dokusunun taze, dondurulmuş veya sabit bir diliminden rastgele numune almak için yumruğa biyopsiler kullanılmasını ve her örnekte hematoksilin ve eozin (H&E) tarafından değerlendirildiği gibi tümörün bulunup bulunmadığını retrospektif olarak doğrulamayı içerir. üropatolog1,2,3,4,5. Yakın tarihli bir inceleme bu mevcut yöntemlerin genel bir bakış derledi6. Bu yöntemler, uluslararası kanser genom konsorsiyumu (ICGC) ve Kanser Genom Atlası (TCGA) gibi büyük ölçekli genomik analizler gibi dokuların daha sonraki bir tarihte tümör içeriği için depolanabileceği ve değerlendirilebileceği bazı downstream uygulamaları için yararlıdır. 4,7. Ancak, manyetik rezonans görüntüleme (MRG) ve/veya biyopsi verilerini örnekleme için prostatın belirli bölgelerini hedeflemek için kullanırsak bu yöntemler geliştirilebilir. Bu iki şekilde metodolojigeliştirmek olacaktır; birincisi, toplanan doku örneklerinin sayısını azaltarak, verimliliği artırarak ve patoloji bölümleri ve depolama maliyeti üzerindeki baskıyı azaltarak, ikinci olarak da taze dokunun hemen onaya gerek kalmadan kullanılmasına izin vererek tümör içeriği, canlı doku görüntüleme, organoid nesil veya ex vivo kültür gibi sanat downstream teknolojileri yeni devlet için. Bu araştırma ihtiyacı PEOPLE (REsearch için PatiEnt prOstate samPLes) yönteminin geliştirilmesine yol açmıştır ve ilk 84 vakanın sonuçları PEOPLE kullanılarak biyobanked son zamanlarda8yayınlandı . Bu yöntemin bir varyasyonu da üç boyutlu (3D) baskılı dilimleme aparatı ve hastaya özgü kalıp ile yayınlanmıştır, ön ve fiksasyon sonrası doku ex vivo MRI kolaylaştırmak için9,10.
Protokol
Protokol yerel kurallara uyar ve UCL/UCLC Biobank Araştırma Etik Komitesi tarafından onaylanmıştır (Referans 15/YH/0311).
NOT: Bu yöntem insan dokusunun örneklemesi içerdiğinden, etik ve rıza ile ilgili tüm yerel prosedürler protokolbaşlamadan önce uyulmalıdır. Ameliyat öncesinde hem MR Hem de biyopsi verileri mevcutsa radikal prostatektomi olguları dahil edilebilir, tümör çapı ≥5 mm. İndeks lezyonu iyi tanımlanmamışsa, yani sadece yaygın değişiklikler MRG ile görülebiliyorsa.
1. Prostat Dilimleme Aparatı
- Prostat dilimleme cihazı(Malzeme Tablosu)satın alın. Alternatif olarak, daha önce10olarak yayınlanan bir 3D yazıcı kullanarak bir bıçak tutamacı yazdırın.
NOT: Burada kullanılan cihaz ve tek kullanımlık bıçaklar, Londra, İngiltere'deki Kanser Araştırmaları Enstitüsü'nden malzeme transfer anlaşması kapsamında satın alınmıştır.
2. Tümör Hedefleme
- İndeks lezyonunu tanısal biyopsi ile gösterildiği gibi tanımlamak için klinik notları gözden geçirin, örneğin, sol posterior.
- Yukarıdaki tümörün yerini ölçmek için MRI görüntülerini gözden geçirin.
- Tümörün eksenel düzlemde en çok görülebildiği diziyi bulun, örneğin T2 ağırlıklı.
- Tümörün en büyük olduğu görüntüyü bulmak için eksenel görüntüler arasında ilerleyin ve referans için görüntüyü yazdırın.
- Karşılık gelen koronal görüntüde, prostat tabanından seçilen eksenel pozisyona olan uzaklığı ve prostatın apeksten baza (mm) tam uzunluğunu ölçün ve referans olarak yazdırın.
3. PProstate'nin toplanması
- Bu prosedür ve alt akım araştırma uygulamaları için uygun bilgilendirilmiş onam alınmış olduğundan emin olmak için hasta notlarını kontrol edin.
- Radikal prostatektomi sonrasında, kuru bir tencerede prostat toplamak. Prostata formalin veya başka bir fiksatif eklenmediğinden emin olun.
- Bir patoloji laboratuvarında laminar akış kaputu gibi numune alma için uygun bir steril konuma transfer.
- Taze doku gerekiyorsa mümkün olan en kısa sürede örneklemeye devam edin.
NOT: Bazı uygulamalar için (örneğin, RNA kadar hızlı bozulmaması gereken DNA'nın değerlendirilmesi), numunenin soğutulması ve ertesi gün numune alınması uygun olabilir.
4. Numune Hazırlama
- Steril tekniği kullanarak yerel dekontaminasyon prosedürlerine göre laminar akış başlığı ve prostat dilimleme aparatı hazırlayın. Burada% 70 etanol sprey ve tüm yüzeylerarasında silin. Steril tek kullanımlık iğneler ve neşterler kullanın. Dilimleyici bıçakları en fazla üç kez kullanın; sıcak sabunlu suda her kullanımdan sonra yıkayın, sonra sprey ve% 70 etanol ile silin.
- Standart bir ölçek kullanarak prostatı (g) tartın.
- Prostata mürekkep. Sol tarafı mavi mürekkeple, sağ tarafını siyah mürekkeple boyayın. Kapak tam kapsül ve daha sonra cerrahi marjları belirtmek için mürekkep ile seminal veziküller.
NOT: Mürekkep leme yordamları yerel olarak değişebilir ve buna göre değiştirilebilir.
5. Prostat Dilimleme
- Duvarları standın tabanına dik olarak yerleştirerek dilimleme aparatı montajı(Şekil 1A).
- Temel ve apeks ters duvarlara bakan, arka tarafı aşağı ve ön ile, böylece prostat yerleştirin. Prostatın etrafına altın iğneler yerleştirin. Dilimleme sırasında prostatı destekleyecek rahat bir uyum elde etmek için gerekirse prostatı hafifçe içe doğru itin.
- Bir cetvel kullanarak prostat uzunluğunu tabandan tepeye ölçün ve MRG ile ölçülen prostat uzunluğuile karşılaştırın. Prostat küçüldüyse, tabandan hedef enine dilime beklenen mesafeye geçici bir düzeltme uygulayın. Örneğin, MRG görüntüsündeki prostatın tam uzunluğu 50 mm ise, ancak bu noktada bir cetvel ile ölçüldüğünde 45 mm'ye küçüldü, beklenen dilimleme pozisyonunu %10 azaltın.
- Tabandan istenilen enine dilime kadar ölçün. Etrafında dilimlemek için bu ölçüme en yakın olan pimi seçin.
- Yaralanmayı önlemek için zincirleme eldiven takmak, dilimleme cihazını tutun(Şekil 1B),tanımlanan pimin her iki tarafına bıçakyerleştirin ve bıçakları 5 mm ayrı tutmak için boşluk tuşunu kullanın. Bıçakları uzun vuruşlarla aşağı, ileri ve geri yavaşça ve sıkıca hareket ettirerek dilim alın(Şekil 1C). Aygıtı sökmeden önce tam bir dilimin ayrıldığından emin olun.
- Duvarları ve pimleri çıkarın ve dikkatle eldiven kullanarak mantar levha steril bir levha üzerine dilim dışarı çıkarın.
6. Doku Örneklemesi
- Enine dilimi görsel olarak inceleyin ve eksenel MR Görüntüsü ile karşılaştırın. Bazı durumlarda, tümör alanı çevreleyen doku daha soluk görünebilir.
- Enine dilimi nazikçe palpatlayın. Bazı durumlarda, tümör çevreleyen doku daha sıkı hissedebilirsiniz.
- Eksenel MRI görüntüsünü kılavuz olarak kullanarak, örnekleme için bir veya daha fazla alan seçin.
-
Doku istenilen alanda biyopsi yumruklar alın.
- 6 mm'lik bir zımba kullanarak, istenilen doku bölgesine bastırın.
- Tam ayrışmayı sağlamak için doku yumruğunu mantara karşı yerinde ve aşağı doğru bükün ve gerekirse ayırmak için keskin bir neşter kullanın.
- Zımbayı çıkarın ve gerektiğinde piston kullanarak dışarı atarak tüplere/kalıplara yerleştirin.
- Ayrı steril biyopsi yumrukları ile gerektiğinde daha fazla tümör ve iyi huylu örnekler için tekrarlayın. Yumrukların kırmızı yla alındığı delikleri mürekkeple.
- Her yumruğun yerini, prostatın ağırlığı ve doku rengi/sıkılığı üzerine yapılan gözlemlere dikkat edin.
7. Lokal Tanı için Prostat ın Sunulması
- Doku büzülmesini ve çözgüoluşmasını önlemek için fiksasyondan önce prostatı steril tek kullanımlık iğnelerle sabitleyin, bu da cerrahi marjların görünümünü değiştirebilir.
- Mantara sabitlemeden sonra, standart klinik tanı için prostatı histopatoloji bölümüne gönderin.
8. Cihazların Dekontaminasyonu
- Biyomedikal atık akışlarındaki ve/veya yerel olarak belirlenen keskin kaplara tüm tek kullanımlık ekipmanları atın.
- Laminar akış kaputunu ve prostat dilimleme cihazını insan dokusuna uygun yerel risk değerlendirmelerine uygun olarak dekontamine edin (örn. %70 EtOH ve silme ile püskürtün).
Sonuçlar
PEOPLE yöntemi kullanılarak örnekalınan taze prostat dokusu, genomik sıralama ve ex vivo kültürü de dahil olmak üzere çeşitli downstream teknikleri için kullanılabilir. Bu yöntem kullanılarak örnekalınan ilk 59 örnek daha önce yöntemin önceki bir sürümü ile karşılaştırıldığında, ilk downstream veri8ile birlikte yayımlanmıştır. Burada prostatın ilk dilimlenmesinden delme biyopsilerinin dondurulması/onarılmasına kadar olan süre yaklaşık 1 dk idi ve RNA'nın bozulmasını önlemek için minimumda tutuldu. Prostatın çıkarılmasından prostat dilimlemesine kadar geçen süre de minimumda tutulmalıdır, ancak burada tiyatro ve patoloji laboratuvarlarımızın farklı yerlerde olması nedeniyle yaklaşık 20 dakika süre verilmelidir.
Downstream uygulamasına bağlı olarak, tipik olarak en az iki örnek alınır: biri beklenen tümör dokusunun bulunduğu bir bölgeden, diğeri de beklenen iyi huylu dokunun bulunduğu bir bölgeden. Örnekleme yönteminin başarısının temel ölçüsü, belirli bir örneklemdeki tümör içeriğini değerlendirmektir.
100.000 genom projesine girilen için, bir H&E lekeli doku bölümü bir üropatolojist tarafından değerlendirilmelidir ve örnek en az %40 tümör hücresi içermelidir. %40'tan az tümör içeren numuneler, başarılı bir şekilde makrodissected ise yine de projeye dahil edilebilir. Bu şekilde örnekalınan ilk 92 olgunun %64'ü en az %40 tümör içermiş ve makrodiskes olmadan 100.000 Genom Projesi'ne sunulmuştur. DNA çıkarıldı ve her durumda yeterli verim ve kaliteye göre dilendi(Tablo 1). Bu örneklerin 59'unun ilk alt kümesi daha önce daha önceki bir yöntem8ile karşılaştırıldığında yayınlanmıştır.
Ex vivo kültür için, eşleşen tümör ve iyi huylu doku önemli bozulma olmadan 72 h kültür dayanacak kadar kaliteli olmalıdır. Toplam üç hastadan alınan çoklu doku örnekleri başarıyla8.000adet kültüre alındı.
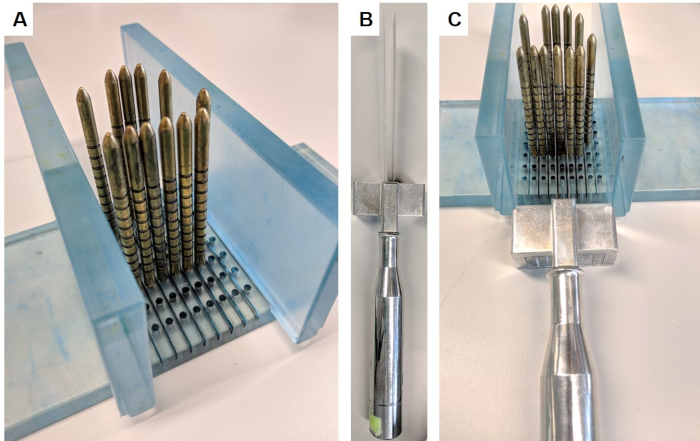
Şekil 1: Prostat dilimleme cihazı. Bu cihaz Kanser Araştırma Enstitüsü'nün malzeme transfer anlaşması ile elde edildi. (A)Duvarlar tabanına dik olarak yerleştirilir ve altın iğneler prostatı çevreleyen taban içine yerleştirilir (prostat resimde değil). (B) Değiştirilebilir paralel bıçaklar bıçak koluna yerleştirilir. (C) Bıçaklar prostatın 5 mm'lik bir bölümünü dilimlemek için altın iğnelerin arasından geçer. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| n (%) | |
| Hit (>%40 tümör) | 59 (64%) |
| Parsiyel vuruş (%5-30 tümör) | 6 (7%) |
| Miss (%0 tümör) | 27 (29%) |
| Toplam | 92 (100%) |
Tablo 1: Tümör vurma oranı. Tümör isabet oranı, H&E lekeli dokunun incelenmesinden sonra prostat kanseri konusunda uzmanlaşmış bir danışman patolog tarafından belirlendi. 100.000 Genom Projesi'ne dahil edilmeye uygun olduğu tespit edildi.
Tartışmalar
Bu protokol deki kritik adımlar arasında tümör bölgesinin örnekleme için tanımlanması, prostat ölçümü ve doku örneklemesi yer almaktadır. İlk olarak, örneklemenin doğru alanını belirlemek için MRG ölçümü önemlidir. Bu yöntemi eşlik eden videoda gösteriyoruz; ancak, ilk etapta bir radyolog ile ölçümlerin onaylanmasını da öneririz. İndeks lezyonu içeren MR Görüntüleri alanına doğru araştırmacı noktası net klinik notlar idealdir. İkinci olarak, prostat ölçümü dikkatle yapılmalıdır, cetvel prostat ın ön paralel, tabandan tepeye tam uzunluğu ölçmek için bir açıda tutulur sağlanması. Üçüncü olarak, tümör bölgeleri orijinal MRI görüntüsüne göre doku dilimini görsel olarak inceleyerek, doku palpe edilerek (bazı durumlarda tümör bölgesi daha yoğun hissedebilir) ve görsel olarak dokunun rengini değerlendirerek örneklemeden önce teyit edilmelidir (bazı durumlarda tümör çevreleyen benign dokudaha soluk görünecektir).
Bu protokol ucl/UCLH'de klinik olmayan doktora sonrası araştırmacılar, patoloji uzmanı, patoloji danışmanları ve araştırma teknisyenleri tarafından tam olarak gerçekleştirilmiştir. Deneyimlerimize göre protokolün tüm adımları teknik arka plan ne olursa olsun on vaka altında öğrenilebilir. Ancak, bir radyologdan MRG ölçümü ve ilk etapta dilimleme ile ilgili bir patologdan eğitim almanızı öneririz. Protokol, daha önce10olarak yayımlandığı gibi, 3B baskılı dilimleme tutamacı kullanılarak değiştirilebilir.
Tekniğin olası sınırlamaları tanıda engellenme riskini içerir. Prostat dilimleme yanlış yapılırsa derecelendirme veya pozitif marj oranları engelleyebilir önemli bir adımdır. Burada iki potansiyel sorun var. İlk olarak, indeks lezyonunun tamamı çıkarılır ve hemen taze doku deneyi için kullanılırsa, bu lezyon için rutin klinik tanı yapılmaz ve hastaya daha düşük dereceli kanser tanısı konulabilir. Bunu önlemek için araştırmacı, örneklemeden önce vakayı rutin olarak gözden geçirecek olan danışman patologla örnekleme planını tartışmalı ve alınacak numunelerin sayısı ve yeri üzerinde anlaşmalıdır. Bu nedenle küçük tümörler lokal olarak dışlanabilir. İkinci olarak, prostat kapsülü fiksasyon dan önce mantar tahtasına doğru bir şekilde sabitlenmezse, bu iç dokunun fiksasyon sırasında dışa doğru şişkinlik etmesine izin vererek cerrahi marjları değiştirebilir. Bu yanlış bir pozitif marjyol açabilir, kalan tümör kapsül de tamamen doku çözgü nedeniyle ikamet gibi görünüyor nerede.
Bu tekniğin mevcut yöntemlere göre önemi esas olarak tümör hedeflemesi ile ilgilidir. Bugüne kadar radikal prostatektomi örneklerinin örneklenme yöntemleri yayınlanmıştır; ancak, bunların hepsi tamamen veya kısmen rastgele örnekleme yaklaşımı1,2,3,4,5,6,7güveniyor. Biyopsi kullanımı ve özellikle MRG veri burada verimlilik artırıldı, tümör dokusu elde artan güven ile azaltılmış örnekleme için izin8.
Bu yöntemin gelecekteki uygulamaları, önceki örnekleme yöntemlerine göre daha geniş bir akış aşağı tekniği yelpazesinin benimsenmesine olanak sağlar. Örneğin, tümör olma olasılığı yüksek olan taze dokunun kullanılabilirliği, tümörün varlığını sağlamak için birçok örnek gerektirmediğinden, daha pahalı ve/veya emek yoğun taze doku tekniklerinden yararlanılabildiği anlamına gelir. Bu, ex vivo kültür, ex vivo MRG, gelişmiş görüntüleme ve transkripsiyon dahil ve bunlarla sınırlı değildir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar Prostat Kanseri İngiltere Mükemmellik ve Seyahat Ödülü Bursu (TLD-PF16-004) ve HP INNOVATE (PG14-018-TR2) altında SH fon için Prostat Kanseri İngiltere kabul etmek istiyorum. Bu çalışma, Ulusal Sağlık Araştırma Enstitüsü University College London Hospitals Biyomedikal Araştırma Merkezi'ndeki araştırmacılar tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 6 mm biopsy punch | Fisher Scientific | 13404607 | Disposable biopsy punches for removing 6 mm tissue samples |
| Black Ink | Leica Biosystems | 3801753 | Tissue marking & margin dye |
| Blue Ink | Leica Biosystems | 3801751 | Tissue marking & margin dye |
| Chainmail hand glove | Arco | 1456803 | Chainmail gloves to protect hand during slicing |
| Cork board | Fisher Scientific | 12396447 | Cork board for pinning prostate to following sampling procedure |
| Needles | SLS (Scientific Laboratory supplies) | SYR6112 | Sterile needles to use to pin tissue to cork board following sampling |
| Prostate slicing aparatus | Insitute of Cancer Research, London | NA - must be obtained under MTA | A kit containing the slicer handle, blades, spacer, base, walls and pins |
Referanslar
- Sooriakumaran, P., Henderson, A., Denham, P., Langley, S. E. A novel method of obtaining prostate tissue for gene expression profiling. International Journal of Surgical Pathology. 17 (3), 238-243 (2009).
- Jhavar, S. G., et al. Processing of radical prostatectomy specimens for correlation of data from histopathological, molecular biological, and radiological studies: a new whole organ technique. Journal of Clinical Pathology. 58 (5), 504-508 (2005).
- Wheeler, T. M., Lebovitz, R. M. Fresh tissue harvest for research from prostatectomy specimens. The Prostate. 25 (5), 274-279 (1994).
- Esgueva, R., et al. Next-generation prostate cancer biobanking: toward a processing protocol amenable for the International Cancer Genome Consortium. Diagnostic Molecular Pathology. 21 (2), 61-68 (2012).
- Dev, H., et al. Biobanking after robotic-assisted radical prostatectomy: a quality assessment of providing prostate tissue for RNA studies. Journal of Translational Medicine. 9, 121 (2011).
- Tolkach, Y., et al. Blind Biobanking of the Prostatectomy Specimen: Critical Evaluation of the Existing Techniques and Development of the New 4-Level Tissue Extraction Model With High Sampling Efficacy. The Prostate. 77 (4), 396-405 (2017).
- Warren, A. Y., et al. Method for sampling tissue for research which preserves pathological data in radical prostatectomy. The Prostate. 73 (2), 194-202 (2013).
- Heavey, S., et al. PatiEnt prOstate samPLes for rEsearch, a tissue collection pathway utilizing magnetic resonance imaging data to target tumor and benign tissue in fresh radical prostatectomy specimens. The Prostate. 79 (7), 768-777 (2019).
- Bailey, C., et al. VERDICT MRI validation in fresh and fixed prostate specimens using patient-specific moulds for histological and MR alignment. NMR in Biomedicine. 32 (5), 4073 (2019).
- Bourne, R. M., et al. Apparatus for Histological Validation of In Vivo and Ex Vivo Magnetic Resonance Imaging of the Human Prostate. Frontiers in Oncology. 7, 47 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır