Method Article
Organoid Kültürü Kullanarak Fare Prostat Epitel Hücrelerinin Ayırt Etme Kapasitesinin Değerlendirilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Fare prostat organoidleri farklılaşmayı düzenleyen mekanizmaları değerlendirmek için umut verici bir bağlam temsil eder. Bu makalede prostat organoidleri kurmak için geliştirilmiş bir yaklaşım açıklanır ve (1) organoidlerden protein lysate toplamak için yöntemler tanıttı, ve (2) tam monte konfokal mikroskopi için düzeltve leke organoidler.
Özet
Prostat epitel ağırlıklı olarak bazal ve luminal hücrelerden oluşur. In vivo soyu takibi, gelişim, doku-rejenerasyon ve dönüşüm sırasında fare prostat bazal ve luminal hücrelerinin farklılaşma kapasitesini tanımlamak için kullanılmıştır. Ancak, bir soy izleme yaklaşımı kullanarak prostat epitel ayırılma kapasitesinin hücre içi ve dışsal düzenleyicilerin değerlendirilmesi genellikle kapsamlı üreme gerektirir ve maliyet-engelleyici olabilir. Prostat organoid testinde bazal ve luminal hücreler prostatik epitel eksvivo üretirler. Daha da önemlisi, birincil epitel hücreleri herhangi bir genetik geçmişe sahip farelerden ya da üç boyutlu (3D) kültüre kaplamadan önce veya sonra herhangi bir sayıda küçük molekülle tedavi edilen farelerden izole edilebilir. 7-10 gün sonra farklılaşma kapasitesinin değerlendirilmesi için yeterli malzeme üretilir. (1) Batı blotu ile protein analizi için bazal türetilmiş ve luminal türetilmiş organoidlerin toplanması ve (2) bozulmamış organoidlerin immünohistokimyasal analizi nin tam montajlı konfokal mikroskopi ile araştırmacıların ekstremite farklılaşmasını değerlendirmelerini sağlar prostat epitel hücrelerinin kapasitesi. Bu iki yaklaşım birlikte kullanıldığında, genetik veya farmakolojik manipülasyona yanıt olarak prostat bazal ve luminal hücrelerinin ayırım kapasitesi hakkında tamamlayıcı bilgiler sağlar.
Giriş
Bazal ve luminal hücreler prostat epitel1 çoğunluğunuoluşturur. Soy izleme çalışmaları bu hücre tiplerinin ağırlıklı olarak yetişkin fare2farklı ataları tarafından kendini idame ettiren olduğunu ortaya koymuştur; ancak, bazal döllerden luminal diferansiyasyon geliştirme dahil olmak üzere çeşitli bağlamlarda gözlenmiştir3,4, doku rejenerasyon5 , inflamasyon6,7 ve prostat kanseri başlatma2,8. Ayrıca, ortaya çıkan veriler çok güçlü luminal atalarının yanı sıra luminal kararlı atalarının varlığını destekler9. Metastatik prostat kanserinde, ar bağımlı luminal soydan bazal ve nöroendokrin özelliklere sahip ar-kayıtsız soydan farklılaşma androjen yol inhibitörleri10,11,12direnç giderek takdir mekanizması nı temsil eder. Bu nedenle, farklılaşma normal fizyoloji, kanser inisiyasyonu ve tedaviye direnç karıştığı gibi, prostat epitel hücre farklılaşması önemli moleküler düzenleyiciler açıklığa kavuşturma önemlidir.
Fare prostat organoid modeli prostat epitel hücre farklılaşması9,13,14çalışma zarif bir ex vivo bağlam olarak ortaya çıkmıştır. Bu tökezmede, tek tek epitel hücreleri 1 hafta içinde hem bazal hem de luminal hücreleri içeren glandüler yapılar oluşturmak bir 3D matris içine kaplanır. Organoid kültüriçine hücreleri kaplamak için mevcut yaklaşımlar verimli organoidler oluşturmak için kullanılabilir iken, bu yaklaşımlar daha fazla optimizasyon gerektirir14. Prostat organoidleri ile ilgili önemli zorluklar (1) analizden Matrigel altında oluşan iki boyutlu (2D) koloniler hariç (2D) analiz, (2) medya değişiklikleri sırasında matris jel bütünlüğünü korumak, ve (3) doğru organoidler sayma. Bu kağıt fare prostat izole epitel hücrelerinden organoidler oluşturmak için bir yaklaşım özetliyor. Açıklanan yaklaşım, 2B kolonilerin oluşmasını önlemek için poli (2-hidroksitil metakrilat) (Poly-HEMA) ile kaplama plakaları gerektirir. Ayrıca, hücreler bir matris jel halka içine kaplanır, bir matris jel disk yerine, hangi medya değişen ve organoidler daha az zor sayma yapar. Bu teknikler, araştırmacıların genetik değişikliklerin veya küçük moleküllerin organoid oluşumundan önce veya sırasında ortaya konması gibi farklılaşma gibi temel süreçleri nasıl değiştirdiğini daha kolay araştırmalarına olanak sağlar.
Batı leke veya immünohistokimyasal analiz için prostat organoidlerinin toplanması, farklılaşmaya dair değerli mekanistik içgörü sağlayabilir13, ancak organoidleri bu tür tekniklere hazırlamak için iyi kurulmuş protokoller eksiktir. Bu el yazması, (1) protein lisatının toplanması için organoidlerin hasat yaklaşımlarını veya (2) konfokal mikroskopi için fiksasyon ve boyama yaklaşımlarını açıklamaktadır. Daha da önemlisi, prostat organoidlerinin düzeltilmesi ve boyanması için tanımlanan yaklaşım, mevcut yöntemlere göre önemli ölçüde iyileştirilmiştir. Bunlar organoidlerin kesitine dayanırken15, Bu el yazmasında açıklanan yöntem, numune hazırlama sırasında organoid hasara karşı korumaya yardımcı olan sağlam organoidler kullanır. Birlikte kullanıldığında, Batı leke ve konfokal mikroskopi farklılaşma moleküler düzenleyiciler ilerler. Alternatif olarak, bu yaklaşımlar geliştirme ve dönüştürme gibi diğer süreçleri modellemek için kullanılabilir.
Protokol
Burada açıklanan tüm yöntemler Kaliforniya Üniversitesi Kurumsal İnceleme Kurulu tarafından onaylanmıştır, Los Angeles.
NOT: Kağıttaaçıklanan yaklaşımları gösteren şema Şekil 1'de verilmiştir.
1. Floresan Aktive Hücre Sıralama (FACS) kullanarak Fare Bazal ve Luminal Prostat Epitel Hücreleri Izole - ZAMANLAMA: 30 Dk
NOT: Karanlıkta 1.3-1.5 adımlarını gerçekleştirin.
- Lawson ve ark.16'daaçıklandığı gibi hücreleri total fare prostatından ayırdıktan sonra hücreleri FACS tüplerine aktarın ve 100 μL'lik ayrışma ortamında 0,1-5 x 106 hücreyi yeniden askıya alın (Tablo 1).
- Cd45, CD31, Ter-119, EpCAM ve CD49f: Aşağıdaki doğrudan konjuge birincil antikorlar uygun hacmi ekleyin.
- 20 dakika boyunca ışıktan korunan buz üzerinde kuluçka.
NOT: Lekesiz ve tek lekeli kontroller için toplam ayrışmış hücrelerin %10'unun kullanılması önerilir. Bu kontroller sıralama için doğru kompansasyon ve gerilim ayarlamak için gereklidir. - Her numuneye 1 mL ayrıştırma ortamı ekleyerek antikor kokteylini söndürün. Hücreyi 800 x g'da oda sıcaklığında 5 dk (RT) santrifüj ile peletleyin ve süpernatantı azarlayarak çıkarın.
- 1 μg/mL 4',6-diamidino-2-fenilindole (DAPI) içeren dissosiasyon ortamlarının uygun hacimdeki hücreleri (1 x 106 hücre başına 250 μL) yeniden askıya alın. FACS'a devam edin. Fare bazal ve luminal prostat epitel hücrelerinin izolasyongösteren akış sitometri çizimleri Şekil 2'degösterilmiştir.
2. Primer Fare Organoid Kültürüne Göre Prostat Epitel Hücrelerinin Kaplaması — ZAMANLAMA: 2-3 H (Poli-HEMA Kaplı Plaka Hazırlama hariç)
NOT: Plakalar, matris jelin altındaki kuyunun yüzeyinde 2B koloni oluşumunu önlemek için Poly-HEMA ile kaplanır. Poly-HEMA kaplı plakaları, fare organoid kültürüne ayırılmış bazal veya luminal prostat epitel hücrelerini kaplamadan 1 gün önce hazırlayın. Azaltılmış büyüme faktörü matris jel 1 mL aliquots, bundan sonra matris jel olarak anılacaktır, buz üzerinde 2 saat önce adım 2.1. Y-27632 (ROCK inhibitörü) adım 2.1'den hemen önce fare organoid ortama eklenmelidir. Buz üzerinde 2.1-2.8 adımlarını gerçekleştirin.
- 4 °C'de 5 dk için 800 x g'de santrifüj ile 5 mL yuvarlak alt tüplerdeki hücreleri peletleyin ve süpernatant aspire edin.
- Hücre peletini fare organoid media 500 μL'lik olarak yıkayın (Tablo 2)14.
- 4 °C'de 5 dk için 800 x g'de santrifüj ile hücreleri peletleyin ve süpernatant aspire edin.
- Fare organoid ortamlarında 1.000 hücre/μL hücre yoğunluğunda yeniden askıya alın.
- Ana karışımları hazırlamak için, fare organoid ortamda asılı epitel hücreleri matris jel ile karıştırın% 25 hücreleri / medya ve% 75 matris jel içeren son bir karışım oluşturmak için. Bazal hücreler genellikle 100-2.000 hücre/80 μL konsantrasyonda, luminal hücreler ise genellikle 2.000-10.000 hücre/80 μL konsantrasyonda kaplanır. Kaplanmış hücrelerin yoğunluğu beklenen malzeme toplama gününe ve istenilen aşağı akım uygulamasına bağlı olarak değişir.
NOT: Chill uygun büyüklükte tüp (ler) beklenen ana karışım hacmi için 5 dk önce ana karışım hazırlama. Matris jelinin elleçleme sırasında sertleşmemesini sağlamak için, yeni bir tüpe aktarmadan önce matris jeli 3-4 kez pipetleme yaparak pipet ucunu soğutmak çok önemlidir. - 24 kuyulu bir plakanın her bir parçasına matris jel/hücre karışımından 80 μL ekleyin. Poli-HEMA kaplama ile doğrudan temas kaçınarak, kuyunun alt yarısı üzerine bir damlacık pipetleme önerilir. Matris jel ekledikten sonra, matris jel / hücre karışımı kuyunun kenarı etrafında bir halka oluşturmak için izin vermek için plaka girdap.
- Matris jelin kısmen sertleşebilmesi için 24 kuyulu plakayı 10 dakika boyunca 37 °C 5% CO2 kuluçka makinesine yerleştirin.
NOT: 24 kuyulu plakayı kuvöze yerleştirdikten hemen sonra fare organoid ortamını 37 °C'de ısıtmaya başlayın. - 10 dakika kuluçkadan sonra, matris jelin tamamen sertlemesine izin vermek için 24 kuyulu plakayı ters çevirin ve 50 dk daha kuluçkaya yatırın.
- Her kuyunun ortasına 350 μL önceden ısıtılmış fare organoid ortamı ekleyin.
NOT: Matris jel bütünlüğünü korumak için, medya eklerken matris jel halka önlemek için önemlidir. - Ortamı ekledikten sonra, 24 kuyulu plakayı %37 °C 5%CO2 kuluçka makinesine geri getirin.
3. Fare Organoid Medya Ikmali — ZAMANLAMA: 10-15 Dk Per 24-well Plate
NOT: Mevcut ortam her 48 saatte bir taze medya ile değiştirilmelidir. Her ortam değişmeden önce, önceden ısınmış fare organoid ortam. Yenileme için kullanılan ortama ROCK inhibitörü eklemenize gerek yoktur.
- 24 kuyulu plakayı 45° açıyla yatırın ve matris jel halkasından kaçınırken p1000 pipet kullanarak mevcut ortamı her kuyunun ortasından nazikçe çıkarın.
- Adım 2.9'da olduğu gibi önceden ısıtılmış fare organoid ortamının 350 μL'sini ekleyin. Önemli besin maddelerinin ve büyüme faktörlerinin hızlı bir şekilde tükenmesini önlemek için 5 günden uzun süre kültürlenmiş organoidlere daha büyük hacimli (1 mL'ye kadar) ortam eklenmesi önerilir.
4. Batı Leke Analizi için Prostat Organoidlerinden Protein Lysat'ın Çıkarılması — ZAMANLAMA: 2.5-4 H
NOT: Protein lisate ekstraksiyonu için organoidler toplanmadan önce, pre-sıcak dispase içeren ortam hazırlayın ve önceden hazırlayın(Tablo 1).
- 3.1 adımda olduğu gibi ortamı her birinden çıkarın.
- Organoidleri toplamak için, tüm halka yerinden çıkana kadar doğrudan matris jel halkasına 1 mL dispase içeren ortam borutlama tarafından matris jeli tekrar tekrar patlatın ve 1,5 mL mikrosentrifuge tüpüne aktarın.
NOT: Poli-HEMA kaplı kuyularla doğrudan temastan kaçınmak çok önemlidir. Doğrudan temas, toplanan malzemenin Poli-HEMA ile kontaminasyonuna neden olabilir ve bu da hücre sağkalımını olumsuz etkileyebilir. - Matris jelinin dispase ile tam olarak sindirimine izin vermek için 1,5 mL mikrosentrifüge tüpü 37 °C 5%5 CO2 kuluçka makinesine 30 dakika ila 1 saat arasında yerleştirin.
- Pelet organoidler 800 x g'da rt'de 5 dk santrifüj ile yapılır ve mikropipet kullanarak süpernatant çıkarılır.
- Organoid pelete fosfat tamponlu salin (PBS) ekleyin ve hafifçe hareket ettirerek yeniden askıya alın.
NOT: Organoid peletin yeterince askıya alınamaması organoid malzemenin artık dispase veya matris jel ile kirlenmesine neden olabilir. - Rt 5 dakika için 800 x g santrifüj ile organoidler pelet ve bir micropipeette kullanarak supernatant kaldırın.
- Her tüpü kuru buz ve metanol içeren bir çözeltiye yerleştirerek organoid peletleri hızlı bir şekilde dondurun. Tüpü ileride -80 °C'de kullanıma kadar saklayın. Alternatif olarak, 4.6.adımdan hemen sonra protein iüzeremi elde edin.
- 10 μL'lik hücre hacminde 100 μL protein lisis tamponu(Tablo 1) içinde organoid peletleri yeniden askıya alın. Yeniden askıya almak için flick.
NOT: Hızlı donma sonrasında devam ederseniz, -80 °C'den numuneleri çıkarmadan önce protein lisis tamponunun çözülmesini sağlayın, çünkü fosfataz ve proteaz aktivitesini önlemek için numunelere hemen lysis tamponu eklenmelidir. - Proteinleri en az 45 dakika buz üzerinde protein lisis tamponuna inkübe edin.
NOT: Nükleer protein geri kazanımının verimliliğini artırmak için buzüzerinde kuluçkadan önce sonicate önerilir; ancak, sonication gerekli değildir. Sonication yapılmazsa, adım 4.10'a geçin.- Sonicate için, ıslak buz tüpleri batırın ve yavaşça mikrosantrifüj tüp dışında sonik dismembrator ucu uygulayın. Sonicate için 40 s 20 kHz.
- Belirlenen protokolleri izleyerek Batı lekesine devam edin.
5. Tam Montaj Konfokal Mikroskopi ile İmmünohistokimyasal Analiz için Prostat Organoidlerinin Düzeltilmesi ve Boyanması
-
24 kuyu tabaklardan prostat organoidlerinin toplanması — ZAMANLAMA: 45-60 dk
NOT: Konfokal mikroskopi için işlemek için prostat organoidleri toplarken, yapılarını korumak için dikkatli bir şekilde ele almak önemlidir. Aşağıdaki toplama protokolü izolasyon sırasında organoid yapının bozulmasını azaltmak için tasarlanmıştır.- 3.1 adımda olduğu gibi ortamı her birinden çıkarın.
- Matris jelini 37 °C 5% CO2 kuluçka makinesinde 30 dakika boyunca 500 μL dispase içeren ortam(Tablo 1)ile kuluçkaya yatırarak sindirin.
- Bir mikrosantrifüj tüp içinde sindirilmiş organoid süspansiyon toplamak ve 800 x g 3 dakika için santrifüj ile organoidler pelet.
-
Prostat organoidlerinin tam montaj immünoresan boyama - ZAMANLAMA: 3-4 gün (1-5 saat/gün)
- PBS'de %4 paraformaldehit 500 μL ekleyin ve rt'de hafif sallayarak 2 saat kuluçkaya yatırın.
- Rt'de 3 dk için 800 x g santrifüj ile organoidler pelet, supernatant kaldırmak ve nazik sallayarak 15 dakika pbs 1 mL ile pelet yıkayın.
- Ek iki kez adım 5.2.2 gibi pelet yıkayın.
- Rt 3 dakika için 800 x g santrifüj ile organoidler pelet ve supernatant kaldırın. Engelleme çözeltisinde 1 μg/mL DAPI ekleyin (Tablo 1). RT'de 2 saat veya alternatif olarak bir gecede 4 °C'de hafif çesitli sallayarak kuluçkaya yatırın.
- Rt 3 dakika için 800 x g santrifüj ile organoidler pelet ve supernatant kaldırın. Birincil antikor ekleyin (tavşan anti-p63, fare anti-sitokeratin 8) engelleme çözeltisi ve nazik sallayarak 4 ° C gecede kuluçka.
- Rt 3 dakika için 800 x g santrifüj ile organoidler pelet ve supernatant kaldırın. Peleti 1 mL PBS ile 15 dk boyunca hafif çetrenle yıkayın.
- Ek iki kez adım 5.2.6 gibi pelet yıkayın.
- Rt 3 dakika için 800 x g santrifüj ile organoidler pelet ve supernatant kaldırın. İkincil antikor ekleyin (keçi anti-tavşan IgG-Alexa Fluor 594, keçi anti-fare IgG-Alexa Fluor 488) bloklama çözeltisi ve nazik sallayarak 4 ° C gecede kuluçka.
- Rt'de 3 dk için 800 x g santrifüj ile organoidler pelet, supernatant kaldırmak ve nazik sallayarak 15 dakika pbs 1 mL ile pelet yıkayın.
- Ek iki kez adım 5.2.9 gibi pelet yıkayın.
6. Tam Montaj Konfokal Mikroskopi için Lekeli Prostat Organoidlerinin Doku Temizlenmesi ve Montajı — ZAMANLAMA: 7 H
- Rt 3 dakika için 800 x g santrifüj ile organoidler pelet ve supernatant kaldırın.
- PBS'de %1 Triton X-100 ile %30 sakarozun 1 mL'sini ekleyin ve rt'de hafif sallayarak 2 saat kuluçkaya yatırın.
- Rt 3 dakika için 800 x g santrifüj ile organoidler pelet ve supernatant kaldırın.
- PBS'de %1 Triton X-100 ile %45 sakarozun 1 mL'sini ekleyin ve rt'de hafif sallayarak 2 saat kuluçkaya yatırın.
- Rt 3 dakika için 800 x g santrifüj ile organoidler pelet ve supernatant kaldırın.
- PBS'de %1 Triton X-100 ile 1 mL%60 sakaroz ekleyin ve rt'de hafif sallayarak 2 saat kuluçkaya yatırın.
- Rt 3 dakika için 800 x g santrifüj ile organoidler pelet ve supernatant% 95 çıkarın.
NOT: Sakaroz konsantrasyonu arttıkça pelet daha gevşek hale gelir. DAPI lekeli organoidlerin UV ışığı altında gözlemlenilmesi ve süpernatantın çıkarılması sırasında kaybolmadıklarını niçin doğrulması önerilir. - Kalan süspansiyonun 10-20 μL'lik damlacıkını odalı bir kapak kaymasına aktarın ve konfokal mikroskopiye devam edin.
NOT: Kapak parçaları damlacıkların her iki tarafına boşluk olarak kullanılmak üzere yerleştirilebilir (Şekil 4C). Bu bir coverslip damlacık üzerine yerleştirildiğinde organoidlerin çökmesini önler.
Sonuçlar
Prostat epitel hücreleri fare organoid kültürüne kaplanır ve burada aşağı akım analizine hazırlanmadan önce hasat edilen organoidler oluştururlar (Şekil 1).
Bazal ve luminal epitel hücreleri FACS kullanılarak izole edilir. DAPI+ hücreleri dışlandıktan ve Lin+ hücreleri (CD45, CD31, Ter119) tükenen sonra, bazal ve luminal hücreler EpCAM ve CD49f'nin diferansiyel ekspresyonuna göre ayırt edilirler (Şekil 2). Prostat bazal ve luminal hücrelerini organoid kültüre kağıda göre tanımlayan yaklaşım şunları gerektirir: (1) hücreleri matris jel halkalarına kaplamak ve (2) Poli-HEMA ile kaplama kuyuları. Halkalar içine Kaplama daha önce Agarwal ve ark9tarif edilmiştir. Bu yaklaşımın kullanılması(Şekil 3A)araştırmacıların ortam yenilerken matris jelinden daha kolay kaçınmalarını sağlar (Adım 3), ve kuyunun çevresini izleyerek organoidleri daha kolay saymalarını sağlar. Poli-HEMA ile kaplama kuyuları retinal organoidlerde 2D koloni oluşumunu önlemek için gösterilmiştir17; ancak bu yaklaşım prostat organoid modelinde kullanılmamıştır. Daha da önemlisi, Kuyuların Poli-HEMA ile kaplanması (Tablo 3) organoid oluşumuna müdahale etmeden 2B kolonilerin oluşumunu ortadan kaldırır (Şekil 3B). Bu değişiklikler prostat organoid testi yeteneklerini genişletmek.
Bazal ve luminal hücreler farklı morfolojileri olan organoidler oluştururlar (Şekil 4A). Bazal kaynaklı organoidlerin çoğu kültürde 7 gün sonra boyut (100-300 μm çap) benzer olmakla birlikte, luminal kaynaklı organoidler belirgin heterojenlik (30-450 μm çap) sergilerler. Ayrıca, çoğu bazal kaynaklı organoidler çok katmanlı epitel ile çevrili lümenler içerir(Şekil 4A, üst),luminal kaynaklı organoidler morfolojide içi boş, tek katmanlı epitel ile katı arasında değişir, kanalize olmayan hücrelerin çok katmanlı kabloları ile(Şekil 4A, alt). Organoidleri downstream analizine hazırlamak için yukarıda açıklanan yaklaşımlar (Steps 4, 5), bu henotypik farklılıkların soy belirteç ifadesindeki farklılıkları yansıtıp yansıtmadığını araştırmak için kullanılmıştır. Batı blot analizi, bazal ve luminal kaynaklı organoidlerin bazal ve luminal primer hücrelerle ilişkili özellikleri koruduğunu ortaya koymuştur. Bazal kaynaklı organoidler bazal marker sitokeratin in daha yüksek düzeylerini ifade 5 (K5), luminal türetilmiş organoidler luminal marker sitokeratin yüksek düzeyde ifade ise 8 (K8) (Şekil 4B). Hem bazal hem de luminal belirteçler toplu popülasyonda bazal ve luminal türetilmiş organoidlerde saptandı, belki de farklılaşma düşündürücüdür(Şekil 4B).
Bazal kaynaklı organoidlerde soy belirteç ekspresyonunu karakterize etmeye ve morfolojik olarak farklı luminal kaynaklı organoidlerin sağlam organoidleri boyanarak ve konfokal mikroskopi yaparak marker ekspresyonunda farklılık gösterip göstermediğini belirlemeye çalıştık(Şekil 4D). Bazal kaynaklı organoidler, bazal marker p63 ve luminal marker K8 orta düzeyde yüksek düzeyde ifade dış katmanları ile çok katmanlı epitel içeren (p63hi, K8orta),ve p63 ve K8 yüksek düzeyde saptanabilir düzeyleri olmadan iç katmanları (p63lo, K8hi)(Şekil 4D, üst). Tek katmanlı luminal kaynaklı organoidler tüm hücreler K8 için pozitif boyanmış olsa da, sadece belirli hücreler nükleer p63 içeriyordu(Şekil 4D, alt). Bu veriler hasat yaklaşımlarını doğrulamak ve Batı leke veya konfokal mikroskopi ile analiz için organoidhazırlamak ve bu nedenle farklılaşma da dahil olmak üzere önemli hücresel süreçleri çalışma organoid tahlil yeteneğini genişletmek.
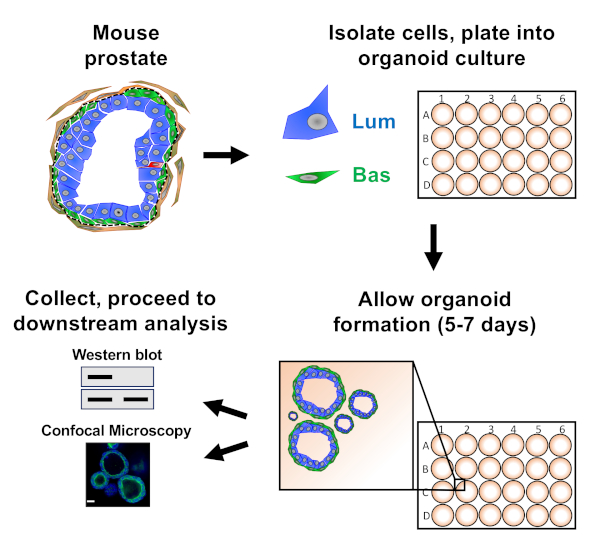
Şekil 1: Toplama ve analiz için prostat organoidleri oluşturmak için iş akışını gösteren şematik. Total fare prostatı ayrıştırılır ve bazal ve luminal prostat epitel hücreleri kurulan protokoller18,19ile floresan aktive hücre sıralama ile izole edilir. Fare organoid ortam ve matris jel karışımı asılı bazal veya luminal hücreleri matris jel halkaları içine kaplanır. Kültür 5-7 gün sonra, organoidler Batı leke veya konfokal mikroskopi ile analiz için hasat edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
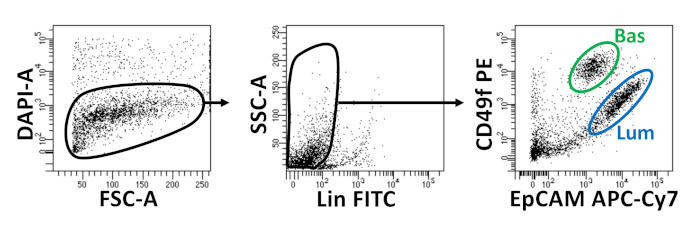
Şekil 2: Floresan aktive hücre sıralama (FACS) kullanılarak fare bazal ve luminal prostat epitel hücrelerinin izolasyonu. Fare prostatından ayrılan hücreler DAPI ile boyanmıştır, ölü hücrelerden canlı ayırt etmek için, ve yüzey antikorları, luminal hücrelerden bazal ayırt etmek için, FACS önce. Sol = DAPI-hücrelerde kapılı. FSC-A = ileri dağılım. Merkezi = Lin kapılı- hücreler (CD45lo, CD31lo, Ter119lo). SSC-A = yan dağılım. Sağ = Bazal hücreler (Bas) (EpCAMhi, CD49fhi), Luminal hücreleri (Lum) (EpCAMhi, CD49forta). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
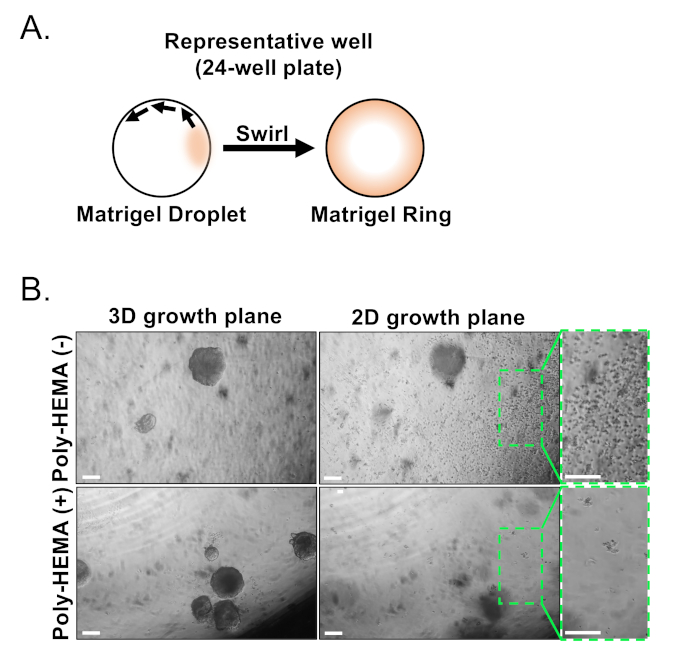
Şekil 3: Fare prostat organoidlerinin kurulması. (A) Şematik bir 24-kuyu plaka bir kuyuda bir matris jel halka oluşturmak için yaklaşım. (B) Organoidlerin (3D büyüme düzlemi) ve iki boyutlu kolonilerin (2D büyüme düzlemi) temsili faz kontrast görüntüleri, prostat epitel hücrelerinin kaplamadan 7 gün sonra un-kaplı (Poly-HEMA (-)) veya kaplamalı (Poly-HEMA (+)) 24-iyi plakalar oluşturdu. 2B büyüme düzlemindeki kutulu bölgeler sağda büyütülmüştür. Ölçek çubukları = 200 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
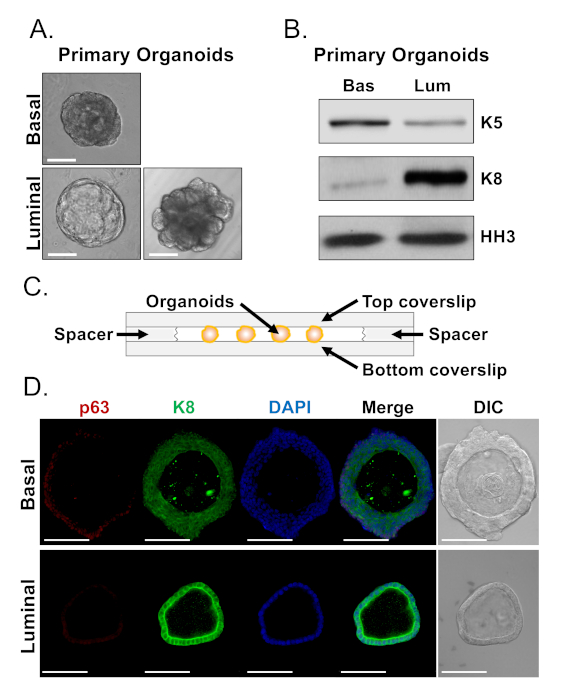
Şekil 4: Batı blot ve tam montaj konfokal mikroskopi ile prostat organoidlerinde soy belirteç ekspresyonunun analizi. (A) Temsili faz kontrast görüntüleri bazal türetilmiş (üst) ve luminal türetilmiş (alt) organoidler kültür 7 gün sonra. Ölçek çubuğu = 100 μm. (B) Bazal türetilmiş (Bas) ve luminal türetilmiş (Lum) organoidlerinin 5 günlük kültürden sonra batı leke analizi. Bazal marker, sitokeratin 5 (K5) ve luminal marker, sitokeratin 8 (K8) ve yükleme kontrolü, histon H3 (HH3) için boyama. (C) Şematik uzaylayıcılar ile odacıklı coverslip gösteren. (D) Temsili diferansiyel girişim kontrastı (DIC) ve 7 günlük kültürden sonra bazal türetilmiş (üstte) ve luminal türetilmiş (alt) organoidlerin immünofloresan görüntüleri. P63 (kırmızı), K8 (yeşil) ve DAPI (mavi) için boyama tek tek ve birleştirilmiş. Ölçek çubukları = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Tarifler | |
| Dispase içeren ortam | 1 mg/mL dispase + 10 μM ROCK inhibitörü ileri DMEM F12'de. Filtre 0,22 μm filtre kullanarak sterilize. |
| Dissociation medya | RPMI 1640 yılında% 10 FBS + 1x Penisilin-Streptomisin. Filtre 0,22 μm filtre kullanarak sterilize. |
| Protein lisis tamponu | RIPA tampon + fosfataz inhibitörleri + proteaz inhibitörleri |
| Çözüm engelleme | %0,2 Triton X-100 ile PBS'de %10 FBS |
Tablo 1: Anahtar çözümlerin hazırlanması için talimatlar.
| Bileşen | Konsantrasyon |
| B-27 | 1x (50x konsantreden seyreltilmiş) |
| GlutaMAX | 1x (100x konsantreden seyreltilmiş) |
| N-asetil-L-sistein | 1,25 mM |
| Normocin | 50 μg/mL |
| Rekombinant İnsan EGF, Hayvansız | 50 ng/mL |
| Rekombinant İnsan Noggin | 100 ng/mL |
| R-spondin 1-klimalı ortam | %10 şartlı ortam |
| A83-01 | 200 nM |
| Dht | 1 nM |
| Y-27632 dihidroklorür (KAYA inhibitörü) | 10 μM |
| Gelişmiş DMEM/F-12 | Temel ortam |
| R-spondin 1-klimalı ortam Drost açıklandığı gibi oluşturulur, ve ark.13. Tüm bileşenlerin eklenmesinden sonra, 0,22 μm filtre kullanarak fare organoid ortamını sterilize edin. KAYA inhibitörü sadece kültürün kurulması ve organoidlerin geçişi sırasında eklenir. | |
Tablo 2: Fare organoid ortamının hazırlanması için talimatlar.
| Poli-HEMA kaplamalı plakaların hazırlanmasıiçin protokol | |
| 1 | 50 mL %98 EtOH'a 0,25 g Poli-HEMA ekleyin. Bir çalkalayıcı üzerinde 37 °C'de Poli-HEMA çözün. Bu işlem en az 4 saat sürer. |
| 2 | Filtre 0,22 μm filtre kullanarak Poli-HEMA sterilize. |
| 3 | 24 kuyulu bir plakanın kuyusu başına 200 μl Poly-HEMA çözeltisi ekleyin. |
| 4 | Poli-HEMA ekledikten sonra kapağı 24 kuyulu plaka(lar)tan çıkarın ve çözeltinin bir gecede buharlaşmasına izin verin. |
| 5 | Her kuyuyu PBS ile iki kez yıkayın ve kuyuların son yıkamadan önce tamamen kuru olduğundan emin olun. NOT: Yıkama sırasında Poli-HEMA kaplamanın bozulması epitel hücrelerinin organoid kültüre dönüştürülmesi yle 2 boyutlu büyümeye katkıda bulunabilir. Poli-HEMA kaplı kuyuların zarar görmesini önlemek için, yıkama sırasında pipet ucu ile doğrudan temastan kaçının. Poly-HEMA kaplı kuyuların bütünlüğü, Pipet ucu yla Poli-HEMA kazınmadığı sürece bozulmadan kalır. |
| 6 | Poli-HEMA kaplı plakalar 4 °C'de iki haftaya kadar saklanabilir. NOT: Saklama dan önce parafilm plakaları sarma kontaminasyon riskini azaltacaktır. |
Tablo 3: Poli-HEMA kaplamalı plakaların hazırlanması için protokol.
Tartışmalar
Prostat epitel hücre farklılaşması hem normal prostat biyolojisi2,3,4,5,6,7 ve hastalıkbiyolojisi8,10,11,12; ancak, bu sürecin ana düzenleyicileri tanımsız kalır. Prostat epitel hücre farklılaşmasının temel düzenleyicilerinin belirlenmesi, modellemek için köklü bağlamların olmaması nedeniyle kısmen zor olmuştur. 2D monolayer kültür model farklılaşma için kullanılabilir iken11,12, Bu bağlamda karmaşık prostat mikroortamı özetlemek için başarısız olur. Ayrıca, farklılaşmayı modellemek için vivo bağlamlarda, manipüle etmek zor olduğu için, mekanistik çalışmalara kendilerini ödünç vermezler. Bu nedenle, farklılaşmayı incelemek için manipüle edilmesi kolay, ancak fizyolojik olarak alakalı bir bağlamın tanımlanması önemlidir.
Prostat organoid modeli, bazaldan lumal diferansiyasyona kadar olan zarif bir ex vivo bağlamını temsil eder. Prostat organoidleri kurmak için yöntemler iyi kurulmuştur14; ancak, bu yöntemlerin daha fazla optimizasyonu gereklidir. Ayrıca prostat organoidlerinin hasat ve analize hazırlanması yaklaşımları da açıkça açıklanmamaktadır. Bu yazıda fare prostatından organoid kültüre izole edilmiş prostat epitel hücrelerine bir yaklaşım açıklanmaktadır. Bu yaklaşım araştırmacıların (1) organoid oluşumu sırasında 2B kolonilerin oluşumunu önlemelerine, (2) ortam ikmali sırasında matris jelinin bozulma riskini azaltmalarına ve (3) organoidleri daha etkili bir şekilde saymalarına olanak tanır. Buna ek olarak, bu el yazması Batı leke analizi için hazırlık için organoidler hasat yaklaşımları özetliyor, ya da tam montaj konfokal mikroskopi. Daha da önemlisi, konfokal mikroskopi için organoidler hazırlamak için kullanılan yaklaşım, görüntü edinimi öncesinde organoid hasarı azaltır, süresi boyunca organoidlerin bozulmamış yapısını korur. Tamamen, yaklaşımlar prostat organoid testi yeteneklerini genişletmek açıklanan.
Özellikle, bazal ve luminal hücrelerin organoid oluşturan kapasitesi ilgili popülasyonları izole etmek için kullanılan yöntemler le hem de kültür koşulları ile değiştirilebilir. Bu istifte kullanılan organoid kültür koşulları ilk olarak Karthaus ve ark.13tarafından tanımlanmıştır. Karthaus ve ark. bazal hücrelerin daha yüksek organoid şekillendirme kapasitesine sahip olduğunu bildirmişken (%15) luminal hücrelere göre (%1)13, Chua ve ark., farklı izolasyon yöntemleri ve kültür koşulları kullanarak, luminal hücrelerin (%0.2-0.3) bazal hücrelere göre daha yüksek organoid şekillendirme kapasitesine sahiptir (%0.03)20. Genel olarak, Karthaus ve ark. tarafından açıklanan yöntemler hem bazal hem de luminal hücreler için daha yüksek organoid şekillendirme oranlarına yol açar, muhtemelen bazal ve luminal hücreleri izole etmek için kullanılan yaklaşım farklılıkları yansıtan13, luminal hücrelerden organoid oluşumuna karşı önyargı kültür koşulları aksine. Bu el yazmasında açıklanan protokolün çok güçlü luminal atalardan luminal organoid oluşumunu mı yoksa kararlı luminal ataları mı9'utercih edip etmediği belirsizliğini koruyor. Zamanında ve maliyet-engelleyici olsa da, in vivo soy izleme çalışmaları organoid testinde açıklanmış farklı prostat epitel soyları ile ilişkili ata özelliklerini doğrulamak için kullanılabilir.
Gelişim, farklılaşma ve dönüşüm gibi süreçler sadece prostat biyolojisi ile ilgili değil, aynı zamanda beyin, akciğer, bağırsak, pankreas ve karaciğer gibi diğer dokuların biyolojisi ile de ilgilidir. Açıklanan yöntemler organoid modelin kullanımını kolaylaştırmak sadece prostat değil, aynı zamanda dokuların geniş bir yelpazede bu süreçleri incelemek için.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
PDC ve JMG Ruth L. Kirschstein Ulusal Araştırma Hizmeti Ödülü GM007185 tarafından desteklenir. JAD, T. Hasson ve Saul Martinez Bursu'na verilen Ulusal Sağlık Enstitüleri (R25GM055052) Ulusal Tıp Bilimleri Enstitüsü tarafından desteklenmiştir. ASG, Spitzer Aile Vakfı Fonu ve Gill Vakfı tarafından desteklenir. Bu çalışma Amerikan Kanser Derneği (RSG-17-068-01-TBG), Savunma Bakanlığı (W81XWH-13-1-0470), Margaret E tarafından desteklendi. Erken Tıbbi Araştırma Güven, NIH / NCI (P50CA092131/ UCLA SPORE Prostat Kanseri), Rose Hills Vakfı ve UCLA Jonsson Kapsamlı Kanser Merkezi, Geniş Kök Hücre Araştırma Merkezi, Klinik ve Çeviri Bilim Enstitüsü ve Ürolojik Onkoloji Enstitüsü destek.
Malzemeler
| Name | Company | Catalog Number | Comments |
| µ-Dish 35 mm, high | ibidi | 81156 | |
| 16% Paraformaldehyde | Thermo Fisher Scientific | 50-980-487 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Thermo Fisher Scientific | D1306 | |
| A83-01 | Tocris | 2939 | |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634010 | |
| APC/Cy7 anti-mouse CD326 (Ep-CAM) Antibody, 100 μg | BioLegend | 118218 | |
| B-27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| Complete Protease Inhibitor Cocktail | Sigma | 11836145001 | |
| (DiHydro)testosterone (5α-Androstan-17β-ol-3-one) | Sigma | A-8380 | |
| Dispase II, Powder | Thermo Fisher Scientific | 17-105-041 | |
| Fetal Bovine Serum (FBS) | Sigma | F8667 | |
| FITC anti-mouse CD31 Antibody (0.5 mg/mL, 50 μg) | BioLegend | 102405 | |
| FITC anti-mouse CD45 Antibody (0.5 mg/mL, 50 μg) | BioLegend | 103107 | |
| FITC anti-mouse TER-119/Erythroid Cells Antibody (0.5 mg/mL, 50 μg) | BioLegend | 116205 | |
| Goat anti-mouse IgG-Alexa Fluor 488 | Invitrogen | A28175 | |
| Goat anti-rabbit IgG-Alexa Fluor 594 | Invitrogen | A11012 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Halt Phosphatase Inhibitor | Thermo Fisher Scientific | 78428 | |
| Matrigel GFR Membrane Matrix | Corning | CB-40230C | |
| Mouse anti-cytokeratin 8 | BioLegend | 904804 | |
| N-acetyl-L-cysteine | Sigma | A9165 | |
| Normocin | Thermo Fisher Scientific | ant-nr-1 | |
| PE anti-human/mouse CD49f Antibody | BioLegend | 313612 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15-140-122 | |
| Poly(2-hydroxyethyl methacrylate) (Poly-HEMA) | Sigma | P3932-25G | |
| Rabbit anti-p63 | BioLegend | 619002 | |
| Radioimmunoprecipitation assay (RIPA) | Thermo Fisher Scientific | PI89901 | |
| Recombinant Human EGF, Animal-Free | PeproTech | AF-100-15 | |
| Recombinant Human Noggin | PeproTech | 120-10C | |
| RPMI 1640 Medium, HEPES (cs of 10) | Thermo Fisher Scientific | 22400105 | |
| Sonic Dismembrator | Thermo Fisher Scientific | FB120 | |
| Sucrose | Sigma | S0389-500G | |
| Triton X-100 | Sigma | X100-5ML | |
| Y-27632 dihydrochloride (ROCK inhibitor) | Selleck Chemical | S1049-50MG |
Referanslar
- Kwon, O. J., Xin, L. Prostate epithelial stem and progenitor cells. American Journal of Clinical and Experimental Urology. 2 (3), 209-218 (2014).
- Choi, N., Zhang, B., Zhang, L., Ittmann, M., Xin, L. Adult Murine Prostate Basal and Luminal Cells Are Self-Sustained Lineages that Can Both Serve as Targets for Prostate Cancer Initiation. Cancer Cell. 21 (2), 253-265 (2012).
- Ousset, M., Van Keymeulen, A., et al. Multipotent and unipotent progenitors contribute to prostate postnatal development. Nature Cell Biology. 14 (11), 1131-1138 (2012).
- Wang, J., et al. Symmetrical and asymmetrical division analysis provides evidence for a hierarchy of prostate epithelial cell lineages. Nature Communications. 5, 1-13 (2014).
- Wang, Z. A., Mitrofanova, A., et al. Lineage analysis of basal epithelial cells reveals their unexpected plasticity and supports a cell-of-origin model for prostate cancer heterogeneity. Nature Cell Biology. 15 (3), 274-283 (2013).
- Kwon, O. J., Zhang, B., Zhang, L., Xin, L. High fat diet promotes prostatic basal-to-luminal differentiation and accelerates initiation of prostate epithelial hyperplasia originated from basal cells. Stem Cell Research. 16 (3), 682-691 (2016).
- Kwon, O. J., Zhang, L., Ittmann, M. M., Xin, L. Prostatic inflammation enhances basal-to-luminal differentiation and accelerates initiation of prostate cancer with a basal cell origin. Proceedings of the National Academy of Sciences. 192 (3), 997-999 (2014).
- Stoyanova, T., et al. Prostate cancer originating in basal cells progresses to adenocarcinoma propagated by luminal-like cells. Proceedings of the National Academy of Sciences. 110 (50), 20111-20116 (2013).
- Agarwal, S., Hynes, P. G., et al. Identification of Different Classes of Luminal Progenitor Cells within Prostate Tumors. Cell Reports. 13 (10), 2147-2158 (2015).
- Ku, S. Y., et al. Rb1 and Trp53 cooperate to suppress prostate cancer lineage plasticity, metastasis, and antiandrogen resistance. Science. 355 (6320), 78-83 (2017).
- Mu, P., et al. SOX2 promotes lineage plasticity and antiandrogen resistance in TP53- and RB1-deficient prostate cancer. Science. 355 (6320), 84-88 (2017).
- Bishop, J. L., et al. The Master Neural Transcription Factor BRN2 Is an Androgen Receptor-Suppressed Driver of Neuroendocrine Differentiation in Prostate Cancer. Cancer Discovery. 7 (1), 54-71 (2016).
- Karthaus, W. R., et al. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell. 159 (1), 163-175 (2014).
- Drost, J., Karthaus, W. R., et al. Organoid culture systems for prostate epithelial and cancer tissue. Nature Protocols. 11 (2), 347-358 (2016).
- McCray, T., Richards, Z., Marsili, J., Prins, G. S., Nonn, L. Handling and Assessment of Human Primary Prostate Organoid Culture. Journal of Visualized Experiments. (143), e59051(2019).
- Lawson, D. A., Xin, L., Lukacs, R. U., Cheng, D., Witte, O. N. Isolation and functional characterization of murine prostate stem cells. Proceedings of the National Academy of Sciences of the United States of America. 104 (1), 181-186 (2007).
- Chen, H. Y., Kaya, K. D., Dong, L., Swaroop, A. Three-dimensional retinal organoids from mouse pluripotent stem cells mimic in vivo development with enhanced stratification and rod photoreceptor differentiation. Molecular vision. 22, 1077-1094 (2016).
- Liu, X., et al. Low CD38 Identifies Progenitor-like Inflammation-Associated Luminal Cells that Can Initiate Human Prostate Cancer and Predict Poor Outcome. Cell Reports. 17 (10), 2596-2606 (2016).
- Lukacs, R. U., Goldstein, A. S., Lawson, D. A., Cheng, D., Witte, O. N. Isolation, cultivation and characterization of adult murine prostate stem cells. Nature protocols. 5 (4), 702-713 (2010).
- Chua, C. W., Shibata, M., et al. Single luminal epithelial progenitors can generate prostate organoids in culture. Nature Cell Biology. 16 (10), 951-961 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır