Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Çin Hamster Yumurtalık Hücre Yetiştiriciliğinde Yüksek İş-İş BulaMetli Otomatik Mikro-Biyoreaktörler Kullanılarak Proses Optimizasyonu
Bu Makalede
Özet
Burada, otomatik bir mikro-biyoreaktörde deney tasarımı ve ardından hücre hasadı ve protein nicelemi nin bir Protein A sütunu kullanılarak çalıştırılaması için ayrıntılı bir prosedür saklıyız.
Özet
Biyoproseslerin istenilen ürünlerin verimini artırmak için optimizasyonu biyofarmasötik endüstrisinde önem taşımaktadır. Bu, gerinim seçimi ve biyoproses parametreleri geliştirilerek elde edilebilir. Shake şişeleri bu amaçla kullanılmıştır. Ancak, pH ve çözünmüş oksijen (DO) gibi proses parametrelerini kontrol etme yeteneğinden yoksundurlar. Bu sınırlama otomatik bir mikro-biyoreaktör yardımıyla aşılabilir. Bu biyoreaktörler daha büyük ölçekte ekimi taklit. Bu sistemin en önemli avantajlarından biri, Deneme Tasarımı'nın (DOE) yazılıma entegre sidir. Bu tümleştirme, birden çok işlem parametresini aynı anda çeşitlendirebileceğiniz bir tasarım oluşturulmasını sağlar. Kritik proses parametreleri ve optimum biyoproses koşulları yazılım içinde analiz edilebilir. Burada sunulan çalışmanın odak noktası, kullanıcıyı yazılımda proses tasarımı ve DOE'nin ekim eki ile dahil edilen adımlarla tanıştırmaktır.
Giriş
Küresel biyofarmasötik pazarı 2018 yılında 250 milyar doların üzerinde ydi ve sürekli olarak1milyar abd doları hızla genişlemektedir. İlaç şirketleri küçük moleküler ilaçlar üretmekten rekombinant proteinler gibi biyoteknolojik olarak üretilen terapötiklere geçiyorlar. Bu tek başına fazla 150 milyar dolar1gelir sorumludur. Memeli hücreleri artık bu farmasötik rekombinant proteinlerin üretimi için yaygın olarak kullanılmaktadır. Mevcut dönemde, memeli hücreleri tarafından üretilen 68 onaylı ürünler arasında, 57 Çin Hamster yumurtalık hücreleri tarafından üretilmektedir (CHO)2. CHO hücreleri özellikle post-translational değişiklikler gerektiren rekombinant proteinlerin üretimi için kullanılır. Bu hücreler bir süspansiyon büyümek ve bu nedenle bir serum serbest kimyasal olarak tanımlanan orta3,,4çoğaltılabilir sonuçlar etkinleştirmek gibi tercih edilir. CHO hücreleri kullanarak diğer avantajı ürünün glikan yapısı insan monoklonal antikor benzer olmasıdır (mAb) ve gen amplifikasyon nedeniyle daha yüksek rekombinant protein verimi ve spesifik verimlilik sonuçları5.
Rekombinant CHO (rCHO) hücre kültürünün verimi son yirmi yılda yüz kat artmıştır. Bu gelişme proses parametrelerinin optimizasyonu, besleme stratejisi ve serum serbest kimyasal olarak tanımlanan orta6geliştirilmesi atfedilir. Farmasötik ürünlerin gereksinimlerindeki artış ile, üretim sürecinin gelişimi için maliyet ve zaman verimliliği üzerindeki basınç artar7. Ürün kalitesini güvence altına alırken basıncı azaltmak için kalite kalite (QbD) kalite üzerinde ilaç endüstrisinin odak yönlendirmiştir. QbD, ürün üretimini ve süreci anlamak için kullanılır. ObD kullanılan önemli bir araç Deney Tasarımı (DOE). Çeşitli giriş değişkenleri ile ortaya çıkan çıktı verileri arasındaki ilişkiyi ortaya çıkararak sürecin anlaşılmasını artırmaya yardımcı olur. Biyoprosesin optimize etmek için DOE yaklaşımının uygulanması, proses koşullarını asimile etme ve titrek miktarını ve kalitesini artırmada projenin erken aşamalarında yararlıdır. Bu yaklaşım, eski moda strateji ile karşılaştırıldığında yararlıdır: bir faktör-at-a-time (OFAT). Klasik, Shainin veya Taguchi kullanarak DOE istatistiksel yaklaşımlar OFAT8çok daha üstündür.
Süreç ve ortam optimizasyonu shake şişelerinde yapılabilir. Şişeler nispeten ucuzdur. Ancak sıcaklık, pH ve çözünmüş oksijen (DO) gibi parametreleri kontrol etmek mümkün değildir. Bu sakıncaları aşmak için, 0,5 L'den 5 L'ye kadar çok kullanımlı tezgah üstü biyoreaktörler kullanılabilir. Reaktörler kapsamlı bir on-line izleme ve süreç kontrolü sağlar. Ancak, çok kullanımlı biyoreaktör kullanımı zaman ve emek yoğundur. Bu dezavantajları aşmak için, tezgah üstü biyoreaktörün izlenmesi ve shake şişesinin kolay kullanımı nın izlenmesi sürecini birleştiren yeni bir tek kullanımlık biyoreaktör kullanılmaktadır. Yüksek verim tarama sistemi ve tek kullanımlık teknoloji proses performansı ve geliştirme verimliliğini artırmak için katkıda bulunmuştur9.
Bu makalede, otomatik mikro-biyoreaktör (AMBR) yazılımında tarifi yüklemek için kurallar listelenmiştir. Bu deney sırasında farklı karıştırıcı hızlarının ve pH'sının canlı hücre konsantrasyonu (VCC) ve titreşen üzerindeki etkisi incelenmiştir. Deney sonucu ve analizi deney yazılımı MODDE 12 tasarımı ile gerçekleştirilir. Ürün analitiği, Protein A sütunlu yüksek basınçlı sıvı kromatografi (HPLC) sisteminde gerçekleştirilir. MAb'nin Fc bölgesinin yüksek yakınlıklı A proteinine bağlanması prensibine dayanır10,11. Bu yöntemle mAb'yi tanımlamak ve ölçmek mümkündür. Niceleme 280 nm ölçülü elüsyon tepe alanları üzerinde gerçekleştirilir.
Protokol
1. Kültür Öncesi Prosedürü
NOT: Bu protokol için 1 x 107 hücre/mL canlı hücre konsantrasyonu olan rekombinant CHO DG44 hücreleri kullanılmaktadır.
- 1,2 mL hücre içeren şişeyi oda sıcaklığına kadar eritin ve hücre süspansiyonuna hemen 10 mL soğuk tohum lu orta içeren 15 mL konik santrifüj tüpüne aktarın.
- Konik santrifüj tüpünü 190 x g ve oda sıcaklığında 5 dakika santrifüj edin ve süpernatantı atın.
- 500 mL'lik bir çırpıda tohum ortamının 150 mL'sini 36,8 °C'ye ısıtın.
- Önceden ısıtılmış tohum orta 10 mL hücre pelet yavaşça yeniden askıya ve sallamak şişesi içine hücreleri aktarın.
- Bir hücre sayacı kullanarak ilk VCC ve canlılığı ölçmek için şişeden numunenin 1 mL'sini kullanın.
NOT: Başarılı ekim için çözülme den sonra canlılık %70'in üzerinde olmalıdır. - Sallayarak şişeyi 36,8 °C'de orbital shaker (19 mm shaker çapı) ve %7,5 CO2'de 120 rpm sallayarak inkübedin.
NOT: Bu koşullar hücre gerginliği ne bağlı olarak değişir ve orta. - Hücreleri geçtikten üç gün sonra, shaker dan sallamak şişesi çıkarın ve laminar akış kabine altına yerleştirin. Son hücre konsantrasyonunu ölçmek için 1 mL numune alın. Yeni geçitteki ilk hücre konsantrasyonu 2 x 105 hücre/mL olacak şekilde önceden ısıtılmış tohum ortamına aktarılacak hacmi hesaplayın.
- Ana ekimiçin biyoreaktöre aktarılmadan önce hücreleri toplam 5 kez aktarın.
2. Ana Tarım
- Prekültür'ün son hücre konsantrasyonu ölçün. Biyoreaktöre aktarılacak hacmi, reaktördeki ilk hücre konsantrasyonu 3 x 105 hücre/mL olacak şekilde hesaplayın.
- Reaktörü nisbiden bir gün önce üretim ortamıyla doldurun, reaktörü dengeleyin ve sıcaklık, pH ve DO gibi proses parametrelerini ayarlayın.
NOT: Yetiştirme koşulları 36.8 °C ve %60 çözünmüş oksijen konsantrasyonudur (DO). 6.9, 7.1 ve 7.3 pH'ları ile birlikte 1050 rpm ve 1300 rpm'lik karıştırıcı hızlarını test ettik. Ekimin toplam süresi, hücrelerin hasat edilmesine kadar 12 gündür. Toplu işlem, besleme ortamının her 24 saat eklenmesinden sonra 72 saat çalışır. Ekimiçin kullanılacak protokol bir sonraki bölümde ayrıntılı olarak listelenmiştir.
3. Tarifi Otomatik Mikro-Biyoreaktör Yazılımında Yazma
NOT: AMBR hücre kültürü yazılımında bir tarif yazmanın iki yolu vardır: sihirbaz kullanılarak veya her adımı el ile ekleyerek oluşturulur. Bu protokolün amacı için sihirbazı kullanan adımlar gösterilir.
- Yeni bir deneme oluşturma
- AMBR hücre kültürü yazılımını açın ve Giriş sekmesinde Yeni Deneme Oluştur'atıklayın.
- Tarifi yükleme
- Yeni Deneme sekmesinde, denemenin yapılacağı tarihle birlikte deneyin adını girin.
- Kültür istasyonu ve ekim sırasında kullanılacak gemilerin kontrol noktasını etkinleştirin. DoE denemesinin programlanması sırasında kolay bir geçiş için Otomatik DoE Etiketleri de etkinleştirilir. Sonraki sekmeye geçmek için İleri'yi tıklatın.
- Antiköpük, inoculum, yem ve glikoz ile birlikte damar içine medya eklenmesi hakkında bilgi ayarlayın.
- Ortam Plakası Ekle kontrol noktasını etkinleştirin. Ortayı içeren plakanın plaka türünü, adını ve konumunu tanımlayın.
DİkKAT: Plakanın tipine bağlı olarak ve plaka bir kapak içeriyorsa, sıvı işleyicinin düzgün çalışmasını sağlamak için kontrol Kapaklı - Gemilere Ortam Ekle'yi tıklatın. Gemilere eklenecek ortamın hacmini girin. Plakadan damarlara ortam transferinin haritasını tanımlayın. Sonraki sekmeye geçmek için İleri'yi tıklatın.
- Ortam Plakası Ekle kontrol noktasını etkinleştirin. Ortayı içeren plakanın plaka türünü, adını ve konumunu tanımlayın.
- Reaktördeki yetiştirme koşullarını ayarlayın.
- Medya bilgileri yazılıma aktarıldıktan sonra, yetiştirme koşullarını atayın. Durum Medya tıklayın ve sıcaklık, hedef DO, üst pH sınırı ve karıştırma RPM (Yukarı veya Aşağı karıştırma) doldurun.
- Damarlar içine inoculums ilaveayarlayın.
- Hücre Plakası Ekle'yietkinleştirin. Ortayı içeren plakanın türünü, adını ve konumunu tanımlayın.
- Damarlara Hücre Ekle'yetıklayın. Aşılama zamanını ve damarlara eklenecek ortamın hacmini girin.
- Sıvı işleyicitarafından hareket edilen yolu plakadan damarlara hücre transferiiçin tanımlayın. Sonraki sekmeye geçmek için İleri'yi tıklatın.
NOT: Pipet İpuçlarını Yeniden Kullan,çapraz kontaminasyonu ve yanlış ilk canlı hücre konsantrasyonunu önlemek için devre dışı bırakıldığından emin olun.
- Yem, glikoz ve köpük önleyici ilave ayarlayın.
NOT: Yem, glikoz ve köpük önleyici ilave prosedürü birbirine benzer. Bu protokol ün hatırına yordam "Feed" için listelenir. Bu glikoz ve antiköpük için çoğaltılabilir.- Özet Akışı Plakası Ekle'yi etkinleştirin ve plaka türünü, adını ve konumunu tanımlayın. Damarlara Yem Ekle'ye tıklayın ve damarlara eklenecek yem hacmini girin. Yemin plakadan damarlara transferinin haritasını tanımlayın.
- Ekime bağlı olarak, yem ek sayısını ekleyin. Bu ekim için, reaktör her 24 saat için 72 saat sonra beslenir.
- Eklenen hücrelerden gecikmeyeveri girerek besleme arasındaki zaman gecikmesini el ile ekleyin. Beslenmenin ilk günü 72 saatlik aşılamadan sonra, sonraki gün ise 96 saat sonra dır.
NOT: Köpük önleyici ilave, ekim sırasında köpürmemek için her gün eklenecek şekilde programlanır.
- Ekim sırasında örnekleme ayarlayın.
- Örnek Plaka Ekle'yi etkinleştirin ve plaka türünü, adını ve konumunu tanımlayın.
- Gemilerden Numune Al'ı kontrol edin ve damarlardan çıkarılacak numunenin hacmini girin. Numunenin damarlardan plakaya transferinin haritasını tanımlayın. Ekim boyunca hacmin 10 mL'nin altına düşmemesini sağlayın.
- Ekim sırasında alınacak numune sayısını ekleyin. Beslemeye benzer şekilde, her giriş numune noktası için numunenin damardan çıkarıldığı süreyi ekleyin.
- İşlemi kaydedin. Şimdi idam için hazır.
NOT: Protokolün sorunsuz çalışmasını sağlamak için AMBR hücre kültürü yazılımındaki İşlem Adımları sekmesine geçin ve tarifin akışını görselleştirmek için İşlem Adımı görünümünü seçin.
- Yeni Deneme sekmesinde, denemenin yapılacağı tarihle birlikte deneyin adını girin.
- Otomatik mikro biyoreaktör deney tasarımı
- Biyoreaktörün DOE yazılımını çalıştırmak için, ana yazılımdaki reçetenin kaydedilmesini ve kullanıma hazır olduğundan emin olun.
- AMBR 15 DOE yazılımını açın ve Investigation'a tıklayın ve Yeni'yiseçin.
- Soruşturma Oluştur iletişim kutusuna yeni DOE soruşturmasının adını girin.
- DOE araştırmasına bir deneme atamak için, farklı parametreleri incelemek için oluşturulan tarifi açın. Gözat'ı tıklatın ve ilgili denemeyi seçin.
- DOE faktörlerini tanımlayın.
- Gemi etiketleri sütunda zaten kayıtlıdır. İstenilen DOE faktörünü tanımlamak için parametreyi seçin ve DOE faktörüetiketli sütuna tıklayın. Yeni'yi seçin ve birimlerin, kısaltmanın, alt ve üst sınırının (örneğin, sıcaklık, DO, pH) ekleyin.
- Yanıt faktörlerini tanımlayın.
- DOE faktörleri tanımlandıktan sonra, yanıtı deneysel analizin yapılandırıştırılacak şekilde tanımlayın.
- Yanıtlar sekmesinde, verilerin analizi için dikkate alınacak değerleri tanımlayın.
- DOE Yanıtlarını Edit'e tıklayın ve yanıtın, kısaltmanın, birimlerin, minimum ve maksimum sınırların (örn. titre, canlı hücre konsantrasyonu) adını tanımlayın.
- Yanıtlar tanımlandıktan sonra, her yanıt için AMBR değişkenini seçin ve değişkeni tanımlayın. Bir yanıt otomatik olarak bir mikro-biyoreaktör değişkeni ile ilişkili olabilir, açılan listeden gerekli değişkeni seçin.
- Gereksinime bağlı olarak yanıtın her biri için denklemi değiştirin. Seçim minimum, maksimum, ilk, son ve ortalama veriler arasındadır.
- Bir tasarım oluşturun.
- Deneme tasarım türünü seçmek, çoğaltma ve merkez noktalarının sayısını eklemek veya kaldırmak için Tasarım Sihirbazı'nı kullanın.
- Tasarım ve model seçimini belirleyen hedefi seçin:
Tarama: Önemli faktörleri bulmak için doğrusal ve etkileşim modellerini kullanır
Optimizasyon (RSM), Ayrıntılı modelleme ve optimizasyon için kuadratik ve kübik modelleri kullanır
Bölünmüş hedef: Formülasyon ve proses faktörleri için modeller ayrı ayrı seçilebilir - Hedefe karar verildikten sonra, orta nokta ve çoğaltma sayısı ile birlikte modeli ve tasarımı seçin.
- Bitiş'e tıklayın ve bir sonraki sekmeye geçin.
- Deneyi tanımlayın.
NOT: DOE faktörleri yazılımın sağ sütununda listelenir. İstenilen faktörlerin seçilmesi üzerine, istenilen parametre ile deney yapan gemiler vurgulanır. Kültür istasyonu içindeki gemiler, tekneye sağ tıklayarak istenilen yere taşınarak hareket ettirilebilir.- AMBR hücre kültürü yazılımında içe aktarılabilen iş paketleri oluşturun. Deney sayısına bağlı olarak farklı çalışma paketleri oluşturulur ve daha fazla uygulama için saklanır
- AMBR kontrol dizüstü bilgisayarında oluşturulan çalışma paketlerinde denemenin yürütülmesi
- Deneme sekmesinde, DOE Denemeoluştur'u tıklatın ve DOE yazılımı kullanılarak oluşturulan iş paketine göz atın.
- Başlat'ıtıklatarak işlemi başlatın.
- Deneysel sonuçların analizi
- Deneme yürütüldükten sonra, verileri Dışa Aktarma DOE Sonuçlarınıkullanarak dışa aktarın. Dışa Aktarma DOE Sonuçları penceresi açılır ve kültür gemisi ni ve istasyonunu gösteren satırlar tabloda listelenir.
- İstenilen satırları seçin ve tüm sonuçları depolamak ve daha fazla analiz için dosyayı kaydetmek için Dışa Aktarılan Seçili Satırlar veya Dışa Aktarma Deneysel verileri tıklatın.
- Sonuçlar sekmesine geçerek ve Alma Sonuçları'nı seçerek verileri AMBR DOE modülüne aktarın.
- İstenilen veri dosyasına göz atın ve Analiz Sonuçları'nıtıklatın.
- Sonuçları MODDE daha fazla analiz edin.
4. Otomatik Mikro-biyoreaktörde Yetiştiriciliğin Yürütülmesi
NOT: Aşağıdaki adımlar, yukarıda belirtilen yazılımda yazılan protokol yardımıyla kullanıcı tarafından yürütülür. Adımlar, aksi belirtilmedikçe kullanıcı tarafından gerçekleştirilir.
- Gemilerin yüklenmesi
- Şekil 2'debetimlenen kültür istasyonunda bir laminar akış dolabı nın altında gama sterilize edilmiş kültür kaplarını açın.
- Kelepçe plakasını %70 etanol ve çift distile su ile temizleyin. Sonra, plaka ve geminin üstüne yerleştirin otoklav.
- Kelepçe plakasını bir karıştırıcı plakası ile monte edin ve her pimin sıkıca sabitlenmesini sağlar.
- Karıştırma tertibatıüzerine hem karıştırıcı plakasını hem de kelepçe plakasını sıkın.
- Mikro-biyoreaktör yazılımının çalıştırıl
- Ekimi yürütmek için Bölüm 3'te yazılı programı kullanın.
- İşlem sekmesinde zamanlanan veya tamamlanan işlem adımlarını görselleştirin.
- Karıştırıcı başlamadan önce damarlara köpük önleyici ekleyin ve ekim sırasında aşırı köpük olmamasını sağlayın. Antiköpük düzenli olarak eklenecektir ve köpük görsel olarak tespit edilir.
- Damariçine ortam eklenmesi
- Mikro biyoreaktörlerle sağlanan 24 kuyu plakasını steril ortamla manuel olarak doldurun ve sistemin belirlenmiş güvertesinde yerleştirin. Plakanın yazılı program (bölüm 3) tarafından belirlenen güverteye yerleştirildiğinden emin olun. Geminin dolumu bölüm 3.2.2'de tasarladığı şekilde yapılacaktır.
NOT: Sıcaklık ve karıştırıcı hemen sonra medya ve antifoam eklenmesi başlar. Sensör okuyucu, damar dolduruldıktan 1 saat sonra etkinleştirilir (Start Monitor adımı). Okuyucu etkinleştirildikten sonra her bir gemiye gaz lama başlar. Ortam, pH kalibrasyonu ve aşılamadan önce en az 6 saat boyunca dengelenir. İşlem parametreleri bölüm 3.2.3'te belirtildiği gibi yazılımda değiştirilebilir.
- Mikro biyoreaktörlerle sağlanan 24 kuyu plakasını steril ortamla manuel olarak doldurun ve sistemin belirlenmiş güvertesinde yerleştirin. Plakanın yazılı program (bölüm 3) tarafından belirlenen güverteye yerleştirildiğinden emin olun. Geminin dolumu bölüm 3.2.2'de tasarladığı şekilde yapılacaktır.
- Aşı
- 5. geçitten sonra canlıth hücre konsantrasyonu ölçün. Tüm damarlarda ilk hücre konsantrasyonunun 3 x 105 hücre/mL olduğundan emin olmak için damarlara aktarılacak hücre sayısını hesaplayın.
- Hücreleri 24 derin kuyu plakasına aktarın, süspansiyonun hacmi gerekli hacmin en az 1,6 katıdır. İnokülün 2 mL'lik gerekli hacmi için, 3,2 mL hücre süspansiyonu plakadaki her kuyuya aktarın.
- 24 kuyu plakasını belirlenen güverteye yerleştirin. Gemiler bölüm 3.2.4'te olduğu gibi aşılanacaktır.
- Günlük örnekleme ve analiz
- Sıvı işleyiciyi kullanarak her gün damarlardan 460 μL numune alın. 800 μL filtrelenmiş 1x PBS tamponu (5x seyreltme) ile numunenin 200 μL'sini seyreltin ve hücre sayacına yerleştirin.
- Kalan numuneyi 190 x g ve oda sıcaklığında 5 dk için santrifüj edin ve daha fazla analiz için süpernatantı (glikoz, laktat, glutamin ve glutamat) saklayın.
- Protein niceliği için ekimin sonuna kadar -20 °C'de 100 μL'lik süpernatantı dondurun.
- Ekimin sonu
- Proses parametresi kontrolü (yani sıcaklık, ajitasyon, pH ve DO) sonlandığında, işlemin izlenmesini durdurun.
- Stirrer plakasını ve kelepçe plakasını sökün.
- Kültür kaplarını çıkarın ve kültür istasyonlarını temizleyin. Kurutma plakalarını kültür istasyonlarına yerleştirin ve vidalayın.
- Bu arada, kelepçe plakalarını %70 etanol ve çift distile su ile iyice temizleyin.
- Kurutma döngüsü tamamlandıktan sonra biyoreaktör yazılımında Durdur'a tıklayın.
- Hücre kültürü hasadı
- Hasat hücreleri 12. 30 dk için 190 x g hücre suyu santrifüj.
- Hücre peletini atın ve supernatant'ı -20 °C'de saklayın.
5. MAb Konsantrasyonu Ölçme
- Ekim sırasında proteinin nicelleştirilmesi için 1,7 mL Protein A sütunu kullanın.
-
Örnekleri eritmeden önce denge ve elüsasyon tamponu hazırlayın.
- 0,5 M Na2HPO4 içeren 0,5 M NaCl pH içeren bir çözeltiyi 7,9 pH'lık bir çözelti ve elüsyon tamponu olarak 2 pH ile 0,5 M NaCl içeren 100 mM lik glisin çözeltisi kullanın.
- Analiz için yerleştirilmeden önce her iki tamponu da 0,2 μm'lik bir membran ve gaz giderme yoluyla filtreleyin.
- Yüksek performanslı sıvı kromatografi sistemini (HPLC) yeni hazırlanmış denge tamponuyla temizle.
- A proteinini HPLC sistemine yükleyin.
- 1 mL/dk akış hızı ile kromatografi yapın. Kolon fırın sıcaklığını 30 °C ve otoörnekr sıcaklığını 10 °C'ye ayarlayın
- Dondurulmuş numuneleri oda sıcaklığında eritin ve her numunenin 225 μL'sini 0,22 μm PVDF membrandan filtreleyin. İstenilen proteinin daha yüksek konsantrasyonu ile numuneleri seyreltmek, otonumuneyi yerleştirmeden önce denge tamponu ve membrandan filtreleme ile 1:20 oranındadır.
- Örnekleri otomatik numuneye yerleştirin. Yöntem ve sırayı yazılıma yükleyin ve sırayı başlatın.
NOT: Yöntem üç aşamadan oluşur (Bkz. Şekil 1):numunenin ilk iki dakika boyunca kolona enjeksiyonu; 10 dk için denge tampon ile 8 dakika ve sütun rejenerasyon için elüsyon tampon izledi.
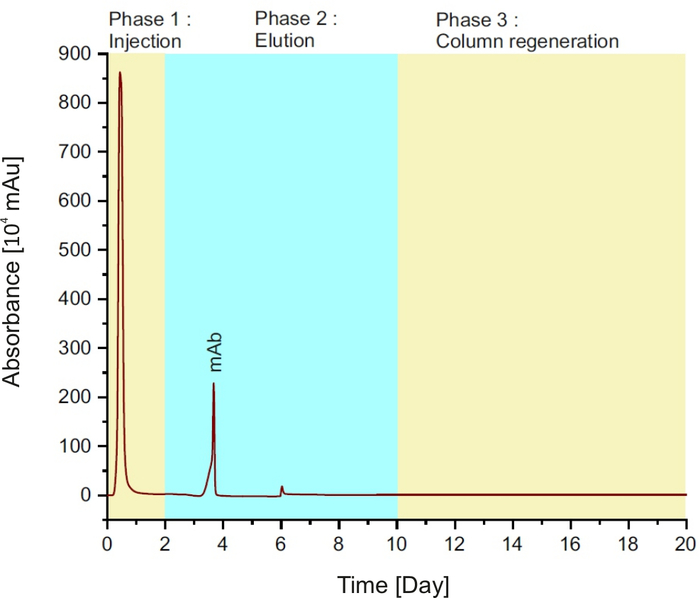
Şekil 1: Protein Tek bir çalışma sırasında farklı aşamaları temsil eden bir kromatogram. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Bu çalışmada yapılan ekime genel bir bakış Şekil 2'desunulmuştur.
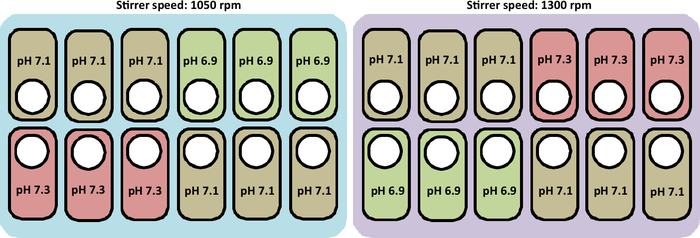
Şekil 2: Kültür istasyonlarındaki pH ve karıştırıcı hız profillerini test etmek için deneysel koşulların şematik gösterimi. Şekil aynı zamanda gemileri yerleştirmek için doğru düzeni temsil eder.
Tartışmalar
Verimi artırmak için sürecin optimizasyonu biyofarmasötik endüstrisinde çok önemlidir. Shake şişeleri potansiyel olarak zorlanma nın taranması için kullanılabilir; ancak, pH ve DO gibi proses parametrelerinin izlenmesi şişelerde kullanılamaz. Mikro-biyoreaktörler, sürecin sürekli izlenmesine ve kontrol altına alabilmesine olanak sağladıkları için avantaja sahiptirler. Mikro-biyoreaktör bu kontrol döngüleri de daha büyük ölçekli benzer bir durum sağlamak ve böylece, daha büyük ölçekli ...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar Bundesministerium für Bildung und Forschung (BMBF), Federal Eğitim ve Araştırma Bakanlığı, Almanya ve Sartorius Stedim Biotech GmbH, Almanya Biyoİşleme ekibi, destek için teşekkür etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL disposable pipette tips, sterilized | Sartorius Stedim Biotech GmbH | A-0040 | |
| 200 mM L-glutamine | Corning, Merck | 25-005-CV | |
| 24 Well deep well plates | Sartorius Stedim Biotech GmbH | A-0038 | |
| 5 mL disposable pipette tips, sterilized | Sartorius Stedim Biotech GmbH | A-0039 | |
| ambr 15 automated microbioreactor system | Sartorius Stedim Biotech GmbH | 001-2804 | |
| ambr 15 Cell Culture 24 Disposable Bioreactors - Sparged | Sartorius Stedim Biotech GmbH | 001-1B86 | |
| Antifoam C Emulsion | Sigma-Aldrich, Merck | A8011 | |
| Bottle Top Sterile filter | Corning, Merck | CLS431474 | 0.1 μm pore size |
| CEDEX Detergent (3% Mucosol) | Roche Innovatis AG | 05-650-658-001 | |
| Cell counter | Roche Innovatis AG | 05-650-216-001 | CEDEX HiRes |
| CHO DG44 cell line | Cellca, Sartorius Stedim Biotech GmbH | ||
| CHOKO Feed Media A (FMA) | Sigma-Aldrich, Merck | CR80025 | |
| CHOKO Feed Media B (FMB) | Sigma-Aldrich, Merck | CR80026 | |
| CHOKO Production Medium | Sigma-Aldrich, Merck | CR80027 | |
| CHOKO Stock Culture Meium | Sigma-Aldrich, Merck | CR80028 | |
| Chromaster high pressure liquid chromatography system | VWR International | ||
| Conical Centrifuge tube | Corning, Merck | SIAL0790 | |
| Ethanol | Merck | 1070179026 | |
| Glycine | Carl Roth | 56-40-6 | |
| HPLC Vials | VWR International | SUPLSU860181 | |
| PBS | Sigma-Aldrich,Merck | P4417 | |
| Protein A Column | Thermo Fisher Scientific | 1502226 | POROS™ A 1.7 mL |
| Sodium chloride | Sigma-Aldrich,Merck | 7647-14-5 | |
| Sodium phosphate dibasic anhydrous | Sigma-Aldrich,Merck | 7558-79-4 | |
| Trypan Blue | VWR International | VWRVK940 | |
| YSI | YSI Inc | 2900D | YSI 2900 Select |
Referanslar
- Walsh, G. Biopharmaceutical benchmarks 2018. Nature Biotechnology. 36, 1136 (2018).
- Kim, J. Y., Kim, Y., Lee, G. M. CHO cells in biotechnology for production of recombinant proteins: current state and further potential. Applied Microbiology and Biotechnology. 93 (3), 917-930 (2012).
- Lai, T., Yang, Y., Ng, S. K. Advances in Mammalian cell line development technologies for recombinant protein production. Pharmaceuticals (Basel). 6 (5), 579-603 (2013).
- Carlage, T., et al. Analysis of dynamic changes in the proteome of a Bcl-XL overexpressing Chinese hamster ovary cell culture during exponential and stationary phases. Biotechnology Progress. 28 (3), 814-823 (2012).
- Hacker, D. L., de Jesus, M., Wurm, F. M. 25 years of recombinant proteins from reactor-grown cells - where do we go from here. Biotechnology Advances. 27 (6), 1023-1027 (2009).
- Shukla, A. A., Gottschalk, U. Single-use disposable technologies for biopharmaceutical manufacturing. Trends in Biotechnology. 31 (3), 147-154 (2013).
- Ao, S., Gelman, L. . Advances in electrical engineering and computational science. Lecture notes in electrical engineering. 39, (2009).
- Bareither, R., et al. Automated disposable small scale reactor for high throughput bioprocess development: a proof of concept study. Biotechnology and Bioengineering. 110 (12), 3126-3138 (2013).
- Kang, Y., Ludwig, D. L., Balderes, P. What can cell culture flocculation offer for antibody purification processes. Pharmaceutical Bioprocessing. 2 (6), 483-485 (2014).
- Choe, W., Durgannavar, T. A., Chung, S. J. Fc-Binding Ligands of Immunoglobulin G: An Overview of High Affinity Proteins and Peptides. Materials (Basel). 9 (12), (2016).
- Schäpper, D., et al. Application of microbioreactors in fermentation process development: a review. Analytical and Bioanalytical Chemistry. 395 (3), 679-695 (2009).
- Zhang, Z., et al. Microbioreactors for Bioprocess Development. Journal of the Association for Laboratory Automation. 12 (3), 143-151 (2007).
- Claßen, J., et al. Spectroscopic sensors for in-line bioprocess monitoring in research and pharmaceutical industrial application. Analytical and Bioanalytical Chemistry. 409 (3), 651-666 (2017).
- Janoschek, S., et al. A protocol to transfer a fed-batch platform process into semi-perfusion mode: The benefit of automated small-scale bioreactors compared to shake flasks as scale-down model. Biotechnology Progress. 35 (2), 2757 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır