Method Article
Gastrointestinal Organoidlerin Genetik Mühendisliği için Evrensel ve Etkili Elektroporasyon Protokolü
Bu Makalede
Özet
Bu protokol, daha büyük plazmidlere sahip dört farklı gastrointestinal organoid varlığın transfeksiyonu için etkili bir elektroporasyon yöntemini açıklar (10 kB ölçüde). Bir gün içinde yapılabilir ve kapsamlı hazırlık veya özel, maliyet yoğun elektroporasyon tamponlar gerektirmez.
Özet
Elektroporasyon plazma zarının elektriksel permeabilizasyonu ile farklı moleküllerle transfeksiyon için yaygın bir yöntemdir. Son yıllarda birincil hasta materyali için bir kültür yöntemi olarak organoidlerin giderek artan kullanımı ile, bu 3D kültür sisteminde genetik mühendisliği için bileşenlerin verimli transfer yöntemleri ne zaman ihtiyaç vardır. Özellikle organoidler için, genetik manipülasyonların etkinliği başarılı bir transfeksiyona bağlıdır. Böylece bu protokol, organoidlerin elektroporasyonunu kolaylaştırmak ve farklı varlıklardaki evrensel işlevselliğini kanıtlamak için geliştirilmiştir. İnsan kolorektal, pankreas, hepatik ve mide kanseri organoidleri küçük ve büyük plazmidlerle başarılı bir şekilde elektroporated edildi. GFP kodlama vektörlerine dayanarak transfeksiyon verimliliği FACS tarafından belirlendi. Hücrelerin kapsamlı bir şekilde hazırlanması veya özel, maliyet yoğun elektroporasyon tamponları gerekli değildir ve protokol bir gün içinde gerçekleştirilebilir.
Giriş
Son yıllarda, yeni bir 3D hücre kültür sistemi, organoidler olarak adlandırdığı, çeşitli normal ve kanserli dokular için geliştirilmiştir. Organoidler fonksiyonel ve morfolojik olarak menşe dokularına çok yakındırlar. Onlar farklı türlerden oluşturulabilir, kolayca genişletilebilir, genomik kararlı ve genetik olarak değiştirilebilir, hangi onları genetik araştırmalar için ideal bir model sistemi yapar1,2,3. CRISPR (Kümelenmiş Düzenli Aralıklı Kısa Palindromik Tekrarlar)/Cas9 sistemi gibi genetik mühendislik teknikleri çeşitli manipülasyonlara olanak sağlar. Klonların seçimi tanımlanmış medya koşulları ile gerçekleştirilebilir, örneğin, APC için WNT ligand çekilmesi (Adenomatozis Polypozis Coli) nakavt klonları4,5. Alternatif olarak, seçim işaretleri bir hedeflemevektörü homologyönettiği onarım tarafından tanıtılması gerekir 6,7. Genellikle birden fazla plazmid intülisi getirilmesi gerektiğinden, verimli bir transfeksiyon çok önemli bir parametre haline gelir. Ayrıca, belirsiz off-hedef etkilerini azaltmak için, Cas9 enonukleaz geçici bir ifade8arzu edilir .
Elektroporasyon DNA, RNA, proteinler veya diğer makromoleküller ile transfect hücreleri için nispeten basit bir yöntemdir. Elektrik darbeleri sayesinde, hücre zarı daha geçirilebilir hale gelir ve artan bir alım nedenolur 9. Kolon organoidlerinin daha önce yayınlanmış bir elektroporasyon protokolünde, dört günlük bir işlemle piggy-bac GFP (yeşil floresan protein) ile%30verimlilik (yeşil floresan protein) ekspresyonu (7.4 kB) sağlandı. Aşağıdaki protokol, tek kılavuz RNA (sgRNA) ve Cas9 ensonükleaz dizisi (örneğin 9.3 kb ile vektör olarak px458) için kodlayan büyük plazmidler ile kanserli veya sağlıklı organoidlerin verimli bir şekilde transfeksiyonunu kolaylaştırmak için geliştirilmiştir. Tüm elektroporasyon süreci bir gün içinde yapılabilir, özel elektroporasyon tamponlar olmadan, ve farklı gastrointestinal organoidler arasında en azından karşılaştırılabilir verimlilikile, yani pankreas duktal adenokarsinom (PDAC), kolorektal kanser (CRC), kolanjiokarsinom (CCC) ve mide kanseri (GC) organoidler.
Protokol
Etik onayı TU Dresden etik komitesinden (#EK451122014) alındı.
1. Elektroporasyon Öncesi Organoid Kültür ve Preparatlar
- Daha önce açıklandığı gibi doku sindirim tarafından organoidler kurmak ve bir bodrum matris (genel bakış tablo 1 ve Malzeme Tablosubakınız)11,12,13,14,15,16,17ilgili varlık özel kültür ortamı ile genişletin .
NOT: İnsan doku örnekleri için bilgilendirilmiş onay ve etik bir komite tarafından çalışmanın onayı gereklidir. - Prewarm 48-iyi plakalar 37 °C post-elektroporasyon tohumlama için.
- 10 μM Y-27632 ve 3 μM CHIR99021 dahil olmak üzere bazal orta w/o antibiyotiklerin yanı sıra varlığa özgü organoid kültür orta w/o antibiyotikleri (bkz. Tablo 1)hazırlayın.
NOT: Antibiyotiklerin çekilmesi toksik etkileri azaltmak için önemlidir. Y-27632 ve CHIR99021 iyileştirici hücre kurtarma10. -
Organoidlerin hazırlanması (Bkz. Şekil 1)
- Kültür ortamında elektroporasyon numunesi başına 48 kuyuluk bir tabakta 5 adet organoid yetiştirin.
NOT: Proliferatif organoidler kullanılmalıdır (son bölünmeden yaklaşık 2-3 gün sonra). - Kuyu başına 10 μM Y-27632 dahil olmak üzere 230 μL dissosiasyon reaktifi hazırlayın (bkz.
- Kültür ortamını her kuyudan çıkarın ve organoidleri hazırlanan ayrışma karışımının 230 μL'lik bir kısmını mekanik olarak ayrıştırın. Bir 15 mL tüp içine elektroporasyon numunebaşına havuz 5 kuyu.
- 10-15 hücre kümeleri meydana gelene kadar 37 °C'de 5-15 dakika girdap ve kuluçka ile karıştırın. Bu nedenle, ayrışma mikroskopik kontrol edin. 10 mL'ye kadar bazal orta w/o antibiyotikler ekleyerek sindirimi durdurun.
NOT: Bu adım çok önemlidir! Kuluçka çok kısa olduğunda elektroporasyon verimliliği azalacaktır, ancak uzun sindirim hayatta kalma yeteneğini azaltacaktır. - Oda sıcaklığında 5 dakika için 450 x g santrifüj, supernatant atın ve elektroporasyon tampon 4 mL ile iki kez yıkayın (Malzeme Tablosubakınız).
- Kültür ortamında elektroporasyon numunesi başına 48 kuyuluk bir tabakta 5 adet organoid yetiştirin.
2. Elektroporasyon
NOT: Kare dalgalar ve ayrılmış poring ve transfer darbe dizileri yeteneğine sahip elektroporatörler için aşağıdaki protokol geliştirilmiştir (Bkz. Şekil 2). İsteğe bağlı olarak, empedans değerleri ve numuneye aktarılan gerilimler, akımlar ve enerjiler tekrarlanabilir deneyler için kontrol olarak ölçülebilir.
- 30 μg plazmid DNA içeren 100 μL elektroporasyon tamponunda (Bkz. Malzemeler Tablosu)organoid peleti yeniden askıya alın.
NOT: Elektroporasyon işlemi sırasında optimum tuz konsantrasyonu için kullanılan plazmid DNA konsantrasyonu 5 μg/μL'yi aşmalıdır. Bu nedenle, vektörlerin hazırlanması için endofree plazmid maksi kitleri (Bkz. Malzeme Tablosu)tavsiye edilir. Toplam 45 μg'a kadar DNA miktarı sitotoksik etkiler olmadan kullanılabilir. - Hava kabarcıkları üretmeden 2 mm boşluk genişliği ile bir elektroporasyon cuvette içine tam DNA-organoid karışımı dağıtın.
- Elektroporasyon parametrelerini Fujii ve ark.10'a göre ayarlayın (bkz. Tablo 2, Şekil 2).
- Bir parmak ile cuvette dokunarak köpük olmadan hücreleri hafifçe karıştırın. Cuvette'i cuvette odasına yerleştirin.
- Elektroporatörün Ω düğmesine basın ve empedans değerine dikkat edin.
NOT: 30-40 Ω arasındaki empedans en iyi sonuçları gösterdi. Genel olarak, 30-55 Ω arasında olmalıdır. Bu durumda, lütfen aşağıdaki hususları kontrol edin: kullanılan cuvette'nin boşluk genişliği, elektroporatörün kablo bağlantıları, olası hava kabarcıkları, elektroporasyon karışımının doğru hacmi ve tuz konsantrasyonu. - Elektroporasyon programını çalıştırmak ve görüntülenen akımların, gerilimlerin ve enerjilerin değerlerini kontrol etmek için Başlat düğmesine basın.
NOT: Ölçülen gerilimlerin, akımların ve enerjilerin değerleri ayarlanan elektroporasyon parametrelerine karşılık gelir. Yinelenen denemelerin karşılaştırılması için bu verileri dikkate almak yararlı olabilir. - Elektroporasyondan sonra, hemen 500 μL kültür orta w / o antibiyotik ekleyin (CHIR99021 ve Y-27632 ile; adım 1.3 bakınız). Beyaz köpük ayırmak için yukarı ve aşağı pipetleme tarafından karıştırın.
NOT: Beyaz köpük elektroporasyon işleminden sonra ortaya çıkar ve ona çok sayıda hücre bağlanır. Bu yüzden, bunun dissosiyasyonu hücreleri kaybetmemek için çok önemlidir. - Numuneyi tamamen cuvette'den elektroporasyon cuvettes'e ait pipetkullanarak yeni bir 15 mL boruya aktarın (bkz. Malzeme Tablosu). Kalan hücrelerin elde edilmesi için cuvette'nin tekrar bazal ortamla durulanması önerilir.
- Hücrelerin yenilenmesi için, oda sıcaklığında 40 dakika kuluçka.
3. Hücrelerin Tohumlanması
- Hücreleri 450 x g'de oda sıcaklığında 5 dk santrifüj edin ve süpernatantatın.
- 100 μL'lik bodrum matrisinde peleti yeniden askıya alın ve önceden ısıtılmış 48 kuyulu bir plakada 20°L damla (bkz. adım 1.2). Polimerizasyon için 37 °C'de 10 dakika kuluçka ya da yetiştirilen organoidlerin bir sonraki bölünmesine kadar Y-27632 ve CHIR99021 ile desteklenen 250 μL kültür ortamı ekleyin (yaklaşık 5-7 gün).
4. Transfeksiyon Etkinliğinin Belirlenmesi
NOT: Genel olarak, ek transfeksiyon kontrolü olarak floresan belirteci taşıyan bir vektörün elektroporate edilmesi önerilir. Seçilen marker ve kromofor olgunlaşmabağlı floresan yaklaşık içinde görünür olacak 24-48 h sonrası transfeksiyon18.
- Transfeksiyon kontrolünde 24-48 h'den sonra floresan'ı mikroskobik olarak kontrol edin (Bkz. Şekil 4B).
-
Floresan aktif hücre taraması (FACS)
- Hasat hücreleri benzer adım 1.4.2-1.4.4 ve tek hücreler olana kadar 10-20 dakika civarında sindirmek. 10 mL'ye kadar fosfat tamponlu salin (PBS) ekleyin.
- Oda sıcaklığında 5 dakika 450 x g santrifüj ve supernatant atın.
- İsteğe bağlı olarak canlı hücrelerin ayrımcılığı için: Pelleti 1 mL'lik fosfat tamponlu salin (PBS) olarak yeniden askıya alın ve uygun bir antikor ekleyin (Bkz. Malzeme Tablosu)veya propidium iyodür (PI). Çok dikkatli bir şekilde sadece dokunarak ve karanlıkta oda sıcaklığında 30 dakika kuluçka. 10 mL PBS ile yıkayın, santrifüj edin ve süpernatantatın.
- Hücre peletini 200 μL PBS'de yeniden askıya alın ve isteğe bağlı olarak süspansiyonu 100 μm'lik hücresüzden FACS tüpüne filtreleyin.
- Hücreleri uygun bir gating stratejisi kullanarak bir FACS makinesi ile analiz edin (Bkz. Şekil 3; Şekil 4A) ve transfeksiyon verimliliğini belirler.
Sonuçlar
Dört farklı kanser varlığına ait organoidler (CRC, CCC, PDAC, GC) küçük bir plazmid (pCMV-EGFP, 4.2 kb) veya büyük bir plazmid (px458, 9.3 kb) kullanılarak en az 3 kez elektroporated edildi. Her iki vektör de akış sitometrisi ile elektroporasyondan sonra transfeksiyon veriminin 48 saat belirlenmesini sağlayan bir GFP kaseti taşır. Sadece canlı hücreleri analiz etmek için tarama yapıldı önce bir yaşam-ölüm antikor ile boyama. Gating stratejisi Şekil 3'tegösterilmiştir.
Dört organoid varlığın tümlerinde 4.2 kB büyüklüğünde plazmid, büyük olana göre daha yüksek verimlilikle transfekslendi (Bkz. Şekil 4). PDAC organoidlerinde küçük plazmidin en verimli transfeksiyonuna 92.1 ± 5.2 % GFP pozitif hücre li erişirken, büyük plazmid % 46.7 ± 3.7 verimlilikle transfeced edildi (ortalama ± standart sapma, n = 3). Pankreas kanseri organoidleri ile karşılaştırıldığında, daha büyük plazmid daha verimli 53.4 ± 11.7% ortalama verimlilik ile CRC organoidler içine transfekte edildi, küçük plazmid ise ortalama verimlilik ile transfected oldu 84.3 ± 5.8%. Transfect için en zor varlık gastrik kanser organoidleri vardı: hem büyük hem de küçük plazmid için, en düşük transfeksiyon verimliliği bu varlık (32.3 ± 12.7 % ve 74.1 ± 5.5% sırasıyla) ulaşıldı. CCC organoidleri küçük plazmid için ortalama transfeksiyon verimi % 83.0 ± 13.1, büyük plazmid için ise % 39.5 ± 10.4 olarak saptandı.
Kavram kanıtı olarak, insan normal mide organoidleri Cas9, GFP ve TP53hedefleyen iki sgRAs için px458_Conc2 plazmid kodlama ile elektroporated edildi. Ekson 8'deki Cas9 indüklenen çift ipliksi kırıkları homolog olmayan son birleştirme (NHEJ) ile onarıldı, bu da çerçeve kayması ve dolayısıyla genin nakavtedilmesiyle sonuçlandı (bkz. Ek Şekil 1).
Tablo 1: Bazal ortam, sindirim karışımları ve yetiştirme ortamının bileşimi. Bu dosyayı görüntülemek için lütfen buraya tıklayın (İndirmek için sağ tıklatın).

Tablo 2: Fujii ve ark.10'agöre elektroporasyon ayarları.
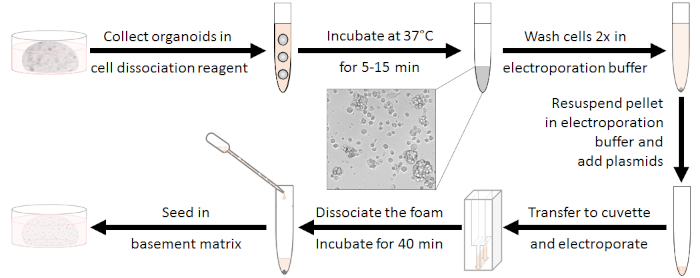
Şekil 1: Elektroporasyon hazırlama iş akışı. İlk olarak, organoidler 10-15 hücre kümeleri ayrıştırılmalı ve antibiyotikler yıkanmış olmalıdır. Elektroporasyondan sonra beyaz köpüğün ayrıştırılması gerekir. Hücreler oda sıcaklığında 40 dakika rejeneratif sonra tohumlu olabilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
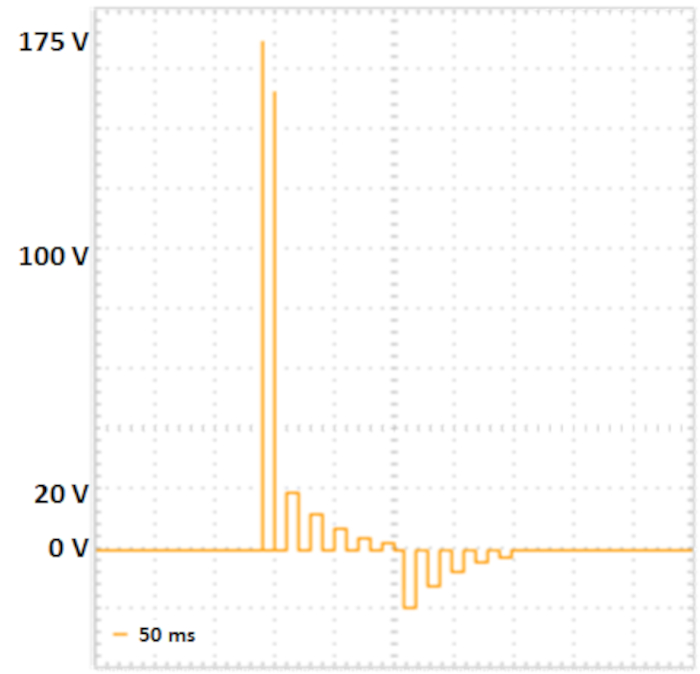
Şekil 2: İki aşamalı elektroporasyon. Yüksek gerilim li iki gözetleme darbesi kısa süreli (175 V ve 157,5 V, her biri 5 ms, 50 ms için duraklama, gerilim bozunumu%10) hücre zarlarında gözenekleri oluşumuna yol açar. Aşağıdaki transfer darbeleri DNA'yı hücrelere verir: beş pozitif transfer darbesi (20 V ile, 12 V, 7.2 V, 4.32 V ve 2.592 V, her biri 50 ms için, 50 ms için duraklatma, gerilim bozunumu %40), ardından beş polarite değişimli transfer darbeleri (20 V, 12 V, 7.2 V, 4.32 V ve 2.592 V, 50 ms için duraklama, gerilim bozunumu %40) takip eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
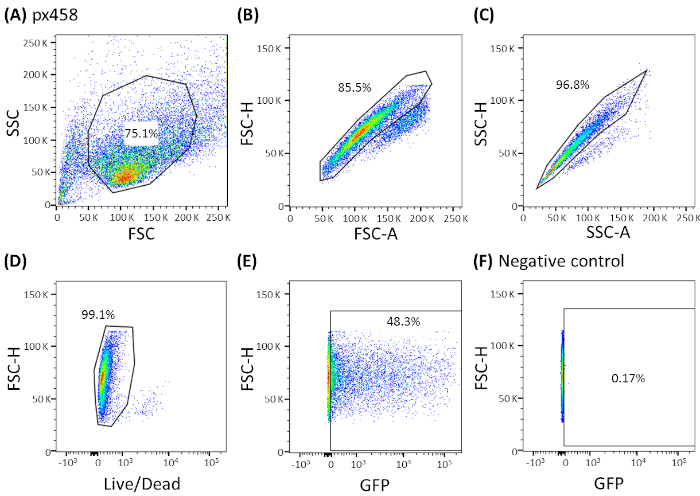
Şekil 3: CCC organoidleri tarafından gösterilen temsili gating stratejisi. Tüm elektroporated organoidler elektroporasyon dan sonra akış sitometri 48 h ile analiz edildi. Plazmid DNA'sı olmadan elektroporated hücreler negatif kontrol olarak kullanılmıştır. Kapılar şu şekilde belirlenmiştir: (A) hücre şekli için gating, (B,C) tek hücreler için gating (doublet ayrımcılık), (D) canlı hücreler için gating (apoptotik hücreler için bir antikor ile lekeli) ve (E,F) nihayet eGFP ifade hücreleri için gating (FITC kanalı). FSC = ileri dağılım; SSC = yan dağılım. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
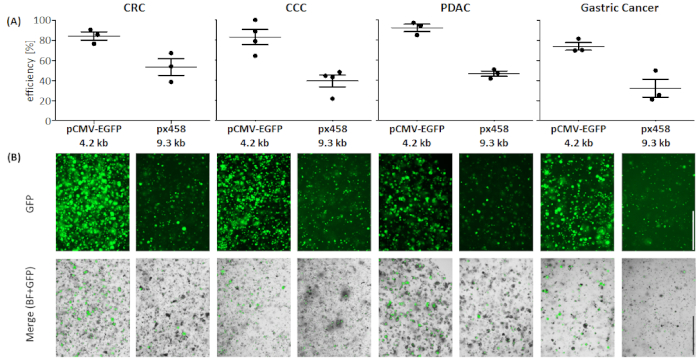
Şekil 4: Dört organoid varlığın elektroporasyon verimliliği. (A) FACS analizi (n = 34, ortalama standart sapma ve her bir değer gösterilir) ve (B) floresan mikroskobu ile görsel karşılaştırma. Ölçek çubuğu = 1.000 μm. BF = parlak alan; CCC = kolanjiokarsinom; CRC = kolorektal kanser; GC = mide kanseri; PDAC = pankreas duktal adenokarsinom. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
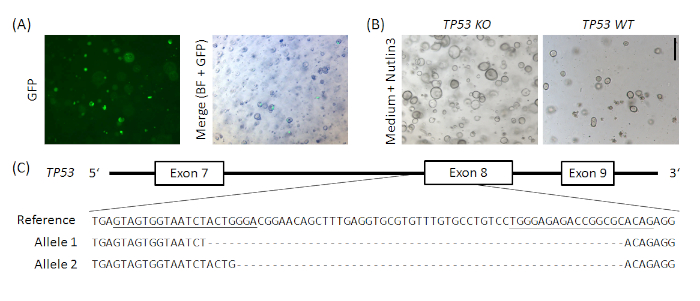
Ek Şekil 1: Normal insan mide organoidlerinde TP53'ün örnek CRISPR/Cas9 tabanlı nakavtı. px458_Conc2 vektörü (bkz. Malzemeler Tablosu)2 gRNA concatemer vektörü, Bon-Kyoung Koo19'dancömert bir hediye olan px45820ile birleştirilerek klonlandı ve 2 sgRNA, Cas9 ve GFP için plazmid kodlaması yapıldı. TP53'ü hedefleyen iki sgRNA, altın kapı klonlama ile px458_Conc2 vektörde kullanılmaya başlandı (benzer şekilde Andersson-Rolf ve ark.19). 10 μg plazmid DNA'sı insan normal mide organoidlerinde elektroporated edildi(A). Klonlar Nutlin3 yönetimi tarafından seçildi (B) ve TP53 nakavt TOPO TA klonlama ve alellerin sıralama tarafından doğrulandı, burada örnek bir klon için gösterilen(C). SGRNA'lar referansta altı çizilidir. Ölçek çubuğu = 200 μm. BF = parlak alan. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, farklı organoid varlıkların etkin, hızlı ve kolay elektroporasyon gerçekleştirmek için ayrıntılı talimatlar verir. PDAC, CRC, CCC ve GC'den sunulan tümör organoidlerine ek olarak, sağlıklı dokudan elde edilen organoidler için de başarılı bir şekilde çalışır. Protokol bir gün içinde gerçekleştirilebilir. Yayınlanan organoid transfeksiyon protokollerinde tüm prosedür dört gün boyunca iki gün boyunca farklı türde yetiştirme ortamı ile hazırlıklar10,21. Protokolümüzde özel bir ön tedavi gerekmez. Elektroporasyon öncesi elektroporasyon tamponu ile yıkanarak ortamın antibiyotik bileşenleri yıkanmış ve optimal empedans değerleri için tuzlu konsantrasyonlarda ayarlama sağlanmıştır. Yine de, bazı kritik yönleri başarılı bir elektroporasyon için düşünülmelidir:
Hücre
Fujii ve ark.10 tarafından yapılan elektroporasyon protokolünde organoidleri tek hücrelere ayırmak ve 20 μm'lik hücre süzgecinden geçirmek önerilir. Elimizde tek hücrelere sindirim güçlü hücrelerin hayatta kalma azaltır. Merenda ve ark.21'deönerildiği gibi, organoidleri 10-15 hücrekümelerine ayırdık ve tek hücreli ayrışmaya göre verimin azaldığını belirleyemedik. Elektroporasyondan sonra, beyaz köpük ayrıştırmak için çok önemli bir adımdır, böylece hiçbir bağlı hücreler kayboluyor.
2B hücre kültürü için, 10 dakikadan 40 dakikaya kadar elektroporasyondan sonra bir rejenerasyon süresinin özellikle büyük plazmidlerin hayatta kalma ve transfeksiyon verimliliğini artırdığı gösterilmiştir22. Test deneylerinde, aynı organoidler için belgelenebilir, bu protokolde elektroporasyon dan sonra 40 dk kuluçka adım yol açan. Elektroporasyondan iyileşmeyi artırmak için, rho-ilişkili protein kigaz (ROCK) inhibitörü Y-27632 ile beş ila yedi gün23kültürlü. Benzer şekilde, glikojen synthase kiaz 3 ek takviyesi (GSK3) inhibitörü CHIR9902110kurtarmak için tek hücrelere yardımcı olmak içindir.
Ayarlar
Kullanılan elektroporatörün avantajlarından biri, empedansın en uygun koşullarda elektroporasyondan önce ölçülebiliyor olmasıdır. Üreticiye göre empedans değerleri 30-55 Ω olmalıdır. Elimizde 30-40 Ω empedans değerleri optimum verimlilik göstermiştir. Bir ön deneyde, poring pulse'un farklı gerilimleri ve darbe uzunluk değerleri, hayatta kalmanın en uygun verim oranını bulmak için çeşitlidir. Özetle, burada açıklanan farklı varlıklarda Fujii ve ark.10'un açıklanan değerlerini doğrulayabiliriz.
Dna
Farklı DNA miktarlarının etkisi, numune başına 45 μg'a kadar olan ön deneylerde test edildi. Sitotoksik etki saptayamadı. Doygunluk > 30 μg ile doza bağımlı bir şekilde transfeksiyon verimi artırıldı. Bu yüzden, son protokolde numune başına 30 μg kullandık, ama tabii ki artırılabilir (örn. paralel olarak daha fazla plazmidin elektroporasyonu için). Ayrıca, DNA'nın saflığı ve konsantrasyonu çok önemli görünüyor. 5 μg/μL'yi aşan bir konsantrasyon optimal transfeksiyon verimi göstermiştir.
Beklendiği gibi, 9.3 kB plazmid daha küçük 4.2 kB plazmid daha düşük bir verimlilik ile transfected olabilir (Şekil 4bakınız). 10 kB'den daha büyük plazmidlerin kullanımının verimliliği daha da azaltması bekleniyor. Gelecekteki uygulamalar için, bu gen taşıyıcıları onları daha küçük24kılan bir plazmid bakteriyel omurga sıyrık eksikliği beri, bir vektör olarak minicircle DNA test etmek ilginç olabilir. Bu gelişmiş bir transfeksiyon verimliliği neden olmalıdır. Ayrıca, organoidlerin CRISPR tabanlı manipülasyonlar için bir ribonükleoprotein olarak Cas9 bağlı sgRNA doğrudan elektroporasyon (RNP) kompleksi alternatif veya ek25olabilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Biz mükemmel teknik yardım için Juliane Fohgrub, Ann-Christin Meinecke ve Max Heiduk teşekkür ederiz. Finansman Deutsche Krebshilfe (No 111350 ve 70112925), Sander Stiftung (No 2014.104.1), Hector Stiftung (No M65.2) ve Avrupa Birliği (ERC No 639050) tarafından sağlanmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| For establishment and culture medium | |||
| [Leu15] Gastrin | Sigma-Aldrich | G9145 | |
| A83-01 | Tocris Bioscience | 2939 | |
| Advanced DMEM/F-12 | Invitrogen | 12634010 | |
| B27 | Invitrogen | 17504044 | |
| B27 Supplement, minus vitamin A | Thermo Fisher Scientific | 12587010 | |
| CHIR99021 | Stemgent | 04-0004 | |
| Collagenase II | Life Technologies | 17101-015 | |
| Collagenase XI | Sigma-Aldrich | C9407-100MG | |
| Collagenase D | Roche | 11088866001 | |
| Dispase II | Roche | 4942078001 | |
| Dnase I | Sigma-Aldrich | D5319 | |
| D-sorbitol | Roth | 6213.1 | |
| Dithiothreitol | Thermo Scientific | 1859330 | |
| EDTA | Roth | 8040 | |
| Forskolin | Tocris Bioscience | 1099 | |
| Glutamax | Life Technologies | 35050061 | |
| Hepes | Thermo Fisher Scientific | 15630106 | |
| hFGF-10 | Preprotech | 100-26 | |
| KCl | Sigma-Aldrich | P9541 | |
| KH2PO4 | Roth | 3904.2 | |
| Matrigel | Corning | 356231 | basement matrix |
| mEGF | Invitrogen | PMG8043 | |
| N2 | Invitrogen | 17502048 | |
| NaCl | Roth | 3957.1 | |
| Na2HPO4 | Roth | K300.2 | |
| N-Acetyl-L-Cystein | Sigma-Aldrich | A9165 | |
| Nicotinamid | Sigma-Aldrich | N0636 | |
| Noggin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (Hek293-mNoggin-Fc) |
| PBS | Gibco | 14190169 | |
| Penicillin Streptomycin | Life Technologies | 15140122 | |
| Primocin | InvivoGen | ant-pm-1 | |
| Prostaglandin E2 | Tocris Bioscience | 2296 | |
| Recombinant Human HGF | Preprotech | 100-39H | |
| Rspondin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (HA-Rspo1-Fc-293T) |
| SB202190 | Sigma-Aldrich | S7067 | |
| Sucrose | VWR | 27,480,294 | |
| TrypLE Express | Gibco | 12604021 | Dissociation reagent |
| Wnt3A | n.a. | n.a. | Conditioned medium produced from L-Wnt3a cells (from Sylvia Boj) |
| Y-27632 | Sigma-Aldrich | Y0503 | |
| Consumables | |||
| Cell Strainer 100 µm | Falcon | 352360 | |
| 48-well plate | Corning | 3548 | |
| Nepa Electroporation Cuvettes 2mm gap w/pipettes | Nepa Gene Co., Ltd. | EC-002S | |
| Tubes 15 ml | Greiner | 188271 | |
| Tubes 15 ml low binding | Eppendorf | 30122208 | Tubes for FACS preparing |
| Equipment | |||
| Electroporator Nepa21 | Nepa Gene Co., Ltd. | n.a. | |
| EVOS FL Auto | Invitrogen | AMAFD1000 | Fluorescence microscope |
| LSRFortessa | BD Bioscience | 647800E6 | FACS |
| Reagents and plasmids | |||
| Live/dead fixable blue dead cell stain kit | Invitrogen | L34962 | Includes antibody for live/dead staining for FACS analysis |
| EndoFree Plasmid Maxi Kit | Qiagen | 12362 | |
| Nutlin-3 | Selleckchem | S1061/07 | |
| Opti-MEM | Gibco | 31985047 | Electroporation buffer |
| 2 gRNA concatemer vector | AddGene | 84879 | |
| pCMV-EGFP | Nepa Gene Co., Ltd. | n.a. | |
| px458 plasmid | AddGene | 48138 | coding for sgRNA and Cas9 |
| px458_Conc2 plasmid | AddGene | 134449 | px458 plasmid containing 2x U6 promotors for two different sgRNAs |
| sgRNA_hTP53_1a | Eurofins Genomics | n.a. | 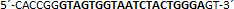 |
| sgRNA_hTP53_1b | Eurofins Genomics | n.a. | 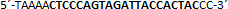 |
| sgRNA_hTP53_2a | Eurofins Genomics | n.a. | 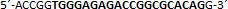 |
| sgRNA_hTP53_2b | Eurofins Genomics | n.a. | 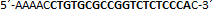 |
Referanslar
- Huch, M., et al. Long-term culture of genome-stable bipotent stem cells from adult human liver. Cell. 160 (1-2), 299-312 (2015).
- Werner, K., Weitz, J., Stange, D. E. Organoids as Model Systems for Gastrointestinal Diseases: Tissue Engineering Meets Genetic Engineering. Current Pathobiology Reports. 4 (1), 1-9 (2016).
- Olayanju, A., Jones, L., Greco, K., Goldring, C. E., Ansari, T. Application of porcine gastrointestinal organoid units as a potential in vitro tool for drug discovery and development. Journal of applied toxicology. 39 (1), 4-15 (2019).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Matano, M., et al. Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids. Nature Medicine. 21 (3), 256-262 (2015).
- Schwank, G., et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 13 (6), 653-658 (2013).
- Drost, J., et al. Use of CRISPR-modified human stem cell organoids to study the origin of mutational signatures in cancer. Science. 358 (6360), 234-238 (2017).
- Zhang, X. H., Tee, L. Y., Wang, X. G., Huang, Q. S., Yang, S. H. Off-target Effects in CRISPR/Cas9-mediated Genome Engineering. Molecular Therapy Nucleic Acids. 4, e264 (2015).
- Tsong, T. Y. Electroporation of cell membranes. Biophysical journal. 60 (2), 297-306 (1991).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nature Protocols. 10 (10), 1474-1485 (2015).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Broutier, L., et al. Human primary liver cancer-derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424-1435 (2017).
- Hennig, A., et al. CFTR Expression Analysis for Subtyping of Human Pancreatic Cancer Organoids. Stem Cells Int. 2019, 1024614 (2019).
- Seidlitz, T., et al. Human gastric cancer modelling using organoids. Gut. 68 (2), 207-217 (2019).
- Stepanenko, O. V., Verkhusha, V. V., Kuznetsova, I. M., Uversky, V. N., Turoverov, K. K. Fluorescent proteins as biomarkers and biosensors: throwing color lights on molecular and cellular processes. Current protein & peptide science. 9 (4), 338-369 (2008).
- Andersson-Rolf, A., et al. Simultaneous paralogue knockout using a CRISPR-concatemer in mouse small intestinal organoids. Dev Biol. 420 (2), 271-277 (2016).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8, 2281 (2013).
- Merenda, A., et al. A Protocol for Multiple Gene Knockout in Mouse Small Intestinal Organoids Using a CRISPR-concatemer. Journal of Visualized Experiments. (125), (2017).
- Lesueur, L. L., Mir, L. M., Andre, F. M. Overcoming the Specific Toxicity of Large Plasmids Electrotransfer in Primary Cells In Vitro. Molecular Therapy Nucleic Acids. 5, e291 (2016).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Darquet, A. M., Cameron, B., Wils, P., Scherman, D., Crouzet, J. A new DNA vehicle for nonviral gene delivery: supercoiled minicircle. Gene Therapy. 4 (12), 1341-1349 (1997).
- Jacobi, A. M., et al. Simplified CRISPR tools for efficient genome editing and streamlined protocols for their delivery into mammalian cells and mouse zygotes. Methods. 121-122, 16-28 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır