Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir Kombinatoryal Tek Etki Alanı Antikor Kütüphanesi adım wise Faj Seçimi ile Son Derece Spesifik Kimyasal Kaynaklı Protein Dimerization Sistemleri Oluşturma
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Herhangi bir küçük molekül ligand için istenilen yakınlık ve özgüllük ile kimyasal kaynaklı protein dimerizasyon sistemleri oluşturma birçok biyolojik algılama ve harekete uygulama olacaktır. Burada, faj la görüntülenen tek etki alanı antikor kütüphanesinin adım adım seçimi yoluyla kimyasal olarak indüklenen dimerizasyon sistemlerinin de novo mühendisliği için etkili, genelleştirilebilir bir yöntemi tanımlıyoruz.
Özet
Sadece küçük moleküllü bir ligand varlığında meydana gelen protein dimerizasyon olayları, biyolojik yolların diseksiyonu ve manipülasyonu için küçük moleküllü biyosensörlerin geliştirilmesini sağlar. Şu anda, kimyasal olarak indüklenen dimerization (CID) sistemlerinin sadece sınırlı sayıda var ve belirli küçük moleküllü ligandlar için istenilen duyarlılık ve seçicilik ile mühendislik yenileri protein mühendisliği alanında bir sorun olmaya devam etmektedir. Burada yüksek bir iş-iş tarama yöntemi, combinatorial binders-enabled sseçim CID (COMBINES-CID), cid sistemlerinin de novo mühendislik ligands büyük bir çeşitlilik için geçerli dir. Bu yöntem, ilk ilgi bir ligand ve daha sonra 2) "dimerization bağlayıcılar" sadece bağlantı bağlayıcı-ligand kompleksleri bağlamak bağlamak 1) "çapa bağlayıcıları" elde etmek için bir faj görüntülenen kombinatoryal nanobody kütüphane iki adımlı seçim kullanır. Çapa bağlayıcılarını seçmek için,10'dan fazla 9 tamamlayıcılık belirleyici bölgeden (CDR) randomize nanocisi olan bir kombinatoryal kütüphane biyotinylated ligand ile taranır ve isabetler biyo-katman interferometrisi (BLI) ile etiketlenmemiş ligand ile doğrulanır. Dimerization bağlayıcıları elde etmek için, nanobody kitaplığı pozitif tarama için hedef olarak çapa bağlayıcı-ligand kompleksleri ve negatif tarama için bağlanmamış çapa bağlayıcıları ile taranır. BİrLEŞTİrME-CID, diğer immünglobulin, immünoglobulin olmayan veya ilaç, metabolitler, sinyal molekülleri vb in vitro ve in vivo algılama için biyosensörler oluşturmak için hesaplamalı olarak tasarlanmış iskeleler ile cid bağlayıcıları seçmek için geniş uygulanabilir.
Giriş
Cid sistemleri, hangi iki protein sadece küçük moleküllü ligand varlığında dimerize (Şekil 1), diseksiyon ve metabolik manipüle için çok yönlü araçlar sunuyoruz, sinyal, ve diğer biyolojik yollar1. Onlar biyolojik aktüasyon potansiyelini göstermiştir, ilaç kontrollü T hücre aktivasyonu gibi2 ve apoptosis3,4,benimseyen T hücre tedavisinin güvenliği ve etkinliğini artırmak için. Ayrıca, küçük moleküllü hedeflerin in vivo veya in vitro tespiti için yeni bir metodoloji sağlarlar. Örneğin, CID proteinleri genetik olarak floresan muhabir sistemleri (örneğin, floresan rezonans enerji transferi (FRET)5 ve dairesel olarak permuted floresan proteinler)6 ile gerçek zamanlı in vivo ölçümler için eritilebilir veya sandviç enzimbağlantılı immünosorbent tahlil (ELISA) benzeri tahliller için yakınlık reaktifleri olarak hizmet verebilir.
Geniş uygulamalarına rağmen, belirli bir küçük moleküllü ligand tarafından kontrol edilebilen yeni CID sistemlerinin oluşturulması büyük zorluklara sahiptir. Hayvan bağışıklama dahil olmak üzere kurulan protein bağlayıcı mühendislik yöntemleri7, in vitro selection8,9, ve hesaplamalı protein tasarımı10 ikili protein-ligand etkileşimleri ile işlev ligand bağlayıcı proteinler üretebilir. Ancak, bu yöntemler ligand kaynaklı üçüncü CID kompleksi oluşturmakta güçlük sahiptir. Bazı yöntemler kimyasal olarak aynı veya farklıproteinler11, 12,13,14,15,16 bağlamak veya önceden varolan küçük molekül-protein kompleksleri 17 hedefleyen antikorlar gibi bağlayıcı proteinleri seçerek güveniki ligandlar bağlayarak CID oluşturmak17,18, ve böylece ligands sınırlı bir seçim var.
Cid sistemlerinin de novo mühendisliği için cid (COMBINES-CID) yönteminin combinatorial binders-enabled sseçim geliştirdik19. Bu yöntem, ligand kaynaklı dimerizasyon yüksek özgüllük elde edebilirsiniz (örneğin, bir çapa-dimerization bağlayıcı dissosilasyon sabiti, KD (ligand olmadan)KD (ligand ile) > 1.000). Dimerizasyon özgüllüğü, ligand bağlama üzerine konformasyonel değişiklikler getirebilen esnek bağlama alanlarına sahip çapa bağlayıcıları kullanılarak elde edilir ve bu da sadece ligand'a bağlı çapa bağlayıcılarını tanıyan konformasyonel seçici bağlayıcıların seçimiiçin bir temel oluşturur. Biz nanobodies cannabidiol (CBD) kaynaklı heterodimers oluşturarak bir kanıt-bir ilke gösterdi, bir 12-15 kDa fonksiyonel antikor parçası evrensel bir iskele ve üç esnek CDR döngüleri oluşan camelid gelen (Şekil 2)20, küçük molekül epitoplar için uyarlanabilir boyutları ile bağlayıcı bir cep oluşturabilirsiniz21,22. Aynı yüksek kaliteli kütüphane farklı ligandlara uygulanabildiği için, özellikle, bir kombinatoryal protein kütüphanesinin in vitro seçimi CID mühendisliği için uygun maliyetli ve genelleştirilebilir olmalıdır.
Bu protokol ve videoda, iki aşamalı in vitro seçimi ve çapa doğrulamasını(Şekil 3A)ve dimerizasyon bağlayıcılarının(Şekil 3B)tanımlanmasına odaklanarak, birleştirici nanobody kütüphanesini hedef olarak CBD kullanarak 109'dan daha yüksek bir çeşitlilikle taramaya odaklanır, ancak protokol diğer protein kütüphaneleri veya küçük moleküllü hedefler için geçerli olmalıdır. CID bağlayıcılarının taranması genellikle 6-10 hafta sürer(Şekil 4).
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Kütüphane inşaatı
- Daha önceaçıklandığıgibi ~ 1.23-7.14 x 109bir çeşitlilik ile sentetik bir kombinatoryal tek etki alanı antikor kütüphanesi kullanın. Bu protokol kitaplık oluşturma içermez, ancak diğer birleştirici bağlayıcı kitaplıklara uygulanabilir.
2. Ligand hedef veya ligand biyotinylation
- Seçilen ligand biyotinylate, örneğin, CBD ve tetrahidrokanabinol (THC)19, çeşitli kimyasal sentez stratejileri ile, bir hedefin uygun biyotinylation sitelerine bağlı olarak.
3. Çapa bağlayıcı taraması
- Seçimin başlangıcı
- 37 °C'de 6 mL 2YT ve dakikada 250 devir (rpm) ile ~0,5'lik 600 nm (OD600)emiciliğe yeni yetişen tek bir TG1 hücrekolonisi aşılayarak seçimin her turuna başlayın. Adım 3.5.1 kullanmak için buz üzerindeki hücreleri kuluçkaya yatırın.
- Biotin bağlı streptavidin boncuklar ile negatif seçim
- 300 μL streptavidin kaplı manyetik boncukları manyetik ayırma rafı kullanarak 300 μL,%0,05 fosfat tamponlu salin ile tween tamponlu (PBST, 1 x PBS % 0,05 vol/vol Tween %20) kullanarak yıkayarak "negatif seçim boncuklarını" hazırlayın ve 1 x PBS ile 2x.
- 1 x PBS (pH = 7.4) 1 mL kazein ile boncukları yeniden askıya alın ve biyotinkullanarak bildirilen bağlama kapasitesini 5 katlayarak boncukları doygunlaştırın. Oda sıcaklığında kuluçka (RT) bir rotator üzerinde 1 saat.
- Toplam sekiz yıkama için 1 x PBS kullanarak %0,05 PBST ve 3x kullanarak boncukları 5x yıkayın.
- 1 x PBS 'de (pH = 7,4) %1 kazein/%1 BSA'ya ~1013 faj parçacıkları ekleyin ve 1 saat boyunca rt'de inkübül.
- Kuluçka dan sonra, adım 3.3.6 kullanılacak supernatant toplamak.
- Biyotinylated ligand bağlı streptavidin boncukile pozitif seçim
- 3.2.1 adımlarını takiben "negatif seçim boncukları" için kullanılan boncuk hacmini 1/2'sini kullanarak "pozitif seçim boncuklarını" hazırlayın.
- 1 × PBS, pH 7.4 1 mL 1 kazein ile boncukyeniden askıya ve tercih edilen biyotinylated ligand kullanarak manuel dayalı hesaplanan tam bağlama kapasitesi 5kat ekleyerek boncuk doygunluk. 1 saat için bir rotator üzerinde RT de kuluçka.
- Toplam sekiz yıkama için 1 x PBS kullanarak %0,05 PBST ve 3x kullanarak boncukları 5x yıkayın.
- Fajlar ve streptavidin kaplı manyetik boncuklar arasında spesifik olmayan bağlanmayı önlemek için boncukları 1 x PBS 'de (pH = 7.4) 1 mL kazein/%1 BSA ile bloke edin ve RT'de 1 saat boyunca bir rotatorüzerinde inkütün.
- Streptavidin kaplı manyetik boncukları %0,05 PBST ve bir kez de 1 x PBS kullanarak toplam dört yıkama için yıkayın.
- Streptavidin kaplı manyetik boncukları, 3.2.5 adımdan alınan bağlanmamış fajları kullanarak yeniden askıya alın ve RT'de 1 saat boyunca bir rotator da kuluçkaya yatırın.
- Manyetik boncuklar rahatsız etmeden supernatant ayıklayın. 3.5.1 adımda kullanılmak üzere, bağlanmamış fajları giriş olarak kaydedin.
- Boncukları %0,05 PBST ve 1 x PBS kullanarak 5x kullanarak 10 kat yıkayın. Her üç yıkıntı arasında özellikle tüp duvarlara bağlı fajlar önlemek için yeni bir tüp onları transfer.
- Faj ile görüntülenen nanocisimlerin elüsasyonu
- Mikromolar aralıktaki konsantrasyonu (örn. 10-50 μM) kullanarak ve RT'de 30 dakika boyunca rotator üzerinde kuluçkaya yatarak, biyotinylated olmayan ligandın450 μL'lik kısmını ekleyerek, rekabetçi bir şekilde bağlı fajları eleyin. Bağlı fajların rekabetçi elüsyonu için seçilen ligand konsantrasyonu "çapa bağlayıcısı"nın istenilen K D'sine bağlıdır. Ligand konsantrasyonları ilk seçim turlarında nispeten yüksek olabilir ve daha sonraki turlarda azalabilir.
- Supernatant toplamak ve çıkış olarak eluted fajlar kaydedin, adım 3.5.2 kullanılacak.
- Giriş/çıkış titrasyonları ve enfeksiyon
- Giriş titrasyonu için, 1 x PBS'de109'a kadar 10 x seri seyreltmeler hazırlayın.3.7 adımdan giriş fajı ile katlayın. Her seyreltmeden 70 μL TG1 hücresine (OD600 ~ 0,5) 10 μL giriş fajı aktararak enfeksiyonları yapmak için 107-109 seri seyreltme kullanın. 45 dakika boyunca 37 °C'de kuluçkaya yatın, enfekte TG1 hücrelerini 100 μg/mL ampisilin ve %2 (wt/vol) glikoz içeren üç adet 90 mm 2YT-agar tabakta türün ve gece boyunca 37 °C'de kuluçkaya yatırın. Gece plakalarından, faj girişi aşağıdaki gibi hesaplanabilir:
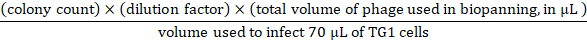
- Çıkış enfeksiyonu ve titrasyon için, eluted fajları TG1 hücrelerinin 3.4.2 ila 3 mL'sinden (OD600~ 0.5) aktarın. 45 dakika boyunca 37 °C'de bir su banyosunda kuluçka. Daha sonra 10 x seri seyreltmeler hazırlamak 2YT kadar 103-kat, plaka 90 mm 2YT-agar yemekleri her seyreltme, ve 37 °C gecede kuluçka. Gece plakalarından, faj çıkışı aşağıdaki gibi hesaplanabilir:
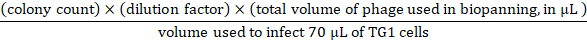
- Kalan enfekte TG1 hücrelerini 100 μg/mL ampisilin ve %2 (wt/vol) glikoz içeren üç adet 150 mm 2YT-agar plakaya bölün. 37 °C'de bir gecede kuluçka plakaları.
- Giriş titrasyonu için, 1 x PBS'de109'a kadar 10 x seri seyreltmeler hazırlayın.3.7 adımdan giriş fajı ile katlayın. Her seyreltmeden 70 μL TG1 hücresine (OD600 ~ 0,5) 10 μL giriş fajı aktararak enfeksiyonları yapmak için 107-109 seri seyreltme kullanın. 45 dakika boyunca 37 °C'de kuluçkaya yatın, enfekte TG1 hücrelerini 100 μg/mL ampisilin ve %2 (wt/vol) glikoz içeren üç adet 90 mm 2YT-agar tabakta türün ve gece boyunca 37 °C'de kuluçkaya yatırın. Gece plakalarından, faj girişi aşağıdaki gibi hesaplanabilir:
- Daha sonraki seçim turları için kütüphane amplifikasyonu ve kurtarma
- Plaka başına 2YT 3 mL ekleyin, steril bir hücre kazıyıcı ile kazıyın ve 50 mL konik tüp tüm hücreleri toplamak. Steril gliserol ile toplanan hücreleri karıştırın (%20 wt/vol son konsantrasyon). Karışımın OD600 ölçün ve 3-5 stok aliquots olun. Uzun süreli depolama için -80 °C'de saklayın.
- Faj kurtarma için, 25 mL 2YT ortam 25 mL 20T medya kullanarak faji içeren TG1 bakteriyel karışımı seyreltmek 2% glikoz ve 100 μg/mL ampisilin ile bir OD600 ~0.1. Kültür hücreleri 37 °C ve 250 rpm bir OD600 ~ 0.5.
- 5 x 109 pfu/mL'de CM13 yardımcı fajı ekleyerek hücreleri süperenfekte edin ve 45 dakika boyunca 37 °C ve 250 rpm'de kuluçkaya yatırın. CM13 yardımcı faj ı tam faj parçacıklarının montajı için gerekli faj kat proteinleri sağlar.
- Glikozu çıkarmak için 10 dk için 8.000 x g'de kültürü santrifüj edin. 100 μg/mL ampisilin ve 50 g/mL kanamisin ile desteklenen 50 mL 2YT ortam ve 25 °C ve 250 rpm'de inkübün kullanarak hücreleri yeniden askıya alın.
- Hücreleri 9.000 x g, 4 °C' de gece kültüründen 30 dk. Yeni bir tüpe aktarın ve 1/5 hacimli PEG/NaCl çözeltisi (%20 wt/vol polietilen glikol-6,000 ve 2.5 M NaCl) kullanarak süpernatant'ı çökeltin. Hafifçe karıştırın ve 1 saat buz üzerine yerleştirin.
- 30 dk. için 4 °C'de 12.000 x g kullanarak faj partiküllerini santrifüj ile toplayın. Artık bakterileri temizlemek için tüpü 20.000 x g ve 4 °C'de 10 dakika santrifüj edin.
- Bakteriyel pelet rahatsız etmeden yeni bir mikrosantrifüj tüp supernatant aktarın. 269 nm ve 320 nm emilimini ölçmek için 1:100 seyreltme kullanın. Toplam faj sayısı aşağıdaki formül23kullanılarak hesaplanabilir:
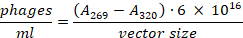
- Faj kütüphanesini kısa süreli kullanım için 4 °C'de veya uzun süreli depolama için -80 °C'de %25 gliserol ile saklayın.
- 3-6 tur için veya istenilen zenginleştirme gözlemlenene kadar (Sonuçlar bölümüne bakın) seçim turlarını (adım 3.1-3.6) tekrarlayın. Plaka ve ligand (bölüm 5-7) onların yakınlık ve özgüllük karakterize etmek için tek klonları (bölüm 4) seçin.
4. Tek klon yalıtımı
- Tek tek klonları zenginleştirilmiş bir alt kütüphaneden ayırmak için, faj bulaşmış TG1 hücrelerinin 10x seri seyreltmelerini hazırlayın (adım 3.5.2). 100 μg/mL ampisilin ve %2 (wt/vol) glikoz içeren 90 mm 2YT-agar tabaklarda seri seyreltmeler ve bir gecede 37 °C'de inküksiyon.
- Geceplakalarından, steril derin kuyu plakalarında kuyu başına 100 μg/mL ampisilin ile desteklenen 250 μL 2YT ortama tek koloniler seçin ve bir gecede 37 °C'de büyüyün.
- Gece kültürlerinden, 100 μL'lik taze 2YT ortama 100 μG/mL ampisilin ile desteklenerek 10 μL'yi 500 μL'lik taze ortama dönüştürün.
- Hücreleri ~0,5'in OD600'üne kadar büyütün, 5 x 109 pfu/mL'de CM13 yardımcı fajı ekleyin ve 45 dakika boyunca 37 °C ve 250 rpm'de kuluçkaya yatın.
- 100 μg/mL ampisilin ve 50 μg/mL kanamisin ile takviye edilmiş 500 μL 2YT ortam ekleyin. Gece boyunca 25 °C ve 250 rpm'de kuluçkaya yatırın.
- 10 dk için 3.000 x g gece kültürleri derin kuyu plakaları santrifüj. Hücre pelet rahatsız etmeden faj parçacıkları içeren supernatant toplamak.
- Faj parçacıkları ligand seçilen klonların özgüllüğünü belirlemek için ELISA için kullanılabilir. Biotin veya hedefin yapısal homolog negatif kontrol olarak kullanılabilir.
5. ELISA tarafından çapa bağlayıcı sı
- Coat 96 iyi ELISA plakaları 100 μL 5 μg/mL streptavidin kullanarak kaplama tampon (100 mM karbonat tampon, pH = 8.6) 4 ° C gecede.
- ELISA plakalarını %0,05 PBST kullanarak 3 kat yıkayın ve hedef kuyulara 1 μM biyotinylated hedefin 100 μL'sini ekleyin. Kontrol kuyularına 100 μL 1 μL biotin veya hedef homolog ekleyin. RT'de 1 saat kuluçka.
- Yıkama plakaları %0,05 PBST kullanarak 5kat ve 1 x PBS'ye %1 kazein 300 μL ekleyerek spesifik olmayan bağlamayı engelleyin. RT'de 1 saat kuluçka.
- ELISA plakalarını %0,05-PBST kullanarak 3x yıkayın ve saflaştırılmış faj süpernatantını ekleyin. RT'de 1 saat kuluçka.
- ELISA plakalarını %0,05 PBST kullanarak 10x yıkayın ve 100 μL horseradish peroksidaz (HRP)-M13 majör kat protein antikor (1:10.000 seyreltme ile 1 x PBS% 1 kazein) ekleyin. RT'de 1 saat kuluçka.
- ELISA plakalarını %0,05 PBST kullanarak 3 kat yıkayın ve 100 μL tetrametilbenzidin (TMB) substrat ekleyin. 10 dakika veya görünür bir renk değişikliği gözlenene kadar kuluçka. 1 M HCl'nin 100 μL'sini ekleyerek reaksiyonu durdurun. Plakayı bir spektrofotometrede 450 nm'de okuyun.
- Protein ekspresyonu ve arınması için, hedefe yüksek yakınlık ve özgüllük gösteren klonları seçin (bkz.
6. Protein ekspresyonu, arınma ve biyotinylasyon
- Daha önce bildirildiği gibi19, subclone bölüm 5 klonları seçilen ve C-terminal Avi etiketli ve His-tagged nanobodies olarak ifade.
- E. coli WK6 hücrelerinin periplazmasındaki (genellikle 1 L kültüründe), ozmotik şokla serbest ve nikel-NTA sütunu kullanarak arındırı(bkz. Malzeme Tablosu)seçilen nanokütleleri ifade edin.
- Bir tuzsuzlama sütunu ile exchange tampon (5% gliserol ile 1 x PBS; Malzemeler Tablosubakınız).
- Daha fazla kullanım için ticari bir kit (Bkz. Malzeme Tablosu)kullanan biyotinylate nanobodies.
7. BLI ile çapa bağlayıcıkarakterizasyonu
- Streptavidin biyosensörleri üzerinde 200 nM biyotinylated çapa bağlayıcıları immobilize ederek seçili çapa bağlayıcılarının bağlayıcı yakınlık ve kinetik analiz (Malzemeler Tablosubakınız) bağlayıcı analiz tampon (1 x PBS (pH = 7.4), 0.05% Tween 20, 0.2% BSA, 3% metanol).
- Veri analizi yazılımı kullanarak sabit durum analizi ile çapa bağlayıcı-ligand etkileşimlerinin dissosyasyon sabitlerini(KD)hesaplayın (bkz. Malzeme Tablosu). Elde edilen KD değerleri genellikle tek-çift basamaklı mikromolar arasında değişir.
8. Dimerization bağlayıcı tarama
NOT: "Dimerization bağlayıcılar" biyopanning tarama iki kritik adım dışında çapa bağlayıcıları benzer: 1) Dimerization bağlayıcılar seçilen biyotinylated çapa bağlayıcısı ve negatif için çapa bağlayıcı-ligand kompleksi kullanılarak seçilir ve pozitif seçimler, sırasıyla. 2) Elüsyon adımı sırasında, 100 mM trietilamin sadece çapa bağlayıcıbağlı pozitif seçilmiş fajlar eute için kullanılır - ligand hedef kompleksi. 100 mM trilamin çözeltisi (pH = 11.5) protein etkileşimlerini bozarak pozitif klonları eşen için kullanılır.
- Seçimin başlangıcı
- 37 °C'de 6 mL 2YT ve ~0,5'in OD600'üne 250 rpm'de, minimum bir ortamda yeni yetiştirilen tek bir TG1 hücre kolonisine aşılayarak seçimin her turuna başlayın. Hücreleri buzda kuluçkaya yatırın.
- Negatif olarak seçilmiş nanocisimlerin kaldırılması
- Streptavidin kaplı manyetik boncuklar 400 μL kullanarak "çıkarma tüpü" hazırlayın ve adım 3.2 izleyin. Ancak, biotin ile doymak yerine, seçilen biyotinylated çapa bağlayıcı kullanarak hesaplanan tam bağlama kapasitesini 5kat ekleyin ve adım 8.3.3'te kullanılacak bağlanmamış fajları kaydedin.
- Olumlu seçilmiş nanogövdelerin seçimi
- "Çıkarma tüpü" için kullanılan streptavidin kaplı manyetik boncukların hacmini 1/2 kullanarak ve 3.3.2 ila 3.3.3 adımlarını izleyerek "yakalama tüpünü" hazırlayın. Ancak, yerine biyotinylated ligand ile doymak, seçilen biyotinylated çapa bağlayıcıkullanarak hesaplanan tam bağlama kapasitesi beş kat ekleyin.
- Pozitif dimerizasyon bağlayıcı seçimi için çapa bağlayıcı-ligand kompleksi oluşturmak için, biyotinylated olmayan ligandyeterince yüksek konsantrasyon ekleyin. Bu en streptavidin bağlı çapa bağlayıcı ligand bağlı kompleksi oluşturmak için izin verecektir.
- "Çıkarma tüpünden" alınan bağlanmamış fajları kullanarak 3.3.3 ile 3.3.8 adımlarını izleyin.
- Pozitif olarak seçilmiş nanocisimlerin elüsasyonu
- Çapa bağlayıcı-ligand kompleksine bağlı fajları 100 mM triethylamin'in 450 μL'sini ekleyerek ve RT'de 10 dakika boyunca bir rotatorda kuluçkaya yatırarak eler.
- Rekabetçi eluted fajlar toplamak ve adımları izleyin 3.4.1 için 3.4.2.
- Dimerization bağlayıcı seçiminin diğer turları
- Daha fazla seçim turu gerçekleştirmek için kitaplığı yükseltmek ve kurtarmak için 3,5 ve 3,6 adımlarını izleyin. 3-6 tur için veya istenilen zenginleştirme gözlemlenene kadar tekrar seçim turları. Plaka ve tek klonları seçin (bölüm 4 bakın) hedefe yakınlık ve özgüllük karakterize etmek için.
9. ELISA tarafından dimerization bağlayıcı karakterizasyonu
- ELISA üzerinden karakterizasyon için tek tek klonları izole etmek için bölüm 4'teki adımları izleyin.
- Dimerizasyon bağlayıcı adaylarının çapa bağlayıcısı-ligand kompleksine olan yakınlığını test etmek için, 100 nM biyotinylated çapa bağlayıcısının 100 μL'sini kullanarak ELISA hedef plakasını katlayın. 1 saat kuluçkadan sonra, çapa bağlayıcı-ligand kompleksini oluşturmak için 1 μM ligand hedefi ekleyin.
- Kontrol plakası, serbest çapa bağlayıcısına bağlanabilen klonları taramak için tek başına biyotinylated çapa bağlayıcısı kullanılarak kaplanmalıdır. 100 nM biyotinylated çapa bağlayıcı 100 μL ekleyin ve 1 saat için RT inkübat.
- Bölüm 5.3-5.7'yi izleyin.
10. BLI ile dimerization bağlayıcı karakterizasyonu
- Demir bağlayıcısı için dimerizasyon bağlayıcılarının bağlayıcı afiyeti ve kinetikleri-ligand kompleksi, bağlayıcı test tamponu ile streptavidin (SA) biyosensörler üzerinde biyotinylated dimerization bağlayıcıları immobilize ederek analiz edilebilir ve daha sonra ligand Seri seyreltme ile eşitlenmiş 1 μM çapa bağlayıcı sıyrık ile test edilebilir. KD, kon, ve etkileşimlerin kkapalı bizim bildirilen yöntem kullanılarak hesaplanabilir19.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
CbD'yi hedef olarak kullanarak 109'dan daha yüksek bir çeşitlilikle kombinatoryal nanobody kütüphanesini taratarak çapa ve dimerizasyon bağlayıcılarının iki aşamalı in vitro seçimi ve doğrulanmasını tanımlıyoruz. Hem çapa hem de dimerizasyon bağlayıcıları için birbirini izleyen seçim turları sırasında faj biyopannasyonunun zenginleştirilmesinin değerlendirilmesi önemlidir. Şekil 5'te gösterildiği gibi 4-6 tur seçimden sonraki tipik zenginleştir...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Farklı biyopanning turları için giriş faj kitaplıklarının doğru konsantrasyonlarını seçmek çok önemlidir. Biz genellikle ~ 1012-10 13 faj parçacıkları bir çeşitlilik >109ile bir giriş kütüphane başladı , her faj klonu ~ 100-1.000 kopya pull-down test sunulacak izin. Bağlayıcı bir kontrolde faj konsantrasyonu çok yüksek veya düşükse, spesifik olmayan bağlanma veya pozitif klonların kaybı olasılığı artacaktır. Çapa veya dimerization bağlayıcı seçi...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Bu çalışmayla ilgili geçici bir patent Washington Üniversitesi tarafından dosyalanmıştır.
Teşekkürler
Bu çalışma Washington Üniversitesi İnovasyon Ödülü (L.G.'ye), ABD Ulusal Sağlık Enstitüleri'nden (1R35GM128918'den L.G.'ye) ve Washington Üniversitesi'nin (L.G.)'ye bir başlangıç fonu tarafından desteklendi. H.J. Washington Araştırma Vakfı lisans bursu ile desteklendi. K.W., Washington Üniversitesi Protein Tasarımı Enstitüsü'nden lisans bursu ile desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1-Step Ultra TMB ELISA substrate solution | Thermo Fisher Scientific | 34029 | |
| Agar | Thermo Fisher Scientific | BP1423-2 | |
| Amicon Ultra-15 Centrifugal Filter unit (3 kDa cutoff) | Millipore | UFC900324 | |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | |
| Bio-Rad Protein Assay Kit II | Bio-Rad | 5000002 | |
| BirA biotin-protein ligase standard reaction kit | Avidity | BirA500 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A2153-50G | |
| Casein | Sigma-Aldrich | C7078-1KG | |
| CM13 Helper phage | Antibody Design Labs | PH020L | |
| D-(+)-Glucose monohydrate | Alfa Aesar | A11090 | |
| Dynabeads M-280 Streptavidin | Thermo Fisher Scientific | 11205D | |
| DynaMag-2 Magnet | Thermo Fisher Scientific | 12321D | |
| EDTA | Thermo Fisher Scientific | BP120-1 | |
| Fast DNA Ladder | New England Biolabs | N3238S | |
| FastDigest BglI | Thermo Fisher Scientific | FD0074 | |
| Glycerol | Thermo Fisher Scientific | BP229-1 | |
| HiLoad 16/600 Superdex 200 pg | GE Healthcare | 28989335 | |
| HiPrep 26/10 Desalting Column | GE Healthcare | 17508701 | |
| HisTrap-FF-1ml | GE Healthcare | 11000458 | |
| Imidazole | Alfa Aesar | 161-0718 | |
| IPTG | Thermo Fisher Scientific | 34060 | |
| Kanamycin | Thermo Fisher Scientific | BP906-5 | |
| M13 Major Coat Protein Antibody | Santa Cruz Biotechnology | sc-53004 | |
| NaCl | Sigma-Aldrich | S3014-500G | |
| NanoDrop 2000/2000c Spectrophotometers | Thermo Fisher Scientific | ND-2000 | |
| Nunc 96-Well Polypropylene DeepWell Storage Plates | Thermo Fisher Scientific | 260251 | |
| Nunc MaxiSorp | Thermo Fisher Scientific | 44-2404-21 | |
| Octet RED96 | ForteBio | N/A | |
| pADL-23c Phagemid Vector | Antibody Design Labs | PD0111 | |
| PEG-6000 | Sigma-Aldrich | 81260-1KG | |
| Platinum SuperFi DNA Polymerase | Invitrogen | 12351010 | |
| PureLink PCR Purification Kit | Thermo Fisher Scientific | K310001 | |
| QIAprep Spin M13 Kit | Qiagen | 27704 | |
| Recovery Medium | Lucigen | 80026-1 | |
| SpectraMax Plus 384 | Molecular Devices | N/A | |
| Sucrose | Sigma-Aldrich | S0389-1KG | |
| Super Streptavidin (SSA) Biosensors | ForteBio | 18-5057 | |
| Superdex 75 increase 10/300 GL Column | GE Healthcare | 28-9909-44 | |
| T4 DNA Ligase | Thermo Fisher Scientific | 15224-025 | |
| TG1 Electrocompetent Cells | Lucigen | 60502-1 | |
| Triethylamine | Sigma-Aldrich | 471283-100mL | |
| Trizma Base | Sigma-Aldrich | T1503 | |
| Tryptone | Thermo Fisher Scientific | BP9726-5 | |
| Tween 20 | Thermo Fisher Scientific | BP337-500 | |
| Yeast Extract | Thermo Fisher Scientific | BP1422-2 | |
| Zeba Spin Desalting Column | Thermo Fisher Scientific | 89882 |
Referanslar
- Stanton, B. Z., Chory, E. J., Crabtree, G. R. Chemically induced proximity in biology and medicine. Science. 359 (6380), (2018).
- Wu, C. Y., Roybal, K. T., Puchner, E. M., Onuffer, J., Lim, W. A. Remote control of therapeutic T cells through a small molecule-gated chimeric receptor. Science. 350 (6258), (2015).
- Straathof, K. C., et al. An inducible caspase 9 safety switch for T-cell therapy. Blood. 105 (11), 4247-4254 (2005).
- Di Stasi, A., et al. Inducible apoptosis as a safety switch for adoptive cell therapy. The New England Journal of Medicine. 365 (18), 1673-1683 (2011).
- Mank, M., et al. A FRET-based calcium biosensor with fast signal kinetics and high fluorescence change. Biophysical Journal. 90 (5), 1790-1796 (2006).
- Nagai, T., Sawano, A., Park, E. S., Miyawaki, A. Circularly permuted green fluorescent proteins engineered to sense Ca2+. Proceedings of the National Academy of Sciences of the United States of America. 98 (6), 3197-3202 (2001).
- Hunter, M. M., Margolies, M. N., Ju, A., Haber, E. High-affinity monoclonal antibodies to the cardiac glycoside, digoxin. Journal of Immunology. 129 (3), 1165-1172 (1982).
- Bradbury, A. R. M., Sidhu, S., Dubel, S., McCafferty, J. Beyond natural antibodies: the power of in vitro display technologies. Nature Biotechnology. 29 (3), 245-254 (2011).
- Chen, G., et al. Isolation of high-affinity ligand-binding proteins by periplasmic expression with cytometric screening (PECS). Nature. Biotechnology. 19 (6), 537-542 (2001).
- Tinberg, C. E., et al. Computational design of ligand-binding proteins with high affinity and selectivity. Nature. 501 (7466), 212-216 (2013).
- Spencer, D. M., Wandless, T. J., Schreiber, S. L., Crabtree, G. R. Controlling signal transduction with synthetic ligands. Science. 262 (5136), 1019-1024 (1993).
- Ho, S. N., Biggar, S. R., Spencer, D. M., Schreiber, S. L., Crabtree, G. R. Dimeric ligands define a role for transcriptional activation domains in reinitiation. Nature. 382 (6594), 822-826 (1996).
- Belshaw, P. J., Ho, S. N., Crabtree, G. R., Schreiber, S. L. Controlling protein association and subcellular localization with a synthetic ligand that induces heterodimerization of proteins. Proceedings of the National Academy of Sciences of the United States of America. 93 (10), 4604-4607 (1996).
- Farrar, M. A., AlberolaIla, J., Perlmutter, R. M. Activation of the Raf-1 kinase cascade by coumermycin-induced dimerization. Nature. 383 (6596), 178-181 (1996).
- Erhart, D., et al. Chemical Development of Intracellular Protein Heterodimerizers. Chemistry & Biology. 20 (4), 549-557 (2013).
- Ballister, E. R., Aonbangkhen, C., Mayo, A. M., Lampson, M. A., Chenoweth, D. M. Localized light-induced protein dimerization in living cells using a photocaged dimerizer. Nature Communications. 17 (5), 5475(2014).
- Hill, Z. B., Martinko, A. J., Nguyen, D. P., Wells, J. A. Human antibody-based chemically induced dimerizers for cell therapeutic applications. Nature Chemical Biology. 14 (2), 112-117 (2018).
- Foight, G. W., et al. Multi-input chemical control of protein dimerization for programming graded cellular responses. Nature Biotechnology. 37 (10), 1209-1216 (2019).
- Kang, S., et al. COMBINES-CID: An efficient method for de novo engineering of highly specific chemically induced protein dimerization systems. Journal of the American Chemical Society. 141 (28), 10948-10952 (2019).
- Muyldermans, S. Nanobodies: natural single-domain antibodies. Annual Review of Biochemistry. 82, 775-797 (2013).
- Fanning, S. W., Horn, J. R. An anti-hapten camelid antibody reveals a cryptic binding site with significant energetic contributions from a nonhypervariable loop. Protein Science. 20 (7), 1196-1207 (2011).
- Zavrtanik, U., Luken, J., Loris, R., Lah, J., Hadzi, S. Structural basis of epitope recognition by heavy-chain camelid antibodies. Journal of Molecular Biology. 430 (21), 4369-4386 (2018).
- Denhardt, D. T., Dressler, D., Ray, D. S. The Single-Stranded DNA Phages. , 605-625 (1978).
- Virnekas, B., et al. Trinucleotide phosphoramidites: ideal reagents for the synthesis of mixed oligonucleotides for random mutagenesis. Nucleic Acids Research. 22 (25), 5600-5607 (1994).
- Gu, L., et al. Multiplex single-molecule interaction profiling of DNA-barcoded proteins. Nature. 515 (7528), 554-557 (2014).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır