Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Lysolipid İçeren Sıcaklığa Duyarlı Lipozomların Mikroakışkan Üretimi
Bu Makalede
Özet
Protokol, sendelenmiş herringbone micromixer microfluidics cihazını kullanarak termosensitli lipozomların hazırlanması için optimize edilmiş parametreleri sunar. Bu aynı zamanda lipozomlar içine doksorubisin ve indosiyanyeşil co-kapsülleme ve kontrollü / tetiklenen ilaç salınımı için doksorubisin fototermal tetiklenen serbest sağlar.
Özet
Sunulan protokol, doksorubisin (DOX) gibi kemoterapötik ilaçların yüklenebilen düşük ısıya duyarlı lipozomların (LTSLs) yüksek iş çıkışlı sürekli hazırlanmasını sağlar. Bunu başarmak için, bir etanolik lipid karışımı ve amonyum sülfat çözeltisi bir sendelenmiş herringbone micromixer içine enjekte edilir (SHM) mikroakışkan cihaz. Çözeltiler SHM tarafından hızla karıştırılarak lipozomlar için homojen bir çözücü ortamı sağlar. Toplanan lipozomlar ilk annealed, daha sonra artık etanol kaldırmak için diyalize. Bir amonyum sülfat pH-gradient boyut dışlama kromatografisi kullanılarak dış çözeltitampon değişimi ile kurulur. DOX daha sonra yüksek kapsülleme verimliliği (> %80) ile lipozomlara uzaktan yüklenir. Elde edilen lipozomlar 100 nm Z-ortalama çapı ile boyutu homojendir. Hafif hipertermi (42 °C) varlığında kapsüllü DOX'un ısıya bağlı patlama salınımını sağlayabilirler. Indocin yeşili (ICG) yakın kızılötesi lazer tetikli DOX sürümü için lipozomlar içine co-yüklenebilir. Mikroakışkan yaklaşım, LTSL'lerin yüksek iş lenme, reprodüktilebilir ve ölçeklenebilir hazırlanmasını sağlar.
Giriş
LTSL formülasyonu kemoterapötik ilaç doksorubisin (DOX) sunmak için geliştirilmiş ve klinik olarak ulaşılabilir hafif hipertermi (T 』 41 °C)1verimli patlama ilaç salınımı sağlar klinik olarak ilgili lipozomal bir üründür. LTSL formülasyonu 1,2-dipalmitoyl-sn-glycero-3-fosfokolin (DPPC), lizozlipid 1-stearoyl-2-hidroksi-sn-glycero-3-fosfatidilkolin (MSPC; M "mono" ve PEGylated lipid 1,2-distearoyl-sn-glycero-3-phosphoetanolamine-N-[methoxy(polietilen glikol)-2000] (DSPE-PEG2000)anlamına gelir. Faz geçiş sıcaklığına (Tm 』 41 °C) ulaştıktan sonra, lysolipid ve DSPE-PEG2000 birlikte membran gözenekleri oluşumunu kolaylaştırmak, ilacın bir patlama serbest sonuçlanan2. LTSLs hazırlanması öncelikle bir toplu yukarıdan aşağıya yaklaşım kullanır, yani lipid film hidrasyon ve ekstrüzyon. Bu tekrarlanabilir aynı özelliklere sahip büyük gruplar hazırlamak için zor kalır ve klinik uygulamalar için yeterli miktarlarda3.
Mikroakışkanlar, değişken nanopartikül boyutu, tekrarlanabilirlik ve ölçeklenebilirlik sunan lipozomları hazırlamak için ortaya çıkan bir tekniktir3. Üretim parametreleri optimize edildikten sonra, üretim boyutu paralelleştirme ile ölçeklendirilebilir ve tezgah ölçeği3,4,5'tehazırlanan özelliklerle aynı dır. Geleneksel toplu teknikler üzerinde mikroakışkanların önemli bir avantajı minyatürleştirme yoluyla uzay ve zaman yüksek kontrol edilebilirlik ile küçük sıvı hacimleri işlemek için yeteneği, daha hızlı optimizasyon sağlayan, sürekli ve otomatik bir şekilde çalışırken6. Ekstrüzyon ve sonication gibi homojenizasyon süreçleri gereksiz olduğu için mikroakışkan cihazlar ile lipozomüretimi daha fazla zaman ve enerji verimli bir aşağıdan yukarıya nanoyağış yaklaşımı ile elde edilir7. Tipik olarak, lipidlerin organik bir çözeltisi (örn. etanol) (ve hidrofobik yük) yanlış bir çözücü olmayan (örn. su ve hidrofilik yük) ile karıştırılır. Organik çözücü çözücü olmayan ile karışır gibi, lipidler için çözünürlük azalır. Lipid konsantrasyonu sonunda yağış süreci tetiklenir kritik bir konsantrasyonulaşır7. Lipidlerin Nanoprecipitates sonunda boyutu büyümek ve bir lipozom içine yakın. Lipozomların büyüklüğünü ve homojenliğini yöneten temel faktörler çözücü olmayan ve çözücü arasındaki orandır (yani sulu-organik akış hızı oranı; FRR) ve lipitlerin lipozomlara kendi kendine montajı sırasında çözücü ortamının homojenliği8.
Bu nedenle mikroakışkanlarda verimli sıvı karıştırma homojen lipozomların hazırlanması için gereklidir ve mikserlerin çeşitli tasarımları farklı uygulamalarda kullanılmaktadır9. Sendelenmiş herringbone micromixer (SHM), düşük seyreltme faktörü ile yüksek iş gücü (mL/dk aralığında) sağlayan yeni nesil pasif mikserlerden birini temsil eder. Bu geleneksel mikroakışkan hidrodinamik karıştırma cihazları8,10üstündür. SHM hızla kaotik advection9,11ile sıvıları karıştırmak ringa kemiği oluklar, desenli vardır. SHM'nin kısa karıştırma zaman ölçeği (< 5 ms, 10-100 ms'lik tipik toplama süresi ölçeğinden daha az) homojen bir çözücü ortamda lipid kendi kendine montajın oluşmasını sağlar ve tek tip boyut dağılımı3,12olan nano partiküller üretir.
Mikroakışkanlar ile LTSLs hazırlanması, ancak, kolesterol eksikliği nedeniyle konvansiyonel lipozomal formülasyonları ile karşılaştırıldığında basit değil8, hangi olmadan lipid bilayers etanol kaynaklı interdigitasyon duyarlı dır13,14,15. Şimdiye kadar, lipozomların mikroakışkan üretimi sırasında artık etanol sunar etkisi iyi anlaşılamamıştır. Bildirilen formülasyonların çoğunluğu doğal olarak interdigitasyon dirençlidir (kolesterol veya doymamış lipidler içeren)16, LTSLs aksine hem doymuş ve kolesterol içermez.
Burada sunulan protokol, LTSL'leri sıcaklık tetikli ilaç dağıtımına hazırlamak için SHM'yi kullansın. Sunulan yöntemde, mikroakışkan olarak hazırlanmış LTSL'lerin dinamik ışık saçılımı (DLS) ile nano boyutlu (100 nm) ve düzgün (dağılım < 0,2) olmasını sağladık. Ayrıca, LTSL lipid çift katmanlı bütünlüğünün bir doğrulama olarak transmembran amonyum sülfat gradyan yöntemi (uzaktan yükleme olarak da bilinir)17 kullanarak DOX kapsüllü. DOX uzaktan yükleme yüksek kapsülleme verimliliği elde etmek için bir pH gradyan korumak için lipozom gerektirir (EE), bozulmamış bir lipid ikikat olmadan gerçekleşmesi olası değildir. Bu sunulan yöntemde, tipik mikroakışkan lipozom hazırlama protokolleri ayırt edici, uzaktan yükleme yeteneğini etkinleştirmek için etanol kaldırılmadan önce bir annealing adım gereklidir; yani lipid iki katmanlı bütünlüğünü geri yüklemek için.
Daha önce de belirtildiği gibi, hidrofilik ve hidrofobik yükler de LTSLs oluşumu sırasında yüklerin eşzamanlı kapsülleme için ilk çözümler tanıtılabilir. Bir kanıtı olarak, indosiyanin yeşil (ICG), bir FDA onaylı yakın kızılötesi floresan boya, aynı zamanda umut verici bir fototermal ajan, ilk lipid karışımı tanıtıldı ve başarıyla LTSLs içine yüklenir. Bir 808 nm lazer DOX / ICG yüklü LTSLs ışınlamak ve başarıyla 5 dakika içinde DOX fototermal ısıtma tetiklenen patlama serbest indüklemek için kullanılır.
Tüm enstrümanlar ve malzemeler ticari olarak mevcuttur, kullanıma hazırdır ve özelleştirmeye gerek yoktur. LTSLs formüle etmek için tüm parametreler optimize edilmiş olduğundan, bu protokole göre, mikroakışkanlar hakkında önceden bilgisi olmayan araştırmacılar, termobuna duyarlı ilaç dağıtım sisteminin temelini oluşturan LTSL'leri de hazırlayabilirler.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Ekipman kurulumu
- Şırınga pompalarını ve SHM'yi aşağıdaki gibi monte edin.
- Pompa ağ kablosu(Şekil 1, sarı)pompa kullanarak ana şırınga pompası (Pompa 01, etanol lipid çözeltisi için) "Ağ için" bağlantı noktasına ikincil şırınga pompası (Pompa 02, sulu çözüm için) "Bilgisayara" bağlantı kurutun.
- Ana pompanın "Bilgisayara" bağlantı noktasını ağ kablosunu pompalamak için bilgisayarı kullanarak bilgisayarın "RS232 Serial" bağlantı noktasına bağlayın(Şekil 1, mavi).
- Bir somun ve ferrule kullanarak SHM'nin giriş ve çıkışlarının her birine boru bağlayın. Her iki giriş için de boru terminalini başka bir somun ve ferrule ve bir sendika derlemesi kullanarak dişi Luer'e dönüştürün. Girişlerin daha uzun borular şırıngalara daha kolay bağlanmasını sağlar (Şekil 2).
- Pompa kontrol yazılımını ayarlayın.
- Şırınga pompasının "Kurulum" düğmesini kullanarak, ana şırınga pompasının ve ikincil şırınga pompasının adresini sırasıyla "Ad:01" ve "Ad:02"ye atayın. Bunun sadece ilk kez yapılması gerekiyor.
- Bilgisayardaki pompa kontrol yazılımını açın. İki şırınga pompası otomatik olarak tespit edilmeli ve ardından bip sesi alınmalıdır. Aksi takdirde, bağlantıyı güncellemek için Pompalar ve Arama pompaları'nı tıklatın. (Şekil 3).
- "HSW Norm-Ject 5 cc (Dia=12,45)" seçeneğini seçerek Çapı 12,45 'e (mm) atayın.
- Pompa 01 (etanol lipid çözeltisi) için 0,25 mL/dk ve Pompa 02 (sulu çözelti) için 0,75 mL/dk'ya ücret tevkitamam. Akış hızı toplam akış hızına (TFR) karşılık gelir (TFR) 1 mL/dak ve sulu-etanol akış hızı oranı (FRR) 3.
- 5 mL'nin üzerindeki değerlere Ses atayın.
NOT: Hedeflenen infüzyon hacmi, tüpün geçersiz hacmi göz önünde bulundurularak yüklenen sıvı hacminden daha büyük olarak ayarlanır. - Her iki pompa için de INF (infüzyon) modunu seçin.
- Ayarları onaylamak için Ayarla'ya basın.
2. LTSLs hazırlayın
- LTSL10 veya LTSL10-ICG lipid karışımı hazırlayın (bkz. Tablo 1).
- İki adet 5 mL Luer kilit şırıngası kullanarak 1 mL lipid karışımı ve en az 3 mL (NH4)2SO4 çözeltisini çekin.
- Şırınganın varil flanşını pompanın tutucuya kaydırarak dik pozisyondaki şırınga pompalarına iki şırınga yı ve şırınganın dalgıç flanşını pompanın itici bloğuna yerleştirin(Şekil 4).
- Isı bandının ucunu sulu solüsyonla şırıngaya sarın. Isıtma bandının diğer ucunu ve termostatın sıcaklık probununun etrafındaki yağ çözeltisi ile şırınganın etrafını sarın. Montaj işlemini kolaylaştırmak için boş şırıngalarla bu adımı uygulamak yararlıdır(Şekil 5A).
- İki şırıngayı SHM'nin ilgili girişlerinin dişi Luer adaptörlerine bağlayın. Lipid karışımı ve (NH4)2SO4 çözeltisi içeren şırıngaların sırasıyla etanol girişi ve sulu girişle bağlantılı olduğundan emin olun. Şırıngalardan hava kabarcıklarını çıkarmak için piston konumunu ayarlayın(Şekil 5B).
NOT: Şırıngaların hala pompaların şırınga tutucusu üzerine güvenli bir şekilde yerleştirilmesini sağlayın. - 10 s ısıtma seansı kullanarak ısıtma bandını kullanarak şırıngaları 51 °C'nin üzerine ısıtın. Termostatın şırıngaların sıcaklığını güncellemesine izin verin. İnfüzyon sırasında sıcaklığı korumak için aşağıdaki adımları tekrarlayın.
DİkKAT: Isının aşırı yayılmasını önlemek için 10 s'den sonra ısıtma bandını kapatın ve termostatın gerçek sıcaklığı güncellemesine izin verin. Isıtma bandı da sıcaklık çok hızlı bir şekilde yükselir gibi dikkatle ele alınmalıdır. Isınma sürekli ekipman ve şırıngalar zarar verebilir, ölçülen sıcaklığı güncellemek için termostat zaman gecikmesi nedeniyle. - Sıcaklık 51 °C'nin üzerine çıktığında, şırınga pompalarını Pompa Kontrol Yazılımında Tümünü Çalıştır'a basarak çalıştırın(Şekil 3).
- Sıvı akışının hava kabarcıkları ve herhangi bir sızıntı olmadığından emin olun. İlk hacmi (yaklaşık 0,5 mL) sıvıyı çıkıştan atık olarak atın.
NOT: Bu ilk atık hacmi kesin değildir ve kurulumun iç hacmine bağlıdır, bu da sıvının şırıngalardan boru ve SHM'den prizye geçmesi için gereken hacimdir. - Bir mikrocentrifuge tüp veya bijou şişe içine lipozom örnekleri olarak sıvı geri kalanını toplamak.
- Şırıngalardan herhangi birinde sıvı neredeyse boşolduğunda infüzyonu duraklat/durdurun.
NOT: Pompalar şırıngalar boşken pozisyonu tam olarak tespit edemeyebilir, çünkü pompalar elle durdurulmalıdır. - Toplanan lipozom solüsyonlarını 60 °C'lik bir su banyosuna 1,5 saat boyunca yerleştirin.
NOT: Bu adım lipozomlara ilaç yüklemesini sağlamak için gereklidir. - Çözümleri diyaliz tüplerine aktarın. Saflaştırılmış lipozomelde etmek için 37 °C'de 2SO4'te 2 SO4'e karşı en az 4 saat boyunca çözeltileri diyalize sokun.
NOT: Protokol burada duraklatılabilir. Bu adımda lipozomlar 5 mM fosfolipid bulunmaktadır. Saflaştırılmış lipozomlar 4 °C'de saklanabilir. - SHM'yi tekrarlanan kullanım için temizlemek için SHM'yi sırayla deiyonize su, etanol ve kuru nitrojen gazıyla yıkayın.
3. DOX'un ltsl'lere transmembran pH degradesi ile uzaktan yüklenmesi
- LtSL'lerin dış tamponunu, transmembran pH gradyanı oluşturmak için boyut dışlama kromatografisi (SEC) kullanarak HEPES tamponlu salin (HBS) ile değiştirin.
- Sütunu hazırlamak için SEC sütununun üstüne toplam 25 mL HBS ekleyin. Tüm eluent sütun aracılığıyla elute ve eluate bertaraf sağlar.
- 2.12.adımdan hazırlanan 1 mL diyalizli lipozomları sütuna ekleyin ve elute'yi atın.
- Sütuna 1,5 mL HBS ekleyin ve elute'yi atın.
- Sütuna 3 mL HBS ekleyin ve 3 mL elute toplayın.
NOT: Protokol burada duraklatılabilir. Lipozomlar bu adımda toplanır ve 1.67 mM fosfolipid vardır. Tampon değiştirilen lipozomlar 4 °C'de saklanabilir.
- Doksorubisin (DOX) ile LTSLs incubate LTSLs ve LTSLs arındırın.
- Dox çözeltisi 1:20 DOX-to-fosfolipid molar oranı içine 1 mL tampon-exchanged lipozom çözeltisi (1.67 mmol) bir bijou şişe içinde bulunan ekleyin. Bu da 48.4 μL 1 mg/mL DOX çözeltisi (83.4 μmol) eklenerek elde edilebilir.
- Dox'un lipozomlara yüklenmesi için bijou şişesini 37 °C'lik bir su banyosuna 1,5 saat yerleştirin.
- 170 μL HBS ve 20 μL 1%(v/v) Triton X-100 çözeltisi ile lipozomların 10 μL'sini siyah 96-kuyu plakasında karıştırın. Üç kuyu için tekrarlayın. Bu kuyular "arınmadan önce" DOX içeriğine karşılık gelir.
- LTSL10-ICG hazırlanması durumunda, lipozomların 40 μL'sini 160 μL DMSO ile 96 kuyulu bir plakada karıştırın. Üç kuyu için tekrarlayın. Bu kuyular "arınmadan önce" ICG içeriğine karşılık gelir.
- Adım 3.1'de açıklandığı gibi lipozom çözüm arındırın.
NOT: Sütunu gelecekteki arınma için yeniden kullanmak için, 3.1.1 adımını gerçekleştirmeden önce 1 mL seyreltilmiş 0,5 M NaOH çözeltisi ekleyerek sütunu ücretsiz DOX'tan temizleyin. Kırmızı serbest DOX hızlı bir şekilde sütun üzerinden mor-mavi dönecek ve elute. - Saflaştırılmış lipozom çözeltisinin 30 μL'sini 150 μL HBS ve 20 μL 1 (v/v) Triton X-100 çözeltisini siyah 96 kuyulu bir plakada karıştırın. Üç kuyu için tekrarlayın. Bu kuyular "arınma sonrası" DOX içeriğine karşılık gelir.
- LTSL10-ICG durumunda, saflaştırılmış lipozom çözeltisinin 40 μL'sini 160 μL DMSO ile 96 kuyulu bir plakaiçinde karıştırın. Üç kuyu için tekrarlayın. Bu kuyular "arınma sonrası" ICG içeriğine karşılık gelir.
- Bir mikroplaka okuyucu (λex = 485 nm, λem = 590 nm) kullanarak, kuyuların DOX floresan şiddetini mikroplaka okuyucusu kullanarak (adım 3.2.3) ve sonrasında (adım 3.2.5) ölçün.
- Arınmadan önce ve sonra floresan yoğunlukları oranını alarak DOX'un (DOX EE) kapsülleme verimliliğini hesaplayın.
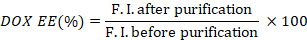
- Bir mikroplaka okuyucu (600 ila 1000 nm) kullanarak, arıtma öncesi ve sonrasında kuyuların ICG emiciliğini ölçün.
- Arıtma sırasında seyreltme faktörlerini (3 kez) dikkate alarak, saflaştırmadan önce ve sonra 792 nm'deki emicilik oranını alarak ICG'nin (ICG EE) kapsülleme verimliliğini hesaplayın.

4. Dinamik Işık Saçılımı (DLS)
- 50 μL lipozom çözeltisi (adım 2.12) ila 450 μL deiyonize su ekleyin.
- Cuvette'yi DLS aletinin içine yerleştirin ve ölçümü üreticinin talimatlarına göre gerçekleştirin.
- Her numune için üç ölçümün ortalama Z ortalama çapını ve dağılımını kaydedin.
5. Diferansiyel tarama lı kalorimetre (DSC)
- Lipozom örneklerinin 1 mL'sini (adım 2.12) santrifüj filtre ünitesi ile 0,5 mL 'ye (son lipid konsantrasyonu 10 mM) yoğunlaştırın. Sabit açılı bir rotor kullanarak, yaklaşık 15 dakika boyunca 7500 x g'de döndürün.
- 20 μL (NH4)2SO4 çözeltisi ve lipozom numunesini iki ilgili DSC tavaya aktarın. DSC numune pres kitini kullanarak tavaları DSC hermetik kapaklı kapatın.
- Numuneyi 30 °C ile 60 °C arasında 1 °C/dk'lık bir ısıtma hızıyla ölçün.
- Verileri uygun yazılımla analiz edin. Faz geçiş sıcaklığını (Tm)faz geçişinin başlangıcı olarak (erime tepe), maksimum eğim noktasının teğetinin x-kesesiyle ölçülür.
6. Doksorubisin salınımı
- HBS'yi su banyosu kullanarak belirlenen sıcaklıkta (37 veya 42 °C) önceden ısıtın. Örnekleri söndürmek için bir buzlu su banyosu hazırlayın.
- Mikrosantrifüj tüpünde 1,9 mL HBS içine 100 μL saflaştırılmış DOX yüklü lipozom (adım 3.2.5) ekleyin. Tüpü belirlenen sıcaklığın su banyosuna yerleştirin.
- Tüpten hemen 200 μL numune çekin ve sonraki ilaç salınımını bastırmak için hızlı bir şekilde buzlu su banyosuna yerleştirin. Bu örnek, başlangıç (t = 0) zaman noktasına karşılık gelir.
- Sonraki zaman noktalarında (t = 5, 10, 10, 15, 30, 60 dk) 200 μL numune çekin ve herhangi bir ilaç salınımını bastırmak için hızlı bir şekilde buz suyu banyosuna yerleştirin.
- Her zaman noktasının 50 μL'lik numunesini siyah 96 kuyulu bir plakada 150 μL HBS ile karıştırın. Bir plaka okuyucu kullanarak DOX floresan yoğunluğunu ölçün.
- Adım 6.5'te hazırlanan rastgele seçilmiş kuyulara %1 'lik (v/v) Triton X-100'ün 20 μL'sini ekleyin. Bir plaka okuyucu kullanarak bu kuyuların DOX floresan yoğunluğunu ölçün. Bu değerler tam olarak yayımlanan (t = %100 serbest bırakma) zaman noktasına karşılık gelir.
- Her zaman noktasının floresan yoğunluğunu (I(t)) enterpolasyona ederek serbest bırakılan DOX yüzdesini hesaplayın ve çizin, başlangıç (I(0)) ve tamamen serbest bırakılmış (I(』)), değere göre.
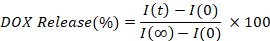
7. Lazer Isıtma ve Tetikleme Li
- Su banyosu sıcaklığını 37 °C'ye ayarlayın ve sıcaklığın dengelenmesine izin verin.
- 96 kuyulu bir tabağa 200 μL DOX yüklü LTSL10-ICG ([ICG] = 10 μg/mL) ekleyin, ardından su banyosuna yerleştirin, alt kısmı suya daldırın.
- Lazer sisteminin akımını 2.27 A olarak ayarlayın. Lazer sisteminin kolimatörünü 96 kuyulu plakanın yüzeyinden dikey olarak 5 cm yukarıda yerleştirin ve bu da 0,5 W/cm2 enerji akısı[Şekil 6]' ye karşılık gelir.
DİkKAT: Lazer sistemi ilgili lazer güvenlik önlemlerine uygun olarak çalıştırılmalıdır. - Lazeri açın ve fiber optik sıcaklık sondasını kullanarak her dakika sıcaklığı izleyin.
- 5 ve 10 dakika, 10 μL lazer ışınlanmış lipozomları 96 kuyulu açık plakadan çekin ve siyah 96 kuyulu bir plakadaki üç kuyu için 190 μL HBS ile karıştırın.
- 170 μL HBS ve 20 μL 1 %1 (v/v) Triton X-100 çözeltisi ile lipozomların 10 μL'sini siyah 96 kuyulu bir plakadaki üç kuyu için karıştırın. Bu kuyular "100% serbest" DOX içeriğine karşılık gelir. DOX floresan yoğunluğunu ölçün ve 6.7 adımda açıklandığı gibi DOX salınımını hesaplayın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
LTSL'lerin mikroakışkanlara göre hazırlanması DPPC/MSPC/DSPE-PEG2000 lipid bileşimini gerektirir (80/10/10, molar oranı; LTSL10). Şekil 7A (solda) 2.9 adımdan itibaren hazırlanmış LTSL10 görünümünü açık ve viskoz olmayan bir sıvı olarak gösterir. LTSL10 formülasyonu geleneksel formülasyondan geliştirilmiştir, LTSL4 (DPPC/MSPC/DSPE-PEG2000, 86/10/4, molar oranı) LTSL4 jel benzeri viskoz bir örn...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Sunulan protokol, düşük ısıya duyarlı lipozomların (LTSLs) şaşırtıcı bir bitkikemiği mikromikseri (SHM) kullanılarak hazırlanmasını açıklar. LTSL10 formülasyonu, 42 °C'lik klinik olarak ulaşılabilir hipertermik sıcaklıkta 5 dakika içinde doksorubisin sıcaklıkla tetiklenen patlama salınımını sağlar. Indocin yeşil (ICG) da fototermal ısıtma için co-DOX serbest bırakılması tetikledi yüklenebilir. Yöntem şuna dayanır: (i) FOsfolipidlerin SHM11'deetanol ve am...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Biz Prostat Kanseri İngiltere (CDF-12-002 Bursu) ve Mühendislik ve Fizik Bilimleri Araştırma Konseyi (EP/M008657/1) finansman için teşekkür ederiz.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Lipoid | PC 16:0/16:0 (DPPC) | |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (DSPE-PEG2000) | Lipoid | PE 18:0/18:0-PEG 2000 (MPEG 2000-DSPE) | |
| 1-stearoyl-2-hydroxy-sn-glycero-3-phosphocholine (MSPC) | Avanti Polar Lipid | 855775P-500MG | Distributed by Sigma-Adrich; also known as Lyso 16:0 PC (Not to be confused with 14:0/18:0 PC, which is also termed MSPC) |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375-100G | |
| Adapters, Female Luer Lock to 1/4"-28UNF | IDEX Health & Science | P-624 | Requires 2 units. For the inlets |
| Adapters, Union Assembly, 1/4"-28UNF | IDEX Health & Science | P-630 | Requires 2 units. (One unit included 2 nuts and 2 ferrules) |
| Ammonium Sulfate ((NH4)2SO4) | Sigma-Aldrich | 31119-1KG-M | |
| Bijou vial | VWR | 216-0980 | 7 mL, clear, polystyrene vial |
| Centrifugal Filter Unit | Sigma-Aldrich | UFC801008 | 10 kDa MWCO, Amicon Ultra-4 Centrifugal Filter Unit |
| Centrifuge | ThermoFisher Scientific | Heraeus Megafuge 8R | With HIGHConic III Fixed Angle Rotor |
| Cuvette | Fisher Scientific | 11602609 | Disposable polystyrene cuvette, low volume, for DLS measurement |
| Dialysis Kit - Pur-A-Lyzer Maxi | Sigma-Aldrich | PURX12015-1KT | 12-14 kDa MWCO |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 34943-1L-M | |
| DLS Instrument | Malvern Panalytical | Zetasizer Nano ZS90 | |
| Doxorubicin Hydrochloride (DOX) | Apollo Scientific | BID0120 | |
| DSC Instrument | TA Instruments | TA Q200 DSC | |
| DSC Tzero Hermetic Lids | TA Instruments | 901684.901 | For DSC measurement |
| DSC Tzero Pans | TA Instruments | 901683.901 | For DSC measurement |
| DSC Tzero Sample Press Kit | TA Instruments | 901600.901 | For DSC measurement |
| Ethanol | VWR | 20821.330 | Absolute, ≥99.8% |
| FC-808 Fibre Coupled Laser System | CNI Optoelectronics Tech | FC-808-8W-181315 | FOC-01-B Fiber Collimator included. |
| Ferrule, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-200 | For the outlet |
| Fibre Optic Temperature Probe | Osensa | PRB-G40 | |
| Glass Staggered Herringbone Micromixer (SHM) | Darwin Microfluidics | Herringbone Mixer - Glass Chip | |
| Heating Tape | Omega | DHT052020LD | Can be replaced by other syringe heater such as "HTC" or "SRT series" for slower heating. Manual wiring to a 3-pin plug required for 240V models |
| Indocyanine Green | Adooq | A10473-100 | Distributed by Bioquote Limited (U.K.) |
| Luer-lock Syringe, 5 mL | VWR | 613-2043 | Hanke Sass Wolf SOFT-JECT 3-piece syringes, O.D. 12.45 mm |
| Microplate Reader | BMG Labtech | FLUOstar Omega | Installed with 485 nm (exictation) and 590 nm (emission) filters |
| Microplate, 96-well, Black, Flat-bottom | ThermoFisher Scientific | 611F96BK | For fluorescence measurement in microplate reader |
| Microplate, 96-well, Clear, Flat-bottom | Grenier | 655101 | For absorbance measurement microplate reader |
| Nut, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-245 | For the outlet |
| PC to Pump Network Cable for Aladdin, 7ft | World Precision Instruments | NE-PC7 | Optional: Syringe pumps can be operated manually |
| Pump control software - SyringePumpPro Software License for 2 | World Precision Instruments | SYRINGE-PUMP-PRO-02 | Optional: Syringe pumps can be operated manually |
| Pump to Pump Network Cable for Aladdin, 7 ft | World Precision Instruments | NE-NET7 | Optional: Syringe pumps can be operated manually |
| Size exclusion chromatography (SEC) column | GE Life Science | 17085101 | Sephadex G-25 resin in PD-10 Desalting Columns |
| Sodium chloride (NaCl) | Sigma-Aldrich | 31434-1KG-M | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S5881-500G | |
| Syringe Pumps & Cable (DUAL-PUMP-NE-1000) | World Precision Instruments | ALADDIN2-220/AL1000-220 | |
| Thermostat Temperature Controller | Inkbird | ITC-308 | Can be replaced by other syringe heater kit/thermostat |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Tubing, ETFE (1/16" OD) | IDEX Health & Science | 1516 | |
| USB To RS-232 Converter | World Precision Instruments | CBL-USB-232 | Optional: For computer without RS-232 port |
| Water Bath | Grant Instruments Ltd. | JB Nova 12 |
Referanslar
- Needham, D., Park, J., Wright, A. M., Tong, J. Materials characterization of the low temperature sensitive liposome (LTSL): effects of the lipid composition (lysolipid and DSPE-PEG2000) on the thermal transition and release of doxorubicin. Faraday Discussions. 161, 515-534 (2013).
- Ickenstein, L. M., Arfvidsson, M. C., Needham, D., Mayer, L. D., Edwards, K. Disc formation in cholesterol-free liposomes during phase transition. Biochimica et Biophysica Acta - Biomembranes. 1614 (2), 135-138 (2003).
- Valencia, P. M., Farokhzad, O. C., Karnik, R., Langer, R. Microfluidic technologies for accelerating the clinical translation of nanoparticles. Nature Nanotechnology. 7 (10), 623-629 (2012).
- Chen, D., et al. Rapid discovery of potent siRNA-containing lipid nanoparticles enabled by controlled microfluidic formulation. Journal of the American Chemical Society. 134 (16), 6948-6951 (2012).
- Forbes, N., et al. Rapid and scale-independent microfluidic manufacture of liposomes entrapping protein incorporating in-line purification and at-line size monitoring. International Journal of Pharmaceutics. 556, 68-81 (2019).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: microfluidics in drug discovery. Nature Reviews Drug Discovery. 5 (3), 210-218 (2006).
- Capretto, L., Carugo, D., Mazzitelli, S., Nastruzzi, C., Zhang, X. Microfluidic and lab-on-a-chip preparation routes for organic nanoparticles and vesicular systems for nanomedicine applications. Advanced Drug Delivery Reviews. 65 (11-12), 1496-1532 (2013).
- Cheung, C. C. L., Al-Jamal, W. T. Sterically stabilized liposomes production using staggered herringbone micromixer: Effect of lipid composition and PEG-lipid content. International Journal of Pharmaceutics. 566, 687-696 (2019).
- Suh, Y. K., Kang, S. A. Review on Mixing in Microfluidics. Micromachines. 1 (3), 82-111 (2010).
- Jahn, A., Vreeland, W. N., Gaitan, M., Locascio, L. E. Controlled Vesicle Self-Assembly in Microfluidic Channels with Hydrodynamic Focusing. Journal of the American Chemical Society. 126 (9), 2674-2675 (2004).
- Stroock, A. D. Chaotic Mixer for Microchannels. Science. 295 (5555), 647-651 (2002).
- Belliveau, N. M., et al. Microfluidic Synthesis of Highly Potent Limit-size Lipid Nanoparticles for In Vivo Delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37(2012).
- Patra, M., et al. Under the influence of alcohol: The effect of ethanol and methanol on lipid bilayers. Biophysical Journal. 90 (4), 1121-1135 (2006).
- Komatsu, H., Rowe, E. S., Rowe, E. S. Effect of Cholesterol on the Ethanol-Induced Interdigitated Gel Phase in Phosphatidylcholine: Use of Fluorophore Pyrene-Labeled Phosphatidylcholine. Biochemistry. 30 (9), 2463-2470 (1991).
- Lu, J., Hao, Y., Chen, J. Effect of Cholesterol on the in Lysophosphatidylcholine Formation of an Interdigitated Gel Phase and Phosphatidylcholine Binary. Journal of Biochemistry. 129 (6), 891-898 (2001).
- Vanegas, J. M., Contreras, M. F., Faller, R., Longo, M. L. Role of unsaturated lipid and ergosterol in ethanol tolerance of model yeast biomembranes. Biophysical Journal. 102 (3), 507-516 (2012).
- Haran, G., Cohen, R., Bar, L. K., Barenholz, Y. Transmembrane ammonium sulfate gradients in liposomes produce efficient and stable entrapment of amphipathic weak bases. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1151 (2), 201-215 (1993).
- Sadeghi, N., et al. Influence of cholesterol inclusion on the doxorubicin release characteristics of lysolipid-based thermosensitive liposomes. International Journal of Pharmaceutics. 548 (2), 778-782 (2018).
- Lawaczeck, R., Kainosho, M., Chan, S. I. The formation and annealing of structural defects in lipid bilayer vesicles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 443 (3), 313-330 (1976).
- Komatsu, H., Okada, S. Ethanol-induced aggregation and fusion of small phosphatidylcholine liposome: participation of interdigitated membrane formation in their processes. BBA - Biomembranes. 1235 (2), 270-280 (1995).
- Marsh, D., Bartucci, R., Sportelli, L. Lipid membranes with grafted polymers: physicochemical aspects. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1615 (1-2), 33-59 (2003).
- Hood, R. R., Vreeland, W. N., DeVoe, D. L. Microfluidic remote loading for rapid single-step liposomal drug preparation. Lab on a Chip. 14 (17), 3359-3367 (2014).
- Dalwadi, G., Benson, H. A. E., Chen, Y. Comparison of diafiltration and tangential flow filtration for purification of nanoparticle suspensions. Pharmaceutical Research. , (2005).
- Roces, C., Kastner, E., Stone, P., Lowry, D., Perrie, Y. Rapid Quantification and Validation of Lipid Concentrations within Liposomes. Pharmaceutics. 8 (3), 29(2016).
- Kim, S. -H., Kim, J. W., Kim, D. -H., Han, S. -H., Weitz, D. A. Enhanced-throughput production of polymersomes using a parallelized capillary microfluidic device. Microfluidics and Nanofluidics. 14 (3-4), 509-514 (2013).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır