Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hücre altı kompartmana özgü Redoksduyarlı Yeşil Floresan Protein kullanılarak Hücresel Oksidasyonun Değerlendirilmesi
Bu Makalede
Özet
Bu protokol hücre içinde hücre altı bölmesi özgü redoks durumunun değerlendirilmesi açıklanır. Redoksduyarlı floresan prob bozulmamış hücrelerde uygun oranmetrik analiz sağlar.
Özet
Hücre içi oksidasyon/redüksiyon dengesinin ölçülmesi, bir organizmanın fizyolojik ve/veya patofizyolojik redoks durumuna genel bir bakış sağlar. Tiyoller, azaltılmış dithiol ve okside disülfür oranları ile hücrelerin redoks durumunu aydınlatmak için özellikle önemlidir. Tasarlanmış sistein içeren floresan proteinler redoksduyarlı biyosensörler için yeni bir dönem açar. Bunlardan biri olan redoksduyarlı yeşil floresan protein (roGFP), adenoviral transdüksiyonlu hücrelere kolayca girilebilir ve hücre altı bölmelerin redoks durumunun hücresel süreçleri bozmadan değerlendirilmesine olanak sağlar. RoGFP azaltılmış sistein ve oksitlenmiş sistinler sırasıyla 488 nm ve 405 nm, emisyon ile 525 nm uyarma maxima var. Bu indirgenmiş ve oksitlenmiş formların oranlarının değerlendirilmesi hücre içinde redoks dengesinin uygun hesaplanmasına olanak sağlar. Bu yöntemde canlı hücre içindeki redoks durumunu değerlendirmek için ölümsüzleştirilmiş insan üçlü negatif meme kanseri hücreleri (MDA-MB-231) kullanılmıştır. Protokol adımları sitosolik roGFP ifade etmek için adenovirüs ile MDA-MB-231 hücre hattı transdüksiyon, H2O2ile tedavi ve hem akış sitometri ve floresan mikroskopi ile sistein ve sistin oranının değerlendirilmesi içerir.
Giriş
Oksidatif stres 1985 yılında Helmut Sies tarafından "eski lehine prooksidant-antioksidan dengesi nde bir bozukluk" olarak tanımlanmıştır1, ve araştırma bir bolluk organizmaların hastalık elde etmek için yapılmıştır-, beslenme-, ve organizmaların yaşlanmaya özgü redoks durumu1,2,3. O zamandan beri, oksidatif stres anlayışı geniş hale gelmiştir. Hastalıklara ve/veya yaşlanmaya karşı antioksidan kullanma hipotezlerinin test edilmesi oksidatif stresin sadece zarar vermekle kalmamış, aynı zamanda hücrelerde başka rolleri de olduğunu göstermiştir. Ayrıca, bilim adamları serbest radikallerin sinyal iletimi için önemli bir rol oynadığını göstermiştir2. Tüm bu çalışmalar makromoleküllerin redüksiyon-oksidasyon (redoks) oranındaki değişikliklerin belirlenmesinin önemini güçlendirmiştir. Enzim aktivitesi, antioksidanlar ve/veya oksidanlar ve oksidasyon ürünleri çeşitli yöntemlerle değerlendirilebilir. Bunlar arasında, thiol oksidasyonunu belirleyen yöntemler tartışmasız en çok kullanılan lar dır çünkü hücrelerdeki antioksidanlar ve prooksidantlar arasındaki dengeyi veorganizmaları4 . Özellikle glutatyon (GSH)/glutatyon disülfür (GSSG) ve/veya sistein (CyS)/sistin (CySS) arasındaki oranlar organizmaların redoks durumunu izlemek için biyobelirteç olarak kullanılmaktadır2.
Prooksidantlar ve antioksidanlar arasındaki dengeyi dengelemek için kullanılan yöntemler esas olarak hücrelerdeki azaltılmış/oksitlenmiş proteinlerin veya küçük moleküllerin seviyelerine dayanır. Batı lekeleri ve kütle spektrometresi, azaltılmış/okside makromoleküllerin (protein, lipidler vb.) oranlarını genel olarak değerlendirmek için kullanılır ve GSH/GSSG oranları spektrofotometri ile değerlendirilebilir5. Bu yöntemlerin ortak bir özelliği, hücre lisisi ve/veya doku homojenizasyonu ile sistemin fiziksel tedirginliğidir. Bu analizler, farklı hücresel bölmelerin oksidasyon durumunu ölçmek gerektiğinde de zorlaşır. Tüm bu tedirginlikler, adak ortamında eserlere neden olur.
Redoks duyarlı floresan proteinler hücrelerde bir rahatsızlık neden olmadan redoks dengesini değerlendirmek için avantajlı bir dönem açtı6. Hücre içi bölmeleri hedefleyerek, hücre içi aktivitelerin ölçülmesine izin verebilirler (örneğin, mitokondri ve sitosolun redoks durumunu atayarak) hücresel organeller arasındaki çapraz konuşmayı araştırmak için. Sarı floresan protein (YFP), yeşil floresan protein (GFP) ve HyPeR proteinleri Meyer ve meslektaşları tarafından gözden geçirilir6. Bu proteinler arasında, redoks duyarlı GFP (roGFP) onun CyS farklı floresan okumalar nedeniyle benzersizdir (ör. 488 nm / em. 525 nm) ve CySS (ör. 405 nm/525 nm) kalıntılar, hangi oranmetrik analiz izin, Y7FPgibi diğer redoks duyarlı proteinlerin aksine,8. Oranmetrik çıktı, ifade düzeyleri, algılama hassasiyetleri ve fotobeyaztma8arasındaki farkları dengelediği için değerlidir. Hücrelerin hücre altı bölmeleri (sitosol, mitokondri, çekirdek) veya farklı organizmalar (bakteri yanı sıra memeli hücreleri) roGFPdeğiştirerekhedef olabilir 7,9,10.
roGFP tahlilleri, özellikle gerçek zamanlı görselleştirme deneyleri için floresan görüntüleme teknikleri kullanılarak gerçekleştirilmektedir. RoGFO'ların akış sitometrik analizleri, önceden belirlenmiş zaman noktalarına sahip deneyler için de mümkündür. Bu makalede, adenoviral transdüksiyon yoluyla roGFP (sitosol hedefli) aşırı ifade memeli hücrelerinde redoks durumunun ratiometrik bir değerlendirme yapmak için floresan mikroskopi ve akış sitometri sitometri kullanımı hem de açıklanmaktadır.
Access restricted. Please log in or start a trial to view this content.
Protokol
NOT: Bu protokol %70-80 eşzamanlı MDA-MB-231 hücreleri için optimize edildi. Diğer hücre hatları için, hücre sayısı ve enfeksiyon çokluğu (MOI) yeniden optimize edilmelidir.
1. Hücrelerin hazırlanması (gün 1)
- MDA-MB-231 hücre hattını 75 cm2 şişede, 10 mL'lik Dulbecco modifiye Kartal ortamı (DMEM) ile %10 fetal büyükbaş serum (FBS) ile %5 CO2 nemli bir atmosferde 37 °C'de muhafaza edin.
NOT: Tüm protokol boyunca tüm ek ve tedavi kuluçkaları için %10 FBS, 37 °C ve %5 CO2 nemlendirilmiş atmosfer ile desteklenen DMEM kullanılmaktadır. - Deney için MDA-MB-231 hücrelerini hazırlayın.
- Şişeiçindeki ortamı aspire edin, 2 mL 2 mL ile hücreleri 2 dk için %0,25 tripsin-EDTA çözeltisi ile ayırın ve 6 mL tam orta (DMEM% 10 FBS) ile tripsin aktivitesini inaktive edin. Hücreleri 150 x g'de 5 dk. Süpernatant'ı aspire edin ve 5 mL tam ortamda hücreleri askıya alın.
- Eşit hacimli hücre süspansiyonu ve %0,4 trypan mavisini karıştırın. Bu karışımın 10 μL alın ve otomatik hücre sayacı ile hücreleri saymak.
NOT: Hücre sayımı için bir Coulter sayacı veya hemositometre de kullanılabilir. - Akış sitometri analizleri için hücreleri 6 kuyuplakasına tohumlayın ve 1 mL'lik 150.000 hücreyi kuyu başına orta tohumlayın. Hücre eki için 16 saat bekleyin.
- Hücreleri floresan görüntüleme için 4 kuyuluk slaytIçine tohum ve tohum 25,000 hücreleri 0.5 mL orta başına kuyu başına. Hücre eki için 16 saat bekleyin.
NOT: Tohum kontrol kuyuları tedavi kuyularına ek olarak. Hücre numarasını belirlemek için kontrol kuyularından birini kullanın (isteğe bağlı: hücrelerin bağlanma süresi iki katına kadar kısaysa, hücre numarasının tohumlama yoğunluğuyla aynı olduğu varsayılabilir) ve diğeri de virüssüz kontrol (0 MOI) için.
2. Adenoviral roGFP transdüksiyonu (gün 2 ve 3)
DİkKAT: Adenovirüsler hastalıklara neden olabilir. Hücreleri transducing ederken, filtrelenmiş ipuçları kullanın ve dekontamine ipuçları, Pasteur pipetler, ve mikrosantrifüj tüpleri ile 10% çamaşır suyu.
NOT: Bu protokol sitosol spesifik roGFP ile gösterilmiştir, ancak diğer hücresel bölmeler (örneğin, mitokondri veya mitokondriyal intermembran uzay) aynı protokol ile hedeflenebilir.
- MDA-MB-231 hücre hattı için her MOI değeri için gerekli adenovirüs (mL) hacmini hesaplayarak EN yüksek transdüksiyon verimliliğini elde etmek için MOI için bir doz-yanıt eğrisi oluşturma(Tablo 1):
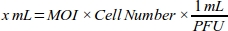
NOT: ML başına plak şekillendirme ünitesi (PFU) olarak ifade edilen adenoviral stoğun her bir partisinin fonksiyonel titreti şirket tarafından sağlanmaktadır. Transdüksiyon için optimum MOI hücre tipleri arasında farklılık gösterir. Çoğu memeli hücresi için optimum MOI aralığı 10 ile 300 arasındadır. Hücresel yanıta göre, MOI değerleri yeniden hesaplanmalıdır (örneğin, hücrelerde sitotoksik yanıt varsa MOI aralığı azaltılmalıdır veya hücreler düşük transdüksiyon verilicisi varsa aralık artırılmalıdır). - Güvenilir pipetleme için hücre kültürü ortamı (%10 FBS ile DMEM) ile 6 x 1010 PFU/mL adenoviral roGFP çözeltisinin 1:100 seyreltilmesini yapın.
- Pipet ve 0.0125 mL (12.5 μL), 0.025 mL (25 μL), 0.05 mL (50 μL) adenoviral roGFP seyreltme eklemek amacıyla 50, 100 ve 200 MOI sırasıyla 50, 100 ve 200 MOI ile 100 MOI ile 150.000 hücreleri transduce için 6 kuyu nun her kuyusu ( sitome analizi için).
- Pipet ve 4 odalı slayt kuyularında 0.0042 mL (4.2 μL) adenoviral roGFP seyreltme ekleyin floresan görüntüleme için 100 MOI ile 25.000 hücre transduce(Tablo 1).
NOT: Adenoviral roGFP yapısı ve hücreleri arasında en yüksek etkileşimi sağlamak için kuyularda en az miktarda ortam kullanılmalıdır. Yüksek serum düzeyleri bazı hücre tiplerinde transdüksiyon verimliliğini olumsuz etkileyebileceğinden, kültür ortamının serum içeriğinin farklı hücre hatları için azalması gerekebilir. - Hücre bakım koşulları altında 16-24 saat boyunca hücreleri kuluçkaya yatırın. Ertesi gün (gün 3), hücre kültür ortamına (DMEM % 10 FBS ile) değiştirilerek hücre kurtarmasına izin verin 24 saat. hücreler morfolojik değişiklikler olsa bile roGFP ifade edebilir.
NOT: 3. günde hücreler roGFP'yi ifade etmeye başlamalıdır; bu nedenle transdüksiyon verimliliği floresan mikroskobu (ex. 488/em. 525 filtreleri) kullanılarak izlenebilir. Tutarlı tahkikat sonuçları elde etmek için faz kontrast mikroskobu altındaki morfolojik değişikliklerin farkında olun ve belgeleyin ve transdüksiyon verimliliğini değerlendirirken morfolojiyi gözlemleyin. - Adım 2.3'te hazırlanan 50, 100 ve 200 MOI numunesini ve bunların akış sitometri analizinden elde edilen transdüksiyon verimliliği sonuçlarını (adım 3.1 ve 4.1) kullanarak bir doz yanıt eğrisi oluşturun. Morfolojik değişikliklerin (adım 2.5) ve MOI'nin doz-yanıt eğrisinin belgelenmesi yle optimal transdüksiyon verimliliğini değerlendirin.
NOT: Hücre popülasyonunun %98'inden fazlası 100 MOI ve 200 MOI ekspres roGFP'de (temsili sonuçlara bakınız) rağmen, 200 MOI grubu MDA-MB-231 hücrelerinin hücre morfolojisinde önemli değişiklikler göstermiştir. Sonuç olarak, MDA-MB-231 hücreleri için en etkili MOI 100 MOI olarak belirlendi. - Optimal MOI (burada, 100 MOI) MDA-MB-231 hücre hattı için seçildikten sonra, test malzemeleri (10 μM H2O2 ve aracı %0,1 deiyonize su) ile deneme yapın.
- Hücreleri bölüm 1'e göre hazırlayın ve tohumlayın. Adım 2.1'de hesaplanan 100 MOI için adenoviral transdüksiyon hacmini kullanarak, 100 MOI adenoviral hücrelerin eteksüldüksiyonu için 2.2−2.4 adımlarını tekrarlayın. Daha sonra 2.5.
3. CyS/CySS bakiyesinin elde edilmesi
- Akış sitometrisi (gün 4)
- 4. günde, 2.7.1 adımdan 10 μM H2O2 ile 1 saat boyunca hücreleri kuluçkaya yatırın.
NOT: Bu protokolde test maddesi olarak 10 μM H2O2, araç arıtma olarak %0.1 deiyonize su kullanılmıştır. Diğer oksitleyici ajanlar burada pozitif kontroller olarak kullanılabilir. - 6 kuyu plakasından aspire ortamı, %0,25 tripsin-EDTA çözeltisi ile 750 μL değiştirin ve hücrelerin ayrılması için 2 dakika bekleyin. 2 mL tam orta (DMEM % 10 FBS) ile tripsinin inaktive ve 15 mL konik tüpler halinde hacim toplamak.
- Tüpleri 150 x g'de 4ºC'de 5 dk santrifüj edin. Süpernatant atın ve fosfat tamponlu salin (PBS) 500 μL hücreleri askıya.
- Adımı 3.1.3'ün tekrarla
- 40 μm mesh kullanarak hücre süspansiyonlarını akış sitometrisi uyumlu tüplere süzün. Tüpleri buzda ve ışıktan uzak tutun ve veri analizi için adım 4.1'i izleyin.
- 4. günde, 2.7.1 adımdan 10 μM H2O2 ile 1 saat boyunca hücreleri kuluçkaya yatırın.
- Mikroskobik görüntüleme (4. gün)
- 4. günde, 10 μM H2O2ile hücreleri tedavi edin, hemen (zaman noktası 0) ve 1 saat tedaviden sonra görüntüleri elde edin ve veri analizi için adım 4.2 izleyin.
4. Veri analizi
- Akış sitometri nicelleştirme
- Hücre boyutunu ve hücrelerin karmaşıklığını değerlendirmek için x ekseninde ve yan dağılımda (SSC) ileri dağılım (FCS) (FCS) (CSC) ve örnek edinme yazılımı ile 3 farklı analiz için akış sitometriyöntemini ayarlayın (SSC ölü ve canlı hücrelerin kabaca tanımlanması için kullanılabilir); Table of Materials ör. 488 nm/em. 525 nm (floresan izotiyoyanat [FITC]) x ekseninde bandpass filtresi ve CyS-roGFP değerlendirmek için y ekseninde SSC; ör. 405 nm/em. 525 nm (Brilliant Violet 510 [BV510]) x ekseninde bandpass filtresi ve CySS-roGFP değerlendirmek için y ekseninde SSC.
- Örnek alma yazılımı yla 0 MOI denetimi edinin ve hücreleri görselleştirin. Kalan numuneler için bu adımı tekrarlayın (50, 100, 200 MOI grubu ve daha sonra 10 μM H2O2 tedavi edilen hücreler ve araç tedavi hücreleri). Dosyaları veri analizine kaydedin.
- Veri analizi yazılımını açın (bkz. Malzemeler Tablosu)ve 0 MOI örnek dosyayı açın. İlgi alan hücre popülasyonunun değerlendirilmesi (Kapı 1). Ex. 488 nm/em için arka plan floresansını en aza indirmek için aşağıdaki gating'leri ayarlayın. 525 nm (Kapı 2) ve ex. 405 nm/em. 525 nm (Gate 3) bantgeçiş filtreleri ile enfekte olmayan (0 MOI) kontrol hücreleri.
- Doz-yanıt eğrisini değerlendirmek için veri analizi yazılımı içinde 50, 100 ve 200 MOI örnek dosyaaçın. Her örnek için Gates 2 ve 3 ile ortalama floresan yoğunluklarını analiz edin. Test örnekleri (10 μM H2O2 tedavi hücreleri ve araç tedavi hücreleri) için bu adımı tekrarlayın.
- Aşağıdaki denklemile roGFP'nin oksitlenmiş ve azaltılmış formları arasındaki ortalama floresan yoğunluk oranını hesaplayın.

- Görüntü değerlendirmesi
- CyS-roGFP ve CySS-roGFP için floresan filtreler içeren bir mikroskop kullanın (örn. 488 nm/em. 525 nm ve ör. 405 nm/em. 525 nm filtreleri.
- Oda slayt her kuyuda, daha büyük alanları görselleştirmek için 4x hedefi kullanarak, görüntüleri elde etmek için 4 rasgele alanları seçin.
NOT: Görüntü görüntüler için 20x objektif de kullanılabilir. - ImageJ yazılımı11ile görüntüyü açın. Analiz Uygula | Her görüntü için komutları ölçün ve verileri ölçmek için adım 4.1.5'teki denklemi kullanın.
NOT: Görüntülerin nicelikseloranı oranmetriktir; bu nedenle, protokol arka plan çıkarma içermez. Ancak, görüntüleri karşılaştırabilmek için her görüntü için parlaklık, kontrast ve doygunluk aynı olmalıdır. İstatistiksel anlamlılık varyans (ANOVA) ve Tukey sonrası hoc testinin tek yönlü analizi ile değerlendirildi.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
CyS/CySS'nin redoks durumu transdükse roGFPs ile kolayca tetkik edilir. Floresan prob, azaltılmış ve oksitlenmiş formlar arasındaki oranı ölçer (uyarma dalga boyları sırasıyla 488 nm ve 405 nm). Floresan verileri hem akış sitometrisi hem de mikroskopi ile elde edilebilir.
Çok sayıda hücre sürekli ve uygun akış sitometri sitometri kullanılarak elde edilebilir. Analiz 3 ana adımdan oluşur: 1) FSC alan filtresi ile ilgi hücre popülasyonu seçin (Şeki...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bir organizmadaki tiyol/disülfür dengesi hücrelerin redoks durumunu yansıtır. Yaşayan organizmalar glutatyon var, sistein, protein tiyolleri, ve düşük molekül ağırlıklı tiyoller, hepsi oksidasyon düzeyi etkilenir ve hücrelerin redoks durumunu yankı4. Mühendislik roGFPs kendi CySartıkları7 ile tiol / disülfür dengesinin non-yıkıcı nicel izin verir. roGFP'nin oranmetrik özelliği memeli hücreleri için güvenilir redoks ölçümleri sağlar. roGFP t...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Hücrelerde sitosol spesifik roGFP ifade etmek için yapı ve rekombinant adenovirüs Paul T. Schumacker, Doktora, Freiberg Tıp Fakültesi, Northwestern Üniversitesi ve ViraQuest Inc, sırasıyla laboratuvarda oluşturuldu. Bu çalışma, NIH Ulusal Biyomedikal Araştırma Mükemmeliyet Merkezleri Enstitüsü (COBRE NIGMS), Ulusal Genel Tıp Bilimleri Sistemleri Farmakoloji ve Toksikoloji Eğitim Programı Hibe T32 GM106999, UAMS Vakfı / Tıbbi Araştırma Bağış Ödülü AWD00053956, UAMS Yıl Sonu Şansölye Ödülleri AWD00053484. Akış sitometri çekirdek tesisi kısmen Mikrobiyal Patogenez Merkezi tarafından desteklendi ve Cobre NIGMS aracılığıyla P20GM103625'e Ev Sahipliği Yaptı Inflamatuar Yanıtlar hibe sitometrisi. İçerik sadece yazarların sorumluluğundadır ve NIH'nin resmi görüşlerini temsil etmek zorunda değildir. ATA, Türkiye Bilimsel ve Teknolojik Araştırma Kurulu (TÜBİTAK) 2214-A bursu ile desteklendi.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco by Life Sciences | 25200-056 | Cell culture |
| 4-well chamber slide | Thermo Scientific | 154526 | Cell seeding material for fluorescent imaging |
| 5 ml tubes with cell strainer cap | Falcon | 352235 | Single cell suspension tube for flow cytometry analysis |
| 6-well plate | Corning | 353046 | Cell seeding material for flow cytometry analysis |
| 15 ml conical tubes | MidSci | C15B | Cell culture |
| 75 cm2 ventilated cap tissue culture flasks | Corning | 4306414 | Cell culture |
| Adenoviral cytosol specific roGFP | ViraQuest | VQAd roGFP | roGFP construct kindly provided by Dr. Schumaker |
| Class II, Type A2 Safety Hood Cabinet | Thermo Scientific | 1300 Series A2 | Cell culture |
| Countess automated cell counter | Invitrogen | C10227 | Cell counting |
| Countess cell counter chamber slides | Invitrogen | C10283 | Cell counting |
| DMEM | Gibco by Life Sciences | 11995-065 | Cell culture |
| FBS | Atlanta Biologicals | S11150 | Cell culture |
| Filtered pipette tips, sterile, 20 µl | Fisherbrand | 02-717-161 | Cell culture |
| Filtered pipette tips, sterile, 1000 µl | Fisherbrand | 02-717-166 | Cell culture |
| Flow Cytometer | BD Biosciences | LSRFortessa | Instrument equipped with FITC and BV510 bandpass filters for flow cytometry analyses |
| Fluorescent Microscope | Advanced Microscopy Group (AMG) | Evos FL | Fluorescent imaging |
| Hydrogen Peroxide 30% | Fisher Scientific | H325-100 | Positive control |
| Light Cube, Custom | Life Sciences | CUB0037 | Fluorescent imaging of roGFP expressing cells (ex 405 nm) |
| Light Cube, GFP | Thermo Scientific | AMEP4651 | Fluorescent imaging of roGFP expressing cells (ex 488 nm) |
| MDA-MB-231 | American Tissue Culture Collection | HTB-26 | Human epithelial breast cancer cell line |
| Microcentrifuge tubes, 2 ml | Grenier Bio-One | 623201 | Cell culture |
| PBS | Gibco by Life Sciences | 10010-023 | Cell culture |
| Pipet controller | Drummond | Hood Mate Model 360 | Cell culture |
| Serologycal pipet, 1 ml | Fisherbrand | 13-678-11B | Cell culture |
| Serologycal pipet, 5 ml | Fisherbrand | 13-678-11D | Cell culture |
| Serologycal pipet, 10 ml | Fisherbrand | 13-678-11E | Cell culture |
| Tissue Culture Incubator | Thermo Scientific | HERACell 150i | CO2 incubator for cell culture |
| Trypan blue stain 0.4% | Invitrogen | T10282 | Cell counting |
Referanslar
- Sies, H. Oxidative stress: A concept in redox biology and medicine. Redox Biology. 4, 180-183 (2015).
- Jones, D. P. Redefining Oxidative Stress. Antioxidants & Redox Signalling. 8 (9-10), (2006).
- Pizzino, G., et al. Oxidative Stress: Harms and Benefits for Human Health. Oxidative Medicine and Cellular Longevity. 20117, 8416763(2017).
- Go, Y. M., Jones, D. P. Thiol/disulfide redox states in signaling and sensing. Critical Reviews in Biochemistry and Molecular Biology. 48 (2), 173-191 (2013).
- Hansen, J. M., Go, Y., Jones, D. P. Nuclear and Mitochondrial Compartmentation of Oxidative Stress and Redox Signaling. Annual Review of Pharmacology and Toxicology. 46 (1), 215-234 (2006).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants and Redox Signaling. 13 (5), 621-650 (2010).
- Dooley, C. T., et al. Imaging dynamic redox changes in mammalian cells with green fluorescent protein indicators. Journal of Biological Chemistry. 279 (21), 22284-22293 (2004).
- Björnberg, O., Østergaard, H., Winther, J. R. Measuring intracellular redox conditions using GFP-based sensors. Antioxidants and Redox Signaling. 8 (3-4), 354-361 (2006).
- Bhaskar, A., et al. Reengineering Redox Sensitive GFP to Measure Mycothiol Redox Potential of Mycobacterium tuberculosis during Infection. PLoS Pathogens. 10 (1), 1003902(2014).
- Loor, G., et al. Mitochondrial oxidant stress triggers cell death in simulated ischemia-reperfusion. Biochimica et Biophysica Acta - Molecular Cell Research. 1813 (7), 1382-1394 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Loor, G., et al. Menadione triggers cell death through ROS-dependent mechanisms involving PARP activation without requiring apoptosis. Free Radical Biology and Medicine. 49 (12), 1925-1936 (2010).
- Esposito, S., et al. Redox-sensitive GFP to monitor oxidative stress in neurodegenerative diseases. Reviews in the Neurosciences. 28 (2), 133-144 (2017).
- Meyer, A. J., et al. Redox-sensitive GFP in Arabidopsis thaliana is a quantitative biosensor for the redox potential of the cellular glutathione redox buffer. Plant Journal. 52 (5), 973-986 (2007).
- Galvan, D. L., et al. Real-time in vivo mitochondrial redox assessment confirms enhanced mitochondrial reactive oxygen species in diabetic nephropathy. Kidney International. 92 (5), 1282-1287 (2017).
- Swain, L., Nanadikar, M. S., Borowik, S., Zieseniss, A., Katschinski, D. M. Transgenic organisms meet redox bioimaging: One step closer to physiology. Antioxidants and Redox Signaling. 29 (6), 603-612 (2018).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51 (11), 1943-1951 (2011).
- Dey, S., Sidor, A., O'Rourke, B. Compartment-specific control of reactive oxygen species scavenging by antioxidant pathway enzymes. Journal of Biological Chemistry. 291 (21), 11185-11197 (2016).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır