Method Article
LQ α ve β Parametrelerinin Değerlendirilmesi, Radyasyon Dozlama Şeması ve in vivo Doz Biriktirme için Işınlayıcı Devreye Alma ve Dozimetri
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Radyasyon dozimetrisi, klinik öncesi deneylerin doğruluğunu artırmak ve verilen radyasyon dozlarının klinik parametrelerle yakından ilişkili olmasını sağlamak için bir teknik sağlar. Bu protokol, uygun deneysel tasarımı sağlamak için preklinik radyasyon deneyleri sırasında her aşamada atılacak adımları açıklar.
Özet
Radyasyon dozimetrisi, yüksek çevirisel alaka düzeyi için preklinik modellerde radyasyon şemalarının doğru bir şekilde teslimi ve tekrarlanabilirliği açısından kritik öneme sahiptir. Herhangi bir in vitro veya in vivo deney yapmadan önce, ışınlayıcı ve bireysel deneysel tasarımlar için spesifik doz çıkışı değerlendirilmelidir. Bir iyonlaşma odası, elektrometre ve katı su kurulumu kullanılarak, izomermerdeki geniş alanların doz çıkışı belirlenebilir. İyonlaşma odasının yerine radyokromik filmlerle benzer bir kurulum kullanılarak, farklı derinliklerde daha küçük alanlar için doz oranları da belirlenebilir. Radyasyon tedavisine yanıt olarak kanser hücrelerinin in vitro klonojenik sağkalım tahlilleri, bu verileri geleneksel doğrusal-ikinci dereceden modele uyarlayarak hücre hatlarının doğal radyo duyarlılığının bir ölçüsünü sağlayan ucuz deneylerdir. Bu tahlillerden tahmin edilen model parametreleri, biyolojik etkili dozların ilkeleriyle birlikte, tümör taşıyan hayvan deneylerinde eşdeğer etkili dozlar sağlayan radyasyon tedavisi için değişen fraksiyonasyon programları geliştirilmesine izin verir. Bu, teslim edilen etkili dozlardaki varyans nedeniyle sonuçların potansiyel kafa karıştırıcılığını ortadan kaldırmak için in vivo radyasyon tedavisi programlarının karşılaştırılmasında dikkate alınması ve düzeltilmesi gereken önemli bir faktördür. Birlikte ele alındığında, bu makale, doz çıkış doğrulaması preklinik hayvan ve kabin ışınlayıcıları, radyo duyarlılığının in vitro değerlendirmesi ve küçük canlı organizmalarda radyasyon iletiminin doğrulanması için genel bir yöntem sunmaktadır.
Giriş
Kanserler toplu olarak ABD'de ve dünyanın birçok ülkesinde ikinci önde gelen ölüm nedenini temsil eder1. Radyasyon tedavisi birçok tümör alt tipi için tedavinin temel taşıdır ve tüm kanser hastalarının yaklaşık yarısına uygulanır2,3. Radyasyon dozlarını vermek için kullanılan ekipmanlar sürekli ilerlediği ve bazı etkili multimodal tedavi yaklaşımları4,5,6geliştirildiği için neredeyse tüm kanserler için hasta sonuçları zaman içinde iyileşmiştir, ancak belirli tümör türlerine sahip hastalar için nüks ve mortalite oranları yüksek kalır 7,8,9. Böylece kanser için radyoterapi, temel ve klinik araştırmaların aktif bir alanı olmaya devam ediyor. Klinik öncesi birçok radyoterapi çalışması, kanserlerin in vitro veya hayvan modellerine radyasyon dozları sunmak için küçük ölçekli ışınlayıcıların kullanımını kullanır. Mekanistik radyobiyoloji ayrıntılarını veya yeni tedavileri keşfetmek için çok sayıda potansiyel deneyle, yanlış sonuçlara, zayıf tekrarlanabilirliğe ve boşa giden kaynaklara yol açan ortak tuzaklarla karşılaşılabilir. Bu tuzaklar üç önemli alana girer: ışınlayıcı dozimetrisi, model hücre çizgilerinin in vitro karakterizasyonu ve in vivo ışınlama dosing programı ve kurulumu. Radyoterapi araştırmalarının bu temel yönlerine önceden dikkat edilmeden daha gelişmiş deneylerden doğru ve tekrarlanabilir sonuçlar elde etmek zordur.
Burada ayrıntılı olarak açıklanan protokol, bu sorunlardan kaçınmak veya hafifletmek için genelleştirilmiş bir stratejiyi açıklar ve bağımsız kullanıma yönelik daha önce geliştirilmiş birkaç metodolojiden yararlanılır. Bu farklı yöntemler, preklinik radyoterapi deneylerinin başlaması veya iyileştirilmesiyle ilgilenen bir araştırmacının bunu sağlam bir deneysel düzen olarak kullanabilmesi için birleştirildi. Önerilen çerçeve, küçük ölçekli hayvan ışınlayıcılarının devreye alınması, model kanser hücre hatlarının temel radyobiyolojik özelliklerinin belirlenmesi ve in vivo tümör modelleri için bir dozlama ve fraksiyonasyon programının uygun şekilde tasarlanması ve uygulanması için metodolojiyi içerir.
Protokol
Bu protokolün laboratuvar hayvanlarının kullanımını içeren herhangi bir adımı, elleçleme ve prosedürler de dahil olmak üzere, Morgantown, Batı Virginia'daki West Virginia Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi tarafından onaylanmıştır (Protokol numarası: 1604001894).
1. Doz çıkışının belirlenmesi
- Amerikan Tıpta Fizikçiler Birliği Görev Grubu'nun (AAPM TG) 6110 ve Xstrahl tarafından belirlenen devreye alma protokolüne benzer şekilde "In-phantom Method" protokolüne dayanan bu protokolü, aşağıdaki kurulum koşulları altında belirli geometriye göre küçük hayvan ışınlayıcısının ışın çıkışını belirlemek için kullanın.
- Işınlayıcıyı, izomerkezde konumlandırılmış açık bir alan (17 cm'ye 17 cm) veya kaynaktan 35 cm olacak şekilde 220 kVp ve 13 mA'da radyasyon sunacak şekilde ayarlayın. Ayrıca, kirişi geniş odaklı 0,15 mm Cu filtre ile filtreleyin. Bazı hücresel ışınlayıcılar yalnızca radyoaktif bir kaynak içerir, bu protokol yalnızca x-ışını ışınlayıcıları için kullanılabilir.
- Katı su fantomlarını aşağıdaki sırayla hizalayın: 1 cm plaka, iyonlaşma odası yuvası ile 2 cm plaka, 2 cm plaka, 1 cm plaka. Katı su fantomlarını bu sırayla istiflemek, iyonlaşma odasını 2 cm derinliğe yerleştirir ve 4 cm'nin yanı sıra arkalık için de izin verir. Dozimetri kurulumunun grafiksel tasviri için Şekil 1'e bakın.
NOT: Büyük, oldukça ağır katı su yığınını barındırmak için yazarlar, hayalet yığının sadece merkezde değil, malzemenin yüzeyindeki kaynaktan doğru mesafede ve düz olmasını sağlamak için değişken destekli özel bir 3D baskılı kanepenin alınmasını önerir.
- Ölçüm ekipmanını kullanın (örneğin, ADCL kalibreli iyonlaşma odası, elektrometre) ve kullanılan düzeltme faktörlerinin bir açıklaması sırasıyla Malzeme Masası ve Tablo 1'de bulunabilir.
NOT: ADCL'nin farklı Yarım Değer Katmanları (HVL, kiriş kalitesinin ölçüsü) için birkaç noktada Nk değerleri sağladığını. Protokolde kullanılacak Nk değeri, birimin ölçülen HVL'si için ADCL değerlerinin enterpolasyonuna dayanmalıdır. Üretici birimimizin HVL'sini ölçtü ve bunu doz oranı çıkış belirlememizde kullandık. - Hayalet yığını ayarlayın ve iyonlaşma odasını adım 1.1.2'de belirtildiği gibi hayalete yerleştirin.
- Hayalet yığını, kaynağın yüzey uzaklığı (SSD) veya radyasyon kaynağından ilk yüzeye olan uzaklığı uygun şekilde seviyelendirildiğinde 33 cm olacak şekilde ayarlayın.
NOT: Yazarlar, katı su plakalarının boyutlarını destekleyecek kadar büyük, özel, 3D baskılı bir kanepe oluşturmayı önerir. Ayrıca, bu protokolde kullanılan, hayalet yığını seviyelendirmek için ayarlanabilir bir bileşene sahiptir.
- Hayalet yığını, kaynağın yüzey uzaklığı (SSD) veya radyasyon kaynağından ilk yüzeye olan uzaklığı uygun şekilde seviyelendirildiğinde 33 cm olacak şekilde ayarlayın.
- Elektrometre sapma voltajı 300 V olarak ayarlanmış üç ayrı x-ışını pozlamasının ortalamasını alın. Sonuç M+olarak adlanacaktır.
NOT: Işınlamalar, 220 kVp ve 13 mA'da radyasyon sağlamak için ayarlanan cihazla gerçekleştirilir. Bu, sonraki iki adım için de aynıdır (adım 1.5-1.6). Kullanıcı güvenliği için, tedaviler sırasında kapıların kapalı kalmasını sağlayın. - -150 V'a ayarlanmış elektrometre sapma voltajı ile 1 dakika okuma olmak üzere üç ayrı x-ışını pozlaması daha gerçekleştirin. Sonuç MLolarak adlanacaktır.
- -300 V'a ayarlanmış elektrometre sapma voltajı ile 1 dakikalık okumalar olmak üzere üç ayrı x-ışını pozlaması daha gerçekleştirin. Sonuç MHveya ayrıca M-olarak adılacaktır.
- Aşağıda açıklandığı gibi sırasıyla Denklem 1 ve Denklem 2'yi kullanarak Ppol ve Piyonunu hesaplayın:
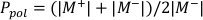 (Denklem 1)
(Denklem 1)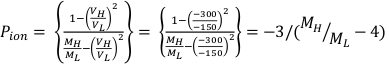 (Denklem 2)
(Denklem 2) - Kalibre edilmiş bir dijital termometre ve barometre kullanarak ışınlayıcının içindeki sıcaklığı Santigrat ve basıncı kPa olarak ölçün. Ardından, PTP'yi Denklem 3'te aşağıda belirtildiği gibi hesaplayın.
NOT: Bu hesaplama, ADCL'nin hava kerma kalibrasyon faktörü için değerlerini belirtirken 22 °C ve 101,33 kPa standart sıcaklık ve basınç değerlerini kullandığını varsayar.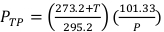 (Denklem 3)
(Denklem 3) - Düzeltilmiş oda odası okumasını hesaplayın, M, ham oda odası okumasını çarparak, MH, Pelec, Ppol, Piyonve PTPile çarpın. Bu denklem aşağıda Denklem 4'te bulunabilir.
NOT: Bu hesaplama, ADCL'nin kalibrasyonlarını oldukça yaygın bir uygulama olan -300V'a ayarlanmış sapma voltajı ile gerçekleştirdiğini varsayar.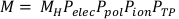 (Denklem 4).
(Denklem 4). - Düzeltilmiş oda okumasını Nk, [(μen/p)wair]su,PQ, chamve P kılıfı ile daha daçarpın. Pkılım sadece suda elde edilen ölçümler için gereklidir. Bu nedenle, bu protokol için Pkılım sadece 1'dir.
NOT: Bu iletişim kuralındaki koşulları kullanarak, ikinci üç öğe 1.0731 değerini verir. Bu değer ışın kalitesine bağlıdır, bu nedenle HVL'nin bunu belirlemek için bilinmesi gerekir. 1.0731 değeri birimimize özgüdür ve örnek olarak verilmiştir. Biriminize özgü PQ,cham ve [(μen/p)wair]su değerlerini belirlemek için, ölçülen HVL'yi kullanın ve Tablo VIII ve Tablo VIII'denenterpolasyon ve AAPM TG61 protokolü10'dan Şekil 3 ve Şekil 4'e göre referans alan boyutu için düzeltin. Bizim durumumuzda, Nk ile 1.0731 çarpmak suya doz sağlar, Dw, Gy'de 1 dakikalık nominal bir süre için, ADCL Nk değerinin Gy / Coulumbs'ta verildiğini varsayarsak. - Kullanılan ışınlayıcının son etkisini belirleyin. X ışınları ilk oluşturulduğunda, çıkış sonlu bir süre içinde tam değerine yükselir. Benzer şekilde, x-ışını kaynağı kapatıldığında, çıkış sonlu bir süre içinde sıfıra düşer.
- Bu geçişin zamanını veya son efektini hesaba katın. Bu, çeşitli zaman ayarları için -300 V olarak ayarlanan elektrometre sapma voltajı ile üç okumanın ortalaması alınarak yapılabilir. Bunu 6, 12, 18, 24, 30 ve 60 saniye boyunca yapın.
- Elektrometre okumalarını zamana karşı çizin ve en iyi düz çizgiyi bulun. 1 dakikalık bir tedavi için toplam süre denklem 5 ile hesaplanabilir:
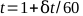 (Denklem 5).
(Denklem 5).
- Belirli bir ışınlayıcının doz oranını denklem 6ile hesaplayın:
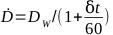 (Denklem 6)
(Denklem 6)
2. Radyokromik film kalibrasyon eğrisi oluşturma
- Gerekli malzemelerin listesi için bkz.
- Önceki protokolle neredeyse aynı bir kurulum kullanarak, filmi katı su hayalet yığınına 2 cm derinliğe yerleştirin. Katı su hayaletlerinin sırası, yukarıda 2 cm katı su ve aşağıda 4 cm katı su olduğu sürece, birikme ve geri dönüş etkileri için önemsizdir.
- Protokol 1'de devreye alan belirlenen dozu kullanarak, Tablo 2'de listelenen dozların tedavi sürelerini denklem 7kullanarak belirleyin:
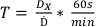 (Denklem 7)
(Denklem 7) - Her filmin aynı boyutta olmasını ve tedaviden tarama alımına kadar aynı yönde kalmasını sağlamak için birkaç film parçası hazırlayın. Bu, sol alt köşeye küçük bir çapraz kesim yerleştirilerek yapılabilir. Bu noktadan sonraki her film aynı film toplu filmden olmalıdır.
NOT: Değerlendirilecek her doz noktası için 3 ayrı çoğaltma hazırlayın. - Tüm düzeltmeler kapalıyken 48 bit renkli bir fotoğraf tarayıcısı kullanarak kesilmiş parçaları tarayın. Her filmin tarama yatağının tam ortasına yerleştirildiklerinden emin olun. Elde edilen değerler, pozlanmamış optik yoğunluğu belirlemek için kullanılan ön pozlama taramalarıdır11,12. 'ye tüm görüntüleri kaydedin. Anahtar verilerin sıkıştırılmasını önlemek için Tiff dosya biçimi.
NOT: Yazarlar filmleri üç kez taramanızı ve elde edilen ortalamayı belirli bir film için tek değer olarak kullanmanızı önerir. - Filmlerin ışınlanmasına, 4 cm katı suyun üzerine bir parça film yerleştirerek başlayın ve kalan 2 cm katı suyu bu bölümde daha önce açıklandığı gibi yukarıda konumlandırın.
- Hayalet seti, filmin doz çıkışını belirlerken iyonlaşma odasıyla kaynaktan aynı mesafede olacak şekilde ayarlayın. Bu ışınlayıcının izomerik noktası.
- Öngörülen bir doz için yukarıdaki adım 2.3'te hesaplanan tedavi süresini programla.
- Tablo 2'delistelenen dozların her biri için tekrar tedavi.
- Filmlerin ışıktan korunarak 24 saat dinlenmesine izin verin.
- Pozlama sonrası film taramalarını yukarıdakiyle aynı şekilde elde edin.
- Görüntüleri ImageJ analiz yazılımına aktarın ve tüm ölçümleri kırmızı kanalda gerçekleştirin.
- Görüntüyü 'de sürükleyin. Dosya biçimini ImageJ içine alın.
- Görüntü açılan menüsünü tıklatın. Görüntü açılır menüsünden Renk'i seçin. Renk seçeneğinden kanalları böl'u seçin.
- Yalnızca kırmızı görüntü kanalını kullanarak, dikdörtgen aracını kullanarak ilgi çekici bir bölge çizin. Ctrl+M tuşlarınabasın. Sonuçlar penceresinden ortalama değeri yazıya dök.
- Taranan tüm filmler için 2.12.1-2.12.4 adımlarını yineleyin.
- Hem pozlanmamış hem de açıkta kalan filmler için piksel değerini merkezi olarak 1 cm x 1 cm karede elde edin. Bu değerler sırasıyla PVU(D) ve PV(D) olarak gösterilir ve Denklem 8'de açıklandığı gibi net optik yoğunluğu hesaplamak için kullanılabilir.
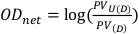 (Denklem 8) 13
(Denklem 8) 13
- Hem ön pozlama hem de pozlama sonrası her film görüntüsü çifti için 2.13.
- Dozun net optik yoğunluğa karşı bir grafiğini çizin ve eğriyi y = ax3 + bx2 + cx + d formatında bir kübik polinomiye sığdırın. Şekil 2B'debir örnek bulunabilir.
3. Klonojenik test yoluyla belirli kanser hücre hatları için α/β değerinin belirlenmesi
NOT: Aşağıdaki protokol, Franken ve arkadaşları tarafından açıklanan yöntemlerin değiştirilmiş bir sürümüdür ve Şekil 3'te görülebilir.
- Hücreleri ~%80 izdiah eder. Hücrelerin hücre büyümesinin günlük aşamasında olması gerektiğinden, bu deney için aşırı bir araya gelen hücre kaynaklarını kullanmaktan kaçının. Şekil 3C'degösterilen temsili klonojenik tahlil sonuçları için, dulbecco'nun Modifiye Kartal Orta (DMEM) bölgesinde %10 fetal sığır serumu ve penisilin/streptomisin ile desteklenmiş beyin-tropik MDA-MB-231 meme kanseri hücreleri kültürlenmiş ve nemlendirilmiş bir inkübatörde %37 °C ve %5 karbondioksitte inkübe edilmiştir.
- Hücreleri koloni tahlil için istenen yoğunlukta tohumla. Tohumlama sırasında doğru seyreltmeler, tahlillerin kaplama verimliliğini belirlemek için çok önemlidir. Birden çok çoğaltmayı plakalayın.
- Radyasyon tedavisi hücre kaplamadan önce gelecekse bu adıma devam edin (Şekil 3A). Alternatif olarak, hücre kaplama radyasyon tedavisinden önce gelecekse 3.4.
- Kültür şişelerinde istenen radyasyon tedavisini gerçekleştirin. Bundan önce veya sonra herhangi bir noktada herhangi bir ek tedavi (yani ilaç tedavisi) yapılabilir. Şekil 3C'dekitemsili sonuçlar için, 3.4 adımda ayrıntılı olarak açıklanan kaplama hücrelerinden sonra radyasyon tedavisi meydana geldi.
- Tercih edilen trypsinization yöntemini kullanarak hücreleri ayıklayın ve tek bir hücre süspansiyonu oluşturun. Kültür medyasını çıkarın ve hücreleri şişeden ayırmak için rekombinant enzim (örneğin, TrypLE Express) ekleyin. Hücreler, hafif bir mikroskop kullanılarak tespit edilene kadar hücreleri enzimle yaklaşık 3 dakika kuluçkaya yatırın. Eşit miktarda hücre kültürü ortamı kullanarak enzimi nötralize edin. Hücreleri 10 dakika boyunca 300 x g'da santrifüjler ve kültür ortamında istenen konsantrasyona yeniden biriktirin.
- Hücreleri istenen yoğunluklarda birden fazla kopya halinde plakala.
- İlk 24 saat sonra taze medya ile değiştirin.
- Her 2-3 günde bir medyayı değiştirmeye devam edin.
- Kontrol kolonileri koloni başına 50 hücreyi aşana kadar hücreleri kültleme devam edin, ~9-14 gün. Kontrol kolonileri radyasyon dozu almayan tedavi gruplarıdır. İlaç tedavilerini kullanan deneyler için de ilaç dozlamalı ancak radyasyon tedavisi olmayan başka bir kontrol grubuna ihtiyaç olmayacaktır.
- Radyasyon tedavisinden önce hücreleri tohumlarken bu adımla devam edin (Şekil 3B).
- Tercih edilen trypsinization yöntemini kullanarak hücreleri ayıklayın ve tek bir hücre süspansiyonu oluşturun.
- Hücreleri birden çok yinelemede istenen yoğunluklara yerleştirin.
- Hücrelerin bir gecede tabağa yapışmasına izin verin.
- İstenilen radyasyon dozlarını gerçekleştirin. İlaç dozlama gibi ek tedaviler, hücreler tedavi plakalarına bağlı olduğu sürece, bu adımdan önce veya sonra herhangi bir noktada yapılabilir. Şekil 3C'dekitemsili sonuçlar için tedaviden önce 1250 beyin-tropik MDA-MB-231 hücresi kaplandı (adım 3.4). Daha sonra hücreler ışınlanmadan 3 saat önce 15 nM doksomabisin ile 3 Gy röntgen ile tedavi edildi.
- İlk 24 saat sonra ortamı değiştirin.
- Medyayı her 2-3 günde bir değiştirin.
- Kontrol grubu kolonileri 50 hücreyi aşana kadar tedavi edilen hücreleri kültüre edin, ~9-14 gün. Kontrol kolonileri radyasyon dozu almayan tedavi gruplarıdır. İlaç tedavilerini kullanan deneyler için de ilaç dozlamalı ancak radyasyon tedavisi olmayan başka bir kontrol grubuna ihtiyaç olmayacaktır.
- Kültür medyasını kuyulardan veya bulaşıklardan çıkarın ve PBS ile yıkayın.
- Hücreleri 1:7 (v:v) buzul asetik asit ve metanol çözeltisinde 15 dakika sabitleyin.
- Fiksasyon çözümünü kaldırın.
- Sabitlemeden sonra, hücreleri 30 dakika veya zaman varsa 2 saat boyunca, oda sıcaklığında 4:1 (v:v) damıtılmış su ve metanol çözeltisinde 2,5-5,0 mg/mL kristal menekşe çözeltisi ile lekeleyin.
- Boyama çözeltisini çıkarın ve hücreleri oda sıcaklığında büyük bir su banyosunda yıkayın.
NOT: Akan su altında yıkamayın. - Her tedavi grubundaki kolonilerin sonuç sayısını sayın ve her plakanın hayatta kalma fraksiyonunu hesaplayın.
- Hayatta kalma fraksiyonunu teslim edilen ilgili doza karşı çizin ve eğriyi üstel bir uyumla sığdırın.
- α/β değerini tahmin etmek için, aşağıda bulunan doğrusal-ikinci dereceden denklemdeki ayarlanabilir parametrelerin her birinin değerlerini tahmin etmek için yukarıdaki çizimin üstel bir uyum değerini kullanın:
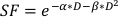 (Denklem 9)
(Denklem 9)
NOT: Hücrelerin ışınlanması, alan boyutunun iyi tabaklara veya petri tabaklarına uyum sağlayacak kadar büyük olması koşuluyla, herhangi bir kolimasyon olmadan genellikle izomerkinde yapılabilir. Bu protokoldeki potansiyel tuzaklar, koloni oluşumu olmaması, açık hücre büyümesi ile önemli hücre göçü, ancak gerçek koloniler olmaması veya steril olmayan bir ışınlayıcı odasında tedavi nedeniyle kontaminasyon gibi verimleri içerebilir.
4. Değişken deneysel tasarımlar için spesifik doz çıktısının belirlenmesi
- İstediğiniz alan boyutuna ve kaynaktan uzaklık olduğuna karar verin.
NOT: Kolimasyon, kolimatörün boyutu veya x-ışını kaynağından uzaklığı ne olursa olsun doz oranını değiştirecektir. - Birikme ve geri atma sağlamak için katı su hayaletlerini kullanarak, bir film parçasını deneysel tasarımı en iyi şekilde gösteren doğru yönde konumlandırın.
NOT: Herhangi bir deneysel kurulum için katı su, belirli bir tasarımın en doğru gösterimini sağlamayabilir. Bunun yerine, gerçek deneyin gemilerini (örneğin, Petri kabı, kuyu plakaları, küçük hayvan hayaletleri vb.) kullanmanızı öneririz. - Filmleri 1 (N=3) ve 2 (N=3) dakika ışınlayın.
- Filmlerin ışıktan korunarak 24 saat dinlenmesine izin verin.
- Bölüm 2'denprosedürleri izleyen her filmin net optik yoğunluğunu belirleyin. Net optik yoğunluktan dozu belirlemek için film kalibrasyon eğrisini kullanın.
- Denklem 10 tarafından tanımlanan bu deneysel kurulum için1dakika, D 1 , çıkış doz oranı olarak Ḋ, aşağıdaki gibi dozu belirleyin:
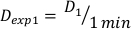 (Denklem 10)
(Denklem 10) - Benzer şekilde, denklem 11 tarafından 2 dakikada dozu aşağıdaki gibi caluclate:
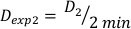 (Denklem 11)
(Denklem 11) - Son etkisi nedeniyle, yukarıdaki hesaplamalar için doz oranı biraz farklı olabilir. Bu nedenle, istenen deneysel tasarım için Dexp'yi hesaplamak için, Denklem 12'debelirtildiği gibi tek tek Dexp ortalamasını kullanın:
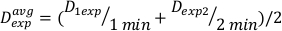 (Denklem 12)
(Denklem 12) - Bu ortalamayı kullanarak, Denklem 13'tebu belirli kurulum için istenen herhangi bir doza tedavi süresini tanımlayın:
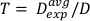 (Denklem 13)
(Denklem 13)
5. Tümör taşıyan farelerin anatomik olarak ilgi çekici bir yerde tedavi edilir
- Fareyi kurumun IACUC tarafından onaylanan güvenli ve insancır anestezi teknikleri ile uyuşturun.
- Uyuşturulmuş hayvanı istenen deneysel tasarımda belirtildiği gibi kısıtlamaya yerleştirin.
- Bu adım isteğe bağlıdır, kullanılamıyorsa 5.6 adımına geçin. Alüminyum filtre kullanarak kolimasyon yapmadan farenin yerleşik portal kamerasını kullanarak bir radyogram elde edin.
- Kolimasyon ile ikinci bir radyogram elde edin.
- Işın konumlandırmasını göstermek için ImageJ'deki radyogramları kapla.
- Önceden belirlenmiş α/ β değerini kullanarak, bir araştırma sorusunu yanıtlamak için en makul yaklaşımı sağlayan doz şemasını belirleyin (yani, 3 Gy'nin 10 fraksiyonunda teslim edilen 30Gy dozunun etkilerini modellemek istiyorsanız, ancak sadece dört kesir vermek istiyorsanız). Denklem 14 kullanarak, varsayılan α/β değeri 10 (bu değer protokol 3'teki bireysel kanser hücresi çizgileri için belirlenebilir) ve 30Gy/10 F'ye benzer bir YATAK ile 6 Gy'nin 4 kesirinde 24 Gy ile tedavi edin.
- İstenilen doz için verilen öngörülen süre boyunca hayvanı tedavi edin.
6. Vivo doz birikiminin histolojik onayı
- Protokol 5'inardından, tedaviden sonraki 1 saat içinde ilgi çekici doku toplamak15,16. Doku hasadından sonra, tercih edilen immünostokimya protokolüne devam edin. Aşağıda bir örnek verilmiştir.
- Buz gibi soğuk perfuse hayvan 4% paraformaldehit (PFA).
- PFA'da 4 °C'de düzeltme sonrası.
- Fiksasyonu takiben, her biri oda sıcaklığında 24 saat boyunca% 10,% 20 ve% 30 sakkarozda dokuyu sırayla sabitlayın.
- Dokuyu jelatin içine gömün ve sırayla% 4 PFA'da ve yine oda sıcaklığında 24 saat boyunca% 10-30 sakkarozda sabitlenin.
- Bloğu kırpın ve 30 dakika boyunca -80 °C'ye yerleştirin.
- Dokuyu 20-30 μm bölümlere dilimleyin.
- Immunostain altı iyi plaka 17,18serbest yüzen bölümler olarakkayar.
- Üç kez yıkayın ve % 1 Triton'da% 1.83 lizin ve% 4 ısı inaktive keçi serumu ile bir çalkalayıcıda 30 dakika boyunca permeabilize edin.
- Bölümleri 24 saat boyunca anti-φH2AX antikor ile kuluçkaya yatır, ardından istenen ikincil antikor ile 2 saatlik inkübasyon.
- Tercih edilen montaj ortamı kullanılarak cam kapaklı kapaklı kapak kaymaları.
- Floresan mikroskopta görüntü.
Sonuçlar
Aşağıdaki protokol 1, kullanılan ışınlayıcıya özgü Gy / min'de bir doz oranı sağlayacaktır. Bununla birlikte, ışınlayıcının türüne bakılmaksızın, bilinen bir doz oranıyla, şekil 2A-B'dekinebenzer filmler ve benzer bir kalibrasyon eğrisi veren protokol 2kullanılarak bir kalibrasyon eğrisi oluşturulabilir. Protokol 3'ten başarılı bir tahlil, homojen bir şekilde mor lekeleyen farklı, iyi çizilmiş hücre kolonileri sağlayacaktır. α/β tahmini, verilen hücre hattının radyo duyarlılığını yorumlamak için literatür değerleri veya diğer tedavi grupları ile karşılaştırılabilir. Protokol 2'yi takiben geliştirilen ve Şekil 2B'degörüntülenen kalibrasyon eğrisini kullanarak, protokol 4, gerekli deneysel ışınlama sürelerini tahmin etmek için kullanılabilecek Şekil 2A'ya benzeyen iki film örneği verecektir. Kullanılan ışınlayıcı için yerleşik bir portal görüntüleme kamerası mevcutsa, küçük hayvanların radyogramları kolimasyonlu ve kolimasyonsuz olarak elde edilebilir. Bu görüntülerin üst üste bindirilmesi, kolimlenmiş radyasyon ışınının Şekil 4A'dagösterildiği gibi tedavi edilen küçük hayvana göre tam konumunu gösterecektir. Protokol 5'te başarılı doz birikimi protokol 6'yı takiben doğrulanabilir. Radyasyonun in vivo veya in vitro sistemlerde bira biriktirildiğinin bir göstergesi de çift iplikli DNA kırılmasının tespit edilmesidir. Şekil 4B'degösterilmiştir Şekil 4A'dasadece sağ yarımküre boyunca işlenmiş aynı fare, sadece tedavi edilen yarımkürede pozitif φH2AX boyama göstermektedir. Bu şekilde, çekirdek iki şey göstermek için DAPI ile lekelenmiştir; 1) tüm histolojik analiz sırasında anti φH2AX antikorunun uygulandığı beyindir ve 2) beynin tedavi edilmemiş yarımküresi bozulmadan kalır.
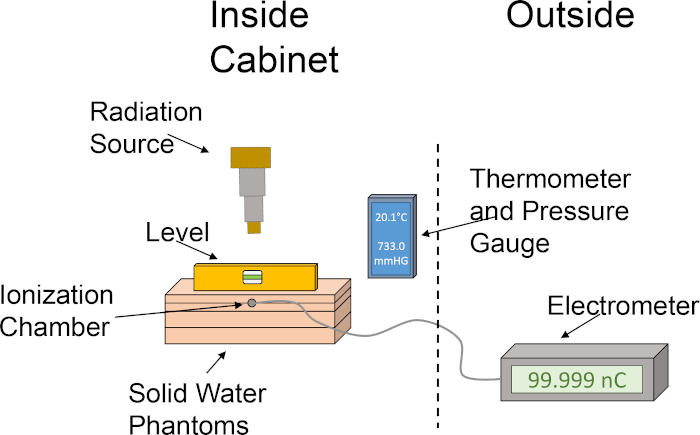
Şekil 1: Doz çıkışının belirlenmesi için iyonlaşma odası ve su hayaletinin kaba kurulumu. Piktogram, ışınlayıcının kabininde bir iyonlaşma odası ve katı su hayaletleri kullanarak dozimetri için gerekli çeşitli bileşenleri kullanan temel bir kurulumu göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Radyokromik film kullanılarak kalibrasyon eğrisinin üretilmesi. (A) Artan doz ile radyokromik filmin temsili renk değişimi. Sol üst (0 cGy); sağ alt (2000 cGy). (B) Net optik yoğunluk ve dozu karşılaştıran potansiyel radyokromik film kalibrasyon eğrisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
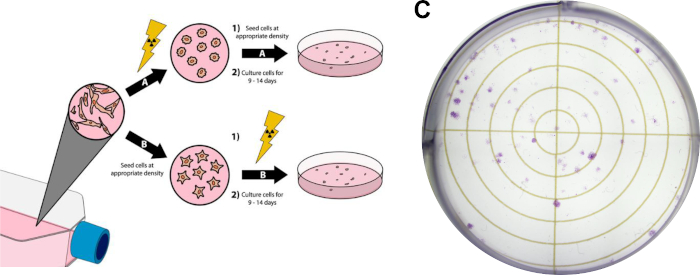
Şekil 3: Kanser Hücrelerinin Klonojenik Tahlili. Hücrelerin radyasyon tedavisi altı kuyu plakası / petri kabında (A) veya sonra (B) kaplamadan önce yapılabilir. Panelde (C), Protokol Bölüm 3'e uyduktan sonra MDA-MB-231 meme kanseri hücreleri ile başarılı bir klonojenik testin temsili bir görüntüsü görüntülenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
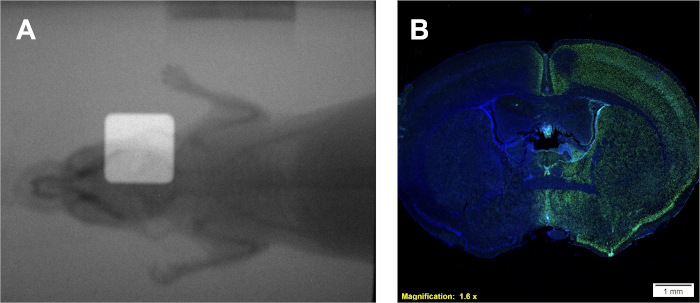
Şekil 4: Doz birikiminin onaylanması için konumlandırma (varsa) ve pozitif φH2AX immünohistokimyasal boyama için çift bindirilmiş radyogram kullanımı. (A) Radyasyon ışınının yerleşimini gösteren temsili bindirilmiş radyogramlar. (B) Artan φH2AX yoğunluğunun gösterdiği gibi sağ yarımküreye doz birikimini gösteren temsili sonuçlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Düzeltme Faktörü | Açıklama | |
| Nφ | Hava kerma kalibrasyon faktörü | |
| [(μen/φ)Whava] su | Suyun kütle enerji emme katsayılarının havaya rasyon; yaklaşık 1,05 | |
| Pq,Cham | Oda tarafından foton akı perterbasyonunu etkileyen oda kökü için düzeltme muhasebesi; yaklaşık 1.022 | |
| Pkılım | İyonlaşma odasını koruyan kılıf için düzeltme muhasebesi; oda su geçirmez olduğu için değeri 1 | |
| Ppol | Kutuplaşmayı oluşturan düzeltme faktörü; Protokol 1'de belirlenmiştir | |
| Piyon | İyon rekombinasyonu için düzeltme faktörü muhasebesi; Protokol 1'de belirlenmiştir | |
| PTp | Deney gününde temerpature ve basınç için düzeltme faktörü acocunting; Protokol 1'de belirlenmiştir | |
Tablo 1: Protokol 1'de doz oranının belirlenmesi için gerekli düzeltme faktörleri.
| Doz | N |
| 0.5 | 3 |
| 1 | 3 |
| 2 | 3 |
| 3 | 3 |
| 4 | 3 |
| 6 | 3 |
| 8 | 3 |
| 10 | 3 |
| 12* | 3 |
| 15* | 3 |
| 20* | 3 |
| * Sadece bireysel deneyler için 10'dan büyük dozlar için gereklidir. | |
Tablo 2: Radyokromik film kalibrasyon eğrisinin üretilmesinde kullanılacak dozlar.
Tartışmalar
Yukarıdaki protokolde radyasyon dozimetrisi için kullanıcı dostu bir yaklaşım, kanser hücre hatlarındaki α/β değerlerinin belirlenmesi ve meme kanseri beyin metastazının preklinik modelinde ışınlama yaklaşımının kısa bir örneği açıklanmaktadır. Bu yöntemler herhangi bir kanser modelini incelemek için kullanılabilir ve sadece meme kanserinin beyin metastazı ile sınırlı değildir. Bu bölümde preklinik radyoterapi deneylerinin altında yatan ilgili incelikler tartışılacaktır.
Dozimetri iki bölümden oluşur: 1) çıktıyı bir çiftçi odası ile kalibre edin, böylece x-ray ünitesinin doz oranı kurulur ve 2) radyokromik film kullanarak pratik bir dozimetri ölçüm sistemi hazırlayın. Çıkış kalibrasyonu ile ilgili olarak, TG-61 suda tekrarlanabilir bir yöntem sağlar. Buradaki protokol, ışınlayıcının üreticisi XStrahl tarafından önerildiği gibi Gammex RMI 457 katı suyu kullanır. Katı su ile göreli dozimetri (profiller veya derinlik dozu eğrileri maksimum dozda normalleştirilmiş) analizine rağmen, su ile% 1'den daha iyisini kabul etse de, katı su için suya kıyasla daha yüksek kütle enerjisi emilim katsayısı nedeniyle mutlak dozda yaklaşık% 3 ila 4'lük bir fark vardır. Bununla birlikte, XStrahl sisteminin tüm kurulumları çıkış kalibrasyonu için katı su protokolünü kullandığından, bu farklılıklar için düzeltme yapmadık. Çıktıyı bilmek, istenen dozu sağlamak için gereken maruz kalma süresinin hesaplanmasına izin verir. Filmi çiftçi odasıyla aynı kuruluma yerleştirmek, filme bilinen dozları sunmamızı sağlar. Filmin taranması daha sonra optik yoğunluklar sağlar. Filme doz daha sonra ilgili net optik yoğunluğa (pozlamadan sonra ve pozlamadan önce optik yoğunluk farkı) karşı grafiklendirilebilir. Bu bir film kalibrasyon eğrisi üretir. Deneysel kurulumları değiştirdiğimizde, bu durumdaki doz oranı değişebilir, çünkü doz oranı alan büyüklüğüne, derinliğe ve ışınlanan malzemeye bağlıdır. Deneysel kurulumla filmi ortaya çıkarmak bize net bir optik yoğunluk sağlar ve film kalibrasyon eğrisini kullanarak ilgili dozu belirleyebiliriz. Bu dozu film ışınlanana bölerek doz oranını alıyoruz. Bu doz oranı daha sonra verilen deneysel kurulum için istenen dozu sunmak için maruz kalma süresini hesaplamak için kullanılabilir. Yukarıda açıklanan protokol, film dozimetrisi ile ilişkili çeşitli nüansları işler. Örneğin, pozlamadan sonra, filmin aktif katmanındaki kimyasal reaksiyonların neredeyse tamamlanması için film yaklaşık 24 saat gerektirir. Bu kadar süreyi beklememek daha düşük bir optik yoğunluğa yol açacaktır.
Herhangi bir çalışmanın tekrarlanabilir dozimetriye sahip olması için, belirli bir ışınlayıcının birkaç temel unsurunun bilinmesi ve anlaşılması önemlidir. Özellikle, kullanılan ışınlayıcının modelini ve modelini diğer araştırmacılar için bilmek ve detaylandırmak çok önemlidir, kaynak türü (x-ışını, radyoaktif, vb.), enerji, yarı değerli katman, alan boyutu, kaynak yüzeye ve kaynak izomerkez mesafelerine, ışınlanan malzemenin boyutu, ışınlanan malzemeden önce zayıflama ve ışınlanmadan sonra geri atma, deneye özgü doz oranı, fraksiyon şeması, kullanılan tam dozimetri ekipmanı ve kullanılan dozimetri protokolü. Tüm bu bilgi noktaları, herhangi bir hayvana veya hücreye bir doz teslim etmeden önce belirli bir ışınlayıcının ışın kalitesini uyumlu bir şekilde tanımlayanşeydir 19. Bu protokolden ve diğerlerinden gelen bir başka ilgili bilgi noktası, Protokol 1'de elde edilen doz oranının sadece kullanılan ışınlayıcının çıktısı olmasıdır. Herhangi bir deney için, oluşturulan bir radyokromik film kalibrasyon eğrisi (Protokol 2) ile karşılaştırıldığında, bu kurulumun doz oranını tanımlamak önemlidir ( Protokol4).
Tüp bebek deneyleri kanser hücre hatlarının radyobiyolojik davranışları hakkında önemli detaylar sağlar. In vitro klonojenik hücre sağkalım tahlilleri, bir hücre hattının doğal radyo duyarlılığını doğru bir şekilde tahmin eder ve ölçer20Sonraki hücresel veya küçük hayvan deneylerinde fraksiyonasyon programlarının tasarımına yardımcı olur21. Özellikle, bu parametreler için yaklaşık değerleri test eder α ve denkleme göre radyoterapiye yanıt olarak hücre ölümünü tahmin etmek için doğrusal-ikinci dereceden modelde kullanılan β:
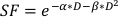 (Denklem 9)
(Denklem 9)
burada SF klonogenik olarak uygulanabilir hücrelerin hayatta kalan fraksiyonudur, D Gy radyasyon dozudur ve α ve βparametreleri 22. α/β oranı, hücresel radyo duyarlılığının doğal bir ölçüsünü sağlar ve daha yüksek değerler bir hücre hattının artan duyarlılığı ileilişkilidir 22. Bu fonksiyonel ilişki doza göre doğrusal olmadığından, radyoterapi fraksiyonasyon şemasının biyolojik etkileri sadece toplam teslim edilen dozla değil, aynı zamanda fraksiyonların sayısı ve boyutu ile de ilgilidir23. Biyolojik etkili doz (BED), bir dokuya verilen gerçek biyolojik dozun bir ölçüsüdür ve farklı fraksiyonasyon şemalarının doğrudan karşılaştırılmasını sağlar24,25. BED denklemi yalnızca α/β tahmini gerektirir ve aşağıda görüntülenir:
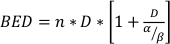 (Denklem 14)
(Denklem 14)
burada n dozun fraksiyonlarının sayısıdır D. Klonojenik hücre sağkalım tahlilleri α/β tahmin eder ve BED denklemi ile radyoterapi fraksiyonasyon şemalarının doğrudan karşılaştırılır. Tedavi gruplarındaki YATAK deneyler içinde veya arasında eşitlikçi değilse radyoterapiye doku veya organ yanıtı (veya diğer yöntemlerle radyoterapi kombinasyonları) ile ilgili yanlış sonuçlar çıkarılabilir. Örneğin, 5 Gy'nin 4 fraksiyonu ile karşılaştırıldığında 10 Gy'nin 2 fraksiyonu aynı BED'i oluşturmaz ve bu nedenle bu dosing şemaları biyolojik yanıt açısından doğrudan karşılaştırılamaz. BED denklemi, doğrusal-ikinci dereceden modeldeki doğal sınırlamalar nedeniyle kusurlu olsa da, çok çeşitli deneysel tedavi koşulları için adil etkileri güvenilir bir şekilde tahmin eder24,25.
Klonojenik hücre sağkalım tahlilleri açıkça kanser modellerinde radyoterapi etkilerinin incelenmesinde önemli bir rol oynamaktadır, ancak in vitro deneyler kanser hücresi radyobiyolojisinin mekanistik ayrıntılarını daha fazla keşfetmek için bir dizi ek seçenek sunmaktadır. Klonojenik hücre sağkalım tahlilinin basit modifikasyonları, paclitaxel veya etoposide26 , 27gibi bazı radyo duyarlı kemoterapiler için etki modlarını belirlemek için kullanılmıştır. Diğer in vitro deneysel seçenekler arasında, γ-H2AX odakları ve/veya çift iplikli DNA kırılması onarımı için 53BP1 boyama gibi belirli hücresel onarım yollarını incelemek için immünosimokimya çalışmaları yer almaktadır28. Bu deneyler, radyoterapiyi kombinasyon tedavileri ile tek bir modalite olarak karşılaştırırken, özellikle belirli bir hücre hattı için mekanistik ayrıntıları incelerken özellikle ilgi çekici olabilir. Diğer deneysel seçenekler arasında, bir hücrenin ışınlamadaki enflamatuar yanıtının doğuştan gelen rolünü incelemek için sitokin ölçümleri veya hücre ölüm şeklinin (örneğin, apoptoz, nekroz, mitotik felaket vb.) farklı terapötik koşullar altında analiz edilmesi29,30,31. Bu tür bir deney, hayvan deneylerini tamamlayabilir veya değiştirebilir ve bir kanser hücresi hattının radyobiyolojisinin daha eksiksiz anlaşılmasıni sağlayabilir. Ek deneylerin seçimi ne olursa olsun, protokol 3'te açıklandığı gibi standart bir klonojenik hücre sağkalım tahlilleri, bir hücre hattının önemli bir ilk radyobiyolojik değerlendirmesidir.
Klonojenik tahliller ve radyasyon dozimetrisi, araştırmacıya klinik senaryolara daha doğrudan benzemek için deneyleri hassas bir şekilde planlamak için bir araç sağlar. Preklinik kanser küçük kemirgen modellerinin eklenmesiyle, radyasyona yanıtı tek başına veya bir tedavi planı bağlamında incelemek mümkündür. Hayvanları kullanmadan önce, doz çıkışının belirlenmesi için kullanılan kurulumdan farklıysa, belirli kurulumun göreli doz çıktısını belirlemek önemlidir32,33. <10 mm alan boyutları için bir doz oranı belirleme söz konusu olduğunda, küçük bir alan içindeki hizalama ve kısmi hacim ortalama etkileri nedeniyle bir iyonlaşma odasının kullanımı daha az doğru hale gelir33. In vivo immünohistokimyasal deneylerle birlikte çıktıyı belirlemek için radyokromik filmin kullanımı, son 16 , 34 ,35 ,36,37,38'de çıktı ve doz birikimini belirlemek için kullanılmıştır.
Açıklamalar
Yazarların yapacakları bir açıklama yok.
Teşekkürler
Yazarlar, WVU'daki Mikroskop ve Hayvan Modelleri Görüntüleme Tesislerine P20GM103434 hibe numarası ile desteklenen ekipmanlarının kullanımı için teşekkür eder. Ek olarak, bu çalışma Ulusal Genel Tıp Bilimleri Enstitüsü'nden P20GM121322 hibe numarası, Ulusal Kanser Enstitüsü hibe numarası F99CA25376801 ve Mylan Sandalye Bağış Fonu tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetic acid, glacial | Sigma-Aldrich | A6283 | This or comparable glacial acetic acid products are acceptable. |
| Crystal Violet | Sigma-Aldrich | C6158 | This or comparable crystal violet products are acceptable. |
| Digital Baraometer | Fisher Scientific | 14-650-118 | For pressure and temperature measurements. |
| Electrometer | Standard Imaging | CDX 2000B | Calibrated by an ADCL; Need correction factor, Pelec |
| Film | Gafchromic | EBT3 Film | Comes in sheets of 25; calibration films and experimental films must come from same set |
| Ionization Chamber | Farmer | PTW TN30013 | Calibrated by an ADCL @ two calibration points |
| Methanol | Sigma-Aldrich | 34860 | This or comparable methanol products are acceptable. |
| Photo Scanner | Epson | Perfection V700 | Equivalent scanners are V800, V10000, V11000, V12000 |
| XenX | Xstrahl | NA | Irradiator used. |
Referanslar
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2019. CA: A Cancer Journal for Clinicians. 69 (1), 7-34 (2019).
- Allen, C., Her, S., Jaffray, D. A. Radiotherapy for Cancer: Present and Future. Advanced Drug Delivery Reviews. 109, 1-2 (2017).
- Delaney, G., Jacob, S., Featherstone, C., Barton, M. The role of radiotherapy in cancer treatment: estimating optimal utilization from a review of evidence-based clinical guidelines. Cancer. 104 (6), 1129-1137 (2005).
- Chen, H. H. W., Kuo, M. T. Improving radiotherapy in cancer treatment: Promises and challenges. Oncotarget. 8 (37), 62742-62758 (2017).
- Le, Q. T., Shirato, H., Giaccia, A. J., Koong, A. C. Emerging Treatment Paradigms in Radiation Oncology. Clinical Cancer Research. 21 (15), 3393-3401 (2015).
- Baumann, M., et al. Radiation oncology in the era of precision medicine. Nature Reviews Cancer. 16 (4), 234-249 (2016).
- Leeman, J. E., et al. Patterns of Treatment Failure and Postrecurrence Outcomes Among Patients With Locally Advanced Head and Neck Squamous Cell Carcinoma After Chemoradiotherapy Using Modern Radiation Techniques. JAMA Oncology. 3 (11), 1487-1494 (2017).
- Coy, P., et al. Patterns of failure following loco-regional radiotherapy in the treatment of limited stage small cell lung cancer. International Journal of Radiation Oncology - Biology - Physics. 28 (2), 355-362 (1994).
- Achrol, A. S., et al. Brain metastases. Nature Reviews Disease Primers. 5 (1), 5(2019).
- Ma, C. M., et al. AAPM protocol for 40-300 kV x-ray beam dosimetry in radiotherapy and radiobiology. Medical Physics. 28 (6), 868-893 (2001).
- Wang, Y. F., Lin, S. C., Na, Y. H., Black, P. J., Wuu, C. S. Dosimetric verification and commissioning for a small animal image-guided irradiator. Physics in Medicine and Biology. 63 (14), 145001(2018).
- Wack, L., et al. High throughput film dosimetry in homogeneous and heterogeneous media for a small animal irradiator. Physical Medicine. 30 (1), 36-46 (2014).
- Devic, S. Radiochromic film dosimetry: past, present, and future. Physical Medicine. 27 (3), 122-134 (2011).
- Franken, N. A., Rodermond, H. M., Stap, J., Haveman, J., van Bree, C. Clonogenic assay of cells in vitro. Nature Protocols. 1 (5), 2315-2319 (2006).
- Ford, E. C., et al. Localized CT-guided irradiation inhibits neurogenesis in specific regions of the adult mouse brain. Radiation Research. 175 (6), 774-783 (2011).
- Zarghami, N., et al. Half brain irradiation in a murine model of breast cancer brain metastasis: magnetic resonance imaging and histological assessments of dose-response. Radiation Oncology. 13 (1), 104(2018).
- Nwafor, D. C., et al. Loss of tissue-nonspecific alkaline phosphatase (TNAP) enzyme activity in cerebral microvessels is coupled to persistent neuroinflammation and behavioral deficits in late sepsis. Brain, Behavior, and Immunity. , (2019).
- Amtul, Z., Hepburn, J. D. Protein markers of cerebrovascular disruption of neurovascular unit: immunohistochemical and imaging approaches. Reviews in Neuroscience. 25 (4), 481-507 (2014).
- Draeger, E., et al. A Dose of Reality: How 20 Years of Incomplete Physics and Dosimetry Reporting in Radiobiology Studies May Have Contributed to the Reproducibility Crisis. International Journal of Radiation Oncology - Biology - Physics. 106 (2), 243-252 (2020).
- Dunne, A. L., et al. Relationship between clonogenic radiosensitivity, radiation-induced apoptosis and DNA damage/repair in human colon cancer cells. British Journal of Cancer. 89 (12), 2277-2283 (2003).
- Yang, Y., Xing, L. Optimization of radiotherapy dose-time fractionation with consideration of tumor specific biology. Medical Physics. 32 (12), 3666-3677 (2005).
- Hall, E. J., Giaccia, A. J. Radiobiology for the radiologist. Eighth edition. , Wolters Kluwer. (2019).
- van Leeuwen, C. M., et al. The alfa and beta of tumours: a review of parameters of the linear-quadratic model, derived from clinical radiotherapy studies. Radiation Oncology. 13 (1), 96(2018).
- Fowler, J. F. 21 years of biologically effective dose. British Institute of Radiology. 83 (991), 554-568 (2010).
- Jones, B., Dale, R. G., Deehan, C., Hopkins, K. I., Morgan, D. A. The role of biologically effective dose (BED) in clinical oncology. Clinical Oncology journal | The Royal College of Radiologists. 13 (2), 71-81 (2001).
- Choy, H., Rodriguez, F. F., Koester, S., Hilsenbeck, S., Von Hoff, D. D. Investigation of taxol as a potential radiation sensitizer. Cancer. 71 (11), 3774-3778 (1993).
- Ng, C. E., Bussey, A. M., Raaphorst, G. P. Inhibition of potentially lethal and sublethal damage repair by camptothecin and etoposide in human melanoma cell lines. International Journal of Radiation Biology. 66 (1), 49-57 (1994).
- Kurashige, T., Shimamura, M., Nagayama, Y. Differences in quantification of DNA double-strand breaks assessed by 53BP1/gammaH2AX focus formation assays and the comet assay in mammalian cells treated with irradiation and N-acetyl-L-cysteine. Journal of Radiation Research. 57 (3), 312-317 (2016).
- Schaue, D., Kachikwu, E. L., McBride, W. H. Cytokines in radiobiological responses: a review. Radiation Research. 178 (6), 505-523 (2012).
- Mery, B., et al. In Vitro Cell Death Determination for Drug Discovery: A Landscape Review of Real Issues. Journal of Cell Death. 10, 1179670717691251(2017).
- Galluzzi, L., et al. Molecular mechanisms of cell death recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death & Differentiation. 25 (3), 486-541 (2018).
- Felix, M. C., et al. Collimator optimization for small animal radiation therapy at a micro-CT. Z Medical Physics. 27 (1), 56-64 (2017).
- Newton, J., et al. Commissioning a small-field biological irradiator using point, 2D, and 3D dosimetry techniques. Medical Physics. 38 (12), 6754-6762 (2011).
- Wong, J., et al. High-resolution, small animal radiation research platform with x-ray tomographic guidance capabilities. International Journal of Radiation Oncology - Biology - Physics. 71 (5), 1591-1599 (2008).
- Ghita, M., et al. Small field dosimetry for the small animal radiotherapy research platform (SARRP). Radiation Oncology. 12 (1), 204(2017).
- Biglin, E. R., et al. Preclinical dosimetry: exploring the use of small animal phantoms. Radiation Oncology. 14 (1), 134(2019).
- Munoz Arango, E. T., Peixoto, J. G., de Almeida, C. E. Small field dosimetry with a high-resolution 3D scanning water phantom system for the small animal radiation research platform SARRP: a geometrical and quantitative study. Physics in Medicine and Biology. , (2019).
- Murrell, D. H., et al. Evaluating Changes to Blood-Brain Barrier Integrity in Brain Metastasis over Time and after Radiation Treatment. Translational Oncology. 9 (3), 219-227 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır