Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Dijital Yüksek Hızlı Siliyer Videomikroskopi Kullanarak Burun Fırçalama Örneklemesi ve İşleme – COVID-19 Pandemisine Adaptasyon
Bu Makalede
Özet
PCD tanısı için başarılı ve yüksek kaliteli siliyer fonksiyonel analizi garanti etmek için, solunum epitel örneklemesi ve işlenmesi için hassas ve dikkatli bir yöntem şarttır. COVID-19 pandemisi sırasında PCD tanı hizmeti vermeye devam etmek için, siliyer videomikroskopi protokolü uygun enfeksiyon kontrol önlemlerini içerecek şekilde güncellenmiştir.
Özet
Primer Siliyer Diskinezi (PKH), önemli otosinopulmoner hastalığa yol açan genetik motil bir siliopatidir. PCD tanısı, farklı tanı yöntemlerindeki zorluklar nedeniyle sıklıkla kaçırılır veya gecikir. PCD için tanı araçlarından biri olan Dijital Yüksek Hızlı Videomikroskopi (DHSV) kullanan siliyer videomikroskopi, siliyer vuruş frekansı (CBF) ve vuruş paterni (CBP) analizinden oluşan siliyer fonksiyonel analiz (CFA) yapmak için en uygun yöntem olarak kabul edilir. Bununla birlikte, DHSV, numunelerin işlenmesi ve analiz edilmesi için standartlaştırılmış, yayınlanmış çalışma prosedüründen yoksundur. Ayrıca, COVID-19 pandemisi sırasında önemli bir enfeksiyon kontrol sorunu olan canlı solunum yolu epitelini kullanır. Bu sağlık krizi sırasında tanısal bir hizmet sunmaya devam etmek için, siliyer videomikroskopi protokolü yeterli enfeksiyon kontrol önlemlerini içerecek şekilde uyarlanmıştır.
Burada, siliyer solunum numunelerinin numune alınması ve laboratuvarda işlenmesi için gözden geçirilmiş bir protokolü açıklıyoruz ve COVID-19 enfeksiyon kontrol önlemlerine uymak için yapılan uyarlamaları vurguluyoruz. Bu protokole göre işlenen ve analiz edilen 16 sağlıklı denekten alınan burun fırçalama örneklerinden elde edilen CFA'nın temsili sonuçları açıklanmıştır. Ayrıca, kalite seçim kriterlerini karşılamayan numuneler artık CFA'ya izin verdiğinden, optimum kalitede epitel siliye şeritlerin elde edilmesinin ve işlenmesinin önemini de gösteriyoruz, bu da bu tekniğin tanısal güvenilirliğini ve verimliliğini potansiyel olarak azaltıyor.
Giriş
Primer siliyer diskinezi (PKH), solunum kirpiklerinin durağan, yavaş veya diskinetik olduğu, mukosiliyer klirens bozukluğuna ve kronik oto-sino-pulmoner hastalığa yol açan kalıtsal heterojen hareketli siliopatidir 1,2,3,4. PKH'nin klinik bulguları erken bebeklik döneminde başlayan kronik ıslak öksürük ve kronik burun tıkanıklığı, bronşektaziye yol açan tekrarlayan veya kronik üst ve alt solunum yolu enfeksiyonları, tekrarlayan veya kronik otitis media ve sinüzittir 5,6,7. PKH hastalarının yaklaşık yarısı situs inversus veya situs ambiguus gibi organ lateralite defektleri ile başvurmaktadır. Bazı hastalar ayrıca erkeklerde hareketsiz sperm ve kadınlarda Fallop tüplerinde hareketsiz kirpikler nedeniyle infertilite sorunları ile başvurmaktadır 1,2,8. PCD nadirdir, ancak prevalansı tanımlamak zordur ve 1: 10.000 ila 1: 20.000 9,10 arasında değişmektedir. Ancak PKH'nin gerçek prevalansının tanıdaki güçlükler ve klinik şüphe eksikliği nedeniyle daha yüksek olduğu düşünülmektedir. PCD semptomları, diğer akut veya kronik solunum yollarının ortak solunum bulgularını taklit eder ve tanıyı doğrulamanın tanısal zorlukları iyi bilinmektedir, bu da yetersiz tedavi ve takibe yol açmaktadır 2,5,9,11.
Dijital Yüksek Hızlı Videomikroskopi (DHSV) kullanan siliyer videomikroskopi, PCD 4,8,12,13 için tanı araçlarından biridir. DHSV, siliyer vuruş frekansı (CBF) ve vuruş paterni(CBP) analizi 2,14,15,16'dan oluşan siliyer fonksiyonel analizi (CFA) gerçekleştirmek için en uygun yöntem olarak kabul edilir. DHSV, genellikle burun fırçalamadan elde edilen canlı solunum epiteli kullanır13.
Mevcut COVID-19 salgını göz önüne alındığında, kanıtlar altta yatan solunum yolu hastalığının COVID-19 enfeksiyonundan sonra daha kötü sonuçlara yol açabileceğini gösterdiğinden, PCD tanısının doğrulanması artık daha da önemlidir17,18. Mevcut pandemi sırasında güvenli ve etkili bir PCD tanı hizmeti, doğrulanmış PCD hastalarının genel popülasyona kıyasla ek koruyucu önlemlerden yararlanmasına da izin verecektir19.
COVID-19'un bulaşması öncelikle damlacık yayılımıyoluyla gerçekleşir 20. Asemptomatik (veya minimal semptomatik) hastalardan yüksek bulaşma potansiyeli, burun örneği20'deki yüksek viral yük ile önerilmektedir. Ek olarak, viral partiküller aerosol haline gelirse, havada en az 3 saat kalırlar21. Bu nedenle, solunum sağlığı çalışanları, tanı teknikleri için klinik bakım ve örnek toplama işlemi gerçekleştirirken yüksek bir viral yük rezervuarına maruz kalmaktadır22. Ayrıca, canlı solunum örneklerinin manipülasyonu, teknisyeni COVID-19 kontaminasyonuna maruz bırakır. COVID-19 hastalarına bakan solunum hekimleri ve KBB cerrahları için en iyi uygulama önerileri23 uygulanırken, COVID-19 pandemisi sırasında DHSV'nin uygulanmasına yönelik önerilerin eksikliği vardır.
Bir PCD teşhis hizmeti sunmaya devam etmek için, sağlık çalışanının (numune toplama gerçekleştiren) ve teknisyenin (numune işleme gerçekleştiren) güvenliğini sağlarken, siliyer videomikroskopi protokolünün COVID-19 pandemisi sırasında uyarlanması gerekiyordu. Siliyer videomikroskopi tekniği şu anda araştırma hizmeti ve uzmanlaşmış tanı merkezleri ile sınırlıdır, çünkü CFA kapsamlı eğitim ve deneyim gerektirir. Ayrıca, şu anda, DHSV 4,13 kullanarak numunelerin işlenmesi ve analiz edilmesi için standardizasyon ve hassas çalışma prosedürü eksikliği vardır.
Bu makalenin amacı, DHSV için standart çalışma prosedürlerini, özellikle canlı burun epitelini örneklendirirken ve işlerken enfeksiyon kontrol önlemlerine ve güvenliğe atıfta bulunarak tanımlamaktır. Bu, mevcut COVID-19 salgınına rağmen yüksek kaliteli PCD tanı ve bakımının devam etmesini sağlayacaktır.
Protokol
Liege hastanesi-fakülte etik kurulu ve Üniversite İş Yerinde Hijyen ve Sağlığın Korunması Bölümü'nden onay alınmıştır.
1. Solunum siliyer epitel örneklemesi
- Örneklemeden önce deneklerin en az 4-6 hafta boyunca enfeksiyondan arındırılmış olduklarından ve burun ve inhale ilaçlardan arındırılmış olduklarından emin olun.
- Takviyeli M199 preparatı hazırlayın: Antibiyotik çözeltisi (5 mL streptomisin / penisilin (50 μg / mL)) ve antifungal çözelti (5 mL amfoterisin B (2.5μg / mL)) ile Hücre Kültürü Ortamı 199 (M199) (500 mL) takviyesi).
- Kapaklı 2 (her burun deliği için bir tane) 15 mL konik tüp hazırlayın ve her birini 3 mL takviyeli M199 ile doldurun.
- Bir bronşiyal sitoloji fırçası hazırlayın (kalınlık: 2 mm ve uzunluk: 11 mm). Fırçanın yaklaşık 15 cm uzunluğunda olduğundan emin olmak için telin ucunu kesin (Şekil 1A,B). Burun fırçalama işlemini yaparken fırçayı tutmak için Weil-Blakesley burun forsepsi kullanın (Şekil 1B).
- COVID-19 adaptasyonu: COVID-19 için durumu bilinmeyen canlı bir burun epitel örneğini işlemekten kaçının, siliyer videomikroskopi için burun fırçalamadan 48 ila 72 saat önce hastayı COVID-19 için test edin. Bu COVID-19 testi, nazofarengeal sürüntü örneği24,25'ten alınan polimeraz zincir reaksiyonundan oluşur. Bu noktada hastanın COVID-19 durumu bilinmediğinden, hekim ve personel FFP2 maskesi, eldiven, yüz siperliği veya gözlük ve uzun kollu suya dayanıklı önlük dahil olmak üzere23,26 kişi tarafından yeterince korunmalıdır. Kullanılamayan, imkansız veya şüpheli PCR testi durumunda, burun fırçalamanın tüm işlemleri L2 biyo-güvenlik laboratuvarında yapılmıştır. COVID-19 durumunun pozitif olması durumunda, PCD tanı testini erteleyin ve hastayı yönetmek için alternatif yaklaşımlar düşünün.
DİKKAT: COVID-19 testi için bu nazofaringeal sürüntü örneklemesi, nazal solunum siliyer epiteline zarar vererek sekonder siliyer diskineziye neden olabilir27,28. Bunu önlemek için, sert endoskopik kontrol altında nazofarenkse kadar burun boşluğuna ince bir pamuklu çubuk sürün, türbinatlara veya septuma zarar vermekten kaçının. Numune daha sonra nazofarenksten alınır ve sert endoskopun kontrolü altında pamuklu çubukla çıkarılır. Yeterli ekipmanla, 0° rijit endoskopi yetişkinlerde ve çocuklarda travma olmadan kolayca yapılabilir.
2. Solunum siliyer epitel örneklerinin elde edilmesi
COVID-19 adaptasyonu: Hastanın COVID-19 durumu negatif olsa bile yanlış negatif oranı nedeniyle işlem sırasında hastadan ağzında cerrahi maske bulundurması istenir ve hekim tarafından eldiven, FFP2 maskesi ve yüz siperliği takılır.
- Burun fırçalama hazırlığı
- Hastadan burnunu üflemesini isteyin.
- Burun endoskopisi altında veya kör olmuş olarak burun fırçalama işlemi yapın. Nazal endoskopi kullanıyorsanız, burun fırçalamadan önce 2 burun deliğini inceleyin (COVID-19 burun sürüntüsü için daha önce 48-72 yapılmışsa tekrarlamayın). Muayene, mukozanın durumunu (burun fırçalama yapıldığında yüksek derecede iltihaplanma kanamaya neden olabilir, ...), inferior konka durumunu (örneğin telanjiektazi varlığını dışlamak için) ve septum nazalinin düz olup olmadığını doğrulamayı mümkün kılar (Şekil 1C).
- Hastadan uzanmasını veya rahatça oturmasını isteyin, başı sandalyede geriye doğru yaslanır (çünkü burun fırçalama, başı geriye doğru hareket ettirmek için bir reflekse neden olur). İkinci bir bakıcı, özellikle çocuklarda, burun fırçalama sırasında başını tutar.
- Burun fırçalamadan önce takviyeli M199'da fırçayı çalkalayın (fırçayı nemlendirmek fırçalamadan kaynaklanan tahrişi azaltır).
NOT: Fırça, takviye edilen M199 içinde nemlendirilmiş olabilir; Hastanın antibiyotiklere alerjisi varsa (penisilin ve streptomisin takviyeli hücre kültürü ortamında bulunur), fırçayı tuzlu suyla nemlendirin.
- Burun fırçalama
- Burun fırçalamayı lokal veya genel anestezi olmadan nazikçe yerleştirin13. Nazal endoskopi kullanıyorsanız, inferior burun konkasını görselleştirmek için endoskopu burun girişine yerleştirin, ardından sitoloji fırçasını buruna yerleştirin. "Kör" bir burun fırçalama işlemi yapıyorsanız, fırçayı burun tabanını takip ederek burun içine yerleştirin (Şekil 1D).
NOT: Bazı tanı merkezleri, burun fırçalama işlemini gerçekleştirmek için nafazolin tamponu ile lokal anestezi kullanır. - Fırçayı inferior burun konkasının arka kısmı üzerinde posterioral ve anterior olarak birkaç kez hareket ettirin ve sonra geri çekin. Operatör, fırçanın epiteli ovaladığını hissetmeli ve hasta fırçalamanın yanında tek taraflı sulu göz hissedebilir.
NOT: Burun fırçalama çok önden yapılırsa, ön burun boşluğu geçişli siliyer olmayan bir epitel ile kaplı olduğu için siliyer hücre elde edilmeyecektir. - Örneklemeden sonra, burun fırçalama örneklerini derhal kültür ortamına yerleştirin. Elde edilen solunum epitel şeritleri, takviye edilen M199'u içeren tüpteki fırça çalkalandırılarak yerinden çıkarılır ve ardından tüp kapatılır (Şekil 1E).
- COVID-19 adaptasyonu: Örneklemeden hemen sonra takviyeli M199'daki fırçayı çalkalayarak epitel şeritlerini yerinden çıkarmayın. Fırçayı tüpe yerleştirin, teli tüpün içine tamamen sığacak şekilde kesin ve tüpü hemen kapatın. Numuneyi hava geçirmez bir çift torbaya yerleştirin.
- Burun fırçalamayı lokal veya genel anestezi olmadan nazikçe yerleştirin13. Nazal endoskopi kullanıyorsanız, inferior burun konkasını görselleştirmek için endoskopu burun girişine yerleştirin, ardından sitoloji fırçasını buruna yerleştirin. "Kör" bir burun fırçalama işlemi yapıyorsanız, fırçayı burun tabanını takip ederek burun içine yerleştirin (Şekil 1D).
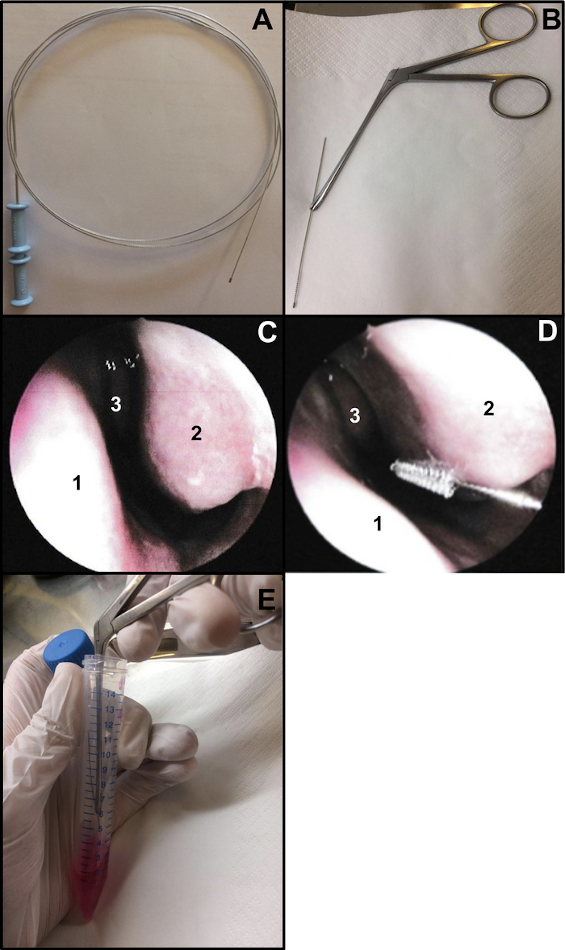
Şekil 1: Burun fırçalama tekniği. (A) Tüm bronşiyal sitoloji fırçası (B) Hazır fırça: Telin fırçalama ucu kesilir (yaklaşık 15 cm uzunluğunda) ve bir Weil-Blakesley nazal forseps tarafından tutulur (C) Burun boşluğunun endoskopik görünümü: septum (1) inferior konka (2) ve orta konka (3) (D) Burun fırçalama, inferior konkanın arka kısmında yapılır (2). Nazal septum (1) Orta konka (3). (E) Solunum epitel şeritleri, takviye edilmiş M199 hücre kültürü ortamında fırça sallanarak yerinden çıkarılır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
3. Solunum siliyer epitel işleme
- Burun fırçalama örneklerini örneklemeden sonraki 9 saat içinde mikroskop altında analiz edin, çünkü hem CBF hem de CBP bu zaman diliminde kararlıdır (yayınlanmamış veriler).
- x100 yağ daldırma faz kontrastı veya parazit kontrast lensi ile dik veya ters ışık mikroskobu kullanın. İdeal olarak, mikroskobu titreşim önleyici bir tablanın üzerine yerleştirin, çünkü siliyer dayak dış titreşimler nedeniyle artefaktlara maruz kalabilir (örneğin laboratuvar tezgahından)13.
COVID-19 adaptasyonu: Operatör, FFP2 maskesi, eldivenler ve uzun kollu suya dayanıklı önlük dahil olmak üzere burun işlemlerini gerçekleştirmek için kişisel koruyucu ekipman kullanır.
- Görselleştirme odasını hazırlayın.
- Kirpikli epitel şeritlerini laboratuarda inşa edilmiş açık bir görselleştirme odasında askıya alın, böylece kirpiklerin mikroskop altında analiz edilirken serbestçe atmasını sağlayın. Bu hazne, bir kapak kaymasının (22 mm x 40 mm) ve bir cam sürgünün, 15 mm'lik bir mesafe ile ayrılan ve cam slayt12'ye yapıştırılan iki bitişik kare kapak fişi (20 mm x 20 mm) ile ayrılmasıyla oluşturulur (Şekil 2, Şekil 4A).
COVID-19 adaptasyonu: Yukarıda açıklanan laboratuvar yapımı oda açıktır ve numune ile çevre arasında gaz ve nem değişimine izin verir13. COVID-19 pandemisi bağlamında, 0,25 mm derinliğinde çift taraflı sıkışmış ara parça kullanılarak kapalı bir görselleştirme odası kullanmak mümkündür (Şekil 3, Şekil 4B). Ara parça cam slayta sıkışır ve daha sonra ara parçanın üstüne bir kapak kayması (22 mm x 40 mm) yapıştırılır.

Resim 2: Laboratuvarda inşa edilen açık odanın montajı. (A) 2 kare kapak fişi (20 mm x 20 mm) cam kızak üzerine yerleştirilir. (B) Kare kapak fişleri yaklaşık 15 mm'lik bir mesafe ile ayrılır ve cam slayt üzerine yapıştırılır. (C) Hazne, iki bitişik kare kapak fişi arasında, takviye edilmiş M199'da küçük bir siliyer epitel örneği (yaklaşık 60 μL) ile doldurulur. (D) İki bitişik kare kapak fişinin üzerine uzun dikdörtgen bir örtü (22 mm x 40 mm) yerleştirilir ve hazneyi örter. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 3: Kapalı haznenin çift taraflı sıkışmış bir ara parça kullanılarak montajı. (A) Cam sürgü ve çift taraflı sıkışmış ara parça. (B) Ara parçanın bir tarafındaki koruma kaldırılır ve ara parça daha sonra cam slayta sıkışır. (C) Koruma, çift taraflı sıkışmış ara parçanın diğer tarafından çıkarılır ve daha sonra ara parça, takviye edilmiş M199'da küçük bir siliyer epitel örneği (yaklaşık 60 μL) ile doldurulur. (D) Ara parçaya uzun dikdörtgen bir örtü (22 mm x 40 mm) sıkışır ve odayı kapatır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
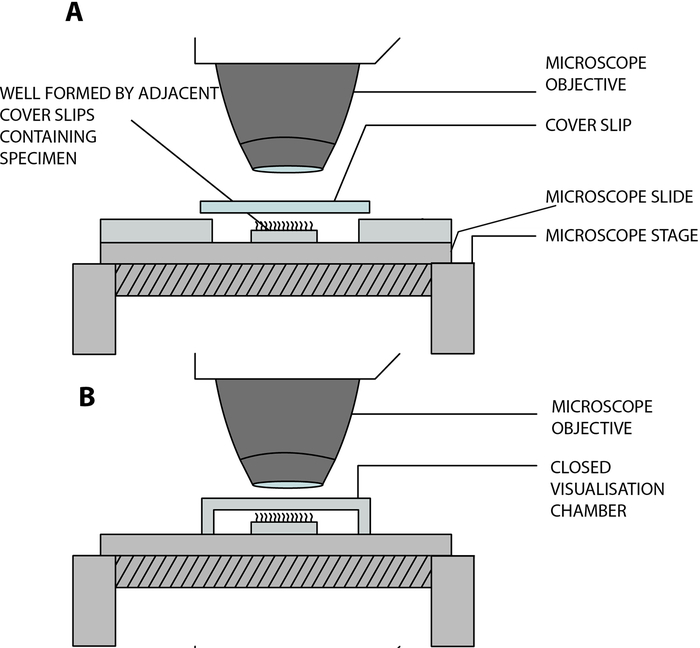
Şekil 4: Dijital yüksek hızlı videomikroskopi (DHSV) kullanarak siliyer videomikroskopi yapmak için kullanılan ana görselleştirme odalarını gösteren şematik diyagram. (A) Açık asılı damla tekniği: Kirpiklenmiş numune, bir kapak kayması ve bir cam slaytın iki bitişik kapak kayması ile ayrılmasıyla oluşturulan açık bir odada, bir hücre kültürü ortamının bir damlasında askıya alınır. (B) Kapalı asılı damla tekniği: Kirpiklenmiş numune, bir cam tarafı ile bir kapak kayması arasına sıkıştırılmış bir ara parça tarafından oluşturulan kapalı bir odada, bir hücre kültürü ortamının bir damlasında askıya alınır. Ara parça hem cam kızağa hem de kapak kaymasına sıkıca yapışır. Kempeneers ve ark.13'ten çoğaltılmış ve değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
- Sıcaklık kontrolü
- Mikroskobu kabarcık sargısı ile çevreleyin (Şekil 5A,B).
- Lens ısıtıcısını Velcro kayışı kullanarak hedefin etrafına takın (Şekil 5C)
- Kontrol sıcaklığı kontrolünü gerçekleştirmeden 1 saat önce lens ısıtıcı kontrol cihazını açın.
- Mikroskobu açın ve mikroskop kurulumunun yapılıp yapılmadığını kontrol edin, çünkü numuneden geçen ışığın miktarı slayttaki sıcaklığı değiştirebilir.
- Isıtmalı kutu kontrol cihazını açın (Şekil 5D).
- Başlamadan önce referans probunun düzgün çalışıp çalışmadığını kontrol edin. Referans probu ucunu parmaklarınızın arasında tutun; vücut ısısını ölçmelidir.
- Serbest ortamı slaytın ortasına, üzerine yapıştırılmış iki bitişik kare kapak fişi (20 mm x 20 mm) arasına yerleştirin.
- Referans prob ucunu takviyeli M199'a yerleştirin. Dikdörtgen bir kapak kayması (22 mm x 40 mm) ile örtün. Probun tamamen ortamla çevrili olduğundan emin olun (aksi takdirde sıcaklık düşebilir).
- COVID-19 adaptasyonu: Bir ara parça kullanarak kapalı odadaki sıcaklık kontrolünü gerçekleştirmek için, ara parçanın bir tarafını kesin (bu delik referans probu ile aynı boyutta olmalıdır). Ara parçayı cam slaytın üzerine yapıştırın, ara parçanın ortasına boş ortam yerleştirin. Referans probunun ucunu ara parçanın deliğinden çözeltinin içine yerleştirin, ardından ara parçanın üzerine dikdörtgen bir kapak kayması (22 mm x 40 mm) yapıştırın.
- Slaytı ısıtılmış kutunun plakasına yerleştirin. Isıtmalı kutuyu kapakla kapatın.
- Yağ daldırma hedefine yağ ekleyin.
- Isıtılmış kutuyu mikroskop aşamasına yerleştirin.
- Plakanın ve kapağın sıcaklığını (yoğuşmayı önlemek için kapağın sıcaklığı, plakanın sıcaklığından 2 °C daha yüksek olmalıdır) ortam içindeki referans probu ile 37 °C'yi ölçecek şekilde ayarlayın.
- 5 dakika bekleyin (numunenin sıcaklığını 37 °C'ye yükseltmek için gereken süre).
- Objektifi, kapak kapağına lensin ucuyla dokunana kadar slayta yaklaştırarak ayarlayın.
- Mikroskopta probun ortasını görmek için hedefi hareket ettirin.
NOT: Probun bilgisayar ekranında göründüğünden emin olun (kirpikli numuneye bakmadan önce kamera sisteminin çalışıp çalışmadığını kontrol etmek için). Probun ortasını görüntülerken, ekran tamamen siyahtır. - Lens ısıtıcısının sıcaklığını ayarlayın (yağa daldırma lensi kapak kayması ile temas ettiğinde sıcaklık kaybını telafi etmek için). Objektif kapak kaymasına dokunduğunda ortam içindeki referans probu ile 37 °C ölçtüğünüzden emin olun.
NOT: İdeal olarak, kontrollü bir sıcaklığa sahip bir odada çalışın, böylece bu sıcaklıklar ayarlandığında değişmez. Odanın sıcaklığı kontrol edilmiyorsa, siliyer videomikroskopi yapmadan önce her gün bu sıcaklık kontrol kontrolünü yapmalısınız. - Sıcaklığı kontrol ettikten sonra, slaytı ısıtılmış kutudan çıkarın.
- Slaytı ve referans probunun ucunu alkolle temizleyin ve uzaklaştırın.
- Lensi izopropanol ile temizleyin ve lens temizleme dokularını dairesel hareketlerle temizleyin.

Şekil 5: DHSV laboratuvarında kullanılan ekipmanlar. (A) 100x yağ daldırma fazı-kontrast lensi ile donatılmış mikroskop, dış titreşimlerin siliyer fonksiyonel analiz için artefaktlara neden olmasını önlemek için titreşim önleyici bir tabla üzerine yerleştirilir (B) Mikroskop, ortam havasından kaynaklanan ısı kaybını önlemek için kabarcık sargısı ile çevrilidir. (C) Yağa daldırma hedefi ısı kaybı yaratır. Bu, bir lens ısıtıcı (oklar) kullanılarak önlenebilir. (D) Numune bir ısıtma kutusu kullanılarak ısıtılır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
4. Solunum siliyer epitel örneklerinin hazırlanması
- Kirpiklerin tüp boyunca yayılmasına izin vermek için tüpü hafifçe sallayın (kirpiklerin serbestçe atmalarını önleyen diğer siliyer şeritlere, mukus veya döküntülere yapışmasını önlemek için).
NOT: Bu adım, siliyer epitelin "optimal kenarlarını" elde etmek için gereklidir (Şekil 12). - Tüpün ortasındaki takviyeli M199'da yaklaşık 50 μL siliyer epiteli bir pipetle geri çekin.
- Numuneyi laboratuvar yapımı hazneye (iki bitişik kare kapak fişi (20 mm x 20 mm) arasında) koyun ve dikdörtgen bir kapak kayması (22 mm x 40 mm) ile örtün. Kabarcık eklememeye dikkat edin.
- COVID-19 adaptasyonu: Bir mikrobiyolojik güvenlik kabininde 4.1-4.3 adımlarını uygulayın. Mikrobiyolojik güvenlik kabinindeki prosedür.
- Numuneyi hazırlamadan 10 dakika önce mikrobiyolojik güvenlik kabinini açın (ortamın steril olduğundan emin olmak için).
- Herhangi bir elleçlemeden önce, tüm mikrobiyolojik güvenlik kabinini% 70 etanol ile dezenfekte edin.
- Mikrobiyolojik güvenlik kabinine yerleştirmeden önce gerekli tüm malzemeleri% 70 etanol ile dezenfekte edin.
- Numuneleri içeren 15 mL konik tüpleri mikrobiyolojik güvenlik kabininin altında sadece bir kez açın, ardından fırçayı (Weil-Blakesley burun forsepsleri kullanarak) takviyeli M199'da çalkalayarak epitel şeritlerini yerinden çıkarın.
- Ara parçayı cam sürgüye yapıştırın ve korumayı çift taraflı sıkışmış ara parçadan çıkarın.
- Kirpiklerin tüp boyunca yayılmasına izin vermek için tüpü hafifçe sallayın.
- Takviyeli M199'daki küçük bir siliyer epitel örneğini tüpün ortasından bir pipetle (yaklaşık 60 μL) çekin ve ara parçayı doldurun.
- Odayı kapatmak için dikdörtgen kapak kaymasını (22 mm x 40 mm) ara parçaya yapıştırın.
- Mikrobiyolojik güvenlik kabininden çıkmadan önce sürgüyü dezenfekte edin.
- Sürgüyü mikrobiyolojik güvenlik kabininden çıkarın.
- Mikrobiyolojik güvenlik kabininden çıkarken eldivenleri değiştirin.
- Kullanımdan sonra mikrobiyolojik güvenlik kabinini kapatmadan önce 10 dakika bekleyin (kapıyı kapatmadan önce mikrobiyolojik güvenlik kabininin ortamının steril olduğundan emin olmak için).
- Slaytı ısıtılmış kutunun plakasına yerleştirin. Isıtmalı kutuyu kapakla kapatın.
- Yağ daldırma hedefine yağ ekleyin.
- Isıtmalı kutuyu mikroskop sahnesine yerleştirin.
- Isıtmalı kutuyu ve lens ısıtıcısını açın.
NOT: Lens ısıtıcısı kullanımdan 1 saat önce açılmalıdır. - Isıtmalı kutunun ve lens ısıtıcı kontrol cihazlarının sıcaklık ayarlarını adım 3.4'te elde edilen değerlere göre ayarlayın.
- 5 dakika bekleyin (hem ısıtmalı kutu hem de objektif ısıtıcı için önceden belirlenmiş ayarlar kullanılırken numunenin sıcaklığını 37 °C'ye yükseltmek için gereken süre).
- Objektifin ucuyla kapak kaymasına dokunana kadar hedefe slayta yaklaşın.
5. Solunum siliyer kenarlarının görselleştirilmesi
- Yüksek hızlı video kamerayı mikroskopa sabitleyin, kamerayı bilgisayara bağlayın ve kamerayı açın.
- Bilgisayarı açın.
- Dijital yüksek hızlı videomikroskopi kamerasını yazılım aracılığıyla bilgisayara bağlayın (böylece oküler lenslerden görüntülenen görüntü monitöre yansıtılır).
- Yazılımı açın ve ardından Ana Menü otomatik olarak açılır (Şekil 6A).
NOT: Yazılım, laboratuvarda görüntü toplama ve işleme için kullanılan programdır. Sistem, video sekanslarının düşük kare hızında veya kare kare kaydedilmesini ve oynatılmasını sağlar. Ücretsiz olarak indirilebilir. - Kamera'yı açın (Şekil 6A).
- Fotoğraf makinesi numaralandırma filtresi göründüğünde Tamam'ı seçin (Şekil 6B).
- Listeyi Yenile'yi seçin; kameranın adını seçin; Arabirim: Uzman'ı seçin, sonra Aç'ı seçin (Şekil 6C).
- Dock cihazına yerleştirilmiş iletişim menüsünün üst kısmındaki fotoğraf makinesi kontrol satırında Canlı öğesini seçin (Şekil 6D).
- Görüntüyü görüntülemek için Oynat'ı ve görüntülemeyi bitirmek için Durdur'u seçin (Şekil 6D).
- Yazılımı açın ve ardından Ana Menü otomatik olarak açılır (Şekil 6A).

Şekil 6: Yazılımın kullanımının açıklaması: solunum siliyer kenarlarının monitöre görselleştirilmesi. (A) Ana Menü , yazılım açılırken doğrudan görünür. (b) Fotoğraf makinesi numaralandırma filtresini kapatın. (C) Fotoğraf makinesini seçin ve Arayüz: Uzman'ı seçin. (D) Canlı mod, mikroskopla görülen görüntünün monitörde görselleştirilmesini sağlar. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
- Fotoğraf makinesi alma ayarını yapın (sağ üst köşede) (Şekil 7).
- Edinme Ayarları'nda Kamera'yı seçin, sonra kare hızını ayarlayın: Hız (Hz): 500 (aşağıya bakın) (Şekil 7A).
- Edinme Ayarları'nda Kamera'yı seçin, sonra ilgi alanını (ROI) ayarlayın (Şekil 7A).
NOT: ROI, x100 yağa daldırma hedefiyle görüntülenen ve 50 μm'ye karşılık gelen piksel sayısını tanımlamak için monitöre yansıtılan dereceli bir ölçek kullanılarak hesaplanır (yaklaşık 50 μm ölçülerindeki siliyer kenarları kaydetmek istediğinizden (aşağıya bakın)). - Alma Ayarları'nda Kaydet'i seçin, sonra videonun süresini ve kaydedilen toplam kare sayısını ayarlayın (2 saniyelik bir süre, seçilen kare hızı 5OO Hz ise 1000 kareye karşılık gelir) (Şekil 7B).
NOT: Deneyimlerimize göre, hem CBF hem de CBP'nin tam bir analizine izin vermek için en az 2 saniyelik bir video uzunluğu gereklidir. - Yeni edinme ayarını kaydetmek için Dosya'yı ve ardından Fotoğraf Makinesi Cfg'sini Kaydet'i seçin (bu yeni yapılandırma için bir ad ve gerekirse bir yorum girin) (Şekil 7C,D).
- Bu yeni kamera yapılandırmasını açmak için Dosya ve Kamera Cfg'sini Yükle'yi açın (Şekil 7C).
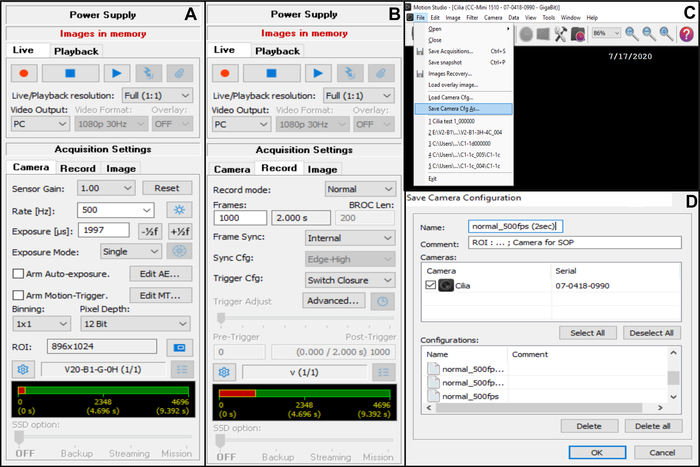
Şekil 7: Yazılımın kullanımının açıklaması: dövülmüş siliyer kenarların video kaydı için kamera edinme ayarlarının ayarlanması. (A) Kamera edinme ayarında, video kaydı için ilgi alanını (ROI) ve kare hızını (Hız) ayarlayın. (B) Kayıt edinme ayarında, video kaydının süresini ayarlayın (daha önce seçilen kare hızına göre, seçilen kayıt süresi için gereken kare sayısı). (C) Bu yeni fotoğraf makinesi yapılandırma ayarları, Fotoğraf makinesini kaydet Cfg işlevi kullanılarak kaydedilebilir . Kamera Cfg Yükle , daha fazla kullanım için kaydedilmiş yapılandırma ayarlarını yeniden açmanıza izin verir. (D) Yeni fotoğraf makinesi yapılandırma ayarları adlandırılabilir ve gerekirse bir yorum eklenebilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
- Oküler lenslerden görüntüleyin ve numune içindeki hücreleri veya kalıntıları arayın, ardından odaklanın.
- Görüntünün monitörde görünür olup olmadığını kontrol edin ve kondenseri (ve parazit kontrastlı lens kullanılıyorsa DIC prizması) ayarlayarak görüntünün kalitesini artırın ve gerekirse odağı ayarlayın.
- Kirpikli epitel şeritlerini arayın.
6. Solunum siliyer kenarları seçimi
NOT: Deneysel sistem, dövülen kirpiklerin üç ayrı düzlemde görülmesini sağlar: yanlara doğru bir profil, doğrudan gözlemciye doğru ve doğrudan yukarıdan dövülür (Şekil 8).
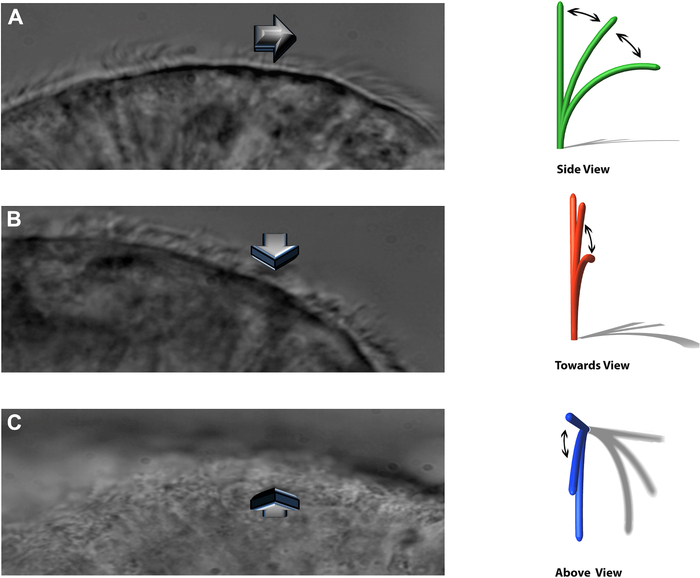
Şekil 8: DHSV tekniği, dövülen kirpiklerin üç ayrı düzlemde görülmesini sağlar. (A) yana doğru profilde. (B) doğrudan gözlemciye doğru ve (C) doğrudan yukarıdan vurmak. Kempeneers ve ark.16'dan çoğaltılmıştır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
- Yalnızca en az 50 μm uzunluğunda olan bozulmamış siliye epitel kenarlarını kaydedin.
- Yanlara doğru profilde yapılan kayıtlar için, Thomas ve ark.29 puanlama sistemine göre kenarın kalitesini belirleyin (Şekil 9). Siliyer fonksiyonel analiz için sadece normal kenarları (Şekil 9A) veya küçük çıkıntıları olan kenarları (Şekil 9B) kullanın. İzole edilmiş hücreleri hariç tutun (Şekil 9E).

Şekil 9: Thomas ve ark.29 tarafından siliyer epitel kenarlarının farklı kalitesi için puanlama sisteminin temsili görüntüsü. (A) Normal kenar: 50 μm uzunluğunda > bozulmamış üniform siliye epitel şeridi olarak tanımlanır (B) Küçük çıkıntılara sahip siliyer kenar: >50 μm uzunluğunda, epitel kenar çizgisinden dışarı çıkıntı yapan hücrelerle birlikte, ancak apikal hücre zarının hiçbir noktası bitişik hücreler üzerindeki kirpiklerin uçlarının üzerinde çıkıntı yapmayan bir kenar olarak tanımlanır (C) Büyük çıkıntılara sahip siliyer kenar: >50 μm uzunluğunda, epitel kenar çizgisinden dışarı çıkıntı yapan hücrelerle, apikal hücre zarının en az bir noktası, bitişik hücrelerdeki kirpiklerin uçlarının üzerinde çıkıntı yapan bir kenar olarak tanımlanır (D) İzole siliye hücre: >50 μm uzunluğundaki bir epitel kenarındaki tek siliyer hücre olarak tanımlanır (E) Tek hücreler: Kendi aralarında veya başka bir hücre tipinde teması olmayan siliyer hücreler olarak tanımlanır. Ölçek çubuğu: 5,5 μm. Thomas et al.29'dan çoğaltılmıştır Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- CFA'yı yalnızca mukus ve döküntü içermeyen kirpikler kullanarak ve kaydedilen kenar için seçilen profilde çırparak gerçekleştirin. Yalnızca kenar boyunca en az 2 CBF ve CBP değerlendirmesine (aşağıya bakınız) izin veren siliyer kenarları seçin.
- CFA için yalnızca yan profilde en az 6 kenar atan ve yukarıdaki kriterleri karşılayan numuneler için kullanın; Yanal profilde maksimum 20 kenarı analiz edin.
- CBP'yi karakterize etmek için gözlemci profilinin üstünden en az 1 ek kirpik kenarı kullanın.
7. Kirpikli kenarın kaydedilmesi
- Saniyede 500 karelik bir kamera kare hızı kullanarak dövülen kirpik kenarını kaydedin ve yüksek çözünürlüklü bir monitöre yansıtın. Hem CBF hem de CBP13'ün analizine izin vermek için minimum 400 Hz kare hızı gereklidir. Partikül boşluğunun verimliliğini değerlendirmek için bir kenarı saniyede 30 kare kare hızında kaydedin.
- Dock cihazına yerleştirilmiş iletişim menüsünün üst kısmındaki fotoğraf makinesi kontrol satırında Canlı'yı seçin (Şekil 6D)
- Görüntüyü görüntülemek için Oynat'ı ve görüntülemeyi bitirmek için Durdur'u seçin (Şekil 6D)
- Bir kenarı kaydetmek için, Kaydet düğmesine basın (Şekil 6D). Kaydetmeden önce kaydı görüntülemek için, dock edilmiş iletişim menüsünün üst kısmındaki kamera kontrol hattına gidin ve Oynatma'yı seçin. Kaydedilen videoyu görüntülemek için Oynat'ı ve görüntülemeyi bitirmek için Durdur'u seçin (Şekil 10A).
NOT: Kaydetmeden önce kaydedilen kenarı görüntülemeyi durdurun.
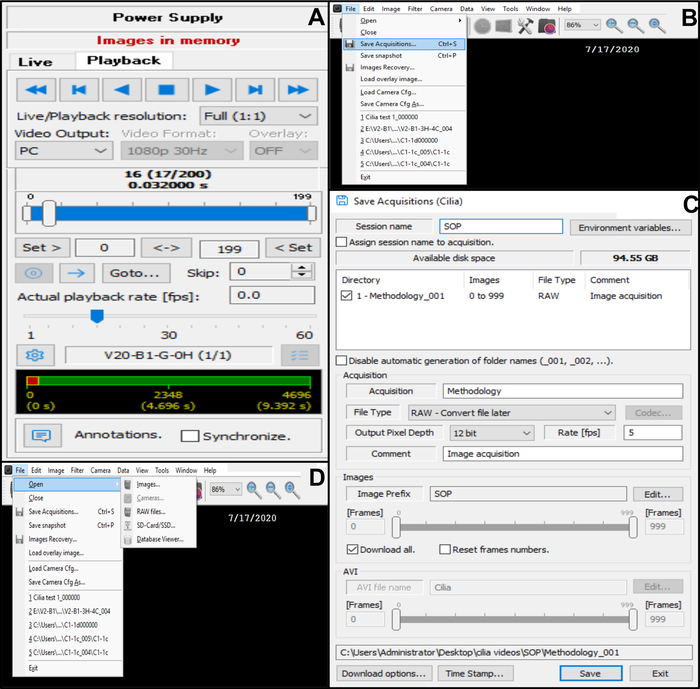
Şekil 10: Yazılımın kullanımının açıklaması. (A) oynatma modu. Kirpikli kenarın dövüldüğü kaydedilmiş bir video dizisini incelemek için, Oynatma Modu'nu seçin. Görüntüyü görüntülemek için Oynat'ı ve görüntülemeyi bitirmek için Durdur'u seçin. Şöhret oranı, siliyer fonksiyonun analizini iyileştirmek için ayarlanabilir (B, C) Dövülmüş kirpikli kenarların video kayıtlarını kaydetme (B) Videoyu kaydetmek için Dosya'yı ve ardından Edinmeleri Kaydet'i seçin. (C) Kaydedilen videonun adını girin ve videonun kaydedildiği yerleşimi seçin. Kaydın . RAW dosyası (D) Analiz edilecek kirpikli kenarların dövüldüğü bir kaydın seçimi: Bir video kaydını açmak için Dosya'yı, ardından Aç'ı ve ardından Görüntüler'i seçin. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
- Videoyu veritabanına kaydedin (Şekil 10B,C).
- Sol üst köşedeki Dosya'yı açın, ardından edinimleri kaydedin (Şekil 10B).
- Edinmeleri kaydet alanına, kaydedilen videonun adını girin ve kaydın RAW dosya türü biçiminde kaydedildiğinden emin olun (Şekil 10C).
- Video kaydedildiğinde, canlı moda geri dönün (dock edilmiş iletişim kutusu menüsünün üst kısmındaki fotoğraf makinesi kontrol satırına geri dönün ve canlı'yı seçin) (Şekil 6D).
- CFA için gerekli seçim kriterlerini karşılayan kenar sayısını kaydetmek için prosedürü tekrarlayın.
NOT: Seçim kriterlerini karşılayan birkaç dövme siliyer kenarını, slaytın hazırlanmasından sonraki en fazla 20 dakika içinde (kurumayı önlemek için) bir slayttan kaydetmek mümkündür. 20 dakika sonra, seçim kriterlerini karşılayan yeterli kenar elde etmek mümkün değilse, yeni bir slayt hazırlayın. - Slaytı ısıtılmış kutudan çıkarın.
- Dikdörtgen kapak kapağını çıkarın ve belirli tehlikeli tıbbi atık konteynerine atın.
- Slaytı (üzerine yapıştırılmış iki kare kapak fişi ile)% 70 etanol ve emici kağıtla temizleyin. Slayt temizlendikten sonra tekrar kullanılabilir.
- COVID-19 adaptasyonu: Sürgüyü kapak kayması ve ara parça ile birlikte hava geçirmez bir torbaya yerleştirin, eldivenleri ve maskeyi çıkarın ve hava geçirmez torbaya yerleştirin. Hava geçirmez torbayı belirli tehlikeli tıbbi atık konteynerine yerleştirin.
8. Siliyer fonksiyonel analiz
- Manuel CBF ve CBP değerlendirmesini gerçekleştirmek için ön hazırlık
- Yazılımı açın.
- Sol üst köşedeki Dosya'yı , ardından Aç'ı ve ardından Görüntüler'i açın (Şekil 10D).
- Analiz edilecek videoyu seçin.
- Dock cihazına yerleştirilmiş iletişim menüsünün üst kısmındaki fotoğraf makinesi kontrol satırına gidin ve Oynatma'yı seçin (Şekil 10A). Kaydedilen videoyu görüntülemek için Oynat'ı ve görüntülemeyi bitirmek için Durdur'u seçin.
- Manuel siliyer vuruş frekansı (CBF) analizi
- CBF değerlendirmesini yalnızca yanlara doğru kenarları kullanarak gerçekleştirin.
- Kirpikli kenarları, her biri yaklaşık 10 μm ölçen yaklaşık 5 bitişik alana bölün (Şekil 11).
- Kirpikleri veya kirpik gruplarını azaltılmış bir kare hızında tanımlayın ve görselleştirin ve her alanda maksimum 2 CBF ölçümü yapılır, bu da her kenar boyunca maksimum 10 CBF ölçümü ile sonuçlanır (Şekil 11).
- Bir grup kirpik grubunun 5 vuruş döngüsünü tamamlaması için gereken kare sayısını kaydedin.
- Basit bir hesaplamayla CBF'ye dönüştürün: (CBF= kayıt kare hızı (Hz)/(5 atım için kare sayısı) x 5)13,16,30. Hareketsiz kirpiklerin CBF'si 0 Hz13 olarak bildirilmiştir.
NOT: Kaydedilen videoları oynatırken kare hızını ayarlayın (Şekil 10A). Bu, özellikle kirpikler analiz edildiğinde çok yavaş attığında, kullanışlıdır. Kare hızını artırmak, kirpiklerin çok yavaş mı attığını yoksa hareketsiz mi olduğunu tanımlamaya yardımcı olur. - Her numune için, ortalama CBF'yi, statik kirpikler de dahil olmak üzere yanal profilde kaydedilen tüm CBF'lerin ortalaması (SD) veya% 95 CI olarak hesaplayın.
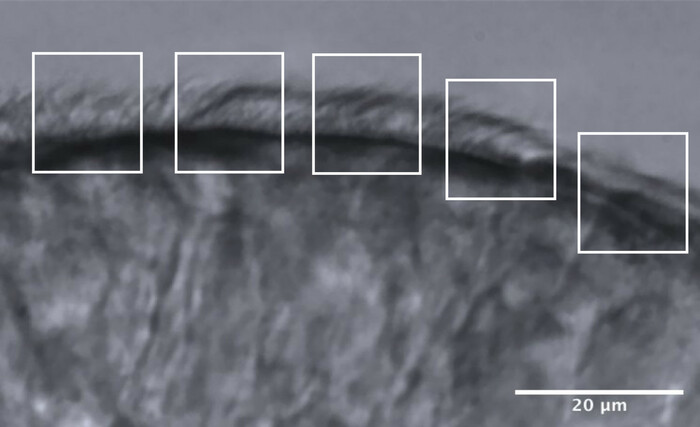
Şekil 11: Optimum kalitede bir kenarın temsili görüntüsü ve CFA analizine izin vermek için 5 alana bölünmesi. Optimum kalitede siliyer epitel kenarı, her biri 10 μm ölçülerinde 5 bitişik alana bölünür. Her alanda maksimum 2 CBF ölçümü (ve 2 CBP değerlendirmesi) yapılır ve her kenar boyunca maksimum 10 CBF ölçümü (ve CBP değerlendirmesi) elde edilir. Ölçek çubuğu = 20 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
- Manuel siliyer vuruş paterni (CBP) analizi
- Diskinezi belirteçlerini değerlendirmek için, yalnızca yan profili kullanın; CBP13 tipini karakterize etmek için uçakları gözlemciye doğru ve yukarıdan kullanın. CBP değerlendirmesi için farklı yöntemler ve puanlar mevcuttur. Aşağıda, diskinezi belirteçlerinin tanımı ile laboratuvarda kullanılan yöntem açıklanmaktadır.
- Numune içindeki her bir farklı CBP'nin yüzdesi
- Bir CBF ölçümü için tanımlanan ve kullanılan her kirpik veya kirpik grubu için (Şekil 11), düşük kare hızında bir CBP analizi yapın: tam bir vuruş döngüsü sırasında kirpikler tarafından alınan kesin yolu, DHSV analizinde gözlemlenen normal CBP ile karşılaştırın12,30.
- Analiz edilen her kirpik veya kirpik grubuna ayrı bir CBP (normal, hareketsiz, sert, dairesel, asenkron (koordine edilmemiş siliyer dayak) veya diskinetik13) atfedin.
- Her numune için, numune içindeki her bir farklı CBP'nin yüzdesini hesaplayın; Örneğe atfedilen CBP, gözlemlenen baskın CBP'dir.
- Diskinezinin 3 belirtecini hesaplayın.
- Hareketsizlik indeksini (IMI) hesaplayın: örneklem içindeki hareketsiz kirpiklerin yüzdesi (CBF sayısı = 0 / örneklemdeki toplam CBF okuma sayısı X 100). IMI'yi ortalama (SD) veya (% 95 CI) olarak ifade edin1,16,31.
- Diskinezi skorunu (DKS) hesaplayın. Her siliyer kenarı kadranlara bölün ve diskinetik (veya anormal şekilde dövülen) kirpiklere sahip kadranların sayısı belirlenir. Bu, 0 ile 4 arasında bir DKS'nin hesaplanmasına izin verir (0: kenar boyunca normal CBP; 1: kirpiklerin% 25'inde ≤ anormal CBP; 2: kirpiklerin% 50'sinde anormal CBP≤; 3: kirpiklerin% 75'inde anormal ≤ vuruş paterni; ve 4: tüm kirpiklerde anormal CBP). Örneklem16,29 için medyan DKS (çeyrekler arası aralık) hesaplanır.
- Normal dayak yüzdesini hesaplayın: örneklem içinde normal bir CBP'ye sahip kirpiklerin yüzdesi olarak tanımlanır (normal CBP okumalarının sayısı / örnek x100 için toplam CBP okumalarının sayısı).
Sonuçlar
Tekniğin etkinliğini göstermek için, CFA'nın sonuçlarını 16 sağlıklı yetişkin gönüllüden oluşan bir seride sunuyoruz (5 erkek, yaş aralığı 22-54 yaş).
Toplam 16 gönüllüden 14'ünden (4 erkek, yaş aralığı 24-54 yaş) alınan burun fırçalama örnekleri, CFA'yı gerçekleştirmek için gereken seçim kriterlerini karşılayan yeterli uygun epitel kenarları sağlamıştır. Bu 14 burun fırçalama örneğinden toplam 242 siliyer kenar kaydedildi ve 212 kenar tanımla...
Tartışmalar
Bu makale, COVID-19 pandemisi sırasında uygun enfeksiyon kontrolü hususları için yapılan ayarlamalarla birlikte, burun fırçalama örneklerini kullanarak CFA için standart bir çalışma prosedürü sağlamayı amaçlamaktadır. PCD tanısı zordur ve şu anda nazal nitrik oksit ölçümü, DHSV kullanarak CFA, iletim elektron mikroskobu (TEM) kullanarak siliyer ultrayapısal analiz, immünofloresan kullanarak siliyer proteinlerin etiketlenmesi ve PCD'ye neden olan genler için genetik test dahil olmak üzere ulu...
Açıklamalar
Bu yazarların açıklayacak hiçbir şeyleri yok.
Teşekkürler
Jean-François Papon, Bruno Louis, Estelle Escudier ve Paris-Est PCD tanı merkezinin tüm ekip üyelerine, PCD tanı merkezlerini ziyaret ettikleri ve sayısız değişim sırasında müsaitlikleri ve içten karşılamaları için teşekkür ederiz. Ayrıca Robert Hirst'e ve Leicester'ın PCD merkezindeki tüm ekip üyelerine karşılamaları, zamanları, tavsiyeleri ve uzmanlıkları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | FisherScientific | 352096 | 15 ml High-Clarity Polypropylene Conical Tube with lid |
| Amphotericin B | LONZA | 17-836E | Antifungal solution |
| Blakesley-weil nasal forceps | NOVO SURGICAL | E7739-12 | Used to hold the brush to perform the nasal brushing |
| Bronchial cytology brush | CONMED | 129 | Used for nasal brushing |
| Cotton swab | NUOVA APTACA | 2150/SG | Used for COVID-19 testing |
| Digitial high-speed videomicroscopy camera | IDTeu Innovation in motion | CrashCam Mini 1510 | |
| Glass slide | ThermoScientific | 12372098 | Microscope slides used to create the visualization chamber |
| Heated Box | IBIDI cells in focus | 10918 | Used to heat the sample |
| Inverted Light microscope | Zeiss | AXIO Vert.A1 | |
| Lens Heater | TOKAI HIT | TPiE-LH | Used to heat the oil immersion lens |
| Medium 199 (M199), HEPES | TermoFisher Scientific | 12340030 | Cell Culture Medium |
| Motion Studio X64 | IDT Motion | version 2.14.01 | Software |
| Oil | FischerScientific, Carl Zeiss | 11825153 | |
| Rectangular cover slip | VWR | 631-0145 | Used to cover the visualization chamber |
| Spacer (Ispacer) 0.25 mm | Sunjinlab | IS203 | Used for the creation of the hermetic closed visualization chamber |
| Square cover slip | VWR | 631-0122 | Used for the creation of lab-built open visualization chamber |
| Streptomycin/Penicillin | FisherScientific, Gibco | 11548876 | Antiobiotics solution |
Referanslar
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Ciliary beat pattern is associated with specific ultrastructural defects in primary ciliary dyskinesia. Journal of Allergy Clinical Immunology. 112 (3), 518-524 (2003).
- Werner, C., Onnebrink, J. G., Omran, H. Diagnosis and management of primary ciliary dyskinesia. Cilia. , 1-9 (2015).
- Kempeneers, C., Chilvers, M. A. To beat, or not to beat, that is question! The spectrum of ciliopathies. Pediatric Pulmonology. 53 (8), 1122 (2018).
- Lucas, J. S., et al. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. The European Respiratory Journal. 49 (1), (2017).
- Knowles, M. R., Zariwala, M., Leigh, M. Primary Ciliary Dyskinesia. Clinics in chest medicine. 37 (3), 449-461 (2016).
- Shapiro, A. J., et al. Diagnosis, monitoring, and treatment of primary ciliary dyskinesia: PCD foundation consensus recommendations based on state of the art review. Pediatric Pulmonology. , (2016).
- Fitzgerald, D. A., Shapiro, A. J. When to suspect primary ciliary dyskinesia in children. Paediatric Respiratory Reviews. , (2016).
- Shoemark, A., Dell, S., Shapiro, A., Lucas, J. S. ERS and ATS diagnostic guidelines for primary ciliary dyskinesia: similarities and differences in approach to diagnosis. European Respiratory Journal. 54 (3), (2019).
- Mirra, V., Werner, C., Santamaria, F. Primary ciliary dyskinesia: An update on clinical aspects, genetics, diagnosis, and future treatment strategies. Frontiers in Pediatrics. 5, 1-13 (2017).
- Ardura-Garcia, C., et al. Registries and collaborative studies for primary ciliary dyskinesia in Europe. European Respiratory Journal Open Research. 6 (2), (2020).
- Leigh, M. W., et al. Clinical features and associated likelihood of primary ciliary dyskinesia in children and adolescents. Annals of the American Thoracic Society. , (2016).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. The European respiratory journal. 34 (6), 1264-1276 (2009).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of Ciliary Beat Pattern in Three Different Beating Planes in Healthy Subjects. Chest. 151 (5), 993-1001 (2017).
- Götzinger, F., et al. COVID-19 in children and adolescents in Europe: a multinational, multicentre cohort study. The Lancet Child & Adolescent Health. , (2020).
- Yang, J., et al. Prevalence of comorbidities and its effects in coronavirus disease 2019 patients: A systematic review and meta-analysis. International Journal of Infectious Diseases. 94, 91-95 (2020).
- Brough, H. A., et al. Managing childhood allergies and immunodeficiencies during respiratory virus epidemics - The 2020 COVID-19 pandemic: A statement from the EAACI-section on pediatrics. Pediatric Allergy and Immunology. 31 (5), 442-448 (2020).
- Zou, L., et al. SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. The New England journal of medicine. 382 (12), 1177-1179 (2020).
- van Doremalen, N., et al. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England journal of medicine. 382 (16), 1564-1567 (2020).
- Tran, K., Cimon, K., Severn, M., Pessoa-Silva, C. L., Conly, J. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PloS one. 7 (4), 35797 (2012).
- Van Gerven, L., et al. Personal protection and delivery of rhinologic and endoscopic skull base procedures during the COVID-19 outbreak. Rhinology. 58 (3), 289-294 (2020).
- Marty, F. M., Chen, K., Verrill, K. A. How to Obtain a Nasopharyngeal Swab Specimen. New England Journal of Medicine. 382 (22), 76 (2020).
- Petruzzi, G., et al. COVID-19: Nasal and oropharyngeal swab. Head & Neck. 42, (2020).
- George, A., Prince, M., Coulson, C. Safe nasendoscopy assisted procedure in the post-COVID-19 pandemic era. Clinical Otolaryngology. , (2020).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PLoS ONE. 9 (2), (2014).
- Jorissen, M., Willems, T., Van der Schueren, B. Ciliary function analysis for the diagnosis of primary ciliary dyskinesia: advantages of ciliogenesis in culture. Acta oto-laryngologica. 120 (2), 291-295 (2000).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Stannard, W. A., Chilvers, M. A., Rutman, A. R., Williams, C. D., O'Callaghan, C. Diagnostic testing of patients suspected of primary ciliary dyskinesia. American Journal of Respiratory and Critical Care Medicine. 181 (4), 307-314 (2010).
- Boon, M., et al. Primary ciliary dyskinesia: critical evaluation of clinical symptoms and diagnosis in patients with normal and abnormal ultrastructure. Orphanet Journal of Rare Diseases. 9 (1), 11 (2014).
- Armengot, M., Milara, J., Mata, M., Carda, C., Cortijo, J. Cilia motility and structure in primary and secondary ciliary dyskinesia. American Journal of Rhinology & Allergy. 24 (3), 175-180 (2010).
- Papon, J. F., et al. Quantitative analysis of ciliary beating in primary ciliary dyskinesia: a pilot study. Orphanet Journal of Rare Diseases. 7 (1), 78 (2012).
- Wallmeier, J., et al. Mutations in CCNO and MCIDAS lead to a mucociliary clearance disorder due to reduced generation of multiple motile cilia. Molecular and Cellular Pediatrics. 2, 15 (2015).
- Boon, M., et al. MCIDAS mutations result in a mucociliary clearance disorder with reduced generation of multiple motile cilia. Nature Communications. 5 (6), 4418 (2014).
- Shapiro, A. J., et al. Diagnosis of Primary Ciliary Dyskinesia. An Official American Thoracic Society Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 197 (12), 24-39 (2018).
- Rubbo, B., et al. Accuracy of high-speed video analysis to diagnose primary ciliary dyskinesia. Chest. (19), 30205 (2019).
- Horani, A., Ferkol, T. W. Advances in the Genetics of Primary Ciliary Dyskinesia. Chest. 154 (3), 645-652 (2018).
- MacCormick, J., Robb, I., Kovesi, T., Carpenter, B. Optimal biopsy techniques in the diagnosis of primary ciliary dyskinesia. The Journal of Otolaryngology. 31 (1), 13-17 (2002).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Jackson, C. L., Goggin, P. M., Lucas, J. S. Ciliary Beat Pattern Analysis Below 37°C May Increase Risk of Primary Ciliary Dyskinesia Misdiagnosis. Chest. 142 (2), 543-544 (2012).
- Green, A., Smallman, L. A., Logan, A. C., Drake-Lee, A. B. The effect of temperature on nasal ciliary beat frequency. Clinical otolaryngology and allied sciences. 20 (2), 178-180 (1995).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Smith, C. M., et al. ciliaFA: a research tool for automated, high-throughput measurement of ciliary beat frequency using freely available software. Cilia. 1 (1), 14 (2012).
- Sisson, J. H., Stoner, J. a., Ammons, B. a., Wyatt, T. a. All-digital image capture and whole-field analysis of ciliary beat frequency. Journal of Microscopy. 211, 103-111 (2003).
- Blanchon, S., et al. Deep phenotyping, including quantitative ciliary beating parameters, and extensive genotyping in primary ciliary dyskinesia. Journal of Medical Genetics. , (2019).
- Feriani, L., et al. Assessing the Collective Dynamics of Motile Cilia in Cultures of Human Airway Cells by Multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Sears, P. R., Thompson, K., Knowles, M. R., Davis, C. W. Human airway ciliary dynamics. American Journal of Physiology - Lung Cellular and Molecular Physiology. 304 (3), 170-183 (2013).
- Quinn, S. P., et al. Automated identification of abnormal respiratory ciliary motion in nasal biopsies. Science translational medicine. 7 (299), (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır