Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Farelerde Transtorasik Dobutamin Stres Ekokardiyografi Kullanılarak Kardiyak Fonksiyondaki İnce Değişikliklerin Ortaya Çıkarılması
Bu Makalede
Özet
Sol ventrikül disfonksiyonu, bir dizi kardiyak bozukluk için son ortak yolu oluşturur. Burada, kardiyak hastalık fare modellerinin sol ventrikül fonksiyonunun kapsamlı bir şekilde değerlendirilmesi ve kardiyak fenotipleme için transtorasik dobutamin stres ekokardiyografi yaklaşımının ayrıntılı bir protokolünü sunuyoruz.
Özet
Sol ventrikül (LV) disfonksiyonu, çok sayıda kardiyak bozukluk için son yolu açar. İnsanlarda non-invaziv yüksek frekanslı transtorasik dobutamin stres ekokardiyografisi ile, kardiyak fonksiyondaki ince değişiklikleri maskelemek için indirgemeci bir araştırma yaklaşımı mümkün hale gelmiştir. Burada, stressiz kalplerde gizlenmiş kalp hastalığı modellerindeki değişikliklerin gözlemlenmesini sağlayan fizyoloji ve patolojide LV mimarisinin ve işlevinin genişletilmiş analizini kolaylaştırmak için bu tekniğin farelerde kullanılması için bir protokol sunuyoruz. Bu araştırma bir ve aynı hayvanda yapılabilir ve hem bazal hem de farmakolojik olarak stres kaynaklı ölçümlere izin verir. Uygun anestezi, görüntülemeye dayalı LV analizi, gözlemci içi ve gözlemciler arası değişkenliğin dikkate alınması ve yakın fizyolojik koşullar altında intraperitoneal dobutamin enjeksiyonundan sonra farelerde elde edilebilecek pozitif inotrop yanıtı elde edilmesi için ayrıntılı kriterleri özetledik. Küçük hayvan modellerinde insan fizyolojisinin ve hastalığının özelliklerini özetlemek için, değerlendirmedeki kritik tuzakları, örneğin farelerde belirgin bir Bowditch etkisini vurguluyoruz. Translasyon hedeflerini daha da karşılamak için, insanlarda ve farelerde stresin neden olduğu etkileri karşılaştırıyoruz. Translasyonel çalışmalarda kullanıldığında, fareler ve insanlar arasındaki fizyolojik farklılıklara dikkat edilmelidir. Deneysel titizlik, hastalarda değerlendirilen bazı parametrelerin, fare modellerinde uzamsal ve zamansal çözünürlükteki kısıtlamalar nedeniyle yalnızca dikkatli bir şekilde kullanılabileceğini belirtir.
Giriş
İnsanlarda birçok kardiyak hastalığın ayırt edici özelliği, sol ventrikülün (LV) sistolik ve/veya diyastolik fonksiyonel bozukluğudur. Kalp yetersizliği semptomları olan hastalarda yapısal anormalliklerin saptanması, sistolik kalp yetmezliğinin tanısı ve yönetimi ile diyastolik fonksiyonun değerlendirilmesi için ekokardiyografi temel bir değerlendirme yöntemi olarak kullanılmaktadır.
Semptomlar spesifik olmadığından ve kalp yetmezliği klinik sendromu olan hastaların üçte birinden fazlası gerçek kalp yetmezliğinden muzdarip olmayabileceğinden, hastanın klinik sunumu için objektif bir ekokardiyografik korelasyon bulmak önemlidir1. Ayrıca, dinlenme veya statik durumda gizli olan bazı semptomlar, aktivite veya stres koşulları altında ortaya çıkabilir. Koroner arter hastalığı olan hastalarda, koroner perfüzyonda zaten küçük olan değişiklikler bölgesel duvar hareket anormalliklerine yol açabilir. Bununla birlikte, bu ince değişiklikler geleneksel ekokardiyografi kullanılarak değerlendirilemez, çünkü kalp hastalığındaki değişiklikler stressiz kalplerde gizlenebilir. Kardiyak fizyopatolojinin daha derin bir şekilde anlaşılmasını sağlamak için stres ekokardiyografi, egzersiz veya farmakolojik olarak indüklenen stres koşulları altında miyokardiyal yapı ve fonksiyonun dinamik bir değerlendirmesini sağlar ve semptomların kardiyak bulgularla eşleştirilmesine izin verir2. Ayrıca, küçük hayvanlarda, bu yöntem non-invaziv güvenilir bir in-vivo aracı temsil eder 3,4,5. İnsanlarda olduğu gibi, miyokardın stres reaksiyonu farelerde ve sıçanlarda farmakolojik ajanlar yoluyla indüklenebilir. Dobutamin sık kullanılan bir ilaçtır ve dobutamin stres ekokardiyografisi insanlarda yaygın olarak yapılır 6,7, ancak bazen kardiyak stres reaksiyonunu değerlendirmek için küçük hayvan modellerinde kullanılır 8,9,10,11. Dobutamin, kalbin pozitif inotropisi ve kronotropisi ile sonuçlanan, ağırlıklı olarak β1-agonistik etkiye sahip sentetik bir katekolamindir. İnsandan fareye doğru bir çeviri elde etmek için, ekokardiyografinin teknolojisi ve kavramsal çerçevesi, örneğin faredeki küçük boyut ve hızlı kalp atış hızı ile ilgili teknik sınırlamalar dikkate alınmalıdır. Dobutamin stres ekokardiyografide insan hedef kalp atış hızı [(220-yaş) x 0.85] olup, sağlıklı gönüllülerde ortalama kalp hızı yaklaşık 150 ± %10'luk bir artışa neden olur12,13. Fareler için böyle bir formül eksiktir. İnsanlarda stres ekokardiyografi ile ejeksiyon fraksiyonunun (EF) %5-20 oranında arttığı tanımlanmıştır12,14. Farelerde EF, kalp atış hızına bağlı olarak %58 ±ila %11 (< 450 bpm) ile %71 ± %11 (≥ 450 bpm) arasında rapor edilir ve daha yüksek kalp atış hızlarıyla yaklaşık %20 oranında değişir4. Farelerde kalp debisini artıran ana mekanizma, kalp atış hızındaki bir artıştır. Bu mekanizmadan kısmen sorumlu olan, farelerde insanlardan daha belirgin olan, frekansa bağlı kalsiyum aracılı pozitif inotropik bir kardiyak yanıt olan Bowditch etkisi veya merdiven fenomenidir15,16. Ek olarak, (stres) ekokardiyografi gözlemci içi ve gözlemciler arası değişkenliğin temelini oluşturur. Bu nedenle, yüksek düzeyde standartlaştırılmış bir prosedür vazgeçilmezdir17,18.
Burada, sağlık ve hastalık modellerinde farelerde kardiyak fonksiyondaki ince değişiklikleri çözmek için standartlaştırılmış görüntüler elde etmek için dobutamin stres ekokardiyografisinin ayrıntılı prosedürünü sunuyoruz. Anahtar bileşenler arasında yeterli anestezi, yeterli kalp atış hızı monitörizasyonu ve farelerde strese bağlı görüntülemedeki olası tuzaklar yer alır. Anahtar parametreler, LVEF'in dikkate alınması da dahil olmak üzere sistolik ve diyastolik fonksiyonun değerlendirilmesidir. Fareler, art yüke bağlı kardiyak disfonksiyona17 dirençli olduğundan, bu protokol kalp kapak hastalığı modellerinde de kullanım için değerli bilgiler ekleyebilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm yöntem ve prosedürler, ilgili tüm yönetmeliklere ('Deneysel ve Diğer Bilimsel Amaçlarla Kullanılan Omurgalı Hayvanların Korunmasına İlişkin Avrupa Sözleşmesi' (Direktif 2010/63/EU) uygun ve uyumlu olarak gerçekleştirildi ve hayvan bakımı kurumsal yönergelere uygun olarak yapıldı. İnsan deneklerden elde edilen veriler, insan refahı için tüm kurumsal, ulusal ve uluslararası yönergelere uygun olarak analiz edildi ve Yerel Etik Kurul (20-9218-BO) tarafından onaylandı. Tüm deneyler 12 haftalıkken erkek C57BL / 6JRj ile gerçekleştirilmiştir.
1. Malzeme ve ekipmanın hazırlanması
NOT: Şekil 1 , küçük hayvan ultrason çalışma alanının bir örneğini göstermektedir.
- Kısılabilir ışıklı, sessiz, kontrollü bir ortamda çalıştırdığınızdan emin olun.
- Ultrason jelini, örneğin bir jel ısıtıcı kullanarak önceden ısıtın. Jelinin 37 °C'ye kadar ısınmasına izin verin. Bu biraz zaman alabilir.
- Platform dahil tüm aletleri dezenfektan mendille temizleyin.
- Platformu açın ve 37 °C'ye ısıtın.
- Ultrason makinesini açın. Hayvan kimliği ve protokol kimliğinin yanı sıra diğer ilgili bilgileri girin. Yaklaşık 30 g vücut ağırlığına sahip fareler için 30 MHz'lik bir merkez iletimine sahip yüksek frekanslı bir ultrason dönüştürücü kullanın.
- Aktif bir gaz boşaltma sistemi ile çalıştığınızdan emin olun.
NOT: Solunan akışta izofluranı adsorbe etmek için aktif karbon filtresi kullanılıyorsa, belirtilen maksimum ağırlık artışına ulaşıldığında ağırlığı kontrol ettiğinizden ve filtreyi değiştirdiğinizden emin olun. - Gerekirse, buharlaştırıcıyı yeterli miktarda izofluran ile doldurun.
DİKKAT: Uçucu anestezikleri solumayın. - Kullanıma hazır bir enjeksiyon çözeltisinin seyreltilmesiyle veya üreticinin talimatına göre dobutamin hidroklorür tozunu %0,9 tuzlu su içinde çözerek 2,5 μg/μL'lik bir dobutamin çalışma çözeltisi hazırlayın. Çözelti, oda sıcaklığında saklandığında en az 24 saat stabildir.

Resim 1: Küçük hayvan kardiyak ultrason çalışma alanı. Muayene sürelerinin kısa kalması gerektiğinden, küçük hayvan stres ekokardiyografisi için ergonomik bir ayar vazgeçilmezdir. İşyeri, bir ultrason makinesi, oksijen beslemeli ve aktif gaz egzozlu bir küçük hayvan anestezi sistemi, entegre bir ray sisteminin parçası olarak gömülü EKG ve mikromanipülatörler aracılığıyla hareket kabiliyetine sahip ısıtmalı bir ekokardiyografi platformu ve bir fizyolojik izleme ünitesinden oluşmaktadır. Ultrason jelini ısıtmak için bir jel ısıtıcı ve bir ısı lambası yararlı yardımcılardır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Farenin görüntüleme ve anestezi indüksiyonu için hazırlanması
- İndüksiyon odasını oksijenle zenginleştirilmiş bir gaz karışımında (1 L / dak% 100 O2 ile) %3-4 v/v izofluran ile doldurun.
- Fareyi tartın. Fareyi yavaşça kuyruğundan alın ve indüksiyon odasına aktarın. Hayvanın hareketlerini yakından gözlemleyerek hayvanın birkaç saniye içinde sakinleştirildiğinden emin olun.
- Gerekirse, anestezi sistemine bağlı burun konisine giden gaz akışını değiştirin (stabil bir sedasyon sağlamak için 1 L / dak %100 O2 ile 1.0-1.5 hacimce %100 izofluran). Fareyi indüksiyon odasından çıkarın ve önceden ısıtılmış platforma dikkatlice yerleştirin. Pençelerin platforma gömülü EKG sensörlerinin üzerinde olduğundan emin olun.
- Skleranın kurumasını önlemek için, her iki göze de merhem jeli sürün.
NOT: Stres ölçümleri zaman alacaktır. - EKG sensörlerine çok az miktarda elektrot kremi sürün. Hayvanı dört uzuvda da yapışkan bantla nazikçe sabitleyin. Hayvanın burun konisindeki baş pozisyonunu sabitlemek için küçük bir parça yapışkan bant kullanın. EKG, görüntü alımı sırasında kalp atış hızını kaydetmek için kullanılır. Stabil ve net bir EKG sinyali için fizyolojik görüntüleme sistemini ayarlayın.
NOT: Çok fazla elektrot kremi EKG sinyal kalitesinin bozulmasına neden olabilir. - İşlem sırasında hayvanı stresten korumak için, kalp atış hızı aralığını 400-450 bpm'de tutarak yeterli sedasyon derinliğini kontrol edin. Kalp atış hızı EKG ile elde edilir. Aralık içinde 50 bpm'lik bir değişiklik kabul edilebilir.
NOT: Hayvanın hareketleri çok dar bir sedasyon seviyesine işaret edebilir. Anestezi, farenin kardiyo-depresyonuna yol açmamalıdır. Sedasyon, yukarıda belirtilen hedef kalp atış hızını elde etmek için ayarlanabilir. - Yağlama kullanarak, vücut sıcaklığının sürekli izlenmesi için nazikçe bir rektal termometre yerleştirin. Sıcaklığı fizyolojik aralıkta tutun (fare türüne ve deney düzeneğine bağlı olarak normalde 36,5 °C ile 37,5 °C arasında). Çevresel olarak kontrol edilmeyen bir hayvan kardiyak ultrason laboratuvarında, kızılötesi aydınlatmanın kullanılması düşünülebilir.
- Göğüsteki vücut kıllarını almak için kimyasal tüy dökücü krem kullanın. Göğsü silerek temizlemek için temiz, nemli bir kağıt havlu kullanın. Kalan tüm krema bileşenlerini çıkardığınızdan emin olun (Şekil 2A).
NOT: Tüy dökücü uygulamadan önce elektrikli kesme makinesi de kullanılabilir. Hayvan artık görüntüleme için hazırlanmıştır. Görüntüleme süresini kısa tutmak kritik olduğundan, görüntüleme öncesi tüm hazırlık 3 dakikadan az sürmelidir.
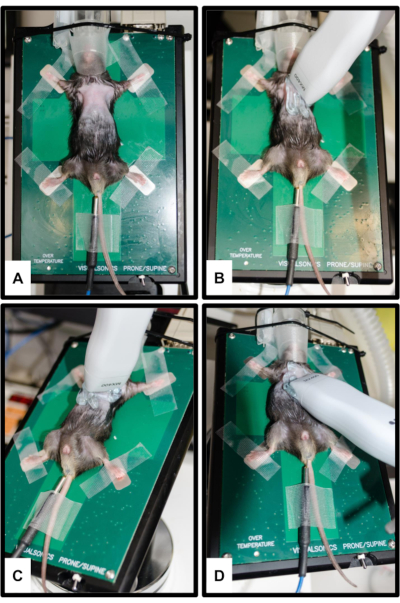
Şekil 2: Hayvan ve dönüştürücü konumlandırma. (A) Fare, dört uzuv da gümüş EKG elektrotlarına sabitlenmiş olarak ısıtılmış platforma bağlanır. Vücut ısısı ölçümü için bir rektal termometre yerleştirilir. Burun, anestezi sisteminin burun konisine nazikçe yerleştirilir. (B) Parasternal uzun eksen görünümü (PSLAX) için prob oryantasyonu; Adım 3.2'ye bakın. (C) Parasternal kısa eksen görünümü (PSSAX) için prob oryantasyonu; Adım 3.3'e bakın. (D) Apikal dört odacıklı görünüm (4CH) için prob oryantasyonu; Adım 3.4'e bakın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Temel kardiyovasküler görüntüleme
NOT: Görüntüler, iki temel dönüştürücü pozisyonu (parasternal ve apikal ultrason penceresi) (Şekil 2) ve en az üç ultrason modalitesi (B (doğruluk) modu, M (otion) modu ve Doppler modu (renkli doppler ve darbeli dalga (PW) doppler) kullanılarak elde edilebilir (Şekil 3, Şekil 4, Şekil 5). Görüntülemenin temelleri için lütfen daha önce yayınlanmışmakalelere bakın 16,18. Daha sonra elde edilen stres görüntüleri ile karşılaştırma için net görüntüler elde etmek çok önemlidir.
- Önceden ısıtılmış ultrason jelini göğsünüze kabarcıksız olarak uygulayın.
NOT: Isıtılmamış ultrason jeli, kalp atış hızını etkileyecek hızlı vücut ısısı kaybına neden olur. - Parasternal uzun eksen (PSLAX) görünümü gerçekleştirin.
NOT: PSLAX, LV'yi uzun ekseninde görselleştirmek için gerçekleştirilir. Bununla, örneğin aort kökü boyutları ve proksimal aort boyutunun yanı sıra LV uzunluğu da elde edilebilir.- Baş araştırmacıdan uzağa bakacak şekilde, kalbi mümkün olduğunca öne getirmek için masayı yaklaşık 10-20 ° sola ve 5-10 ° öne doğru eğin. Dönüştürücüyü, işaretleyici (çentik) hayvanın sağ omzuna bakacak şekilde kalbin uzun ekseni ile aynı hizada parasternal olarak yerleştirin (Şekil 2B).
- En uygun görünümü ayarlamak için mikro manipülatörleri kullanın. Görüntüyü optimize etmek için görüntü kontrol paneli kontrollerini kullanın. Midventriküler seviyede en az bir 2D B modu resmi ve bir M modu resmi elde edin.
- Belirli bir soru için gerekirse herhangi bir ek resim edinin. En az 100 kare ve en az 3 (-6) tam kardiyak döngü elde edin.
- Parasternal kısa eksen (PSSAX) görünümü gerçekleştirin.
NOT: PSSAX, LV'yi kısa ekseninde görselleştirmek için gerçekleştirilir. Bu açıdan bakıldığında, örneğin sol ventrikül sistolik sonu hacmi (LVESV), sol ventrikül diyastol sonu hacmi (LVEDV), strok hacmi (SV) ve kardiyak debi (CO) hesaplanabilir.- Açıyı değiştirmeden dönüştürücüyü saat yönünde 90° çevirin (işaretleyici şimdi hayvanın sol omzunu gösteriyor) (Şekil 2C). Bazal, midventriküler (papiller kasların seviyesi) ve apikal görünümde en az bir B modu görüntüsü elde edin.
- En bazal ve en apikal görünümü tanımlamak için, uzun eksen boyunca, LV odasının tam kardiyak döngüsünün hala görülebildiği en uzak noktalara kaydırın. Orta ventrikül seviyesinde, yaklaşık olarak papiller kaslar seviyesinde bir ara pozisyonda görüntü alın.
- Midventriküler görünümde en az bir M modu görüntüsü elde edin.
NOT: Bazı ultrason makineleri, farklı görünümler için ön ayarlar sağlar; Görüntüleri almadan önce yeterli ön ayarı kontrol etmeniz önerilir.
- Apikal dört odacıklı (4CH) görünüm gerçekleştirin.
NOT: 4CH önemlidir çünkü öncelikle PW doppler kullanarak mitral kapağı değerlendirmek için kullanılabilir.- Hayvanın modifiye edilmiş bir Trendelenburg pozisyonunda olduğu platformu, başı aşağı gelecek şekilde eğin. Dönüştürücüyü, işaretleyici hayvanın sol tarafına bakacak şekilde farenin kafasına doğru eğin (Şekil 2D).
- Mitral ve triküspit kapağın en az bir B modu görüntüsünün yanı sıra renkli doppler ve PW doppler görüntüsü elde edin. Deneysel soruya bağlı olarak, 4CH görünümünde doku dopplerini uygulayın.
NOT: Apikal 4CH konumuna ulaşmanın en kolay yolu, masayı PSAX görünümünden eğmek ve dönüştürücüyü açılandırmaktır. Göğüs kafesine çok fazla baskı uygulamamaya dikkat edin, çünkü bu, örneğin diyastolik fonksiyon ölçümlerini etkileyebilir.
4. Dobutamin stres görüntüleme
NOT: Hedef kalp atış hızına ulaşıldığında, hedef kalp atış hızı sabit olduğu sürece standartlaştırılmış görünümler elde edilmelidir. Bu genellikle PSLAX ve PSSAX arasında birden fazla geçiş gerektirir. PSLAX ve PSSAX arasındaki geçiş yalnızca 90° döndürme gerektirdiğinden, görünümler kolayca görüntülenebilir.
- Karşılaştırılabilirliği sağlamak için aynı anesteziyi koruyarak bir ve aynı hayvanda dobutamin stres testi yapın. Başlangıç kalp atış hızının 400-450 bpm aralığında sabit kaldığından emin olun. EKG okumalarını kaydedin ve elde edilen görüntülerle birlikte ve üzerine kaydedin. EKG sinyalinin net olduğundan emin olun. Aksi takdirde, net bir EKG sinyali görüntülenene kadar dört uzvu da yeniden bantlamayı deneyin.
- Yine, PSLAX görünümünü gerçekleştirin (B modu ve M modu görüntüleri). Görüntüleri "temel" görüntü olarak kaydedin. İlk kalp atış hızını da kaydetmek ve aklınızda bulundurmanız gerektiğinden emin olun.
- Şırıngayı önceden doldurun ve 27 G iğne ve 1 mL şırınga kullanarak intraperitoneal olarak 5 μg / g vücut ağırlığı dobutamin enjekte edin. Kalp atış hızını yakından izleyin. Hedef kalp atış hızına ulaşılana kadar ekokardiyografik görüntüleri kaydedin ve daha sonra analiz etmek için kalp atış hızındaki artışı kullanın. Dobutamin dozuna bağlı olarak yaklaşık 1 dakika sonra %15-30'luk bir artıştan sonra sürdürülebilir anlamlı bir dobutamin kaynaklı kalp hızı artışına ulaşılır.
NOT: Enfeksiyonları önlemek için her hayvan için her zaman tek kullanımlık steril enjeksiyon iğneleri kullanın. Dobutamin duyarlılığı ve (alt) maksimal yük, fare suşuna göre değişebilir ve deney düzeneğine bağlı olabilir ve ön deneylerde tanımlanmalıdır. Dobutamin dozunun deney düzeneğine göre ayarlanması önerilir.
DİKKAT: Keskin ve potansiyel bulaşıcı maddelerin kullanımı için kurumsal yönergeleri izleyin. İğneyi her zaman onaylı bir tıbbi atık kabına atın! - Hedef kalp atış hızına ulaşıldığında ve yaklaşık 30 saniye boyunca sabit kaldığında, 3. adımda açıklandığı gibi PSLAX B modu ve M modu görüntülerini alın.
- Yine, PSSAX elde etmek için dönüştürücüyü saat yönünde çevirin view adım 3'te açıklandığı gibi. Burada, bazal, midventriküler (papiller kas seviyesi) ve apikal seviye ve midventriküler (papiller kas seviyesi) seviyenin B modu görüntülerini elde edin. Hedef kalp atış hızının sabit kaldığından emin olun. Aksi takdirde, PSLAX konumuna geri dönün ve tekrar görüntülemeye başlayın.
NOT: Sürekli dobutamin12 infüzyonu olmadan kalp atış hızı düşeceğinden (bu makalede ele alınmamıştır), görüntüler iki dakika içinde alınmalıdır. PSLAX ve PSSAX görüntüleri, ilgili stres kaynaklı ölçümlerin çoğu için gereklidir ("Temsili Sonuçlar" bölümüne bakın). - Şimdi, apikal 4CH view tekrar (adım 3.4'te açıklandığı gibi). PW doppler kullanarak, ilgilenilen akış modellerini ölçün (adım 3.4.2.'de açıklandığı gibi). Gerilmemiş koşullar altında, PW doppler kullanılarak, biri ventrikülün pasif dolgusunu (E (arly) dalgası) ve diğeri atriyal kasılma sonrası aktif dolguyu (A (deneme) dalgası) temsil eden iki karakteristik dalga ölçülür. Artan kalp atış hızlarıyla, bu dalgalar kaynaşma eğilimindedir ve dobutamin kaynaklı stres altında belirgin bir şekilde ölçülemeyebilir.
5. Son adımlar
- Yaklaşık 5 dakika sonra kalp atış hızı tekrar düşmeye başladığında, tüm görüntülerin yakalandığından emin olun.
- Ultrason jelini temiz, nemli bir kağıt havlu kullanarak göğsünden nazikçe çıkarın. Bant sabitlemesini dikkatlice çıkarın. Bıyıkları dışarı çekmekten kaçınmak için hayvanın kafasını sabitleyen banda özellikle dikkat edin.
- Anesteziyi kapatın. Aktif bir gaz egzozu kullanıyorsanız, gaz tükenmesine devam ettiğinizden emin olun. Uyanma süresi boyunca hayvanı ayrı bir ısıtılmış kafeste bir kağıt havlu üzerine yerleştirin. Hayvanı yakından gözlemleyin. Sternal yaslığı sürdürmek için yeterli bilinci yeniden kazanana kadar gözetimsiz bırakılmamalıdır. Uyandıktan ve tamamen iyileştikten sonra hayvanı kafesine aktarın.
NOT: Bu tekniğin nihai olmayan karakteri nedeniyle, hayvan ilgili tüm düzenlemelere uygun olarak deney içinde kalabilir.
6. Çevrimdışı değerlendirme
- Kardiyak fonksiyonun ayrıntılı değerlendirmesini yapmak için görüntü verilerini bir çalışma istasyonundaki çevrimdışı analiz yazılımına aktarın. Stressiz ve stresli kalp fonksiyonu arasındaki farka özellikle dikkat edin. Kalp atış hızı her zaman kaydedilmeli ve sunulmalıdır.
NOT: Yazılım analizi farklı yazılımlar arasında farklılık gösterdiğinden, bu protokol kapsamında yer almamaktadır. Lütfen üreticinin talimatlarına bakın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
PSLAX'ta elde edilen fizyolojik stressiz ekokardiyografik görüntü Şekil 3'te gösterilmiştir. Diyastolde, ventrikül duvarları düzgün görünür (Şekil 3A) ve belirli bir dereceye kadar kalınlaşır (Şekil 3B,C). 5 μg/g vücut ağırlığı dobutamin i.p. enjeksiyonu, kalp atış hızında (pozitif kronotropik etki)12
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Kardiyak fonksiyonun strese bağlı değerlendirmesi, insanlarda egzersiz testi veya farmakolojik stres testi kullanılarak klinik bir ortamda yaygın olarak kullanılmaktadır 6,7. Farelerin egzersiz sonrası hemen ekokardiyografisi sedasyon ihtiyacı nedeniyle çok sınırlı olduğundan, dobutamin kaynaklı stres ekokardiyografisinin strese bağlı kardiyak fizyopatolojiyi değerlendirmek için en translasyonel yöntem olması...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Yazarlar aşağıdaki finansman kaynaklarını kabul etmektedir: Alman Araştırma Vakfı (UMEA Genç Klinisyen Bilim Adamı, Stephan Settelmeier; RA 969/12-1, Tienush Rassaf; HE 6317/2-1, Ulrike Hendgen-Cotta), Else-Kroener-Fresenius-Stiftung (2014_A216, Tienush Rassaf).
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Activated Charcoal Filter | UNO BV | 180000140 | http://www.unobv.com/Rest%20Gas%20Filters.html |
| Aquasonic 100 Ultrasound Transmission Gel | Parker Laboratories | 001-02 | https://www.parkerlabs.com/aquasonic-100.asp |
| Chemical Hair removal lotion | General Supply | - | |
| Cotton Swaps | General Supply | - | |
| ddH2O | General Supply | - | |
| Dobutamine | Carinopharm | 71685.00.00 | https://www.carinopharm.de/stammsortiment/#103 |
| Flowmeter for laboratory animal anesthesia | UNO BV | SF3 | http://www.unobv.com/Flowmeters.html |
| Gas Exhaust Unit | UNO BV | - | http://www.unobv.com/Gas%20Exhaust%20Unit.html |
| Heating Lamp | Philips | - | |
| Induction Box | UNO BV | - | http://www.unobv.com/Induction%20box.html |
| Medical Sharps Container | BD | 305626 | https://legacy.bd.com/europe/safety/de/products/sharps/ |
| MX400 ultrasound transducer (20-46 Mhz) | VisualSonics | MX400 | https://www.visualsonics.com/product/transducers/mx-series-transducers |
| Octenisept disinfectant | Schuelke | 173711 | https://www.schuelke.com/de-de/produkte/octenisept.php |
| Omnican F syringe with needle 1ml | B. Braun | 9161502S | https://www.bbraun.de/de/products/b60/omnican-f.html |
| Paper Towels | General Supply | - | |
| Signacreme Electrode Cream | Parker Laboratories | 017-05 | https://www.parkerlabs.com/Signacreme.asp |
| Standard Gauze Pads | BeeSana Meditrade | 4852728 | https://www.meditrade.de/de/wundversorgung/verbandstoffe/beesana-mullkompresse/ |
| Thermasonic Gel Warmer | Parker Laboratories | 82-03-20 CE | https://www.parkerlabs.com/thermasonic_apta_sbp.asp |
| Transpore Tape | 3M | 1527NP-0 | https://www.3mdeutschland.de/3M/de_DE/unternehmen-de/produkte/~/3M-Transpore-Fixierpflaster/ |
| Vaporizer Sigma Delta | UNO BV | - | http://www.unobv.com/Vaporizers.html |
| Vevo 3100 high-frequency preclinical ultrasound imaging system | VisualSonics | Vevo3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100 * required software package: Cardiovascular package; B-mode, M-mode, pulsed-wave doppler mode |
| Vevo Imaging Station with integrated rail system, heated platform and physiological monitoring unit | VisualSonics | - | https://www.visualsonics.com/product/accessories/imaging-stations |
| VevoLab Analysis Software | VisualSonics | Vers. 3.2.5 | https://www.visualsonics.com/product/software/vevo-lab *required software package: Vevo Strain, LV analysis |
Referanslar
- Oh, J. Echocardiography in heart failure: Beyond diagnosis. European Journal of Echocardiography. 8 (1), 4-14 (2007).
- Lancellotti, P., et al. The clinical use of stress echocardiography in non-ischaemic heart disease: Recommendations from the european association of cardiovascular imaging and the american society of echocardiography. Journal of the American Society of Echocardiography. 30 (2), 101-138 (2017).
- Lindsey, M. L., Kassiri, Z., Virag, J. A. I., de Castro Bras, L. E., Scherrer-Crosbie, M. Guidelines for measuring cardiac physiology in mice. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 733-752 (2018).
- Zacchigna, S., et al. Toward standardization of echocardiography for the evaluation of left ventricular function in adult rodents: a position paper of the ESC Working Group on myocardial function. Cardiovascular Research. , 110(2020).
- Hendgen-Cotta, U. B., et al. A novel physiological role for cardiac myoglobin in lipid metabolism. Scientific Reports. 7, 43219(2017).
- Al-Lamee, R. K., et al. Dobutamine stress echocardiography ischemia as a predictor of the placebo-controlled efficacy of percutaneous coronary intervention in stable coronary artery disease: The stress echocardiography-stratified analysis of ORBITA. Circulation. 140 (24), 1971-1980 (2019).
- Cadeddu Dessalvi, C., Deidda, M., Farci, S., Longu, G., Mercuro, G. Early ischemia identification employing 2D speckle tracking selective layers analysis during dobutamine stress echocardiography. Echocardiography. 36 (12), 2202-2208 (2019).
- Li, Z., et al. Reduced myocardial reserve in young x-linked muscular dystrophy mice diagnosed by two-dimensional strain analysis combined with stress echocardiography. Journal of the American Society of Echocardiography. 30 (8), 815-827 (2017).
- Puhl, S. L., Weeks, K. L., Ranieri, A., Avkiran, M. Assessing structural and functional responses of murine hearts to acute and sustained beta-adrenergic stimulation in vivo. Journal of Pharmacological and Toxicological Methods. 79, 60-71 (2016).
- Ferferieva, V., et al. Assessment of strain and strain rate by two-dimensional speckle tracking in mice: comparison with tissue Doppler echocardiography and conductance catheter measurements. European Heart Journal Cardiovascular Imaging. 14 (8), 765-773 (2013).
- Wiesmann, F., et al. Dobutamine-stress magnetic resonance microimaging in mice : acute changes of cardiac geometry and function in normal and failing murine hearts. Circulation Research. 88 (6), 563-569 (2001).
- Pellikka, P. A., et al. Guidelines for performance, interpretation, and application of stress echocardiography in ischemic heart disease: From the American Society of Echocardiography. Journal of the American Society of Echocardiography. 33 (1), 1-41 (2020).
- Ahonen, J., et al. Pharmacokinetic-pharmacodynamic relationship of dobutamine and heart rate, stroke volume and cardiac output in healthy volunteers. Clinical Drug Investigation. 28 (2), 121-127 (2008).
- Nath Das, R. Determinants of cardiac ejection fraction for the patients with dobutamine stress echocardiography. Epidemiology. 07 (03), (2017).
- Balcazar, D., et al. SERCA is critical to control the Bowditch effect in the heart. Scientific Reports. 8 (1), 12447(2018).
- Zhang, B., Davis, J. P., Ziolo, M. T. Cardiac catheterization in mice to measure the pressure volume relationship: Investigating the Bowditch Effect. Journal of Visualized Experiments. (100), e52618(2015).
- Casaclang-Verzosa, G., Enriquez-Sarano, M., Villaraga, H. R., Miller, J. D. Echocardiographic approaches and protocols for comprehensive phenotypic characterization of valvular heart disease in mice. Journal of Visualized Experiments. (120), e54110(2017).
- Respress, J. L., Wehrens, X. H. Transthoracic echocardiography in mice. Journal of Visualized Experiments. (39), e1738(2010).
- Rea, D., et al. Strain analysis in the assessment of a mouse model of cardiotoxicity due to chemotherapy: Sample for preclinical research. In Vivo. 30 (3), 279-290 (2016).
- Beyhoff, N., et al. Application of speckle-tracking echocardiography in an experimental model of isolated subendocardial damage. Journal of the American Society of Echocardiography. 30 (12), 1239-1250 (2017).
- Pappritz, K., et al. Speckle-tracking echocardiography combined with imaging mass spectrometry assesses region-dependent alterations. Scientific Reports. 10 (1), 3629(2020).
- Krahwinkel, W., et al. Dobutamine stress echocardiography. European Heart Journal. 18, suppl_D 9-15 (1997).
- Michel, L., et al. Real-time pressure-volume analysis of acute myocardial infarction in mice. Journal of Visualized Experiments. (137), e57621(2018).
- Baumgartner, H., et al. ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 38 (36), 2739-2791 (2017).
- Knuuti, J., et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. European Heart Journal. 41 (3), 407-477 (2020).
- Schoensiegel, F., et al. High throughput echocardiography in conscious mice: Training and primary screens. European Journal of Ultrasound. 32, Suppl 1 124-129 (2011).
- Gao, S., Ho, D., Vatner, D. E., Vatner, S. F. Echocardiography in Mice. Current Protocols in Mouse Biology. 1, 71-83 (2011).
- Scherrer-Crosbie, M., Thibault, H. B. Echocardiography in translational research: of mice and men. Journal of the American Society of Echocardiography. 21 (10), 1083-1092 (2008).
- Tanaka, N., et al. Transthoracic echocardiography in models of cardiac disease in the mouse. Circulation. 94 (5), 1109-1117 (1996).
- Roth, D. M., et al. Cardiac-directed adenylyl cyclase expression improves heart function in murine cardiomyopathy. Circulation. 99 (24), 3099-3102 (1999).
- Castle, P. E., et al. Anatomical location, sex, and age influence murine arterial circumferential cyclic strain before and during dobutamine infusion. Journal of Magnetic Resonance Imaging. 49 (1), 69-80 (2019).
- Ren, S., et al. Implantation of an isoproterenol mini-pump to induce heart failure in mice. Journal of Visualized Experiments. (152), e59646(2019).
- Carillion, A., Biais, M., Riou, B., Amour, J. Comparison of Dobutamine with Isoproterenol in echocardiographic evaluation of cardiac β-adrenergic response in rats: 4AP8-9. European Journal of Anaesthesiology. 29, (2012).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 16 (3), 233-270 (2015).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Pieske, B., et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). European Heart Journal. 40 (40), 3297-3317 (2019).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Rammos, C., et al. Impact of dietary nitrate on age-related diastolic dysfunction. European Journal of Heart Failure. 18 (6), 599-610 (2016).
- Koshizuka, R., et al. Longitudinal strain impairment as a marker of the progression of heart failure with preserved ejection fraction in a rat model. Journal of the American Society of Echocardiography. 26 (3), 316-323 (2013).
- Bunting, K. V., et al. A practical guide to assess the reproducibility of echocardiographic measurements. Journal of the American Society of Echocardiography. 32 (12), 1505-1515 (2019).
- Grune, J., et al. Accurate assessment of LV function using the first automated 2D-border detection algorithm for small animals - evaluation and application to models of LV dysfunction. Cardiovascular Ultrasound. 17 (1), 7(2019).
- Lau, E. M. T., et al. Dobutamine stress echocardiography for the assessment of pressure-flow relationships of the pulmonary circulation. Chest. 146 (4), 959-966 (2014).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır