Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Akut Beyin Dilimlerinde Endojen Monoamin Salınımının Ölçümü için Plaka Bazlı Bir Tahlil
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu yöntem, akut beyin dilimleri kullanılarak endojen monoamin salınımının tespiti için basit bir teknik sunar. Kurulum, monoamin salınımı için bir doku tutucu içeren 48 kuyulu bir plaka kullanır. Serbest bırakılan monoamin, elektrokimyasal algılama ile birlikte HPLC tarafından analiz edilir. Ek olarak, bu teknik ilaç keşfi için bir tarama yöntemi sağlar.
Özet
Monoamin nörotransmitterler çok sayıda nörolojik ve psikiyatrik rahatsızlıkla ilişkilidir. Bu tür koşulların hayvan modelleri monoamin nörotransmitter salınımında ve alım dinamiklerinde değişiklikler göstermiştir. Monoamin fonksiyonunu incelemek için elektrofizyoloji, Hızlı Tarama Döngüsel Voltammetri (FSCV), görüntüleme, in vivo mikrodiyaliz, optogenetik veya radyoaktivite kullanımı gibi teknik olarak karmaşık yöntemler gereklidir. Burada sunulan yöntem, monoamin salınımını incelemek için doku tutucular içeren 48 kuyulu bir plaka kullanarak akut beyin dilimlerinde monoamin salınımını tespit etmek için optimize edilmiş iki adımlı bir yaklaşımdır ve monoamin salınım ölçümü için elektrokimyasal algılama (HPLC-ECD) ile birlikte yüksek performanslı sıvı kromatografisidir. Kısaca, prefrontal korteks, hipokampus ve dorsal striatum dahil olmak üzere ilgi çekici bölgeleri içeren sıçan beyin bölümleri bir doku dilimleyici veya vibratom kullanılarak elde edildi. Bu ilgi alanları tüm beyinden parçalandı ve oksijenli bir fizyolojik tamponda kuluçkaya yatırıldı. Deneysel zaman seyri boyunca uygulanabilirlik 3-(4,5-dimetilthiazol-2-yl)-2,5-difenyltetrazolium bromür (MTT) tahlili ile incelendi. Akut olarak parçalanmış beyin bölgeleri, ışınlayıcı (amfetamin) veya ekzosytotik veziküler salınımın (KCl) aktivasyonu yoluyla monoamin salınımını indüklediği bilinen çeşitli ilaç koşullarında inkübe edildi. Kuluçkadan sonra, süpernatanttaki serbest bırakılan ürünler bir HPLC-ECD sistemi aracılığıyla toplandı ve analiz edildi. Burada akut beyin dilimlerinden HPLC ile bazal monoamin salınımı saptanır. Bu veriler, AMPH ve KCl'nin monoamin salınımı yaptığını gösteren önceki in vivo ve in vitro sonuçları destekler. Bu yöntem özellikle monoamin taşıyıcıya bağımlı salınım ile ilişkili mekanizmaları incelemek için yararlıdır ve monoamin salınımı etkileyen bileşikleri hızlı ve düşük maliyetli bir şekilde tarama fırsatı sağlar.
Giriş
Nörolojik ve psikiyatrik hastalıkların bolluğu, monoamin nörotransmitterinin (dopamin [DA], serotonin [5-HT], norepinefrin [NE]) homeostazının düzensizliği veya yetersiz bakımı ile ilişkilidir1,2,3. Bu durumlar depresyon1,2, şizofreni2, anksiyete2, bağımlılık4, menopoz5,6,7, ağrı8 ve Parkinson hastalığı3'ü içerir, ancak bunlarla sınırlı değildir. Örneğin, menopozun birkaç sıçan modeli, hipokampus, prefrontal korteks ve striatum içindeki monoaminlerin düzensizliğinin veya azaltılmasının, menopoz yaşayan kadınlarda görülen hem depresyon hem de bilişsel düşüşle ilişkili olabileceğini göstermiştir. Bu modellerdeki monoaminlerin düzensizliği HPLC-ECD kullanılarak kapsamlı bir şekilde incelenmiştir, ancak çalışmalar ölçülen nörotransmitter içeriği ile nörotransmitter salınımı arasında ayrım yapmamıştır5,6,7. Monoaminler klasik olarak Ca2+'a bağımlı veziküler salınım9 yoluyla hücre dışı alana salınır ve ilgili plazma membran geri alım sistemi (dopamin taşıyıcı, DAT; serotonin taşıyıcı, SERT; norepinefrin taşıyıcı, NET)10,11 aracılığıyla geri dönüştürülür. Buna karşılık, veriler bu taşıyıcıların monoamin salgılayabildiğini veya efflux yapabildiğini göstermektedir, çünkü amfetamin (AMPH) ve 3,4-Metilennedioxymethamphetamine (MDMA) gibi kötüye kullanım ilaçlarının, taşıyıcı sistemleri aracılığıyla sırasıyla DA ve 5-HT'yi serbest bıraktıkları bilinmektedir12,13,14,15,16,17 . Bu nedenle, monoamin salınım dinamiklerinin uygun bir mekanistik anlayışı, spesifik ve hedefli farmakoterapilerin geliştirilmesi için çok önemlidir.
Hızlı Tarama Döngüsel Voltammetri (FSCV)18, in vivo mikrodiyaliz13, görüntüleme19, radyolabeled monoaminler20 ile preincubasyon, optogenetik ve daha yakın zamanda genetik olarak kodlanmış floresan sensörler ve fotometri21,22 gibi monoamin salınımını incelemek için çok çeşitli teknikler örülmektedir. . FSCV ve in vivo mikrodiyaliz monoamin salınımını incelemek için kullanılan başlıca tekniklerdir. FSCV, öncelikle akut beyin dilimlerinde ve in vivo23'te DA'nın uyarılmış eksosit salınımını incelemek için kullanılır. FSCV salınımı uyarmak veya uyandırmak için elektrotlar kullandığından, nörotransmitter salınımının birincil kaynağı Ca2+bağımlı veziküler salınımdır18,24,25,26,27,28,29,30,31 . In vivo mikrodiyaliz, HPLC ile birleştiğinde, ilgi çekici bir beyin bölgesine yerleştirilen bir prob kullanarak hücre dışı nörotransmitter seviyelerindeki değişiklikleri ölçmektedir13,32. FSCV'ye benzer şekilde, in vivo mikrodiyaliz için önemli bir sınırlama nörotransmitter salınımının kaynağını belirlemede zorluktur: Ca2+ bağımlı veziküler salınım veya taşıyıcı bağımlı. Dikkat çekici, her iki yöntem de monoamin salınımının doğrudan ölçülecek uzamasına izin verir. Optogenetiğin son zamanlarda ilerlemesiyle, araştırmalar 5-HT ve DA salınımının enfes hücre tipi özgüllükle kısa bir zaman aralığı içinde tespitini göstermektedir21,22. Bununla birlikte, bu stratejiler karmaşık ve maliyetli teknikler ve ekipmanlar gerektirir ve özellikle reseptörlere monoamin bağlanması yoluyla dolaylı olarak monoamin salınımı ölçmektedir. Ayrıca, radyolabelli monoaminler monoamin dinamiklerini incelemek için de kullanılır. Radyolabelli monoaminler, her bir monoamin taşıyıcısını aşırı ifade eden heterolog hücreler gibi çeşitli model sistemlere önceden yüklenebilir20,33,34,35,36,37,38,39,40, primer nöronlar20, sinaptozomlar33,39,41, 42 ve akut beyin dilimleri43,44. Bununla birlikte, radyoaktivite deneyciye potansiyel zarar verir ve trityum etiketli analitler endojen monoamin dinamiklerini sadık bir şekilde yeniden özetlemeyebilir45,46. HPLC-ECD gibi off-line algılama yöntemleri ile birlikte süperfüzyon sistemleri, birden fazla doku kaynağından monoaminlerin tespit edilmesine izin verdi. Burada, bu protokol, endojen bazal ve uyarılmış monoamin salınımini doğrudan ölçmek için akut beyin dilimlerini kullanarak optimize edilmiş ve düşük maliyetli, basit ve hassas bir yöntem sağlar.
Akut beyin dilimleri, öncelikle in vivo anatomik mikroçevreyi korudukları ve bozulmamış sinapsları korudukları için mekanistik hipotezlerin test edilmesine izin verir47,48,49,50,51,52. Birkaç çalışmada, akut beyin dilimleri veya doğranmış beyin dokusu, Ca2+ aracılı salınımı uyarmak için KCl kullanan bir süperfüzyon tekniği ile birlikte kullanılmıştır53,54,55,56. Superfüzyon sistemleri, monoaminler de dahil olmak üzere nörotransmitter salınım mekanizmalarını alanın anlamasını ilerletmek için kritik öneme sahiptir. Bununla birlikte, bu sistemler nispeten pahalıdır ve doku analizi için mevcut oda sayısı 4-12 arasında değişmektedir. Buna karşılık, burada sunulan yöntem ucuzdur, 48 doku örneğinin ölçümüne izin verir ve 96 doku örneğine kadar kullanmak üzere rafine edilebilir. 48 kuyu plakasındaki her kuyu, serbest bırakılan ürünü dokudan ayırmak için filtre kullanan doku tutucular içerir ve serbest bırakılan monoaminler daha sonra HPLC-ECD tarafından toplanır ve analiz edilir. Daha da önemlisi, bu yöntem monoamin salınımını modüle eden farmakolojik ajanlarla tedaviden sonra prefrontal korteks, hipokampus ve dorsal striatum gibi farklı beyin bölgelerinden 5-HT, DA ve NE salınımının eşzamanlı olarak ölçülmesine izin verir. Böylece, deneyci, test edilen numune sayısını artıran ve böylece kullanılan hayvan sayısını azaltan ucuz bir çoklu kuyu sistemi kullanarak birden fazla soruyu yanıtlayabilir.
Protokol
Hayvan işleme ve doku toplama dahil olmak üzere tüm deneyler, 201508873 (UF) ve 1071 (CCNY) onaylı protokole uyarak Florida Üniversitesi ve New York Şehir Koleji Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) uyarınca gerçekleştirildi. Reaktifler ve arabellek için lütfen Tamamlayıcı Dosya'ya bakın.
1. Akut sıçan beyin dilimleri hazırlayın
NOT: Bu deneyde yetişkin erkek sıçanlar (250-350 g) kullanılmıştır. Bununla birlikte, bu kurulum farklı gelişim noktaları, dişi sıçanlar ve diğer türler için işlevseldir. Fareler gibi daha küçük bir hayvan kullanıyorsanız, deneyci durum başına farklı sayıda beyin dilimi veya yumruk kullanarak protokolü optimize etmek için ayarlayabilir. Diseksiyon arabelleği Arabellek 1 olarak adlandırılır; efflux arabelleği Buffer 2 olarak adlandırılır.
- Tamamlayıcı Dosyada belirtildiği gibi Buffer 1'i hazırlayın. Tampon 1'i buz üzerinde 20 dakika boyunca % 95/5 (O2/CO2) ile köpürterek oksijenle doyur. Tampon 1'in 50 mL'lik kısmını çıkarın ve küçük bir beher veya Petri kabında buzda soğutun. Bu tampon, akut olarak hasat edilen tüm beyni tutmak için kullanılır.
- Bir veya iki yetişkin sıçanı (250-350 g) % 1-2 izofluran ile uyuşturmak, giyotin kullanarak kafalarını kesmek ve beyinlerini hızla çıkarmak. Beyni hemen 1.1 adımından itibaren kabın içine buz gibi oksijenli Tampon 1'e yerleştirin.
NOT: Izofluran ve giyotinin güvenle kullanıldığından emin olun. Duman kaputunun altında açık izofluran. - Vibratom veya komprestom kullanarak, her ilgi çekici bölgeden 300 μm koronal beyin kesiti kesin (Şekil 1). Bölümler yapılırken Kabarcıklanma Arabelleği 1 bulunmalıdır. Paslanmaz çelik bir spatula kullanarak, beyin dilimlerini dikkatlice ve hemen buz gibi oksijenli Tampon 1 ile dolu yeni bir Petri kabına aktarın (Şekil 2).
- Fare beyin atlası57 kullanarak dilimleri dikkatlice cam slaytlara (Şekil 1G) taşıyarak beyin dilimlerini daha fazla parçalara ayırın (örneğin, yumruklar, kesilmiş). Örneğin, dorsal striatumu karanlık, çizgili yapısına göre tanımlayın ve kortekse ve benzersiz spiral yapıya yakınlığına dayanarak hipokampusu tanımlayın. Sağ ve sol yarımküreler kontrol ve deneysel dilimler olarak kullanılmak üzere ayrılabilir (Şekil 2G - H). Burada, sırt striatum daha fazla 2 mm yumruklar halinde diseksiyon edildi (Şekil 1G).
- Ucu kesilmiş plastik bir transfer pipet kullanarak, dilimleri veya beyin yumruklarını oksijenli buz gibi Tampon 1'e batırılmış küçük kaplara aktarın. Bu kaplar paslanmaz çelik ağ veya tamponla dolu küçük Petri kapları olabilir (Şekil 1H).
2. Beyin dilimlerinden veya yumruklardan ex-vivo endojen monoamin salınımı
NOT: Bu bölüm için kullanılan cihaz, karbojen hattına bağlı içe filtreler olmadan altı mikrosantrifüj filtre ünitesi yapılmış 48 kuyu plakası ve bir doku tutucudan oluşur (Şekil 2). Tutucuyu yapmak için sağlam bir plastik çubuk kullanın (örneğin, bir hücre kazıyıcıdan) ve mikrosantrifüj filtre ünitelerini içine inset filtreleri olmadan süper yapıştırın. 1-2 gün kurumasına izin verin. Endojen monoamin salınım deneyi için gereken süre ve amfetamin, fluoksetin ve kokain konsantrasyonları mevcut literatüre ve önceki protokollere dayanmaktadır13,20,58.
-
Doku aktivasyonu
- Beyin dokusunu 1.1.5 adımından efflux odasının her kuyusuna aktarın ve 0.5-1 mL oksijenli Tampon 2'de bir slayt ısıtıcısında 37 °C'de 30-50 dakika boyunca iyileşmeye izin verin, sabit, nazik köpürme ile (Şekil 2B1).
- Bu kuluçka sırasında, ilaçları deney için istenen konsantrasyona seyreltin. Tüm ilaçlar Tampon 2'de çözülmelidir ve konsantrasyonlar mevcut literatüre dayanmaktadır.
-
İlk kuluçka
- Beyin dokusuna sahip doku tutucuyu 500 μL oksijenli Tampon 2 içeren kuyulara taşıyın ve 37 °C'de 20 dakika kuluçkaya yatırın. Tutucuda fazla tampon olmayana kadar kuyunun kenarına dokunarak minimum veya hiç tampon taşınmamasını sağlayın.
- Monoamin taşıyıcı inhibitörler gibi farmakolojik ajanlarla yapılan deneylerde, doku örneklerini oksijenli Tampon 2'de seyreltilmiş ilaçlarla kuluçkaya yatırın (örneğin, 10 μM Fluoksetin, 40 μM kokain; bkz. Şekil 2B2). Her kuyudaki son hacim 500 μL olacaktır.
-
İkinci kuluçka
- Mendille tutucuyu, her ilacın istenen konsantrasyonu olsun veya olmadan 500 μL toplam Tampon 2 içeren yeni bir kuyu setine taşıyın. Fazla arabellek artık olmadığından emin olun. Her kuyu deneysel koşullar için bir n = 1'i temsil eder. Her deneysel durum üç taraflı olarak gerçekleştirilir.
- Bir kuyu oksijenli Tampon 2, sonraki 10-30 μM AMPH içerir ve son kuyu 10-30 μM AMPH artı monoamin taşıyıcı inhibitörleri içerir. Her ilaç oksijenli Tampon 2'de çözülür.
- 37 °C'de 20 dakika boyunca dokuyu 500 μL ilaç durumu ile kuluçkaya yatırın.
NOT: Ek kuyular, monoamin taşıyıcı inhibitörleri olan veya olmayan oksijenli yüksek K+ Buffer 2 içerebilir. Her ilacı oksijenli Tampon 2'de (500 μL) çözün. - 20 dakikalık bu ikinci inkübasyon sırasında, çözeltiyi 2.2.1 adımındaki ilk inkübasyondan kuyulardan toplayın ve 50 μL 1 N perklorik asit veya fosforik asit içeren mikrosantrifüj tüplerine aktarın (HPLC tipine bağlı olarak, son konsantrasyon 0.1 N). Numunenin son hacmi 550 μL olacaktır.
- 20 dakikalık ikinci inkübasyondan sonra, beyin bölümleri veya yumruklarla doku tutucuyu boş bir kuyuya taşıyın ve plakayı buz üzerinde koruyun. Süpernatantı 50 μL 1 N perklorik asit veya fosforik asit içeren mikrosantrifüj tüplerine aktarın. Numunenin son hacmi 550 μL olacaktır.
- Her bir kuyuya 1 mL buz gibi Tampon 1 ekleyin. Küçük cımbız kullanarak tüm dokuyu toplayın ve mikrosantrifüj tüplerini temizlemeye aktarın.
- Tüpleri -80 °C'de beyin dokusu ile koruyun. Tampon 1'in 1 mL'lik kısmını atın (Şekil 2B4).
- Her inkübasyondan 2 dakika boyunca 2.500 x g'da mikrosantrifüj filtre tüpleri (0,22 μm) kullanılarak elde edilen filtre çözeltileri. Elektrokimyasal algılamalı HPLC kullanarak monoamin içeriğini belirlemek için filtratı kullanın (Şekil 2B5).
3. Doku canlılığı
- MTT tahlilleri
NOT: Bu deneysel kurulumla ilgili önemli bir endişe, doku birkaç saate kadar kullanılabileceği için doku canlılığıdır59. Deney sonunda doku canlılığını belirlemek için MTT tahlili60,61 kullanılır. Bu tahlil, sarı tetrazolium tuzu MTT'nin (3-(4,5-dimetilthiazol-2-yl)-2,5-difenyltetrazolium bromürü) yeterli metabolizmaya sahip canlı hücreler tarafından mor formazan kristallerine dönüştürülmesine dayanmaktadır.- Deney sonrası ayrı bir doku örnekleri grubunu koruyun ve iki gruba ayırın.
- Kontrol olarak Tampon 2'de çözünen Triton X-100'de (%1) 37 °C'de bir grubu 20 dakika kuluçkaya yatır. Triton X-100 tedavisi hücre ölümüyle sonuçlanır. Tampon 2'de ikinci grubu koruyun ve Triton X-100'de kuluçkaya yatmayın (doku canlılığı kontrolü).
- Oksijenli Tampon 2'deki her iki gruba da 0,5 mg/mL'lik son konsantrasyona MTT (PBS'de stok çözeltisi 5 mg/mL, pH 7,4) ekleyin.
- Doku örneklerini 37 °C'de 20 dakika kuluçkaya yatırın, PBS ile yıkayın ve formazan kristallerini çözmek için SDS (%10, w/v), DMF (%25, v/v) ve su karışımının 250 μL'sini içeren mikrosantrifüj tüplere aktarın.
- Örnekleri 24 saat kuluçkaya yatır.
- Tüpleri 10 dakika boyunca 10.000 x g'da santrifüj edin ve bir mikro plaka okuyucu kullanarak süpernatantın (200 μL) emiciliğini 562 nm ve 690 nm'de ölçün. Doku canlılığı şu şekilde hesaplanır: (A562-A690)/doku ağırlığı.
4. Monoaminlerin HPLC analizi
- HpLC-ECD kullanarak her deneysel durumdan monoamin salınımı önceki protokollere göre ölçün13,44, ters faz sütunu kullanarak.
- Algılama için gereken mobil aşamayı hazırlayın. Bu, 100 mM fosforik asit, 100 mM sitrik asit, 0.1 mM EDTA-Na2, 600 mg/ L oktanösölfonic asit, % 8 v / v asetonitrile (son pH 6.0) oluşur. Mobil fazın bileşimi, kullanılan HPLC ve sütun türüne bağlıdır.
- Elektrokimyasal dedektörün (2 mm camsı karbon elektrot) potansiyelini 0,46 V'a ayarlayın ve akış hızını 0,05 mL/dk olarak ayarlayın.
- Otomatik algılama ve algılama için HPLC'ye nörotransmitter standartları da dahil olmak üzere her numunenin 5 μL'sini yükleyin. Eklenen her numunenin miktarı kullanılan HPLC'nin türüne bağlıdır.
- HPLC çalıştırmayı tamamladıktan sonra, kromatograf verilerini elde etmek ve analiz etmek için verilen HPLC analiz yazılımını kullanın.
- Monoamin içeriğini her monoaminden oluşan standart bir eğri kullanarak analiz edin (Dopamin: DA, Norepinefrin: NE ve Serotonin: 5-HT; Şekil 2C). Üreticinin yönergelerine göre eğrinin (AUC) altındaki alanı elde etmek için elde edilen kromatogramları kullanın.
5. Doku lysates protein nicelleştirme için hazırlanması
-
Protein tahlili
- Beyin kesitleri/yumrukları içeren her mikrosantrifüj tüpüne buz gibi lizis tamponu artı proteaz inhibitörleri (0,1 g/1 mL) ekleyin ve bir pestle homojenizatör kullanarak homojeniznize edin. Mikrosantrifüj tüpleri, protein bozulmasını önlemek için homojenizasyon yaparken buz üzerinde tutulmalıdır.
- Kuluçka dokusu ışık dönüşü ile 4 °C'de 1 saat homojendir.
- Santrifüj dokusu 4 °C'de 15 dakika boyunca 16.000 x g'da homojenleşir ve süpernatantı geri kazanır.
- Standart olarak sığır serum albümin (BSA) ile süpernatantlarda protein konsantrasyonu belirleyin.
- Her beyin örneğindeki monoamin içeriğini, 250 μL beyin dokusunda ölçülen toplam protein (μg) içeriğine normalleştirin. Nmol monoamin / g proteinini belirlemek için aşağıdaki formülü kullanın. df = seyreltme faktörü.
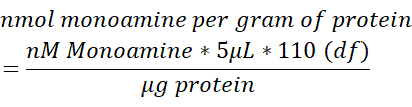
6. İstatistiksel analiz
- Monoamin salınımını (nmol/g) tek yönlü ANOVA'yı ve ardından Sidak'ın post-hoc karşılaştırmalar için çoklu karşılaştırma testini kullanarak analiz edin.
- Bağımsız gruplar için Eşleşmeyen Bir Öğrencinin t-test'ini kullanarak doku canlılığını analiz edin (Kontrol vs. %1 Triton X-100).
- Tüm istatistiksel analizler için alfa seviyesini 0,05 ≤ olarak ayarlayın.
Sonuçlar
Bu teknik, hplc kullanarak endojen monoaminlerin salınımını ölçmek için beyin dilimlerinin kullanımını, iç doku tutuculu 48 kuyulu bir plakaya dayanan elektrokimyasal algılama ile açıklar. Deneysel kurulum Şekil 1 ve Şekil 2'de tasvir edilir. Başlangıçta, deney sonunda doku canlılığını sağlamak için bir MTT (3-(4,5-dimetilthiazol-2-yl)-2,5-difenyltetrazolium bromür, bir tetrazol) tahlil yapıldı. Fonks...
Tartışmalar
Monoamin salınım ölçümleri yıllardır heterolog hücreler, nöronal kültürler, beyin sinaptozomları, ex vivo akut beyin dilimleri ve tüm hayvanlar gibi bir dizi sistemde yapılmaktadır13,20,41,42,58,64,65,66,67,68
Açıklamalar
Yazarların hiçbir açıklaması yok.
Teşekkürler
Bu çalışma, J.A.P.'ye Fondecyt Başlatma Fonu N 11191049 ve G.E.T.'ye NIH hibeSI DA038598 tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 48 Well plate | NA | NA | Assay |
| Acetonitrile | Fischer Scientific | A998-1 | Mobile Phase |
| Calcium Chloride Ahydrous | Sigma Aldrich | C1016 | Modified Artifical Cerebrospinal Fluid OR Efflux Buffer |
| Clarity Software | Anetc | ||
| Citric Acid | Sigma Aldrich | Mobile Phase | |
| D-(+)-Glucose | Sigma | 1002608421 | Dissection Buffer |
| DMF | Sigma Aldrich | D4551 | MTT Assay |
| EDTA-Na2 | Sigma Aldrich | Mobile Phase | |
| GraphPad Software | Graphpad Software, Inc | Statistical Analysis | |
| Glycerol | Sigma Aldrich | G5516 | Lysis buffer |
| HEPES | Sigma Aldrich | H3375 | Lysis buffer |
| HPLC, Decade Amperometric | Anetc | HPLC, LC-EC system | |
| HPLC | Amuza | HPLC HTEC-510. | |
| L-Asrobic Acid | Sigma Aldrich | A5960 | Dissection Buffer |
| Magnesium Sulfate | Sigma | 7487-88-9 | KH Buffer |
| Microcentrifuge Filter Units UltraFree | Millipore | C7554 | Assay - 6 to fit in 48 well plate |
| MTT | Thermo Fisher | M6494 | MTT Assay |
| Nanosep | VWR | 29300-606 | Assay; protein assay |
| Octanesulfonic acid | Sigma Aldrich | V800010 | Mobile Phase |
| Pargyline Clorohydrate | Sigma Aldrich | P8013 | Modified Artifical Cerebrospinal Fluid OR Efflux Buffer |
| Phosphoric Acid | Sigma Aldrich | Mobile Phase | |
| Potassium Chloride | Sigma | 12636 | KH Buffer |
| Potassium Phosphate Monobasic | Sigma | 1001655559 | KH Buffer |
| Precisonary VF-21-0Z | Precissonary | Compresstome | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P2714 | Lysis buffer. |
| Sodium Bicarbonate | Sigma | S5761 | Dissection Buffer |
| Sodium Bicarbonate | Sigma Aldrich | S5761 | Dissection Buffer |
| Sodium Chloride | Sigma | S3014 | KH Buffer |
| Sodium Dodecyl Sulfate | Sigma Aldrich | L3771 | Lysis buffer |
| Triton X-100 | Sigma Aldrich | T8787 | MTT Assay / Lysis buffer |
Referanslar
- Jesulola, E., Micalos, P., Baguley, I. J. Understanding the pathophysiology of depression: From monoamines to the neurogenesis hypothesis model - are we there yet. Behavioural Brain Research. 341, 79-90 (2018).
- Krystal, J. H., D'Souza, D. C., Sanacora, G., Goddard, A. W., Charney, D. S. Current perspectives on the pathophysiology of schizophrenia, depression, and anxiety disorders. Medical Clinics of North America. 85 (3), 559-577 (2001).
- Barone, P. Neurotransmission in Parkinson's disease: beyond dopamine. European Journal of Neurology. 17 (3), 364-376 (2010).
- Howell, L. L., Kimmel, H. L. Monoamine transporters and psychostimulant addiction. Biochemical Pharmacology. 75 (1), 196-217 (2008).
- Kirshner, Z. Z., et al. Impact of estrogen receptor agonists and model of menopause on enzymes involved in brain metabolism, acetyl-CoA production and cholinergic function. Life Sciences. 256, 117975 (2020).
- Long, T., et al. Comparison of transitional vs surgical menopause on monoamine and amino acid levels in the rat brain. Molecular and Cellular Endocrinology. 476, 139-147 (2018).
- Long, T., et al. Estradiol and selective estrogen receptor agonists differentially affect brain monoamines and amino acids levels in transitional and surgical menopausal rat models. Molecular and Cellular Endocrinology. 496, 110533 (2019).
- Burke, N. N., et al. Enhanced nociceptive responding in two rat models of depression is associated with alterations in monoamine levels in discrete brain regions. Neuroscience. 171 (4), 1300-1313 (2010).
- Lane, J. D., Aprison, M. H. Calciumm-dependent release of endogenous serotonin, dopamine and norepinephrine from nerve endings. Life Sciences. 20 (4), 665-671 (1977).
- Ramamoorthy, S., Shippenberg, T. S., Jayanthi, L. D. Regulation of monoamine transporters: Role of transporter phosphorylation. Pharmacology and Therapeutics. 129 (2), 220-238 (2011).
- Torres, G. E., Gainetdinov, R. R., Caron, M. G. Plasma membrane monoamine transporters: structure, regulation and function. Nature Reviews. Neuroscience. 4 (1), 13-25 (2003).
- Hilber, B., et al. Serotonin-transporter mediated efflux: A pharmacological analysis of amphetamines and non-amphetamines. Neuropharmacology. 49 (6), 811-819 (2005).
- Mauna, J. C., et al. G protein βγ subunits play a critical role in the actions of amphetamine. Translational Psychiatry. 9 (1), 81 (2019).
- Sitte, H. H., Freissmuth, M. Amphetamines, new psychoactive drugs and the monoamine transporter cycle. Trends in Pharmacological Sciences. 36 (1), 41-50 (2015).
- Johnson, L. A., Guptaroy, B., Lund, D., Shamban, S., Gnegy, M. E. Regulation of amphetamine-stimulated dopamine efflux by protein kinase C β. Journal of Biological Chemistry. 280 (12), 10914-10919 (2005).
- Kahlig, K. M., et al. Amphetamine induces dopamine efflux through a dopamine transporter channel. Proceedings of the National Academy of Sciences of the United States of America. 102 (9), 3495-3500 (2005).
- Kantor, L., Hewlett, G. H. K., Gnegy, M. E. Enhanced amphetamine- and K+ -mediated dopamine release in rat striatum after repeated amphetamine: differential requirements for Ca 2+ - and calmodulin-dependent phosphorylation and synaptic vesicles. The Journal of Neuroscience. 19 (10), 3801-3808 (2018).
- Brodnik, Z. D., et al. Susceptibility to traumatic stress sensitizes the dopaminergic response to cocaine and increases motivation for cocaine. Neuropharmacology. 125, 295-307 (2017).
- Henke, A., et al. Toward serotonin fluorescent false neurotransmitters: development of fluorescent dual serotonin and vesicular monoamine transporter substrates for visualizing serotonin neurons. ACS Chemical Neuroscience. 9 (5), 925-934 (2018).
- Garcia-Olivares, J., et al. Gβγ subunit activation promotes dopamine efflux through the dopamine transporter. Molecular Psychiatry. 22 (12), 1673-1679 (2017).
- Xiao, N., Privman, E., Venton, B. J. Optogenetic control of serotonin and dopamine release in Drosophila larvae. ACS Chemical Neuroscience. 5 (8), 666-673 (2014).
- Bass, C. E., et al. Optogenetic control of striatal dopamine release in rats. Journal of Neurochemistry. 114 (5), 1344-1352 (2010).
- Stamford, J. A. Fast cyclic voltammetry: measuring transmitter release in "real time". Journal of Neuroscience Methods. 34 (1-3), 67-72 (1990).
- Brodnik, Z. D., Ferris, M. J., Jones, S. R., España, R. A. Reinforcing doses of intravenous cocaine produce only modest dopamine uptake inhibition. ACS Chemical Neuroscience. 8 (2), 281-289 (2017).
- Brodnik, Z. D., España, R. A. Dopamine uptake dynamics are preserved under isoflurane anesthesia. Neuroscience Letters. 606, 129-134 (2015).
- Ferris, M. J., Calipari, E. S., Yorgason, J. T., Jones, S. R. Examining the complex regulation and drug-induced plasticity of dopamine release and uptake using voltammetry in brain slices. ACS Chemical Neuroscience. 4 (5), 693-703 (2013).
- Siciliano, C. A., Calipari, E. S., Ferris, M. J., Jones, S. R. Biphasic mechanisms of amphetamine action at the dopamine terminal. The Journal of Neuroscience The Official Journal of the Society for Neuroscience. 34 (16), 5575-5582 (2014).
- Rice, M. E., et al. Direct monitoring of dopamine and 5-HT release in substantia nigra and ventral tegmental area in vitro. Experimental Brain Research. 100 (3), 395-406 (1994).
- Bunin, M. A., Prioleau, C., Mailman, R. B., Wightman, R. M. Release and uptake rates of 5-hydroxytryptamine in the dorsal raphe and substantia nigra reticulata of the rat brain. Journal of Neurochemistry. 70 (3), 1077-1087 (1998).
- Park, J., Takmakov, P., Wightman, R. M. In vivo comparison of norepinephrine and dopamine release in rat brain by simultaneous measurements with fast-scan cyclic voltammetry. Journal of Neurochemistry. 119 (5), 932-944 (2011).
- Park, J., Bhimani, R. V., Bass, C. E. In vivo electrochemical measurements of norepinephrine in the brain: current status and remaining challenges. Journal of the Electrochemical Society. 165 (12), 3051-3056 (2018).
- Butcher, S. P., Fairbrother, I. S., Kelly, J. S., Arbuthnott, G. W. Amphetamine-induced dopamine release in the rat striatum: an in vivo microdialysis study. Journal of Neurochemistry. 50 (2), 346-355 (1988).
- Garcia-Olivares, J., et al. Inhibition of dopamine transporter activity by G protein βγ subunits. PLoS One. 8 (3), 1-9 (2013).
- Carneiro, A. M. D., Blakely, R. D. Serotonin-, protein kinase C-, and Hic-5-associated redistribution of the platelet serotonin transporter. Journal of Biological Chemistry. 281 (34), 24769-24780 (2006).
- Rajamanickam, J., et al. Akt-mediated regulation of antidepressant-sensitive serotonin transporter function, cell-surface expression and phosphorylation. The Biochemical Journal. 468 (1), 177-190 (2015).
- Egaña, L. A., et al. Physical and functional interaction between the dopamine transporter and the synaptic vesicle protein synaptogyrin-3. The Journal of Neuroscience The Official Journal of the Society for Neuroscience. 29 (14), 4592-4604 (2009).
- Guptaroy, B., Fraser, R., Desai, A., Zhang, M., Gnegy, M. E. Site-directed mutations near transmembrane domain 1 alter conformation and function of norepinephrine and dopamine transporters. Molecular Pharmacology. 79 (3), 520-532 (2011).
- Ordway, G. A., et al. Norepinephrine transporter function and desipramine: Residual drug effects versus short-term regulation. Journal of Neuroscience Methods. 143 (2), 217-225 (2005).
- Steinkellner, T., et al. Amphetamine action at the cocaine- and antidepressant-sensitive serotonin transporter is modulated by CaMKII. Journal of Neuroscience. 35 (21), 8258-8271 (2015).
- Guptaroy, B., et al. A juxtamembrane mutation in the N terminus of the dopamine transporter induces preference for an inward-facing conformation. Molecular Pharmacology. 75 (3), 514-524 (2009).
- Carpenter, C., et al. Direct and systemic administration of a CNS-permeant tamoxifen analog reduces amphetamine-induced dopamine release and reinforcing effects. Neuropsychopharmacology. 42 (10), 1940-1949 (2017).
- Aquino-Miranda, G., Escamilla-Sánchez, J., González-Pantoja, R., Bueno-Nava, A., Arias-Montaño, J. -. A. Histamine H3 receptor activation inhibits dopamine synthesis but not release or uptake in rat nucleus accumbens. Neuropharmacology. 106, 91-101 (2016).
- Reddy, I. A., et al. Glucagon-like peptide 1 receptor activation regulates cocaine actions and dopamine homeostasis in the lateral septum by decreasing arachidonic acid levels. Translational Psychiatry. 6 (5), 809 (2016).
- Koutzoumis, D. N., et al. Alterations of the gut microbiota with antibiotics protects dopamine neuron loss and improve motor deficits in a pharmacological rodent model of Parkinson's disease. Experimental Neurology. 325, 113159 (2020).
- Herdon, H., Strupish, J., Nahorski, S. R. Differences between the release of radiolabelled and endogenous dopamine from superfused rat brain slices: Effects of depolarizing stimuli, amphetamine and synthesis inhibition. Brain Research. 348 (2), 309-320 (1985).
- Thongsaard, W., Kendall, D. A., Bennett, G. W., Marsden, C. A. A simple method for measuring dopamine release from rat brain slices. Journal of Pharmacological and Toxicological Methods. 37 (3), 143-148 (1997).
- Dorris, D. M., Hauser, C. A., Minnehan, C. E., Meitzen, J. An aerator for brain slice experiments in individual cell culture plate wells. Journal of Neuroscience Methods. 238, 1-10 (2014).
- Humpel, C. Organotypic brain slice cultures: a review. Neuroscience. 305, 86-98 (2015).
- Papouin, T., Haydon, P. Obtaining acute brain slices. BIO-PROTOCOL. 8 (2), 477-491 (2018).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. Journal of Neuroscience Methods. 59 (1), 5-9 (1995).
- Yamamoto, C., McIlwain, H. Electrical activities in thin sections from the mammalian brain maintained in chemically-defined media in vitro. Journal of Neurochemistry. 13 (12), 1333-1343 (1966).
- Buskila, Y., et al. Extending the viability of acute brain slices. Scientific Reports. 4, 4-10 (2014).
- Kako, H., Fukumoto, S., Kobayashi, Y., Yokogoshi, H. Effects of direct exposure of green odour components on dopamine release from rat brain striatal slices and PC12 cells. Brain Research Bulletin. 75 (5), 706-712 (2008).
- McBride, W. J., Murphy, J. M., Lumeng, L., Li, T. -. K. Effects of ethanol on monoamine and amino acid release from cerebral cortical slices of the alcohol-preferring P line of rats. Alcoholism: Clinical and Experimental Research. 10 (2), 205-208 (1986).
- Chen, J. C., Turiak, G., Galler, J., Volicer, L. Effect of prenatal malnutrition on release of monoamines from hippocampal slices. Life Sciences. 57 (16), 1467-1475 (1995).
- Becker, J. B., Castañeda, E., Robinson, T. E., Beer, M. E. A simple in vitro technique to measure the release of endogenous dopamine and dihydroxyphenylacetic acid from striatal tissue using high performance liquid chromatography with electrochemical detection. Journal of Neuroscience Methods. 11 (1), 19-28 (1984).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
- Dailey, J. W., Reith, M. E. A., Steidley, K. R., Milbrandt, J. C., Jobe, P. C. Carbamazepine-induced release of serotonin from rat hippocampus in vitro. Epilepsia. 39 (10), 1054-1063 (1998).
- Buskila, Y., et al. Extending the viability of acute brain slices. Scientific Reports. 4, 5309 (2014).
- Mewes, A., Franke, H., Singer, D. Organotypic brain slice cultures of adult transgenic P301S mice-A model for tauopathy studies. PLoS One. 7 (9), (2012).
- Rönicke, R., et al. AB mediated diminution of MTT reduction - An artefact of single cell culture. PLoS One. 3 (9), (2008).
- Ihalainen, J. A., Riekkinen, P., Feenstra, M. G. P. Comparison of dopamine and noradrenaline release in mouse prefrontal cortex, striatum and hippocampus using microdialysis. Neuroscience Letters. 277 (2), 71-74 (1999).
- Richards, D. A., Obrenovitch, T. P., Symon, L., Curzon, G. Extracellular dopamine and serotonin in the rat striatum during transient ischaemia of different severities: a microdialysis study. Journal of Neurochemistry. 60 (1), 128-136 (1993).
- Fog, J. U., et al. Calmodulin kinase II interacts with the dopamine transporter C terminus to regulate amphetamine-induced reverse transport. Neuron. 51 (4), 417-429 (2006).
- Balázsa, T., Bíró, J., Gullai, N., Ledent, C., Sperlágh, B. CB1-cannabinoid receptors are involved in the modulation of non-synaptic [3H]serotonin release from the rat hippocampus. Neurochemistry International. 52 (1), 95-102 (2008).
- Schechter, L. E. The potassium channel blockers 4-aminopyridine and tetraethylammonium increase the spontaneous basal release of [3H]5-hydroxytryptamine in rat hippocampal slices. The Journal of Pharmacology and Experimental Therapeutics. 282 (1), 262-270 (1997).
- Boudanova, E., Navaroli, D. M., Stevens, Z., Melikian, H. E. Dopamine transporter endocytic determinants: carboxy terminal residues critical for basal and PKC-stimulated internalization. Molecular and Cellular Neuroscience. 39 (2), 211-217 (2008).
- Bowyer, J. F., et al. Interactions of MK-801 with glutamate-, glutamine- and methamphetamine-evoked release of [3H]dopamine from striatal slices. The Journal of Pharmacology and Experimental Therapeutics. 257 (1), 262-270 (1991).
- Perszyk, R. E., et al. GluN2D-containing N-methyl-D-aspartate receptors mediate synaptic transmission in hippocampal interneurons and regulate interneuron activity. Molecular Pharmacology. 90 (6), 689-702 (2016).
- Jones, S. R., et al. Profound neuronal plasticity in response to inactivation of the dopamine transporter. Proceedings of the National Academy of Sciences of the United States of America. 95 (7), 4029-4034 (1998).
- Jedema, H. P., Narendran, R., Bradberry, C. W. Amphetamine-induced release of dopamine in primate prefrontal cortex and striatum: striking differences in magnitude and timecourse. Journal of Neurochemistry. 130, 490-497 (2014).
- Buchmayer, F., et al. Amphetamine actions at the serotonin transporter rely on the availability of phosphatidylinositol-4,5-bisphosphate. Proceedings of the National Academy of Sciences. 110 (28), 11642-11647 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır