Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tadı Uyaranlara Fare Genikül Ganglion Nöron Yanıtlarının In vivo Kalsiyum Görüntülemesi
Bu Makalede
Özet
Burada canlı, uyuşturuldulu bir laboratuvar faresinin genikül ganglionunun nasıl ortaya çıkarılacağını ve bu nöronların topluluklarının uyaranları tatmak için tepkilerini ölçmek için kalsiyum görüntülemenin nasıl kullanılacağını ve farklı uyarıcılarla birden fazla denemeye izin vermeyi sunuyoruz. Bu, hangi nöronların hangi şok tabancalarına yanıt verdiğine derinlemesine karşılaştırmalar sağlar.
Özet
Son on yıl içinde, genetik olarak kodlanmış kalsiyum göstergelerindeki (GECI'ler) gelişmeler in vivo fonksiyonel görüntülemede bir devrimi teşvik etti. Kalsiyumun nöronal aktivite için bir proxy olarak kullanılması, bu teknikler büyük nöronal topluluklar içindeki bireysel hücrelerin çeşitli uyaranlara yanıtlarını gerçek zamanlı olarak izlemenin bir yolunu sağlar. Biz ve diğerleri, canlı uyuşturulmuş farelerin dillerine uygulanan uyaranları tatmak için bireysel genikül ganglion nöronlarının yanıtlarını görmek için bu teknikleri uyguladık. Genikül ganglion, ön dili ve damağı içselleştiren gustatory nöronların hücre vücutlarının yanı sıra kulağın pinnasını içselleştiren bazı somatosensör nöronlardan oluşur. GCaMP ile bireysel genikül ganglion nöronlarının tat çağrışımlı yanıtlarının görüntülenmesi, bu nöronların vahşi tip farelerdeki ayarlama profilleri hakkında önemli bilgiler ve genetik olarak manipüle edilmiş farelerde periferik tat yanlış dönen fenotipleri tespit etmenin bir yolunu sağlamıştır. Burada genikül ganglionu, GCaMP floresan görüntü alımını, veri analizi için ilk adımları ve sorun gidermeyi ortaya çıkarmak için cerrahi prosedürü gösteriyoruz. Bu teknik transgenik olarak kodlanmış GCaMP veya AAV aracılı GCaMP ifadesi ile kullanılabilir ve belirli genetik ilgi alt kümelerini (örneğin, Cre aracılı GCaMP ifadesi) görüntülenecek şekilde değiştirilebilir. Genel olarak, genikül ganglion nöronlarının in vivo kalsiyum görüntülemesi periferik gustatory nöronların aktivitesini izlemek için güçlü bir tekniktir ve daha geleneksel tam sinir chorda tympani kayıtlarına veya tat davranışı testlerine tamamlayıcı bilgiler sağlar.
Giriş
Memeli periferik tat sisteminin önemli bir bileşeni genikül gangliondur. Kulağın pinnasını içselleştiren bazı somatosensör nöronlara ek olarak, genikül ön dili ve damağı içselleştiren gustatory nöronların hücre gövdelerinden oluşur. Diğer periferik duyusal nöronlara benzer şekilde, genikül ganglion nöronları, periferik olarak tat tomurcuklarına ve merkezi olarak yalnız sistemin beyin sapı çekirdeğine uzun bir aksla sözde tek kutupludur1. Bu nöronlar öncelikle atp ağız boşluğunda tat uyaranlarına yanıt veren tat reseptör hücreleri tarafından serbest bırakılması ile aktive edilir2,3. ATP tat sinyali için gerekli bir nörotransmitterdir ve gustatory ganglion nöronları tarafından ifade edilen P2rx reseptörleri aktivasyonları için gereklidir4. Tat reseptör hücrelerinin belirli bir tat modalitesi (tatlı, acı, tuzlu, umami veya ekşi) için belirli tat reseptörlerini ifade ettiği göz önüne alındığında, tadı uyaranlara verilen gustatory ganglion nöron yanıtlarının da dar bir şekilde ayarlandırılacağı hipotez edilmiştir5.
Tüm sinir kayıtları hem chorda tympani hem de daha büyük üstün petrosal sinirlerin genikül ganglion6,7'yebeş tat modalitesini temsil eden gustatory sinyalleri iletdiğini göstermiştir. Bununla birlikte, bu hala belirli bir şok tabancasına nöronal yanıtların özgüllüğü hakkında sorular bıraktı: tat modalitesine özgü nöronlar, polimodal nöronlar veya her ikisinin bir karışımı varsa. Tek lif kayıtları, bireysel liflerin aktivitesi ve kimyasal hassasiyetleri 8,9,10hakkında daha fazla bilgi verir, ancak bu metodoloji az sayıda elyaftan veri toplamakla sınırlıdır. Benzer şekilde, bireysel sıçan genikül ganglion nöronlarının in vivo elektrofizyolojikkayıtları,bireysel nöronların11 , 12,13, yanıtları hakkında bilgi verir, ancak yine de popülasyonun aktivitesini kaybeder ve hayvan başına nispeten az nöron kaydı verir. Nöronal toplulukların yanıt kalıplarını, bireysel nöronların aktivitesini gözden kaçırmadan analiz etmek için yeni tekniklerin çalıştırılması gerekiyordu.
Kalsiyum görüntüleme, özellikle GCaMP gibi genetik olarak kodlanmış kalsiyum göstergelerini kullanarak, bu teknik atılımı sağlamıştır14,15,16,17,18. GCaMP, kalsiyumu nöronal aktivite için bir proxy olarak kullanır ve hücre içindeki kalsiyum seviyeleri yükseldikçe yeşil floresan artar. Sinyali gürültü oranına iyileştirmek, bağlama kinetiğini ayarlamak ve özel deneyler için uyum sağlamak için yeni GCaMP formları geliştirilmeye devam ediyor19. GCaMP, tüm sinir kaydının aksine tek bir nöron çözünürlüğü sağlar ve aynı anda tek lif veya tek hücre kaydının aksine nöron topluluklarının yanıtlarını ölçebilir. Genikül gangliyonunun kalsiyum görüntülemesi, vahşi tip farelerde bu nöronların ayar profilleri hakkında önemli bilgiler sağlamıştır16,20ve genetik olarak manipüle edilmiş farelerde periferik tat yanlış yönlendiren fenotipler tanımlamıştır18.
Genikül ganglionuna in vivo kalsiyum görüntüleme tekniklerinin uygulanmasının en büyük zorluklarından biri kemikli tympanic bulla içinde kapsüllenmiş olmasıdır. Geniküle optik erişim elde etmek için, ganglionu sağlam tutarken kemik katmanlarını çıkarmak için hassas bir ameliyat gerekir. Bu amaçla, diğer araştırmacıların genikül ganglion'a erişmelerine ve GCaMP'nin bu nöronların uyarıcı in vivo tatmak için floresan yanıtlarına aracılık ettiğini göstermelerine yardımcı olmak için bu kılavuzu oluşturduk.
Access restricted. Please log in or start a trial to view this content.
Protokol
Hayvan protokolleri Texas San Antonio Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komiteleri tarafından gözden geçirildi ve onaylandı.
1. Ameliyat öncesi kurulum
NOT: Kullanılan pompa sistemi, mikroskop, kamera ve görüntüleme yazılımına göre değişeceğinden, ekipmanın ilk kurulumunun burada ele alınmadığını lütfen unutmayın. Kurulum talimatları için lütfen ekipman satıcısı tarafından sağlanan öğretim materyallerine bakın. Yazarlar tarafından kullanılan ekipmanlar için lütfen Malzeme Tablosunabakın.
- Tüm araç (su) ve tastant hatlarında sıvı akışlarını sağlayın. Hat tıkanmışsa, bağlantıyı kesin ve suyla yıkayın. Çizgi bükülmüşse, sıvı akana kadar masaj yapın. Sıvının işaret üzerine başladığından ve durduğundan emin olun.
- Tüm hatların engelsiz olduğu onaylandıktan sonra, aracı 10 s boyunca çalıştırın ve ardından tüm vanaları kapatın.
- Görüntüleme yazılımının gerekli tüm değişkenlerle (örneğin, deneme süresi, dosya adları, kare hızı vb.) hazır olduğundan emin olun. Açık kaynaklı bir görüntü alma yazılım paketi olan μManager'ı kullanarak, saniyede 5Hz kare için Pozlama Süresi etiketli alana 200 ms girin, binningaltında x2 'yi seçin ve Live etiketli düğmeye basın. Video başlatıldığında, sol taraftaki yatırım getirisietiketli düğmeye basın. Bu, 512x512 görüş alanına neden olur.
2. Hayvanı uyuşturup hareketsiz hale getirdi
NOT: Aşağıdaki protokol, 18-35 g ağırlığındaki her iki cinsiyetteki fareler için optimize edilmiş bir terminal prosedürdür. 10 ila 12 haftalık hayvanlarla kullanılması önerilir. Snap25-GCaMP6s gibi Genetik Olarak Kodlanmış Kalsiyum Göstergelerini (GECI'ler) ifade eden transgenik hayvanlarla veya viral GECI'lerle stereotaksik olarak enjekte edilen hayvanlarla kullanılabilir. Protokol için eldiven, laboratuvar önlüğü ve yüz maskesi giyilmelidir.
- Hayvanı scruff ve Ketamin (100 mg/ kg) ve Xylazine (10 mg / kg) intraperitoneal enjeksiyonu gerçekleştirin. Devam etmeden önce anestezinin derinliğini parmak sıkışması ile değerlendirin.
- Başın üst kısmını tıraş edin ve boynun önündeki cerrahi bölgeyi tıraş edin.
- Isıtma yastığını açın ve hayvan eğilimliyi ped üzerine yerleştirin.
- Gözlerin kurumasını önlemek için hayvanın gözlerine merhem uygulayın.
- Hayvanın kafatasını ortaya çıkarmak için başın orta çizgisine bir kesi (~1 cm) yapın. Çıplak kemiğin erişilebilir olması için steril bir çubuk kullanarak bağ dokusunu çıkarın. Kafatasının kuru olduğundan emin olmak için pamuk uçlu bir aplikatör kullanın.
- Kafatasına veteriner bağı uygulayın. Açıkta kalan kafatasını kapattığından emin ol. Tutkalın kurumasını bekleyin.
- Petri kabı kapağında, karıştırın ve kafatasına bir diş çimentosu tabakası uygulayın. 2.5. adımda kullanılan pamuk uçlu aplikatörnün arka ucu bu işlem için iyi çalışacaktır. Baş direğini diş çimentosunun üzerine yerleştirin ve kafa direğini kafatasına yerleştirmek için ikinci bir diş çimentosu tabakası uygulayın.
- Diş çimentosu kuruyana ve katı olana kadar bekletin. Pamuk uçlu aplikatörü ikiye bölün ve test etmek için diş çimentosunda dürtmek için sivri uçları kullanın. Diş çimentosu dürtülmeye teslim olmazsa, hayvan sırtüstü bir pozisyona döndürülebilir.
3. Trakeotomi
- Cerrahi bölgeye ameliyat öncesi ovma uygulayın. Ovma sonrası, boğazın derisinde sternumdan çeneye kadar ~ 2 cm orta çizgi kesi yapın.
- Digastrik kasları tamamen açığa çıkardığından emin olarak cildi ve maksiller altı bezleri geri çek.
- Dikişi paratrascheal kas yapısında bulun, künt diseksiyonla ayırın ve geri çekerek açın.
- Trakeanın üst kısmında polietilen boruya sığacak kadar büyük bir açıklığı dikkatlice kesin (I.D. 0.86 mm, O.D. 1.27 mm). Nefes borusunun çapını yarıdan fazla kesmeyin. Nefes borusuna akciğerlere doğru boru yerleştirin.
- Paratracheal kasları serbest bırakmak ve submaksiller bezleri geri çekmek için retraktörleri yeniden konumlandırın.
- Tutkal paratraseral kas yapısı, en az miktarda veteriner yapıştırıcısı ile boru üzerinde birlikte (bkz. Şekil 1A).
4. Tympanic bulla'yı kırmak
- İstenen digastrik kası (sol veya sağ) hafifçe kızdırın ve bağ dokusunu ayırın. Kan damarlarından kaçınarak kasın ön ucundan kesin ve tympanic bulla'dan temizleyene kadar arka arkaya çekin.
- Tympanic bulla'yı kaldırmak için başı hafifçe arkaya eğin. Karotis arter ön kısmının dalını digastrik kasın arka yerleştirme noktasına yerleştirin. Tympanic bulla'nın dışbükey yapısı için bu kan damarının sadece posterior'u hissedin.
- Bu konumdaki kas yapısında bir dikiş arayın (bkz. Şekil 1B). İki ince kürs seti kullanarak, timpanik bullanın kemiği görünene kadar dikişte künt diseksiyon. Tympanic bulla'yı net bir şekilde görmek için retraktörleri kullanın.
- Bulla üzerinde arka ön tarafta çalışan dikişi bulun (bkz. Şekil 1C). Cerrahi bir sonda kullanarak, bu dikişin ortasındaki kemikte bir delik açın. Kemikte dairesel bir alanı kesmek için bir dizi ince uç makası kullanın, kan damarlarını ön, arka ve bullanın derinlerinde kesmemeye dikkat edin.
5. Geniküle maruz kalma
- Bu deliğin içinde dışbükey bir kemik parçası var, bu koklea. Kokleanın ön bir kasıdır, tensör tympani (bkz. Şekil 1D). Yay makasını kullanarak tensör tympani'yi kesin ve çıkarın.
- Bir parmak sıkışması gerçekleştirin. Hayvan yanıt verirse, yeniden yapılanma için 1/3 dozda bir ketamin / ksilazin karışımı verin.
- Sulama sıvısı ve emme hattı hazırlayın. Cerrahi sondayı kullanarak koklear promontory'de bir delik açın. Dışarı akan sıvıyı hemen sulayın ve emişle çıkarın. Bu sıvı bu noktadan aşağı yukarı sürekli akacaktır ve periyodik olarak ele alınması gerekecektir.
- Kokleadaki deliği büyüt. Kokleayı arka ve yanal kenara çevreleyen kan damarına dikkat edin.
- Farenin başını öne eğ. Kokleanın altındaki temporal kemikteki deliği bulun (bkz. Şekil 1E). Bu deliğe giden sırt ön kısmını not edin, bu sırt doğrudan yedinci sinirin üzerine oturur.
- Deliğe cerrahi bir prob yerleştirin ve yedinci siniri açığa çıkarmak için temporal kemiği dikkatlice kaldırın (bkz. Şekil 1F). Yedinci sinirin ne kadarının görünür olduğunu stoklayın ve genikül tam olarak maruz kalmazsa, hayvanın başını arkaya eğin ve kemiği ön taraftan sinire çekmeye çalışın.
- Ganglion hala tam olarak görünmüyorsa, altından daha fazla kemik çekin. Bunu yapmak geniküle zarar verebileceği için sondayı kemiğin derinliklerine yerleştirmemeye çok dikkat edin.
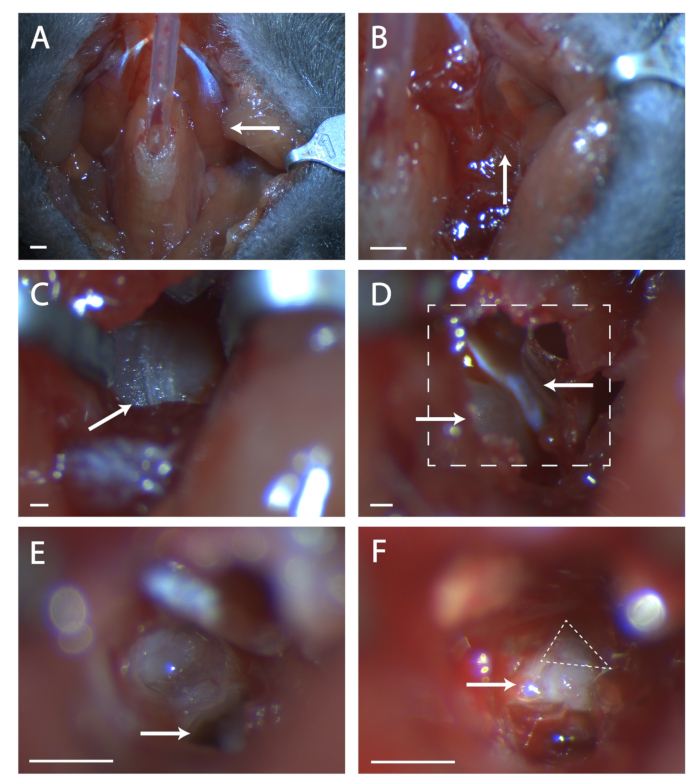
Şekil 1: Genikül ganglionun cerrahi maruziyeti. (A) Trakeotomi sonrası fare boyun boşluğunun görüntüsü. Ok, figürün geri kalanında araştırılan cerrahi alanın üzerinde yatan digastrik kası işaret ediyor. (B) Daha önce belirtilen digastrik kasın altındaki bölgenin görüntüsü. Ok, künt diseksiyon için kas yapısındaki dikişi gösterir. (C) Tympanic Bulla görüntüsü. Ok, kemikteki dikişin cerrahi bir probla kırılıp kırılmasını gösterir. (D) Bullayı açtıktan sonra cerrahi bölge görüntüsü. Sol alt ok kokleayı, üst ok tensör tympani'yi gösterir. Kutulu çizgi (E) ve (F) alanlarını gösterir. (E) Koklea sonrası cerrahi bölgenin görüntüsü kırıldı ve içeriği çıkarıldı. Beyaz ok, protokol adım 5.6'da başvurulan cerrahi probun nereye yerleştirneceğine işaret eder. (F) Açıkta kalan genikül ganglionun bir görüntüsü. Ok, yedinci sinirin gövdesini gösterir, kesikli üçgen genikül ganglionu çevreler. Paneller A-B, Ölçek = 5 mm. Paneller C-F, Ölçek = 1 mm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
6. Gergin paneli çalıştırın
- Genikülün üzerindeki sıvıyı çıkarmak için emiş kullanın. İsteğe bağlı olarak, sızıntıyı azaltmaya yardımcı olmak ve mikroskop navigasyonunda yardımcı olmak için bir emici nokta yerleştirin.
- Hayvanı mikroskop altında emici ped üzerine yerleştirin. Genikül ganglionu bulun: yararlı simgesel yapılar arasında bullada kalan delik, zamansal kemikteki delik ve yedinci sinir bulunur. Epifluoresans kapsamındaki FITC/GFP filtresini kullanarak, GCaMP ekspresyon genikül ganglion nöronlarını tek tek kontrol edin. 10x hedef (çalışma mesafesi 10mm), tek tek hücrelerin aktivitesini izlemek için yeterli çözünürlük sağlayacaktır, ancak 20x hedef (çalışma mesafesi 12 mm) de kullanılabilir.
- Lezzetli hat için dağıtma iğnesini hayvanın ağzına sıkıca yerleştirin. Sıvı yakalamak için hayvanın ağzının altına bir Petri kabı yerleştirin.
- Kameranın mikroskobun görüş alanını görüntülemesini sağlayın. Video kaydının başlangıcını lezzetli sununun başlangıcıyla senkronize edin.
- Kayıt sırasında yanıtlar, sürüklenme ve sızıntı için canlı yayını izleyin.
- Sızıntı meydana gelirse, genikül görünümü net olana kadar sıvıyı emişleyin ve tekrarlayın. Sürüklenme meydana gelirse, baş direğin tüm kısımlarının sıkıca sıkılıp sıkıldığını kontrol edin. Yanıt alınmazsa, sıvının aktığını ve mikroskop ve kameranın görüş alanını gizleyen bir şey olmadan uygun konuma odaklandığını kontrol edin.
- İstediğiniz sayıda video elde edilene kadar tekrarlayın. Retraktörleri hafifçe kolaylaştırın, ardından karşı taraftaki 3-6 adımlarını tekrarlayın.
- İstenen tüm gangliyonlar için istenen videolar elde edildikten sonra, hayvanı servikal çıkık yoluyla ötenazi edin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Protokolün ardından transgenik bir Snap25-GCaMP6s hayvanı sakinleştirildi, geniculate gangliyon maruz kaldı ve video kaydedilirken dile tastant uygulandı. Deneyin amacı, her hücreden hangi şok tabancalarının yanıtlar ortaya çıkarttığıydı. Tastantlar (30 mM AceK, 5 mM Kinin, 60 mM NaCl, 50 mM IMP + 1 mM MPG, 50 mM Sitrik Asit)18 di suda çözünmüş ve dile 13 s DI su ile ayrılmış 2 s için uygulanmıştır.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu çalışma, genikül ganglionu cerrahi olarak ortaya çıkarmak ve nöronlarının GCaMP6'larla aktivitesini görsel olarak kaydetmek için adım adım bir protokol açıklanmaktadır. Bu prosedür çok benzer daha önce açıklanan17, birkaç önemli istisna dışında. İlk olarak, bir kafa direğinin kullanılması, ameliyat sırasında kafa konumlandırmasının kolay ayarını sağlar. İkincisi, uyaran teslimatı ile ilgili olarak, Wu ve Dvoryanchikov'un yaklaşımı, yemek borusu tüpü<...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların rapor etmek için herhangi bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar fare hayvancılığı için S. Humayun'a teşekkür eder. Bu çalışma için finansman kısmen UTSA'nın Beyin Sağlığı Konsorsiyumu Mezunu ve Doktora Sonrası Tohum Hibesi (B.E.F.) ve NIH-SC2-GM130411 tarafından L.J.M.'ye sağlanmıştır.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 x #5 Inox Forceps | Fine Science Tools | NC9792102 | |
| 1ml Syringe with luer lock | Fisher Scientific | 14-823-30 | |
| 2 x #3 Inox Forceps | Fine Science Tools | M3S 11200-10 | |
| 27 Gauge Blunt Dispensing Needle | Fisher Scientific | NC1372532 | |
| 3M Vetbond | Fisher Scientific | NC0398332 | |
| 4-40 Machine Screw Hex Nuts | Fastenere | 3SNMS004C | |
| 4-40 Socket Head Cap Screw | Fastenere | 3SSCS04C004 | |
| Absorbent Points | Fisher Scientific | 50-930-668 | |
| Acesulfame K | Fisher Scientific | A149025G | |
| Artificial Tears | Akorn | 59399-162-35 | |
| BD Allergist Trays with Permanently Attached Needle | Fisher Scientific | 14-829-6D | |
| Blunt Retractors | FST | 18200-09 | |
| Breadboard | Thor Labs | MB8 | |
| Citric Acid | Fisher Scientific | A95-3 | |
| Cohan-Vannas Spring Scissors | Fine Science Tools | 15000-02 | |
| Contemporary Ortho-Jet Liquid | Lang | 1504 | |
| Contemporary Ortho-Jet Powder | Lang | 1520 | |
| Cotton Tipped Applicators | Fisher | 19-062-616 | |
| Custom Head Post Holder | eMachineShop | See attached file 202410.ems | |
| Custom Metal Head Post | eMachineShop | See attached file 202406.ems | |
| DC Temperature Controller | FHC | 40-90-8D | |
| Digital Camera, sCMOS OrcaFlash4 Microscope Mounted | Hamamatsu | C13440 | |
| Disection Scope | Leica | M80 | |
| Hair Clippers | Kent Scientific | CL7300-Kit | |
| IMP | Fisher Scientific | AAJ6195906 | |
| Ketamine | Ketaved | NDC 50989-996-06 | |
| LED Cold Light Source | Leica Mcrosystems | KL300LED | |
| Luer Lock 1/16" Tubing Adapters | Fisher | 01-000-116 | |
| Microscope | Olympus | BX51WI | |
| Mini-series Optical Posts | Thorlabs | MS2R | |
| MPG | Fisher Scientific | AAA1723230 | |
| MXC-2.5 Rotatable probe Clamp | Siskiyou | 14030000E | |
| NaCl | Fisher Scientific | 50-947-346 | |
| petri dishes | Fisher Scientific | FB0875713A | |
| Pressurized air | Airgas | AI Z300 | |
| Quinine | Fisher Scientific | AC163720050 | |
| Self Sticking Labeling Tape | Fisher Scientific | 159015R | |
| Silicone Pinch Valve Tubing 1/32" x 1/16" o.d. (per foot) | Automate Scientific | 05-14 | |
| Sola SM Light Engine | Lumencor | ||
| Snap25-2A-GCaMP6s-D | JAX | 025111 | |
| Student Fine Scissors | Fine Science Tools | 91460-11 | |
| Surgical Probe | Roboz Surgical Store | RS-6067 | |
| Surgical Probe Holder | Roboz Surgical Store | RS-6061 | |
| Thread | Gütermann | 02776 | |
| BD Intramedic Tubing | Fisher Scientific | 22-046941 | |
| Two Stage Gas Regulator | Airgas | Y12FM244B580-AG | |
| Tygon vinyl tubing - 1/16" | Automate Scientific | 05-11 | |
| Valvelink8.2 digital/manual controller | Automate Scientific | 01-18 | |
| Valvelink8.2 Pinch Valve Perfusion System | Automate Scientific | 17-pp-54 | |
| Xylazine | Anased | NADA# 139-236 |
Referanslar
- Krimm, R. F. Factors that regulate embryonic gustatory development. BMC Neuroscience. 8, Suppl 3 4(2007).
- Taruno, A., Matsumoto, I., Ma, Z., Marambaud, P., Foskett, J. K. How do taste cells lacking synapses mediate neurotransmission? CALHM1, a voltage-gated ATP channel. Bioessays. (35), 1111-1118 (2013).
- Taruno, A., et al. Taste transduction and channel synapses in taste buds. Pflugers Archiv-European Journal of Physiology. 473, 3-13 (2021).
- Kinnamon, S. C., Finger, T. E. A taste for ATP: neurotransmission in taste buds. Frontiers in Cell Neuroscience. 7, 264(2013).
- Chandrashekar, J., Hoon, M. A., Ryba, N. J., Zuker, C. S. The receptors and cells for mammalian taste. Nature. 444 (7117), 288-294 (2006).
- Yarmolinsky, D. A., Zuker, C. S., Ryba, N. J. Common sense about taste: from mammals to insects. Cell. 139 (2), 234-244 (2009).
- Ninomiya, Y., Tonosaki, K., Funakoshi, M. Gustatory neural response in the mouse. Brain Research. 244 (2), 370-373 (1982).
- Formaker, B. K., MacKinnon, B. I., Hettinger, T. P., Frank, M. E. Opponent effects of quinine and sucrose on single fiber taste responses of the chorda tympani nerve. Brain Research. 772 (1-2), 239-242 (1997).
- Frank, M. The classification of mammalian afferent taste nerve fibers. Chemical Senses. 1 (1), 53-60 (1974).
- Ogawa, H., Yamashita, S., Sato, M. Variation in gustatory nerve fiber discharge pattern with change in stimulus concentration and quality. Journal of Neurophysiology. 37 (3), 443-457 (1974).
- Sollars, S. I., Hill, D. L. In vivo recordings from rat geniculate ganglia: taste response properties of individual greater superficial petrosal and chorda tympani neurones. Journal of Physiology. 564, Pt 3 877-893 (2005).
- Yokota, Y., Bradley, R. M. Geniculate ganglion neurons are multimodal and variable in receptive field characteristics. Neuroscience. 367, 147-158 (2017).
- Breza, J. M., Curtis, K. S., Contreras, R. J. Temperature modulates taste responsiveness and stimulates gustatory neurons in the rat geniculate ganglion. Journal of Neurophysiology. 95 (2), 674-685 (2006).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits: A decade of progress. Neuron. 98 (4), 865(2018).
- Barreto, R. P. J., et al. The neural representation of taste quality at the periphery. Nature. 517, 373-376 (2015).
- Wu, A., Dvoryanchikov, G. Live animal calcium imaging of the geniculate ganglion. Protocol Exchange. , 106(2015).
- Lee, H., Macpherson, L. J., Parada, C. A., Zuker, C. S., Ryba, N. J. P. Rewiring the taste system. Nature. 548 (7667), 330-333 (2017).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171(2015).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- Li, K. The image stabilizer plugin for ImageJ. , Available from: http://www.cs.cmu.edu/~ kangli/code/Image_Stabilizer. html (2008).
- Ackman, J. dF Over F movie ImageJ Plugin. , Available from: https://gist.github.com/ackman678/5817461 (2014).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, (2019).
- Zhang, J., et al. Sour sensing from the tongue to the brain. Cell. 179 (2), 392-402 (2019).
- Lee, D., Kume, M., Holy, T. E. A molecular logic of sensory coding revealed by optical tagging of physiologically-defined neuronal types. bioRxiv. , 692079(2019).
- Moeyaert, B., et al. Improved methods for marking active neuron populations. Nature Communication. 9 (1), 4440(2018).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır