Method Article
Kromatin İmmünopresipitasyon Analizi için Dondurulmuş Kimerik Karaciğer Dokusundan Kromatin Ekstraksiyonu
Bu Makalede
Özet
Bu protokol, dondurulmuş dokulardan kromatin preparatına odaklanır ve Crosslinking Chromatin Immunoprecipitation (X-ChIP) ve ardından kantitatif PCR analizi (X-ChIP-qPCR) veya yeni nesil dizileme yaklaşımları (X-ChIP-seq) için uygundur.
Özet
Çapraz Bağlama Kromatin İmmünopresipitasyonu (X-ChIP), konakçı ve/veya patojen kromatin üzerindeki histon izlerinin seviyelerini ve transkripsiyon faktörlerinin doluluğunu değerlendirmek için yaygın olarak kullanılan bir tekniktir. Dokulardan kromatin preparatı, hücre kültürü için kullanılanlarla karşılaştırılabilir tekrarlanabilir ve güvenilir protokoller elde etmek için üstesinden gelinmesi gereken ek zorluklar yaratır. Doku bozulması ve fiksasyon, kromatinin etkili bir şekilde kesilmesini sağlamak için kritik adımlardır. Farklı hücre tiplerinin ve kümelerinin bir arada bulunması, optimum parça boyutuna ulaşmak için farklı kesme süreleri gerektirebilir ve kesme tekrarlanabilirliğini engelleyebilir. Bu yöntemin amacı, hem ChIP-qPCR hem de yeni nesil dizileme (NGS) uygulamaları için uygun dondurulmuş dokudan (karaciğer) güvenilir ve tekrarlanabilir konakçı kromatin preparatları elde etmektir. Sıvı azot dokusu pulverizasyonunun ardından homojenizasyonun kombinasyonunun, yalnızca homojenizasyona kıyasla daha fazla tekrarlanabilirliğe yol açtığını gözlemledik, çünkü çoğunlukla verimli bir şekilde kesilebilen ayrışmış tek hücrelerden oluşan bir süspansiyon sağlar. Ayrıca, homojen çapraz bağlama sağlamak için fiksasyon adımı hafif rotasyon altında gerçekleştirilmelidir. Sabit malzeme daha sonra zaman alıcı santrifüjleme gradyanlarından kaçınarak sitoplazmik protein ve patojen DNA'larının ve RNA'larının (uygulanabilir olduğunda) kontaminasyonunu azaltmak için tampon bazlı çekirdek izolasyonu için uygundur. Sonraki sonikasyon nükleer lizizi tamamlayacak ve kromatini keserek seçilen kesme koşullarına göre belirli bir boyut aralığı üretecektir. Boyut aralığı NGS uygulamaları için 100 ila 300 nt arasında olmalıdır, ChIP-qPCR analizi için daha yüksek (300-700 nt) olabilir. Bu tür protokol uyarlamaları, dondurulmuş doku örneklerinden kromatin analizlerini büyük ölçüde iyileştirebilir.
Giriş
Keşfinden bu yana, memeli hücrelerinde epigenetik düzenleme, bu tür mekanizmaların anlaşılmasının sadece hücre biyolojisinde değil, aynı zamanda hastalık ve tümör biyolojisinde de önemli bilgiler sağlayacağı göz önüne alındığında, giderek artan bir tanıma kazanmıştır1. Ayrıca, enfeksiyöz ajanlar da konakçı epigenetik değişikliklere neden olabilir2 konakçı hücre mekanizması, kalıcı DNA virüsleri 3,4 gibi patojenlerin kromatinini de etkileyebilir. Bu konakçı-patojen etkileşimi enfeksiyon kalıcılığında rol oynuyor gibi görünmektedir. 2
DNA ile geri dönüşümlü bir ilişki yoluyla, histon proteinleri nükleozom adı verilen bir kompleks oluşturur. Nükleozomlar sırayla kromatin olarak bilinen daha yüksek bir organizasyon seviyesine ulaşır. Kromatin yeniden şekillenmesinin, gen ekspresyonunu sıkı bir şekilde düzenlediği, transkripsiyon faktörlerine (TF'ler) erişim izni verdiği veya reddettiği bilinmektedir5. Bu faktörler, RNA polimeraz II'nin (PolII) gen promotörlerine alımını tetikleyebilir veya bloke edebilir ve DNA şablon6'dan mRNA sentezini etkileyebilir. Histon proteinleri, histon kıvrımının her iki ucunu çevreleyen kuyruk7'yi içerir, bu da post-translasyonel modifikasyonlara (PTM'ler) maruz kalabilir ve yapısal kromatin değişiklikleri ile gen transkripsiyonunun sıkı bir şekilde düzenlenmesine izin verir. Histon PTM'lerin çoğu kuyruk N-terminusunda bulunur, asetilasyon ve metilasyon en iyi çalışılan PTM'lerdir, ancak fosforilasyon8, ubikitinasyon9 ve ribozilasyon10 da bildirilmiştir. Bu tür proteinleri karakterize etmek ve incelemek, gen düzenlemesi hakkında derin bir fikir edinmek için gereklidir.
Şu anda, doğrudan DNA-protein etkileşimlerini incelemek için bir avuç köklü yöntem ve araç bulunmaktadır: Elektroforetik mobilite kayma testi (EMSA), Maya tek hibrit tahlil (Y1H) ve DNA ayak izi11. Bununla birlikte, bu yöntemler kendi başına tek DNA-protein etkileşimlerine odaklanır ve genom çapında çalışmalar için geçerli değildir. Bu tekniklerin bir diğer sınırlaması, araştırılan DNA segmentleri ile histon ilişkisinin olmamasıdır. Bu nedenle, bu tür yaklaşımlar in vivo transkripsiyonel makinenin karmaşıklığını yansıtmak için tasarlanmamıştır ve DNA'ya protein bağlanmasını etkileyebilecek (teşvik edebilecek veya inhibe edebilecek) önemli yapısal değişiklikleri12 veya diğer gerekli enzimleri / kofaktörleri13 dikkate almazlar.
Hücrelerin formaldehit (FA) gibi ajanlarla sabitlenmesinin, protein-DNA etkileşimlerinin in vivo anlık görüntüsünü sağlayabileceği fikri, kromatin immünopresipitasyon tahlillerinin (ChIP) gelişimi için temel oluşturmuştur14. Bu, kantitatif PCR (qPCR) teknolojisinin ve oldukça spesifik antikorların mevcudiyeti ile birlikte, ChIP-qPCR testlerinin geliştirilmesine izin verdi. Daha sonra, maliyetleri daha uygun hale gelen yeni nesil dizileme tekniklerinin (NGS) ortaya çıkışı, ChIP deneylerini NGS yaklaşımlarıyla (ChIP-seq) birleştirmeyi kabul etti ve böylece araştırmacılara kromatin düzenlemesinin araştırılmasını sağlayan yeni güçlü araçlar sağladı. Bu tahlillerde, izole edilmiş veya kültürlenmiş hücreler disuccinimidyl glutarat (DSG) ve / veya FA ile sabitlenir, çekirdekler izole edilir, kromatin daha sonra parçalanır ve ilgili antikor tarafından çökeltilir. Bundan sonra DNA, PCR veya NGS yaklaşımları ile saflaştırılır ve analiz edilir. EMSA, Y1H ve DNA ayak izinin aksine, ChIP testleri hücre içindeki protein-DNA etkileşiminin küresel bir anlık görüntüsünü sağlama yeteneğine sahiptir. Bu, esneklik sunar ve aynı numune içinde birden fazla lokusun analizine izin verir. Bununla birlikte, tahlilin doğası gereği, ChIP, nihayetinde, doğrudan protein-DNA etkileşimleriyle ilgilendiğinde, yukarıda belirtilen yöntemlerin hassasiyetini sunmayan, sadece doğrudan etkileşimleri değil, dolaylı etkileşimleri de tespit edebilir.
Hücre kültürü materyalinden kromatin hazırlama protokolleri iyi kurulmuş15 ve yüksek oranda tekrarlanabilir, kullanıcının 1-2 iş günü içinde hem qPCR hem de NGS yaklaşımları için uygun kromatin elde etmesini sağlar. Bununla birlikte, tüm dokulardan yüksek kaliteli kromatin elde etmek, kromatinin optimal fiksasyonunu ve kesilmesini sağlarken doku içindeki hücreleri ayrıştırma ihtiyacı nedeniyle hala bir zorluktur. Ek olarak, farklı doku tiplerinin bileşimi ve morfolojisi değişir, bu nedenle mevcut protokollerin ayarlanmasını gerektirir16,17. Kriyokorunmuş dokunun kullanımı, taze numunelere kıyasla ek zorluklar sunar. Bunun nedeni, kapsamlı malzeme kaybı olmadan tek bir hücre süspansiyonu elde etmenin zorluğudur. Bu, yanlış kesmeye yol açarak aşağı akış uygulamalarını engeller. Bununla birlikte, taze muadili yerine dondurulmuş doku örneklerine erişmek sadece çalışma esnekliğini arttırmakla kalmaz, aynı zamanda uzunlamasına veya karşılaştırmalı çalışmalardan kaynaklanan örneklerle çalışan araştırmacılar için tek seçeneği temsil edebilir. Dondurulmuş doku için bir avuç kromatin hazırlama protokolü yayınlanmıştır. Bunlar çoğunlukla numune çözme ve ardından kıyma, manuel/makine tabanlı ayrışma veya sıvı azot toz haline getirme adımları18,19,20'ye dayanır.
Burada, hem viral hem de konakçı genomlarını analiz etmeyi amaçlayan X-ChIP yaklaşımlarına uygun tekrarlanabilir bir kromatin kesme elde etmek için sıvı azottaki doku pulverizasyonunu havane homojenizasyonu ile birleştiren dondurulmuş sabitlenmemiş karaciğer örnekleri için optimize edilmiş bir kromatin hazırlama yöntemi15 açıklanmaktadır.
Protokol
İnsan karaciğeri kimerik farelerinden doku örneklemesi21 , Avrupa Birliği direktifi 86/609/EEC'ye uygun olarak gerçekleştirilmiş ve Helsinki Deklarasyonu ilkelerine uygun olarak Hamburg şehri ve eyaleti etik komitesi tarafından onaylanmıştır.
1. Reaktiflerin hazırlanması
- Deiyonize suda 1.25 M glisin çözeltisi hazırlayın. 0,22 μm gözenek boyutunda filtreli steril filtre. 4 °C'de saklayın.
- 5 M sodyum klorür (NaCl) çözeltisi hazırlayın. Oda sıcaklığında saklayınız.
- CaCl2 çözeltisi hazırlayın: Deiyonize suda 300 mM CaCl2 ve 10 mM Tris-HCl pH 8. 0,22 μm gözenek boyutlu filtreli steril filtre ve RT'de saklayın.
- Deiyonize suda% 10'luk bir Triton X-100 seyreltme hazırlayın. RT'de depolayın.
- Tris-EDTA tamponunu hazırlayın: Deiyonize suda 1 mM EDTA ve 10 mM Tris pH 8. 4 °C'de saklayın.
- Aşağıdaki tamponları gerekli miktara göre hazırlayın:
- Tampon A: 50 mM Hepes-KOH pH 7.5, 140 mM NaCl, 1 mM etilendiamintetraasetik asit (EDTA),% 10 Gliserol,% 0.5 NP-40 ve% 0.25 Triton X-100'ü deiyonize suda hazırlayın. 0,22 μm gözenek boyutunda filtreli steril filtre. 4 °C'de saklayın.
- Tampon B'yi hazırlayın: 10 mM Tris-HCl pH 8, 200 mM NaCl, 1mM EDTA, 0,5 mM egtazik asit (EGTA). 0,22 μm gözenek boyutunda filtreli steril filtre. 4 °C'de saklayın.
- Tampon C: %1 SDS, 10 mM EDTA ve 50 mM Tris-HCl pH 8'i deiyonize suda hazırlayın. 0,22 μm gözenek boyutunda filtreli steril filtre. RT'de depolayın.
- Kromatin seyreltme tamponu hazırlayın: deiyonize suda %0,01 SDS, %1,1 Triton X-100, 1,2 mM EDTA, 16,6 mM Tris-HCl pH 8 ve 166 mM NaCl. 0,22 μm gözenek boyutunda filtreli steril filtre. 4 °C'de saklayın.
2. Malzeme hazırlama
- Kuru buz, buz ve sıvı azot toplayın.
DİKKAT: Yanıkları önlemek için kuru buz ve sıvı azotu gerekli özenle kullanın. - Santrifüjü 4 °C'de önceden soğutun.
NOT: Bu adım, yıkama adımları sırasında protein bozulmasını ve çapraz bağlanmayı önlemek için önemlidir, çünkü bu, kromatinin kalitesini düşürecektir. - Kuru buz üzerine steril bir tabak koyun ve soğumaya bırakın.
NOT: Plakanın kesme işlemini kolaylaştıracak kadar büyük olduğundan emin olun. 100 mm'lik Petri tabağı/hücre kültürü kabı önerilir. - Gerekli glisin alikotunu 1.25 M çıkarın ve RT'ye ulaşmasına izin verin.
- Tampon A, B ve PBS'nin gerekli alikotlarını çıkarın. 1 kat konsantrasyona ulaşmak için proteaz ve / veya deasetilaz ve fosfataz inhibitörleri ekleyin ve bunları buz üzerinde bırakın.
- RT'de bırakarak gerekli tampon C aliquotunu çıkarın. Belirtilene kadar proteaz ve/veya deasetilaz ve fosfataz inhibitörlerini eklemeyin.
- RT PBS'nin gerekli aliquot'unu çıkarın.
DİKKAT: Tampon C, sodyum dodesil sülfat (SDS) içerir. Tamponu hazırlarken uygun güvenlik önlemlerini alın.
NOT: SDS buz üzerinde çökelir ve proteaz ve deasetilaz inhibitörleri RT'de kararlı değildir. - Haznesine sıvı azot döken harcı önceden soğutun ve tedarikçi talimatlarına kesinlikle uyun. Metal havaneyi kuru buzda en az 5 dakika soğutun.
NOT: Önerilene alternatif bir harç kullanmak mümkündür. Bununla birlikte, bu protokolde kullanılan cihaz, kendine özgü yapısı nedeniyle, toz haline getirme işlemi sırasında önemli bir kayıp olmadan az miktarda doku ile çalışmaya izin verir. - Dounce homojenizatörünü buz üzerinde ilişkili havane A ile önceden soğutun.
NOT: Havane A, homojenizatör ile gevşek bir uyum sağlar. Bu, önemli hücre lizisi olmadan tek bir hücre süspansiyonu elde etmeyi sağlar.
3. Doku çapraz bağlama
- Bir neşter ve cımbız yardımıyla kuru buz üzerinde doğrudan kabın üzerinde yaklaşık 50 mg dondurulmuş doku kesin.
NOT: Neşterin RT'de tutulması önerilir, çünkü bu kesme işlemini kolaylaştıracaktır. Neşter üzerine çok fazla baskı uygulamaktan kaçının, çünkü bu, doku parçalarının kesme alanının dışına saçılma riskini artıracaktır. Not etmek gerekirse, 50 mg doku (bu durumda karaciğer) yaklaşık 5 milyon hücre vermelidir. Sıcak bıçağın kesici kenarı çözeceğini unutmayın. Bununla birlikte, doku parçasının nispeten büyük boyutu göz önüne alındığında, bunun sınırlı bir etkisi olmalıdır. Daha küçük parçalar kesildiğinde, dokunun dağılmasını önlemek için dikkat ederek soğuk bir neşter kullanmak faydalı olabilir. - Kesilen dokuyu kuru buz üzerinde soğutulmuş 1,5 mL'lik bir tüpe koyun. Doku çözülmesinden kaçının.
- Dokuyu içeren tüpü harç üzerine hareket ettirin ve 5 dakika boyunca orada oturmasına izin verin.
NOT: Numunenin harçta dinlenmesine izin verilmesi, sıcaklığını düşürür (-80 °C'den -196 °C'ye). Bu, tokluğunu arttırır ve toz haline getirme adımını kolaylaştırır. - Önceden soğutulmuş havane yardımıyla numuneye, daha fazla katı ufalanma görünmeyene kadar basınç uygulayın.
NOT: Aşırı dönme kuvvetleri ile havane ısıtmasından kaçınmak önemlidir, çünkü bu numuneyi çözecektir. Her numune pulverizasyonundan sonra havaneli% 70 etanol (EtOH) ile temizleyin ve kuru buz üzerinde tekrar soğumaya bırakın. - Numuneyi içeren tüpü harçtan çıkarın ve gerekli inhibitörlerle 950 μL buz gibi soğuk PBS ekleyin. Numune tamamen askıya alınana kadar yavaşça yukarı ve aşağı pipet yapın. Hemen adım 3.6'ya geçin.
- Doku süspansiyonunu homojenizatöre aktarın ve daha ince bir süspansiyon elde etmek için havaneli A ile 20-30 vuruş uygulayın. Köpüklenmeden kaçının.
NOT: Vuruş miktarı doku kıvamına göre optimize edilmelidir. Bu adım, pulverizasyondan sonra elde edilen küçük hücre kümelerini daha da ayrıştırır. Uygun olmayan bir homojenizasyon, kesme verimliliğini etkileyebilir. - Homojenatı buz üzerinde önceden soğutulmuş yeni bir 1,5 mL tüpe aktarın.
- 4 °C'de 1.300 x g'de 5 dakika boyunca santrifüj yapın ve süpernatanı dikkatlice çıkarın.
- Peletleri nazik pipetleme ile 950 μL RT PBS'de tamamen askıya alın ve %1 nihai konsantrasyona sahip olmak için 63,6 μL'lik %16 MeOH içermeyen FA ekleyin. Hemen adım 3.10'a geçin.
DİKKAT: FA toksik bir kimyasaldır. Uygun güvenlik önlemleriyle bir duman davlumbazının altında tutun.
NOT: Tamamlanmamış yeniden süspansiyon, fiksasyon adımı sırasında hücre toplanmasına neden olabilir. Bu, lizis ve kesme işlemini engeller. - RT'de 10 dakika döndürün. Hemen ardından adım 3.11'e geçin
NOT: Agregaları önlemek için rotasyon gereklidir. Fiksasyon için gereken süre, ilgilenilen hedefe ve numune tipine göre optimize edilmelidir. Aşırı sabitleme sürelerinin uygun kesmeyi engelleyebileceğini not etmek önemlidir. - 125 mM nihai konsantrasyon elde etmek için RT'ye 113 μL 1.25 M glisin ekleyin ve 5 dakika döndürün.
NOT: Glisin, aşırı çapraz bağlanmayı önleyerek fiksatif reaksiyonu söndürür. - 4 °C'de 3 dakika boyunca 1.300 x g'de santrifüj.
- Süpernatantı atın ve gerekli inhibitörlerle 950 μL buz gibi soğuk PBS'de pipetleme yaparak peleti dikkatlice askıya alın.
- 4 °C'de 3 dakika boyunca 1.300 x g'de santrifüj.
- 3.13-3.14 arasındaki adımları tekrarlayın ve hemen kromatin izolasyon adımlarına geçin.
4. Kromatin izolasyonu
- Peletin üzerine gerekli inhibitörlerle birlikte 950 μL Tampon A ekleyin. Pelet tamamen boşalana kadar pipetleme ile hafifçe karıştırın ve 4 °C'de 10 dakika döndürün.
NOT: Bu adım, çekirdek lizisi olmadan sabit tek hücreli süspansiyonu lize eder. Bu, sitozolik proteinlerin ve RNA'ların numunesinin atılmasına izin verir. Lizis süresinin uzatılması, lize edilmesi zor hücreler için faydalı olabilir, ancak dokunun kullanım süresini arttırır. Bu noktada, kümelerin boyutunu ve tek hücrelerin varlığını kontrol etmek için tripan mavisi / DAPI boyamasından sonra preparatı mikroskop altında kontrol etmek mümkündür. Bununla birlikte, sabit doku materyali nedeniyle tek çekirdeğin takdir edilmesi kolay olmayabilir. - 2.000 x g'de 4 °C'de 5 dakika boyunca santrifüj yapın ve süpernatanı dikkatlice çıkarın.
- Peletin üzerine gerekli inhibitörlerle birlikte 950 μL Tampon B ekleyin. Pelet tamamen boşalana kadar pipetleme ile hafifçe karıştırın ve 4 °C'de 10 dakika döndürün.
NOT: Bu adım, daha fazla istenmeyen lizizi önlemek için lizis tamponunu çekirdek preparatından yıkar. - 2000 x g'de 4 °C'de 5 dakika boyunca santrifüj. Bu arada, gerekli inhibitörleri (adım 2.5 ile aynı) C tamponuna ekleyin.
- Supernatan'ı dikkatlice çıkarın.
- Pelet ve pipete kuvvetli bir şekilde 300 μL RT tampon C ekleyin.
- Numuneyi 15-30 s boyunca vorteks edin ve kapaktaki damlaları toplamak için tüpü kısaca döndürün.
NOT: Bu adım, sabit çekirdekleri serbest bırakmak ve lize etmek için önemlidir. Numune bütünlüğünü korumak ve aynı zamanda SDS çökelmesinden kaçınmak için, sonikasyondan önce numuneyi 9-11 ° C'lik bir sıcaklığı korumak için buz üzerinde tutulan plastik bir rafta tutun.
5. Kromatin parçalanması
- Numuneyi, tüp başına 100 μL lize çekirdek süspansiyonu sağlayan üç temiz 0.65 mL sonikasyon sertifikalı tüpe aktarın.
NOT: Maksimum hacim 300 μL olan 1.5 mL sonikasyon sertifikalı tüpler kullanmak mümkündür. Bu tüpler için özel bir tutucuya ihtiyaç vardır. 0,65 mL, tüp başına numunenin daha küçük hacmi nedeniyle daha homojen kesme sunmalıdır. - 30 s AÇIK ve 30 s KAPALI ayarı ile yüksek yoğunlukta 28 döngü için kromatini sonikleştirin. Sonikatör banyosunun uygun şekilde soğutulduğundan emin olun (buz veya soğutma cihazı).
NOT: Bu adımın hemen hemen her durumda optimizasyona ihtiyacı vardır. Kullanıcı, kesme süresinin arttırılmasının daha küçük ve daha homojen parçalar sağlayacağını akılda tutmalıdır; Bununla birlikte, bu kromatin kalitesini düşürme şansını artırabilir. Gerekli parça boyutunu sağlayan en düşük döngü sayısını seçin. Bu adımın optimizasyonu sırasında, döngü sayısının çekirdeklerin çoğunluğunu lize etmek için yeterli olup olmadığını kontrol etmek için nükleer boyama yapmak yararlıdır. - Sonikasyonlu kromatini, daha önce buz üzerinde soğutulmuş yeni bir 1.5 mL tüpe aktarın.
- 30 μL Triton X-100% 10 çözelti ve 5-10 s boyunca vorteks ekleyin.
NOT: Triton X-100, SDS'yi bağlayarak 4 °C'de daha fazla yağışı önler. Triton X-100'ün nihai miktarı her zaman% 1 olmalıdır. - 4 °C'de 15 dakika boyunca 16.000 x g'de santrifüj.
- Süpernatantı buz üzerinde önceden soğutulmuş temiz bir 1,5 mL tüpe aktarın.
- NOT: Süpernatant kesilmiş kromatini içerir ve net görünmelidir. Pelet "kesilemez" dinlenmeler içerir ve oldukça küçük kalmalıdır (karaciğer dokusu durumunda çoğunlukla kahverengi). Başarısız kesme işleminin belirtilerini arayın: daha net hale gelmeyen kromatin çözeltisi ve adım 4.5'teki pelet boyutlarına benzer.
6. DNA saflaştırma
- 10-25 μL kesilmiş kromatini yeni bir tüpe aktarın ve 200 μL'lik son hacme ulaşmak için Tampon C ekleyin. Gerekirse, prosedür bu adımda kesintiye uğrayabilir ve numune -20 ° C'de saklanabilir.
- 8 μL 5 M NaCl ekleyin ve 1000 rpm'de çalkalama altında bir ısıtma bloğunda 65 ° C'de en az 6 saat inkübe edin.
NOT: Bu adım, kromatinin çapraz bağlantısını keser. Çapraz bağlamayı mümkün olduğunda gece boyunca uzatmak daha güvenlidir. NaCl'nin varlığı süreci daha verimli hale getirir. - Numuneleri RT'de 5 dakika soğumaya bırakın ve 2 μL RNase A ekleyin.
- 1000 rpm'de çalkalama altında 37 ° C'de 1 saat inkübe edin.
- Numuneleri ısıtma bloğundan çıkarın ve 7 μL 300 mM CaCl 2 ve2 μL Proteinaz K ekleyin.
- Isıtma bloğunu 56 ° C'ye ayarlayın ve 1000 rpm'de çalkalama altında 30 dakika boyunca inkübe edin. Bu arada, her numune için 4 ° C'de 1 dakika boyunca 16.000 x g'de santrifüj ederek bir faz ayırma tüpü hazırlayın.
NOT: Bu özel tüpler, nükleik asit fenol-kloroform ekstraksiyonu sırasında faz ayrımını kolaylaştırır. - Tüpleri ısıtma bloğundan çıkarın ve RT'de 3 dakika boyunca dengelenmelerini sağlayın.
- Numunenin 400 μL'sini daha önce santrifüjlenmiş bir faz ayırma tüpüne aktarın.
- 400 μL fenol-kloroform-izoamil alkol çözeltisi (PCI) ve 5 s boyunca vorteks ekleyin.
DİKKAT: PCI oldukça uçucu ve toksik bir bileşiktir. Lütfen bir duman davlumbazının altında gerekli güvenlik önlemleriyle kullanın. - 4 °C'de 5 dakika boyunca 16.000 x g'de santrifüj.
- 5 s için 400 μL Kloroform ve vorteks ekleyin.
DİKKAT: Kloroform oldukça uçucu ve toksik bir bileşiktir. Lütfen bir duman davlumbazının altında gerekli güvenlik önlemleriyle kullanın.
NOT: Bu adım, aşağı akış PCR uygulamalarına müdahale edebilecek olası fenol kalıntılarını temizler. - 4 °C'de 5 dakika boyunca 16.000 x g'de santrifüj.
- Üst fazın 400 μL'sini, 24 μL 5 M NaCl ve 0.75 μL glikojen eklendiği yeni bir 1.5 mL tüpe aktarın. Kısaca vorteks.
- 1.055 μL% 100 EtOH ekleyin ve iyice vorteks yapın. Doğru karıştırmayı sağlayın.
- 1 saat boyunca -80 ° C'de veya gece boyunca -20 ° C'de (AÇIK) inkübe edin.
NOT: Bu adım kesilen DNA'yı çökeltir; verimi en üst düzeye çıkarmak için ON inkübasyonunun seçilmesi önerilir. - 4 °C'de 30 dakika boyunca 16.000 x g'de santrifüj.
- Peletin yerinden çıkmamasına dikkat ederek süpernatantı dikkatlice çıkarın.
- 500 μL soğuk% 70 EtOH ekleyin. Peletin yıkandığından emin olmak için tüpü hafifçe eğin.
NOT: Bu adım, nükleik asitlerle birlikte çökelmiş olabilecek tuz kalıntılarını gidermek için gereklidir. Tuzlar diğer çıkış yönündeki uygulamalara müdahale edebilir. - 4 °C'de 15 dakika boyunca 16.000 x g'de santrifüj.
- Tüm süpernatantı dikkatlice çıkarın ve peletin RT'de kurumasını bekleyin.
NOT: Borunun 37 °C'de bir ısıtma bloğu üzerinde inkübe edilmesi, kurutma için gereken süreyi azaltacaktır. - 50 μL Tris-EDTA çözeltisi (TE-Buffer) ekleyin ve tüpü 300 rpm'de çalkalama altında 5-10 dakika boyunca 37 ° C'de ısıtma bloğuna koyun.
NOT: Bu adım peletin çözünmesini sağlar. Protokol burada duraklatılabilir ve numune 1 haftaya kadar 4 ° C'de veya daha uzun depolama için -20 ° C'de saklanabilir. - % 1 agaroz jeli üzerinde DNA analizi yapın.
7. DNA boyutu analizi
- 100 mL çalışan tampon başına 1 g agarozu karıştırarak% 1'lik bir agaroz jeli hazırlayın (yani, Tris-asetat-EDTA (TAE) veya Tris-borat-EDTA (TBE)). Agaroz tamamen çözülene kadar süspansiyonu ısıtın. Jel çözeltisini dökmeden önce her 100 mL agaroz çözeltisi için 10 μL EtBr ekleyin.
DİKKAT: EtBr, kanserojen olduğu bilinen bir DNA interkalasyon ajanıdır. Lütfen bir duman davlumbazının altında gerekli güvenlik önlemleriyle kullanın.
NOT: EtBr boyama (doğrudan jel içinde veya koşudan sonra) şiddetle tavsiye edilir. Diğer DNA intercalating boyalar, DNA yaymaları ile çalışırken ellerimizde iyi performans göstermedi. Dar yükleme kuyuları, daha geniş olanlara kıyasla daha iyi bir çözünürlük sağlar. - Numunenin 10 μL'sini 2 μL 6x Yükleme Boyası ile karıştırın. Daha sonra, numunenin 10 μL'sini jelin içine yükleyin ve yükleme boyasının son bandı jelin 2 / 3'ü için çalışana kadar çalıştırın. Bir DNA merdiveni eklediğinizden emin olun.
- Jeli görüntüleyin ve yayma boyutunun istenen uygulama aralığında olup olmadığını doğrulayın.
Kromatin kalite kontrolünden geçerse, çıkış yönündeki uygulamalar için kullanılabilir.
Sonuçlar
Kromatin hazırlamak, başarılı bir ChIP elde etmek için çok önemli bir adımdır. Dondurulmuş örneklerden kaliteli kromatin hazırlamak için, verimli kesmeyi engelleyebilecek doku kümelerinin varlığını önlemek için fiksasyondan önce etkili doku bozulmasını sağlamalıyız. Şekil 1'de protokolün özetlenmiş bir işlem hattı gösterilmektedir. Tek başına pulverizasyon, dokuyu tamamen ayrıştırmak için yeterli değildir, çünkü değişken büyüklükte hücre kümeleri ve az sayıda tek hücre üretir (Şekil 1a). İlk pulverizasyon adımını Dounce homojenizasyonu ile ilişkilendirerek, doku kümelerinin miktarı güçlü bir şekilde azalır ve kalanlar daha küçüktür (Şekil 1b). Fiksasyon ve lizis adımlarından sonra, görünür tek çekirdek sayısı (Şekil 1c) artarken, tipik küresel görünüm kaybolur. 28 döngü için sonikasyondan sonra, nükleer boyama (Hoechst 33258 / DAPI) artık çoğunlukla görünmez. Bu gerçekten de başarılı bir kesme işleminin işaretidir (Şekil 1d). Bir kromatin alikotunun çapraz bağlanmasından ve DNA'nın agaroz jeli üzerinde görselleştirilmesinden sonra, başarılı kesme, 100-300 bp aralığında fragmanların varlığı ile tanınabilir. (Şekil 2a) DNA miktarı, hazırlanan doku parçasının bileşimine göre değişebilir. Bu kromatin, ChIP-qPCR için başarıyla kullanılabilir. Şekil 2b'de gösterildiği gibi, kromatin H3K4me3, H3K27ac (aktif genlerle ilgili modifikasyonlar) ve H3K27me3 (susturulmuş genlerle ilgili modifikasyon) antikorları ile başarılı bir şekilde çökeltilebilir. Kromozom 1 Açık Okuma Çerçevesi 43 (C1orf43), Proteazom 20S Alt Birim Beta 2 (PSMB2) ve Gliseraldehit 3-fosfat dehidrogenaz (mGapdh) promotör bölgeleri, Homeobox C13 (HOXC13), Homeobox C12 (HOXC12) ve fare Miyelin Transkripsiyon Faktörü 1 (mMyt1) promotör bölgelerine kıyasla H3K4me3 ve H3K27ac bakımından zenginleştirilmiş sonuçlar doğurmuştur (Tablo 1). Bunun nedeni, C1orf43, PSMB2 ve mGapdh'nin karaciğerde yapısal olarak transkripte edilmesi, HOXC13, HOXC12 ve mMyt1'in susturulmasıdır. H3K27me3, ChIP testinin başarısını doğrulayan tam tersi bir davranış gösterir. Bu farelerin karaciğerinin bir kimera olması, hem murin hem de insan kromatinini analiz etmemize izin verdi. Ek olarak, aynı kromatin ChIP-seq deneyleri için başarıyla kullanılabilir. Sıralama adımından sonra, okumalar, hizalanmamış parçaların miktarını azaltmak için hem murin hem de insan genomlarından oluşan bir indekse hizalandı. Daha sonra, okumalar türlere göre ayrılmış ve EaSeq22 ile daha fazla analiz edilmiştir. Sinyal yoğunluğu daha sonra her genin transkripsiyon başlangıç bölgesinde (TSS) ölçüldü ve sonuç H3K4me3 sinyal yoğunluğu için sıralandı. Şekil 3a ve Şekil 3c, hem fare hem de insan kromatini içindeki genlerin önemli bir kısmı için TSS'de H3K4me3 ve H3K27ac'nin belirgin bir varlığını göstermektedir. Buna ek olarak, H3K27me3 antikorelasyonları H3K4me3/H3K27ac ile ilişkilidir. H3K27me3, bu PTM'den beklendiği gibi sadece TSS'de değil, genin tüm uzunluğunda bulunur. Şekil 3b ve Şekil 3d, H3K27me3 için zenginleştirilmiş ve hem fare hem de insan karaciğerlerinde transkripsiyonel olarak inaktif olduğu bilinen HOXC / HoxC kümesini göstermektedir. H3K4me3 ve H3K27ac'nin profillenmesi, bu iki PTM için zirveleri gösterirken, H3K27me3'ün sinyal yoğunluğu daha düşük ve daha dağınık olma eğilimindedir.
Kromatin preparatının karmaşıklığı nedeniyle, aşırı fiksasyon meydana gelebilir, lizis veya sonikasyon süresi optimal olmayabilir, büyük hücre kümeleri devam edebilir veya numunenin yetersiz kullanımı yetersiz olabilir. Bunların hepsi preparatın kalitesini etkileyen olaylardır. Bazı durumlarda, kromatin parçalarının doğru boyutta zenginleştirilmesi hala mevcut olacak veya daha yüksek bir boyuta kaydırılacaktır. Diğer durumlarda, erken lizis veya başarısız kesme nedeniyle malzeme kaybı olabilir. Şekil 4 , bu tür olumsuz ve optimal olmayan sonuçların bazı örneklerini göstermektedir. Şerit 3 ve 4, parça boyutunun 200 bp ile 800 bp arasında zenginleştiğini göstermektedir. Bununla birlikte, parça boyutunun 100 bp'den >10.000 bp'ye kadar uzandığı açıktır. Şerit 5 ve 6'da, hazırlık sırasında belirgin bir malzeme kaybı ile 100-250 bp aralığında bir zenginleştirme mevcuttur. Bu, sonikasyonun neden daha küçük parçalar ürettiğini açıklayabilir. Şerit 7, parça aralığının artmasıyla biraz daha düşük optimal bir hazırlık gösterirken, şerit 8 neredeyse tamamen malzeme kaybı gösterir. Bu, erken nükleer lizis veya yetersiz doku ayrışmasından ve bunun sonucunda 5.5. adımdan sonra kaybolmasından kaynaklanabilir.
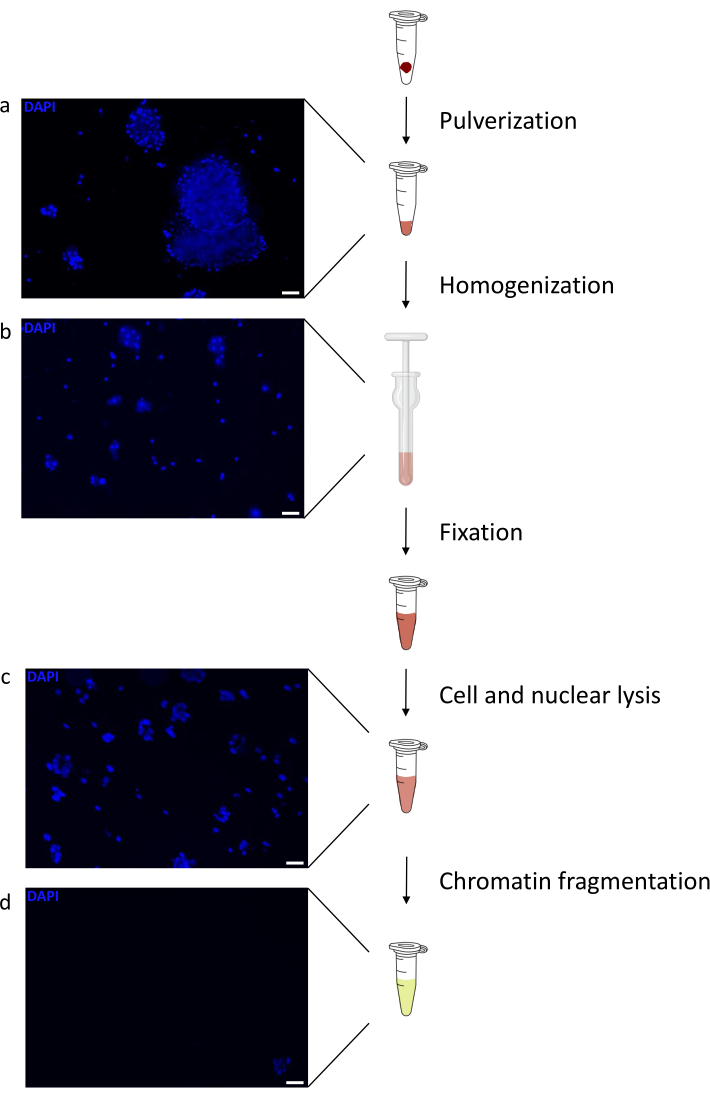
Şekil 1: Kromatin hazırlama protokolüne genel bakış. Resimler doku pulverizasyonundan sonra (a), ek manuel homojenizasyondan (b), nükleer lizizden sonra (c) ve sonikasyondan sonra (santrifüjlemeden önce) (d) çekildi. Nükleer boyama Hoechst 33258/DAPI ile yapıldı. Ölçek çubuğu = 200 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
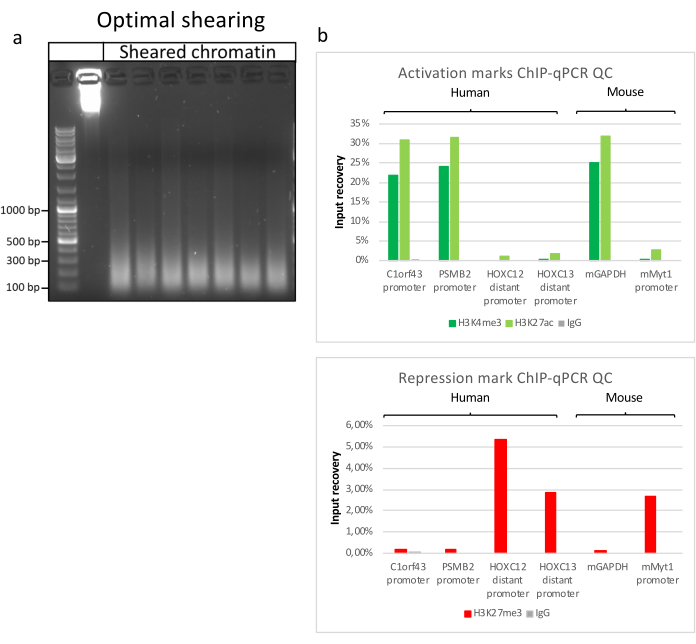
Şekil 2: Temsili kromatin kesme ve kalitesi ChIP-qPCR ile değerlendirilmiştir . Farklı kromatin preparatlarından elde edilen protokollere göre parçalanmış kromatin numuneleri ile% 1 agaroz jeli. Önceden kromatin/DNA bozunması olmamasını sağlamak için kesilmemiş kromatin kontrolü eklenir (a). Kesilmiş kromatin, ChIP-qPCR testi yaparak kalite açısından test edilmiştir. Yeni hazırlanan kromatini çökeltmek için H3K4me3, H3K27ac ve H3K27me3 antikorları kullanıldı. (b ) qPCR analizi insan (C1orf43 ve PSMB2), murin (Gapdh) aktif promotörler ve insan (HOXC13, HOXC12), murin (Myt1) inaktif promotörler üzerinde yapıldı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
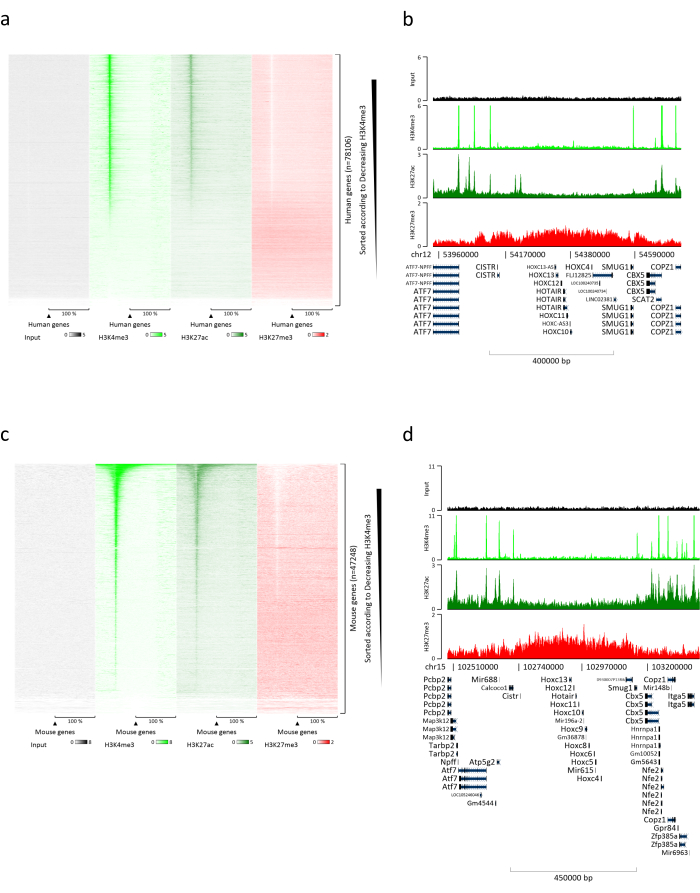
Şekil 3: Temsili ChIP-seq analizi. Okumalar, hem insan hem de fare genomları (hg19 ve mm10) ile oluşturulan bir indekse hizalanmıştır. Hizalamadan sonra insan ve murin okumaları ayrıldı ve daha fazla analiz edildi. Sinyalin TSS'de nicelleştirildiği ve H3K4me3 yoğunluğu (a) için azalan sırada gösterildiği insan genlerinin ısı haritası. Aktif genlerle çevrili baskılanmış genlerin (HOX kümesi) insan gen kümesi örneği (b). Sinyalin TSS'de nicelleştirildiği ve H3K4me3 yoğunluğu (c) için azalan sırada gösterildiği murin genlerinin ısı haritası. Aktif genlerle (d) çevrili baskılanmış genlerin (Hox kümesi) bir murin gen kümesi örneği. Gösterilen tüm veriler, milyon okuma başına EaSeq tarafından normalleştirilmiştir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 4: Optimal olmayan ve başarısız kromatin preparatları . Protokole göre parçalanmış kromatin örnekleri ile% 1 Agaroz jeli. Şekil, kontrol olarak kullanılan kesilmemiş kromatin (Şerit 2), optimal kesme (Şerit 3-4), şeffaf malzeme kaybı ile optimum kesme (Şerit 5-6), yetersiz kesme (Şerit 7) ve geniş malzeme kaybı (Şerit 8) içerir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
| Astar adı | Sıra | |
| C1orf43 destekleyicisi | İletmek | AGTGGGTGGAGAATGCAGAC |
| Ters | GAGATTACCCCACCCCATTC | |
| PSMB2 destekleyicisi | İletmek | CTTATTCAACCCCCGACAAA |
| Ters | GATGAAGGACGGTGAGAGGA | |
| HOXC13 distal promotör | İletmek | GAGCCCGAGATTCACTCAAC |
| Ters | TTATGCCCAGTTTTGGGGTA | |
| HOXC12 distal promotör | İletmek | AAAGCTTCCCACTGCAAAGA |
| Ters | AAATCTGGGGGCGAACTACT | |
| mGAPDH destekçisi | İletmek | GGTCCAAAGAGAGGGAGGAG |
| Ters | GCCCTGCTTATCCAGTCCTA | |
| mMYT destekçisi | İletmek | CAGCCCAATTCTAGCCACAT |
| Ters | CCAAAGCAGGGGAGTAGGAG |
Tablo 1: ChIP-qPCR testleri için kullanılan aktif ve inaktif genler için qPCR primerleri listesi.
Tartışmalar
Çıtçıtlı dondurulmuş dokudan kromatin preparatı, tekrarlanabilir ve güvenilir sonuçlar elde etmek için optimize edilmesi gereken adımların sayısı nedeniyle bir zorluk olmaya devam etmektedir. Daha önce yayınlanmış olanprotokollerin çoğu 16,23, manuel ayrışmadan önce doku kıyma gerektirir (atlama). Numunenin sabitlenmesinden önce protein bozulmasına neden olabilecek adımlardan mümkün olduğunca kaçınmaya çalıştık. Pulverizasyon adımı dondurulmuş karaciğer preparatları24'te zaten kullanılmaktadır ve manuel ayrışmayı daha kolay ve tekrarlanabilir hale getirir (bkz. Şekil 2a). 1.5 mL tüpler için özel olarak tasarlanmış bir harç kullanımı ile (bakınız Protokoller), pulverizasyon işlemi sırasında numune kaybı azalır ve karaciğer biyopsi örnekleri gibi az miktarda dokunun işlenmesine izin verilir. Prensip olarak, herhangi bir taşlama adımı olmadan doğrudan doku homojenizasyonu kullanmak mümkündür; Bununla birlikte, daha önce pulverizasyon yapılmadan doku homojenizasyonu, deneyimlerimize göre daha kötü bir tekrarlanabilirliğe sahiptir ve aşağı akış uygulamaları için sorunların ortaya çıkması daha yüksektir (veriler gösterilmemiştir).
Kromatinin dokulardan hazırlanmasında karşılaşılan sorunların çoğu, bu örneklerin doğasından ve hücre kümelerinin kaliteyi kaybetmeden fiksasyon için yeterince küçük olup olmadığının düzgün bir şekilde kontrol edilememesinden kaynaklanmaktadır. Dahası, her adımda her bir alikotu kontrol etmek, protein bozunma şansını artırmak için zaman alıcı olacaktır.
Fiksasyon (adım 3.9), kromatin preparatının temel ve önemli bir parçasıdır. Dokunun doğası gereği, fiksasyon adımı, doku homojenize edilene kadar ertelenmiştir. Bu tür ertelenmiş fiksasyon adımı, daha homojen bir hücre süspansiyonu üretme avantajına sahiptir. Bununla birlikte, özellikle manipülasyona duyarlı hedefler söz konusu olduğunda, sabitlemenin adım 3.6'dan hemen önce gerçekleştirilmesinin gerekli olabileceğinin farkındayız. Bu, son derece hassas proteinlerin veya PTM'lerin korunmasına yardımcı olur, ancak hücre kümelerinin boyutunu artırabilir, sabitlendiğinde homojen olmayan kesmeye neden olabilir. Protokolde kullanılan FA çözeltisinin konsantrasyonu standarttır, ancak genel fiksasyonu iyileştirmeye çalışmak için değiştirilebilir. Burada seçilen sabitleme süresi, sahada yaygın olarak kullanılan standart koşulları da yansıtır. Sabitleme çözeltisinin daha yüksek konsantrasyonu durumunda, sabitleme süresi azaltılabilirken, daha düşük bir miktar olması durumunda arttırılmalıdır. Operatör, fiksasyon süresindeki bir değişikliğin numunenin aşırı sabitlenmesine yol açabileceğini veya protein bozulmasına yer açabileceğini düşünmelidir. Büyük kompleksleri (veya bir kısmını) ve TF'leri çökeltmeyi hedeflemek durumunda, bir DSG çözeltisi ve ardından bir FA25,26 kullanarak çift adımlı bir sabitleme gerçekleştirmek avantajlı olacaktır. Bu durumda DSG, protein-protein etkileşimlerini stabilize ederken, formaldehit çoğunlukla doğrudan DNA-protein etkileşimleri üzerinde hareket eder27.
Operatör, DNA saflaştırması için adım 6.7'den başlayarak daha hızlı olan ve toksik bileşikler kullanmayan kolon tabanlı bir kit uygulama olasılığını dikkate almalıdır. Bununla birlikte, her zaman kaybedilecek olan belirli miktarda bağlanmamış DNA olacaktır. Bu nedenle, klasik fenol-kloroform ekstraksiyonunu ve ardından EtOH çökeltmesini kullanmanızı öneririz. Ayrıca, agaroz jelini çalıştırmadan önce (adım 7.2), DNA konsantrasyonunu ölçmek ve her kuyucuğun daha net bir resme sahip olması için aynı miktarı yüklemek faydalı olabilir.
Bu protokolün bir sınırlaması, bu protokolü yalnızca insan-karaciğer kimerik farelerinden türetilen karaciğer örneklerini kullanarak araştırdığımız ve kullandığımız gerçeğinden kaynaklanmaktadır28. Kendi başına karaciğer epitel ve bağ dokusundan oluşur29. Hastalık durumunda, fibrotik doku ve yağ dokusu mevcut olabilir30,31 doku bozulması sırasında ek zorluklar yaratır. Bununla birlikte, protokolümüzün ayrışma ve sonikasyon adımlarının optimizasyonu olmadan kemik, kas ve yağ dokusu üzerinde kullanılamayacağını biliyoruz. Unutulmaması gereken, hücre kültürü örneklerinde olduğu gibi hepsine uygun bir protokolün bulunmaması nedeniyle her dokunun bir tür optimizasyona ihtiyaç duymasıdır15. Bununla birlikte, çok az optimizasyonla veya hiç optimizasyon olmadan, bu protokolün akciğer, bağırsak, mide, pankreas veya böbrek dokuları gibi bileşimde karaciğer ile benzerlikleri paylaşan diğer dokulara başarıyla uygulanabileceğine inanıyoruz.
Protokolümüz ayrıca HBV kovalent kapalı DNA epizomu (cccDNA) üzerindeki TF'leri ve histon modifikasyonlarını analiz etmek için başarıyla kullanılmıştır32. Bu, insan Sitomegalovirüsü33 (hCMV) ve insan Adenovirüsleri34 (HAdV) gibi karaciğeri etkileyen diğer viral genomlar için böyle bir yaklaşım uygulama şansını açar. Kaposi Sarkoma Herpes Virüsü35 (KHSV), Herpes Simpleks Virüsü36 (HSV1/2) Polyoma virüsleri, Epstein-Barr Virüsü37 (EBV) gibi diğer dokularda kalıcı bir enfeksiyon oluşturan diğer DNA virüslerini analiz etmenin mümkün olacağı göz ardı edilmemiştir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Çalışma, Alman Araştırma Vakfı (DFG) tarafından Maura Dandri'ye (SFB 841 A5) hibe ve Hamburg Eyaleti tarafından Araştırma Programı (LFF-FV44: EPILOG) ile desteklenmiştir.
Dr. Tassilo Volz, Yvonne Ladiges ve Annika Volmari'ye teknik yardımları ve makaleyi eleştirel bir şekilde okudukları için teşekkür ederiz. Dr. Thomas Günther ve Prof. Adam Grundhoff, ChIP-qPCR analizi için çok yararlı öneriler ve astar setleri sağladıkları için.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22µm sterile syringe filter | Labsolute | 7699822 | |
| 1.5 mL Safeseal tubes | Sarstedt | 7,27,06,400 | |
| 6x orange loading dye | Thermofisher | R0631 | |
| Benchtop refrigerated centrifuge | |||
| Bioruptor NGS | Diagenode | ||
| Blade or Scalpel | |||
| Calcium chloride dihydrate | Carl Roth | HN04 | |
| Chloroform | Sigma Aldrich (Merck) | C2432 | |
| cOmplete Protease Inhibitor Cocktail | Roche | 11697498001 | |
| Deacetylase Inhibitor | Active Motif | 37494 | |
| Dounce tissue grinder set | Sigma Aldrich (Merck) | DWK885300-0001-1EA | |
| EDTA 500 mM solution | PanReac AppliChem | A4892 | |
| EGTA | Sigma Aldrich (Merck) | E4378 | |
| EtBr | Carl Roth | 2218 | Concentration 10mg/mL |
| Ethanol absolute | CHEMSOLUTE | 2273 | |
| Glycerol | Sigma Aldrich (Merck) | G9012 | |
| Glycin | Carl Roth | 0079 | |
| Glycogen | Roche | 10901393001 | Concentration: 20mg/mL |
| Heating block | |||
| HEPES | Sigma Aldrich (Merck) | H4034 | |
| LE Agarose | Biozym | 840000 | |
| Liquid nitrogen cooled mini mortar | Bel-Art | H37260-0100 | |
| MeOH free Formaldehyde 16% | Thermofisher | 28908 | |
| NP-40 | Roche | 11332473001 | |
| PBS 1x | Thermofisher | 10010015 | |
| Pefabloc SC-Protease-Inhibitor | Sigma Aldrich (Merck) | 11429868001 | |
| Phase Lock Gel - Heavy | QuantaBio | 2302830 | |
| Phenol:Chloroform:Isoamyl alcohol 25:24:1 | Sigma Aldrich (Merck) | P3803 | |
| Potassium chloride | Carl Roth | 6781 | |
| Potassium hydroxyde | Merck | 105033 | |
| Proteinase K | Lucigen | MPRK092 | Concentration: 50 µg/µL |
| RNAse A | Lucigen | MRNA092 | Concentration: 5 mg/mL |
| SDS 10% solution | PanReac AppliChem | A3950 | |
| Sodium carbonate anhydrous | Carl Roth | A135 | |
| Sodium chloride | Sigma Aldrich (Merck) | S7653 | |
| Sterile Petri dishes | Sarstedt | 83,39,02,500 | |
| Tris-HCl solution | Sigma Aldrich (Merck) | T2694 | |
| Triton-X100 | Sigma Aldrich (Merck) | X100 |
Referanslar
- Waddington, C. H., Pantelouris, E. M. Transplantation of nuclei in newt's eggs. Nature. 172 (4388), 1050-1051 (1953).
- Silmon de Monerri, N. C., Kim, K. Pathogens hijack the epigenome: A new twist on host-pathogen interactions. American Journal of Pathology. 184 (4), 897-911 (2014).
- Knipe, D. M., et al. Snapshots: chromatin control of viral infection. Virology. 435 (1), 141-156 (2013).
- Tropberger, P., et al. Mapping of histone modifications in episomal HBV cccDNA uncovers an unusual chromatin organization amenable to epigenetic manipulation. Proceedings of the National Academy of Sciences of the United States of America. 112 (42), 5715-5724 (2015).
- Sproul, D., Gilbert, N., Bickmore, W. A. The role of chromatin structure in regulating the expression of clustered genes. Nature Reviews Genetics. 6 (10), 775-781 (2005).
- Fischle, W., Wang, Y., Allis, C. D. Histone and chromatin cross-talk. Current Opinion in Cell Biology. 15 (2), 172-183 (2003).
- Ling, X., Harkness, T. A., Schultz, M. C., Fisher-Adams, G., Grunstein, M. Yeast histone H3 and H4 amino termini are important for nucleosome assembly in vivo and in vitro: redundant and position-independent functions in assembly but not in gene regulation. Genes & Development. 10 (6), 686-699 (1996).
- Zhang, L., Eugeni, E. E., Parthun, M. R., Freitas, M. A. Identification of novel histone post-translational modifications by peptide mass fingerprinting. Chromosoma. 112 (2), 77-86 (2003).
- Wang, H., et al. Role of histone H2A ubiquitination in Polycomb silencing. Nature. 431 (7010), 873-878 (2004).
- Hassa, P. O., Haenni, S. S., Elser, M., Hottiger, M. O. Nuclear ADP-ribosylation reactions in mammalian cells: where are we today and where are we going. Microbiology and Molecular Biology Reviews. 70 (3), 789-829 (2006).
- Dey, B., et al. DNA-protein interactions: methods for detection and analysis. Molecular and Cellular Biochemistry. 365 (1-2), 279-299 (2012).
- Hager, G. L., McNally, J. G., Misteli, T. Transcription dynamics. Molecular Cell. 35 (6), 741-753 (2009).
- Nagy, Z., Tora, L. Distinct GCN5/PCAF-containing complexes function as co-activators and are involved in transcription factor and global histone acetylation. Oncogene. 26 (37), 5341-5357 (2007).
- Solomon, M. J., Larsen, P. L., Varshavsky, A. Mapping protein-DNA interactions in vivo with formaldehyde: evidence that histone H4 is retained on a highly transcribed gene. Cell. 53 (6), 937-947 (1988).
- Gunther, T., Theiss, J. M., Fischer, N., Grundhoff, A. Investigation of viral and host chromatin by ChIP-PCR or ChIP-Seq analysis. Current Protocols in Microbiology. 40, 11-21 (2016).
- Cotney, J. L., Noonan, J. P. Chromatin immunoprecipitation with fixed animal tissues and preparation for high-throughput sequencing. Cold Spring Harbor Protocols. 2015 (4), 419(2015).
- Haim, Y., Tarnovscki, T., Bashari, D., Rudich, A. A chromatin immunoprecipitation (ChIP) protocol for use in whole human adipose tissue. American Journal of Physiology-Endocrinology and Metabolism. 305 (9), 1172-1177 (2013).
- Castellano-Castillo, D., et al. Chromatin immunoprecipitation improvements for the processing of small frozen pieces of adipose tissue. PLoS One. 13 (2), 0192314(2018).
- Savic, D., Gertz, J., Jain, P., Cooper, G. M., Myers, R. M. Mapping genome-wide transcription factor binding sites in frozen tissues. Epigenetics Chromatin. 6 (1), 30(2013).
- Perna, A., Alberi, L. A. TF-ChIP method for tissue-specific gene targets. Frontiers Cell Neuroscience. 13, 95(2019).
- Allweiss, L., et al. Proliferation of primary human hepatocytes and prevention of hepatitis B virus reinfection efficiently deplete nuclear cccDNA in vivo. Gut. 67 (3), 542-552 (2018).
- Lerdrup, M., Johansen, J. V., Agrawal-Singh, S., Hansen, K. An interactive environment for agile analysis and visualization of ChIP-sequencing data. Nature Structural & Molecular Biology. 23 (4), 349-357 (2016).
- Perna, A., Alberi, L. A. TF-ChIP Method for Tissue-Specific Gene Targets. Frontiers in Cellular Neuroscience. 13, 95(2019).
- Liang, N., Fan, R., Goni, S., Treuter, E. Preparation of Frozen Liver Tissues for Integrated Omics Analysis. Methods in Molecular Biology. 1951, 167-178 (2019).
- Liu, Z., et al. Proteomic and network analysis of human serum albuminome by integrated use of quick crosslinking and two-step precipitation. Scientific Reports. 7 (1), 9856(2017).
- Singh, A. A., et al. Optimized ChIP-seq method facilitates transcription factor profiling in human tumors. Life Science Alliance. 2 (1), 201800115(2019).
- Aoki, T., et al. Bi-functional cross-linking reagents efficiently capture protein-DNA complexes in Drosophila embryos. Fly. 8 (1), 43-51 (2014).
- Allweiss, L., Dandri, M. Experimental in vitro and in vivo models for the study of human hepatitis B virus infection. Journal of Hepatology. 64, 1 Suppl 17-31 (2016).
- Krishna, M. Microscopic anatomy of the liver. Clinics in Liver Disease. 2, Suppl 1 4-7 (2013).
- Tannapfel, A., et al. Histopathological diagnosis of non-alcoholic and alcoholic fatty liver disease. Virchows Archiv. 458 (5), 511-523 (2011).
- Schuppan, D., Afdhal, N. H. Liver cirrhosis. Lancet. 371 (9615), 838-851 (2008).
- Allweiss, L., et al. Therapeutic shutdown of HBV transcripts promotes reappearance of the SMC5/6 complex and silencing of the viral genome in vivo. Gut. , 322571(2021).
- Gerna, G., Kabanova, A., Lilleri, D. Human cytomegalovirus cell tropism and host cell receptors. Vaccines. 7 (3), (2019).
- Echavarria, M. Adenoviruses in immunocompromised hosts. Clinical Microbiology Reviews. 21 (4), 704-715 (2008).
- Frohlich, J., Grundhoff, A. Epigenetic control in Kaposi sarcoma-associated herpesvirus infection and associated disease. Seminars in Immunopathology. 42 (2), 143-157 (2020).
- Nicoll, M. P., Proenca, J. T., Efstathiou, S. The molecular basis of herpes simplex virus latency. FEMS Microbiology Reviews. 36 (3), 684-705 (2012).
- Thorley-Lawson, D. A., Hawkins, J. B., Tracy, S. I., Shapiro, M. The pathogenesis of Epstein-Barr virus persistent infection. Current Opinion in Virology. 3 (3), 227-232 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır