Method Article
Kan-Beyin Bariyer Geçirgenliğini Artırmak için Odaklanmış Ultrason ve Mikrobubble Tedavilerini Görselleştirmek için Gerçek Zamanlı Intravital Multifotoğraf Mikroskopisi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, kan-beyin bariyer geçirgenliğini artırmak için odaklanmış ultrason ve mikrobubble tedavileri sırasında kemirgen beyninin gerçek zamanlı in vivo multifoton floresan görüntülemesini sağlayan cerrahi ve teknik prosedürleri açıklar.
Özet
Kan-beyin bariyeri (BBB), ilaçların beyne başarılı bir şekilde ulaştırılması için önemli bir zorluktur. Mikrobubbles varlığında ultrason maruziyeti, BBB'nin geçirgenliğini geçici ve lokal olarak artırmak için etkili bir yöntem olarak ortaya çıkmış ve ilaçların BBB genelinde para ve hücrelerarası taşınmasını kolaylaştırmıştır. Ultrason-mikrobubble tedavisi sırasında vaskülatın görüntülenmesi, beyindeki ultrason-mikrobubble tedavilerinin mekanizmaları ve dinamikleri hakkında değerli ve yeni içgörüler sağlayacaktır.
Burada, bir halka dönüştürücü ve 20x objektif lens ile hizalanmış bir kranial pencere kullanarak intravital multifotoğraf mikroskopisi için deneysel bir prosedür sunuyoruz. Bu kurulum, ultrason-mikrobubble tedavileri sırasında beynin yüksek uzamsal ve zamansal çözünürlükte görüntülenmesini sağlar. Beyne optik erişim, kafatasının açık bir kranial penceresinden elde edilir. Kısaca, kafatasının 3-4 mm çapında bir parçası çıkarılır ve beynin açıkta kalan bölgesi cam bir kapakla kapatılır. İkinci bir cam kapak kapağına takılan 0,82 MHz halka dönüştürücü üstüne monte edilir. Agarose (%1 w/v), ultrason yayılımını engelleyen hava kabarcıklarını önlemek için dönüştürücünün kapakları ile kranial pencereyi kaplayan kapak arasında kullanılır. Steril cerrahi işlemler ve antienflamatuar önlemler alındığında ultrason-mikrobubble tedavileri ve görüntüleme seansları birkaç hafta boyunca tekrar tekrar yapılabilir. Floresan dektran konjugeleri, vaskülatları görselleştirmek ve ultrason-mikrobubble kaynaklı etkileri (örneğin, sızıntı kinetiği, damar değişiklikleri) ölçmek için intravenöz olarak enjekte edilir. Bu makalede kranial pencere yerleşimi, halka dönüştürücü yerleşimi, görüntüleme prosedürü, yaygın sorun giderme adımları ve yöntemin avantajları ve sınırlamaları açıklanmaktadır.
Giriş
Nörolojik bozuklukların tedavisinde önemli bir zorluk, kan-beyin bariyerinin (BBB) varlığıdır. BBB, hidrofilik, yüklü, polar ve büyük (> 400 Da) moleküllerin beyin parenkimsine girmesini sınırlar1. Şu anda beyin parenkimine BBB genelinde terapötikler sunmak için kullanılan bir yöntem stereotaktik intrakraniyal enjeksiyonlar kullanmaktır2. Araştırılan diğer daha az invaziv yöntemler, BBB3 genelinde reseptör aracılı doğum için ilaç tasarlamak gibi kullanılan tekniklerin karmaşıklığı tarafından engellenir veya intranazal enjeksiyonlar4 veya hiperosmotik çözümlerin yönetimi gibi hedeflenen alanların mekansal hassasiyetinde sınırlıdır5.
Ultrason kullanımı sistemik enjekte mikrobubbles ile birlikte, bir ultrason kontrast ajanı, geçici olarak BBB6 geçirgenliğini artırmak için noninvaziv bir araç olarak geliştirilmiştir. Odaklanmış bir dönüştürücü7 veya yönlendirilebilir fazlı bir dönüştürücü dizisi8,9 kullanılarak, ultrason milimetre seviyesi hassasiyeti ile beyindeki seçilen bölgelere hedeflenebilir ve hedef dışı etkileri en aza indirir. Ultrason-mikrobubble tedavileri manyetik rezonans görüntüleme kılavuzu7,10,11,12,13,14 veya stereotaktik çerçeveler15 kullanılarak her deneğin beyin anatomisine göre özelleştirilebilir. Ayrıca, BBB geçirgenliğindeki artışın boyutu, mikrobubbles16,17,18'den kaynaklanan akustik emisyonları izleyerek gerçek zamanlı olarak kontrol edilebilir. Ultrason-mikrobubble tedavilerinin güvenliğini ve fizibilitesini araştıran klinik çalışmalar şu anda dünya çapında devam etmektedir (örneğin, ClinicalTrials.gov tanımlayıcısı NCT04118764).
Ultrason-mikrobubble BBB tedavileri tipik olarak BBB geçirgenliğinde tedavi kaynaklı artışların doğrulanması, kontrastla geliştirilmiş manyetik rezonans görüntülemede görselleştirilmesi veya in vivo görüntüleme veya ex vivo histolojide boya ekstravazasyonu ile değerlendirilir. Bununla birlikte, ultrason-mikrobubble tedavilerinin tamamlanmasını takiben çoğu mikroskobik analiz ex vivo olarak gerçeklenmiştir11,19, böylece ultrason maruziyeti sırasında ve hemen ardından dinamik biyolojik yanıtlar eksiktir. Ultrason maruziyeti sırasında yapılan gerçek zamanlı görüntüleme, ultrason-mikrobubble BBB tedavilerini ve aşağı akış yanıtlarını yönlendiren mekanizmaların anlaşılmasına yardımcı olabilir ve bu da terapötik uygulamalarını anlamamızı artırabilir. Ayrıca in vivo görüntüleme teknikleri ile kronik kraniyal pencerelerin kullanılması ultrason-mikrobubble tedavilerinin zamansal yönlerini değerlendirmek için boyuna çalışmalara olanak sağlayacaktır.
Bu protokolün amacı kemirgenlerde akut ve kronik çalışmalar için ultrason-mikrobubble tedavilerinin gerçek zamanlı multifotoğraf görüntülemesini yapmak için gereken cerrahi ve teknik prosedürleri tanımlamaktır (Şekil 1). Bu iki bölümde elde edilir: birincisi, in vivo görüntülemeyi etkinleştirmek için bir kranial pencere oluşturmak ve ikincisi, eşzamanlı sonikasyon ve görüntülemeyi etkinleştirmek için üste bir halka dönüştürücü monte etmek. Kranial pencereler nörobilimciler tarafından nörovasküler kaplin20, β-amiloid patogenez21 ve nöroimmünoloji22'nin in vivo görüntülemesi için yaygın olarak kullanılmaktadır. Bu protokolde fare ve sıçan kafatasında akut (iyileşme dışı) ve kronik (iyileşme) kraniyal pencereler oluşturmak için cerrahi prosedürler açıklanmıştır. Özellikle kronik deneyler için kranial pencere metodolojileri iyi belgelenmiştir23,24,25. Mevcut literatürle uyumlu olmak için bu protokol boyunca 'akut' ve 'kronik' terimleri kullanılacaktır. In vivo görüntüleme için halka dönüştürücülerin tasarımı da daha önce tanımlanmıştır26. Bu tekniklerin mevcudiyetine ve ultrason-mikrobubble tedavilerinin gerçek zamanlı görüntülenmesinden elde edilebilecek içgörülere rağmen, bu tekniği kullanarak literatürü başarıyla yayımlayan çok az araştırma laboratuvarı var26,27,28,29,30,31,32 . Bu nedenle, bu protokolde, bu gerçek zamanlı ultrason-mikrobubble deneylerinin yapılmasının cerrahi ve teknik detayları açıklanmıştır. Belirtilen sonikasyon ve görüntüleme parametreleri BBB deneyleri için optimize edilmiş olsa da, ultrasonun beyne maruz kalmasının nöromodülasyon33,34, β-amiloid plak izleme31 ve immün hücre yanıtları32 gibi diğer etkileri de bu teknik kullanılarak araştırılabilir.
Protokol
Aşağıdaki tüm deneysel prosedürler Norveç Gıda ve Güvenlik Kurumu, Sunnybrook Araştırma Enstitüsü Hayvan Bakım Komitesi ve Kanada Hayvan Bakım Konseyi tarafından onaylanmış ve bunlara uygun olarak yürütülmüştir.
1. Malzeme hazırlama
- Kranial pencere cerrahisi ve ultrason-mikrobubble tedavileri için gerekli malzemeleri hazırlayın. Kronik kraniyal pencereler için sterilize edilmiş alet ve malzemeler, steril bir cerrahi alan ve ameliyat öncesi ve sonrası ilaç kullanımı gereklidir23,24,25.
- Dönüştürücü ve kapak hazırlığı
- Dönüştürücünün fiziksel bütünlüğünü kontrol edin: çatlaklar ve ezikler arayın. Dönüştürücünün üst ve yan tarafındaki elektrotların sağlam olduğundan emin olun.
- Siyanoakrilat tutkallarını küçük bir tabağa yatırın. Dönüştürücünün yüzeyine ince bir tutkal tabakası yaymak için bir aplikatör kullanın.
- Dönüştürücüsü cam kapak kapağına yerleştirin. 20-30 sn boyunca sıkıca bastırın.
NOT: Cam kapak kapağının halka dönüştürücü ile hizalanmasını kolaylaştırmak için 3D baskılı bir kalıp kullanılabilir, bu da kapak ve halka dönüştürücü üzerinde sıkı ve hatta basınç sağlar (Şekil 2). - Dönüştürücü ve kapak arasında kabarcık olup olmadığını kontrol edin. Kabarcıklar varsa, kapak sapını kapatın ve hava ultrason yayılımını engeller gibi adım 1.2.3.'den tekrarlayın. Oda sıcaklığında gece boyunca tedavi edin.
- Bir cam kapak takımına yapıştıktan sonra dönüştürücüyle eşleştirin (Şekil 3).
NOT: Bu protokol, özel bir eşleştirme devresi ile 50 Ω empedans ve 0° faz yükü ile eşleşen şirket içinde üretilen bir kurşun zirkonat titanat halka dönüştürücü (10 mm dış çap, 1,4 mm kalınlık, 1,2 mm yükseklik)35 kullanır. Dönüştürücü, kalınlık modunda 0,82 MHz'de sürülür ve kapak kapağının yaklaşık 1 mm altında dairesel bir odak noktası üretir. Benzer özelliklere sahip halka dönüştürücüler (10 mm dış çap, 1,5 mm kalınlık, 1,1 mm yükseklik) karakterize edilmiştir26 ve çokotonlu mikroskopi deneyleri için yaygın olarak kullanılmıştır27,28,29,31,32,36.
- Dönüştürücü yeniden kullanımı ve kapak değiştirme
- Kapak kılıfını çatlamışsa veya önceki deneyden döküntü (örneğin, kürk, tutkal) varsa değiştirin. Kapakçık çıkarmak için, dönüştürücü ve kapak tonlarını 20 dakika boyunca asetona batırarak tutkalı çözün.
NOT: Aseton dönüştürücü ve/veya elektrotların bütünlüğünü etkileyebilir. Bu adıma geçmeden önce üreticiye danışın. - Asetonun aplası asepsle hafifçe çekerek tutkalın çözülüp çözülmediğini kontrol edin. Uzun süre aseton maruziyetini önlemek için her 10 dakikada bir kontrol edin.
- Kapak kılıfını çatlamışsa veya önceki deneyden döküntü (örneğin, kürk, tutkal) varsa değiştirin. Kapakçık çıkarmak için, dönüştürücü ve kapak tonlarını 20 dakika boyunca asetona batırarak tutkalı çözün.
2. Hayvan hazırlığı
- Bir indüksiyon odasında tıbbi hava, oksijen ve izofluran karışımı kullanarak hayvanı uyuşturun.
NOT: Taşıyıcı gaz olarak oksijen kullanımının mikrobubbles37,38'in yarı ömrünü etkilediği ve BBB geçirgenliğinde ultrason-mikrobubble kaynaklı artışların büyüklüğünü azalttığı bildirilmiştir27, ancak hipoksi ve mortalite riskini de azaltabilir39. Proje amaçlarına ve veteriner tavsiyesine göre taşıyıcı gazları seçin. Ketamin/ksilazine kokteyli gibi enjekte edilebilir anestezikler de kullanılabilir; ancak solunabilir anestezi kullanırken anestezi düzlemini ve kan oksijen seviyelerini kontrol etmek daha kolaydır. - Hayvanın bir parmak sıkışması yaparak yeterli bir anestezi düzlemine ulaşmış olup olmadığını kontrol edin. Uygulanacak dektran, mikrobubbles ve ilaçların dozajını belirlemek için hayvanı tartın. Kürkü hayvanın kafasından çıkarın ve hayvanı stereotaktik bir çerçeveye yerleştirin.
- Akut deneyler için dekstran ve mikrobubble enjeksiyonları için sistemik dolaşıma erişim kurulmalıdır. Bunu başarmak için kuyruk damarına 27 g kateter yerleştirin.
NOT: Retro-orbital enjeksiyonlar da mümkün olmakla birlikte, multifotoğraf görüntüleme sırasında kafa bölgesindeki çalışma alanının sınırlı olduğu için kuyruk damarları önerilir. - Hayvanı stereotaktik çerçeveye aktarın ve anesteziyi burun konisine geçirin. Isıtma yastığı veya ılık suyla dolu bir eldiven gibi bir ısı kaynağı kullanarak hayvanın 37 °C'lik çekirdek sıcaklığını koruyun.
- Rektal prob kullanarak hayvan sıcaklığını ve nabız oksimetresi kullanarak hayvan fizyolojisini izleyin. Oftalmik merhem uygulayın. Uygun ameliyat öncesi analjezik ve/veya antienflamatuar ilaçlar enjekte edin (bkz. Malzeme Tablosu).
- Kranial pencere ameliyatına başlamadan önce, anestezi düzlemini ve hayvanın kalp atış hızını, O2 doygunluğunu, solunum hızını ve sıcaklığını kontrol edin.
- Kranial pencere ameliyatına başlamak için, depilatör krem uygulayarak ve/ veya kürk makası kullanarak kafadaki kürkü çıkarın. Kürkü gözlerin arasından boynun ön yarısına çıkarın (Şekil 4A).
NOT: Depilatör krem ile uzun süreli temas cildi yakacaktır. Kronik kraniyal pencere ameliyatları için, saç derisini alternatif betadin mendilleri ve kürk çıkarıldıktan sonra% 70 EtOH ile yıkayın. Cerrahi alanı steril cerrahi için hazırlayın. Sterilite Adım 2.15'e kadar korunmalıdır. - Kafa derisini çıkarmak için, sagittal dikiş boyunca baskın olmayan elde tutulan tokmakları kullanarak cildi gözlerin arasına kaldırın. Kavisli makas kullanarak, parietal kemikleri ortaya çıkarmak için cildi çıkarın (Şekil 4B). Kafatasından veya kafa derisinden kanama varsa pamuklu çubukla sıkı basınç uygulayın; bir sonraki adıma geçmeden önce kanama durdurulmalıdır.
NOT: Akut ameliyatlar için sıvı siyanoakrilat yapıştırıcı veya doku yapıştırıcısı kullanılarak cilt geri itilebilir ve kafatasına yapışabilir. - Pamuklu çubuklar kullanarak kafatasının dış yüzeyini kaplayan periosteumu çıkarın.
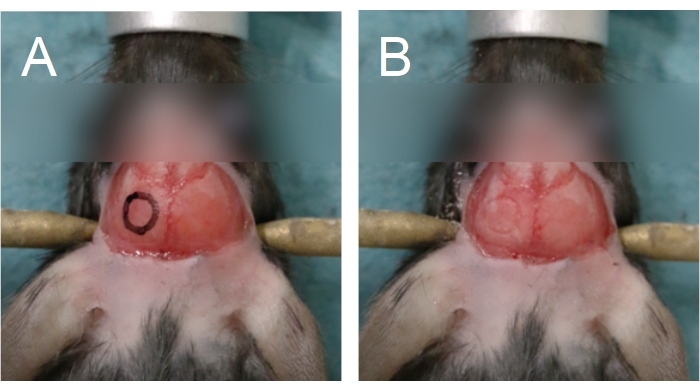
- Bir çalışma mikroskobu (6-25x) ve bir diş matkabı (0,5 mm matkap çapak, orta hız) kullanarak, kafatasındaki kranial pencerenin istenen konumunu işaretlemek için parietal kemiğe bir daire çizin (Şekil 5). Bu bölgeler daha ince ve büyük kan damarlarını kapladığı için sagittal dikiş, lambda ve bregmadan kaçının.
NOT: Delme yapmayı kolaylaştırmak için kafatası penceresinin ana hatları bir işaretleyici ve şablon kullanılarak kafatasına çekilebilir (Şekil 5A). Sıçanlar için, dairesel, kranial bir pencere yerine dikdörtgen bir pencere delmek daha kolay olabilir. Sıçan kafatası kemiğinin kalınlığı nedeniyle, delme işlemini tamamlamak için 0,5 mm matkap ucu kullanmadan önce kompakt kemikteki kranial pencereyi ana hatlarıyla belirlemek için 0,7 mm matkap ucu kullanın. - Matkap ucuna hafif basınç uygulayın; aşırı basınç beyin dokusuna zarar verme riskini artırır. Kafatasının delme sırasında aşırı ısınmasını önlemek için, bir şırıngam kullanarak kafatasına salin damlatın veya salin içine batırılmış bir cerrahi sünger parçası uygulayın.
- Ortaya çıkan kemik adası kafatasının geri kalanından ayırana kadar kafatasını delmek ve soğutmak arasında geçiş yapın. Forseps veya matkap ucu kullanarak kemik adasına hafif basınç uygulayarak delme ilerlemesini kontrol edin. Kemik adası kafatasının geri kalanından ayırana kadar delmeye devam edin.
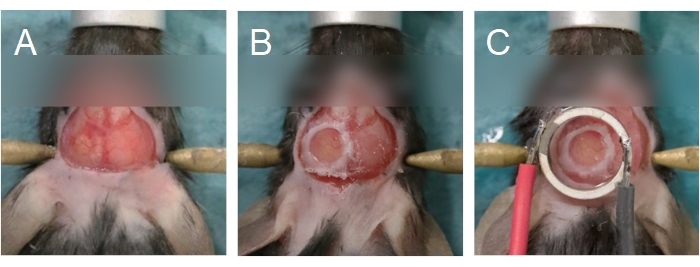
NOT: Kafatasının en ince bölgelerindeki küçük çatlaklar, delme işleminin neredeyse tamamlandığının iyi bir göstergesidir. Kemik adasını zamanından önce çıkarmaya çalışmak, kemik parçalarının beyin dokusuna nüfuz etmesine, dura zarar görmesine ve iltihaplanma ve kanamaya neden olabilir. - Kemik adasının kenarlarını veya üst kompakt kemik tabakasını kavramak için bir çift ince toka kullanarak kemik adasını çıkarın (Şekil 6A). Önceden tuzlu suya batırılmış bir cerrahi sünger parçası uygulayarak beynin nemli tutulmasını sağlayın. Kanama görülürse, cerrahi süngeri kanama olan bölgeye yerleştirin. Kanama sona erene kadar bir sonraki adıma geçmeyin.
NOT: Kanama 5 dakika sonra devam ederse, hayvan çok sesli görüntüleme deneyleri için kullanılamaz. Sıçanlar için, kalınsa durayı çıkarmak gerekebilir. Durayı çıkarmak için, çalışma mikroskobunda yüksek büyütme ve bir çift ince toz kullanın. - Bir kranial pencere yerleştirmek için, bir çift asa ile bir cam kapak ucu alın, bir tarafa bir damla salin yerleştirin ve kafatasındaki deliğin üzerinde manevra yap. Kapak altlarında hava kabarcıkları olmadığından emin olun.
NOT: Fareler için 5 mm, sıçanlar için 8 mm cam kapak kılıfı kullanın. Sıçanlar için, kafatası kemiğinin kalınlığı nedeniyle, kapak ve beyin arasındaki boşluğu doldurmak için salin yerine bir agarose çözeltisi kullanın. Dönüştürücü ve kapak kilip, kranial pencere için ayrı bir kapak kılıfı kullanmak yerine doğrudan kafatasına da yapıştırılabilir. Bu seçenek için 3.1 adımına geçin. Ayrıntılar için Şekil 1'e bakın. - Kafatasına bağlamak için kapak kılıfının çevresine bir siyanoakrilat tutkal tabakası yayın (Şekil 6B). Kapak kılıfı altında tutkal olmadığından emin olun. Tutkalın beyinle temas etmediğine emin olmak için kapak kılıfına basınç uygulayın.
- Tutkal tamamen kuruduğunda, diş matkabı kullanarak tutkalın yüzeyini bile dışarı çıkarın. Tüm tutkal kalıntılarının cerrahi bölgeden çıkarıldığından emin olun.
NOT: Kronik kraniyal pencereler için, gerekli ameliyat sonrası ilaçları enjekte edin (bkz. Malzeme Tablosu), yara bakımı ve yumuşak yiyecekler için merhem sağlayın ve hayvanı bir ısı lambası altında kurtarın.
3. Halka dönüştürücünün yerleştirilmesi
- %1 (w/v) agarose çözeltisini hazırlayın. Küçük bir beher veya Erlenmeyer şişesine 0,1 g agarose ve 10 mL PBS (1x) veya salin ekleyin. Beheri bir ocak üzerine yerleştirerek veya çözeltiyi mikrodalga fırında (30-45 s) ısıtarak agarose tamamen çözünene kadar çözeltiyi kaynatın.
- Agarose çözeltisi hızlı bir şekilde soğuduğu için 3.2-3.5 adımları zamana duyarlıdır. ~ 0,5 mL agarose'u 1 mL şırıngaya çekin.
NOT: Beynin bütünlüğünü korumak için, agarose sıcaklığının kullanmadan önce vücut sıcaklığına yaklaşık olarak sahip olduğundan emin olun. - Agarose'ı kranial pencerenin kapak kapağına liberal olarak yatırın.
NOT: Doku blanches ise, agarose sıcaklığı çok yüksekti; hayvan ötenazi yapılmalıdır. Beyni kaplayan ayrı bir kapak parçası yoksa (yani, dönüştürücü ve kapak kapağı doğrudan beyne yerleştirilir, adım 2.14'e bakın), o zaman agarose bu adımda beynin yüzeyine biriktirilmelidir. - Dönüştürücüsü kranial pencerenin üzerine yerleştirin (Şekil 6C). Transdüser ve kranial pencere arasında minimum agarose olacak şekilde sıkı basınç uygulayın. Dönüştürücünün kafatası penceresine ortalanmış (XY düzlemi) ve paralel (Z düzlemi) olduğundan ve agaroseda hava kabarcıkları olmadığından emin olun.
- Agarose jöle benzeri bir kıvama geldiğinde, bir spatula veya neşter kullanarak dönüştürücünün örtünün çevresinden fazla agarose kesin. Dönüştürücünün kapak kapağının altında hava kabarcıkları olmadığından emin olun.
- Bir spatula kullanarak, dönüştürücünün kapak kapağının çevresine bir siyanoakrilat tutkal tabakası yayın, kafatasına uzanır, böylece dönüştürücü kafatasına sıkıca yapışır.
- Tutkal tamamen kuruyana kadar dönüştürücü üzerinde sıkı baskıyı koruyun (10-15 dk).
4. Multifotoğraf mikroskopi görüntüleme
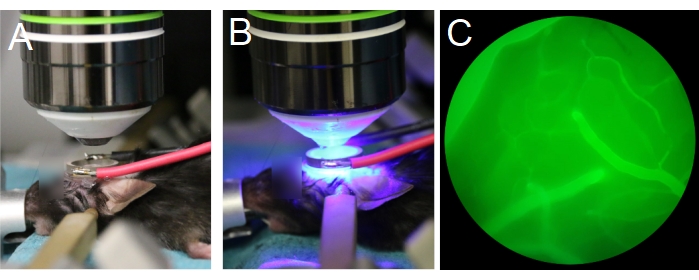
- Hayvanı objektif mercek altına yerleştirin (Şekil 7A). Objektif lensin halka dönüştürücüsünü ortalayıp dönüştürücü ile paralel olduğundan emin olun (Şekil 7B). Suya batırma objektif lensi kullanılırsa, halka dönüştürücünün merkezini deiyonize ve gazdan çıkmış su ile doldurun.
NOT: Gazdan arındırılmış su uygun ultrason yayılımı için önemlidir. - Objektif lensi en yüksek konumdan başlayın ve ardından halka dönüştürücünün içine gelene kadar objektif lensi yavaşça küçümseyin (Şekil 7A, B). Objektif lensin dönüştürücü veya kapakla çarpışmamasını sağlayın.
NOT: Objektif lensin Z konumunun beynin yüzeyiyle düzlemde olup olmadığını kontrol etmek için göz merceği arasında ve objektif lensin dönüştürücü veya kapakla çarpışmamasını sağlamak için göz ile değiştirin. Kuyruk damarı içinden floresan dektran enjeksiyonundan sonra pial damarları göz merceğinden görselleştirmek daha kolay olabilir (Şekil 7C). - Görüntüleme için çoktoğraf mikroskobu hazırlayın.
NOT: Bu protokol, dik bir multifotoğraf mikroskobu ve kapak(lar)ın ötesine odaklanmak için yeterli olan 2 mm çalışma mesafesine sahip 20-25x objektif lens kullanır. - Dektranı hazırlayın. Üreticinin talimatlarına uygun miktarda PBS'yi dektran şişesine ekleyin. Dektran tozlarının tamamen çözünmesini sağlamak için dektran çözeltisini 1-3 dakika boyunca girdaplayın. Dektran çözeltisini kuyruk damarına enjekte edin.
- Görüntü taraması ayarlama
- Göz merceği kullanarak objektif lensin beyne paralel olduğundan emin olun. XZ ve YZ yanlış hizalamalarını düzeltmek için hayvanı eğin.
- Çoktoğraf mikroskopunda bir görüş alanı seçin. Ultrason maruziyeti öncesinde vaskülatın temel bir görüntüsüne sahip olmak için ultrasona maruz kalmadan önce bir XYZ taraması ayarlayın.
NOT: Tipik görüntüleme parametreleri aşağıdaki gibidir: 300-800 μm derinlikte, 2-5 μm adım boyutunda ve 10-20 zaman yığını. Objektif lensin görüntüleme sırasında en düşük noktasında dönüştürücü veya kapakla temas etmediğinden emin olun.
5. Ultrason maruziyeti
- Tüm BNC kablolarının doğru bağlandığından emin olun (Şekil 3).
- Ultrason-mikrobubble tedavilerinden önce, sırasında ve sonrasında görüntü yığınlarını yakalamak için yeterince uzun bir XYZT görüntü taraması ayarlayın.
- Üreticinin talimatlarını izleyerek mikrobubbles hazırlayın. Mikrobubbles kuyruk damarına enjekte ve görüntülemeye başlayın.
NOT: Mikrobubble enjeksiyonları, tutarlı enjeksiyon oranını sağlamak ve eşzamanlı mikrobubble enjeksiyonu ve görüntülemeyi etkinleştirmek için bir infüzyon pompası ile yapılabilir. Görüntüleme sırasında mikrobubbles enjekte edilecekse, dedektörleri ortam ışığına maruz kalmadan kuyruk damarı ile kolayca erişilebildiğinden emin olun. - Sonication başlayın.
NOT: Tipik sonikasyon parametreleri aşağıdaki gibidir: 10 ms döngüler, 0.2-0.4 mekanik indeksi ve 1-4 Hz arasındaki darbe tekrarı frekansları. - Sonikasyon süresi boyunca ve sonication'ın bitimini takiben multifotoğraf görüntülemeye devam edin. Kan damarlarından dektran ekstravazasyonuna dikkat edin, çünkü bu BBB geçirgenliğindeki artışların göstergesidir.
NOT: Distran ekstravasküler alanda, ancak görüş alanının çevresinde tespit edilirse, görüş alanının dışında etkilenen kan damarları olabilir. Bu, dönüştürücünün objektif lensin odağıyla yanlış hizalanmasıyla sonuçlanabilir. Bu senaryoda, nesnel lensi hareket ettirerek veya hayvanı yeniden konumlandırarak görüş alanını ayarlamak, dönüştürücünün yeniden hizalanmasını yapmaktan daha kolaydır. - Görüntüleme tamamlandıktan sonra, derin anestezi veya CO2 boğulması altında hayvan servikal çıkığı ötenazi. Kronik kraniyal pencereler için, açıkta kalan kafatasına bir diş çimentosu tabakası yayın.
NOT: Kronik kraniyal pencereler için, pencereyi çevreleyen cilt, 2.8.
6. Görüntü analizi
- Görüntü yığınlarını dışa aktar.
- Görüntüleri görüntü analiz yazılımı (örneğin, Olympus Fluoview, ImageJ/FIJI, Bitplane Imaris, ThermoFisher Scientific Amira) ve/veya programlama araçlarıyla (örneğin, Python, MATLAB) analiz edin.
Sonuçlar
Başarılı ultrason-mikrobubble tedavileri, floresan dektranın intravaskülerden ekstravasküler boşluğa ekstravazasyonu ile tespit edilebilir (Şekil 8), BBB geçirgenliğinde bir artış olduğunu gösterir. Halka dönüştürücünün basınç alanına bağlı olarak pial damarlar ve/veya kılcal damarlar etkilenecektir.
Ultrason-mikrobubble tedavilerinin neden olduğu damar değişikliklerini değerlendirmek için ultrason-mikrobubble tedavisinden önce, ultrason-mikrobubble tedavisinden önce, sırasında ve sonrasında ilgi çekici damarın çapı ölçülebilir (Şekil 9). Bu, piyasada bulunan bir yazılımda (örneğin, Olympus Fluoview yazılımı) manuel olarak yapılabilir. Görüntü alımı sırasında kan akışını değerlendirmek için bolus dektran enjeksiyonları ve hat taramaları da kullanılabilir30,41. Dektran kaçağı kinetiğini ilaç dağıtımında temsili bir model olarak değerlendirmek için MATLAB26,27,29,41 gibi araçlar kullanılarak iç ve ekstravasküler boşluklar arasındaki sinyal yoğunluğu değerlendirilebilir (Şekil 10).
ImageJ/FIJI kullanılarak daha fazla görüntü işleme elde edilebilir. ImageJ/FIJI, MATLAB ile uyumlu ve vasküler değişiklikleri veya floresan nesnelerin uzunlukları veya arasındaki mesafe (örneğin, kan damarlarına β-amiloid plakları) gibi biyolojik görüntü analizinde ortak analizler yapmak için çok uygun olan açık kaynaklı bir yazılımdır. ImageJ/FIJI'de oluşturulan görüntü işleme işlem hatları özel makrolar yazılarak otomatikleştirilebilir.
Kan damarlarının 3D segmentasyonu ve hücre takibi gibi daha karmaşık analizler daha gelişmiş, yarı otomatik yazılımlar kullanılarak elde edilebilir (Şekil 11). Segmentasyondan sonra, kan damarlarını arteriyoles, venules veya kılcal damarlar olarak sınıflandırmak gibi çap, dallanma, işkence kalıpları ve akış yönüne göre daha spesifik analizler yapılabilir42,43. Kan damarı segmentasyonunu otomatikleştirmek için makine öğrenimi algoritmaları da geliştirilmiştir22,44.
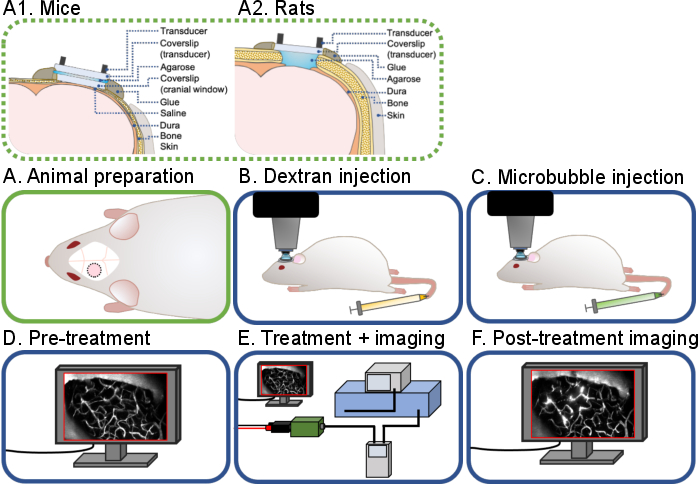
Şekil 1: Intravital multifotoğraf ultrason-mikrobubble beyin deneylerinin genel iş akışı. Bu protokolde açıklanan intravital multifotoğraf ultrason-mikrobubble beyin deneylerinin genel bir iş akışı gösterilmiştir. 6 adım vardır: (A1) fareler ve (A2) sıçanlar için hayvan hazırlığı, (B) Dektran enjeksiyonu, (C) Mikrobubble enjeksiyonu, (D) Tedavi öncesi görüntüleme, (E) Tedavi ve görüntüleme, (F) Tedavi sonrası görüntüleme ve veri analizi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
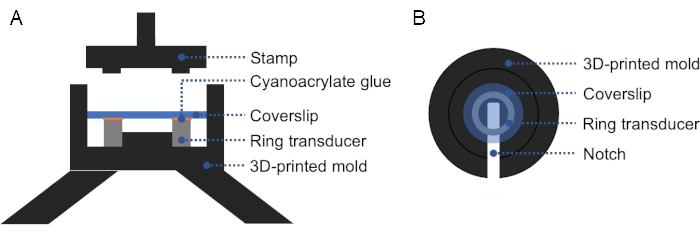
Şekil 2: 3D baskılı kalıbın kesit ve üst görünümü. (A) Kalıbın kesit. Halka dönüştürücünün üst yüzeyine ince bir siyanoakrilat tutkal tabakası uygulanır ve üstüne bir kapak parçası yerleştirilir. Bir damga, kapak ve halka dönüştürücüye sert, hatta basınç uygulamak için kullanılabilir. (B) Kalıbın üst görünümü. Hazırlanan dönüştürücünün çıkarılmasını kolaylaştırmak için kalıba bir çentik eklenebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
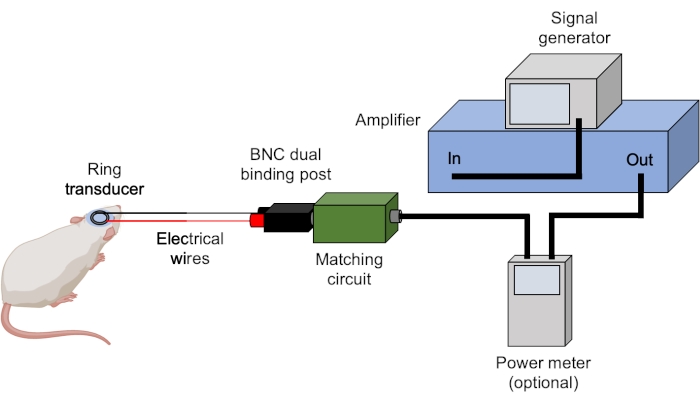
Şekil 3: Ultrason kurulumu. Ultrason deneyleri için tipik donanım gösterilmiştir. Ultrason parametreleri sinyal üreteci tarafından ayarlanır ve tetiklenir ve amplifikatör tarafından yükseltilir. Bir güç ölçer, sinyali dönüştürücüyle eşleşen kutuya göndermeden önce ileriye doğru ve yansıyan güçleri kaydetmek için kullanılabilir. Aksi belirtilmedikçe tüm bağlantılar BNC kabloları kullanılarak elde edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
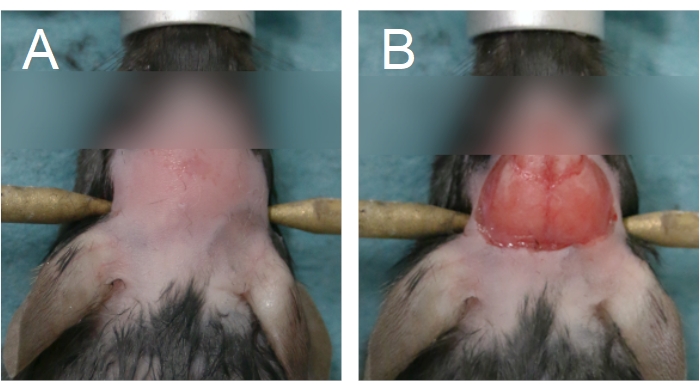
Şekil 4: Kürk çıkarma ve kafa derisi çıkarma alanı. (A) Kürk çıkarma göz aralarından başlamalı ve boynun ön yarısına kadar uzatılmalıdır. (B) Parietal kemikleri açığa çıkarmak için kafa derisi çıkarılması yeterli olmalıdır. Kanama devam etmeden önce durdurulmalıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 5: Kafatası penceresinin anahattı. Kranial pencere bir parietal kemik üzerinde yer almaktadır. (A) Sondaj işlemine yardımcı olmak için kafatasına kafatası penceresinin bir taslağı çizilebilir. (B) Kranial pencerenin ana hatları, kompakt kemiği deldiden sonra görülebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 6: Kraniyal pencere ve dönüştürücü hizalaması. (A) Kranial pencere bir parietal kemik üzerinde oluşturulur. Kemik adası çıkarıldı, altındaki beyin açığa çıktı. (B) Kafatasına siyanoakrilat yapıştırıcı kullanılarak bir cam kapaklı kapak kapatıldığında kranial pencere tamamlanır. (C) Dönüştürücü kraniyal pencereye ortalanır ve siyanoakrilat tutkal kullanılarak yapıştırılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 7: Objektif lens ve dönüştürücünün konumlandırılması. (A,B) Objektif lens halka dönüştürücüye ortalanır. (C) Floresan dektran ile dolu kan damarları göz merceğinden, epifluoresans altında görülebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
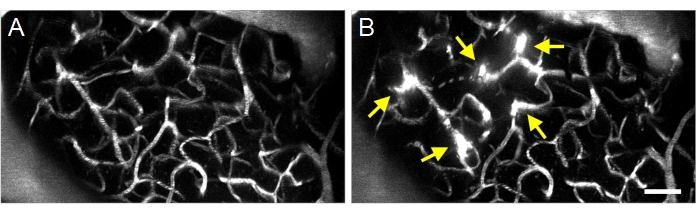
Şekil 8: Ultrason-mikrobubble indüklenen maksimum projeksiyon multifotoğraf görüntüleri BBB geçirgenliğinde artar. Ultrason-mikrobubble tedavilerinden önce ve (B) önce vaskülatın maksimum projeksiyon görüntüleri. Başarılı ultrason-mikrobubble tedavileri, floresan dektran ekstravazasyonu (oklar) olarak görselleştirilen tedavi sonrasında BBB geçirgenliğindeki artışlar gözlemlenerek doğrulanabilir. Ölçek çubuğu: 50 μm. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
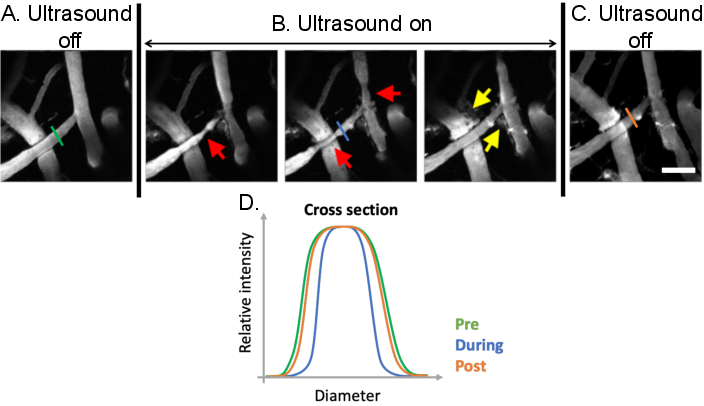
Şekil 9: Ultrason-mikrobubble tedavileri ile indüklenen vasomodülasyonun analizi. Ultrason-mikrobubble tedavileri öncesi, sırasında ve sonrasında serebral kan damarlarının maksimum projeksiyon görüntüleri. Mikrobubbles tüm görüntülerde mevcuttur. (A) ön tedavi koşulları ile karşılaştırıldığında ultrason-mikrobubble tedavileri (kırmızı oklar) sırasında net vasomodülasyon (B) gözlenebilir. BBB geçirgenliğinde ultrason-mikrobubble aracılı artışlar, floresan dektranın intravaskülerden ekstravasküler boşluğa (sarı oklar) sızmasından tedaviden sonra da belirgindir. (C) Ultrason kapatıldığında damar çapları ön işleme, taban çizgisi boyutlarına geri döner. (D) Ultrason-mikrobubble tedavisinden önce, sırasında ve sonrasında ilgi çekici damarın çapı çizilerek damar değişiklikleri analiz edilebilir. Ölçek çubuğu: 100 μm. (Yayınlanmamış çalışma). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
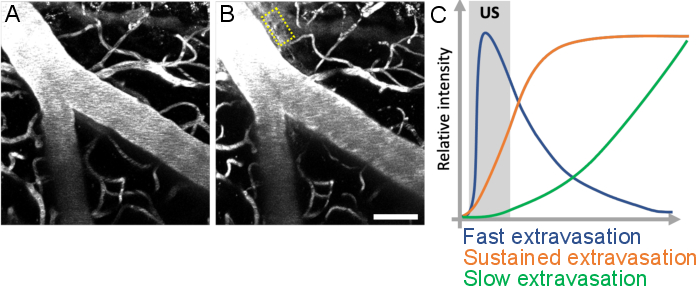
Şekil 10: Ultrason-mikrobubble tedavileri sonrasında kaçak kinetiklerin analizi. BBB geçirgenliğindeki artış, floresan dektranın intravaskülerden ekstravasküler alana sızması olarak görselleştirilir. BBB geçirgenliğindeki değişiklikler, ultrason-mikrobubble tedavilerinden önce (A) ve (B) önce elde edilen görüntü yığınları karşılaştırılırken belirgindir. (C) Kaçak kinetikler, ekstravasküler bölmelerde (sarı dikdörtgen) dektranın yoğunluğu, hacmi ve hızı takip edilerek analiz edilebilir. Ölçek çubuğu: 50 μm. (Yayımlanmamış çalışma.) Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
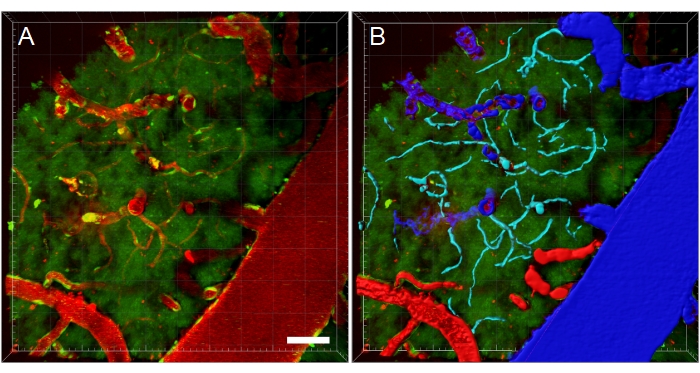
Şekil 11: Multifotoni mikroskopi XYZ yığınının kan damarı segmentasyonu. (A) Transgenik egfp sıçanında kan damarlarının derinliği (XYZ) yığını. Kan damarları floresan Texas Red 70 kDa dektran (kırmızı) intravenöz enjeksiyonu ile görselleştirilir. Yeşil kanal floresan hücreleri ve doku otofluoresansını gösterir. (B) Kan damarlarının 3D rekonstrüksiyonları oluşturulur ve daha sonra tipe özgü analizleri kolaylaştırmak için kan damarı tipine göre renk kodlanır. Damar/venüleler mavi, arterler/arteriyollar kırmızı ve kılcal damarlar siyandır. Ölçek çubuğu: 50 μm. Bitplane Imaris kullanılarak oluşturulan yeniden yapılandırmalar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Beynin intravital multifotoğraf mikroskopisi izlenmesi ultrason maruziyeti sırasında beyin yanıtlarını incelemek için değerli bir araçtır. Burada açıklanan protokol, ultrason-mikrobubble tedavileri sırasında beyin parankiminin multifotoğraf mikroskopisi görüntülemesinin tek yöntemidir. Kranial pencerelerin oluşturulması ve halka dönüştürücülerin kullanılması, yüksek uzamsal ve zamansal çözünürlükte ultrason-mikrobubble tedavilerine vasküler, hücresel ve diğer aşağı akış yanıtlarının gerçek zamanlı izlenmesini sağlar. Diğer gruplar ultrason-mikrobubble tedavilerinin tamamlanmasının ardından multifotoğraf mikroskopi görüntülemesi yapmışlardır, böylece beyin parankiminin tedavilere gerçek zamanlı yanıtını kaçırmıştır19. Açıklanan prosedür, ultrason-mikrobubble tedavilerinin arkasındaki akut mekanizmaları aydınlatmaya yardımcı olabilecek verilerin toplanmasına izin veren gelişmiş zamansal kontrol sunar. Elde edilen görüntü yığınlarından extravasation kinetics27,29,30, β-amiloid plak hacmindeki değişiklikler31 ve hücre dinamiği32 gibi nicel ve nitel veriler ayıklanabilir ve analiz edilebilir.
Protokol boyunca çeşitli sorun giderme adımları vurgulandı. İlk olarak, kraniyal pencere ameliyatı sırasında agarose kullanımı ve dönüştürücünün yerleştirilmesi gibi operatör hatasına özellikle duyarlı cerrahi adımlar vurgulandı. Ameliyat sırasında hayvan fizyolojisini izlemek ve enjeksiyondan önce dektranı iyice girdaplamak da dahil olmak üzere hayvan rahatsızlığını ve ölümünü önleme adımları da sağlanmıştır. İkinci olarak, dönüştürücünün fiziksel özellikleri ve objektif lens, dönüştürücü ve kranial pencerenin hizalanması da vurgulandı. Halka dönüştürücünün özellikleri ve akustik özellikleri, hayvan modelinin yanı sıra kullanılan objektif lens göz önünde bulundurularak belirlenmelidir. Özellikle, halka dönüştürücünün iç çapı objektif lensi çevrelemek için yeterince büyük, ancak hayvanın kafatasına güvenli bir şekilde monte edilecek kadar küçük olmalıdır. Ek olarak, dönüştürücünün odak alanı kullanılan objektif lensin aralığıyla hizalanmalıdır.
Yaygın bir zorluk, kranial pencere ve halka dönüştürücünün objektif lense göre açılı olmasıdır. Objektif lensin kraniyal pencere ve dönüştürücü ile doğru merkezlenmesi (XY) ve hizalanması (Z), dönüştürücünün odak alanının ve dolayısıyla tedavi edilen beyin dokusunun bölgesinin görüntüleme alanıyla uyumlu olmasını sağlar ve görüntüleme sırasında objektif lens ile dönüştürücü arasındaki çarpışma riskini azaltır. Hizalama, hayvanın baş pozisyonunun ayarlanması ve/veya sabitlenmiş stereotaktik çerçevenin döndürülerek elde edilebilir.
Mikroskop bileşenleri (örneğin, dedektörler, ışın ayırıcılar) ve görüntü alma parametreleri çalışmanın amacına göre seçilmelidir. Burada objektif lens ile beyin arasında bulunan kapak uçları ve halka dönüştürücünün varlığı nedeniyle uzun odak uzaklığı (> 2 mm) olan objektif bir lens kullanılmaktadır. Dik bir mikroskop, özellikle beyin deneyleri için hayvanı manevra yapmak için daha fazla alan sağladığı için de önerilir. İntravasküler boyanın ultrason-mikrobubble kaynaklı sızıntısının kinetiğini yakalamak için, bir rezonans tarama sistemi kullanılarak elde edilebilen yüksek bir zamansal çözünürlük uygundur. Bunu galyum arsenit fosfit (GaAsP) dedektörleri gibi yüksek hassasiyetli bir algılama sistemiyle birleştirmek de daha olumlu görüntülerle sonuçlanacaktır.
Sunulan deneysel prosedürün çeşitli sınırlamaları vardır. İlk olarak, cerrahi prosedür oldukça invazivdir ve iltihaplanmaya neden olduğu bildirilmiştir45, ancak iltihap en aza indirilebilir46. Ayrıca kraniyal pencere ameliyatlarının neden olduğu immün yanıtların ameliyattan sonraki 2-4 hafta ile düzelmeye devam ettiği gözlenmiştir23,24,25. Ek olarak, delme işlemi, özellikle aşırı kuvvet veya hız ile gerçekleştirildiğinde, uygulanan ısı, titreşim ve basınç üretimi nedeniyle alttaki dokuya zarar verebilir. Kranial pencere ameliyatları ve multifotoni görüntülemenin de beyin sıcaklığını etkilediği gözlenmiştir47. Bu sınırlamalar, bozulmamış kranial pencerelerin dikkatli bir şekilde oluşturulması, kronik kranial pencerelere sahip hayvanların uygun şekilde kurtarılması ve geri bildirim kontrollü bir ısıtma kaynağı kullanılarak normotermik vücut sıcaklığının korunması yoluyla bir dereceye kadar azaltılabilir. İkincisi, görüntüleme derinliği kullanılan mikroskop ve objektif lens ile sınırlıdır. Örneğin, hipokampus gibi daha derin beyin yapılarında ultrason-mikrobubble tedavisinin etkisi, aşırı kortikal dokunun çıkarılması48 veya kortikal penetrasyon49 ile birlikte mikro lenslerin kullanılması gibi daha invaziv önlemler olmadan çalışılamaz. Uzun çalışma mesafesine sahip objektif bir lens kullanmak bu sorunu bir dereceye kadar çözebilir, ancak ışık penetrasyonu da daha derinlerde sınırlıdır.
Bu protokolün temsili görüntüleri vahşi tip kemirgenlerden elde edilirken, sunulan deneysel prosedür Alzheimer hastalığı31 gibi transgenik hayvanlara ve hastalık modellerine de uygulanabilir. Ultrason kaynaklı nöromodülasyon gibi BBB modülasyonu ile ilgisi olmayan ultrason deneyleri de bu protokol33,34 kullanılarak izlenebilir. Diğer olası uygulamalar, konfokal mikroskobu ultra yüksek hızlı bir kamera50 ile eşleştirmek gibi farklı mikroskop veya dedektör kurulumları kullanılarak elde edilebilir. Fotobleaching ve fototoksiklik, büyük eksitasyon hacmi nedeniyle konfokal mikroskoplarda nispeten daha kötü olsa da, ultra yüksek hızlı görüntüleme, ultrason-mikrobubble BBB tedavilerini yönlendiren mekanizmaları daha da aydınlatabilecek yüksek zamansal çözünürlükle beyin kılcal endotel hücre-mikrobubble etkileşimlerinin görselleştirilmesini sağlayabilir. Sonuç olarak, açıklanan protokol, ultrason-mikrobubble BBB deneylerinin neden olduğu vasküler ve hücresel etkileri gerçek zamanlı olarak izlemek için bir yöntem sağlar, bu tedavileri yönlendiren mekanizmaları daha fazla belirlemek için bir araç sağlar ve ayrıca beyin parankiminin ultrason-mikrobubble tedavilerine karşı aşağı akış tepkilerini aydınlatır.
Açıklamalar
Charissa Poon, Melina Mühlenpfordt, Marieke Olsman ve Catharina de Lange Davies finansal veya finansal olmayan rekabet çatışması ilan etmemektedir. Spiros Kotopoulis tam zamanlı bir çalışandır ve ultrason ve mikrobubble / küme gelişmiş ilaç teslimatı geliştiren bir şirket olan EXACT Therapeutics AS'de hisse sahibidir. Kullervo Hynynen, araştırma dışı destek aldığı FUS Instruments'ın kurucusudur.
Teşekkürler
Hayvanların barınması Karşılaştırmalı Tıp Çekirdek Tesisi (CoMed, NTNU) tarafından sağlanmıştır. Şekil 3 BioRender.com oluşturuldu. Video kaydı ve düzenlemesi NTNU Doğa Bilimleri Fakültesi web yöneticisi Per Henning tarafından yapıldı. Proje, Norveç Bilim ve Teknoloji Üniversitesi (NTNU, Trondheim, Norveç), Norveç Araştırma Konseyi (RCN 262228), Kanada Sağlık Araştırmaları Enstitüleri (FDN 154272), Ulusal Sağlık Enstitüsü (R01 EB003268) ve Sunnybrook Sağlık Bilimleri Merkezi'nde Odaklanmış Ultrason Araştırmaları Temerty Kürsüsü tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Ring transducer placement | |||
| Agarose (powder) | Sigma-Aldrich | A9539 | |
| Beaker or Erlenmeyer flask (50 ml) | VWR | 213-0462 or 214-1130 | |
| Cyanoacrylate glue (gel) | Loctite | 1363589 | |
| Glass coverslips (13 mm) | Thermo Fisher Scientific | CB00130RA120MNT0 | Coverslip for ring transducer. |
| Hot plate or microwave | Corning | PC-400D | To heat agarose solution. |
| PBS (1X) | Sigma-Aldrich | P4417 | |
| Ring transducer | Custom-made | Custom-made | Custom-made. E.g. https://doi.org/10.1109/ULTSYM.2014.0518 |
| Rubber stopper | VWR | 217-0867 | |
| Animal preparation and drugs | |||
| Bupivacaine*A | Aspen | 169912 | Dose: 1 mg/kg, s.c., local anesthetic injected at incision site. |
| Buprenorphine*A | Indivior | 521634 | Dose mouse: 0.05-0.1 mg/kg, s.c., opioid, administer pre-surgery. |
| Buprenorphine*A | Indivior | 521634 | Dose rat: 0.01-0.05 mg/kg, s.c.. |
| Carprofen*C | Pfizer | DIN 02255693 | Dose: 5 mg/kg, s.c., NSAID, adminster post-surgery. |
| Depilatory cream | Veet | N/A | For complete fur removal after trimming. |
| Dexamethasone*C | Sandoz | DIN 00664227, 2301 | Dose: 3 mg/kg, i.m., corticosteroid, reduces cerebral edema, administer pre-surgery. |
| Enrofloxacin*C | Bayer | DIN: 02249243 | Dose: 5 mg/kg, i.p., antibiotic, administer post-surgery. |
| Fur clippers | Aesculap | 90200714 | Exacta/Isis. |
| Heating pad | Physitemp Instruments INC | HP-1M | |
| Isoflurane | Baxter | ESDG9623C | Dose: 3% induction, 1% maintenance; anesthetic. |
| Meloxicam*A | Boehringer Ingelheim Vetmedica GmbH | 25388 | Dose mouse: 2-3 mg/kg, s.c., NSAID, administer pre-surgery. |
| Meloxicam*A | Boehringer Ingelheim Vetmedica GmbH | 25388 | Dose rat: 1 mg/kg, s.c. |
| Pulse oximeter | STARR Life Sciences Corp | N/A | MouseOx. |
| Stereotaxic frame | Kopf | Kopf 900 | |
| Sterile ophthalmic ointment | Théa | 597562 | Viscotears. |
| Tail vein catheter (24 G) | BD Neoflon | 391350 | |
| * Discuss dosing and type of administration with veterinarian prior to use. A For acute window surgeries, C For chronic window surgeries. Dose for mice and rats are the same unless otherwise specified. | |||
| Material and equipment for cranial window placement | |||
| Alcohol swabs | BD | 326895 | |
| Curved fine surgical scissors | Fine Science Tools | 14002-12 | |
| Cotton or fibreless swabs | Chemtronics | CX50 | |
| Cyanoacrylate glue (gel) | Loctite | 1594457 (gel), 230992 (liquid) | If unavailable, liquid cyanoacrylate glue can be mixed with extra-fine acrylate powder. |
| Dental cement | Lang Dental | Jet Set-4 Denture Repair Package | |
| Dental micromotor hand drill | FOREDOM | K.1070-2 | High speed rotary micromotor kit with 2.35 mm collet. |
| Forceps | Fine Science Tools | 11152-10, 11370-40 | |
| Glass coverslips | Thermo Fisher Scientific | CB00050RA120MNT0 (5 mm) | Mouse cranial windows. |
| Glass coverslips | Thermo Fisher Scientific | CB00080RA120MNT0 (8 mm) | Rat cranial windows. |
| Micro drill burrs (0.5 mm) | Meisinger | HM71005 (0.5 mm) | |
| Micro drill burrs (0.7 mm) | Meisinger | HM71007 (0.7 mm) | |
| Stereo microscope | Nikon | SMZ645 | |
| Surgical gelatin sponge | Ethicon | MS0005 | |
| Vetbond Tissue adhesive | 3M | 1469SB | |
| Weigh boats / trays | VWR | 10803-148 | |
| * Autoclave drapes, tools, materials, and gowns, and use sterile surgical gloves, for chronic cranial window surgeries. | |||
| Multiphoton microscopy | |||
| 20x water immersion objective | Olympus | XLUMPLFLN20 XW | Numerical aperture 1.0, working distance 2.0 mm. |
| Fluorescent dextran (e.g. FITC 70 kDa) | Sigma Aldrich | 46945 | Recommended 10 kDa-2 MDa. |
| MaiTai DeepSee Ti:Sapphire laser oscillator | Spectra-Physics | N/A | |
| SliceScope microscope | Scientifica | N/A | |
| Ultrasound treatment | |||
| 50 dB RF Amplifier | E&I | 2100L | |
| Matching circuit | Custom-made | Custom-made | Custom-made. |
| Microbubbles | Bracco Imaging | N/A | SonoVue (Bracco Imaging, Europe). Dose 1 ml/kg. |
| Microbubbles | Lantheus | N/A | Definity (Lantheus Medical Imaging, North America). Dose 0.02-0.04 ml/kg. |
| Signal generator | Agilent Technologies | 33500B |
Referanslar
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Kalladka, D., et al. Human neural stem cells in patients with chronic ischaemic stroke (PISCES): a phase 1, first-in-man study. Lancet. 388 (10046), 787-796 (2016).
- Pardridge, W. M. The blood-brain barrier: Bottleneck in brain drug development. the journal of the American Society for Experimental NeuroTherapeutics. 2 (1), 12 (2005).
- Lochhead, J. J., Thorne, R. G. Intranasal delivery of biologics to the central nervous system. Advanced Drug Delivery Reviews. 64 (7), 614-628 (2012).
- Nagy, Z., Pappius, H. M., Mathieson, G., Hüttner, I. Opening of tight junctions in cerebral endothelium. I. Effect of hyperosmolar mannitol infused through the internal carotid artery. The Journal of Comparative Neurology. 185 (3), 569-578 (1979).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220 (3), 640-646 (2001).
- Burgess, A., et al. Alzheimer disease in a mouse model: MR imaging-guided focused ultrasound targeted to the hippocampus opens the blood-brain barrier and improves pathologic abnormalities and behavior. Radiology. 273 (3), 736-745 (2014).
- Abrahao, A., et al. First-in-human trial of blood-brain barrier opening in amyotrophic lateral sclerosis using MR-guided focused ultrasound. Nature Communications. 10 (1), 4373 (2019).
- Hynynen, K., Jones, R. M. Image-guided ultrasound phased arrays are a disruptive technology for non-invasive therapy. Physics in Medicine and Biology. 61 (17), 206-248 (2016).
- Burgess, A., et al. Targeted delivery of neural stem cells to the brain using MRI-guided focused ultrasound to disrupt the blood-brain barrier. PLoS One. 6 (11), 27877 (2011).
- McDannold, N., Arvanitis, C. D., Vykhodtseva, N., Livingstone, M. S. Temporary disruption of the blood-brain barrier by use of ultrasound and microbubbles: Safety and efficacy evaluation in rhesus macaques. Cancer Research. 72 (14), 3652-3663 (2012).
- Downs, M. E., et al. Long-term safety of repeated blood-brain barrier opening via focused ultrasound with microbubbles in non-human primates performing a cognitive task. PLOS One. 10 (5), 0125911 (2015).
- Baghirov, H., et al. Ultrasound-mediated delivery and distribution of polymeric nanoparticles in the normal brain parenchyma of a metastatic brain tumour model. PloS One. 13 (1), 0191102 (2018).
- Sulheim, E., et al. Therapeutic effect of cabazitaxel and blood-brain barrier opening in a patient-derived glioblastoma model. Nanotheranostics. 3 (1), 103-112 (2019).
- Bing, C., et al. Transcranial opening of the blood-brain barrier in targeted regions using a stereotaxic brain atlas and focused ultrasound energy. Journal of Therapeutic Ultrasound. 2, 13 (2014).
- O'Reilly, M. A., Hynynen, K. Blood-brain barrier: Real-time feedback-controlled focused ultrasound disruption by using an acoustic emissions-based controller. Radiology. 263 (1), 96-106 (2012).
- Jones, R. M., Deng, L., Leung, K., McMahon, D., O'Reilly, M. A., Hynynen, K. Three-dimensional transcranial microbubble imaging for guiding volumetric ultrasound-mediated blood-brain barrier opening. Theranostics. 8 (11), 2909-2926 (2018).
- Jones, R. M., McMahon, D., Hynynen, K. Ultrafast three-dimensional microbubble imaging in vivo predicts tissue damage volume distributions during nonthermal brain ablation. Theranostics. 10 (16), 7211-7230 (2020).
- Arvanitis, C. D., et al. Mechanisms of enhanced drug delivery in brain metastases with focused ultrasound-induced blood-tumor barrier disruption. Proceedings of the National Academy of Sciences. 115 (37), 8717-8726 (2018).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. Journal of Cerebral Blood Flow and Metabolism. 33, (2012).
- McCarter, J. F., et al. Clustering of plaques contributes to plaque growth in a mouse model of Alzheimer's disease. Acta Neuropathologica. 126 (2), 179-188 (2013).
- Cruz Hernández, J. C., et al. Neutrophil adhesion in brain capillaries reduces cortical blood flow and impairs memory function in Alzheimer's disease mouse models. Nature Neuroscience. 22 (3), 413-420 (2019).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Cao, V. Y., et al. In vivo two-photon imaging of experience-dependent molecular changes in cortical neurons. Journal of Visualized Experiments. (71), e50148 (2013).
- Nhan, T., Burgess, A., Hynynen, K. Transducer design and characterization for dorsal-based ultrasound exposure and two-photon imaging of in vivo blood-brain barrier disruption in a rat model. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 60 (7), 1376-1385 (2013).
- Cho, E. E., Drazic, J., Ganguly, M., Stefanovic, B., Hynynen, K. Two-photon fluorescence microscopy study of cerebrovascular dynamics in ultrasound-induced blood-brain barrier opening. Journal of Cerebral Blood Flow & Metabolism. 31 (9), 1852-1862 (2011).
- Burgess, A., Nhan, T., Moffatt, C., Klibanov, A. L., Hynynen, K. Analysis of focused ultrasound-induced blood-brain barrier permeability in a mouse model of Alzheimer's disease using two-photon microscopy. Journal of Controlled Release. 192, 243-248 (2014).
- Nhan, T., et al. Drug delivery to the brain by focused ultrasound induced blood-brain barrier disruption: Quantitative evaluation of enhanced permeability of cerebral vasculature using two-photon microscopy. Journal of Controlled Release. 172 (1), 274-280 (2013).
- Nhan, T., Burgess, A., Lilge, L., Hynynen, K. Modeling localized delivery of Doxorubicin to the brain following focused ultrasound enhanced blood-brain barrier permeability. Physics in Medicine and Biology. 59 (20), 5987-6004 (2014).
- Poon, C. T., et al. Time course of focused ultrasound effects on β-amyloid plaque pathology in the TgCRND8 mouse model of Alzheimer's disease. Scientific Reports. 8 (1), 14061 (2018).
- Poon, C., Pellow, C., Hynynen, K. Neutrophil recruitment and leukocyte response following focused ultrasound and microbubble mediated blood-brain barrier treatments. Theranostics. 11 (4), 1655-1671 (2021).
- Tufail, Y., et al. Transcranial pulsed ultrasound stimulates intact brain circuits. Neuron. 66 (5), 681-694 (2010).
- Chu, P. -. C., et al. Neuromodulation accompanying focused ultrasound-induced blood-brain barrier opening. Scientific Reports. 5 (1), 15477 (2015).
- Yddal, T., Kotopoulis, S., Gilja, O. H., Cochran, S., Postema, M. . Transparent glass-windowed ultrasound transducers. , 2079-2082 (2014).
- Santos, M. A., Goertz, D. E., Hynynen, K. Focused ultrasound hyperthermia mediated drug delivery using thermosensitive liposomes and visualized with in vivo two-photon microscopy. Theranostics. 7 (10), 2718-2731 (2017).
- Mullin, L., et al. Effect of anesthesia carrier gas on in vivo circulation times of ultrasound microbubble contrast agents in rats. Contrast Media & Molecular Imaging. 6 (3), 126-131 (2011).
- Itani, M., Mattrey, R. F. The effect of inhaled gases on ultrasound contrast agent longevity in vivo. Molecular Imaging and Biology. 14 (1), 40-46 (2012).
- Baum, J. A. The carrier gas in anaesthesia: Nitrous oxide/oxygen, medical air/oxygen and pure oxygen. Current Opinion in Anaesthesiology. 17 (6), 513-516 (2004).
- Poon, C., McMahon, D., Hynynen, K. Noninvasive and targeted delivery of therapeutics to the brain using focused ultrasound. Neuropharmacology. , 20-37 (2017).
- Joo, I. L., et al. Early neurovascular dysfunction in a transgenic rat model of Alzheimer's disease. Scientific Reports. 7, 46427 (2017).
- Dorr, A., et al. Amyloid-β-dependent compromise of microvascular structure and function in a model of Alzheimer's disease. Brain: A Journal of Neurology. 135, 3039-3050 (2012).
- Kim, T. N., et al. Line-scanning particle image velocimetry: An optical approach for quantifying a wide range of blood flow speeds in live animals. PLOS One. 7 (6), 38590 (2012).
- Teikari, P., Santos, M., Poon, C., Hynynen, K. Deep learning convolutional networks for multiphoton microscopy vasculature segmentation. arXiv. , (2016).
- Denes, A., et al. Surgical manipulation compromises leukocyte mobilization responses and inflammation after experimental cerebral ischemia in mice. Frontiers in Neuroscience. 7, 00271 (2014).
- Koletar, M. M., Dorr, A., Brown, M. E., McLaurin, J., Stefanovic, B. Refinement of a chronic cranial window implant in the rat for longitudinal in vivo two-photon fluorescence microscopy of neurovascular function. Scientific Reports. 9 (1), 5499 (2019).
- Podgorski, K., Ranganathan, G. Brain heating induced by near-infrared lasers during multiphoton microscopy. Journal of Neurophysiology. 116 (3), 1012-1023 (2016).
- Ulivi, A. F., et al. Longitudinal two-photon imaging of dorsal hippocampal CA1 in live mice. Journal of Visualized Experiments: JoVE. (148), e59598 (2019).
- Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., Webb, W. W. In vivo multiphoton microscopy of deep brain tissue. Journal of Neurophysiology. 91 (4), 1908-1912 (2004).
- Beekers, I., et al. Combined confocal microscope and Brandaris 128 ultra-high-speed camera. Ultrasound in Medicine & Biology. 45 (9), 2575-2582 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır