Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Damlacık Arayüzü Bilayer'in Sıcaklık Kontrollü Montajı ve Karakterizasyonu
Bu Makalede
Özet
Bu protokol, yüksek erime sıcaklıklarına sahip lipitler için lipid monolayer montajını ve damlacık arayüzü bilayer oluşumunu teşvik etmek için geri bildirim sıcaklığı kontrollü bir ısıtma sisteminin kullanımını ve membrandaki sıcaklık odaklı değişiklikleri karakterize etmek için kapasitans ölçümlerini detaylandırıyor.
Özet
Lipid bilayerlerin montajı için damlacık arayüzü bilayer (DIB) yöntemi (örn. DİB'ler) yağdaki lipid kaplı sulu damlacıklar arasında diğer yöntemlere göre önemli faydalar sunar: DİB'ler kararlı ve genellikle uzun ömürlüdür, bilayer alanı ters yönde ayarlanabilir, broşür asimetrisi damlacık bileşimleri ile kolayca kontrol edilebilir ve doku benzeri çift katman ağları birçok damlacığın bitişik olmasıyla elde edilebilir. DiB'lerin oluşturulması, lipitlerin damlacıkların yüzeylerinde yüksek yoğunluklu lipid monolayerlere kendiliğinden bir şekilde bireyi gerektirmektedir. Bu, yaygın sentetik lipitler için oda sıcaklığında kolayca meydana gelse de, bazı hücresel lipit özleri de dahil olmak üzere oda sıcaklığının üzerinde erime noktalarına sahip lipitler için benzer koşullarda yeterli bir monolayer veya stabil iki katmanlı oluşmaz. Bu davranış, model membran çalışmalarındaKI DDB'lerin bileşimlerini ve belki de biyolojik alaka düzeyini sınırlamıştır. Bu sorunu gidermek için, DIB damlacıklarını barındıran yağ rezervuarını dikkatlice ısıtmak ve sıcaklığın lipid zarı üzerindeki etkilerini karakterize etmek için deneysel bir protokol sunulmaktadır. Özellikle, bu protokol, daha geniş bir lipit tipi kümesi için monolayer montajını ve bilayer oluşumunu iyileştiren yüksek sıcaklıkları reçete etmek için bir geri bildirim döngüsü tarafından kontrol edilen termal iletken alüminyum fikstürün ve dirençli ısıtma elemanlarının nasıl kullanılacağını göstermektedir. Zarın yapısal özellikleri ve bilayerden oluşan lipitlerin termotropik faz geçişleri, DIB'nin elektrik kapasitansındaki değişiklikler ölçülerek ölçülür. Birlikte, bu prosedür, çok bileşenli lipit karışımları için etkili bir erime sıcaklığı(TM)belirlemek de dahil olmak üzere çeşitli sıcaklıklarda model membranlarındaki biyofiziksel olayların değerlendirilmesinde yardımcı olabilir. Bu özellik, model membranlarında doğal faz geçişlerinin daha yakın bir şekilde çoğaltilmesine izin verecek ve hücresel meslektaşlarının heterojenliğini daha iyi yakalayanlar da dahil olmak üzere daha geniş bir membran bileşenlerinden model membranların oluşumunu ve kullanımını teşvik edecektir.
Giriş
Hücresel zarlar, tüm canlı hücreleri kapsülleyen ve alt bölümlere ayıran binlerce lipit tip1,protein, karbonhidrat ve sterolden oluşan seçici geçirgen bariyerlerdir. Kompozisyonlarının işlevlerini nasıl etkilediğini anlamak ve doğal ve sentetik moleküllerin hücresel zarlarla nasıl etkileşime girdiğini, bunlara nasıl yapıştığını, bozulduğunu ve yer değiştirmesini, bu nedenle biyoloji, tıp, kimya, fizik ve malzeme mühendisliğinde geniş kapsamlı etkileri olan önemli araştırma alanlarıdır.
Bunlar, hücresel karşılıklarının bileşimini, yapısını ve taşıma özelliklerini taklit eden sentetik veya doğal olarak oluşan lipitlerden birleştirilmiş lipid bilayerleri de dahil olmak üzere model membranlarının montajı, manipüle edilmesi ve incelenmesi için kanıtlanmış tekniklerden doğrudan yararlanmayı amaçlamaktadır. Son yıllarda, yağdaki lipid kaplı su damlacıkları arasında düzlemsal lipid bilayer inşa etmek için damlacık arayüzü bilayer (DIB) yöntemi2,3,4 önemli ilgi gördü5,6,7,8 ,9,10,11 ,1112,13,14,15,16,17,18,19,20,21,22,23, ve model membran oluşumu için diğer yaklaşımlara göre pratik avantajlar göstermiştir: DIB yönteminin gerçekleştirilmesi kolaydır, sofistike bir imalat veya hazırlık gerektirmez (örn. "boyama") membranını desteklemek için bir substratın, sürekli olarak üstün membranlar verir uzun ömürlülük, standart elektrofizyoloji ölçümlerine izin verir ve asimetrik broşür bileşimleri ile model membranlarının oluşumunu kolaylaştırır3. Bilayer damlacıklar arasında kendiliğinden oluştuğundan ve her damlacık pozisyon ve makyajda uyarlanabildiğinden, DIB tekniği, uyaranlara duyarlı membranlar 18 , 24 , 25 ,26,27,28'inkullanımı üzerine inşa edilen hücreden ilham alan malzeme sistemleri geliştirmeye de büyük ilgi çekmiştir. ,29, dengeli bölmeleme ve taşıma14,30,31ve doku benzeri malzemeler17,23,32,33,34,35,36.
DDB'li olanlar da dahil olmak üzere model membranlar üzerinde yayınlanan deneylerin çoğu oda sıcaklığında (RT, ~20-25 °C) ve bir avuç sentetik lipitle (örneğin, DOPC, DPhPC, vb.) gerçeklenmiştir. Bu uygulama, model zarlarında çalışılabilen biyofiziksel soruların kapsamını sınırlar ve gözleme dayanarak, DIB'leri birleştirmek için kullanılabilecek lipit türlerini de kısıtlayabilir. Örneğin, 42 °C erime sıcaklığına sahip DPPC gibi sentetik bir lipit, sıkıca paketlenmiş monolayerleri bir araya getirmez veya RT37'deDIB oluşturmaz. Oda sıcaklığında DIB oluşumu, memelilerden (örneğin, beyin toplam lipid özü, BTLE)38 veya bakteriler (örneğin, Escherichia coli total lipid özü, ETLE)37, birçok farklı lipit türü içeren ve yüksek sıcaklıklarda (37 °C) bulunan hücrelerden kaynaklanan doğal özler için de zor olmuştur. Böylece çeşitli bileşimlerin incelenmesini sağlamak, membran aracılı süreçleri biyolojik olarak ilgili koşullarda anlama fırsatları sağlar.
Yağın sıcaklığını yükseltmek iki amaca hizmet edebilir: monolayer montajın kinetiğini arttırır ve lipitlerin sıvı düzensiz bir faza ulaşmak için erime geçişine neden olabilir. Her iki sonuç da dib için bir ön koşul olan monolayer derleme39'ayardımcı olur. Bilayer oluşumu için ısıtmaya ek olarak, oluşumdan sonra zarın soğutulmasının soğutulmasının tek lipid bilayerlerinde termotropik geçişleri tanımlamak için kullanılabilir38Kalorimetre kullanarak tespit edilmesi zor olabilecek doğal lipit karışımlarındakiler (örneğin BTLE) dahil. Lipitlerin termotropik geçişlerini değerlendirmenin yanı sıra, DIB'nin sıcaklığını kesin olarak değiştirmek, membran yapısı38'deki sıcaklık kaynaklı değişiklikleri incelemek ve lipid bileşiminin ve akışkanlığının, fizyolojik olarak ilgili bir sıcaklıkta (37 °C) memeli ve bakteriyel model zarları da dahil olmak üzere membran aktif türlerin (örneğin, gözenek oluşturan peptitler ve transmembran proteinleri37)kinetiğini nasıl etkilediğini incelemek için kullanılabilir.
Burada, rt'den daha yüksek sıcaklıklarda monolayer montajı ve çift katmanlı oluşumu etkinleştirmek için modifiye edilmiş bir DIB yağ rezervuarının nasıl monte edileceğinin ve geri bildirim sıcaklığı denetleyicisinin nasıl çalıştırılacağının açıklaması açıklanacaktır. Önceki bir protokolden ayırtedilen 40, dib'nin yağ rezervuarındaki montajına ve karakterizasyonuna paralel olarak sıcaklığı ölçmek ve kontrol etmek için gereken enstrümantasyonun entegrasyonu ile ilgili açık ayrıntı dahildir. Bu nedenle prosedür, bir kullanıcının çeşitli bilimsel bağlamlarda çeşitli sıcaklıklarda DIB'leri oluşturmak ve incelemek için bu yöntemi uygulamasına olanak sağlayacaktır. Ayrıca, temsili sonuçlar, sıcaklık çeşitli olduğunda ortaya çıkabilecek hem membran yapısında hem de iyon taşınımında ölçülebilir değişiklik türleri için özel örnekler sağlar. Bu teknikler, farklı membran bileşimlerinde membran aktif türlerin kinetiğini incelemek de dahil olmak üzere DBS'lerde etkili bir şekilde tasarlanabilecek ve gerçekleştirilebilecek birçok biyofiziksel çalışmaya önemli eklemelerdir.
Protokol
1. Isıtmalı fikstür hazırlığı
- Genişlik ve uzunluk olarak 25 mm x 40 mm'ye kesilmiş 1 mm kalınlığında 2 adet yalıtımlı kauçuk toplayın, sırasıyla, 25 mm x 40 mm olan 6 mm kalınlığında bir kauçuğun 2 parçası, hazırlanmış bir alüminyum taban fikstür tertibatı ve alüminyum taban fikstürünün görüntüleme penceresine sığan akrilik bir yağ haznesi (imalat ve patlayan montaj görünümü hakkında ayrıntılar için S1, S2 ve S3 şekillerine bakın). Alüminyum fikstürü ilk olarak fikstürün altına UV kürlenebilir yapıştırıcılı bir cam kapaklı görüntüleme penceresi takarak ve fikstürün her 25 mm x 25 mm yan flanşının üstüne 1 dirençli ısıtma elemanı yapıştırarak hazırlayın.
- Daha ince kauçuk parçaları mikroskop aşamasına yerleştirin, böyle şekilde her parçanın uzun kenarı gösterildiği gibi sahne açıklığı için teğettir (Şekil 1).
- Alüminyum taban fikstürünü, fikstürün görüntüleme penceresi objektif lensin üzerinde ortalanmış olacak şekilde yalıtımlı pedlerin üzerine yerleştirin. Bağlı damlacıkların görüntülenmesi için uygun hizalama gereklidir.
- Her dirençli ısıtma elemanının üzerine daha kalın bir kauçuk parçası yerleştirin ve yerinde tutmak için bir mikroskop sahne klipsi kullanın. Bu parçalar, ısıtma elemanlarını sahne klipslerinin neden olduğu hasarlardan korur ve ısıtma elemanları ile hem alüminyum fikstür hem de mikroskop aşaması arasındaki yanlışlıkla elektriksel kısa devreye karşı yalıtılır.
- Uçtan ~4 mm'de 90° açı elde etmek için bir termokuplün ölçüm ucunun ölçüm ucunun dikkatlice bükülmesi.
- Termokuplün bükülmüş ucunu alüminyum fikstürün sol alt köşesine yerleştirin ve kilitleme vidasıyla hafifçe sabitleyin.
- Akrilik hazneyi alüminyum fikstürün kuyusuna yerleştirin. Bu, damlacıkların görüşünü engelleyebilecek görüntüleme penceresi ile akrilik rezervuarın tabanı arasındaki hava kabarcıklarını hapsetme riskini en aza indirmek için alüminyum fikstürünün kuyusuna (adım 1.8) altıgen yağı eklemeden önce yapılır.
NOT: Alüminyum fikstürün görüntüleme bölmesine eklenen yağ, akrilik rezervuarda bulunan damlacıkların daha net görüntülenmesi için akrilik ve camın kırılma endeksleriyle eşleşmek için kullanılır. Bu nedenle, alüminyum fikstürün kuyusundaki yağın akrilik rezervuarın içeriğiyle temas etmediğini ve alüminyum fikstürün titiz bir şekilde temizlenmesinin gerekli olmadığını belirtmek gerekir. - Aşırı doldurmamaya dikkat ederek alüminyum fikstürü kuyusuna (yani akrilik rezervuarın duvarları ile alüminyum armatür arasında) ~1.000 μL heksadecane yağı dağıtın. Alüminyum fikstürün kuyusundaki yağ seviyesi, ısı transferi için yüzey alanını en üst düzeye çıkarmak için izin verilemez kadar yüksek olmalı, ancak yağın fikstürün kenarlarından mikroskop aşamasına veya objektif lense dökülmesine izin vermemelidir.
- Akrilik rezervuara ~1.000 μL heksadecane yağı dağıtın, aşırı doldurmamaya dikkat edin.
NOT: Akrilik rezervuar deneyler arasında her zaman iyice temizlenmelidir. Kullanıcı, etil-alkol ve deiyonize su ile ardışık durulamalardan oluşan bir alay ve ardından 12 saatin üzerinde bir kurutucu kabında kurutma kullanmalıdır.

Şekil 1: Isıtmalı sahne montajı. Görüntüler, DIB oluşumu için termal iletken fikstürün ve yağ rezervuarının montajını göstermektedir; her görüntünün altındaki sayılar iletişim kuralının karşılık gelen adımını tanımlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Eşzamanlı geri bildirim sıcaklık kontrolü ve bir DIB'nin elektriksel karakterizasyonu için enstrümantasyon
NOT: Bu protokol, bir DIB'nin geri bildirim sıcaklık kontrolünü ve eşzamanlı elektriksel karakterizasyonunu etkinleştirmek için aşağıdaki araçları entegre eder: iki mevcut evrensel seri veri yolu (USB) bağlantısına sahip kişisel bir bilgisayar (PC), özel bir veri toplama (DAQ-1) sistemiyle eşleştirilmiş bir yama kelepçesi amplifikatörü, bir dalga biçimi jeneratörü, voltaj çıkışı ve sıcaklık giriş modüllerine sahip ikinci bir programlanabilir DAQ (DAQ-2) ve bir güç kaynağı / amplifikatörü. Aşağıdaki adımlarda, bir DIB'nin eşzamanlı elektrofizyolojisinden sıcaklığın ölçülması ve kontrolü için gereken bu aletlerin gerekli bağlantıları (Şekil 2a'dagösterildiği gibi) açıklanmaktadır. Eşdeğer enstrümanlar için ikameler gerektiği gibi yapılabilir.
- DAQ-2 modüllerine çıkış ve giriş bağlantıları kurun.
- Diferansiyel gerilim bağlantıları için gerilim çıkış modülünde iki çift vida terminali seçin ve bu konumlara tel uçları takın. Tek sayı terminalleri ortak yer bağlantılarıdır ve çift sayı terminalleri gösterildiği gibi topraklanmamış çıkışlardır (Şekil 2c). Bu iki çift kurşun kablonun her birini vidalı terminal-BNC adaptörlerine bağlayın ve ardından her adaptörü voltaj sinyallerini diğer cihazlara yönlendirmek için kullanılan ayrı bir BNC kablosuna bağlayın.
NOT: Bu kurulumda, güç amplifikatörüne sıcaklık kontrol çıkışı için 0 ve 1 terminallerindeki diferansiyel bağlantılar atanırken, 6 ve 7 terminallerindeki başka bir bağlantı çifti, yama kelepçesi amplifikatörü aracılığıyla damlacıklara gönderilecek voltaj çıkışı için belirlenmiştir. - (Şekil 2c) atıfta bulunarak, termokuple giriş modülünde bir termokuple terminali seti seçin (örneğin, terminal 2 ve 3 TC1 çifti olarak belirlenmiştir) ve termokuple kablolarını bağlayın.
- Diferansiyel gerilim bağlantıları için gerilim çıkış modülünde iki çift vida terminali seçin ve bu konumlara tel uçları takın. Tek sayı terminalleri ortak yer bağlantılarıdır ve çift sayı terminalleri gösterildiği gibi topraklanmamış çıkışlardır (Şekil 2c). Bu iki çift kurşun kablonun her birini vidalı terminal-BNC adaptörlerine bağlayın ve ardından her adaptörü voltaj sinyallerini diğer cihazlara yönlendirmek için kullanılan ayrı bir BNC kablosuna bağlayın.
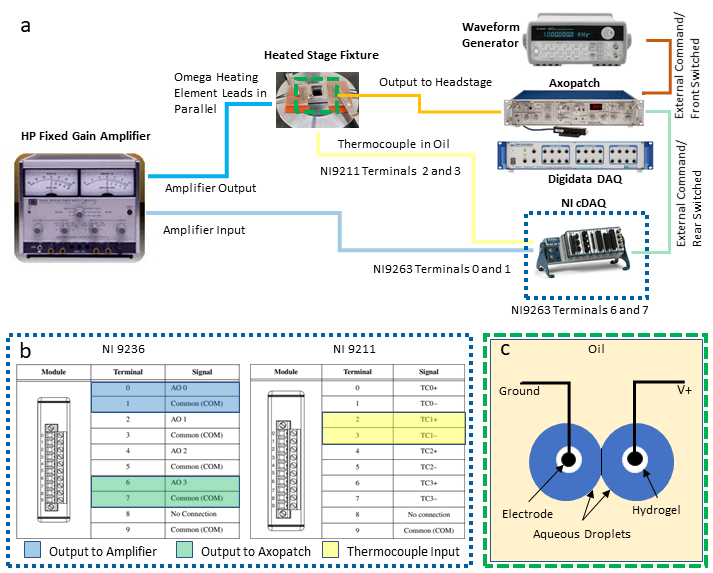
Şekil 2: Sistem kablolama bağlantıları. Sistem için gerekli cihazların ve kablolamanın şeması (a) içinde gösterilirken, (b) içinde DAQ-2 bağlantılarına ayrıntılı bir bakış sağlanır. (c)resimlerinde DIB oluşumu için yağa batırılmış hidrojel kaplı elektrotlar üzerindeki sulu damlacıklar gösterilmektedir. İki elektrot, yama kelepçesi amplifikatörünün baş kulis ünitesinde sırasıyla topraklanmış ve topraklanmamış (V+) bağlantılara bağlanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- DAQ-2 modüllerine elektrik bağlantıları yapıldıktan sonra, DAQ-2 şasisini bir USB bağlantısı üzerinden bir PC'ye bağlayın ve bir elektrik güç kaynağına bağlanın. Ardından, ticari bir yazılımla kullanmadan önce başarılı sürücü ve yazılım yüklemesini onaylayın.
- DAQ-2 ve dirençli ısıtma elemanları arasında bir güç amplifikatörü yapılandırın ve bağlayın.
- Amplifikatörü 10X kazançla sabit kazançlı amplifikasyon modunda çalışacak şekilde yapılandırın.
- Muz jakı-BNC adaptörü kullanarak, voltaj çıkış modülündeki(Şekil 2b)0 ve 1 terminallerinden kaynaklanan BNC kablosunu güç amplifikatöründeki giriş bağlantılarına bağlayın.
- Ek BNC adaptörleri ve kablolama kullanarak, güç amplifikatörünün çıkış terminallerini, her iki elemanın da kullanım sırasında aynı voltaj düşüşünü sürdürmesini sağlamak için birbirine paralel olarak kablolu ısıtma elemanları setine ve amplifikatöre bağlayın.
- Elektrofizyoloji ekipmanı için gerekli bağlantıları kurun.
- Gerilim çıkış modülündeki(Şekil 2b)6 ve 7 terminallerinden kaynaklanan bir BNC kablosunu yama kelepçesi amplifikatörünün arkasındaki Arka Anahtarlı Dış Komuta BNC konektörlerine bağlayın.
- Dalga biçimi üreteci çıkışı ile yama kelepçesi amplifikatörünün arkasındaki Ön Anahtar Harici Komut bağlantısı arasında ikinci bir BNC kablosu bağlayın.
NOT: Bu iki bağlantı, yama kelepçesi amplifikatörü aracılığıyla damlacık elektrotlarına uygulanan voltaj dalga formlarını üretmek için alternatif yöntemler sağlar. Dalga biçimi üreteci özellikle membran kapasitansını ölçmek için kullanılan üçgen dalga biçimi voltajları üretmek için kullanışlıdır. Kullanıcı, kendi uygulaması için hangisinin gerekli olduğuna karar verebilir. - Üçüncü bir BNC kablosuyla, yama kelepçesi amplifikatörünün ön panelinde bulunan ölçülen akımın çıkışını DAQ-1'in ön tarafında bulunan mevcut bir analog giriş BNC konektörüne bağlayın.
- Dördüncü bir BNC kablosuyla, ölçülen membran voltajının çıkışını (yama kelepçesi amplifikatörünün arkasında) DAQ-1'deki ayrı bir analog giriş konektörüne bağlayın. Bu, elektrotlar boyunca uygulanan voltajın dijitalleştirilmesini sağlar.
- Ref. 40'ta7-9. basamaklarda açıklandığı gibi mikromanipülatörler üzerinde hazırlanan ve desteklenen iki damlacık elektrot ile elektrot uçlarını yama kelepçesi amplifikatörüne kablo ile bağlanan yama kelepçesi başlığına bağlayın.
NOT: Baş sahnenin rolü, elektrotlar arasındaki voltajı kontrol etmek ve elde edilen akımı ölçmektir, bu da yama kelepçesi amplifikatörü tarafından DAQ-1'e çıkış alan orantılı bir voltaja dönüştürülür. - DAQ-1'i bir USB bağlantısıyla bir PC'ye bağlayın ve ilgili güç kaynağı kablolarını hem yama kelepçesi amplifikatörüne hem de DAQ-1'e bağlayın.
- Tüm ölçüm ekipmanlarının gücü.
NOT: Bu kurulumdaki belki de en önemli ayrıntı, güç amplifikatörü çıkışının (mA-A) bağlantılarının, bir DIB'deki pA-nA seviyesi akımlarını ölçmek için hassas bir devre kullanan yama kelepçesi amplifikatörunun başmüfhane ünitesinden elektriksel olarak izole edildiklerinden emin olmaktır.
3. Damlacık arayüzü bilayerlerinin geri bildirim sıcaklık kontrolü
NOT: Geri bildirim sıcaklık kontrol sisteminin çalıştırılabilirliği için aşağıdaki adımlar, orantılı integral (PI) geri bildirim sıcaklık kontrolü40 , 41(bkz. Tamamlayıcı Kodlama Dosyaları)uygulamak için oluşturulan özel bir grafik kullanıcı arabirimine(GUI) dayanmaktadır. Bunun yerine başka yazılım ve kontrol algoritmaları kullanılabilir. Bu programın bir kopyası, okuyucuya makalenin ek bilgileriyle sağlanır, ancak kullanıcı kendi ekipmanı ve ihtiyaçları için yapılandırmakla sorumludur.
- PC'de DAQ-2 yazılımını başlatın ve sıcaklık kontrol programı dosyasını açın. GUI açıldıktan sonra, GUI'nin sol alt köşesindeki klasör simgesine tıklayarak ve sıcaklık kontrol programını seçerek programı tekrar açın (Şekil 3).
- Oransal kontrol kazancı (KP) ve integral kontrol kazancı ( KI) için uygun sayısal değerleri girin.
NOT: Sırasıyla 0.598 ve 0.00445 K P ve KI değerlerinin kurulumda iyi çalıştığı bulunmuştur. Bu değerler, ölçülen açık döngü ısıtma yanıtlarından elde edilen parametreleri içeren bir sistem modeli kullanılarak simülasyon yoluyla yinelemeli olarak belirlenmiştir (bkz. Şekil 4). Açık döngü ısıtmasırasında, öngörülen ısıtma gücü ölçülen sıcaklıklardan bağımsızdır. Buna karşılık, kapalı döngü ısıtma, uygulanan gücün ısıtıcılara, ölçülen sıcaklığı istenen sıcaklığa yaklaştırmaya yardımcı olacak şekilde sürekli olarak ayarlanmasıdır. Bu, burada bir PI kontrol şeması kullanılarak elde edilir. - Sıcaklık kontrol şemasını test etmek için, istediğiniz ayar noktası sıcaklığını (oda sıcaklığının üzerinde) girin ve ardından GUI içindeki geri bildirim sıcaklık kontrolünü açın. Önümüzdeki birkaç dakika boyunca GUI'de görüntülenen geri bildirim (kapalı döngü) kontrolü altında ölçülen sıcaklık sinyalini gözlemleyin. Yağın ölçülen sıcaklığı istenen sıcaklığı büyük ölçüde alarsa, değişikliklere çok yavaş tepki verirse veya istenen ayar noktasına yakınsamazsa, kullanıcının istenen kapalı döngü performansını elde etmek için kontrol kazanımlarını ayarlaması gerekir.
NOT: Program, dirençli ısıtma elemanlarına verilen güç (ve dolayısıyla voltaj) için bir doygunluk sınırı tanımlar. Örneğin, burada bildirilen iki öğe her biri 5 W'a kadar güç tüketir. Bunları paralel olarak kablolama, toplam güç tüketiminin 10 W'ı geçmemesi gerektiği anlamına gelir. Kullanıcının cihazlara sağlanması gereken maksimum güç miktarını göz önünde bulundurması ve bu sınırın kapalı döngü sisteminin istenen sıcaklık değişikliklerine yanıt verme hızını etkileyebileceğini bilmesi önerilir. Daha yüksek güç ısıtma elemanları daha hızlı ısıtma ve daha yüksek ayar noktası sıcaklıkları sağlar, ancak ısıtma için daha yüksek tedarik edilen akımlar gerektirir. - Sistem kabul edilebilir kapalı döngü performansına ayarlanmışken, GUI'de ayarlanan nokta olarak DIB oluşumu için istenen yağ sıcaklığını girin.
NOT: Örneğin, 60 °C'lik bir ayar noktası sıcaklığı, sulu damlacıklarda BTLE lipozomları ile yapılan deneylerde iyi sonuçlar verdi37. Kullanıcı, tel tipi elektrotlarda asılı damlacıklar arasındaki DIB montajını açıklayan protokoller ve yama kelepçesi amplifikatörü, DAQ-1 ve elektrofizyoloji ölçüm yazılımı kullanılarak elektrofizyoloji ekipmanının yapılandırılmasıiçin başkabiryere yönlendirilir. Özellikle, Najem ve ark.40'ın protokolü 13. Bu adımın ötesinde, monolayer veya çift katmanlı oluşumu teşvik etmek için ısıtma gerektiren lipitler kullanılırken başarılı monolayer ve bilayer oluşumu için biraz farklı bir yaklaşım kullanılır. - Gümüş/gümüş klorür (Ag/AgCl) elektrotlarının uçlarını, akrilik rezervuarın dibine neredeyse temas edene kadar yağa küçümseyin. Elektrot uçlarının bu şekilde konumlandırılması, elektrot üzerindeki damlacığın, yağdaki konvektif akımların damlacıkları hidrojel kaplı elektrotlardan ayırdığı gözlenen ısıtılmış yağda tutmak için çok önemlidir (Şekil 2c).
- Pipet, her elektrot ucuna 2 mg / mL BTLE, 100 mM potasyum klorür (KCl) ve 10 mM 3 -(N-morpholino) propansülfyonik asit (MOPS) içeren sulu lipid çözeltisinin 250 nL damlacığını ve monolayer oluşumunu teşvik etmek için ısıtılmış yağda en az 10 dakika kuluçkaya yatmalarını sağlar.
- Sahne başlığını ve ısıtmalı sahne fikstürünü topraklanmış bir Faraday kafesi ile örtün.
- Damlacıkları yavaşça hafif temasa getirin
kullanıcı damlacıkların temastan deforme olduğunu görene veya birbirini yerinden etmeye başlayana ve ikiyer oluşumu başlayana kadar birkaç dakika bekleyene kadar elektrotların yatay konumlarını manipüle eder. Birkaç dakika sonra bir bilayer oluşmadıysa, damlacıklar bilayer oluşumunu kolaylaştırmak için daha fazla bir araya getirilebilir. İnceltilmiş bir interfacial bilayer oluşumu görsel muayene ile doğrulanabilir (Şekil 5a) veya 10 mV, 10 Hz üçgen voltaj22çıkış yapan bir dalga formu jeneratörü tarafından indüklenen kare dalga biçimi kapasitif akımının genliğindeki artış ölçülerek. İlk oluşumda ve ilk belirlenen noktada sonraki karakterizasyondan önce, iki arada bir alana ulaşmak için iki katın en az 10 dakika boyunca dengelenmesine izin verin.
NOT: Yağ türü bilayer inceltme, membran kalınlığı ve damlacıklar arası temas açısı üzerinde önemli bir etkiye sahip olabilir. Genel olarak, yağ molekülü ne kadar küçük olursa, lipid akil zincirleri tarafından işgal edilen bilayer'in hidrofobik çekirdeğinde o kadar kolay kalabilir. Yağ tutma hem monolayer hem de bilayer gerilimini ve kalınlığını arttırır ve damlacıklar arasındaki alanı ve temas açısını azaltır. Bu ölçümler daha zayıf bir yapışıklık durumunu ifade eder. Daha büyük, daha hacimli moleküller tam tersi bir etki uygular. Örneğin, squalene, bilayer inceltme sırasında monolayerler arasında kolayca dışlanmasını sağlayan altıgen gibi alkanlardan daha hacimli bir moleküldür. Bu nedenle, squalene'de oluşan DDB'ler daha incedir, daha yüksek temas alanları ve açılar gösterirler ve22,42 (damlacık damlacık yapıştırma ölçüsü) daha yüksek serbest oluşum enerjileri sergilerler.
4. DiB'lerde sıcaklığa bağlı davranışların karakterizasyonu
NOT: Dib tabanlı model membranlarında sıcaklıktaki değişikliklerin membranın yapısını ve taşıma özelliklerini nasıl etkilediği de dahil olmak üzere birçok fiziksel süreç incelenebilir. İstenilen sıcaklıkta başarılı çiftyapı oluşumundan sonra aşağıdaki adımlar yapılmalıdır.
- Membrandaki lipitlerin termotropik faz geçişlerini tanımlamak için bilayer oluşumuna izin veren bir noktadan yağ banyosunun sıcaklığını düşürürken membranın nominal kapasitansını ölçün38.
- GUI'deki sıcaklık grafiğini sağ tıklatın ve görüntülenen verileri temizleyin. Bu, sonraki kayıtlar için arabellekte yeterli alan olmasını sağlar.
- Yama kelepçesi amplifikatörüne bağlı dalga formu jeneratörünü kullanarak, DIB elektrotları boyunca üçgen voltaj dalga formu (örneğin, 10 mV, 10 Hz) uygulayın ve indüklenen akım yanıtını ikiyerden kaydedin.
- Ayarlanan nokta sıcaklığını 5 °C'lik artışlarla azaltarak ve istenen sıcaklık elde edilene kadar sıcaklık değişimleri arasındaki yeni sabit durum sıcaklığında minimum 5 dakika bekleyerek bilayer'i soğutun. Alternatif olarak, geri bildirim kontrol sistemini kapatarak bilayer'i pasif olarak soğutmayı deneyin. Bununla birlikte, 50-60 ° C'den pasif soğutma uygulayan deneylerin daha yüksek birleşme oranlarına neden olduğunu unutmayın.
- Yağ banyosu ve bilayer istenen minimum sıcaklığa soğuduktan sonra, GUI'deki sıcaklık grafiğini tekrar sağ tıklayın ve sıcaklık verilerini zamana karşı bir elektronik tablo yazılımına dışa aktarın. Geçerli kaydı durdurun.
- Ölçülen akımdan, kare dalga akımı tepkisinin nominal kapasitansını, soğutma süresi boyunca zamana göre hesaplayın.
- Membran kapasitansı nasıl değiştiğini gözlemlemek için nominal kapasitansı(C)ve sıcaklığı(T)çizin. TM'yitanımlamak için C ve T'deki nonmonotonic değişiklikleri bulun.
NOT: Nominal kapasitans kare dalga akım genliğinden hesaplanabilir43 (| I|) ilişki | kullanma Ben| = Dv/dt'nin voltaj genliğinin dört katına eşit olduğu C dv/dt (| V|) ve uygulanan üçgen gerilimin frekansı (f) . Bu denklemlerden C = | I|/(4| V|f).
- Benzer şekilde, yağ banyosunun ve bilayer alanının sıcaklığını art arda artırarak, bilayer'in yarı statik spesifik kapasitansını (Cm) sabit sıcaklıklarda değerlendirin.
- GUI'yi kullanarak ayarlanan nokta sıcaklığını 10 °C'lik artışlarla değiştirin ve sistemin yeni sıcaklığa dengelenmesine izin verin.
- Kapasitif akım ve kayıt ölçümünü başlatmak için Adım 4.1.2'yi gerçekleştirin.
- Mikro manipülatörleri kullanarak elektrotların konumlarını dikkatlice ayarlayarak bilayer alanını değiştirin (yani, elektrotların ayrılması bilayer alanını azaltır). Kare dalga akımının sabit bir durum genliğine ulaşmasına izin verin ve mikroskop aşamasının açıklığından görüldüğü gibi bilayer'i görüntülemek için mikroskopa monte edilmiş bir kamera kullanarak memb alanının zamana karşı hesaplanmasını sağlamak için DIB'nin görüntülerini toplayın. Aynı zamanda, görüntü toplama için karşılık gelen zaman noktasını işaretlemek için geçerli kayıt yazılımına dijital bir etiket ekleyin.
NOT: Mikro manipülatörler elektrotların hassas kontrolünü ve böylece damlacıklar arasında hafif temas sağlar. Damlacıkların kaba manipülasyonu, damlacıkların birleşerek veya bir damlacığın elektrottan düşmesine neden olarak başarısız bir deneye yol açabilir. Başka bir yerde tartışıldığı gibi22, iki katlı alan, alt görünüm görüntüsünde çakışan daireler olarak görünen damlacıklar arasındaki temas uzunluğundan hesaplanır. Damlacıkların konumları ve boyutları ve temas hattının uzunluğu, bir görüntü işleme yazılımı kullanılarak veya diğer bilimsel programlama araçlarıyla hesaplanabilir. - Toplam 5 DIB görüntü ve iki katlı akımın sabit durum bölgelerini elde etmek için Adım 4.2.1.2'yi en az 4 kez yineleyin.
- İstediğiniz her sıcaklıkta Adım 4.2.1'i tekrarlayın.
- Elde edilen görüntüler için sabit durum bilayer alanlarına karşılık gelen etiketli zaman noktalarında, her sıcaklık için C ve A verilerini ayıklamak için mevcut kayıtları ve DIB görüntülerini analiz edin.
- Her sıcaklık için C ve A verilerini çizin ve her sıcaklıkta iki katlı C m'yi temsil eden birinci sınıf bir gerileme eğimini hesaplayın22.
- Adım 4.2.4 ile Tarasında elde edilen Cm'nin çizim değerleri.
- Erime sıcaklıklarını tanımlamak için monoton olmayan varyasyonlar için Cm ve T verilerini inceleyin, TM.
- GUI'yi kullanarak ayarlanan nokta sıcaklığını 10 °C'lik artışlarla değiştirin ve sistemin yeni sıcaklığa dengelenmesine izin verin.
- İkiyer boyunca bir dc voltaj adım girişi oluşturarak gerilime bağlı iyon kanalı oluşumunun dinamiklerini değerlendirin.
- İlk Gerilimi mV'de istediğiniz adım değerine ayarlayın (örneğin, 100 mV).
- Son Gerilim ve Adım Boyutunu istenen adımdan daha yüksek bir değere ayarlayın (örneğin, 110 mV son gerilim ve 110 mV adım boyutu).
- Adım girişi için istediğiniz süreyi saniye cinsinden ayarlayın (ör. 90 s).
- Adım girişi için istediğiniz polariteyi seçin (örneğin, pozitif).
- GUI/voltaj çıkış modülünden kaynaklanan komut voltajını baş kulise göndermek için yama kelepçesi amplifikatörünü değiştirin.
- Geçerli kayıtları başlatın.
- Voltajı açın ve kritik bir voltaja S şeklinde bir yanıt sergilemesi gereken indüklenmiş akım tepkisini kaydedin (örneğin, 2 mg/ mL BTLE'de 1 μg / mL Mz için ~ 70 mV).
- Ayrı olarak, bir membran için dinamik akım-gerilim ilişkileri, iyon kanalı davranışları gibi voltaja bağlı ilişkileri ortaya çıkarmak için istenen sıcaklıklarda elde edilebilir.
- Dalga biçimi üretecinden kaynaklanan komut voltajını baş kulise göndermek için yama kelepçesi amplifikatörünü değiştirin ve mevcut kayıtları başlatın.
- Dalga biçimi üretecinde, istenen genlik, ofset ve frekans ile sürekli bir sinüzoidal dalga formu çıkışı.
- İndüklenen geçerli yanıtı bir veya birden çok döngü boyunca kaydedin.
- Farklı sinüs dalgası genlikleri, frekansları ve sıcaklıkları için istediğiniz gibi tekrarlayın.
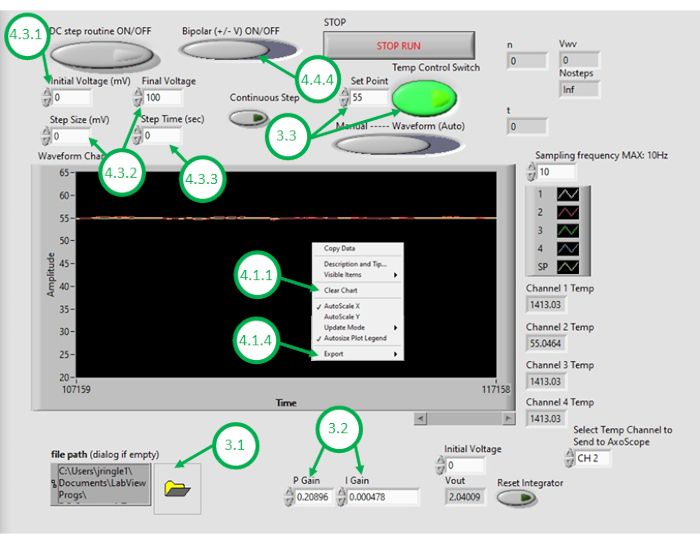
Şekil 3: Sıcaklık kontrolü GUI' si. Bu şekil, yağ banyosunun sıcaklığını kontrol etmek için programın GUI'sini kullanmak için gereken kritik adımları vurgular ve etiketler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Şekil 1, dib oluşumu için mikroskop aşamasında alüminyum fikstürün ve akrilik yağ rezervuarın nasıl hazırlandığını göstermektedir. Montaj adımları 1.2-1.4, fikstürü daha verimli ısıtma için sahneden termal olarak yalıtmaya yarar. 1.5-1.7 arası adımlar termokuplün fikstüre nasıl düzgün bir şekilde takılacağını ve yağ haznesinin nasıl konumlandırılacağını gösterir ve 1.8 -1.9 adımları bu parçalara yağ dağıtmak için önerilen yerleri gösterir...
Tartışmalar
Burada açıklanan protokol, DIB oluşturmak için kullanılan yağ ve damlacıkların sıcaklığını kontrol etmek için deneysel bir sistemin montajı ve işletilme talimatları sağlar. Özellikle RT'nin üzerinde erime sıcaklıklarına sahip lipitler kullanılarak DIB oluşumunu sağlamak için faydalıdır. Ayrıca, yağ rezervuarının sıcaklığını tam olarak değiştirerek, bilayer sıcaklığı, yüksek sıcaklıkların kapasitans, alan, kalınlık, indüklenmiş termotropik faz değişiklikleri, membran a...
Açıklamalar
Yazarların çıkar çatışması yoktur.
Teşekkürler
Ulusal Bilim Vakfı Hibe CBET-1752197 ve Hava Kuvvetleri Bilimsel Araştırma Ofisi Hibe FA9550-19-1-0213 tarafından finansal destek sağlanmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 25 mm x 40 mm x 1 mm insulative rubber (x2) | Any | Insulates the bottom of the aluminum fixture from the stage of the microscope | |
| 25 mm x 40 mm x 6 mm insulative rubber (x2) | Any | Protects heating elements from being damaged by the microscope stage clips and insulates the top of the heating elements. | |
| 3-(N-morpholino) propanesulfonic acid | Sigma Aldrich | M3183 | Buffering agent for lipid solution |
| Acrylic substrate | Fabricated in house | HTD_STG_2 | ~1000 uL acrylic well with a poka-yoke exterior profile to fix orientation |
| Aluminum fixture | Fabricated in house | HTD_STG_1 | Base fixture with an oil well that holds the acylic fixture and includes two flat pads adjacent to the oil well for the heating elements |
| Brain Total Lipid Extract | Avanti | 131101C-100mg | 25 mg/mL porcine lipid extract |
| Compact DAQ Chassis (cDAQ) | National Instruments | cDAQ-9174 | Chassis to house multiple types of sensor measurement or output modules |
| Data Acquisition System (DAQ) | Molecular Devices | Digidata 1440A | High resolution analog to digital converter |
| Fixed gain amplifier/power supply | Hewlitt Packard | HP 6826A | Amplifies DC voltage output from the voltage output module |
| Glass Cover Slip | Corning | CLS284525 | Seals bottom of aluminum base and allows for optical characterization of the bilayer |
| Heating element (x2) | Omega | KHLV-101/5 | 25 mm x 25 mm polymide film kapton heating element with a 5 watt power limit. |
| M3 Stainless Steel Screw | McMaster Carr | 90116A150 | Secures thermocouple to aluminum fixture |
| Patch clamp amplifier | Molecular Devices | AxoPatch 200B | Measures current and outputs voltage to the headstage |
| Personal computer | Any | Computer with mulitiple high speed usb ports and a minimum of 6 Gb of ram | |
| Potassium Chloride | Sigma Aldrich | P3911 | Electrolyte solution of dissociated ions |
| Temperature input module | National Instruments | NI 9211 | Enables open and cold junction thermocouple measurements for the cDAQ chassis |
| Thermocouple | Omega | JMTSS-020U-6 | U-type thermocouple with a diameter of 0.02 inches and 6 inches in length |
| UV Curable Adhesive | Loctite | 19739 | Secures glass coverslip to aluminum base fixture |
| Voltage output module | National Instruments | NI 9263 | Analog voltage output module for use with the cDAQ chassis |
| Waveform generator | Agilent | 33210A | Used to output a 10 mV 10 Hz sinusoidal waveform |
Referanslar
- van Meer, G., de Kroon, A. I. P. M. Lipid map of the mammalian cell. Journal of Cell Science. 124 (1), 5-8 (2011).
- Bayley, H., et al. Droplet interface bilayers. Molecular BioSystems. 4 (12), 1191-1208 (2008).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130 (18), 5878-5879 (2008).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. Journal of the American Chemical Society. 129 (27), 8650-8655 (2007).
- Sarles, S. A., Leo, D. J. Physical encapsulation of droplet interface bilayers for durable, portable biomolecular networks. Lab on a Chip. 10 (6), 710-717 (2010).
- Stanley, C. E., et al. A microfluidic approach for high-throughput droplet interface bilayer (DIB) formation. Chemical Communications. 46 (10), 1620-1622 (2010).
- Gross, L. C. M., Heron, A. J., Baca, S. C., Wallace, M. I. Determining membrane capacitance by dynamic control of droplet interface bilayer area. Langmuir. 27 (23), 14335-14342 (2011).
- Huang, J., Lein, M., Gunderson, C., Holden, M. A. Direct quantitation of peptide-mediated protein transport across a droplet, interface bilayer. Journal of the American Chemical Society. 133 (40), 15818-15821 (2011).
- Leptihn, S., Thompson, J. R., Ellory, J. C., Tucker, S. J., Wallace, M. I. In vitro reconstitution of eukaryotic ion channels using droplet interface bilayers. Journal of the American Chemical Society. 133 (24), 9370-9375 (2011).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angewandte Chemie International Edition. 51 (13), 3134-3138 (2012).
- Dixit, S. S., Pincus, A., Guo, B., Faris, G. W. Droplet shape analysis and permeability studies in droplet lipid bilayers. Langmuir. 28 (19), 7442-7451 (2012).
- Elani, Y., deMello, A. J., Niu, X., Ces, O. Novel technologies for the formation of 2-D and 3-D droplet interface bilayer networks. Lab on a Chip. 12 (18), 3514-3520 (2012).
- Michalak, Z., Fartash, D., Haque, N., Lee, S. Tunable crystallization via osmosis-driven transport across a droplet interface bilayer. CrystEngComm. 14 (23), 7865-7868 (2012).
- Punnamaraju, S., You, H., Steckl, A. J. Triggered release of molecules across droplet interface bilayer lipid membranes using photopolymerizable lipids. Langmuir. 28 (20), 7657-7664 (2012).
- Boreyko, J. B., Mruetusatorn, P., Sarles, S. A., Retterer, S. T., Collier, C. P. Evaporation-induced buckling and fission of microscale droplet interface bilayers. Journal of the American Chemical Society. 135 (15), 5545-5548 (2013).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Villar, G., Graham, A. D., Bayley, H. A Tissue-like printed material. Science. 340 (6128), 48-52 (2013).
- Barriga, H. M. G., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. Journal of The Royal Society Interface. 11 (98), (2014).
- Boreyko, J. B., Polizos, G., Datskos, P. G., Sarles, S. A., Collier, C. P. Air-stable droplet interface bilayers on oil-infused surfaces. Proceedings of the National Academy of Sciences. 111 (21), 7588-7593 (2014).
- Mruetusatorn, P., et al. Dynamic morphologies of microscale droplet interface bilayers. Soft Matter. 10 (15), 2530-2538 (2014).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. The gating mechanism of mechanosensitive channels in droplet interface bilayers. MRS Proceedings. , 1755 (2015).
- Taylor, G. J., Venkatesan, G. A., Collier, C. P., Sarles, S. A. Direct in situ measurement of specific capacitance, monolayer tension, and bilayer tension in a droplet interface bilayer. Soft Matter. 11 (38), 7592-7605 (2015).
- Bayley, H., Cazimoglu, I., Hoskin, C. E. G. Synthetic tissues. Emerging Topics in Life Sciences. 3 (5), 615-622 (2019).
- Oliver, A. E., et al. Protecting, patterning, and scaffolding supported lipid membranes using carbohydrate glasses. Lab on a Chip. 8 (6), 892-897 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nature Nanotechnology. 4 (7), 437-440 (2009).
- Najem, J. S., et al. Activation of bacterial channel MscL in mechanically stimulated droplet interface bilayers. Scientific Reports. 5, 13726 (2015).
- Freeman, E. C., Najem, J. S., Sukharev, S., Philen, M. K., Leo, D. J. The mechanoelectrical response of droplet interface bilayer membranes. Soft Matter. 12 (12), 3021-3031 (2016).
- Tamaddoni, N., Sarles, S. A. Toward cell-inspired materials that feel: measurements and modeling of mechanotransduction in droplet-based, multi-membrane arrays. Bioinspiration & Biomimetics. 11 (3), 036008 (2016).
- Restrepo Schild, V., et al. Light-patterned current generation in a droplet bilayer array. Scientific Reports. 7, 46585 (2017).
- Milianta, P. J., Muzzio, M., Denver, J., Cawley, G., Lee, S. Water permeability across symmetric and asymmetric droplet interface bilayers: Interaction of cholesterol sulfate with DPhPC. Langmuir. 31 (44), 12187-12196 (2015).
- Mruetusatorn, P., et al. Control of membrane permeability in air-stable droplet interface bilayers. Langmuir. 31 (14), 4224-4231 (2015).
- Wauer, T., et al. Construction and manipulation of functional three-dimensional droplet networks. ACS Nano. 8 (1), 771-779 (2013).
- Bayley, H. Building blocks for cells and tissues: Beyond a game. Emerging Topics in Life Sciences. 3 (5), 433-434 (2019).
- Booth, M., Restrepo Schild, V., Downs, F., Bayley, J. Droplet network, from lipid bilayer to synthetic tissues. Encyclopedia of Biophysics. , (2019).
- Booth, M. J., Cazimoglu, I., Bayley, H. Controlled deprotection and release of a small molecule from a compartmented synthetic tissue module. Communications Chemistry. 2 (1), 142 (2019).
- Gobbo, P., et al. Programmed assembly of synthetic protocells into thermoresponsive prototissues. Nature Materials. 17 (12), 1145-1153 (2018).
- Taylor, G. J., Sarles, S. A. Heating-enabled formation of droplet interface bilayers using escherichia coli total lipid extract. Langmuir. 31 (1), 325-337 (2015).
- Taylor, G. J., et al. Capacitive detection of low-enthalpy, higher-order phase transitions in synthetic and natural composition lipid membranes. Langmuir. 33 (38), 10016-10026 (2017).
- Lee, S., Kim, D. H., Needham, D. Equilibrium and dynamic interfacial tension measurements at microscopic interfaces using a micropipet technique. 2. Dynamics of phospholipid monolayer formation and equilibrium tensions at the water-air interface. Langmuir. 17 (18), 5544-5550 (2001).
- Najem, J. S., et al. Assembly and characterization of biomolecular memristors consisting of ion channel-doped lipid membranes. Journal of Visualized Experiments. (145), e58998 (2019).
- Wang, Y. G., Shao, H. H. Optimal tuning for PI controller. Automatica. 36 (1), 147-152 (2000).
- Needham, D., Haydon, D. A. Tensions and free energies of formation of "solventless" lipid bilayers. Measurement of high contact angles. Biophysical Journal. 41 (3), 251-257 (1983).
- Sarles, S. A., Leo, D. J. Physical Encapsulation of Interface Bilayers for durable portable biolayer network. Lab on a Chip. 10 (6), 710-717 (2010).
- Muller, R. U., Peskin, C. S. The kinetics of monazomycin-induced voltage-dependent conductance. II. Theory and a demonstration of a form of memory. The Journal of General Physiology. 78 (2), 201-229 (1981).
- Nenninger, A., et al. Independent mobility of proteins and lipids in the plasma membrane of Escherichia coli. Molecular Microbiology. 92 (5), 1142-1153 (2014).
- Venkatesan, G. A., et al. Adsorption kinetics dictate monolayer self-assembly for both lipid-in and lipid-out approaches to droplet interface bilayer formation. Langmuir. 31 (47), 12883-12893 (2015).
- Najem, J. S., et al. Memristive ion channel-doped biomembranes as synaptic mimics. ACS Nano. 12 (5), 4702-4711 (2018).
- Tamaddoni, N., Taylor, G., Hepburn, T., Michael Kilbey, S., Sarles, S. A. Reversible, voltage-activated formation of biomimetic membranes between triblock copolymer-coated aqueous droplets in good solvents. Soft Matter. 12, 5096-5109 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır