Method Article
Biyofilm Malzeme Heterojenliğinin 3 boyutlu analizi için boncuk hareketine dayalı bir hesaplama çerçevesi
Bu Makalede
Özet
Heterojen bakteriyel biyofilmler yoluyla 1 μm karboksilat boncukların hareket modelini analiz etmek ve ölçmek için bir yöntem açıklıyoruz. Hareket modellerinin karşılaştırılması, biyofilmlerin malzeme özelliklerindeki farklılıkları ölçmek için kullanılabilir.
Özet
Bakteriyel biyofilmlerin malzeme özelliklerinde farklılıklar, farklı bakteri türlerinin biyofilmlerinde, aynı tür içinde farklı büyüme koşulları altında ve matris modifiye edici moleküllerle muamele edildikten sonra gözlenmiştir. 3D biyofilmlerin malzeme özelliklerini daha iyi ölçmek için, Enterococcus faecalis, Salmonella enterica serotype Typhimurium ve Escherichia coli biyofilmleri arasındaki farkları ve ayrıca amiloid curli'nin Enterobacteriaceae biyofilmlerine sertliği doğrulamadaki rolünü incelemek için deneysel ve hesaplamalı bir iş akışı geliştirildi ve uygulandı. Biyofilmlerdeki 1 μm karboksilat boncukların uzay-zamansal dinamikleri, 20 dakika boyunca 20 μm 3D biyofilmlerde izlendi. 4B görüntü yığınları, boncuk hareketinin 3B yörünge verilerini üretmek için ImageJ'deki Mosaic eklentisi kullanılarak işlendi. Bu yörünge verileri, yörünge ömürleri, boncuk hızları, yörüngeler boyunca hücre yoğunlukları ve sınırlayıcı kutu bilgileri dahil olmak üzere hareket verilerinin hesaplandığı ve csv dosyalarında saklandığı yeni geliştirilen bir Boncuk Değerlendirici araç kutusu ile analiz edildi. Bu makale, deney kurulumu ve görüntü kaydından boncuk yörüngesi hesaplama ve analizine kadar iş akışını sunmaktadır. Curli içeren biyofilmlerin yapısı, curli-mutant ve Enterokok biyofilmlerine göre daha kararlı boncuk etkileşimleri ve daha az boncuk hareketi ile sonuçlandı. Boncuk hareketi, boncuk hızı ve yörünge sınırlayıcı kutu hacmi ölçülürken hücre yoğunluğuna güçlü bir şekilde bağlı görünmedi, bu da biyofilmlerin diğer malzeme özelliklerinin boncuk dinamiklerini kontrol ettiği hipotezini destekledi. Bu teknik, farklı matris bileşimlerinin biyofilmlerindeki farklılıkların yanı sıra matris modifiye edici işlemlerden önce ve sonra biyofilmlerin nicelleştirilmesi için yaygın olarak uygulanabilir.
Giriş
Bakteriyel biyofilmler, insan mikrobiyotasının bir parçası olarak her yerde bulunur ve moleküllerle sürekli etkileşim halindedir. Bu moleküllerin boyutları 1 nm antibiyotik ve 1-3 mm bakteriden gastrointestinal sistemdeki daha büyük lif parçacıklarına kadar değişir. Tek veya çok türlü biyofilmlerin bileşimi, malzeme özelliklerini ve dolayısıyla parçacıkların biyofilmler 1,2,3,4,5 boyunca hareket modelini etkiler. Bir örnek, korunmuş, fibriller çapraz beta tabaka yapısına sahip olan bakteriyel amiloidlerdir6. Amiloid curli, Escherichia coli ve Salmonella enterica serotype Typhimurium gibi enterik bakteriler tarafından eksprese edilir ve genler diğer birçok bakteri filumundatespit edilmiştir 7. Biyofilmlerin çeşitli malzeme özellikleri curli 8,9'dan etkilenir. Curli, hücre dışı DNA (eDNA) ve selüloz10,11 gibi matrisin diğer bileşenleri ile doğrudan etkileşime girer. Curli hücreleri çevreler ve hücresel zar sertliğini12 ve biyofilmin13 genel viskoelastik özelliklerini etkiler. Curli, fibronektine bağlanarak artan gerilme mukavemetine aracılık eder, bu da güçlü cam yüzey bağlantısında bir artışa neden olur14. Gelen bakteriyofajlar kıvrılmaya bağlanır ve fajın biyofilmlere inozyonunu sınırlar15.
Kabaca 20 μm kalınlığında Enterococcus faecalis, E. coli ve S'yi analiz etmek için çok testli kaplanmış kuyu slaytları kullanıldığında. Konfokal mikroskopi kullanan Typhimurium biyofilmleri, E. coli, S. arasındaki açık farklar. Typhimurium10,16 ve E. faecalis biyofilmleri (mevcut çalışma) gözlenebilir. Enterobacteriaceae türü biyofilmler yüksek düzeyde sertliğe sahipken ve düşük hücresel yoğunluğa sahip alanların görüntülenmesi kolayken, çizgi ve çerçeve ortalaması kullanılarak E. faecalis biyofilmlerinin net yüksek çözünürlüklü resimlerinin elde edilmesi, görüntüleme işlemi sırasında hücre stabilitesi için yeterli yüzey gerilimini indüklemek için slayta basınç uygulanmasını gerektirdi. Curli gibi bakteriyel amiloidler, nispeten sert olabileceklerini düşündüren oldukça düzenli yapılar oluşturur17. Bu, amiloid curli'nin E. coli ve S'de sertliği indükleyebileceği hipotezini motive etti. Typhimurium biyofilmleri. E. faecalis'in incelenen koşullar altında amiloidleri eksprese ettiğine dair net bir kanıt yoktu. E. faecalis'in daha patojenik suşları ile ilişkili bir pilin geni olan protein Esp'in yakın zamanda amiloid yapıları ürettiği gösterilmiştir18; bununla birlikte, blastn ve blastp aramaları kullanılarak, bu çalışmalarda kullanılan E. faecalis kommensal tip suş OG1RF'de bu gen tespit edilmedi. OG1RF tarafından üretilen feromon cOB1, amiloid benzeri yapılaroluşturabilir 19. Bununla birlikte, verilen biyofilm büyüme koşulları ve daha önce S için kullanılan amiloid tespit yöntemleri ileE. faecalis'te Typhimurium amiloid boyama10, OG1RF amiloidleri tespit edilemedi (veriler gösterilmemiştir). S'nin amiloid mutantları kullanılarak amiloidin Enterobacteriaceae biyofilmlerine katkısını belirlemek için viskoz E. faecalis, E. coli ve S. Typhimurium arasındaki genel malzeme özelliklerini karşılaştırmak ve amiloidin Enterobacteriaceae biyofilmlerine katkısını belirlemek için yeni bir dört boyutlu (4D) görüntü tekniği geliştirilmiştir. Typhimurium ve E. coli.
Geçmişte, floresan boncuklar, mikroreoloji 20,21,22,23,24,25 kullanılarak biyofilmlerin malzeme özelliklerini iki boyutta (2D) analiz etmek için başarıyla kullanılmıştır. Bu, biyofilm26'da çeşitli derinliklerde 2D optik dilimleri inceleyerek üç boyutlu bir biyofilme uygulanabilir. Mevcut teknik, 4D modellemede kullanılmak üzere zaman içinde 1 μm mikro ölçekli boncukları 3D olarak izlemek için geliştirilmiştir. Gerekçenin bir kısmı, plazmitlerin gastrointestinal mikrobiyota toplulukları boyunca hareketini anlamak için 4D modelleme kullanmanın kapsayıcı konseptiydi. 1 μm çapında floresan yüklü karboksilat boncuklar kullanıldı, çünkü bunlar, boyut ve yük açısından, plazmit hareketi ve bakımı için seçilen model organizma olan E. faecalis'e iyi karşılık geliyor27, 28. Biyofilmlerin fiziksel özelliklerini ölçmek için bir 4D test geliştirilmiştir (Şekil 1A). Tasarlanan metodolojide, biyofilmlere boncuklar eklenmiş ve mekansal-zamansal yörüngeleri 10-20 dakika boyunca 10-20 μm kalınlığındaki biyofilmler aracılığıyla kaydedilmiştir. 3B'deki boncuk yörüngeleri daha sonra yeni geliştirilen bir araç kutusu kullanılarak yörünge uzunluğu, boncuk hızı, yörünge sınırlayıcı kutu hacmi (yörüngeyi içeren minimum kutu) ve sınırlayıcı kutu hücresel yoğunluğu açısından ölçüldü. Aşağıdaki protokol, biyofilm içeren bakteri ve boncukların 4D görüntü verilerini oluşturmak, verileri ImageJ29 ve Mosaic eklentisi ile önceden işlemek ve bir Boncuk Değerlendirici araç kutusu ile boncuk yörüngelerini analiz etmek için kullanılabilir.
Bu teknik, malzeme özelliklerini incelemenin yanı sıra parçacık ve bakteri hareketini üç boyutlu olarak izlemek için birden fazla uygulamaya sahiptir. Örneğin, bu tekniğin erken bir versiyonu, curli'ye karşı yönlendirilen monoklonal antikorların biyofilmlerin yapısal bütünlüğü üzerindeki etkisini karakterize etmek için kullanıldı16. Tam sürüm, biyofilm malzeme özelliklerinin daha ayrıntılı bir analizini sağlamak için birden fazla araca sahiptir ve monoklonal antikor tedavisinin biyofilmler üzerindeki etkilerini incelemek için kullanılmaya devam etmektedir. Biyofilmlerin malzeme yük özelliklerini ve parçacıkların farklı matris bileşimlerine sahip biyofilmler boyunca hareketini incelemek için farklı yüklere sahip parçacıklar kullanılabilir. Bu, akış altında olmayan biyofilmlerde gözlemlediğimiz boncukların hareketinden sorumlu malzeme özelliklerini ortaya çıkaran 2D mikroreolojiden elde edilen sonuçları karşılaştırmak için kullanılabilir. Bu teknik, farklı biyofilm bileşimine sahip bölgelere sahip karışık tür biyofilmlerinde de kullanılabilir. Biyofilmler, statik ve akış biyofilmleri arasındaki malzeme özelliklerindeki değişiklikleri ve akışın parçacıkların hareketi üzerindeki etkisini incelemek için mikroakışkan cihazlarda ve akış hücrelerinde akış altında canlı olarak görüntülenebilir. Teknikler, eksojen bakterilerin bir biyofilm topluluğu boyunca hareketini karakterize etmek için floresan etiketli bakterilere de uygulanabilir. Üç renk kullanılarak, floresan etiketli donör bakteriler, floresan etiketli alıcı bakteriler ve floresan etiketli plazmitler, plazmitlerin hareketini, yerleştirilmesini ve transferini izlemek için kullanılabilir.
Protokol
1. Biyofilm hazırlama
NOT: Analiz için biyofilmler, biyofilmin bir optik cam yüzey üzerinde oluşmasına izin veren herhangi bir yöntem kullanılarak büyütülebilir. Biyofilm yapısı, protokolün yıkama ve/veya montaj aşamaları sırasında yapının bozulmaması için optik yüzeye yeterince yapışmalıdır. Aşağıda, 24 oyuklu plakalarda 96 oyuklu optik alt plakalar ve 12 mm cam lameller için teknik açıklanmaktadır. Diğer seçenekler arasında farklı boyutlarda optik alt plakalar ve akışlı ve akışsız optik akış odaları bulunur.
- Biyofilm kurulumu
- Plakanın kuyucuklarına bakteri üreme ortamı ekleyin. Bu çalışma için, E. faecalis, 24 oyuklu bir plakaya 2 mL Todd-Hewitt (TH) ekleyin ve optik alt 96 oyuklu plakalara 0.4 mL TH ekleyin. S için. Typhimurium, E. coli ve izojenik csgAB curli mutantları, kuyucuklara 0.7 mL tuzsuz Luria Suyu (LB) ekler. Optik alt bölmeler kullanıyorsanız, Adım 1.2'ye geçin.
- 12 mm # 1.5 cam optik lameller bir Petri kabına yerleştirin ve üzerlerini etanol ile kaplayın.
- Forseps kullanarak, lamel çıkarın ve kalan alkolü ateşe vermek için bir alev kullanın. Alkolün yanmasına izin verin. Onları ateşe vermek için alevi kullanın; Lameli alevin içinde tutmayın çünkü çatlayacaktır. Çatlamayı önlemek için lameli kuyuya yerleştirmeden önce 10-20 saniye soğumaya bırakın.
- Lameli ortamın üzerine serilmesini önlemek için ortamı içeren kuyuya belirli bir açıyla yerleştirin. Lameli kuru bir kuyuya eklemeyin ve ardından orta ekleyin çünkü bu, lamelin kuyunun dibine yapışmasına neden olur.
- Lameli ortamı içeren kuyunun dibine dikkatlice itmek için steril bir pipet ucu kullanın.
NOT: Optik cam lamel veya optik alt plakanın kalınlığını (#1 veya #1.5) konfokal mikroskop optiğinin kalınlığıyla eşleştirmeyi unutmayın.
- Biyofilmi biyofilm büyümesi için uygun koşullar altında inkübe edin. Bu çalışmalarda, E. faecalis biyofilmlerini 37 °C'de statik kültürler halinde büyütülür ve E. coli biyofilmleri aerobik olarak 30 °C'de büyütülür.
- Bu çalışmalarda, E. faecalis biyofilmlerini sabah ve akşam erken saatlerde orta geçişlerle 2 gün boyunca büyütün. Biyofilmin zarar görmesini veya yerinden çıkmasını önlemek için plakayı dikkatlice eğin. Pipet ucunu kuyunun alt kenarına yakın bir yere yerleştirin ve ortamı yavaşça dışarı çekin. İlk mL taze ortamı da aynı şekilde ekleyin. İkinci mL'yi orta/kuyu arayüzünün yakınına yavaşça ekleyin.
- Bu çalışmalarda, optimum kıvırcık üretimi için büyüme koşullarını kullanın. Büyümek S. Typhimurium biyofilmleri, 6-8 gün boyunca 28 ° C'de, biyofilmin slaytın yaklaşık 2 / 3'ü kadar yapışmasına ve daha sonra hava-sıvı arayüzü üzerinde bir pelikül olarak büyümesine izin veren bir eğim üzerinde inkübe edildi. Bu, orta düzeyde bir değişiklik olmadan yapıldı. Ortamın kurumasını önlemek için, 24 oyuklu plakayı su tavası olan bir odaya yerleştirin.
2. 4D görüntüleme
- Biyofilm montajının hazırlanması
- Crimson 1 μm karboksilat FluoSpheres boncuklarını PBS'de 1:50 oranında seyreltin (1 mL PBS'de 2 x10 7 boncuk). Optik alt bölmeler kullanılıyorsa, 1 μL ila 300 μL boncuk hazırlığı seyreltmesinde Syto9 ekleyin.
- (isteğe bağlı) Büyüme ortamının otofloresan özelliği varsa, büyüme ortamının izlerini gidermek için biyofilmi yıkayın. Bu deneylerde, 1 mL PBS ile iki kez yıkayın, plakayı dikkatlice eğin, pipet ucunu kuyunun alt kenarına yakın bir yere yerleştirin ve ortamı yavaşça dışarı çekin. Ucu alt kenara yakın bir yere yerleştirerek PBS'yi ekleyin ve kuyuyu yavaşça doldurun. Bu tekniği, 24 oyuklu bir plakadaki lamellere ek olarak optik dip kuyularında kullanın.
- Ortamı veya PBS'yi çıkarın. 2.1.1'de hazırlanan seyreltilmiş Crimson boncukları biyofilme ekleyin. Bu çalışmalarda, lamellere 1 mL boncuk (2x107) ve 96 oyuklu optik alt plakalara 0.2 mL boncuk (4x106) ve Syto9 ekleyin.
- Boncuk birleşmesine izin vermek için oda sıcaklığında 1 dakika inkübe edin.
- Boncukları çıkarın ve ilişkilendirilmemiş boncukları çıkarmak için biyofilmi PBS ile bir kez nazikçe yıkayın. Bu çalışmalarda, lamel için 1 mL PBS ile nazikçe yıkayın, kuyuyu 1 mL PBS ile doldurun ve 2.1.6'ya geçin. 96 oyuklu optik alt plakalar için, biyofilmi 0,2 mL PBS ile nazikçe yıkayın ve kuyuyu 0,2 mL PBS ile yeniden doldurun. Optik alt bölme artık görüntülenmeye hazırdır, bu nedenle adım 2.2'ye geçin.
- (Lamel kullanılıyorsa) 1 μL Syto9 (yeşil floresan DNA boyası; üreticinin talimatlarına göre seyreltilmiş) kaplanmış 10 oyuklu çok testli bir slaytta bir kuyunun ortasına ekleyin. Bu kaplamalı lameller 23-25 μm kuyu derinliklerine sahiptir.
- (Lamel kullanılıyorsa) Alkol alevi ile sterilize edilmiş forseps kullanarak, lameli kuyudan dikkatlice çıkarın ve Syto9 damlasını içeren kuyuya ters çevirin. Lamelin 1 mL PBS'de bırakılması, kuyudan çıkarılmasını kolaylaştırır ve ilişkili olmayan boncukların biyofilmden yıkanmasına yardımcı olur.
- (Lamel kullanılıyorsa) Lameli kaydırmadan veya aşağı bastırmadan lameli parmak-oje ile dikkatlice kapatın, bu da daha viskoz, daha az sert biyofilmlerde hareketi durduracak yüzey gerilimine neden olabilir.
- (Lamel kullanılıyorsa) Oje kurumasını bekleyin. Lamelin dış yüzeyini %70 etanol ile dikkatlice silin. Yukarıda belirtilen nedenlerden dolayı lamel üzerine herhangi bir baskı uygulamadan siliniz.
- Konfokal görüntüleme
NOT: Bu çalışmalarda, 63x objektifli bir TCS konfokal sistemi ile donatılmış ters spektral görüntüleme lazer taramalı konfokal mikroskop kullanın. Kapsam, bir 4D video oluşturmak için kullanılacaktır (Şekil 1). 3D biyofilm, 18-20 μm kalınlığındaki biyofilmler aracılığıyla 0,5 μm'lik adımlarla yakalanan ve 36-40 Z dilimi oluşturan Z dilimlerinden oluşacaktır. Her 3D biyofilmin yakalanması 50-60 saniye sürecektir. Dilimler birlikte 3D biyofilm olarak görselleştirilebilen bir çerçeve oluşturacaktır. Bu işlem, toplam 20-4 dakikalık bir izleme süresi için 18D hızlandırılmış videoyu oluşturmak için 20 kez tekrarlanacaktır.- Floroforları yakalamak için kapsamı ayarlayın. Bu çalışmalarda, Syto9'u (bakteriyel DNA boyama) 488 nm lazerle uyarın ve 495 ila 540 nm arasındaki emisyonu ölçün (Leica Sp5 bir spektral görüntüleme mikroskobudur). 633 nm lazerle koyu kırmızı (kırmızı) boncukları uyarın ve 650 nm ile 700 nm arasındaki emisyonu ölçün. Bu florofor ayarları, istenen herhangi bir floroforu yakalamak için ayarlanabilir.
- xyzt görüntüleme modunu seçin.
- Biyofilmin kalın ve ince bölgelerindeki viskoelastik özelliklerdeki farklılıkları yakalamak için daha yüksek ve daha düşük yoğunluklu bölgelerin bir karışımı ile biyofilmin bir bölgesini tanımlayın.
- 18-20 μm kalınlığında bir Z yığını ayarlayın. Lamel monteli bir biyofilmde, boncuk sıkışma artefaktlarını önlemek için biyofilmin en üst ve en alt kısımlarının cama temas etmesini önleyin (lütfen tartışmaya bakın).
- Biyofilmin en parlak noktasındaki yoğunluğun tüm dinamik aralığını kullanmak için kazancı ve ofseti ayarlayın. Bu, biyofilmin alt katmanlarından gelen sinyal örtüşmesini en aza indirir.
- Dilim kalınlığını 0,5 μm olarak ayarlayın. Bu, boncuk bilgisi kaybı olmadan hızlı görüntülemeye izin verir.
- Çözünürlüğü 512 x 512 (0,48 μm) olarak ayarlayın. Bu, hızlı görüntülemeye izin verirken, biyofilm yapısını ve boncuk hareketi ayrıntılarını görmek için yeterli çözünürlüğe sahip görüntüler üretir.
- Görüntüleme süresini en aza indirin.
- 20 yığın yakalayacak şekilde ayarlayın.
- .lif (veya benzer bir konfokal dosya) olarak kaydedin. 4D film ImageJ'de oluşturulabilir.
3. ImageJ ile 4D biyofilm videosu oluşturma
- .lif dosyasını ImageJ'de aşağıdaki ayarlarla açın: Hyperstack ile yığını görüntüle, Yığın sırası XYCZT, renk modu: renklendirilmiş, otomatik ölçeklendirme işaretli. Ardından Tamam'a basın.
- Kanalları Böl > Görüntü > Renk'i seçin.
- Görüntü > Renk'i seçin > Kanalları Birleştir'> Bileşik Oluştur'> Tamam'a tıklayın.
- 3D görüntüleyici > Eklentiler'i seçin > Kanallar mavi işaretini kaldırın > Tamam'ı seçin.
- Düzenle > İçeriği işaretli göster'i seçin > Sınırlayıcı kutuyu göster seçeneğini belirleyin.
- Görüntüyü seçmek için fare tıklamasını ve basılı tutmasını kullanın. Ardından, tıklama düğmesini basılı tutmaya devam ederken görüntüyü döndürün. Görüntüyü, biyofilmin alt kısmı altta olacak ve açı boncukları görselleştirmeyi destekleyecek şekilde döndürün. Ardından görüntüyü serbest bırakın.
- Video kaydetmek için pencerenin altındaki kırmızı Kayıt düğmesine basın.
- Sıkıştırma olarak jpeg kullanarak .avi dosyası olarak kaydedin.
4. Yörünge verilerinin oluşturulması
- Açık kaynaklı araç ImageJ'yi (https://imagej.net/Fiji) ve parçacık izleme eklentisi Mosaic'i (https://imagej.net/MOSAICsuite) yükleyin.
- Boncuklar ve bakteriler için iki kanalı içeren .lif dosyasını içe aktarın. Kanalları bölün ve dosyaları ayrı ayrı kaydedin.
- ImageJ'de, görüntü voksel boyutunu (x, y ve z boyutları) ve zaman adımı boyutunu bir metin dosyasında saklayın.
- ImageJ'de Eklentiler | Particle Tracker 2D/3D'yi mozaikleyin ve başlatın.
- Aşağıdaki parametreleri girin: Yarıçap: 3, Kesme: 0.003, Başına/Abs: 0.12, Bağlantı Aralığı: 2, Yer Değiştirme: 10.00 ve dinamikler Brownian'da ayarlanmıştır. Bu deneylerde Brownian seçiminin ardındaki mantık için lütfen sonuçlara bakın.
- Yörüngeler oluşturun ve yörünge listesini .csv dosyaları olarak dışa aktarın.
5. Yörüngeleri analiz etmek
- VRL Studio'yu yükleyin (https://vrl-studio.mihosoft.eu)
- Biyofilm projesini (https:// neurobox3d.github.io/Biofilm/) indirin ve VRL Studio'da başlatın
- Yörünge dosyasını ImportData'ya yükleyin
- ProcessTrajectories'de x, y ve z piksel boyutunu belirtin (bu değerleri bulmak için ImageJ'yi kullanın).
- ComputeVelocity'de kare aralığını belirtin (bu değeri bulmak için ImageJ'yi kullanın).
- Bakteriyel tiff dosyasını (bkz. adım 3.2) Comdensity'ye yükleyin.
- SaveVelocityDataToFile'daki hız verileri için çıkış yollarını ve SaveTrajectoryDataToFile'daki yörünge verileri için çıkış yollarını ayarlayın.
- SaveVelocityDataToFile ve SaveTrajectoryDataToFile'ı çağırın.
- Analiz için verileri Excel'e aktarın. Bu veriler, yörünge uzunluklarını, yörünge ömürlerini, yörünge sınırlayıcı kutu boyutlarını ve hacimlerini, ortalama boncuk hızlarını ve varyanslarını içerecektir. Analiz, yerel (verilen yörünge sınırlayıcı kutular içinde) hücresel yoğunlukları hesaplamak için Syto9 etiketli bakteriler için kanalı kullanarak ağırlıklı değişkenleri hesaplar. Analiz, ağırlıklı ortalama hızların ve varyansların yanı sıra sınırlayıcı kutu varyansının ağırlıklı ortalamaları ve varyanslarının hesaplanmasıyla sonuçlanır.
Sonuçlar
Bu yöntem, curli'nin E. coli ve S'ye sertlik kazandırabileceği hipotezini test etmek için kullanıldı. Typhimurium biyofilmleri, konfokal mikroskopi deneyleri sırasında boncuk hareketini azaltır. Mevcut araç kutusu, Enterococcus faecalis kommensal tip OG1RF'nin malzeme özelliklerini Salmonella enterica serotipi Typhimurium, E. coli ve bunların ilgili izojenik curli mutantlarına karşılaştırmak için kullanıldı (Şekil 1B ve Ek Video 1, Ek Video 2, Ek Video 3, Ek Video 4, Ek Video 5, Ek Video 6). Biyofilm malzeme özellikleri, negatif yüklü boncuklar ile biyofilm hücreleri ve matris malzemeleri ile hücresel yoğunluk arasındaki sertlik (örneğin, eDNA'ya bağlı kıvrılma) veya elektrostatik ve hidrofobik etkileşimler açısından potansiyel olarak farklılık gösterebilir.
Tekrarlanabilirlik
Biofilm araç kutusu,VRL-Studio 32 içinde Groovy 30 ve Java31'de programlandı ve tüm hesaplama bileşenlerinin otomatik Kullanıcı Arayüzü (UI) oluşturulmasıyla modüler bir iş akışı tasarımı sağladı. Bu, sonuçları analiz ederken kasıtsız deneyci kaynaklı önyargıyı ortadan kaldırarak otomatik bir iş akışına izin verdi.
Biyofilmlerdeki hareket tipini doğrulamak için MSD kullanımı
Particle Tracker 2D/3D kullanarak yörüngelerin analizi için, farklı boncuk hareketi türlerinin analizi için farklı dinamik ayarları mevcuttur. Bu çalışmalar için, E. faecalis hareketsiz bir bakteri olduğundan, E. coli ve Salmonella'nın biyofilmlerde flagella eksprese etmediğinden "Brown hareketi" (yani difüzyon güdümlü hareket) ayarı seçildi ve deneyler akış yokluğunda kapalı bir sistemde gerçekleştirildi. Bu ayar, boncukların hesaplanan ortalama kare yer değiştirmeleri (MSD) ile daha fazla doğrulanabilir. m'nin yörünge segmentlerinin sayısı olduğu tanımı 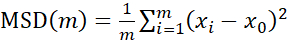 kullanarak, MSD'nin her yörünge boyunca değişimi hesaplanabilir. Doğrusal yörüngeler, dağınık boncuk hareketini gösterir (Şekil 2A). İkinci dereceden en küçük kareler uydurma kullanılarak, biyofilmdeki tüm boncukların ortalama hareket modeli hesaplandı, baskın doğrusal düzen gösterildi ve itici kuvvet olarak pasif difüzyon doğrulandı (Şekil 2A-2F).
kullanarak, MSD'nin her yörünge boyunca değişimi hesaplanabilir. Doğrusal yörüngeler, dağınık boncuk hareketini gösterir (Şekil 2A). İkinci dereceden en küçük kareler uydurma kullanılarak, biyofilmdeki tüm boncukların ortalama hareket modeli hesaplandı, baskın doğrusal düzen gösterildi ve itici kuvvet olarak pasif difüzyon doğrulandı (Şekil 2A-2F).
Sınırlayıcı kutu analizi.
Araç kutusu, yörüngeler oluşturmak için ImageJ Mosaic ve Particle Tracker 2D/3D'yi kullanır (Adım 4) ve ardından otomatik Biyofilm analiz boru hattını kullanarak, biyofilm malzeme özelliklerini karşılaştırmak için kullanılabilecek boncuk yörüngeleri hakkında önemli veriler üretir. μm3 cinsinden sınırlayıcı kutu hacmi, bir yörünge içeren minimum kutu oluşturularak ve hacmi ölçülerek ölçülmüştür (Şekil 3).
E. faecalis biyofilmleri , 1-6000μm3 sınırlayıcı kutu değerleri ile daha fazla boncuk hareketine sahiptir (Şekil 3B, 3C ve 3D). Sonuçlar, yaklaşık 25 μm'lik kaplanmış bir kuyucuk ile kaplanmış bir lamel üzerine monte edilmiş bir cam lamel (Şekil 3C) ile optik cam kuyucukların dibinde büyütülen ve doğrudan görüntülenen (Şekil 3D) biyofilmlere karşı görülen hareketin, birkaç farkla eşdeğer sonuçlar verdiğini doğrulamaktadır. Tek fark, E. faecalis biyofilmlerinin monte edilmiş lamel tepesine yakın bir yerde, 10 dakikadan daha uzun ömürlere sahip kararlı yörüngeler, ancak aynı zamanda küçük sınırlayıcı kutular kaydedilebildi, oysa optik alt plakada daha yüksek hareketliliğe sahip belirli sayıda boncuk kaydedilebildi. Birlikte ele alındığında, bu, cam sürgünün monte edilmesinin, sistemin biyofilmin tepesindeki yüzey gerilimini monte edilmiş lamel biyofilmindeki kızağa karşı değiştirmiş olabileceğini ve bunun da sonuçta daha az viskoz biyofilm bölgelerindeki bazı boncukların hareketliliğini azaltmış olabileceğini düşündürmektedir (Şekil 3B, 3C, 3D ve 3I). Bu kategoriye giren yörüngeler çok küçük bir yüzdeydi ve bu az sayıda sıkışmış boncukla bile, monte edilmiş bir lamel üzerindeki E. faecalis'in ortalama MSD'si, bir optik alt plaka biyofilminden hesaplanan MSD'den biraz daha yüksekti (Şekil 3).
S. Typhimurium ve E. coli boncuk yörüngeleri, E. coli için 1-6000 μm3 ve S için 1-5000 μm3 sınırlayıcı kutulara sahip izojenik kıvrılma mutantlarına kıyasla 0-10μm3'lük daha küçük sınırlayıcı kutu hacimlerine sahipti (Şekil 3A, 3B, 3E ve 3F). Typhimurium (Şekil 3A, 3B, 3F ve 3H), daha büyük boncuk hareketliliğini gösterir. Bu sonuçlar, amiloidin varlığının biyofilmlerde artan sertlik ile ilişkili olduğunu ve videolarda kayda değer biyofilm hareketinin eksikliği ile tutarlı olduğunu göstermiştir. Sınırlayıcı kutu hacimleri, biyofilmin düşük yoğunluklu bölgelerinde bile sürekli olarak küçüktü (0-10μm3). Bu gözlem, curli'nin biyofilm10'un düşük hücre yoğunluğu bölgelerinde bulunabileceğine dair önceki gözlemlerle tutarlıdır.
Enterobacteriaceae biyofilmlerinin optik alt plakalar üzerindeki davranışını karşılaştırmak mümkün değildi çünkü bunlar hava-sıvı arayüzünde peliküller olarak büyürler (Adım 1.2.2). Bir lamel kullanılırken, pelikül arayüzde lamele bağlanır ve lamel çıkarıldığında, pelikül lamel üzerine serilir ve tek bir görüntü yüzeyi oluşturur. Eğimli bir şekilde büyütülmüş bir optik alt plakada, hala kuyuda sıvı varken görüntüleme yapıldı. Bu, pelikülün hala optik tabanın üzerinde yüzdüğü ve pelikülü Leica Sp5 gibi ters çevrilmiş bir dürbünün çalışma derinliğinden çıkardığı anlamına gelir. Biyofilmi mikroskobun çalışma derinliğine getirmek için yeterli ortamın çıkarılması, numunenin 20 dakikalık görüntüleme işlemi boyunca kurumasına neden oldu.
Genel olarak, çizimler ek filmlerdeki görsel gözlemleri doğrulamaktadır ve gözlemlenen MSD farklılıklarıyla tutarlıdır (Şekil 3I ve 3J).
Yörünge ömürleri
Yörünge ömrü, bir boncuğun kaydedildiği ardışık çerçevelerin sayısı olarak ölçüldü (Şekil 3).
Daha viskoz, sıvı benzeri E. faecalis biyofilmlerinde, tüm boncukların yörünge ömrü 10 dakikadan daha kısaydı ve yörüngelerin çoğu E. faecalis biyofilmleri için 2-5 dakika arasında değişiyordu. Bununla birlikte, kayıtlı kısa yörünge ömrüne sahip boncuklar, toplam görüntüleme zaman penceresi boyunca E. faecalis biyofilmlerinde görsel inceleme ile bulunabilir (Ek Video 1 ve 2). Bu nedenle, boncukların kayıtlı bir yörünge boyunca hareket etmesi, biyofilmden aralıklı olarak ayrılması ve bir yörüngeyi sonlandırması ve biyofilm ile yeniden birleşmesi mümkündür, bu noktada yeni bir yörünge başlatılır. Bu sonuçta, biyofilmde boncukların sürekli varlığı altında kısa yörünge ömürlerine yol açacaktır. Bu tekniği kullanarak, özellikle viskoz bir biyofilmde yörünge ömürlerinin, bir boncuğun biyofilm ile ilişkili olduğu toplam süreyi hafife alma eğiliminde olduğuna dikkat etmek önemlidir.
S'de. Daha küçük sınırlayıcı kutu hacimlerine sahip olan Typhimurium biyofilmleri, boncukların çoğunluğu (yaklaşık% 80), kabaca 15-20 dakikalık gerçek zamanlıya karşılık gelen 16-20 karelik uzun yörünge ömrüne sahipti (Şekil 3A, 3G ve 3H). Bunların aksine, izojenik curli mutant biyofilmler, 1-6000 μm3 (E. coli) ile 1-5000μm3 (S) arasında değişen sınırlayıcı kutu hacimlerine sahip daha fazla hareketli boncuk taşıdı. Typhimurium) (Şekil 3A, 3B, 3F ve 3H). Bununla birlikte, 10μm3'ten daha büyük sınırlayıcı kutu hacimlerine sahip %>70 yörüngeye sahip E. faecalis biyofilmlerinin aksine, Enterobacteriaceae türü biyofilmler, 10μm3'ün üzerinde sınırlayıcı kutu hacimlerine sahip yalnızca %30 boncuk yörüngeleri kaydetmiştir. Kıvrık mutant biyofilmlerde genel boncuk yörünge ömürleri daha küçük olmasına rağmen, bazı yörüngeler önemli boncuk hareketini ve uzun yörünge ömürlerini yansıtıyordu (Şekil 3H). Bu gözlem, bu değişkenliğin, viskoelastisite gibi değişen biyofilm malzeme özelliklerine ve/veya yük gibi parçacık yüzey kimyası değişikliklerine karşılık gelebileceğini gösterebilir.
Boncuk yörünge uzunlukları ve hızlarının analizi
Yörünge uzunluğu, boncukların μm cinsinden kat ettiği mesafenin bir ölçüsüdür. Bu ölçüm, μm/s cinsinden boncuk hareketinin hızı ile tutarlıdır. Daha büyük sınırlayıcı kutu hacimleriyle tutarlı olarak, E. faecalis biyofilmlerindeki boncuklar, kıvrık içeren biyofilmlerde <4 μm'ye kıyasla, 5-20 μm olmak üzere 10 kat daha uzun yörüngelere sahipti. Daha kısa yörüngelerle tutarlı (Şekil 4A). E. faecalis boncukları, 15 kata kadar daha yüksek hızlarda ölçülmüştür ve boncukların çoğunluğu 0.01-0.15 μm/s aralığında hızlara karşı <0.006 μm/s) hızlara sahiptir (Şekil 4B). Bununla birlikte, curli mutant biyofilmleri, E. faecalis biyofilmlerine kıyasla genel olarak daha düşük hızları ve daha kısa yörüngeleri ölçtü, ancak curli içeren ebeveyn suşlarından daha uzun yörüngeler ve daha yüksek hızlar ölçtü (Şekil 4A ve 4B).
Curli30'un fibriller kafes benzeri yapısının, hareketliliği anizotropik bir şekilde etkileyebilmesi, xy düzlemindeki hareketi azaltabilmesi ve z yönünde hareketliliğin artmasına izin vermesidir (Şekil 2G). Kıvrım içeren biyofilmlerde yaklaşık 50 benzersiz boncuka ait büyük yörünge havuzu (yaklaşık 800), bu hızlı hareket eden boncukların her birini x, y ve z'de tek bir boncuk olarak sayarak, Mozaik Parçacık İzleme'nin sınırlamaları ile tutarlı olacaktır. Bu gözlemi doğrulamak için ek araştırma ve yazılım geliştirme gerekli olacaktır.
Hücresel yoğunluğa boncuk hareketi bağımlılığının analizi
Boncuk hareketinin hücresel yoğunluğa bağımlılığı, ağırlıklı ortalama hızlar ve varyansların yanı sıra ortalamalar/ağırlıklı ortalamalar ve sınırlayıcı kutu hacimlerinin varyansları kullanılarak belirlendi. Syto9 etiketli bakteriler için ikinci görüntüleme kanalı, ağırlıklı hızların hesaplanmasında yerel hücresel yoğunlukları hesaplamak için kullanıldı. Hücresel yoğunluk, her bir yörünge kenarının sınırlayıcı kutusu üzerinde Syto9 voksel verilerinin ortalaması alınarak hesaplandı (Şekil 5, sağda). Böylece, boncuk hızı, kenar bazında (yerel) hücre yoğunlukları ile ağırlıklandırılabilir. Hücre duvarı, zarlar ve DNA içeriği için lekeler dahil olmak üzere bakterileri görselleştirmek için kullanılabilecek çok sayıda leke türü vardır. Hücresel yoğunluğu belirlemek için Syto9 seçildi çünkü hangi optik Z dilimi görselleştirilirse görselleştirilsin en tutarlı sinyali veriyor. Zarf lekeleri (hücre duvarı ve zarı), Z diliminin konumuna bağlı olarak farklı bir sinyal verecektir. Z dilimi hücrenin üstünü veya altını içeriyorsa, sinyal, Z diliminin hücrenin ortasından geçtiği ve hücrenin yalnızca ana hatlarının lekelendiği durumdan daha güçlü olacaktır.
Kırmızı kanaldan gelen boncuk yörüngeleri 20 kare için izlendi, burada bireysel yörüngeler minimum 2 kare ve çerçeveleri birbirine bağlayan 19 yörünge segmenti ile maksimum 20 kare ömre sahipti (Şekil 5). Boncuk hareketliliğinin hücre yoğunluğu bağımlılığını incelemek için, voksel başına GFP yoğunluğu (512x512 voksel görüntüsündeki bireysel ölçümlerin her biri) belirlendi. Boncuk yörüngesinin her bir segmenti etrafındaki hücre yoğunluğu, segmentin sınırlayıcı kutusundaki yerel olarak ortalama yoğunluk olarak hesaplandı.
Bazı biyofilmler için, istatistiksel olarak anlamlı yoğunluk bağımlılığı belgelenebilir (Şekil 6), en belirgin şekilde bir cam lamel üzerinde büyütülen ve çok kuyulu bir lam üzerine ters çevrilen E. faecalis biyofilmleri için (Şekil 6A). Aksine, 96 oyuklu bir plakanın dibinde büyütülen E. faecalis biyofilmleri (Şekil 6B) yoğunluk bağımlılığı göstermedi. Sonuç olarak, bu, yüksek derecede akışkan E. faecalis biyofilmlerinin, çok kuyulu bir lam üzerine montaj nedeniyle potansiyel olarak hafifçe sıkıştırılabileceğini düşündürmektedir, bu da daha hızlı hareket eden boncukların sayısındaki azalma ve biyofilmin tepesinde cam slayta karşı sıkışmış küçük sınırlayıcı kutu hacimlerine sahip olanlar ile tutarlıdır (Şekil 3C'ye karşı Şekil 3D). Hem Salmonella hem de E. coli biyofilmleri (Şekil 6C ve 6D) ve bunların izojenik mutantları (Şekil 6E ve 6F) çok az hücresel yoğunluk bağımlılığı gösterdi veya hiç göstermedi.
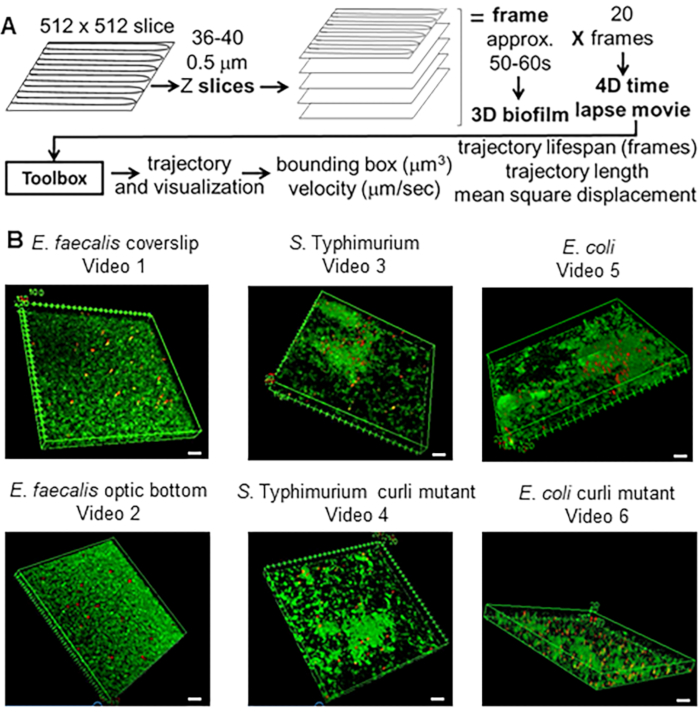
Şekil 1. Görüntüleme ve analiz hattı (adım 2-4) (A) Biyofilmler 2.2'de belirtildiği gibi görüntülenir. Görüntülenen biyofilmler kullanılarak (bkz. 3) 4'te tarif edildiği gibi boncuk yörüngeleri oluşturulmuştur. Yörüngeler kullanılarak ilgili veriler analiz araç kutusu ile hesaplanmıştır (bkz. 5) (B) Biyofilmler, lameller (E. faecalis, Video 1), S. Typhimurium (Video 3), E. coli (Video 5) ve izojenik kıvrılma mutantları (Video 4, Video 6) veya optik dip 96 oyuklu plakada (E. faecalis alt, Video 2). Beyaz ölçek çubuğu 20 mm'dir. Bu rakam (31)'den izin alınarak çoğaltılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
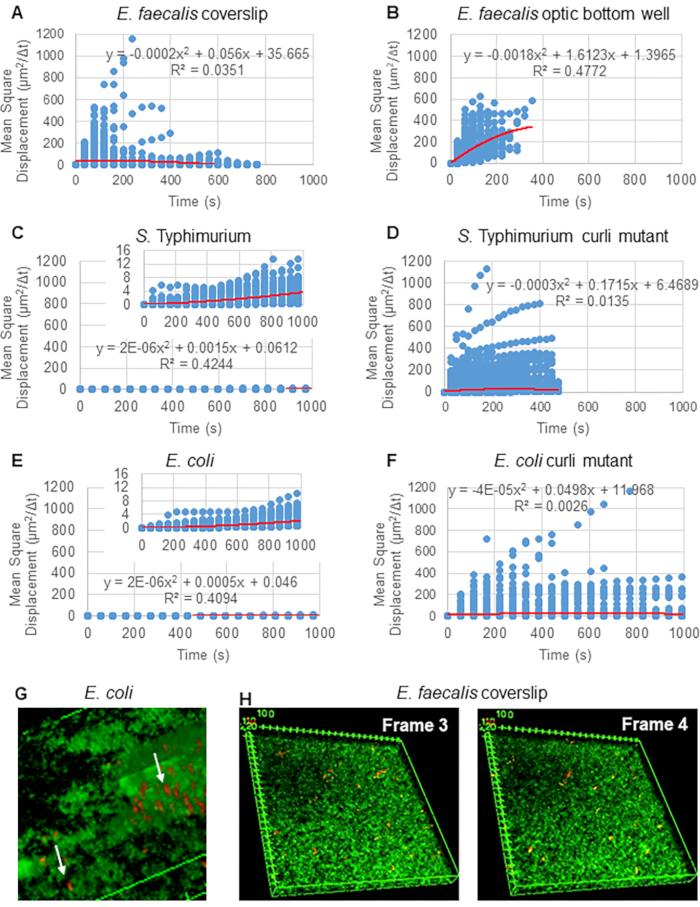
Şekil 2. Biyofilmlerdeki boncuk hareketinin doğası gereği dağınık olduğu belirlenmiştir (Brown hareketi, bkz. adım 5) (AF) MSD verileri, Brown hareketini doğrulamak için doğrusal davranış (kırmızı çizgi) gösterir. Biyofilmler adım 1'e göre büyütüldü (G) E . coli ve S. Typhimurium'da gözlenen eliptik boncuk hareketi örneği E. coli 4D biyofilm testinin bir çerçevesinden alınan biyofilmler (H) E . faecalis optik dip kuyusundan alınan çerçeve 3 ve 4 arasındaki boncuk desenlerindeki büyük değişiklikler örneği. Biyofilmin kendisinin bir miktar akış ortaya çıkardığına dikkat edin (Video 1 ve 2), bu da kare 3 ve 4'ün farklı şekilde yönlendirilmiş gibi görünmesini sağlar. Bu rakam (31)'den izin alınarak çoğaltılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
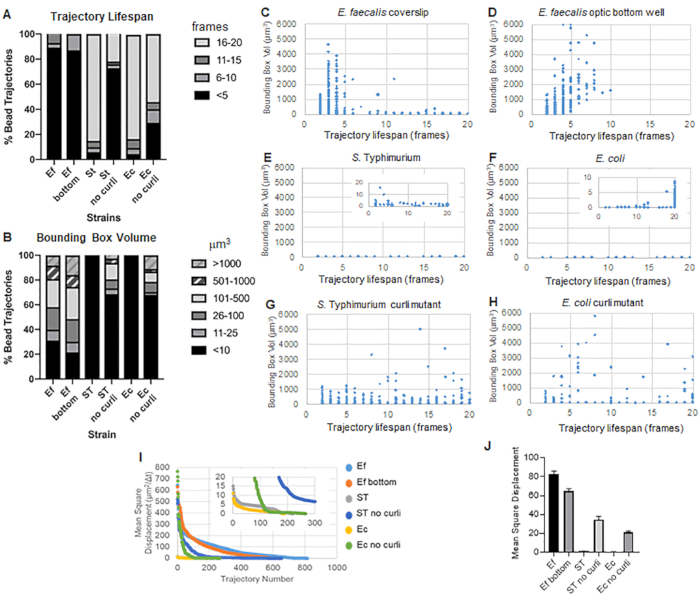
Şekil 3. Sınırlayıcı kutular ve yörünge ömürleri kullanılarak rijitlik farklarının analizi. Biyofilmler, lameller (E. faecalis, Video 1), S üzerinde adım 1'de anlatıldığı gibi büyütüldü . Typhimurium (Video 3), E. coli (Video 5) ve izojenik kıvrılma mutantları (Video 4, Video 6) veya optik dip 96 oyuklu plakada (E. faecalis alt, Video 2). Yörünge ömürleri, sınırlayıcı kutu hacimleri (5. adımda hesaplanmıştır) ile birlikte toplam boncuk yörüngelerinin (A) ve saçılma grafiklerinin (C-H) %'si olarak sunulur (I) Farklı biyofilmlerdeki boncuk MSD'lerinin karşılaştırılması (H) Her biyofilm türünün ortalama MSD'leri. Çubuklar, verilerin %95 güven aralığını gösterir. Bu rakam (31)'den izin alınarak çoğaltılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
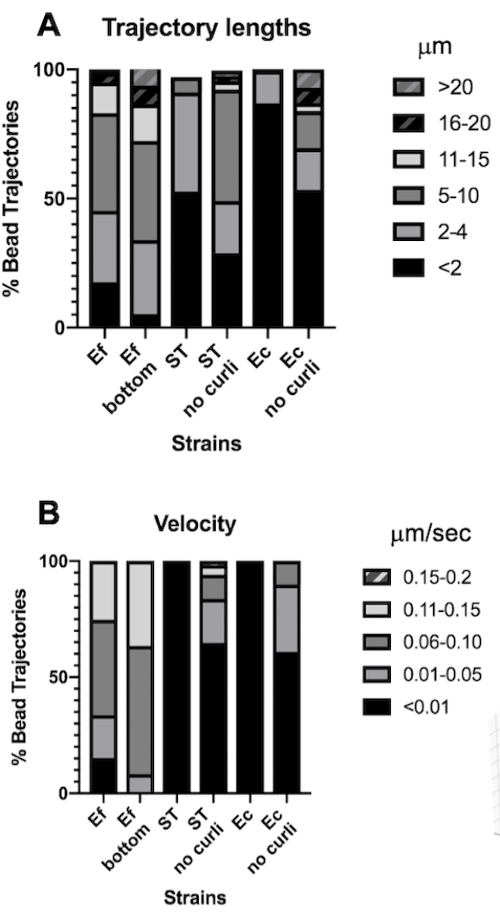
Şekil 4. Yörünge uzunluğu ve boncuk hızındaki farklılıkların analizi. Biyofilmler adım 1'de tarif edildiği gibi büyütüldü. Yörünge uzunlukları μm cinsinden gösterilir ve toplam boncuk yörüngelerinin (A) %'si olarak sunulur. Hız μm/s cinsinden gösterilir ve toplam boncuk yörüngelerinin (B) %'si olarak sunulur. Bu rakam (31)'den izin alınarak uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
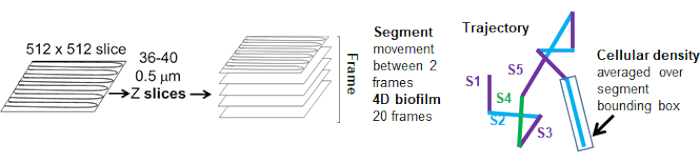
Şekil 5. Yörünge segmenti analizinin ana hatları. Bu rakam (31)'den izin alınarak uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
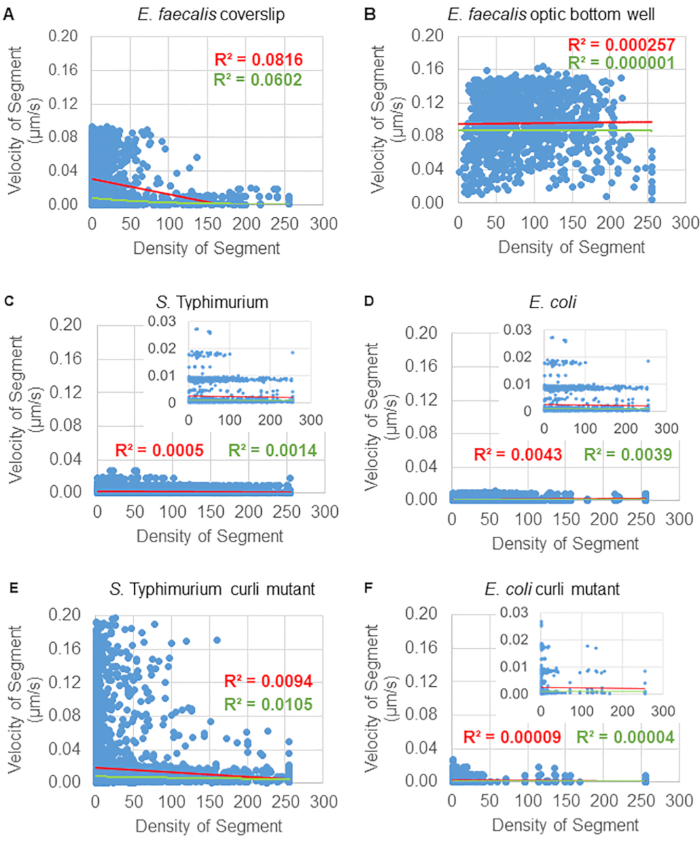
Şekil 6. Biyofilm analiz boru hattı kullanılarak biyofilm yoğunluğunun boncuk hızı üzerindeki etkisinin incelenmesi (adım 5). Sonuçlar, boncuk hızının yalnızca hücre yoğunluğuna bağlı olmadığını gösterdi. Biyofilmler adım 1'de tarif edildiği gibi büyütüldü. Yörüngeler, bireysel yörünge segmentleri ölçeğinde analiz edildi (Şekil 5). Her segment için, μm/s cinsinden boncuk hızı, sınırlayıcı kutu hücresel yoğunluğuna (sınırlayıcı kutu içindeki voksel başına ortalama GFP) karşı çizildi. Kırmızı çizgi doğrusal regresyonu, yeşil çizgi ise üstel regresyon izini gösterir. Bu rakam (31)'den izin alınarak çoğaltılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Video 1. 1,5 kalınlığında optik cam lamel üzerinde büyütülen 24 saatlik E. faecalis OG1RF biyofilminin 4D videosu.4D hızlandırılmış video, 512x512 çözünürlükte bir mikroskop kullanılarak oluşturuldu. 40 görüntüden oluşan bir Z serisi, bir biyofilmin yaklaşık 20 μm kalınlığındaki bir bölgesinin 0.5 μm'lik adımlarla görüntülenmesiyle oluşturuldu. Her Z serisi bir kareydi ve yakalamak için 50-60 saniye gerekiyordu. Bir 4D video üretmek için 20 bitişik kareden oluşan bir dizi yakalandı. Video oynatma yaklaşık 120x'tir. Video, en az 6 bağımsız deneyi temsil eder. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Video 2. 96 oyuklu optik alt plaka üzerinde büyütülen 24 saatlik bir E. faecalis OG1RF biyofilminin 4D videosu. 4D hızlandırılmış video, 512x512 çözünürlükte bir mikroskop kullanılarak oluşturuldu. 40 görüntüden oluşan bir Z serisi, bir biyofilmin yaklaşık 20 μm kalınlığındaki bir bölgesinin 0.5 μm'lik adımlarla görüntülenmesiyle oluşturuldu. Her Z serisi bir kareydi ve yakalamak için 50-60 saniye gerekiyordu. Bir 4D video üretmek için 20 bitişik kareden oluşan bir dizi yakalandı. Video oynatma yaklaşık 120x'tir. Video, 3 bağımsız deneyi temsil eder.Bunu indirmek için lütfen buraya tıklayın Video.
Ek Video 3. 6-7 gün boyunca 1.5 kalın optik cam lameller üzerinde büyütülen bir Salmonella enterica serotipi Typhimurium biyofilm ATCC 14028'in 4D videosu. 4D hızlandırılmış video, 512x512 çözünürlükte bir mikroskop kullanılarak oluşturuldu. 40 görüntüden oluşan bir Z serisi, bir biyofilmin yaklaşık 20 μm kalınlığındaki bir bölgesinin 0.5 μm'lik adımlarla görüntülenmesiyle oluşturuldu. Her Z serisi bir kareydi ve yakalamak için 50-60 saniye gerekiyordu. Bir 4D video üretmek için 20 bitişik kareden oluşan bir dizi yakalandı. Video oynatma yaklaşık 120x'tir. Video, 3 bağımsız deneyi temsil eder.Bunu indirmek için lütfen buraya tıklayın Video.
Ek Video 4. Salmonella enterica serotipi Typhimurium biyofilmleri ATCC 14028 curli (csgBA) mutantının 4 boyutlu videosu, 6-7 gün boyunca 1.5 kalınlığında optik cam lameller üzerinde büyütüldü. 4D hızlandırılmış video, 512x512 çözünürlükte bir mikroskop kullanılarak oluşturuldu. 40 görüntüden oluşan bir Z serisi, bir biyofilmin yaklaşık 20 μm kalınlığındaki bir bölgesinin 0.5 μm'lik adımlarla görüntülenmesiyle oluşturuldu. Her Z serisi bir kareydi ve yakalamak için 50-60 saniye gerekiyordu. Bir 4D video üretmek için 20 bitişik kareden oluşan bir dizi yakalandı. Video oynatma yaklaşık 120x'tir. Video, 3 bağımsız deneyi temsil eder.Bunu indirmek için lütfen buraya tıklayın Video.
Ek Video 5. 6-7 gün boyunca 1.5 kalınlığında optik cam lameller üzerinde yetiştirilen E. coli UTI89'un 4D videosu. 4D hızlandırılmış video, 512x512 çözünürlükte bir mikroskop kullanılarak oluşturuldu. 40 görüntüden oluşan bir Z serisi, bir biyofilmin yaklaşık 20 μm kalınlığındaki bir bölgesinin 0.5 μm'lik adımlarla görüntülenmesiyle oluşturuldu. Her Z serisi bir kareydi ve yakalamak için 50-60 saniye gerekiyordu. Bir 4D video üretmek için 20 bitişik kareden oluşan bir dizi yakalandı. Video oynatma yaklaşık 120x'tir. Video, 3 bağımsız deneyi temsil eder.Bunu indirmek için lütfen buraya tıklayın Video.
Ek Video 6. 4D video E. coli UTI89 curli (csgBA) mutantı 6-7 gün boyunca 1.5 kalınlığında optik cam lameller üzerinde büyütüldü. 4D hızlandırılmış video, 512x512 çözünürlükte bir mikroskop kullanılarak oluşturuldu. 40 görüntüden oluşan bir Z serisi, bir biyofilmin yaklaşık 20 μm kalınlığındaki bir bölgesinin 0.5 μm'lik adımlarla görüntülenmesiyle oluşturuldu. Her Z serisi bir kareydi ve yakalamak için 50-60 saniye gerekiyordu. Bir 4D video üretmek için 20 bitişik kareden oluşan bir dizi yakalandı. Video oynatma yaklaşık 120x'tir. Video, 3 bağımsız deneyi temsil eder.Bunu indirmek için lütfen buraya tıklayın Video.
Tartışmalar
Kritik adımlar ve sorun giderme
Bu tekniğin en büyük zorluğu, E. faecalis gibi çok viskoz bir biyofilm ile monte edilmiş bir lamel kullanmaktır.Lamelin, yeniden konumlandırılmadan çok kuyulu kızak üzerine dikkatli ve doğru bir şekilde yerleştirilmesi gerekir. Sızdırmazlık adımı sırasında, lamel üzerinde aşağı itilmesini veya yanlışlıkla kayma yüzeyi boyunca itilmesini/kaymasını önlemek için dikkatli olunmalıdır. Herhangi bir hareket veya basınç, yüzey gerilimi oluşturabilir ve viskoz bir biyofilmin hareketini engelleyebilir. Mümkünse, bir optik alt kuyu üzerindeki bir biyofilmi bir lamel montajıyla görüntüleyerek biyofilm malzeme özelliklerinin karşılaştırılması, teknik değerlendirmeye izin verecektir. Doğru bir şekilde gerçekleştirildiğinde, bir lamel montajı, E. faecalis için bir optik alt plakadaki bir biyofilme çok benziyordu.
Ek olarak, monte edilmiş bir lamel kullanılırken, biyofilmin arayüzlerinin altta lamel veya en üstte lamel ile görüntülenmesinden kaçınılmalıdır. Ters çevrilmiş bir dürbün kullanıldığında, lamel alttayken, biyofilmin tabanında lamel ile sıkışmış boncuklar olabilir. Bu boncuklar biyofilmden geçer ve nazikçe yıkandıktan sonra bile lamel tarafından tutulur. x, y ve z koordinatları 0 ve sınırlayıcı kutu koordinatları 0'dır. Bununla birlikte, tedaviden sonra biyofilm bütünlüğünün incelenmesi gibi belirli uygulamalar için bu veri noktaları bir araç olarak kullanılabilir. Boncukların kalın bir biyofilm bölgesinden lamel tabakasının dibine nüfuz etme kabiliyeti, tedaviden sonra biyofilm bütünlüğünü değerlendirmek için kullanılabilir (el yazması Tükel laboratuvarı ile işbirliği içinde hazırlanmaktadır). Biyofilmin tepesinde, E. faecalis gibi viskoz bir biyofilmde, lamel tarafından uygulanan sıkıştırmaya dair bazı kanıtlarımız vardı. Bu, cam slayt arayüzündeki bazı boncukların hareketini sınırladı ve boncuk hareketi analizine bir miktar yoğunluk bağımlılığı getirmiş olabilir.
Biyofilmler için yıkama adımları gerekliydi çünkü büyüme ortamı yeşil kanalda güçlü otofloresansa sahiptir. Gözlemlenen bölgelerin en doğru karakterizasyonunu elde etmek için ilişkili boncukları en üst düzeye çıkarmak için fazla boncukları kullanmayı ve ilişkilendirilmemiş boncukları yıkayarak çıkarmayı seçiyoruz.
İstenen veri setlerini elde etmek için gereken boncuk ve yıkama sayısının ampirik olarak belirlenmesi gerekir. Bir biyofilmde çok fazla boncuk bulunması, analiz edilmesi zor olan imkansız derecede büyük veri kümeleri oluşturur. Çok az sayıda boncuk bulunması, biyofilm ortamlarının kapsamlı bir örneklemesini oluşturmaz. Bununla birlikte, eklenen boncuk sayısının kontrolü (1 mL PBS'de2x10 7 boncuk) ve yıkama adımlarının kullanımı, yapısına, mekansal düzenlemesine ve bileşimine bağlı olarak biyofilm ile ilişkili nispeten tutarlı sayıda boncuk (40-140) ile sonuçlandı.
Karışık viskoz ve sert bölgelere sahip biyofilmleri incelerken, boncuklar zamanla sert bölgelerde sıkışıp kalabilir. Bu durumda, boncuklar eklendikten hemen sonra görüntülemeye başlanması gerekir. Bu genellikle lameller kullanılarak gerçekleştirilemez, ancak boncukların ve yıkama adımlarının eklenmesinden hemen sonra görüntülemenin yapılabileceği optik alt plakalar veya akış hücreleri gerektirir.
Değişiklikler ve Gelecekteki Uygulamalar
Mikroakışkan cihazların kullanımı. Çalışmalarımızda, Enterobacteriaceae biyofilmlerinin incelenmesi için belirlenen en uygun koşullar, biyofilmin hava-sıvı arayüzünde bir pelikül olarak büyümesini gerektirmiştir. Bu, çalışmalarda optik alt plakaların ve mikroakışkan cihazların kullanımını sınırladı. Bununla birlikte, biyofilm oluşum koşulları izin verdiğinde, biyofilmler mikroakışkan odalarda veya akış hücrelerinde büyütülebilir. Biyofilmler daha sonra yıkanabilir ve biyofilmde minimum bozulma ile mikroakışkan cihazdan boncuklar sokulabilir.
Biyofilm büyümesi sırasında boncukların eklenmesi. Biyofilmlere fazla boncuk eklemeyi ve ardından analiz sırasında mevcut olan boncuk sayısını optimize etmek için ilişkilendirilmemiş boncukları nazikçe yıkayarak çıkarmayı seçtik. Viskoz E. faecalis biyofilmlerinde, 20 dakikalık görüntüleme süresi boyunca boncukların ayrılması ve yeniden birleşmesi mümkündür. Biyofilm büyümesi sırasında farklı zamanlarda az sayıda boncuk eklenirse, boncukları biyofilm içinde yakalamak mümkün olabilir, bu da daha viskoz biyofilmlerde biyofilm hareketinin daha doğru karakterizasyonuna olanak tanır.
Görüntülenecek bölgenin seçimi. Malzeme özellikleri ile ilgili çalışmalar için, biyofilmin kalın ve ince bölgelerini seçmek en iyisidir. Bununla birlikte, işlenmiş bir biyofilmin malzeme özelliklerindeki değişiklikleri incelerken, viskoelastik özelliklerdeki değişiklikleri ve bu bölgelerdeki boncuk penetrasyonunu belirlemek için kalın birleşik bölgeler görüntülenebilir. Bu durumda, biyofilme nüfuz eden ve lamel ile sıkışıp kalan boncukları aramak, biyofilm bozulmasının yararlı bir ölçüsüdür.
Akış altında görüntüleme. Optik cam akış hücreleri veya mikroakışkan cihazlar kullanılarak, akış altındaki bir biyofilmdeki boncukların veya bakterilerin hareketi görüntülenebilir. Bu farklı şekillerde yapılabilir. Boncukların tüm hazneye enjeksiyonu ve ardından boncukların biyofilm ile birleşmesine izin vermek için kısa bir inkübasyon ile yapılabilir. İlişkilendirilmemiş boncuklar yıkama ile çıkarılabilir ve biyofilm akışlı veya akışsız olarak görüntülenebilir. Tersine, odanın bir tarafına az sayıda boncuk sokulabilir ve bunların biyofilm içindeki ve içindeki hareketleri akış altında izlenebilir. Akışı kullanırken, Mozaik boncuk izleme ayarlarının seçiminde dikkatli olunması gerekecektir (Adım 4.5). Mevcut çalışmalarda dinamik ortam Brownian idi. MSD hesaplamaları, mekanizmanın dağınık olma ihtimalinin yüksek olduğunu doğruladı ve bu da Brownian'ı uygun ayar haline getirdi.
Matris boyama. Mevcut çalışmalarda, Syto9 ile boyama, biyofilm yapı yoğunluğunu değil, hücresel yoğunluğu inceler. Örneğin, amiloidlerin varlığı muhtemelen biyofilmin matris malzemesinin yoğunluğunu arttırır. Hareketin amiloid yoğunluğuna bağımlılığı, Syto9 yerine floresan matris boyaları kullanılarak belirlenebilir.
Floresan etiketli bakteriler. Floresan etiketli bakteriler, eksojen bakterilerin biyofilmler (örneğin, plazmid içeren bakteriler) yoluyla hareketini izlemek için kullanılabilir. Enterokoklar gibi floresan etiketli bakterilerle ilgili zorluk, bakterileri doğru bir şekilde izleme yeteneğini zorlaştıran tekler, diplokoklar ve kısa zincirler oluşturmalarıdır. Bakterilerin tek hücreli bir morfolojiye sahip olması durumunda bu işlem daha kolay olacaktır.
Sınırlama
Yörünge görselleştirme ve birleştirmedeki sınırlamalar.
Yöntemin bir sınırlaması, yörünge görselleştirme ve dikiştir. Yeniden yapılandırılmış ve analiz edilen yörüngeler, x, y, z noktası koordinatlarından oluşur ve sonraki noktalar bu noktalar arasındaki doğrusal yolu tanımlar. Bu tür parçalı doğrusal yörüngelerin görselleştirilmesi çeşitli araçlarla sağlanabilir. Bir yaklaşım, Python ve Jupyter not defterlerini Python eklentileri, Pandas ve Matplotlib ile birlikte kullanmaktı. Bu tekniğin orijinal olarak yayınlandığı Journal of Bacteriology makalesinde mevcut yörüngeleri görselleştirmek mümkün olsa da34, gelecekteki araştırmalarda ele alınan önemli sınırlamalar vardı.
Şu anda, yeniden yapılandırılmış yörüngelerin sayısı biyofilmdeki boncukların sayısından daha fazladır, bu da birden fazla yörüngenin bir boncuğa karşılık gelebileceği anlamına gelir. Bu, Mosaic'in bir yörüngeyi sonlandıracağı ve bir saniyeyi başlatacağı bir karede zayıf bir konfokal sinyalden kaynaklanabilir. Bu, özellikle daha az viskoz biyofilmlerde, bir boncuk için birden fazla daha kısa yörünge olarak kaydedilebilir. Çok sayıda yörüngenin bir başka nedeni de yörünge dikişinin olmamasıdır. Özellikle E. faecalis optik dip kuyusu biyofilmlerinde, boncuklar görüntüleme sırasında görsel olarak biyofilm ile ilişkili kalır (Ek Video 2). Bununla birlikte, 10'dan daha uzun yörüngeler yoktu ve yörüngelerin %90'ından fazlasının ömrü 5 kare veya daha azdı (Şekil 3D). Yazılım yalnızca tanımlanmış bir uzunluğun üzerindeki yörüngeleri analiz etmek için kullanılıyorsa (örneğin, plazmitleri aktarabilen hücreleri izlerken), daha kısa yörüngeler veri setinden otomatik olarak kaldırılabilir. Bununla birlikte, yörüngelerin dikilmesinin çok önemli olabileceği başka amaçlar da vardır. Son olarak, hızlı boncuk hareketinin tek bir yörünge olarak izlenememesi, Z yönündeki hızlı hareket nedeniyle Enterobacteriaceae biyofilmlerinde daha fazla yörüngeye neden olarak eliptik şekilli boncuklara neden olabilir (Şekil 2G). Hızlı anizotropik hareketle bozulan yörüngeleri dikme olasılığı, Enterobacteriaceae'deki curli amiloid matrisinin etkisini incelemek için önemli olacaktır.
Mana
3D biyofilmlerin malzeme özelliklerini karşılaştırmak için boncuk yörüngelerini incelemek için hesaplamalı bir iş akışı geliştirilmiştir. İş akışı, araştırmacıların heterojen biyofilmlerde akışkanlar dinamiğinin hesaplamalı modellemesinde kullanılabilecek kritik parametreleri belirlemelerini sağlar. Bu açık kaynaklı boncuk değerlendiricisinin yardımıyla, bakteriyel amiloid curli'nin malzeme özellikleri üzerindeki etkisi incelenebilir ve curli'ye bağlı olarak artan biyofilm matris sertliği gösterilebilir. Daha genel bir bağlamda, değerlendirici, biyofilm arıtımı veya akış gibi farklı çevresel koşullar tarafından indüklenen biyofilm yapısındaki değişiklikleri incelemek için kullanılabilir. Örneğin, araç, Tükel laboratuvarı (LKSOM Temple Üniversitesi) ile işbirliği içinde monoklonal antikor tedavisinin biyofilm yapılarının bozulması üzerindeki etkisini analiz etmek için kullanılıyor. Boncuk değerlendirici araç kutusu, işlevlerini daha da geliştirmek ve genişletmek için VRL-Studio kullanılarak modüler bir şekilde tamamen uyarlanabilir ve genişletilebilir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
GQ ve BAB laboratuvarlarındaki çalışmalar, kamu, ticari veya kar amacı gütmeyen sektörlerdeki herhangi bir finansman kuruluşundan özel bir hibe almadı. Yazarlar, yararlı tartışmalar için Ph.D'den Isaac Klapper'a (Temple Üniversitesi Matematik Bölümü) ve bu tekniği içeren ilk yayında Enterobacteriaceae uzmanlığı için Çağla Tükel'e (Temple Üniversitesi Mikrobiyoloji ve İmmünoloji Bölümü) teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96-well plates, No. 1.5 Uncoated Coverslip, 5 mm Glass Diameter | MatTek | P96G1.55F | |
| Fisherbrand Cover Glasses: Circles | Fisher Scientific | 12-293-232P | 1.5 optic glass coverslip |
| Invitrogen Syto 9 Green Fluorescent Nucleic Acid Stain | Invitrogen | S34854 | |
| Molecular Probes FluoSpheres Carboxylate-modified Microspheres, 1 um, crimson fluorescent (625/645) | Molecular Probes | F8816 |
Referanslar
- Huang, R., Li, M., Gregory, R. L. Bacterial interactions in dental biofilm. Virulence. 2, 435-444 (2011).
- Nadell, C. D., Drescher, K., Wingreen, N. S., Bassler, B. L. Extracellular matrix structure governs invasion resistance in bacterial biofilms. ISME Journal. 9, 1700-1709 (2015).
- Billings, N., Birjiniuk, A., Samad, T. S., Doyle, P. S., Ribbeck, K. Material properties of biofilms - key methods for understanding permeability and mechanics. Reports on Progress in Physics. 78, 036601 (2015).
- Araújo, G. R. d. e. S., Viana, N. B., Gómez, F., Pontes, B., Frases, S. The mechanical properties of microbial surfaces and biofilms. The Cell Surface. 5, 100028 (2019).
- Tallawi, M., Opitz, M., Lieleg, O. Modulation of the mechanical properties of bacterial biofilms in response to environmental challenges. Biomaterials Science. 5, 887-900 (2017).
- Tursi, S. A., Tükel, &. #. 1. 9. 9. ;. Curli-Containing Enteric Biofilms Inside and Out, Matrix Composition, Immune Recognition, and Disease Implications. Microbiology and Molecular Biology Reviews. 82, (2018).
- Dueholm, M. S., Albertsen, M., Otzen, D., Nielsen, P. H. Curli functional amyloid systems are phylogenetically widespread and display large diversity in operon and protein structure. PLoS One. 7 (12), 51274 (2012).
- Hung, C., et al. Escherichia coli biofilms have an organized and complex extracellular matrix structure. mBio. 4, 00645 (2013).
- Kikuchi, T., Mizunoe, Y., Takade, A., Naito, S., Yoshida, S. Curli fibers are required for development of biofilm architecture in Escherichia coli K-12 and enhance bacterial adherence to human uroepithelial cells. Microbiology and Immunology. 49, 875-884 (2005).
- Gallo, P. M., et al. Amyloid-DNA Composites of Bacterial Biofilms Stimulate Autoimmunity. Immunity. 42, 1171-1184 (2015).
- Serra, D. O., Richter, A. M., Hengge, R. Cellulose as an architectural element in spatially structured Escherichia coli biofilms. Journal of Bacteriology. 195, 5540-5554 (2013).
- Oh, Y. J. Characterization of curli A production on living bacterial surfaces by scanning probe microscopy. Biophysical Journal. 103, 1666-1671 (2012).
- Lembré, P., Di Martino, P., Vendrely, C. Amyloid peptides derived from CsgA and FapC modify the viscoelastic properties of biofilm model matrices. Biofouling. 30, 415-426 (2014).
- Oh, Y. J., et al. Curli mediate bacterial adhesion to fibronectin via tensile multiple bonds. Scientific Reports. 6, 33909 (2016).
- Vidakovic, L., Singh, P. K., Hartmann, R., Nadell, C. D., Drescher, K. Dynamic biofilm architecture confers individual and collective mechanisms of viral protection. Nature Microbiology. 3, 26-31 (2018).
- Tursi, S. A., et al. Salmonella Typhimurium biofilm disruption by a human antibody that binds a pan-amyloid epitope on curli. Nature Communications. 11, 1007 (2020).
- Perov, S., et al. Structural Insights into Curli CsgA Cross-β Fibril Architecture Inspire Repurposing of Anti-amyloid Compounds as Anti-biofilm Agents. PLOS Pathogens. 15 (8), 1007978 (2019).
- Taglialegna, A., et al. The biofilm-associated surface protein Esp of Enterococcus faecalis forms amyloid-like fibers. Npj Biofilms and Microbiomes. 6, 15 (2020).
- Gour, S., Kumar, V., Rana, M., Yadav, J. K. Pheromone peptide cOB1 from native Enterococcus faecalis forms amyloid-like structures, A new paradigm for peptide pheromones. Journal of Peptide Science. 25, 3178 (2019).
- Stoodley, P., Debeer, D., Lewandowski, Z. Liquid flow in biofilm systems. Applied and Environmental Microbiology. 60, 2711-2716 (1994).
- Birjiniuk, A., et al. Single particle tracking reveals spatial and dynamic organization of the E. coli biofilm matrix. New Journal of Physics. 16, 085014 (2014).
- Chew, S. C., et al. Dynamic remodeling of microbial biofilms by functionally distinct exopolysaccharides. mBio. 5, 01536 (2014).
- Cao, H., et al. Revealing region-specific biofilm viscoelastic properties by means of a micro-rheological approach. Npj Biofilms and Microbiomes. 2, 5 (2016).
- Galy, O., et al. Mapping of bacterial biofilm local mechanics by magnetic microparticle actuation. Biophysical Journal. 103, 1400-1408 (2012).
- Rogers, S. S., vander Walle, C., Waigh, T. A. Microrheology of bacterial biofilms in vitro, Staphylococcus aureus and Pseudomonas aeruginosa. Langmuir. 24, 13549-13555 (2008).
- Hart, J. W., Waigh, T. A., Lu, J. R., Roberts, I. S. Microrheology and Spatial Heterogeneity of Staphylococcus aureus Biofilms Modulated by Hydrodynamic Shear and Biofilm-Degrading Enzymes. Langmuir. 35 (9), 3553-3561 (2019).
- van Merode, A. E. J., van der Mei, H. C., Busscher, H. J., Krom, B. P. Influence of culture heterogeneity in cell surface charge on adhesion and biofilm formation by Enterococcus faecalis. Journal of Bacteriology. 188, 2421-2426 (2006).
- Tariq, M., Bruijs, C., Kok, J., Krom, B. P. Link between Culture Zeta Potential Homogeneity and Ebp in Enterococcus faecalis. Applied and Environmental Microbiology. 78, 2282-2288 (2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ, 25 years of image analysis. Nature Methods. 9, 671-675 (2012).
- . Oracle.com Available from: https://docs.oracle.com/en/java (2021)
- Hoffer, M., Poliwoda, C., Wittum, G. Visual reflection library, a framework for declarative GUI programming on the Java platform. Computing and Visualization in Science. 16, 181-192 (2013).
- Perov, S., et al. Structural Insights into Curli CsgA Cross-β Fibril Architecture Inspire Repurposing of Anti-amyloid Compounds as Anti-biofilm Agents. PLOS Pathogens. 15, 1007978 (2019).
- Malhotra, K., et al. Development of a New Bead Movement-Based Computational Framework Shows that Bacterial Amyloid Curli Reduces Bead Mobility in Biofilms. Journal of Bacteriology. 202, 00253 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır