Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Serebellar Granül Nöron Morfolojisi ve Sinaps Gelişimini Incelemek için In Vivo Postnatal Elektroporasyonun Kullanılması
Bu Makalede
Erratum Notice
Özet
Burada, fare beyinciğindeki granül nöronların sinaptogenezini, doğum sonrası beyin gelişiminin zaman boyunca, bu hücreler sinaptik yapılarını rafine ettiklerinde ve kendilerini genel beyin devresine entegre etmek için sinapslar oluşturduklarında görselleştirmek için bir yöntem açıklıyoruz.
Özet
Nöronlar, diğer hücrelerle uygun bağlantılar kurmak için beyin gelişimi sırasında yapılarında ve işlevlerinde dinamik değişikliklere uğrarlar. Kemirgen beyinciği, zaman içinde tek bir hücre tipi olan serebellar granül nöronun (CGN) gelişimini ve morfogenezini izlemek için ideal bir sistemdir. Burada, gelişmekte olan fare serebellumundaki granül nöron progenitörlerinin in vivo elektroporasyonu, sonraki morfolojik analizler için hücreleri seyrek olarak etiketlemek için kullanılmıştır. Bu tekniğin etkinliği, CGN olgunlaşmasının kilit gelişimsel aşamalarını sergileme yeteneğinde, bu hücrelerin sinaptik girdilerinin çoğunu aldığı özel yapılar olan dendritik pençelerin oluşumuna özel olarak odaklanarak gösterilmiştir. Serebellar gelişim boyunca CGN sinaptik yapılarının anlık görüntülerini sağlamanın yanı sıra, bu teknik, ilgilenilen herhangi bir genin rolünü ve CGN morfolojisi, pençe gelişimi ve sinaptogenezi üzerindeki etkisini incelemek için granül nöronlarını hücre özerk bir şekilde genetik olarak manipüle etmek için uyarlanabilir.
Giriş
Beyin gelişimi, embriyogenezden doğum sonrası yaşama kadar uzanan uzun bir süreçtir. Bu süre zarfında beyin, sonuçta davranışı yönlendirmek için dendritler ve aksonlar arasındaki sinapsların kablolamasını şekillendiren içsel ve dışsal uyaranların bir kombinasyonunu bütünleştirir. Kemirgen beyinciği, sinapsların nasıl geliştiğini incelemek için ideal bir model sistemidir, çünkü tek bir nöron tipi olan serebellar granül nöronun (CGN) gelişimi, bir progenitör hücreden olgun bir nörona geçerken izlenebilir. Bu, kısmen, serebellar korteksin çoğunluğunun doğum sonrası gelişmesinden kaynaklanmaktadır, bu da doğumdan sonra kolay genetik manipülasyona ve hücre etiketlemesine izin verir1.
Memelilerde, CGN farklılaşması, embriyonik gelişimin sonunda, arka beyindeki proliferatif hücrelerin bir alt kümesinin, beyincikyüzeyinde ikincil bir germinal bölge oluşturmak için eşkenar dörtgen dudağın üzerinden göç etmesiyle başlar 2,3,4. Granül nöron progenitör (GSMH) kimliğine tamamen bağlı olmalarına rağmen, bu hücreler doğum sonrası 14. güne (P14) kadar dış granül tabakasının (EGL) dış kısmında çoğalmaya devam ederler. Bu tabakanın çoğalması, beyinciğin büyük ölçüde genişlemesine neden olur, çünkü bu hücreler sadece CGN5'e yol açar. Yenidoğan CGN'ler EGL'deki hücre döngüsünden çıktıktan sonra, iç granül tabakasına (IGL) doğru içe doğru göç ederler ve beyinciğin moleküler tabakasında çatallanacak ve hareket edecek bir akson bırakarak Purkinje hücrelerine sinaps yapan paralel lifler oluştururlar6. Bu liflerin moleküler tabaka içindeki konumu, hücre döngüsü çıkışının zamanlamasına bağlıdır.
Farklılaşan CGN'ler önce paralel liflerini moleküler tabakanın altına doğru bırakırken, daha sonra farklılaşan CGN'lerin aksonları ilk 7,8'de kümelenir. CGN hücre gövdeleri IGL'ye ulaştığında, dendritleri detaylandırmaya ve yakındaki inhibitör ve uyarıcı nöronlarla sinapslar oluşturmaya başlarlar. Bir CGN'nin olgun dendritik ağacı, dört ana süreçle kalıplaşmış bir mimari sergiler. CGN olgunlaşması boyunca, bu dendritlerin sonundaki yapılar, postsinaptik proteinlerle zenginleştirilmiş bir pençe oluşturur 9,10. Dendritik pençeler olarak adlandırılan bu özel yapılar, sinapsların çoğunu granül nöronlar üzerinde içerir ve hem pons'tan kaynaklanan yosunlu lif innervasyonlarından uyarıcı girdileri hem de lokal Golgi hücrelerinden inhibitör girdileri almak için önemlidir. Tamamen yapılandırıldıktan sonra, CGN'lerin sinaptik bağlantıları, bu hücrelerin pre-serebellar çekirdeklerden gelen girdileri, serebellar korteksten derin serebellar çekirdeklere yansıtan Purkinje hücrelerine aktarmasına izin verir.
GSMH'lerin doğum sonrası in vivo elektroporasyonu, viral enfeksiyon ve transgenik fare çizgilerinin üretilmesi gibi diğer etiketleme tabanlı yöntemlere göre avantajlıdır, çünkü istenen yapıların ekspresyonu hızlı bir zaman çizelgesinde elde edilebilir ve yöntem, hücre özerk etkilerini incelemede yararlı olan küçük bir hücre popülasyonunu hedefler. Bu yöntem, CGN'lerin morfolojik gelişimini incelemek için önceki çalışmalarda kullanılmıştır; Bununla birlikte, bu çalışmalar ya tek bir zaman noktasına ya da kısa bir zaman penceresine odaklanmıştır 9,10,11,12,13. Bu etiketleme yöntemi, doğum sonrası yaşamın ilk üç haftasında CGN farklılaşmasının tüm zaman seyri boyunca meydana gelen CGN morfolojisindeki değişiklikleri belgelemek için görüntü analizi ile eşleştirildi. Bu veriler, serebellar devrelerin yapımının altında yatan CGN dendrit gelişiminin dinamiklerini ortaya koymaktadır.
Protokol
NOT: Tüm prosedürler Duke Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylanan protokoller kapsamında gerçekleştirilmiştir.
1. İn vivo elektroporasyon veya IVE için DNA hazırlığı (ameliyattan 1 gün önce)
- Aşağıdaki malzemeleri toplayın: saflaştırılmış DNA (hayvan başına 0.5-25 μg), 3 M sodyum asetat, etanol, Hızlı Yeşil boya, ultra saf damıtılmış su, fosfat tampon çözeltisi (PBS) (bkz.
NOT: DNA için, bir insan ubikitin promotörü altında yeşil floresan proteini (GFP) eksprese eden bir yapı Addgene'den (FUGW, https://www.addgene.org/14883/) elde edilmiştir. GFP'yi veya her yerde bulunan bir promotörün kontrolü altındaki başka bir floresan proteinini ifade eden herhangi bir yapı çalışmalıdır. Bu teknikle CGN'ye özgü etiketleme, yapıya değil, elektroporasyona bağlıdır. - İstenilen miktarda DNA'yı, hacimce %10 3 M sodyum asetat ve %250 hacimce %100 buz gibi soğuk etanol karıştırarak elektroporasyon için hazırlayın. DNA'nın hemen çözeltiden çökeleceğini unutmayın.
- DNA karışımını gece boyunca -20 ° C'de veya -80 ° C'de bir saat boyunca çökeltmeye devam edin.
- Pelet, DNA'yı bir masa üstü santrifüjde >16.000 × g olarak çökeltti ve% 70 etanol ile iki kez yıkadı.
- DNA peletinin tamamen kurumasına izin verin ve 1x PBS +% 0.02 Hızlı Yeşil çözelti içinde yeniden oluşur.

Şekil 1: Ara parça kullanılarak enjeksiyon derinliğinin 1,5 mm ile sınırlandırılması. (A) 11,2 mm'lik bir segment, bir tıraş bıçağı kullanılarak bir yükleme pipeti kesilir. (B) Ara parça, Hamilton şırıngasının ucuna (toplam uzunluk 1,27 cm veya 0,5 inçtir) takılır ve yapıştırıcı veya parafilm ile sabitlenir. Açıkta kalan uç 1,5 mm uzunluğunda olmalıdır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
2. Yedi günlük postnatal farelerde granül nöron progenitörlerinin in vivo elektroporasyonu
NOT: Tüm elektroporasyon ameliyatları steril ve yüksek havalandırmalı bir cerrahi süitte gerçekleştirildi ve tüm personel eldiven, yüz maskesi, saç başlığı, önlük ve ayakkabı kılıfları dahil olmak üzere eksiksiz kişisel koruyucu ekipman giydi. Alternatif olarak, ameliyatlar havalandırılan ve steril bir başlıkta gerçekleştirilebilir.
- Aşağıdaki malzemeleri toplayın: elektroporasyon için DNA, küçük cerrahi makas, küçük cerrahi cımbız, özelleştirilmiş Hamilton şırıngası, pamuk uçlu aplikatör, ısıtma yastığı, betadin,% 70 etanol, 1x PBS, parafilm, doku yapıştırıcısı (n-bütil-ester siyanoakrilat), izofluran, elektroporatör ve cımbizer tipi elektrotlar (bkz.
- Enjeksiyon derinliğini 1,5 mm ile sınırlamak için Hamilton şırıngasının üzerine sığacak şekilde sterilize edilmiş bir yükleme ucundan bir ara parça kesin (Şekil 1A, B). Ara parçayı yapıştırıcı veya parafilm ile sabitleyin.
- P7 yavrusunu bir izofluran odasında 0.8 L / dak doğum hızında anestezi yapın. Hayvanın azalmış solunum ve ayak parmağı veya kuyruk sıkışması yanıtı eksikliği açısından izlenerek tam anesteziyi onaylayın (Şekil 2A).
- Hayvan tamamen anestezi altına alındıktan sonra, yavruları burun konisi ile donatılmış bir kaide üzerine yerleştirin ve 0.8 L / dak'lık bir doğum hızında sabit% 4 izofluran verin. Bölgeyi hazırlamak için yavru kafanın üst kısmını steril bir betadin çubuğu ile 3 kez temizleyin, ardından% 70 etanol, ikisi arasında dönüşümlü olarak. Devam etmeden önce çözeltinin kurumasını bekleyin.
- Bir çift sterilize makas kullanarak, arka beyni ortaya çıkarmak için kulakların üstünden tabanına kadar olan mesafeyi kapsayan bir kesimle küçük bir kesi yapın (Şekil 2B).
- Beyinciği bulun (Şekil 2C), Hamilton şırıngasının açıkta kalan ucunu kafatasından beyne dik olarak yerleştirin ve şırınganın arka pistonunu yavaşça iterek serebellar parankimin içine 1.5 μL DNA karışımı enjekte edin. DNA karışımının verilmesinden sonra, geri dökülmeleri önlemek için iğneyi yavaşça geri çekin ve DNA çözeltisinin 30 saniye boyunca yayılmasına izin verin.
- İzofluranı kapatın ve yavruyu 37 ° C'lik bir ısıtma yastığına yerleştirin. Her iki ucu steril 1x PBS'ye batırarak cıvıl cıvıl tip elektrodu elektroporasyon için hazırlayın.
NOT: Cımbız tipi elektrotun ıslatılması, elektrik darbelerinin uygulanması sırasında yavru derisinde temas yanıklarını önleyecektir. - Cımbız elektrodu, artı ucu aşağıya bakacak ve negatif ucu hayvanın başının üstünde olacak şekilde enjeksiyon bölgesinin üzerine yönlendirin (Şekil 2D). Aşağıdaki ayarlarla elektroporatörden beş elektrik darbesini yönetin: 50 ms, 130 V ve 950 ms darbeler arası aralık.
NOT: Gerekirse, enjeksiyon bölgesinin serebellar vermis üzerinde bulunduğundan emin olmak için bir test enjeksiyonu yapın (Şekil 2E). - Kesiyeri kapatın ve yarayı toksik olmayan bir n-bütil-ester siyanoakrilat doku yapıştırıcısı ile kapatın. Yarayı% 70 etanol ile temizleyin, çünkü herhangi bir eser miktarda kan, ebeveyn bebek cinayeti ve yamyamlık olasılığını arttırır.
- Yavruyu baraja geri döndürmeden önce hayvanın 37 ° C'lik bir ısıtma yastığı üzerinde iyileşmesine izin verin. Tam iyileşmeyi sağlamak için ameliyattan sonra en az 2 saat boyunca her 30 dakikada bir yavruları izleyin.
NOT: Her iki ebeveyn tarafından da bebek öldürme oldukça yaygındır. Yamyamlığı önlemek için, elektroporasyona başlamadan önce sire'yi farklı bir kafeste saklayın ve temizlenmiş ve kurtarılmış yavruları (yani, kan lekesi yok, tamamen hareketli) her zaman orijinal yataktaki orijinal kafese geri gönderin. Yavrular, kan kokusunu en aza indirmek için orijinal kafesten dışkılarla da silinebilir. Vekil barajın kullanılması, orijinal baraj yavrularını yamyamlaştırmaya devam ederse gerekli olabilir.
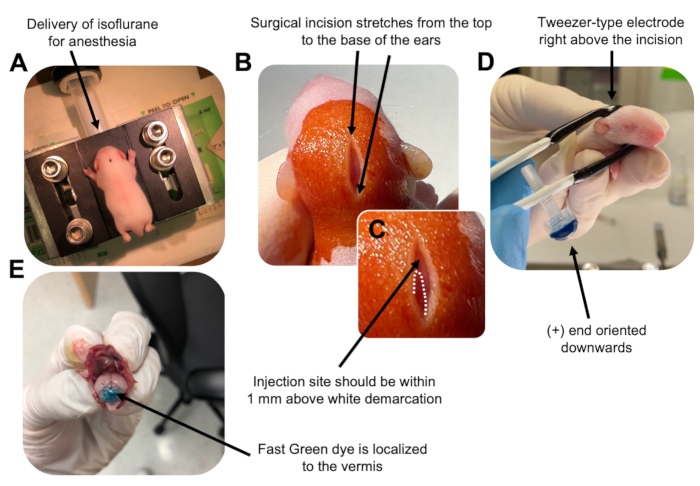
Şekil 2: P7 wildtype fare yavrularında granül nöron progenitörlerinin in vivo serebellar elektroporasyonu. (A) Yavrular, DNA çözeltisinin enjeksiyonu boyunca anestezi sağlamak için 0.8L / dak oranında verilen% 4 izofluran ile uyuşturulur. İzofluran 0.8 L / dak oranında verilir. (B) Fareyi betadin ve% 70 etanol ile 3 kez sterilize ettikten sonra, kulakların mesafesini kapsayan ve arka beyni ortaya çıkaran bir kesi yapılır. (C) Enjeksiyon bölgesi için bir dönüm noktası olan kafatası üzerindeki beyaz bir sınırın büyütülmüş bir görüntüsü. DNA yapısı, işaretin 1 mm yukarısına enjekte edilmelidir; noktalı çizgiler sınırı ana hatlarıyla belirtir ve siyah ok enjeksiyon bölgesini gösterir. Serebellar vermisin sırtları görülebilir ve enjeksiyon bölgesini bulmak için yararlı olabilir. (D) Verimli elektroporasyon için Tweezer tipi elektrot oryantasyonu. Ayrıca (+) uç, elektrik darbelerinin uygulanmasından önce negatif yüklü DNA'yı serebellar parankim'e çekmek için aşağı doğru yönlendirilmelidir. (E) % 0.02'lik Hızlı Yeşil boyanın 1 μL'lik test enjeksiyonu, enjeksiyonun 5-7 lobülleri arasındaki serebellar vermisin ortasına lokalize olduğunu gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
3. Elektroporatörlü CGN'lerin immünohistokimyası
- Aşağıdaki malzemeleri toplayın: izofluran, 1x PBS,% 4 paraformaldehit (PFA),% 30 sakaroz, normal keçi serumu, iyonik olmayan deterjan, cam slaytlar, cam kapaklar, oje, montaj ortamı, Hoechst nükleer boyası ve uygun birincil ve ikincil antikorlar (bkz.
- Deney hayvanını izofluran ile uyuşturun ve bir ayak parmağı ve kuyruk tutamağı ile tam anesteziyi onaylayın.
- Hayvanın kalbinin sol ventrikülüne yavaşça 1x PBS ve% 4 PFA enjekte ederek bir trans-kardiyal perfüzyon gerçekleştirin. Vena kavayı keserek kanın hayvandan akmasına izin verin.
- Beyni 4 ° C'de% 4 PFA'ya batırarak gece boyunca sabitleyin. Ertesi gün, beyni 1x PBS ile hızlı bir şekilde durulayın ve beyni en az 24 saat boyunca kriyoproteksiyon için 1x PBS'de% 30 sakkaroza aktarın.
- Gerekirse, beyni rostral-kaudal eksen boyunca ikiye bölün ve dik bir floresan diseksiyon mikroskobu kullanarak transfekte muhabir yapısının ekspresyonunu onaylayın.
NOT: Beyni kurumasını önlemek için küçük bir kapta 1x PBS'ye batırılmış halde tutun. - Beyni dondurucu bir mikrotom üzerine monte edin, 25 μm sagital bölümleri dilimleyin ve bölümlerin 1: 1 x PBS ve gliserol karışımında açılmasına izin verin.
NOT: Kesitler, uzun süreli depolama için bu kriyoprotektan çözeltisinde -20 °C'de saklanabilir. - Kriyoprotektanı çıkarmak için bölümleri 1x PBS'de her biri 10 dakika boyunca üç kez yıkayın ve dokuyu 1x PBS +% 10 normal keçi serumu +% 0.2 iyonik olmayan deterjanda oda sıcaklığında 1 saat boyunca bir orbital çalkalayıcıda bloke edin.
- Birincil antikor çözeltisi hazırlayın: 1x PBS,% 10 normal keçi serumu,% 0.2 iyonik olmayan deterjan ve anti-GFP antikoru ve çözeltiyi 5 dakika boyunca >16.000 × g'da santrifüj edin. Antikor çözeltisindeki bölümleri 4 °C'de bir orbital çalkalayıcı üzerinde 48 saat boyunca inkübe edin.
- Birincil antikor çözeltisini 1x PBS +% 0.2 iyonik olmayan deterjanla beş kez 15 dakika boyunca yıkayın.
- İkincil antikor çözeltisi hazırlayın: 1x PBS,% 10 normal keçi serumu,% 0.2 iyonik olmayan deterjan ve GFP'yi tespit etmek için uygun bir ikincil antikor; Çözeltiyi >16.000 × g'de santrifüj edin. Antikor çözeltisindeki bölümleri, 2-3 saat boyunca oda sıcaklığında bir orbital çalkalayıcı üzerinde inkübe edin. Ağartmayı önlemek için bölümleri ışığa maruz kalmaktan koruyun.
- İkincil antikor çözeltisini her seferinde 15 dakika boyunca 1x PBS +% 0.2 iyonik olmayan deterjanla üç kez yıkayın. Çekirdekleri boyamak için bölümleri 1x PBS + Hoechst'te 5 dakika boyunca inkübe edin.
- Hoechst çözeltisini 1x PBS +% 0,2 iyonik olmayan deterjanla yıkayın ve cam slaytlara monte edin. Bölümleri montaj ortamıyla örtün, slaytları örtün ve buharlaşmayı önlemek için sürgüyü oje ile kapatın.
4. CGN'lerin morfolojik analizleri - üç boyutlu (3D) rekonstrüksiyon ve yüzey alanı ve hücresel hacim
- Konfokal mikroskopta tek elektroporated CGN'leri 2x yakınlaştırma ile 63x hedefte görüntüleyin ve yığın başına 0,5 μm'de z-yığını görüntüleri çekin. Kolay görüntü analizi ve yeniden yapılandırma sağlamak için görüntü penceresi başına bir hücre görüntüleyin.
- Üç boyutlu (3B) alanda elektroporated CGN'lerin yapısını kolay ve verimli bir şekilde izlemek için aşağıdaki bağlantıyı (https://imagej.net/Simple_Neurite_Tracer:_Basic_Instructions) kullanarak FIJI için Simple Neurite Tracer eklentisini yükleyin.
NOT: Eklentinin güncelleştirilmiş bir sürümü vardır (https://imagej.net/SNT). - Basit Nörit Tracer'ı kullanarak nörit uzunluğunu ve dendritik pençe oluşumunu kör bir şekilde analiz edin. Elektroporated CGN'lerin tek kanallı z-stack görüntülerini FIJI'ye yükleyin ve Eklentiler'e tıklayın | Segmentasyon | Basit Nörit İzleyici (Şekil 3D).
- Açılır menüye erişin ve Yeni 3B Görüntüleyici Oluştur'u seçin (Şekil 3B).
- Bir dendritin tabanına kaydırın, burada soma hücresine bağlanır ve kavşağa tıklayarak bir yol başlatın. Hücre doldurma sinyalinin en parlak olduğu bölümleri tıklatıp izi korumak için [y] düğmesine basarak yolu manuel olarak izleyin. Pençe içermiyorsa dendritin sonuna kadar veya pençenin tabanına kadar izleyin ve [f] düğmesine basarak yolu onaylayın (Şekil 4D).
- Daha sonra, yapının tabanında bir yol başlatarak ve en uzun nöritin sonuna kadar izleyerek pençeyi izleyin. Windows'ta [ctrl] veya Mac OS'ta [alt] tuşunu basılı tutup yolu tıklatarak ikincil ve üçüncül dalları izleyin. [f] düğmesine basarak yolu onaylayın.
- İzler için ölçümlerin ayrı bir pencerede görülebildiğini gözlemleyin; Her pençe için toplam uzunluğu elde etmek için pençe dallarının (birincil, ikincil, üçüncül) tüm ölçümlerini toplayın.
- Elektroporated CGN'lerin yüzey alanını ve hücresel hacmini analiz etmek için Imaris hücre analiz yazılımını indirin (https://imaris.oxinst.com/).
NOT: FIJI, hazır ve ücretsiz eklentileri kullanarak z-stack görüntülerinden 3B hücreleri yeniden oluşturmak için de kullanılabilir. Ek olarak, Basit Nörit İzleyici'de hacimsel bir oluşturma özelliği vardır, ancak Imaris aşağıda özetlenen nedenlerden dolayı kullanılmıştır. - Elektroporasyonlu bir CGN'nin z-stack görüntüsünü Imaris'e yükleyin. Aşma tuşuna basarak 3B yeniden yapılandırma araç setine erişin.
- CGN'yi yeniden yapılandırmak için, Yüzeyler tuşuna basın ve görüntü penceresindeki hücrenin tamamını kapsayan bir ilgi alanı seçin. İşiniz bittiğinde, Oluştur'un altında sağ alt köşedeki mavi ileri oka basın.
- Görüntü farklı sinyaller için birden fazla kanal içeriyorsa, elektroporated CGN'yi içeren kanalı seçin ve mavi ileri oka basın.
- Kaydırma çubuğunu kullanarak, elektroporatörlü hücrenin sinyaline en doğru şekilde uyan istenen bir eşik ayarlayın. Eşiği doğru bir şekilde belirlemek için hücrenin yüzeyine daha yakın yakınlaştırın. İşiniz bittiğinde, hücreyi yeniden yapılandırmak ve meta verilerden yüzey alanını ve birim boyutunu elde etmek için çift yeşil oka basın.
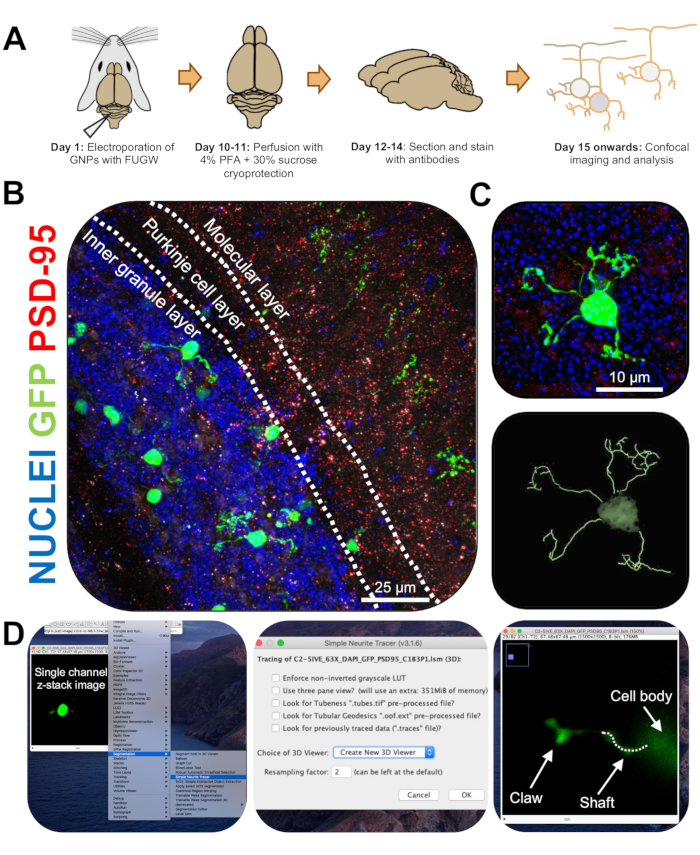
Şekil 3: İmmünohistokimyasal analiz ve elektroporat granül nöronların üç boyutlu rekonstrüksiyonu. P7 CD-1 fareleri, GFP'yi ifade eden bir yapı ile elektroporate edildi. Beyinler toplandı ve morfolojik analiz için immünohistokimya, konfokal mikroskopi ve 3D rekonstrüksiyona tabi tutuldu. (A) 10 DPI farenin elektroporasyonundan görüntü işlemesine kadar zaman çizelgesi. (B) Elektroporated beyincik 10-DPI sagital kesitinin maksimum projeksiyon görüntüsü; beyaz çizgiler serebellar katmanları sınırlar ve ölçek çubuğu 25 μm'dir. (C) Tek bir elektroporated granül nöronun maksimum projeksiyon görüntüsü 10-DPI ve buna karşılık gelen 3D iz, ölçek çubuğu 10 μm'dir. (D) 3D-rekonstrüksiyonları FIJI eklentisi Basit Nörit Tracer kullanılarak oluşturulmuştur. Tüm ölçümler, hücre doldurma sinyalini takip ederek z-yığını boyunca izlendi. Şaft ve pençe ölçümleri her dendrit için ayrı ayrı izlendi; noktalı çizgi, mevcut düzlem içindeki dendrit kısmını gösterir. Kısaltmalar: 3D = üç boyutlu; GFP = yeşil floresan protein; DPI = enjeksiyondan sonraki günler; PSD-95 = postsinaptik yoğunluk proteini 95; GSMH'ler = granül nöron progenitörleri; PFA = paraformaldehit. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuçlar
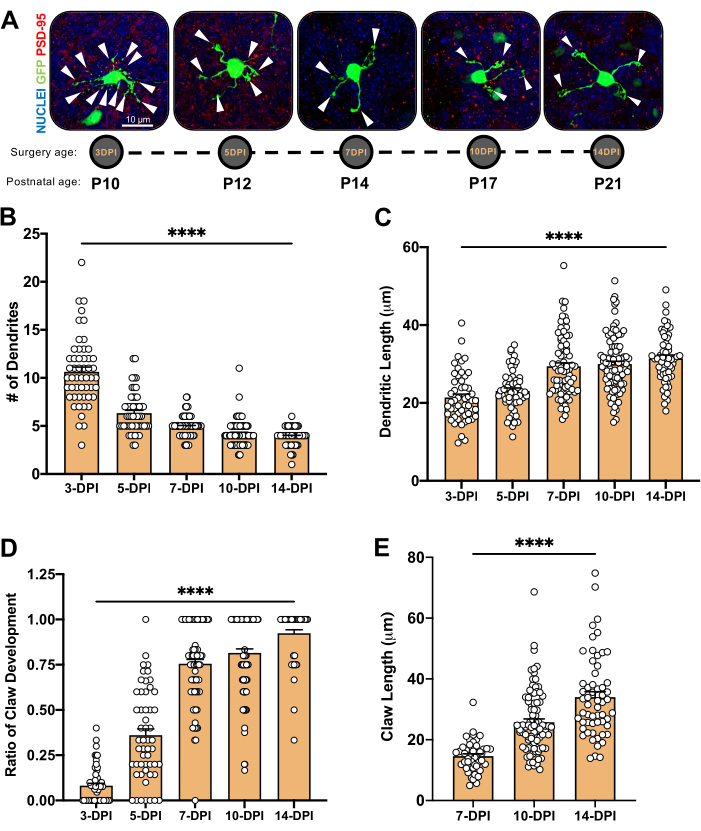
Şekil 4: Serebellar gelişim sırasında granül nöron morfolojisinin analizi. (A) 3-DPI ila 14-DPI (doğum sonrası yaş P10 ila P21), çekirdekler (mavi) ve GFP (yeşil) arasındaki elektroporated CGN'lerin maksimum projeksiyon görüntüleri; ok uçları bireysel dendriti gösterir ve ölçek çubuğu 10 μm'dir. (B) Ortalama dendrit sayısı. (
Tartışmalar
Serebellar granül nöronlar, memeli beynindeki en bol nöronlardır ve kemirgen beynindeki toplam nöron popülasyonunun neredeyse% 60-70'ini oluşturur 1,14. Beyincik, hücresel proliferasyon, göç, dendrit oluşumu ve sinaps gelişimi mekanizmalarını aydınlatmak için yaygın olarak kullanılmıştır 6,9,10,11,15,16,17,18,19,20 ...
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Çalışma, NIH hibeleri R01NS098804 (A.E.W.), F31NS113394 (U.C.) ve Duke Üniversitesi'nin Yaz Sinirbilim Programı (D.G.) tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Betadine | Purdue Production | 67618-150-17 | |
| Cemented 10 µL needle | Hamilton | 1701SN (80008) | 33 gauge, 1.27 cm (0.5 in), 4 point style |
| Chicken anti-GFP | Millipore Sigma | AB16901 | Our lab uses this antibody at a 1:1000 concentration |
| Cotton-tip applicator | |||
| Donkey anti-chicken Cy2 | Jackson ImmunoResearch | 703-225-155 | Our lab uses this antibody at a 1:500 concentration |
| Ethanol (200 proof) | Koptec | V1016 | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0052 | |
| Fast Green FCF | Sigma | F7252-5G | |
| FUGW plasmid | Addgene | 14883 | |
| Glass slides | VWR | 48311-703 | Superfrost plus |
| Glycerol | Sigma-Aldrich | G5516 | |
| Heating pad | Softheat | ||
| Hoescht 33342 fluorescent dye | Invitrogen | 62249 | |
| Imaris | Bitplane | ||
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Micro cover glass | VWR | 48382-138 | |
| Nail polish | Sally Hansen | Color 109 | |
| Normal goat serum | Gibco | 16210064 | |
| O.C.T. embedding compound | Tissue-Tek | 4583 | |
| Olympus MVX10 Dissecting Scope | Olympus | MVX10 | |
| P200 pipette reach tip | Fisherbrand | 02-707-138 | Used for needle spacer |
| Parafilm | Bemis | PM-996 | |
| PBS pH 7.4 (10x) | Gibco | 70011-044 | |
| Simple Neurite Tracer | FIJI | https://imagej.net/Simple_Neurite_Tracer:_Basic_ Instructions | |
| Sucrose | Sigma | S0389 | |
| Surgical tools | RWD Life Science | Small scissors and tweezers | |
| Triton X-100 | Roche | 11332481001 | non-ionic detergent |
| Tweezertrodes | BTX Harvard Apparatus | 45-0489 | 5 mm, platinum plated tweezer-type electrodes |
| Ultrapure distilled water | Invitrogen | 10977-015 | |
| Vectashield mounting media | Vectashield | H1000 | |
| Vetbond tissue adhesive | 3M | 1469SB | |
| Zeiss 780 Upright Confocal | Zeiss | 780 |
Referanslar
- Altman, J., Bayer, S. A. . Development of the cerebellar system : in relation to its evolution, structure, and functions. , (1997).
- Rahimi-Balaei, M., Bergen, H., Kong, J., Marzban, H. Neuronal migration during development of the cerebellum. Frontiers in Cellular Neuroscience. 12, 484 (2018).
- Alder, J., Cho, N. K., Hatten, M. E. Embryonic precursor cells from the rhombic lip are specified to a cerebellar granule neuron identity. Neuron. 17 (3), 389-399 (1996).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annual Review of Neuroscience. 18, 385-408 (1995).
- Ben-Arie, N., et al. Math1 is essential for genesis of cerebellar granule neurons. Nature. 390 (6656), 169-172 (1997).
- Borghesani, P. R., et al. BDNF stimulates migration of cerebellar granule cells. Development. 129 (6), 1435-1442 (2002).
- Espinosa, J. S., Luo, L. Timing neurogenesis and differentiation: insights from quantitative clonal analyses of cerebellar granule cells. Journal of Neuroscience. 28 (10), 2301-2312 (2008).
- Markwalter, K. H., Yang, Y., Holy, T. E., Bonni, A. Sensorimotor coding of vermal granule neurons in the developing mammalian cerebellum. Journal of Neuroscience. 39 (34), 6626-6643 (2019).
- Shalizi, A., et al. PIASx is a MEF2 SUMO E3 ligase that promotes postsynaptic dendritic morphogenesis. Journal of Neuroscience. 27 (37), 10037-10046 (2007).
- Shalizi, A., et al. A Calcium-regulated MEF2 sumoylation switch controls poststynaptic differentiation. Science. 311 (5763), 1012-1017 (2006).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain. Science. 303 (5660), 1026-1030 (2004).
- Holubowska, A., Mukherjee, C., Vadhvani, M., Stegmuller, J. Genetic manipulation of cerebellar granule neurons in vitro and in vivo to study neuronal morphology and migration. Journal of Visualized Experiments: JoVE. (85), e51070 (2014).
- Yang, Y., et al. Chromatin remodeling inactivates activity genes and regulates neural coding. Science. 353 (6296), 300-305 (2016).
- Herculano-Houzel, S. Coordinated scaling of cortical and cerebellar numbers of neurons. Frontiers in Neuroanatomy. 4, 12 (2010).
- Wilson, P. M., Fryer, R. H., Fang, Y., Hatten, M. E. Astn2, a novel member of the astrotactin gene family, regulates the trafficking of ASTN1 during glial-guided neuronal migration. Journal of Neuroscience. 30 (25), 8529-8540 (2010).
- Kokubo, M., et al. BDNF-mediated cerebellar granule cell development is impaired in mice null for CaMKK2 or CaMKIV. Journal of Neuroscience. 29 (28), 8901-8913 (2009).
- Schwartz, P. M., Borghesani, P. R., Levy, R. L., Pomeroy, S. L., Segal, R. A. Abnormal cerebellar development and foliation in BDNF-/- mice reveals a role for neurotrophins in CNS patterning. Neuron. 19 (2), 269-281 (1997).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. Journal of Neuroscience. 15 (7), 4970-4981 (1995).
- Zhou, P., et al. Polarized signaling endosomes coordinate BDNF-induced chemotaxis of cerebellar precursors. Neuron. 55 (1), 53-68 (2007).
- Dhar, M., Hantman, A. W., Nishiyama, H. Developmental pattern and structural factors of dendritic survival in cerebellar granule cells in vivo. Scientific Reports. 8 (1), 17561 (2018).
- Ito, M. Synaptic plasticity in the cerebellar cortex and its role in motor learning. Canadian Journal of Neurological Sciences. 20, 70-74 (1993).
- Jorntell, H., Hansel, C. Synaptic memories upside down: bidirectional plasticity at cerebellar parallel fiber-Purkinje cell synapses. Neuron. 52 (2), 227-238 (2006).
- Nakanishi, S. Genetic manipulation study of information processing in the cerebellum. Neuroscience. 162 (3), 723-731 (2009).
- Chang, C. H., et al. Atoh1 controls primary cilia formation to allow for SHH-triggered granule neuron progenitor proliferation. Developmental Cell. 48 (2), 184-199 (2019).
Erratum
Formal Correction: Erratum: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development
Posted by JoVE Editors on 4/06/2023. Citeable Link.
An erratum was issued for: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development. A figure was updated.
Figure 2 was updated from:
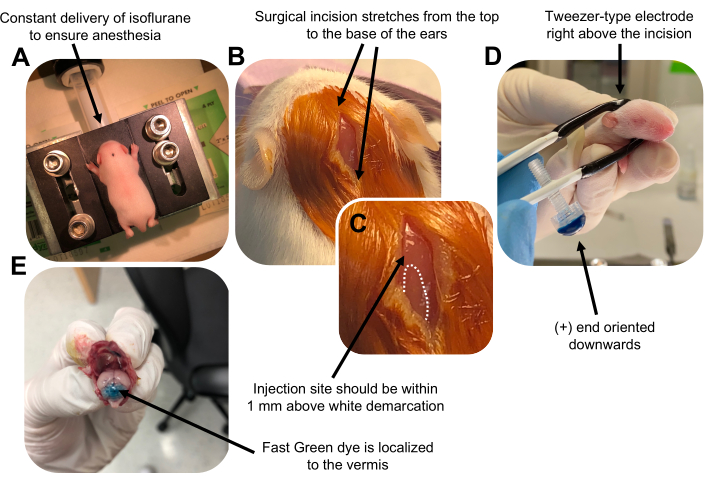
Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.
to:

Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır