Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sıçanlarda Kısmi Heterotopik Hindlimb Transplantasyon Modeli
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu makale sıçanlarda kısmi heterototopik osteomiyokutanöz flap transplantasyon protokolünü ve orta vadeli takipte potansiyel sonuçlarını sürmektedir.
Özet
Vaskülarize kompozit allotransplantasyonlar (VCA), karmaşık bir doku defektinden sonra otolog cerrahi olanakları olmayan hastalar için en gelişmiş rekonstrüksiyon seçeneğini temsil eder. Yüz ve el nakilleri şekilsiz hastaların hayatlarını değiştirerek onlara yeni bir estetik ve fonksiyonel sosyal organ kazandırmıştır. Umut verici sonuçlara rağmen, VCA yaşam boyu immünsüpresyon komorbidititeleri ve enfeksiyöz komplikasyonlar nedeniyle hala düşük performans gösteriyor. Sıçan, immünolojik yolları ve greft reddetme mekanizmalarını araştıran in vivo çalışmalar için ideal bir hayvan modelidir. Sıçanlar ayrıca perfüzyon ve kriyoprezervasyon çalışmaları da dahil olmak üzere yeni kompozit doku grefti koruma tekniklerinde yaygın olarak kullanılmaktadır. Sıçanlarda VCA için kullanılan modeller düşük postoperatif morbidite ve mortalite ile tekrarlanabilir, güvenilir ve verimli olmalıdır. Heterotopik uzuv nakli işlemleri bu kriterleri karşılar ve ortotopik uzuv nakillerine göre daha kolaydır. Kemirgen mikrocerrahi modellerinde ustalaşmak, mikrocerrahi ve hayvan bakımında sağlam bir deneyim gerektirir. Burada sıçanlarda kısmi heterotopik osteomiyokutanöz kapak naklinin güvenilir ve tekrarlanabilir bir modeli, ameliyat sonrası sonuçları ve potansiyel komplikasyonların önlenmesinin yolu bildirilmektedir.
Giriş
Son yirmi yılda, VCA yüz 1 , üst ektremite amputasyonları2, penis 3 ve diğer karmaşık doku kusurları4,5dahil olmak üzere ciddi şekil bozukluğu yaşayan hastalar için devrimci bir tedavi olarak gelişti. Bununla birlikte, yaşam boyu süren immünosupresyonun sonuçları hala bu karmaşık rekonstrüktif ameliyatların daha geniş bir uygulamasını engellememektedir. Temel araştırmalar, anti-ret stratejilerini geliştirmek için çok önemlidir. Transplantasyon lojistiğini iyileştirmek ve donör havuzunu artırmak için VCA koruma süresinin artırılması da önemlidir (VCA donörlerinin cilt tonu, anatomik boyut, cinsiyet dahil olmak üzere katı organ bağışçılarına göre daha fazla kriteri yerine getirmeleri gerektiğinden). Bu bağlamda, sıçan uzuv transplantasyonları allograftların immün reddi6,7,yeni tolerans indüksiyon protokolleri8ve koruma çalışmaları 9 ,10,11üzerinde yapılan çalışmalarda yaygın olarak kullanılmaktadır. Bu nedenle, bu VCA modelleri VCA çeviri araştırmaları için ustalaşmak için önemli bir unsurdur.
Osteomiyokutan kapaklar literatürde 8,12 ,13,14sıçanlarda VCA'yı incelemek için güvenilir modeller olarak tanımlanmıştır. Ortotopik tam ektremite transplantasyonları greft fonksiyonunun uzun süreli değerlendirilmesine izin verse de, daha yüksek postoperatif morbidite ve mortalite oranları ile ilişkili zaman alıcı bir işlemdir14. Buna karşılık, heterotopik uzuv transplantasyon modelleri işlevsel değildir, ancak VCA üzerinde tekrarlanabilir çalışmalara olanak sağlar. Postoperatif sonuçlar, sıçan VCA transplantasyon çalışması başlamadan önce güvenilir bir şekilde beklenebilir. Bu çalışmada sıçanda, üç haftalık bir takip süresi boyunca ameliyat içi ve postoperatif olarak ortaya çıkabilecek sık olası sonuçları ve komplikasyonları içeren kısmi heterototopik osteomiyokutanöz flap transplantasyon modeli raporlanmaktadır.
Protokol
Tüm hayvanlar, Laboratuvar Hayvanlarının Bakımı ve Kullanımı için NIH Kılavuzu'na uygun olarak insancıl bakım aldı. Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC-protokol 2017N000184) ve Hayvan Bakım ve Kullanım İnceleme Ofisi (ACURO) tüm hayvan protokollerini onayladı. Tüm deneyler için doğuştan erkek Lewis sıçanları (250-400 g) kullanılmıştır.
1. Cerrahi
- Lewis farelerini izofluran soluma kullanarak uyuşturun. İndüksiyon odasında % 5 izofluran ile anesteziye indükle ve nefes alma konisi yoluyla% 1.5-3 izofluran inhalasyonu ile anesteziyi koruyun.
- Sağkalım işlemlerinde ameliyattan önce göz yağı uygulayın. Cerrahi bölgeyi tıraş edin, depilatör kremle tedavi edin, ovalayın ve steril perdelerle örtün.
- Kesiden önce ve işlem sırasında düzenli olarak bir parmak sıkışma testi ile toplam anesteziyi onaylayın. Tüm prosedür boyunca kalp ve solunum hızlarını izleyin. Tüm ameliyatlar için steril aletler, malzemeler, perdeler ve eldivenler kullanarak steril koşulları koruyun. Yordamlar için kullanılan aletlerin listesi için Malzeme Tablosuna bakın.
2. Donör hakkı kısmi hindlimb tedariki
- Bacağın distal üçte biri olan ayak bileğinin üstündeki deride çevresel bir kesi yapın.
- Bipolar kümeser kullanarak saphenöz arteri ve popliteal arterin terminal dalını iskeletleştirin ve dağlayın. Tibial kemik açığa olana kadar gastrocnemius, soleus, tibialis ön ve pazı femoris kaslarını dağlayıp kesin.
- Sağ kasık kırışıklığında 2,5 cm'lik bir kesi yapın. Kasık yağ yastığını parçalara ayrıştırın ve femoral damarları açığa çıkarmak için distal olarak geri alın. Kasık bağını kavramak için bir balık kancası retraktörü kullanın ve kasık yağ yastığını distal olarak tutmak için sıkma tokaları kullanın.
NOT: Kasık yağ pedi kısmi uzuv hasadına dahil edilir. - Femoral damarları parçalara ayırın, Murphy dallarını kişiselleştirin (genellikle kasık bağı ile epigastrik dal arasında bulunan derin kaslı kollateral dallar) ve 8-0 ile ligat naylon kravatlar.
- Donör sıçanı 27,5 G iğne kullanarak penis sırt damarı içine enjekte edilen 100 IU/kg heparin ile heparinize edin.
- Kalça çevresindeki deri kesisini tamamlayın.
- Biceps femoris ve gluteus superficialis kaslarını bipolar kümesps kullanarak dağlayın. Siyatik siniri orta uyluk kemiği uzunluğunda dağlayıp kesin. Femur proksimal olarak arka femoral tepe seviyesinde ortaya çıkın.
NOT: Adductor ve kuadriseps kasları tedarikin dışında bırakılır. Zararsız pedidül korunur. - Kasık bağı seviyesinde 8/0 naylon bağları olan femoral damarları ligat. Femoral arterde ligatürün hemen altında bir arteriotomi gerçekleştirin ve 24 G anjiyo kateteri takılmasına izin vermek için genişle.
- Pedilenin altında kalan kası dağlayıp kesin, uyluk kemiğinin ön tarafını açığa çıkar.
- Kaval kemiğini ve uyluk kemiğini sırasıyla (orta uzunlukta) mümkün olduğunca proksimal ve distal olarak bir kemik kesici kullanarak kesin.
- Net bir venöz çıkış elde etmek için kısmi hindlimb'i 2 mL heparin salin (100 IU/mL) ile yıkayın. Mikrovasküler transfere kadar steril bir gazlı bezle buz üzerinde saklayın(Şekil 1).
- Hayvan genel anestezi altındayken, hayvan yaşam belirtisi göstermeden (solunum hareketi ve kalp atışı yok) ötanaziyi exsanguination ile gerçekleştirin.

Şekil 1: Sıçan kısmi hindlimb hasat edildi. Femoral artere heterotopik mikrovasküler transfere hazır 24 G anjiyokatr yerleştirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Alıcı cerrahisi
- Kesiden önce, boynun arkasını tıraş edin ve buprenorfin 0.01-0.05 mg / kg deri altından uygulanır. Sıçanı bir ısıtma yastığına supine pozisyonuna yerleştirin.
- Sağ kasık kırışıklığında 2,5 cm'lik bir kesi yapın. Kasık yağ yastığını parçalara ayrıştırın ve femoral damarları açığa çıkarmak için distal olarak yaslanın. Kasık bağını geri çekmek için bir kanca kullanın ve kasık yağ yastığını distal olarak tutmak için sıkma tokaları kullanın.
- Femoral damarları parçalara ayırın, Murphy dallarını kişiselleştirin ve 8/0 naylon bağlarla ligat edin.
- Her iki damarı da 8/0 naylon bağ kullanarak epigastrik damarların üzerinde ligat edin. Yaklaşık olarak yaklaşık kelepçeler yerleştirin ve damar uçlarını genişletin; heparin salin ile durulayın.
- Sol kanatta kalçanın üzerinde bir kesi yapın ve kasık kırışıklığına deri altı bir tünel ile deri altı bir cep oluşturun.
NOT: İçe inset kesi, hayvanın normal bir hindlimb hareketini koruduğundan emin olmak için kalçanın hareket aralığının üzerinde yapılır. Ek olarak, greft inset ve mikrovasküler transfer bölgesi arasında bir kese köprüsü tutmak greftin daha iyi sabitlenmesini sağlar(Şekil 2). - Kısmi uzuv ve kasık yağ yastığının proksimal kısmını mikrovasküler transfer için deri altı tünelinden geçirin. 10/0 naylon dikiş kullanarak venöz ve arteriyel anastomozlar gerçekleştirin. Her iki yaklaşık kelepçeyi de çıkarın ve uzuvların yeniden uzasını gözlemleyin. Her anastomozun açıklığını değerlendirmek için her iki damarda bir "sağım testi" gerçekleştirin.
NOT: Venöz anastomoz için genellikle sekiz ila dokuz dikiş, arteriyel anastomoz için ortalama 6 dikiş gereklidir. - Nakledilen uzvun medial tarafında uzunlamasına bir cilt kesisi yapın ve grefti yerleştirin. Greftin fazla derisini çıkarın ve yarayı emilebilir 4/0 dikişler kullanarak ayrı dikişler ve çalışan bir dikişle kapatın.
- Nakledilen uzuv ve alıcının kasık yağ pedlerini iki ayrı emilebilir dikiş kullanarak birlikte dikin ve mikrovasküler anastomozların son kontrolünden sonra en sonunda kasık kırışıklığını kapatın.
NOT: Kasık yağ pedleri, anastomozların üzerine koruyucu bir yağ tabakası eklemek ve greftin ve pedilesinin güvenli bir konumunu sağlamak için sıkıca dikilir. Titiz bir kapatma yara iyileşmesi için daha iyidir; ayrıca yaradan arta kalan kanamayı önler ve kendi kendini sakatlama riskini azaltır. - Perioperatif kanama miktarına göre sıvı kaybını deri altından 1-3 mL salin ile telafi edin.
- Hayvanın boynuna bir Elizabeth tasması yerleştirin ve doğru pozisyonda tutmak için cilde 2 gevşek dikiş uygulayın.
- isoflurane inhalasyonunu durdurun ve hayvanı tamamen bilinçli ve ambülatör olana kadar bir ısıtma yastığı üzerinde sürekli izleyin.
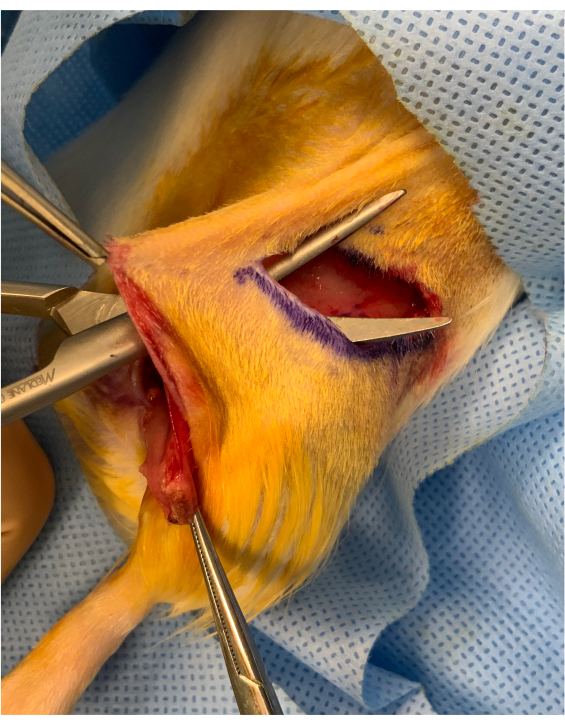
Şekil 2: Osteomiyokutanöz uzuv başlamadan önce perioperatif görüntü. Kasık kırışık kesisi ile greftin kalçanın üstündeki başlangıcı arasında yaklaşık 1 cm'lik kutanöz bir köprü korunur. Greft köprünün altına yerleştirilir ve mikrovasküler transfer için sabit tutulur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Ameliyat sonrası bakım
- Hayvanı 72 saat boyunca günde iki kez, daha sonra ameliyat sonrası güne (POD) 7'ye kadar günde bir kez ve sonra haftada iki kez izleyin.
NOT: İzleme hayvan ve greft durumuna göre ayarlanmalıdır (soluk gözler ek sıvılar, hayvan ağrısının bir göstergesi olarak porfirin lekelenmesi, anormal greft rengi / sıcaklığı) ve veteriner hekimle daha fazla bakım tartışılmalıdır. Greftin zarar görmesini önlemek için tüm çalışma süresi boyunca alıcı sıçanlar için tek muhafaza gereklidir. - IACUC yönergelerine göre buprenorfin ve/veya steroid olmayan antienflamatuar ilacın deri altı enjeksiyonu ile analjezi gerçekleştirin.
- Grefti değerlendirin ve aynı cihazı kullanarak resimlerle günlük fiziksel muayene gerçekleştirin.
NOT: Greftin cildinde epilasyon kremi kullanmak, naklin cilt rengini daha iyi değerlendirmek için faydalıdır.
Sonuçlar
Bu tek operatörlü çalışmada 30 adet singeneik heterotopik kısmi uzuv nakli yapıldı. Başarı, ameliyat sonrası 21. günde VCA yetmezliği veya ötanazi gerektiren komplikasyonların olmaması olarak tanımlandı. Greftin normal evrimi Şekil 3'tetemsil edilir. Alıcıda kısmi uzuv temini ve greft inset için ortalama süre sırasıyla 35 ve 105 dk'ydı; ortalama iskemi süresi 105 dk idi. Takip sırasında iki tip komplikasyon meydana geldi (Tablo 1)-erken veya ge?...
Tartışmalar
Kemirgenlerde ortotopik uzuv transplantasyon modelleri literatürde tanımlanmıştır15,16,17; bununla birlikte, sinir onarımı, kas yeniden takma ve femurun mükemmel bir osteosynthesis'ine ihtiyaç duyarlar, bu da çok zor bir adım olabilir. Bu modeller ayrıca kemirgenlerde daha yüksek morbidite ve mortalite oranı ile ilişkilidir14Özellikle nakledilen bir hindlimb'in normal bir işlevinin iyile?...
Açıklamalar
Yazarların hiçbir açıklaması yok.
Teşekkürler
Bu çalışma, Savunma Bakanlığı Sağlık İşleri Müsteşar Yardımcılığı tarafından Kongre Tarafından Yönlendirilen Tıbbi Araştırma Programı aracılığıyla Ödül No. W81XWH-17-1-0680. Görüşler, yorumlar, sonuçlar ve öneriler yazarların görüşleridir ve Savunma Bakanlığı tarafından onaylanmamıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 24 GA angiocatheter | BD Insyte Autoguard | 381412 | |
| 4-0 suture Black monofilament non absorbable suture | Ethicon | 1667 | Used to suture the E-collar to the back of the neck |
| 4-0 suture Coated Vicryl Plus Antibacterial | Ethicon | VCP496 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Bipolar cords | ASSI | 228000C | |
| Black Polyamide Monofilament USP 10-0, 4 mm 3/8c | AROSurgical | T04A10N07-13 | Used to perform the microvascular anastomoses |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Dissecting Scissors 15 cm, Round Handle 8 mm diameter, Straight Slender Tapered Blade 7 mm, Lipshultz Pattern | ASSI | ASSI.SAS15RVL | |
| Double Micro Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 18040-22 | |
| Elizabethan collar | Braintree Scientific | EC-R1 | |
| Forceps 13.5 cm long, Flat Handle, 9 mm wide Straight Tips 0.1 mm diameter (x2) | ASSI | ASSI.JFL31 | |
| Halsey Micro Needle Holder | Fine science tools (FST) | 12500-12 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star Elastic Stays | CooperSurgical | 3314-8G | Used to retract the inguinal ligament for femoral vessels dissection |
| Lone Star Self-Retaining Retractors | CooperSurgical | 3301G | |
| Micro-Mosquito Hemostats | Fine science tools (FST) | 13010-12 | Used to retract the inguinal fat pad distally |
| Needle Holder, 15 cm Round Handle, 8 mm diameter, Superfine Curved Jaw 0.2 mm tip diameter, without lock | ASSI | ASSI.B1582 | |
| Nylon Suture Black Monolfilament 8-0, 6.5 mm 3/8c | Ethilon | 2808G | Used to ligate collateral branches on the femoral vessels |
| Offset Bone Nippers | Fine science tools (FST) | 16101-10 | |
| S&T Vascular Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 00398-02 | |
| Walton scissors | Fine science tools (FST) | 14077-09 |
Referanslar
- Lanteiri, L., et al. Feasibility, reproducibility, risks and benefits of face transplantation: a prospective study of outcomes. American Journal of Transplantation. 11 (2), 367-378 (2011).
- Park, S. H., Eun, S. C., Kwon, S. T. Hand transplantation: current status and immunologic obstacles. Experimental and Clinical Transplantation. 17 (1), 97-104 (2019).
- Cetrulo, C. L., et al. Penis transplantation: first US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Grajek, M., et al. First complex allotransplantation of neck organs: larynx, trachea, pharynx, esophagus, thyroid, parathyroid glands, and anterior cervical wall: a case report. Annals of Surgery. 266 (2), 19-24 (2017).
- Pribaz, J. J., Caterson, E. J. Evolution and limitations of conventional autologous reconstruction of the head and neck. Journal of Craniofacial Surgery. 24 (1), 99-107 (2013).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. I. Results with syngeneic grafts. Transplantation. 35 (4), 293-299 (1983).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. II. Results with allogeneic grafts. Transplantation. 35 (4), 300-304 (1983).
- Adamson, L. A., et al. A modified model of hindlimb osteomyocutaneous flap for the study of tolerance to composite tissue allografts. Microsurgery. 27 (7), 630-636 (2007).
- Arav, A., Friedman, O., Natan, Y., Gur, E., Shani, N. Rat hindlimb cryopreservation and transplantation: a step toward "organ banking". American Journal of Transplantation. 17 (11), 2820-2828 (2017).
- Gok, E., et al. Development of an ex-situ limb perfusion system for a rodent model. ASAIO Journal. 65 (2), 167-172 (2019).
- Gok, E., Rojas-Pena, A., Bartlett, R. H., Ozer, K. Rodent skeletal muscle metabolomic changes associated with static cold storage. Transplantation Proceedings. 51 (3), 979-986 (2019).
- Brandacher, G., Grahammer, J., Sucher, R., Lee, W. P. Animal models for basic and translational research in reconstructive transplantation. Birth Defects Research. Part C, Embryo Today. 96 (1), 39-50 (2012).
- Fleissig, Y., et al. Modified heterotopic hindlimb osteomyocutaneous flap model in the rat for translational vascularized composite allotransplantation research. Journal of Visualized Experiments: JoVE. (146), e59458 (2019).
- Ulusal, A. E., Ulusal, B. G., Hung, L. M., Wei, F. C. Heterotopic hindlimb allotransplantation in rats: an alternative model for immunological research in composite-tissue allotransplantation. Microsurgery. 25 (5), 410-414 (2005).
- Jang, Y., Park, Y. E., Yun, C. W., Kim, D. H., Chung, H. The vest-collar as a rodent collar to prevent licking and scratching during experiments. Lab Anim. 50 (4), 296-304 (2016).
- Kern, B., et al. A novel rodent orthotopic forelimb transplantation model that allows for reliable assessment of functional recovery resulting from nerve regeneration. American Journal of Transplantation. 17 (3), 622-634 (2017).
- Perez-Abadia, G., et al. Low-dose immunosuppression in a rat hind-limb transplantation model. Transplant International. 16 (12), 835-842 (2003).
- Sucher, R., et al. Orthotopic hind-limb transplantation in rats. Journal of Visualized Experiments. (41), e2022 (2010).
- Fleissig, Y. Y., Beare, J. E., LeBlanc, A. J., Kaufman, C. L. Evolution of the rat hind limb transplant as an experimental model of vascularized composite allotransplantation: Approaches and advantages. SAGE Open Medicine. 8, 2050312120968721 (2020).
- Lindboe, C. F., Presthus, J. Effects of denervation, immobilization and cachexia on fibre size in the anterior tibial muscle of the rat. Acta Neuropathologica. 66 (1), 42-51 (1985).
- Nazzal, J. A., Johnson, T. S., Gordon, C. R., Randolph, M. A., Lee, W. P. Heterotopic limb allotransplantation model to study skin rejection in the rat. Microsurgery. 24 (6), 448-453 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır