Method Article
Ökaryotik Hücrelerden Çeviri Komplekslerinin Hızlı In Vivo Fiksasyonu ve İzolasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Canlı maya ve memeli hücrelerinde formaldehit çapraz bağlama ile çevirisel (protein biyosentez) kompleksleri hızla stabilize etmek için bir teknik sunuyoruz. Yaklaşım, geçici ara maddelerin ve dinamik RNA:protein etkileşimlerinin parçalanarak parçalanmasını sağlar. Çapraz bağlantılı kompleksler, derin sıralama tabanlı profil oluşturma yöntemleri, mikroskopi ve kütle spektrometresi gibi birden fazla aşağı akış uygulamasında kullanılabilir.
Özet
Messenger(m)RNA'nın hızlı bir şekilde yeniden dağıtılmasını ve mRNA çevirisinin değiştirilmesini içeren hızlı yanıtlar, hücrelerin devam eden homeostatik ayarlamalarıyla ilgilidir. Bu ayarlamalar, dalgalanan besin ve tuzluluk seviyeleri, sıcaklık ve çeşitli kimyasal ve radyasyon stresleri sırasında ökaryotik hücrenin hayatta kalabilmesi ve 'hasar kontrolü' için kritik öneme sahiptir. RNA düzeyindeki yanıtların son derece dinamik doğası ve RNA:RNA ve RNA:protein aralarının çoğunun kararsızlığı nedeniyle, sitoplazmik RNA durumunun anlamlı bir anlık görüntüsünü elde etmek ancak sınırlı sayıda yöntemle mümkündür. Transkriptome çapında, RNA-seq tabanlı ribozom profilleme tipi deneyler çevirinin kontrolü için en bilgilendirici veri kaynakları arasındadır. Bununla birlikte, tek tip bir RNA ve RNA:protein ara stabilizasyonunun olmaması, özellikle hızlı hücresel yanıt yollarında farklı önyargılara yol açabilir. Bu makalede, RNA ve RNA:protein ara stabilizasyonuna yardımcı olmak için farklı geçirgenliğe sahip ökaryotik hücreler için geçerli olan hızlı fiksasyonun ayrıntılı bir protokolünü sunuyoruz. Ayrıca stabilize RNA:protein komplekslerinin ribozomal ve poli(ribo)somal fraksiyonlarla birlikte çökeltilmesine dayalı izolasyon örnekleri sunuyoruz. Ayrılmış stabilize malzeme daha sonra Çeviri Karmaşık Profil dizilimi (TCP-seq) yaklaşımı ve türevleri gibi ribozom profil oluşturma türü deneylerin bir parçası olarak kullanılabilir. TCP-seq tarzı yöntemlerin çok yönlülüğü artık çeşitli organizmalarda ve hücre türlerinde uygulamalar tarafından gösterilmiştir. Stabilize kompleksler ayrıca benzeşim saflaştırılabilir ve elektron mikroskopisi kullanılarak görüntülenebilir, farklı poli (ribo)somal fraksiyonlara ayrılabilir ve çapraz bağlantının tersine çevrilmesinin kolaylığı nedeniyle RNA dizilimine tabi tutulabilir. Bu nedenle, sedimasyon bazlı veya diğer RNA:protein kompleksi zenginleştirme türüne dayanan snap-chilling ve formaldehit fiksasyonuna dayanan yöntemler, canlı hücrelerdeki hızlı RNA:protein kompleksi dinamiklerinin daha ince ayrıntılarını araştırmak için özellikle ilgi çekici olabilir.
Giriş
Canlı organizmalar, yaşamları boyunca homeostazı korumak ve hayatta kalmayı sağlamak için hızlı yanıtlar gerektiren dinamik hücre içi ve hücre dışı değişikliklere maruz kalırlar. Çevresel adaptasyona izin vermek için ökaryotik hücreler gen ekspresyon kontrolü ile metabolizmalarını ayarlarlar. Gen ekspresyon kontrolü transkripsiyon ve/veya çeviri sırasında yapılabilir; çeviri yanıtları genellikle daha hızlımeydanagelen 1,2,3,4. Örneğin, çevirisel değişiklikler genellikle stres başlangıcından 1-30 dakika içinde ortaya çıkarken, transkripsiyon düzeyindeki değişiklikler strese maruz kalma3,4,5'den saatler sonra takip gelir. Çeviri çıktısındaki değişiklikler, haberci (m)RNA moleküllerinin sitoplazmadaki kalıcı kullanılabilirliği nedeniyle daha hızlı bir şekilde elde edilir. Tersine, transkripsiyon seviyesinde, yeni mRNA molekülleri sentezlenmeli ve ökaryotlarda, çekirdekten işlenmeli ve ihraç edilmeli ve yanıt süresi2, 4 ,6,7,8'debüyük gecikmeler üretilmelidir.
Strese akut çevirisel yanıt genellikle hücre sağkalımı için gerekli proteinlerin seçici olarak yukarı doğruülmesi ile çeviri çıktısında genel bir azalma ile karakterize edilir.1,3,4,9. Protein üretim üretiminin azaltılmasının, prosesin yüksek enerji gideri nedeniyle çok önemli olduğu düşünülmektedir.3,7. Seçici inhibisyon ve upregülasyonu kolaylaştırmak için, çevirisel yanıtlar bir dizi karmaşık düzenleyici mekanizma tarafından servis edilir. Düzenleme çevirinin tüm aşamalarında uygulanabilir: başlatma, uzama, polipeptid biyosentezinin sonlandırılması ve ribozomal geri dönüşüm10,11,12,13, ancak başlatma aşamasında en güçlü şekilde sergilendi5,7,9,10,13. Başlatma sırasında, ökaryotik başlatma faktörlerinin (eIF' ler) yardımıyla küçük ribozomal alt bira (SSU), bir başlangıç kodonu tanınana kadar mRNA'nın 5' çevrilmemiş bölgesine (UTR) bağlanır ve tarar2,5,6,8,11,12,13. Düzenleyici mekanizmalar genellikle bağlanmayı, taramayı ve kodon tanımayı başlatan eIF'leri hedefler. Örneğin, başlatıcı Met-tRNA'nın işe alınmasına yardımcı olan temel bir çeviri faktörü olan eIF2 başlatma faktörüiMet SSU'ya, stres koşulları altında ökaryotlarda sıklıkla hedef edilir4,6,11. Mayada, bu faktörün fosforilasyonu besin yoksunluğu ve ozmotik stres altında indüklenebilir.1,4,11,14,15ve memeli hücrelerinde amino asit açlığı, endoplazmik reticulum (ER) stresi, UV stresi, viral enfeksiyon ve değiştirilmiş oksijen seviyeleri bu yanıtı tetikleyebilir8,9,11. Spesifik mRNA çevirisinin hızlı bir şekilde yukarılanması, hipoksiye karşı memeli hücre yanıtında belirgindir, bu da hipoksi indüksiyonunun ve hipoksi-indükleyici faktörlerin (HIF' ler) biyosentezinin seçici olarak yukarılasyonunu gösterir. HIF'ler transkripsiyon faktörleridir, bu da DNA transkripsiyon düzeyinde daha uzun süreli hücresel yeniden programlamayı ortaya çıkarır8,9,16. Isı stresi altındaki mayada da benzer tepkiler gözlenmiştir, Isı Şok Proteinlerinin (HSP' ler) hızlı çevirisel ekspresyonu ve ardından gecikmiş transkripsiyon seviyesi yanıtları17,18. Besin yoksunluğu ve ısı şokuna ek olarak, mayadaki çevirisel yanıtlar değişen oksijen altında incelenmiştir.8,19tuzluluk5, fosfat, kükürt20,21 ve azot22,23 Düzey. Bu araştırmanın mayanın endüstriyel kullanımları üzerinde pişirme ve fermantasyon gibi yaygın etkileri vardır.24,25. Çevirisel yanıtlar, oksidatif stres gibi hücre içi streslerle karakterize olan nörodejeneratif bozukluklar ve kalp hastalıkları gibi hastalıkların anlaşılmasında da etkili olabilir. Genel olarak, çevirisel yanıtlar gen ekspresyon kontrolünün ayrılmaz bir parçası ve ökaryotik organizmalarda çok çeşitli stres koşullarına hızlı adaptasyonu kolaylaştırır.
Çeviri yanıtlarını incelemek için, çeviri ortamının en az bozuk anlık görüntülerini sağlayan yöntemler gereklidir. Polisome profilleme, mRNA genelinde çeviri çalışmasında kullanılan, mRNA'nın poli(ribo)somal fraksiyonlarının sakkaroz gradyanları26,27aracılığıyla ultrasantrifüjleme yoluyla ayrılmasını içeren klasik bir yaklaşımdır. Yaklaşım, bireysel mRNA'lar için çeviri düzeylerini (ters transkripsiyon ve polimeraz zincir reaksiyonu, RT-PCR26gibi algılama yöntemleriyle) veya küresel olarak yüksek verimli tekniklerle (microarray veya RNA-seq28,29)birlikte araştırmak için kullanılabilir. Daha gelişmiş bir yaklaşım ribozom profillemedir, bu da mRNA molekülü boyunca bir mRNA molekülü boyunca uzun ribozomların genom çapında pozisyonlarının incelenmesine ve ayrıca transkriptom genelinde çevirinin verimliliğinin çıkarımına ve ana ve alternatif başlangıç sitelerinin kullanımına izin verir30,31. Ribozom profilleme, üzerlerinde ribozomal varlıkla korunan mRNA parçalarının izolasyonu ve dizilimini içerir. Ribozom profilleme, hipoksik stres, ısı şoku ve oksidatif stres31,32dahil olmak üzere bir dizi koşulda çeviri dinamikleri hakkında önemli bir fikir sağlamıştır. Teknik, maya ve memeli hücreleri de dahil olmak üzere birden fazla kaynak malzeme türüne uyarlanmıştır.
Polisome ve ribozom profilleme, çevirideki araştırma yeteneklerini genişletmede temel olsa da, çeviri süreci bu yöntemlerle yakalanması zor çeşitli çeviri ara ve komplekslerini içerir11,13. Ek bir sınırlama, çeviri kompleksleri belirli çeviri inhibitörlerinin (antibiyotikler) eklenmesiyle in vivo olarak stabilize edildiğinden, belirli ribozom dağıtım eserlerine yol açtığından veya hücre lizisinde özellikle (antibiyotikler) veya spesifik olmayan (yüksek tuz veya magnezyum iyonları) eks vivo olduğundan, daha kısa ömürlü veya daha az kararlı ara33'ün yoksunluğuna yol açan hızlı yanıt türlerini inceleme yeteneğinin eksikliğindenkaynaklanmaktadır. 34,35.
Formaldehit, kromatin immünöteritasyon (ChIP) ve çapraz bağlantı immün önkupitasyon (CLIP) çalışmaları gibi nükleik asitleri ve proteinleri çapraz bağlamak için yaygın olarak kullanılır. Küçük boyutu ve mükemmel hücre geçirgenliği hızlı bir in vivo eylem sağlar36. Hızlı formaldehit çapraz bağlamaya dayanarak, ribozom profil oluşturma yaklaşımı Çeviri Kompleksi Profil Sıralaması (TCP-seq)10, 36,37 , 38,39,40ile genişletilmiştir. İlk olarak mayada geliştirilen TCP-seq, tarama veya sonlandırma sonrası SSU kompleksleri ve birden fazla ribozomal yapılandırma37 , 38,41,42dahil olmak üzere tüm çeviri aralarınınyakalanmasınısağlar. Yöntem çeşitli çalışmalarda kullanılmıştır10,38,39,41,42, bazıları çevirinin tutuklanmasını kolaylaştırmak için hem çeviri inhibitörlerinin hem de formaldehit çapraz bağlantısının kombinatoryal yaklaşımını kullanır. Tekniğin başka bir değiştirilmiş sürümü olan seçici TCP-seq39,son zamanlarda TCP-seq uygulamalarının kapsamını genişleterek çapraz bağlantılı komplekslerin immünpurifikasyonunu dahil etmek için sunuldu. Formaldehit çapraz bağlantısının hızlı, verimli ve geri dönüşümlü doğası, bu yaklaşımları geçici mRNA:çeviri karmaşık etkileşimlerini, özellikle de son derece dinamik çeviri düzeyinde yanıt yolları bağlamında incelemek için uygun hale getirir.
Burada, kapsamlı çeviri karmaşık stabilizasyonu ve izolasyonu amacıyla in vivo formaldehit çapraz bağlama süreçlerini detaylandırıyoruz. Maya ve memeli hücreleri için nüanslı ayrı protokoller sağlıyoruz (Şekil 1). Ayrıca, çapraz bağlantı stabilize malzemenin(Şekil 1),immünblotting (batı blotting), immün destekli saflaştırma (veya 'immün önseçikleme' kullanılarak birlikte saflaştırılmış protein faktörü tespiti gibi) kullanımının örneklerini özetliyoruz; IP) ve belirli ilgi faktörleri, elektron mikroskopisi ve RNA dizilimi içeren çeviri komplekslerinin zenginleştirilmesi.
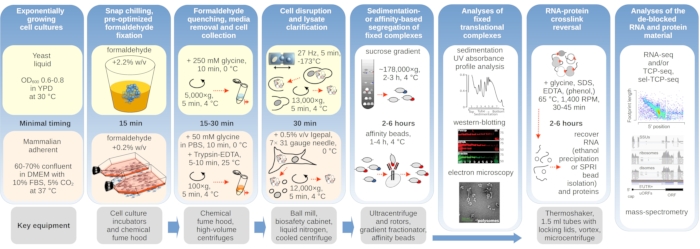
Şekil 1: Tipik deneysel kuruluma genel bir bakış gösteren şematik. Çeviri komplekslerinin in vivo formaldehit stabilizasyonunun ana adımları, gerekli temel araçlar hakkında bilgilerle desteklenmiş bir akış çizelgesi olarak tasvir edilir. Çapraz bağlantılı malzemenin potansiyel aşağı akış uygulamaları, RNA'nın SPRI boncuk saflaştırılması, RNA dizilimi ve kütle spektrometresi gibi bu protokolde başarıyla kullanılan ancak doğrudan kapsanmayan örnekler de dahil olmak üzere özetlenmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
1. Maya hücresi protokolü
- Maya hücre kültürü ve fiksasyonu
NOT: Hücre sabitleme vehasat, değişikliklerle 10,38'denuyarlanmıştır.- Uygun ortamda 600 nm'de (OD 600) 0,05 AU'dan fazla olmayan başlangıç optik yoğunluğuna sahip bir orbital çalkalayıcıda 1L maya hücre kültürünü (vahşi tip (WT) BY4741 örnek olarak verilmiştir, peptonun %2'si, dekstrozun %2'si (glikoz), 40 mg/L adenin sülfat (YPD) örnek olarak kullanılır) istenilen koşullarda (30 °C bunda kullanılır) deney).
- Maya hücrelerinin sıvı süspansiyon kültürünü peletleme için uyumlu rotor ve santrifüj şişeleri ile bir hazırlık santrifüjü kurun. Glikoz açlığı deneyleri için, 600 nm'de (OD 600) 0.6-0.8 AU optik yoğunluğuna ulaşıldıktan sonra,30° C'de kısa bir santrifüjleme kullanarak, 1 dakika boyunca 5.000 x g hücreyi peletin.
NOT: Büyüyen hücrelerin OD kaydını tutun ve üstel büyüme aşaması ilgi çekiyorsa, OD600 0.6-0.8 AU'ya ulaşana kadar hücrelerin büyümesine izin verin. - Peletin hemen sıcak (30 °C) YP ortamlarında tekrar çalıştırın, hiç veya düşük (%0,25 w/v) ilave glikoz ve yörüngesel bir çalkalayıcı-inkübatörde kültürü 30 °C'de 10 dakika daha kuluçkaya bırakın.
NOT: Ortam kompozisyonu sonraki çapraz bağlantı verimliliğini etkileyebilir. Bu iletişim kuralı yalnızca YPD kullanılarak sınanmıştır. Açlık deneyleri yaparken, zamanlamaya bağlı kalmak ve prosedürler arasındaki gecikmeleri en aza indirmek kritik öneme sahiptir. - Hücreler hazır olduğunda, duman kaputunun içine 250 g temiz ezilmiş su buzu içeren bir beher ile bir buz kutusu kurun. Kaputun içinde 25 mL şeritler ve yeni satın alınan metanol stabilize edilmiş %37 w/v formaldehit çözeltisinin erişilebilir olduğundan emin olun. 1 L kültürünü% 25 w / v ezilmiş su buzu içeren behere dökün.
NOT: Aksi belirtilmedikçe, hücreler dondurulana kadar sonraki tüm işlemler boyunca hücreleri buzda tutun. - %2,2 w/v'lik son konsantrasyona %37 w/v formaldehit çözeltisinin 75 mL'sini ekleyin ve buz eriyene kadar karışımı yoğun bir şekilde karıştırın.
- Buz eridikten sonra, 10 dakika boyunca bir zamanlayıcı kurun.
NOT: Tekrarlanabilir sabitleme sonuçları elde etmek için önerilen zamanlamalara ve sıcaklık rejimine uyun. - 10 dakika kuluçkaya yatırıldıktan sonra, kültürü önceden soğmuş santrifüj şişelerine aktarın ve hücreleri 4 °C'de santrifüjleme, 5.000 x g'da 5 dakika boyunca peletlayın. Bu dönüş açıkken, 50 mL'lik bir tüpü öncool ve taze hazırlanmış tampon A'yı (kalan formaldehitleri nötralize etmek için glisin içeren) buz üzerinde tutun.
NOT: Tam arabellek bileşimleri için sağlanan tabloya bakın. - Santrifüjlemeden sonra, santrifüj tüplerini buzla temas eden pelet tarafı ile buza yerleştirin. Tüpleri duman kaputuna getirin ve süpernatantı formaldehit atık kabına atın.
- Hücre peletini 25 mL şerit kullanarak ve 50 mL'lik bir tüpe aktararak tüm tüplerden 20 mL tampon A'da yeniden atın.
NOT: Bu yıkama, irreproducible çapraz bağlantıyı önlemek için kritik öneme sahiptir ve tampon ilavesi hücrelerin hasadından 20 dakikayı geçmemelidir. - A tamponu ile hacmi 40 mL'ye kadar çıkarın ve yıkanmış hücreleri 4 °C'de santrifüjleme ile toplayın, 5 dakika boyunca 5.000 x g.
- Herhangi bir glisin kontaminasyonunu gidermek için süpernatant atın ve hücre peletini glisin içermeyen A tamponu olan 40 mL tampon A1'e yeniden atın.
- Pelet hücreleri tekrar 4 °C'de santrifüjleme ile, 5 dakika boyunca 5.000 x g.
- A1 tamponu ile yıkamaları bir kez daha tekrarlayın. Süpernatant atın ve hücre peletini buza yerleştirin. Tüpü peletle tartın (ıslak hücre kütlesi hücre kültürünün 1 L'si başına ~1 g olmalıdır).
- Maya hücresi bozulması ve sitozol toplama
- Alüminyum folyo ile kaplı bir polistiren köpük kutusunu sıvı azotla yaklaşık 3 cm derinliğe kadar doldurun. Kutuya 50 mL'lik bir tüpü dik yerleştirin.
- Peleti (~1 g ıslak hücre kütlesi) 10 sn boyunca pipetleme ve girdaplama ile 550 μL tampon A2'de yeniden depola. 10 sn için 10 μL 40 U/μL RNaz inhibitörü ve girdap ekleyin.
DİkKAT: Sıvı nitrojeni kullanırken termal yalıtımlı eldivenler gibi uygun koruyucu ekipmanları giyin. Sıvı nitrojeni tutmak için kullanılan herhangi bir kabın sızmamasını ve içindeki tüp rafın yukarı yüzmemesini veya yan yata düşmemesini sağlayın. Oksijen tükenmesini önlemek için iyi havalandırılmış bir alanda çalışın. - 1 mL pipet kullanarak, hücre süspansiyonu sıvı nitrojen içeren 50 mL tüpe damlatın.
NOT: Damlacıkların toplanmasını önlemek için damlama yavaş ve dikkatli bir şekilde yapılmalıdır. Yeni damlacıkları tanıtmadan önce damlacıkların donduğundan emin olun. - Donmuş hücre süspansiyon damlacıkları ile 50 mL tüpü oda sıcaklığına aktarın ve sıvı nitrojen tamamen buharlaşana kadar bekleyin. Tüpü kapağıyla kapatın ve hücre peletlerini -80 °C'de saklayın veya hemen devam edin.
DİkKAT: Tüpü kapatmadan önce sıvı nitrojenin tamamen buharlaştığından emin olun. Kapalı bir tüpte kalan sıvı nitrojen, tehlikeli bir basınç birikmesine neden olabilir. - Bir sonraki adıma hazırlanmak için, kuru buz üzerinde 1,5 mL çekirdeksiz tüpler ve 10 mL paslanmaz çelik taşlama kavanozları ön soğutma.
- Donmuş hücre süspansiyon damlacığı temiz, steril bir spatula kullanarak kavanozlara aktarın.
DİkKAT: Taşlama kavanozlarının sıkıca kapatıldığından emin olun. - Taşlama kavanozlarını sıvı nitrojene 1 dakika batırın ve sıvı fazın bağlantının altında kalmasını sağlayın. 1 dakika boyunca ajitasyon için 27 Hz'de bir kriyo mikser değirmeni kurun.
NOT: Numune işleme için yalnızca bir kutu gerektirse bile, taşlama tenekesini her zaman aynı modelden biriyle dengeleyin. - Mühürlü öğütme kavanozlarını mikser değirmeninde 1 dakika boyunca 27 Hz'de ajite edin.
- Öğütme kavanozlarını daha önce olduğu gibi sıvı nitrojende yeniden soğutun ve mikser değirmeninde 1 dakika daha 27 Hz'de çalkalayın.
- Kavanozları 1,5 mL nükleaz içermeyen tüplerle birlikte kuru buz içeren buz kutusuna aktarın. Küçük bir çelik spatula kullanarak, elde edilen toz numuneyi ~100 mg aliquots'taki tüplere aktarın ve tüpleri -80 ° C'de saklayın.
NOT: Polisome sedimrasyon profil analizi, sitozolün çevrilmiş ve çevrilmemiş fraksiyonlara ayrılması ve çevrilen fraksiyonun RNaz sindirimi üzerine SSU, ribozom ve disome fraksiyonlarına daha fazla ayrılmasından oluşan deney başına ~600 mg numune kullanılması önerilir.
- Sabit (poli)ribozomal komplekslerin sitozol çevrilmemiş fraksiyonlarından ayrılması
NOT: Daha önce oluşturulan prosedür10,38genellikle çevrilmiş RNA'yı (poli)ribozomlarla birlikte sedimmentasyonuna göre zenginleştirmek için takip edilir. Çevrilmiş ve çevrilmemiş sitozol fraksiyonlarını ayırmak için daha rafine bir yaklaşım burada tanıtılarak malzemenin çökeltme ve daha sonra yeniden çözünürlüğe getirilmesi ihtiyacı ortadan kaldırılmaktadır.- İnce duvar ultrasantrifüj tüplerinde (5 mL, 13 x 51 mm) dondurma-çözme yöntemi 43 kullanarak B tamponu ile2,5 mL doğrusal %10-%20 w/v sakkaroz gradyanları hazırlayın.
NOT: Dondurarak çözme yöntemi, tamponlanmış sakkaroz katmanlarının sıralı olarak eklenmesi ve dondurulması ile üst üste doğrusal olarak gerileyen konsantrasyonlarla gerçekleştirilir. Ayrıntılar için Ek Tablo 1'e bakın. - Süreksiz bir %50 w/v sakkaroz yastığı oluşturmak için, doğrusal gradyanların çözülmesi ve stabilize etmesi üzerine, 19 G x 1,5" iğneye bağlı 1 mL şırınga veya benzer/uygun boyutlarda bir cam kılcal damar kullanarak B tamponunda % 50 sakkarozun 0,5 mL'sini yavaşça tüplerin altına dağıtın. Dağıtmadan önce, önceden oluşturulmuş sakkaroz gradyanlarının üstünden altına iğnenin veya kılcal damarın ucunu dikkatlice ve yavaşça sürün, herhangi bir rahatsızlıktan kaçının, tüp tabanına ulaşana kadar.
NOT: B tamponunun hazırlanmasıyla ilgili yönergeler için Ek Tablo 1'e bakın. - Üst kısımları çıkararak veya B tamponunda 10 w/v'den fazla sakkaroz katlayarak degradeleri dikkatlice dengeleyin ve buz gibi veya 4 °C'de tutun.
NOT: Tüp duvarına çökeltmeden daha yüksek sedimentasyon oranına sahip malzemeyi toplamak için alttaki % 50 sakkaroz tabakasına sahip süreksiz gradyana ihtiyaç vardır. - Donmuş hücre toz örneğinin ~100 mg'ını oda sıcaklığında çözün ve hemen buza yerleştirin. Pipetleme ile 150 μL tampon A2 karıştırın, 1 U / μL'ye RNaz inhibitörü ekleyin ve 10 s boyunca girdapla karıştırın (aşırı köpürmeyi ve gaz fazı ile karıştırmayı önleyin).
NOT: Aksi belirtilmedikçe, malzemeyi buzda tutarken tüm işlemlere devam edin. - Tüpleri 4 °C, 13.000 x g'da 5 dakika boyunca santrifüj ederek hücre kalıntılarını peletin ve 1,5 mL'lik yeni bir düşük protein bağlama tüpünde netleştirilmiş süpernatantı (~150 μL) geri kazan.
- Elde edilen netleştirilmiş karışımı 1.3.3 adımından itibaren süreksiz sakkaroz gradyan tüplerine yükleyin ve dikkatlice dengeleyin.
- Tüpleri 4 °C'de orta hacimli salıncak kovası rotorunda ultrasantrifüj, ortalama g kuvveti 287.980 x g (k-faktör 49) ile 1 saat 30 dk.
NOT: Bu koşullar, serbest (poli)ribozomal) SSU'ları ve LSU'ları (büyük ribozomal alt cin) korumak için önceden optimize edilmiştir (post-ultracentrifugation gradyan UV absorbans izleme analizi kullanılarak) gradyanın üst kısmında (%10-%20 sakkaroz) (poli)ribozomal fraksiyonu altta yoğunlaştırırken (%50) malzemeyi peletlemeden sakkaroz yastığı. - Çevrilen sitozol fraksiyonunu toplamak için 19 G x 1,5" iğne ile donatılmış yeni bir steril 1 mL şırınga kullanın. 5 mL gradyanı, tüpün tabanının görünür olmasını sağlamak için sabit bir rafa yerleştirin.
- Tüpün üstünden, iğneyi doğrudan degradenin dibine sokun (tüpü delmeden) ve hafifçe, herhangi bir kabarcık oluşturmadan, çevrilmiş RNA havuzunu içeren alt çözeltinin tam olarak 0,5 mL'lik bir kısmını çizin.
NOT: Bu adımın soğuk bir odada gerçekleştirilmesini ve tüpün sıkıca tutulmasını sağlayın. Degradenin bozulmasını önlemek için 0,5 mL'nin tamamının tek bir yukarı vuruş hareketiyle çizılması önerilir. - (Poli)ribozomal varlığı ve elde edilen karışımdaki SSU, LSU ve daha hafif fraksiyonların tükenmesini, ultrasantrifüjleme çalışmasında sakkaroz gradyanının absorbans okuması ile onaylayın.
- Toplanan çevrilmiş RNA havuzunu önceki adımdan 100 μL'ye, 10 kDa kesilmiş selüloz membranlı bir mikro konsantrasyon cihazında ultrafiltrasyon kullanarak konsantre edin.
NOT: Mikro konsantrasyon cihazının zarını 0,5 mL tampon 1 ile önceden yıkayın (bkz. Şekil 2a)ve üretici tarafından önerilen döndürme koşullarını (g) kullanın. - Malzemeyi önceki adımdan beş kez daha seyreltin (tampon 1 ile 400 μL ekleyin) ve daha küçük bir hacmin yanı sıra sakkarozun kısmen çıkarılmasına izin vermek için 200 μL'ye geri konsantre olun.
NOT: Elde edilen karışımların -80 °C'de 6 aya kadar saklanması ve 'toplam çevrilmiş RNA' RNA-seq kütüphane yapısı veya TCP-seq kitaplık konstrüksiyonunun RNaz sindirim adımı için giriş malzemesi olarak kullanılması önerilir. 'Çevrilmemiş' sitozol fraksiyonu, benzer bir prosedür kullanılarak degradenin üstünden kurtarılabilir ve -80 °C'de saklanabilir.
- İnce duvar ultrasantrifüj tüplerinde (5 mL, 13 x 51 mm) dondurma-çözme yöntemi 43 kullanarak B tamponu ile2,5 mL doğrusal %10-%20 w/v sakkaroz gradyanları hazırlayın.
- Sabit (poli)ribozomal komplekslerin RNaz sindirimi ve sindirilen malzemenin küçük ribozomal alt birliğe (SSU), monoribozomal (ribozomlar, RS) ve diribozomal (disomes, DS) fraksiyonlarına ayrılması
NOT: Yordam genellikle daha önce açıklanan bir yaklaşımı izler10,38ancak üç yalıtılmış kesirde de en iyi çözünürlüğü elde etmek için değiştirilmiş bir degrade türü, ayırma süresi, ivmelenme ve RNaz sindirim koşulları kullanılır.- Adım 1.3.1'de açıklandığı gibi 43 dondurarak çözme yöntemini kullanarak 13 mL ince duvar polipropilen tüplerinde 1'de 1 tampon ile yapılan 12,5 mL doğrusal%10-%40 w/v sakkaroz gradyanlarını dikkatlice dengele ve burada not edin.
- Oda sıcaklığında çözün ve örnekleri hemen buza aktarın veya konsantre ve sakkaroz tükenmiş çevrilmiş sitosol fraksiyonunu adım 1.3.12'den alın.
NOT: Aksi belirtilmedikçe tüm prosedürlere buz üzerinde devam edin. - Çevrilen sitozol fraksiyonunu, 23 °C'de 30 dakika boyunca kesirin 1 OD260 birimi başına 4,5 U E. coli RNase I'de karıştırarak sindirin. RNase I'i devre dışı bırakmak için karışıma RNase I'i 0,25 U/μL'ye inaktive edebilen RNase inhibitörini hemen ekleyip karıştırın.
NOT: RNase I'i inhibe edebilen RNaz inhibitörü kullanın. - Örnekleri hemen buza aktarın.
DİkKAT: Önerilen sindirim koşullarına uymak ve eklenen RNase I miktarını dikkatlice ölçmek önemlidir. Burada atıfta bulunulan RNase I ünitesi, 37 °C'de 30 dakika içinde fare karaciğeri RNA'sından 1 μg asit çözünür malzeme üretmek için gereken enzim miktarı olarak tanımlanır. Enzim stoğu çok konsantreyse, çözeltinin çok küçük hacimlerini pipetlemekten kaçınmak için tampon 1 ile seyreltilmesi önerilir. - Reaksiyon karışımlarını adım 1.4.1'den %10-%40 w/v sakkaroz gradyanlarına yükleyin.
NOT: Degrade başına 150-300 μL aralığında son hacimleri kullanın. Her saflaştırma en az iki degrade gerektirir. Optimum ayırmayı elde etmek için malzemenin farklı giriş hacimlerini (DS için daha düşük AU260,10-11 AU 260ve nispeten daha yüksek AU260, 13-14 AU260, SSU veya RS için) kullanın. - Tüpleri 4 °C'de orta hacimli salıncak kovası rotorunda ortalama g kuvveti 178.305 x g (k-faktörü 143,9) ile 3 saat 30 dakika boyunca ultracentrifuge edin.
DİkKAT: Yedek denge tüplerine ihtiyaç duyulursa, kütle ve kütle dağılımlarını numune içeren tüplerle eşitleyin. Tekdüze sakkaroz konsantrasyonuna sahip tüpler değil, numune kaplamasına eşdeğer bir miktar tampon ile kaplanmuş yedek sakkaroz gradyanları kullanın. - 0,2 μm filtreli ağır kovalama çözeltisini (örneğin, burada kullanıldığı gibi deiyonize suda% 60 sakkaroz) deplasman pompasına doldurmak da dahil olmak üzere, ultracentrifugation spin tamamlanmasından en az 30 dakika önce bir gradyan fraksiyonatör cihazı kurun.
NOT: Deiyonize su kullanarak fraksiyonatörün hatlarının ve borularının kirletilmesi, ardından deiyonize suda% 1-2 SDS çözeltisi, deiyonize su ve son olarak çalıştırmalardan önce ve sonra deiyonize su çözeltisinde% 80 etanol kullanılması önerilir. - Absorbans okuma taban çizgisini, önce sistemi deiyonize suyla doldurarak ve üreticinin önerilerine göre optikleri sıfırlayarak ve daha sonra numune tüpleriyle aynı tamponla yapılan yedek bir boşaltılmış 14 x 89 mm sakkaroz gradyanı kullanarak taban çizgisi kaymasını telafi ederek ayarlayın (örneğin, tampon 1).
NOT: 1,5 mL/dk gibi örnek okumayla ilgili ayarlamaları yapmak için aynı yer değiştirme hızını kullanın. - Dedektörün optik yoluna giren ve ilk olarak fraksiyon toplayıcı çıkışında görünen çözelti arasındaki süreyi doğru bir şekilde sayarak yer değiştirme sistemi ölü hacmini ölçün.
NOT: Önerilen 1,5 mL/dk hız ile kesirleme oda sıcaklığında yapılabilir. Toplanan fraksiyonların hemen buz üzerine aktarılması önerilir. - Numunelerin beklenen sedimasyon pozisyonuna ve absorbans profiline göre 254 nm, 1,5 mL/dk yer değiştirme hızında canlı absorbans okuma ve sıralı fraksiyon algılama kullanarak kesirleme gerçekleştirin. Daha önce ölçüldüğü gibi ölü hacme karşılık gelen bir zaman gecikmesi ile kollektör tüpü anahtarlama kullanın.
- SSU, RS ve DS komplekslerinin konumlarına ve hareketliliğine karşılık gelen fraksiyonları izole edin ve bunları yeni düşük protein bağlayıcı 1,5 mL mikrosantrifüj tüplerine toplayın; izole edilmiş fraksiyonları hemen buz üzerine aktarın ve hemen işlenmezse dondurun.
NOT: Toplanan fraksiyonların kuru buz veya sıvı nitrojende derhal flaşla dondurulması ve -80 °C veya altında 6 aya kadar saklanması önerilir.
- RNA-seq kitaplıkları oluşturmak için ribozomal komplekslerin çapraz bağlantısının kaldırılması ve RNA'nın izolasyonu
- Çapraz bağlantıları bloke etmek/tersine çevirmek ve RNA'yı ilişkili proteinlerden uzaklaştırmak için, tüm sakkaroz gradyan fraksiyonlarının yaklaşık yarısını kapak emniyeti / kilitleme cihazlarıyla yeni düşük nükleik asit bağlayıcı nükleaz içermeyen polipropilen 1,5 mL mikrosantrifüj tüplerine (tüp başına 350 μL) aktarın.
- Karışımları 40 μL%100 durdurma çözeltisi (%10 SDS w/v ve 100 mM EDTA), 4 μL 1 M Tris-HCl pH 2 ile 25 °'de destekleyin C (10 mM'ye), 1,6 μL 2,5 M glisine (10 mM'ye) ve 400 μL'lik son hacmi elde etmek için deiyonize nükleaz içermeyen su.
- Boruların içeriğini pipetleme ile karıştırın ve tüpleri oda sıcaklığında aktarın.
- Her tüpe asidik fenol:kloroform:izoamil alkol 125:24:1 (pH 4.0-5.0) karışımının eşit hacmini ekleyin. Maksimum hıza ayarlanmış bir girdap karıştırıcı kullanarak karışımları 2 dakika boyunca kuvvetlice çalkalayın.
DİkKAT: Fenol ve kloroform aşındırıcı ve toksiktir. Sıvılarla fiziksel temastan kaçının ve iyi havalandırılmış bir alanda veya duman kaputunun altında çalışın. Fenol veya kloroform ile çalışırken her zaman eldiven, laboratuvar önlüğü ve koruyucu gözlük veya yüz siperliği kullanın. - Tüpleri bir termoşakere yerleştirin ve 30 dakika boyunca 65 °C, 1.400 rpm'de sürekli sallayın.
- Karışımı oda sıcaklığında 10 dakika boyunca 12.000 x g'da santrifüj ederek faz toplamayı kolaylaştırın.
- Üst sulu aşamaları toplayın ve taze düşük nükleik asit bağlayıcı 1,5 mL tüplere aktarın.
NOT: Çapraz kontaminasyonu önlemek için sulu aşamaları tamamen kurtarmaya çalışmayın. Makul bir geri kazanım hacmi 300-350 μL'dir. - Toplanan sulu fazları 0,1 hacimli 3 M sodyum asetat (25 °C'de pH 5), 20 μg glikojen (5 μg/μL stok kullanılarak) ve 2,5 hacim mutlak etanol ile tamamlar. Tüpleri 1 dakika boyunca girdaplayarak çözeltileri dikkatlice karıştırın.
- Numuneleri -20 °C'de en az 2 saat kuluçkaya yatırarak RNA'yı çökeltin (geceleme önerilir).
- Tüpleri oda sıcaklığına ısıtın ve girdapla karıştırın.
NOT: Tüplerin önceden ısınması ve daha sonra oda sıcaklığında santrifüjlenmesi (zorla soğutma olmadan) tuz ve fenol birlikte yağışı ve taşımayı azaltmaya yardımcı olur. Bu koşullar, açıklandığı gibi ve yeterince saf etanol kullanılarak gerçekleştirilirse RNA koleksiyonunun maddi kaybına veya verimsizliğine neden olmamalıdır. - Boruları oda sıcaklığında 30 dakika boyunca 12.000 x g'da santrifüj ederek RNA çökeltisini peletin.
- Süpernatantı atın ve peletin iki kez% 80 v / v etanol ile yıkayın, her seferinde oda sıcaklığında 10 dakika boyunca 12.000 x g'da santrifüjleme ile toplayın.
- Boru kapaklarını açarak ve açılan tüpleri 10 dakika boyunca 45 °C'ye ayarlanmış kuru blok bir ısıtıcıya yerleştirerek RNA peletlerini kurutun. Elde ettiği kurutulmuş peletin 20 μL 1x HE tamponunda çözün.
- UV absorbans spektrumu ölçümünü kullanarak eldeki RNA konsantrasyonu tahmin edin.
NOT: RNA parça uzunluğu ve toplam miktarı, otomatik floresan bazlı kılcal jel elektroforez aparatı gibi denatüre jel-elektroforez kullanılarak daha fazla değerlendirilebilir.
- SSU'ların etiketli eIF'ler tarafından seçici eş-immünizasyonu ve seçici SSU zenginleştirmesinin batı blot analizi
NOT: Manyetik IgG boncukları kullanarak benzeşim saflaştırması yapmak için 1.4.11 adımından sindirilmiş ve çökeltilmiş SSU fraksiyonunun ~15 AU (260 nm) kullanın. SSU kesirinin ~%5'ini giriş denetimi olarak kaydedin (Giriş kesir, I). eIF4A etiketli (TIF1-TAP; Tandem Benzeşim Arıtma etiketi) maya suşu kullanıldı, bu da anti-TAP antikoru kullanarak TAP etiketini yoklayarak eIF4A'yı tespit etmeyi mümkün kılıyor.- 100 μL manyetik IgG boncuk süspansiyonunu (lysat veya fraksiyonun her 15 AU'u (260 nm) için 1 mg boncuk kullanıldı) yeni bir düşük protein bağlayıcı 1,5 mL tüpe aktarın; boncukları manyetik raf kullanarak toplayın ve aspire edin.
- Manyetik rafı kullanarak pipetleme ve toplama ile sıralı resüspensiyon kullanarak manyetik boncukları 1 mL tampon 1 ile iki kez yıkayın.
- Yıkadıktan sonra, boncukları manyetik rafta tutarken toplayın ve dekantlayın.
- Yıkanmış boncuklara SSU fraksiyonunu ekleyin ve karışımı ~20 rpm'de ayarlanmış bir siklooksikerde 4 °C'de dönme ile 4 saat kuluçkaya yatırın.
- 4 °C'de manyetik rafı kullanarak boncukları toplayın ve süpernatantı kaydedin (Akış fraksiyonu, FT).
- Boncukları 4 °C'de iki kez 4 mM DTT ile desteklenmiş tampon 1 ile yıkayın, her seferinde siklooksiserde 10 dakika döndürün ve manyetik raftaki boncukları toplayıp dekante edin. Yıkamaları kaydedin (W1 ve W2 fraksiyonları).
- Batı şişkinliği gibi analitik bir uygulama için, pH 8,5 ila 1x ve DTT ile LDS (lityum dodecyl sülfat) poliakrilamid jel elektroforez (PAGE) numune tamponunu 2 mM'ye ekleyerek, bağlı malzemeyi denatüre etme ve azaltma koşulları altında elüte edin.
- Elution'ı sonlandırmak için karışımı 95 °C'de bir termal blokta 5 dakika ısıtın.
- Manyetik rafı kullanarak boncukları toplayın ve denatüre eluat 'ı (E fraksiyonu) taze düşük protein bağlama 1,5 mL mikrosantrifüj tüpünde geri kazanın.
- Denatüre sodyum dodecyl sülfat (SDS) PAGE'i hemen çalıştırmak için önceki adımdaki E fraksiyonunu kullanın veya E fraksiyonunu -20 °C'de saklayın.
NOT: Sonraki herhangi bir uygulama için TAP etiketiyle zenginleştirilmiş çeviri komplekslerinin hazırlık koleksiyonu için Tütün Etch Virüsü (TEV) proteazını kullanan alternatif bir elution yaklaşımı kullanın. Daha fazla ayrıntı için Tamamlayıcı Tablo 1'e bakın. - Seyreltilmiş FT, W1 ve W2 fraksiyonlarını konsantre etmek için, 3x hacimli buz gibi aseton ekleyerek malzemelerini çökeltin. Örnek aseton karışımını -20 °C'de 3 saat boyunca kuluçkaya yatırın.
- 4 °C'de 10 dakika boyunca tüpleri 13.000 x g'da santrifüj ederek çökeltme pelet.
- Süpernatant atın ve açık tüplerde 30 dakika boyunca oda sıcaklığında pelet kurutun.
- Peletin 2 mM DTT ile desteklenmiş 7 μL 1x LDS yükleme tamponunda çözün. Numuneleri 5 dakika boyunca 95 °C'ye ayarlanmış bir termal blokta ısıtın.
- Tüm I, FT, W1, W2 ve E örneklerini akrilamid gradyanı, Bis-Tris poliakrilamid denatüre jelinin %4-%12 w/v'sine yükleyin. Protein işaretleyicisi (10-250 kDa) iyice çözülene ve kurşun boya jelin dibine ulaşana kadar, 80 V'ta tampon çalıştıran 1x MES SDS (2- [N-mopholino]etanesülfonic asit, sodyum dodecyl sülfat) kullanarak jeli çalıştırın.
NOT: WCL'nin seri seyreltmelerinin (tüm hücre lisat) (2-10 μg) jel üzerine kontrol olarak yüklenmesi önerilir. Jelin fraksiyon malzemesi boyunca karşılaştırılabilir yüklenmesini sağlamak için birkaç girişimde bulunulabilir. - Jelin protein içeriğini, batı şişkinlik ekipmanı üreticisinin önerdiği gibi soğuk bir odada 1 saat boyunca 100 V'ta ıslak transfer yöntemiyle polivinilidene difluorid (PVDF) membranına aktarın.
- Membranı, sürekli sallanma altında 1 saat boyunca oda sıcaklığında uygun bir blokaj tamponu (Fosfat Tamponlu Salin bazlı) kullanarak engelleyin.
- Üreticinin antikor seyreltme talimatlarını takiben, soğuk bir odadaki bir siklooksikte Bloke Tampon (PBS) seyreltilmiş antikor (1:1.000 seyreltme) ile membranın bir gecede inkübasyonu ile etiketlenmiş eIF4A proteinini, anti-Pab1p antikorunu veya anti-β-actin antikorunu (veya başka bir arzu edilen hedefi) tespit etmek için anti-TAP-antikor ile membranı araştırın.
NOT: 1:1.000 antikor seyreltme iyi bir başlangıç noktasıdır. - Membranı 1x Fosfat Tamponlu Salin ile üç kez yıkayın, 0.2% v / v Ara 20 (PBST) her biri 10 dakika boyunca.
- Membranı, oda sıcaklığında 1 saat boyunca bir siklooksikte inkübasyon yaparak üreticinin talimatlarını takiben floresan etiketli ikincil antikorlarla probunlayın.
NOT: 1:20.000 antikor seyreltme iyi bir başlangıç noktasıdır. - Membranı her biri 10 dakika boyunca 1x PBST ile üç kez yıkayın. Zarı kısaca deiyonize suyla ve ardından mutlak metanol ile durulayın. Membranı üreticinin talimatlarına göre floresan görüntüleme sisteminde kurutun ve görselleştirin.
NOT: Diğer proteinler için boyama, farklı floresan kanallarla eşleşen boyalara sahip ikincil antikorlar kullanılarak elde edilebilir (eIF4A-TAP vs. gibi). β-actin çifti burada kullanılır), sıralı boyama veya sıyırma ve aynı zarı boyama veya membranın tekrar eden fraksiyon deseni ile yüklü bir jelden kesilmesi ve her parçanın ilgili antikorlarla ayrı ayrı yoklanması (burada kullanılan Pab1p örneğinde olduğu gibi).
2. Memeli hücre protokolü
- Memeli hücre kültürü ve fiksasyonu
- 2 T-175 şişede, HEK293 hücrelerini Dulbecco'nun Modifiye Kartal Orta'sında %60-%70 birleştiği ve 37 °C'de %10 v/v Fetal Sığır Serumu ve %5 v/v karbondioksitte büyütür.
NOT: Tüm ortam, L-glutamin, fenol kırmızısı ve sodyum bikarbonat içeren, ancak HEPES veya sodyum piruvat içermeyen, yüksek glikozlu, ticari olarak satın alınan 500 mL DMEM'e 55 mL ticari FBS eklenerek yapılır. %70 izdihamda T-175 şişesi başına hücre sayısı 1.7-2.0 x 107aralığında olmalıdır. - İstenilen sabitleme süresinden en az 3 saat önce, T-175 şişelerinin medyasını tam olarak 30 mL önceden ısıtılmış komple ortamla değiştirin ve şişeleri bir hücre inkübatöründe değiştirin.
NOT: Hücre kopmasını önlemek için taze ortamın şişenin karşı tarafına hücre monolayerine borulatılmış olduğundan emin olun. Medya değişimini mümkün olduğunca hızlı bir şekilde yürütmeye çalışarak minimum gaz ve sıcaklık dengesi bozukluğuna neden olur. - Hücre ortamı değiştirildikten sonra, sabitleme için gereken tamponları ve kimyasalları hazırlayın. 500 mL'lik bir DPBS şişesine 10,2 mL 2,5 M glisin stoğu ekleyerek ve karıştırarak Dulbecco'nun 50 mM glisinli Fosfat Tamponlu-Tuzlu (DPBS) hazırlayın.
- Steril olmayan koşullarda kullanılmak üzere 2.1.1 adımda olduğu gibi% 10 FBS ile desteklenmiş bir şişe DMEM ve% 0.25 Tripsin-EDTA 100 mL aliquot hazırlayın. Kalsiyum klorür (CaCl2)ve magnezyum klorür (MgCl 2) ile öncedenformüle edilmiş ek bir şişe ticari DPBS kaynağı.
NOT: Çözeltiler 4 °C'de 2 haftaya kadar saklanabilir. - Bir T-175 şişesinin üstüne eşit şekilde sığabileceği ve hazırlanan tamponlarla birlikte duman kaputunda, buzun üzerinde tutabileceği ezilmiş su buz ile ağzına kadar bir buz kutusu hazırlayın.
NOT: Herhangi bir çevresel değişikliğe çevirinin hızlı tepkileri nedeniyle, hücre şişelerinin inkübatörden çıkarılması ile formaldehit çözeltisinin eklenmesi arasındaki tüm zamanlamalar en aza indirilmelidir. - Hücreleri soğutmak için, T-175 şişesini inkübatörden çıkarın ve maksimum yüzey teması sağlamak için buza sıkıca bastırın. Kimyasal duman kaputunun içinde, matarayı yan tarafına yatırın, böylece ortam hücrelerin karşısındaki tarafta toplar. Pipet 168 μL% 37 w / v formaldehit doğrudan havuzlanmış ortama (% 0.2 w / v son konsantrasyona). Matarayı hafifçe ileri geri sallayarak hemen karıştırın, şişeyi kapatın ve buz üzerinde yeniden konumlandırın, yatay olmasını ve hücrelerin eşit şekilde kaplanmasını sağlayın.
DİkKAT: Formaldehit, potansiyel uzun süreli yan etkileri olan ve aynı zamanda hem solunum sistemi hem de cilt için tahriş edici zararlı bir maddedir. Sadece uygun bir kimyasal duman kaputunda ele alınmalıdır. Formaldehit kapları duman kaputunun dışındayken her zaman kapatılmalıdır.
NOT: Formaldehitin şişe duvarına değil, doğrudan hücre ortamına eklenmesini sağlayın. Adım 2.1.6 1 dakikadan az sürmelidir. - Şişeleri 10 dakika daha buz üzerinde kuluçkaya yatırın. Ortamı, hücrelerin karşısındaki şişe tarafından uygun bir atık kabına dökün.
- Bir striptiz kullanarak, Dulbecco'nun Fosfat Tamponlu Salin'inin 30 mL'sinde kalsiyum ve magnezyum iyonları olmadan pipet ve ayrıca hücrelerin karşısındaki tarafta hafifçe 50 mM glisin içerir. Matarayı sallayarak karıştırın; şişeyi yatay konuma getirin ve buz üzerinde 10 dakika daha kuluçkaya yatırın.
- Çözeltiyi hücrelerin karşısındaki şişe tarafından dökün ve hücreleri ayırmak ve yeniden hayata geçirmek için standart % 0,25 w/v Trypsin-EDTA çözeltisinin 7 mL'sini hafifçe ekleyin. Şişeyi oda sıcaklığında 5-10 dakika kuluçkaya yatırın.
NOT: Trypsin-EDTA çözümünün tüm hücreleri eşit şekilde kapsadığından emin olun. Hücre müfrezesini teşvik etmek için periyodik nazik eğme ve sallama kullanın. - Şişeyi dikey olarak yeniden konumlandırın ve bir şerit kullanarak, şişe duvarlarından kalan hücreleri hafifçe yıkayarak ayrılmış hücreleri toplayın. Süspansiyonu buz üzerinde kurulu 50 mL'lik bir tüpe aktarın.
NOT: Sabit hücreler daha kırılgan hale gelebilir; hücreleri şişe duvarından ayırmak için gerekenden yoğun veya daha fazla pipet yapmayın. - Toplanan hücre süspansiyonu derhal 20 mL komple ortamla (%10 FBS ile steril olmayan buz gibi ortam) tamamlayın ve tüpü hafifçe çevirerek karıştırın.
NOT: Tripini nötralize etmek için hücre zarlarının daha fazla zarar görmesini ve hücre parçalanmasını önlemek için tam hücre kültürü ortamı (%10 FBS dahil) eklenir. - Tüpü 5 dakika ve 4 °C için 100 x g'da santrifüj ederek hücreleri peletin. Hücre peleli açıkça görülebiliyor olmalıdır.
- Ortamı dökün ve hücre peletini Ca 2+ ,Mg2+ile 10 mL buz gibi DPBS'de ve glisin olmadan hafifçe yeniden depolayın.
- 2.1.12.
- Yıkama tamponunu dökün ve hücre peletini 800 μL buz gibi DPBS'de Ca2+, Mg2+ile glisin olmadan buz üzerinde hafifçe yeniden depolayın. Yeniden dirilen hücreleri 1,5 mL mikrosantrifüj tüpüne yeni bir düşük protein bağlamasına aktarın.
- Tüpü 100 x g'da 3 dakika ve 4 °C'ye santrifüj edin. 1 mL pipettör kullanarak süpernatant dikkatlice atın. Bu aşamada, hücre pelezi -80 ° C'de dondurulabilir veya hücre liziz adımına devam edebilir.
NOT: Dondurulmuş hücre peletleri -80 °C'de 1 yıla kadar saklanabilir. Hücre pelet dondurmanın sonraki lizizi kolaylaştırdığını ve daha uzun süreli depolama planlanmış olmasa bile donmasını önerdiğini bulduk.
- 2 T-175 şişede, HEK293 hücrelerini Dulbecco'nun Modifiye Kartal Orta'sında %60-%70 birleştiği ve 37 °C'de %10 v/v Fetal Sığır Serumu ve %5 v/v karbondioksitte büyütür.
- Memeli hücre bozulması ve sitozol koleksiyonu
- Biyogüvenlik kabininde, noniyonik, nondenatüre deterjana dayalı 300 μL lizis tamponu ve 7 μL 40 U/μL RNaz inhibitörü ekleyin. 1 mL'lik bir uç kullanarak pipetleme yaparak iyice karıştırın.
- 1-3 mL şırıngaya 25 G'lık bir iğneyi dikkatlice takın ve en az yedi yavaş yukarı doğru alım ve hızlı aşağı egzoz darbeleri kullanarak karışımı kuvvetlice pipetleyin.
- Şırıngayı ve iğneyi keskin bir kutuya atın ve 31 G iğne ile donatılmış 0,3 mL şırınga kullanarak işlemi tekrarlayın.
- Şırıngayı ve iğneyi keskin bir kutuya atın. Hücre kalıntılarını peletmek için tüpleri 4 °C, 12.000 x g'da 5 dakika santrifüj edin.
- Süpernatantı yeni bir düşük protein bağlayıcı 1,5 mL mikrosantrifüj tüpüne aktarın. Her ikisini de, hücre kalıntılarını (kontrol amacıyla) ve elde edilen netleştirilmiş hücre lisatını -80 °C'de saklayın.
NOT: İki T-175 şişesi birleştirildiğinde ve önerilen hacimler takip edildiğinde, lisatın optik yoğunluğu25-30 AU 260 arasında değişir. Lisatlar ve hücre kalıntıları -80 °C'de 1 yıla kadar saklanabilir.
- Sabit (poli)ribozomal komplekslerin sitozol çevrilmemiş fraksiyonlarından ayrılması
- Genellikle maya protokolünün 1.3.1 adımında açıklandığı gibi, ancak tampon 2(Şekil 2a)kullanılarak, 13 mL ince duvar polipropilen tüplerinde, 14 x 89 mm'lik doğrusal%15-%45 oranında sakkaroz gradyanları hazırlayın.
NOT: Gradyanları, kesirlenmeden önceki gece 4 °C'de soğuk bir odada bir gecede çözün. - Önceki adım 2.2.5'ten itibaren hücre lisatının 150-250 (maksimum 300) μL'yi dengeli degradelere yükleyin. Kalan lisatı -80 °C'de saklayın ve kontrol amacıyla kullanın.
NOT: Burada polizomal, ribozomal ve 'serbest' SSU fraksiyonlarına sedimanasyona dayalı ayrım örneği verilmiştir. Alternatif bir yaklaşım için sağlanan Tamamlayıcı Tablo 1'e bakın. - Tüpleri 4 °C'de orta hacimli salıncak kovası rotorunda ultracentrifuge, ortalama g kuvveti 178.305 x g (k-faktörü 143.9) 1 saat 45 dk.
- Döndürmenin tamamlanmasından 30 dakika önce, maya protokolü 1.4.7-1.4.9 adımlarında açıklandığı gibi degrade fraksiyonatörünü ayarlayın ve taban çizgisine kurun.
- Maya protokolü 1.4.10-1.4.11 adımlarında açıklandığı gibi gradyanları genel olarak kesirli olarak tanımlayın.
NOT: Bu adım polizomal, ribozomal ve 'serbest' SSU kesirlerini ayırır. Polizomal fraksiyonlar polizom profilleme deneylerinde kullanılabilir. - Toplanan fraksiyonları hemen buz üzerine aktarın ve daha fazla işlenmezse, 6 aya kadar -80 ° C'de saklayın.
NOT: Kesir toplayıcı tüp değişimi on-line fraksiyon tanımlaması ve ayrımı ile senkronize edilirse, 800 μL'ye kadar fraksiyon kullanmanızı öneririz (kesir başına 32 s toplama süresi 1,5 mL/dk). Kesirleme satır içi emiciliği okumadan gerçekleştirilirse, 250-500 μL fraksiyonlar (1,5 mL/ dak'ta kesir başına 10-20 sn) kullanılması önerilir. Ayırmadan sonra, fraksiyonlar immünpurifikasyon, elektron mikroskopisi, denatüre PAGE ve batı şişkinliği için hemen kullanılabilir veya sonraki RNA ve/ veya proteomik analizler için çapraz bağlantı tersine çevrilmesine tabi tutulabilir.
- Genellikle maya protokolünün 1.3.1 adımında açıklandığı gibi, ancak tampon 2(Şekil 2a)kullanılarak, 13 mL ince duvar polipropilen tüplerinde, 14 x 89 mm'lik doğrusal%15-%45 oranında sakkaroz gradyanları hazırlayın.
Sonuçlar
Çeviri kompleksleri tamponların iyonik bileşimine duyarlıdır, bu da sedimantasyon özelliklerinin değerlendirildiği ultra merkezirifüjleme sırasında özellikle önemlidir. Bu nedenle, çeviri komplekslerini ve ayrı ribozomal alt birimleri (SSU, LSU), monozomları (RS) ve gradyan boyunca poliomları çözmek için en uygun koşulları seçmek için öğütülmüş sabit olmayan maya malzemesinden çıkarılan netleştirilmiş lizat kullanarak birkaç sedimasyon tamponunu test ettik. Tüm tamponlar 25 mM HEPES-KOH pH 7.6 ve 2 mM DTT içeren çekirdek bileşimine dayanıyordu. KCl, MgCl2, CaCl2ve EDTA konsantrasyonları tamponlar boyunca daha da değiştirildi (Şekil 2a) ve bu bileşenler gradyan yüklemeden önce lysates'e ve buna göre gradyan dökümünden önce sakkaroz gradyan tamponlarına eklendi.
Tamponlarda 1 ve 2 iyi çözülmüş çeviri kompleksleri elde edildi. Tampon 1, küçük ribozomal alt ünlemlerin (SSUs) biraz daha iyi ayrılmasına neden oldu (Şekil 2a). MgCl2 atlanması ve EDTA ilavesi (tamponlar 3,4), polizomların çoğu ve muhtemelen kısmi sökülmeleri için yüksek sedimasyon özelliklerinin kaybına neden oldu (Şekil 2a). 2,5 mM CaCl2 ilavesi biraz daha homojen polizomal zirvelere neden olurken, iyileşme marjinaldi ve bu durumda polizomal malzemenin genel miktarı azaldı (Şekil 2a) tamponlara kıyasla 1 ve 2. Böylece tercih edilen çalışma arabelleği olarak arabellek 1'i seçtik.
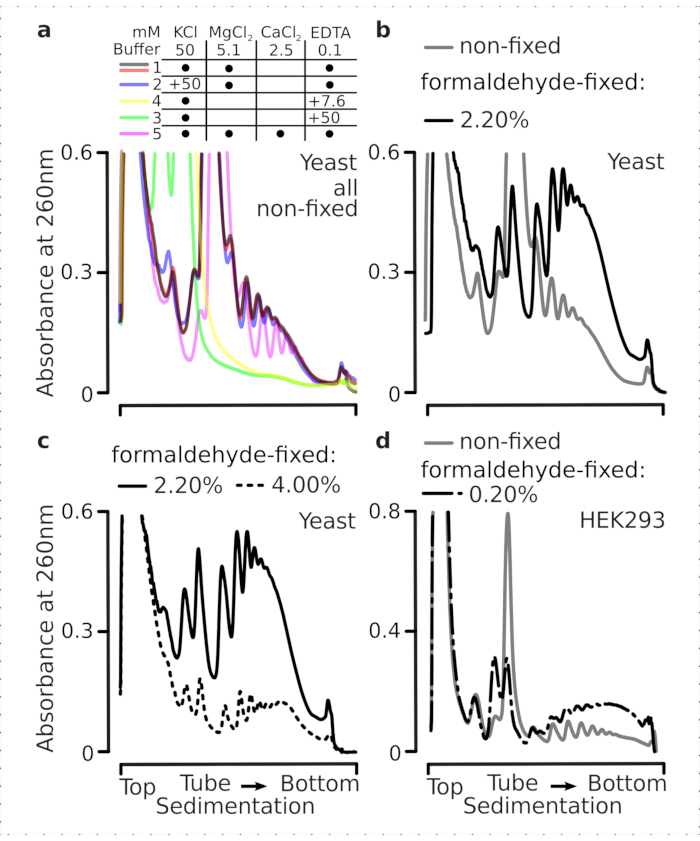
Şekil 2: Çevirisel karmaşık ekstraksiyon için tampon koşullar ve fiksasyonun stabilize edici etkisinin değerlendirilmesi. Gösterilen UV absorbans profilleri 260 nm toplam maya hücre lisat için toplanan 10%-40 w/v sakkaroz gradyanları. (a)Mono ve divalent tuzların ve magnezyum iyon sequestration'ın sabit olmayan maya hücrelerinden çıkarılan malzemenin tortulasyonu üzerindeki etkileri. Kırmızı ve gri çizgiler tipik bir yinelemeyi temsil eder. (b,c) Formaldehit sabit maya hücrelerinin sabit olmayan (gri çizgi), %2,2 (siyah çizgi) ve %4,4 (siyah noktalı çizgi) elde edilen lysates karşılaştırması. (d) Polizomların, aynı sabit olmayan hücrelerden (gri çizgi) elde edilen malzemeye kıyasla, HEK 293T hücrelerinin optimize edilmiş% 0,2 w /v formaldehit fiksasyonu (siyah kesikli ve noktalı çizgi) ile stabilizasyonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Daha sonra farklı formaldehit konsantrasyonlarına sabitleme ile polizomal stabilizasyonun etkisini kontrol ettik. Aksi takdirde aynı hücre malzemesini, tamponları, hücre işleme ve zamanlama yaklaşımlarını kullanarak, sabit olmayan hücrelerden ve formaldehitin% 2.2 ve% 4 w / v ile sabitlenmiş hücrelerden çıkarılan malzemeyi karşılaştırdık (Şekil 2b,c). Formaldehitin% 2.2 w / v'sinin fiksasyon için daha uygun olduğunu bulduk, çünkü polizomları polizom-monozom oranı ile değerlendirilebileceği gibi mükemmel bir şekilde korudu (Şekil 2b), ribozomal malzemenin genel verimini, aşırı fiksasyon belirtileri gösteren formaldehitin% 4 w / v'sine kıyasla azaltmadı (Şekil 2c).
Memeli hücrelerinden elde edilen malzeme için, deterjan bazlı ekstraksiyonun gerektirdiği daha büyük liziz tampon-hücre hacim oranı nedeniyle tampon 2 (Şekil 2a) kullanılmıştır. Bu, sakkaroz gradyanlarında çökeltme üzerine iyi çözülmüş çeviri kompleksleri üretti (Şekil 2d). Özellikle, daha yüksek konsantrasyonlar önemli polizomal ve ribozomal malzeme kaybına neden olduğu için % 0.2 w/ v'lik çok daha düşük bir formaldehit konsantrasyonu kullanıldı (veriler gösterilmedi). Maya hücreleri ile elde edilen sonuçlara benzer olarak, çapraz bağlantı stabilize malzeme polizomların daha iyi korunmasını ve daha yüksek polisome-monozom oranını göstermiştir (Şekil 2d).
Daha sonra seçilen formaldehit fiksasyon koşullarının çapraz bağlamanın bir sonucu olarak polizomal fraksiyonlar içinde aktif olarak çevrilmiş mRNA'yı stabilize edecek kadar verimli olup olmadığını test ettik ve geliştirilmiş polizomal verim sadece enzim fonksiyonunu ve çeviri uzama ilerlemesini engellemenin bir sonucu değildir. Poliomları ve ribozomları istikrarsızlaştırmak için EDTA ve yüksek monovalent tuz (KCl) kullandık. Bu reaktifler, netleştirilmiş maya hücresi lysates'e eklendi ve sırasıyla tampon 1 bileşiminin üstündeki sonraki tüm tamponlara ve sakkaroz gradyanlarına dahil edildi.
Gerçekten de, 15 mM EDTA sabit hücrelerden elde edilen polizomal fraksiyonlar üzerinde daha az istikrarsızlaştırma etkisi gösterdi (Şekil 3a), çapraz bağlı komplekslerin daha sağlam olduğunu doğruladı. Formaldehit sabit hücrelerinin% 4 w / v'sinden elde edilen malzeme daha iyi açılmaya direndiği için, EDTA'nın istikrarsızlaştırıcı etkileri formaldehit konsantrasyonunun artırılmasıyla biraz aşılabilir (Şekil 3a). Bununla birlikte, EDTA konsantrasyonunun 50 mM'ye çıkarılması, malzemenin daha yavaş tortulması ve iyi şekilli zirvelerin yokluğundan kaynaklanabileceği gibi, çeviri komplekslerinin çoğunun hem sabit hem de sabit olmayan koşullar altında istikrarsızlaşmasına neden oldu (Şekil 3b). Bu, polizomal bileşenlerin mRNA'dan tamamen ayrışması yerine, yapıların kısmen açılmaması ve genel kompaktlık kaybı ile açıklanabilir. Bu durumda bile, çapraz bağlantılı malzeme daha hızlı sedimentasyon göstermiştir (Şekil 3b).
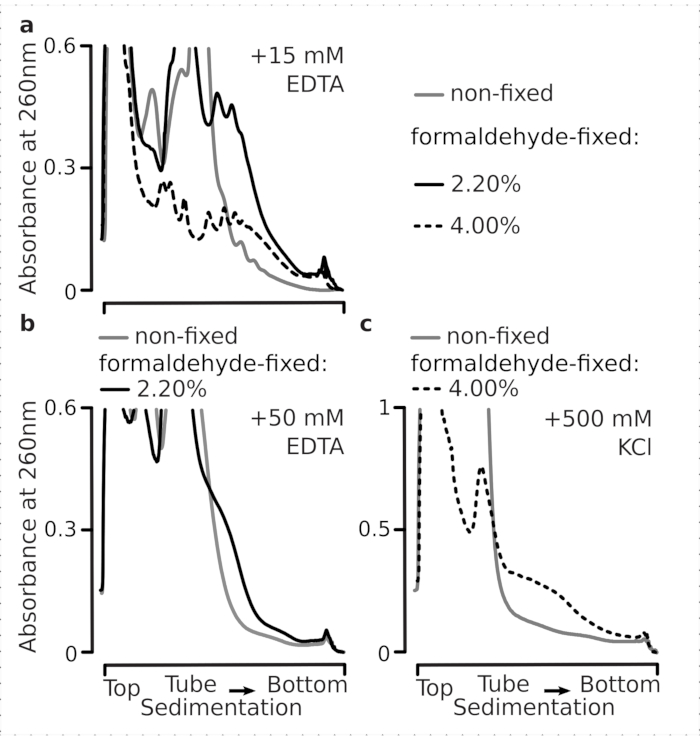
Şekil 3: In vivo maya formaldehit fiksasyonunun polizomların stabilitesi üzerindeki etkileri. Tüm denemelerde tampon 1 (bkz. metin ve Şekil 2a)kullanılmıştır. Şekil 2 göstergesinde açıklandığı gibi veri türü ve çizim. (a) Hücre lizatlarına 15 mM EDTA eklenmesinin ve daha sonraki tamponların sabit olmayan (gri çizgi), formaldehit sabit hücrelerinin% 2.2'si (siyah çizgi) ve% 4'ü (siyah noktalı çizgi) elde edilen polizomların stabilitesi üzerine karşılaştırılması. (b) ile aynı (a), ancak 50 mM EDTA eklenmesi ve formaldehit sabit hücrelerinin% 4 w / v hariç. (c) ile aynı (a), ancak 500 mM KCl eklenmesi ve formaldehit sabit hücrelerinin% 2.2 w / v hariç. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
EDTA etkilerine benzer şekilde, 500 mM KCl'de, formaldehit fiksasyonunun% 4 w / v ile stabilitesinde büyük bir iyileşme bulduk (Şekil 3c). Bu durumda belirgin kompaktlık kaybı, ribozomal komplekslerin bileşenlerinin RNA'dan tamamen ayrışması yerine kısmi olarak ayrışmasıyla da açıklanabilir. Genel olarak, formaldehit sabit hücrelerinden elde edilen polisomes, bu komplekslerde ek kovalent bağlar oluşturmakla tutarlı olarak açılmaya ve yapısal istikrarsızlaşmaya karşı daha yüksek direnç göstermiştir.
Büyüme koşullarının uyarılması sırasında, mRNA'lar hızla başlatılabilir ve bu da poliribozomlar veya polisomes olarak bilinen yapıları oluşturan aynı mRNA molekülleri üzerinde birden fazla ribozom birikmesine neden olabilir. Polisomes, sıralarına göre çökelttikleri sakkaroz gradyanlarında ultracentrifugation ile ayrılabilir (mRNA'da aynı anda bağlı ribozom sayısı). Çeviri bastırıldığında, ribozomlar yakında başka bir çeviri turuna girememektedir, bu da daha düşük bir düzenin poliomlarına doğru kalıcı bir kayma olarak sergilenen poliomların (kısmi) 'sökülmesine' neden olur4,26.
Polisome sipariş dağılım seviyesinde görselleştirilebilen bir çevirisel yanıt modeli glikoz açlığı ile sağlanabilir. Glikoz tükenmesi maya1,3,40üzerindeki en dramatik ve hızlı çevirisel inhibitör etkilerden biriniortayaçıkarır. Önceki çalışmalar, glikoz tükenmesinin 1 dakika içinde, polizomların kaybı, monozomların birikmesi ve çeviri başlatmanın inhibisyonunun meydana gelebileceğini kanıtlamıştır4. Glikoz re-supplement 5 dakika içinde, çeviri polisomes belirgin artış ile hızlı bir şekilde restore edilir3,4. Ayrıca hücreler %0.5 (w/v) veya daha düşük glikoz içeren ortamlara maruz kaldıklarında çevirinin inhibe edildiği ve %0.6 (w/v) veya daha yüksek glikoz seviyelerinde hiçbir etki görülmediği gözlendi.
Bu nedenle, fiksasyon koşullarımızın, polisome-monozom oranı ile değerlendirilebileceği gibi, glikoz stres yanıtı dinamikleri içindeki çevirisel farklılıkların korunması için uygun olup olmadığını belirlemek istedik. Yüksek glikozda (%2.00 w/v ilavesi) orta üssel fazda yetişen hücrelerden elde edilen malzemeyi, 10 dakika boyunca hiç veya düşük eklenmiş (sırasıyla% 0.00 veya% 0.25 w/ v) glikoz ile ortama aktarılanlarla karşılaştırdık. Fiksasyon, kontrole paralel olarak formaldehitin% 2.2'si kullanılarak gerçekleştirildi (aç olmayan; % 2 w / v ilave glikoz içeren aynı standart ortamla hızlı medya değişimi, ardından 10 dakika inkübasyon ve fiksasyon) ve 10 dakika aç (aynı ortamla hızlı medya değişimi ancak düşük 0.25 w / v veya ek glikoz, ardından 10 dk ve fiksasyon) hücreleri için inkübasyon.
Daha önceki bulgularla tutarlı olarak, maya hücrelerinin glikoz açlık stresi üzerine çeviriyi yoğun bir şekilde baskıladığını gözlemledik (Şekil 4a). Her ikisi de, hiçbir ek ve düşük glikoz koşulları, düşük ilave glikoz durumunda hafif ama açıkça daha fazla polisomes tutularak, polizom demontajını tetiklemedi. Bu nedenle, maya glikoz giderme yanıtı tamamen açık veya tamamen kapalı bir tipte olmayabilir ve yavaş yavaş ayarlanır. Sabit hücrelerden gelen formaldehit çapraz bağlama, polizomal malzemenin stabilize edici etkisine ilişkin beklentileri onaylamak, aç ve aç olmayan hücreler arasında daha yüksek bir ayrım göstermiş ve muhtemelen yanıtın daha yüksek bir dinamik aralığını korumuştır (Şekil 4b). İlginç bir şekilde, sabit hücrelerden gelen malzeme durumunda, düşük ilave glikoz konsantrasyonu, sabit olmayan hücrelere kıyasla eklenmemiş glikoz durumundan çok daha iyi ayırt edilen spesifik polizomal bollukla sonuçlandı (Şekil 4a). Bu, formaldehit fiksasyon yaklaşımının, çevirisel yanıtlar sırasında olduğu gibi, son derece dinamik süreçlerin dengesindeki nispeten dakika ve geçici farklılıkların korunması ve yakalanmasındaki uygunluğunun güçlü bir göstergesidir.

Şekil 4: Glikoz açlığı üzerine maya çevirisinde hızlı değişiklikler yakalamak. Tüm denemelerde tampon 1 (bkz. metin ve Şekil 2a)kullanılmıştır. Şekil 2 göstergesinde açıklandığı gibi veri türü ve çizim. (a)Aç olmayan (gri çizgi), kısıtlı glikoz açlığı (10 dakika boyunca% 0.25 w/ v ilave glikoz; kahverengi çizgi) ve glikoz tükenmiş (10 dakika boyunca ilave glikoz yok; kırmızı çizgi) sabit olmayan maya hücrelerinden elde edilen hücre lysates. (b) ile aynı (a), ancak % 2.2 w/v formaldehit sabit hücreler için. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sakkaroz gradyan sedimmentasyonu ('polisome profilleme') kullanılarak mRNA'nın aktif olarak çevrilmesiyle ilişkili ribozomlar tarafından çeviri durumunun izlenmesi yaygın olarak uygulanan bir tekniktir26,27,28. Nicel mikroarray analizi ile birlikte ve daha yakın zamanda yüksek verim sıralamasıile 28,44 , polisome profilleme ribozom ilişkili mRNA'lar transkriptom çapında hakkında bilgi sağlar. Çeşitli varsayımlarla, geleneksel olarak protein biyosentez araştırmaları alanında, polizomal varlığın ilgili mRNA'ların çevirisinde aktif katılımın bir göstergesi olduğu tartışılmıştır. Başka bir sonuç genellikle (ancak her zaman değil), belirli bir uzunluktaki bir mRNA'da ne kadar fazla ribozom varsa (poliomların sırası ne kadar yüksekse), mRNA'nın çeviride o kadar aktif olarak yer aldığıdır. Bu nedenle, polizomal fraksiyonu malzemenin geri kalanından ayırmak, aktif olarak çevrilen RNA'yı izole etme açısından yararlı olabilir. Ayak izi profil oluşturma yaklaşımları ve özellikle tarama, başlatma ve durdurma kodon komplekslerinden türetilen kurtarılmış SSA'ların ayrı bir popülasyonu oluşturan TCP-seq10, 38,39 içinde, tam monozomlar veya politekozomlarla birlikte tortulanmayan ribozomal alt birimleri kaldırmak da içgörülü olabilir.
Bu nedenle, ücretsiz SSU'lar (ekli mRNA olmadan tek SSU veya SSU'lara bağlı mRNA) gibi 'çevrilmemiş' mRNP'lerin mRNA'ların 'aktif olarak çevrilen' havuzundan ayrılmasını istihdam ettik. Bunu başarmak için, bir (mono-) veya birkaç ribozom (polisome) ile etkileşimlerde bulunan mRNA'ların aktif olarak çevrilebileceğini varsaydık. Bu tür kompleksler diğerlerinden daha yüksek sedimasyon katsayıları ile ayrılabilir. Ayrıca, 'aktif olarak çevrilmiş' mRNA havuzunu, malzemeyi tüp duvarına doğrudan pelleting yerine bir sakkaroz yastığına (% 50 w / v) ayırmayı önerdik. Hızlı çökelten komplekslerin mindere santrifüjlenmesi, absorbans profili okumasını kullanarak ayırmayı izlememize ve topaklanma ve yeniden çözünürlüğe kıyasla çözünür, toplanmamış ve denatüre olmayan malzemenin daha yüksek bir çıktısını elde etmemizi sağladı10,38.
Genel olarak, bireysel SSUs'ları, ribozomları, disomeleri ve potansiyel olarak kompakt bir şekilde paketlenmiş poliomları daha yüksek bir sırayla arındırmak için, sabit netleştirilmiş lizatlar iki aşamalı bir ultrasantrifüjleme işlemine tabi tutulmuştur(Şekil 5). İlk sakkaroz gradyanında, ultrasantrifüjleme, gradyanın üst kısmında (%10-%20 v sakkaroz) ayrılmış serbest SSU'lar ve LSU'larla sonuçlanırken, tam bir ribozomla ilişkili polisomes ve mRNA'lar da dahil olmak üzere çapraz bağlantılı çevrilmiş havuz, degradenin alt kısmında (%50 w/v sakkaroz) yoğunlaşmıştır (Şekil 5a ). Çevrilmiş mRNA havuzunu içeren sakkaroz tabakasının alt % 50'si yoğunlaştı ve RNA'sı RNase I ile sindirildi, ardından ayrı SSU, LSU, RS, RNase dirençli disomes (DS) ve yüksek sıralı nükleoz dirençli polizomların küçük bir kısmını elde etmek için ikinci bir sakkaroz gradyan ultrasantrifüjasyonu ( Şekil5b). İtilasyon elektron mikroskobu ile uranil asetat ve görüntüleme ile negatif boyama, her sedimentasyon aşamasında izole edilen komplekslerin kimliğini doğrulamıştır (Şekil 5).

Şekil 5: Çevrilmemiş RNA'dan uzak toplam çevrilmiş RNA kesirlerinin izolasyonu. (a,c) Şematik (solda) ve ilgili temsili sonuçlar (sağ; şekil 2 göstergesinde açıklandığı gibi veri türü ve çizim) (a) serbest SSU'lar ve ribozomlar ve poliomlarla birlikte çökeltme ile tanımlanan çevrilmiş mRNA havuzu dahil olmak üzere çevrilmemiş sitozol fraksiyonlarının ilk süreksiz sakkaroz gradyan ayrımı, ve (c) çevrilmiş mRNA havuzundan kurtarılan tek tek ribozomal komplekslerin kontrollü RNase I sindirimi ve ultrasantrifüjasyonu ile ikinci bir doğrusal sakkaroz gradyanı ile SSU, LSU, ribozomal (RS) ve çekirdeğe dirençli disomal (DS) fraksiyonlara ayrılması. Aç olmayan sindirilmiş malzemenin yüksek(15AU260) ve düşük (8 AU 260)miktarları, küçük fraksiyonlar ilgi çekici olduğunda ultrasantrifüj yüklerini artırma olasılığını göstermek için dahil edildi. Daha yüksek sıralı nükleaz dirençli polisomes de tanımlanabilir (örneğin, sağlanan örneklerdeki trisomes). (b,d) İranil asetat kontrastlı kesirlerin temsili TEM görüntüleri (a,c), etiketli olarak. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Fiksasyon rejiminin geçici ribozom ilişkili proteinlerin (özellikle eIF'ler) tutulmasına uygunluğunu kontrol etmek için, ribozom fraksiyonları boyunca ribozomlara dinamik olarak bağlı bir labile eIF olan eIF4A'nın birlikte sedimasyonunu test ettik. EIF4A Tandem Benzeşim Saflaştırma (TAP) etiketli maya suşundan (TIF1-TAP) yararlandık ve sabit ve sabit olmayan hücrelerden elde edilen malzemedeki eIF4A varlığını anti-TAP antikoru kullanarak araştırdık, ek bir RNA bağlayıcı kontrol olarak Pab1p'nin bolluğuna kıyasla, SDS-PAGE ve ardından batı şişkinliği(Şekil 6).
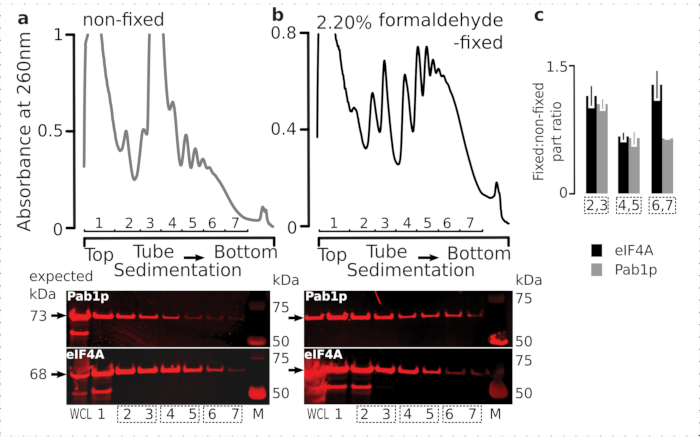
Şekil 6: İn vivo formaldehit fiksasyonu üzerine çeviri komplekslerindeki geçici proteinlerin stabilizasyonu. (a,b) (üst çizimler) Tüm hücre lisat (WCL) (a) sabit olmayan ve (b) % 2.2 formaldehit-sabit eIF4A-TAP maya hücreleri ultrasantrifüjasyon ile ayrılmış ve Şekil 2 efsanesinde açıklandığı gibi görselleştirilmiştir. (alt çizimler) İlgili degradelerde (üst çizimler) analiz edilen malzemenin ayrılması üzerine ilgili sakkaroz gradyan fraksiyonlarının batı lekeli görüntülenmesi ve kontrol olarak WCL. (c) Sabit ve sabit olmayan malzeme fraksiyonlarında eIF4A veya Pab1p bolluğu arasındaki ortalama oran. eIF4A (siyah çubuklar) ve Pab1p'nin (gri çubuklar) göreli oranları (tüm 2-7 fraksiyonların sinyaline normalleştirilmiş) 2,3 (SSU, LSU), 4,5 (RS, hafif politeomlar) ve 6,7 (ağır politeom) verilerinden (a,b) (alt çizimler) ve sabit olmayan oranlara sabitlenmiş olarak hesaplanmıştır. Hata çubukları, oranın ortalamadan standart saptığı ve havuza alınan kesirlerin (noktalı kutular) çoğaltma olarak kabul edildiğini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Hücrelerdeki yüksek bolluklarıyla tutarlı olarak, tüm hücre lisatında (WCL) proteinlerin her ikisinden de yüksek yoğunlukta sinyal ve sabit olmayan hücrelerden elde edilen daha yavaş tortul fraksiyonlar gözlemledik(Şekil 6a, alt panel). Ayrıca WCL'de sabit hücrelerden elde edilen ve çapraz bağlı malzeme ekstraksiyonunun verimliliğini ve beklenmedik kayıpların olmamasını güvence altına alan önemli miktarda bu proteinler tespit ettik(Şekil 6b, alt panel). Bununla birlikte, sabit olmayan hücrelerin aksine, sabit hücrelerden elde edilen malzeme, Pab1p'ye kıyasla daha hızlı çökelten ribozomal fraksiyonlarda eIF4A'nın yüksek bağıl varlığını göstermiştir (Şekil 6c). Bu sonuç, eIF4A'nın formaldehit çapraz bağlı malzemedeki politelerle daha sıkı ilişkili kaldığını göstermektedir.
Çapraz bağlamanın ribozomal fraksiyonlardaki eIF4A varlığı üzerindeki olumlu ve spesifik stabilizasyon etkisini doğruladıktan sonra, eIF4A içeren kompleksleri manyetik IgG boncuklarıyla yakınlık saflaştırma ile yakalamak ve zenginleştirmek için eIF4A etiketli (TIF1-TAP) maya suşundan sabit malzemeyi kullandık. Sakkaroz gradyanı yoluyla ilk çökeltiden sonra benzeşimle zenginleştirilmiş WCL, ücretsiz SSU ve polizomal (çevrilmiş mRNA havuzu) fraksiyonlarımız vardır (örneğin, maya protokolünün bölüm 1.3'ü, ayrıca çevrilen havuzun RNase I ile ayrı komplekslere sökülmesi üzerine ikinci çökeltiden SSU, LSU ve RS fraksiyonları (örneğin, maya protokolünün bölüm 1.4'ü) (Şekil 7 ). Her durumda, LSU fraksiyonu hariç, kaynak malzemedeki β-aktinin varlığına kıyasla eIF4A'nın saflaştırılmış fraksiyonlarda (eluat, E) seçici zenginleştirilmesini gözlemleyebildik (giriş, I) (Şekil 7).
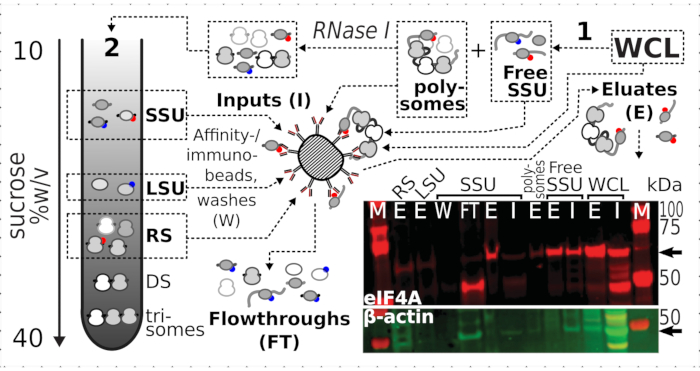
Şekil 7: In vivo formaldehit stabilize çeviri komplekslerinin geçici ilişkili eIF4A ile seçici immünpurifikasyonu. Şematik, eIF4A-TAP maya hücrelerinin fraksiyone edilmemiş netleştirilmiş WCL'si de dahil olmak üzere farklı çeviri komplekslerinin ve eIF4A epitopunun kaynağını göstermektedir; ücretsiz SSU'lar ve çevrilmiş RNA havuzu (politeler) ilk ultrasantrifüjasyonda ayrılmıştır; SSU, LSU ve RS fraksiyonları RNase I digestion tarafından çevrilmiş RNA'dan kurtarıldı ve ikinci ultrasantrifüjleme kullanılarak ayrılmıştır (metne bakın). Batı lekeli görüntü, eşzamanlı lekeli β-aktin kontrolünün bolluğuna kıyasla kesirlerdeki eIF4A bolluğunun görselleştirilmesini sağlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tamamlayıcı Tablo 1. Bu Tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
Formaldehit fiksasyonu, biyomoleküllerin10, 36 , 45 ,46,47,48'in hızlı in vivo çapraz bağlanmasının uygun ve popüler bir yöntemidir. Diğer potansiyel biyomolekül hedefleri ile karşılaştırıldığında, çeviri komplekslerinin başarılı bir şekilde yakalanması, hücrelerin veya diğer malzemelerin çıtlatma sırasında anında sabitlenmeyi gerektirir. Tanımlanmamış stabilizasyon olmadan, çeviriyle ilgili farklı süreçlerin devam etme potansiyeli vardır, karmaşık dağılımı bozulmamış in vivo durumdan uzağa kaydırır49. Diğer çevirisel arrest ve ribozomal kompleks stabilizasyon yöntemleri ile karşılaştırıldığında, hücre zarları arasında formaldehit eyleminin hızlılığı ve çapraz bağlantıların ayrımsız doğası, çeviri karmaşık aralarının yerel olarak dağıtılmış durumlarına daha yakın maksimum çeşitliliğinin korunmasını vaat eder50.
Burada sunulan yaklaşım hem maya hem de memeli hücrelerinde oluşturulmuş ve optimize edilmiştir ve yöntemler artık tüm omurgalılarda (örneğin zebra balığı embriyoları) 10 , 38 ,39,49,51,52gibi daha çeşitli biyolojik materyallerde kullanılmak üzere diğer gruplar tarafından türetilmiştir. . Bu çalışmalar, yaklaşımın çok yönlülüğünü ve geniş uygulanabilirliğini topluca güvence altına alsa da, çeviri komplekslerinin hızlı formaldehit çapraz bağlanması, optimizasyon ve ayarlama ihtiyacı nedeniyle yeni biyolojik malzeme türlerine geçişinin biraz zor olduğu düşünülebilir.
Yöntemin başarısı için en önemli gereklilik formaldehit konsantrasyonunun ve hücre toplama ve bozulma tekniğinin yeniden optimizasyonudur. Daha az geçirgen, küçük ve yuvarlak maya hücreleri çok daha yüksek (en az 10 kat) formaldehit konsantrasyonu ve sabit hücrelerin fiziksel bozulmasını gerektirir. Buna karşılık, kültürdeki büyük ve düzleştirilmiş yapışık memeli hücreleri kolayca aşırı sabitlenebilir ve sabitleme sırasında nazik bir şekilde elleçleme gerektirebilirken, sabit komplekslerin çıkarılması deterjanlar kullanılarak membran bozulması ile kimyasal olarak gerçekleştirilebilir. Çapraz bağlamanın altı, daha az kararlı veya daha kısa ömürlü ara maddelerin daha sonraki bir duruma dağılmasına veya sızmasına izin verebilir. Aşırı çapraz bağlama ribozomal fraksiyonları izole etme ve inceleme yeteneğini olumsuz yönde etkileyebilir ve ağır komplekslerin daha derin tükenmesi gibi seçici önyargılar oluşturabilir. Gözlemimize göre, kullanılan yapışan insan hücrelerinin türü gibi küçük değişiklikler bile, kurtarılan çapraz bağlantılı komplekslerin verimini etkileyebilir ve çapraz bağlama rejiminin yeniden optimizasyonunu gerektirebilir. Ayrıca, bitki hücreleri gibi önemli ölçüde farklı geçirgenlik özelliklerine sahip hücrelerin, sabitleme koşullarının ek kapsamlı optimizasyonu gerektireceğini tahmin edebiliriz52. Yine de, yaklaşımla tamamen uyumsuz bir biyolojik malzeme türü hayal etmek zordur.
Memeli fiksasyon protokolü ile ilgili bir husus, giriş olarak kullanılan hücre malzemesinin yoğunluğu ve miktarıdır. Hücresel çeviri dinamikleri üzerinde dış etkilerden kaçınmak için hücrelerin en az 2 gün boyunca yeniden tohumlama veya diğer pertürbasyonlar olmadan sürekli büyümesi önerilir. Çoğu hücre tipi için geçerlidir, ancak bağlı hücrelerin çoğunluğu için sürekli olarak% 70'ten fazla olmayan birleşme seviyelerine ulaşılması, çeviri oranlarını olumsuz ve öngörülemez bir şekilde etkileyebilecek büyük temas inhibisyon etkilerinin olmamasını sağlayacaktır.
Formaldehit fiksasyonunun ayrım gözetmeyen reaktivitesinden kaynaklanan bir başka ilginç ve potansiyel olarak benzersiz olarak kullanışlı özelliği, karma taksonomi sistemlerindeki çeviri kompleksleri üzerindeki stabilizasyon etkisidir. Mitokondri, kloroplastlar ve farklı hücre içi parazitlerin bakteriyel ve daha da fazla çeviri komplekslerinin belirli çeviri inhibitörleri ile hedeflenebilmesi oldukça zor olmuştur. Buna karşılık, TCP-seq verilerinde, mitotranscriptome ile eşlenen ayak izleri38 , 39,50verilerinde kolayca gözlemlenebilir. Daha sonraki ilginç bir gelişme, güvenilir hızlı çevirisel tutuklama ve diğer yollarla karmaşık stabilizasyonun sorunlu olacağı toprak, su veya bağırsak örnekleri gibi tüm mikro komünitelerde çeviriyi araştırmak için yaklaşımın kullanılması olabilir.
Ayrıca, en karmaşık malzeme (sert ve/ veya hacimli dokular gibi) için, hücre bozulması ve malzeme homojenizasyonu üzerine formaldehit stabilizasyonunun kullanılmasını hiçbir şeyin engellemediği belirtilmelidir. Bu yaklaşım, belirli küçük molekül inhibitörleri33 , 53,54,55ile çeviri komplekslerini stabilize ederken hücre girişi gecikmesini gidermek için zaten sıklıkla kullanılır. Formaldehit fiksasyonunun geleneksel olarak elektron mikroskopisi 45 , 56,57,58gibi uygulamalarda ex vivo / in vitro numune stabilizasyonu için mükemmel sonuçlarla kullanıldığı göz önüne alındığında, bu durumda, özellikle çeviri komplekslerinin iyice sabitlenmiş hücrelerden zayıf çıkarılmasıyla ilişkili olanlar daha da az olumsuz etkiler bekleyebiliriz.
Bulgularımız, eIF4A gibi son derece geçici kompleksleri stabilize etmek için hızlı formaldehit fiksasyonunun kullanılabilirliğini doğrulamamaktadır. Memelilerin aksine, maya eIF4A'nın kapak bağlama kompleksi eIF4F ve sonuç olarak genel olarak çeviri kompleksleri ile çok daha zayıf bir şekilde ilişkili olması dikkat çekicidir. eIF4A genelliklemaya29,59, 60,61,62,63'tekiribozomal malzemenin herhangi bir kapsamlı saflaştırılması sırasında kaybolur. Bununla birlikte, in vivo -sabit maya malzemesinde,varlığının beklendiği çeviri komplekslerinin tüm fraksiyonlarında eIF4A'nın güvenilir zenginleştirilmesini sağlamak mümkündür. Daha önce yayınlanan Sel-TCP-seq verileri, ribozomlarla daha güçlü bir şekilde ilişkili olan eIF2 ve eIF3'ün zenginleştirilmesini göstermiştir (aynı zamanda geçici olarak meydana gelen ortak çevirisel protein kompleksi derlemesini de ortaya koymuştur)39. Bu nedenle, yöntem çeviri komplekslerinin hem daha güçlü hem de daha zayıf ekli bileşenlerinin tespiti için uygundur.
Özetlemek gerekirse, öncelikle çevirinin başlangıç aşamasında meydana gelen değişiklikler ve mRNA üzerinde minimal olarak pertüre ribozomal dağılım gerektiğinde içgörüler elde etmek için yararlı bir yaklaşım sunduk. Daha da önemlisi, yaklaşım eIF4A gibi çeviri komplekslerinin nispeten labile ve dinamik bileşenlerinin stabilizasyonu için uygundur ve gerekli optimizasyonlara tabi olarak yaygın olarak kullanılabilir. Ayrıca, çevirinin hızlı dinamik değişimi senaryolarında formaldehit fiksasyonunun yararlılığına dair kanıtlar sunduk, çevresel değişikliklere veya stres koşullarına hızlı hücresel tepkiler gibi araştırma alanlarını açtık.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan eder.
Teşekkürler
Bu çalışma Avustralya Araştırma Konseyi Keşif Projesi hibesi (DP180100111 to T.P. and N.E.S), National Health and Medical Research Council Investigator Grant (GNT1175388 to N.E.S.) ve Research Fellowship (APP1135928 to T.P.) tarafından desteklendi. Yazarlar, Üniversite ve Federal Hükümet tarafından finanse edilen Avustralya Ulusal Üniversitesi İleri Mikroskopi Merkezi'ndeki Mikroskopi Avustralya'nın tesislerini kabul ediyorlar.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Yeast extract | Merck, Sigma-Aldrich | 70161 | |
| Peptone | Merck, Sigma-Aldrich | 70178 | |
| D-Glucose (Dextrose) | Merck, Sigma-Aldrich | 49139 | |
| Adenine sulphate | Amresco | 0607-50G | |
| Formaldehyde solution | Merck Sigma-Aldrich | F11635-500ML | ACS reagent, 37 wt. % in H2O, contains 10-15% Methanol as stabiliser (to prevent polymerisation) |
| RNaseOUT™ Recombinant Ribonuclease Inhibitor | Invitrogen™ byThermo Fischer Scientific | 10777019 | |
| cOmplete™, EDTA-free Protease Inhibitor Cocktail | COEDTAF-RO Roche by Merck | 11873580001 | |
| Magnesium chloride solution | (Merck/Sigma-Aldrich) | M1028 | |
| Ethylenediaminetetraacetic acid solution | (Merck/Sigma-Aldrich) | E7889 | |
| Ambion™ RNase I, cloned, 100 U/µL | Ambion | AM2294 | |
| SUPERase•In™ RNase Inhibitor (20 U/μL) | Invitrogen™ by Thermo Fisher Scientific | AM2694 | |
| Acidic phenol:chlorophorm:isoamyl alcohol 125:24:1 (pH 4.0-5.0) | (Merck/Sigma-Aldrich) | P1944-100ML | |
| Dynabeads™ Goat Anti-Mouse IgG | Invitrogen™ by Thermo Fisher Scientific) | 11033 | |
| Sodium Acetate (3 M), pH 5.5 | Invitrogen™ by Thermo Fisher Scientific) | AM9740 | |
| Glycogen (5 mg/ml) | Invitrogen™ by Thermo Fisher Scientific) | AM9510 | |
| Ethyl alcohol, Pure | Merck; Sigma Aldrich | E7023 | |
| Amersham™ Hybond® P Western blotting membranes, PVDF | Merck | GE10600023 | PVDF membrane for western blotting |
| Bolt™ 4 to 12%, Bis-Tris, 1.0 mm, Mini Protein Gel | Invitrogen™ by ThermoFischer Sientific | NW04120BOX | Protein gel |
| 4X Bolt™ LDS Sample Buffer | Invitrogen™ by ThermoFischer Sientific | B0007 | LDS sample loading buffer |
| Precision Plus Protein™ Kaleidoscope™ Prestained Protein Standards | BioRad | 1610375 | Protein ladder |
| 20X Bolt™ MES SDS Running Buffer | ThermoFischer Scientific | B0002 | PAGE runninjg buffer |
| Intercept® (PBS) Blocking Buffer | LI-COR | 927-70001 | Odyssey Blcoking buffer (PBS) |
| IRDye® 800CW Goat anti-Mouse IgG Secondary Antibody | LI-COR | 92632210 | |
| IRDye® 800CW Goat anti-Rabbit IgG Secondary Antibody | LI-COR | 92632211 | |
| TAP Tag Polyclonal Antibody | Invitrogen™ by ThermoFischer Sientific | CAB1001 | |
| Anti-beta Actin antibody | Abcam | ab8227 | |
| Sucrose | (Merck/Sigma-Aldrich) | 84097 | BioUltra, for molecular biology, ≥99.5% (HPLC) |
| DL-Dithiothreitol solution | (Merck/Sigma-Aldrich) | 43816 | BioUltra, for molecular biology, ~1 M in H2O |
| Terumo Syringe 1CC/mL | Terumo Syringe | 878499 | |
| Potassium chloride | (Merck/Sigma-Aldrich) | 60128 | |
| HEPES | (Merck/Sigma-Aldrich) | H3375 | |
| Dulbecco's Modified Eagle's Medium - high glucose | Sigma Aldrich | D5796 | |
| Fetal Bovine Serum | Sigma Aldrich | 12003C | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300062 | |
| Dulbecco's Phosphate Buffered Saline with Calcium and magnesium | Sigma-Aldrich | D8662 | |
| Glycine | Sigma-Aldrich | G7126 | |
| Tris hydrochloride | Merck/Sigma-Aldrich | 10812846001 | |
| Sodium dodecyl sulfate | Merck/Sigma-Aldrich | 436143 | |
| IGEPAL CA-630 | Merck/Sigma-Aldrich | I3021 | |
| Rnasin Ribonuclease Inhibitor | Promega | N2111 | |
| Stainless steel grinding jar | Retsch | 02.462.0059 | |
| MM400 mixer mill | Retsch | 20.745.0001 | |
| Gradient Fractionator | Brandel | BRN-BR-188 | |
| Thermomixer R | Eppendorf | Z605271 | |
| Nanodrop spectrophotometer | Thermo Fisher Scientific | ND-2000 | |
| 0.5-ml microcentrifuge tubes with locking devices | Eppendorf Safe-Lock | 30121023 | |
| Mini Gel Tank | (Thermo Fisher Scientific) | A25977 | PAGE running tank |
| 5 mL, Open-Top Thinwall Ultra-Clear Tube, 13 x 51mm | Beckman-Coulter | 344057 | |
| 13.2 mL, Certified Free Open-Top Thinwall Polypropylene, 14 x 89mm - 50Pk | Beckman-Coulter | 331372 | |
| Amicon Ultra-0.5 ultrafiltration devices | Merck | UFC5030 | Ultracel-30 regenerated cellulose membrane, 0.5 mL sample volume |
| Thermo Sorvall Evolution RC Floor Super Speed Centrifuge | Cambridge Scientific | 15566 | |
| Beckman Coulter Optima L-90K | GMI | 8043-30-1191 | |
| Nunc EasYFlask 175cm2 | Thermofisher Scientific | 159910 | |
| Falcon 50 mL Conical Centrifuge Tubes | Thermofisher Scientific | 14-432-22 | |
| 25 mL Serological Pipette | Sigma-Aldrich | SIAL1250 | |
| 10 mL Serological Pipette | Sigma-Aldrich | SIAL1100 | |
| DNA lobind tubes | Eppendorf | 30108051 | |
| Cold Centrifuge 5810 R | Eppendorf | EP022628188 | for 50 mL tubes |
| Orbital Shaking Incubator | Ratek | OM11 | |
| Frezco 17 Microcentrifuge | Thermofisher Scientific | 75002402 | |
| Eppendorf DNA lo-bind tubes | Merck/Sigma-Aldrich | EP0030108051 | |
| Eppendorf® Protein LoBind tubes | Merck/Sigma-Aldrich | EP0030108116 | |
| SW 41 Ti Swinging bucket rotor | Beckman-Coulter | 331362 | |
| Heracell™ 150i CO2 Incubator, 150 L | Thermofisher Scientific | 51026282 | |
| 0,3 mL ultra-fine II short insulin syringe | BD Medical | 328822 | |
| 3 mL syringe with Luer Lok tip | BD Medical | 302113 | |
| 25 G x 16 mm Hypodermic Needle | Terumo | TUAN2516R1 |
Referanslar
- Janapala, Y., Preiss, T., Shirokikh, N. E. Control of translation at the initiation phase during glucose starvation in yeast. International Journal of Molecular Sciences. 20 (16), 4043 (2019).
- Masvidal, L., Hulea, L., Furic, L., Topisirovic, I., Larsson, O. mTOR-sensitive translation: Cleared fog reveals more trees. RNA Biology. 14 (10), 1299-1305 (2017).
- Ashe, M. P., De Long, S. K., Sachs, A. B. Glucose depletion rapidly inhibits translation initiation in yeast. Molecular Biology of the Cell. 11 (3), 833-848 (2000).
- Crawford, R. A., Pavitt, G. D. Translational regulation in response to stress in Saccharomyces cerevisiae. Yeast. 36 (1), 5-21 (2019).
- Melamed, D., Pnueli, L., Arava, Y. Yeast translational response to high salinity: global analysis reveals regulation at multiple levels. RNA. 14 (7), 1337-1351 (2008).
- Hershey, J. W., Sonenberg, N., Mathews, M. B. Principles of translational control: An overview. Cold Spring Harbor Perspectives in Biology. 4 (12), 011528 (2012).
- Mata, J., Marguerat, S., Bähler, J. Post-transcriptional control of gene expression: a genome-wide perspective. Trends in Biochemical Sciences. 30 (9), 506-514 (2005).
- Spriggs, K. A., Bushell, M., Willis, A. E. Translational regulation of gene expression during conditions of cell stress. Molecular Cell. 40 (2), 228-237 (2010).
- Liu, B., Qian, S. B. Translational reprogramming in cellular stress response. Wiley Interdisciplinary Reviews RNA. 5 (3), 301-315 (2014).
- Archer, S. K., Shirokikh, N. E., Beilharz, T. H., Preiss, T. Dynamics of ribosome scanning and recycling revealed by translation complex profiling. Nature. 535 (7613), 570-574 (2016).
- Hinnebusch, A. G., Ivanov, I. P., Sonenberg, N. Translational control by 5'-untranslated regions of eukaryotic mRNAs. Science. 352 (6292), 1413-1416 (2016).
- Dever, T. E., Green, R. The elongation, termination, and recycling phases of translation in eukaryotes. Cold Spring Harbor Perspectives in Biology. 4 (7), 013706 (2012).
- Shirokikh, N. E., Preiss, T. Translation initiation by cap-dependent ribosome recruitment: Recent insights and open questions. Wiley Interdisciplinary Reviews RNA. 9 (4), 1473 (2018).
- Jiménez-Díaz, A., Remacha, M., Ballesta, J. P., Berlanga, J. J. Phosphorylation of initiation factor eIF2 in response to stress conditions is mediated by acidic ribosomal P1/P2 proteins in Saccharomyces cerevisiae. PLoS One. 8 (12), 84219 (2013).
- Sonenberg, N., Hinnebusch, A. G. Regulation of translation initiation in eukaryotes: mechanisms and biological targets. Cell. 136 (4), 731-745 (2009).
- Majmundar, A. J., Wong, W. J., Simon, M. C. Hypoxia-inducible factors and the response to hypoxic stress. Molecular Cell. 40 (2), 294-309 (2010).
- Barraza, C. E., et al. The role of PKA in the translational response to heat stress in Saccharomyces cerevisiae. PLoS One. 12 (10), 0185416 (2017).
- Richter, K., Haslbeck, M., Buchner, J. The heat shock response: Life on the verge of death. Molecular Cell. 40 (2), 253-266 (2010).
- Jamar, N. H., Kritsiligkou, P., Grant, C. M. The non-stop decay mRNA surveillance pathway is required for oxidative stress tolerance. Nucleic Acids Research. 45 (11), 6881-6893 (2017).
- Chen, Z., et al. The complete pathway for thiosulfate utilization in Saccharomyces cerevisiae. Applied and Environmental Microbiology. 84 (22), (2018).
- Marzluf, G. A. Molecular genetics of sulfur assimilation in filamentous fungi and yeast. Annual Review of Microbiology. 51, 73-96 (1997).
- Miller, D., Brandt, N., Gresham, D. Systematic identification of factors mediating accelerated mRNA degradation in response to changes in environmental nitrogen. PLoS Genetics. 14 (5), 1007406 (2018).
- Zhang, W., Du, G., Zhou, J., Chen, J. Regulation of sensing, transportation, and catabolism of nitrogen sources in Saccharomyces cerevisiae. Microbiology and Molecular Biology Reviews. 82 (1), (2018).
- Tokpohozin, S. E., Fischer, S., Becker, T. Selection of a new Saccharomyces yeast to enhance relevant sorghum beer aroma components, higher alcohols, and esters. Food Microbiology. 83, 181-186 (2019).
- Walker, G. M., Stewart, G. G. Saccharomyces cerevisiae in the production of fermented beverages. Beverages. 2 (4), 30 (2016).
- Chassé, H., Boulben, S., Costache, V., Cormier, P., Morales, J. Analysis of translation using polysome profiling. Nucleic Acids Research. 45 (3), 15 (2017).
- Jin, H. Y., Xiao, C. An integrated polysome profiling and ribosome profiling method to investigate in vivo translatome. Methods in Molecular Biology. 1712, 1-18 (2018).
- Arava, Y., et al. Genome-wide analysis of mRNA translation profiles in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences of the United States of America. 100 (7), 3889-3894 (2003).
- Lackner, D. H., et al. A network of multiple regulatory layers shapes gene expression in fission yeast. Molecular Cell. 26 (1), 145-155 (2007).
- Ingolia, N. T., Ghaemmaghami, S., Newman, J. R. S., Weissman, J. S. Genome-Wide Analysis in Vivo of Translation with Nucleotide Resolution Using Ribosome Profiling. Science. 324 (5924), 218-223 (2009).
- Ingolia, N. T., Hussmann, J. A., Weissman, J. S. Ribosome Profiling: Global Views of Translation. Cold Spring Harbor Perspectives in Biology. 11 (5), (2019).
- Gerashchenko, M. V., Lobanov, A. V., Gladyshev, V. N. Genome-wide ribosome profiling reveals complex translational regulation in response to oxidative stress. Proceedings of the National Academy of Sciences of the United States of America. 109 (43), 17394-17399 (2012).
- Hussmann, J. A., Patchett, S., Johnson, A., Sawyer, S., Press, W. H. Understanding biases in ribosome profiling experiments reveals signatures of translation dynamics in yeast. Proceedings of the National Academy of Sciences Genetics. 11 (12), 1005732 (2015).
- Santos, D. A., Shi, L., Tu, B. P., Weissman, J. S. Cycloheximide can distort measurements of mRNA levels and translation efficiency. Nucleic Acids Research. 47 (10), 4974-4985 (2019).
- Schneider-Poetsch, T., et al. Inhibition of eukaryotic translation elongation by cycloheximide and lactimidomycin. Nature Chemical Biology. 6 (3), 209-217 (2010).
- Hoffman, E. A., Frey, B. L., Smith, L. M., Auble, D. T. Formaldehyde crosslinking: A tool for the study of chromatin complexes. Journal of Biological Chemistry. 290 (44), 26404-26411 (2015).
- Kage, U., Powell, J. J., Gardiner, D. M., Kazan, K. Ribosome profiling in plants: What is not lost in translation. Journal of Experimental Botany. 71 (18), 5323-5332 (2020).
- Shirokikh, N. E., Archer, S. K., Beilharz, T. H., Powell, D., Preiss, T. Translation complex profile sequencing to study the in vivo dynamics of mRNA-ribosome interactions during translation initiation, elongation and termination. Nature Protocols. 12 (4), 697-731 (2017).
- Wagner, S., et al. Selective translation complex profiling reveals staged initiation and co-translational assembly of initiation factor complexes. Molecular Cell. 79 (4), 546-560 (2020).
- Zlotorynski, E. Profiling ribosome dynamics. Nature Reviews Molecular Cell Biology. 17 (9), 535-535 (2016).
- Sen, N. D., Gupta, N., S, K. A., Preiss, T., Lorsch, J. R., Hinnebusch, A. G. Functional interplay between DEAD-box RNA helicases Ded1 and Dbp1 in preinitiation complex attachment and scanning on structured mRNAs in vivo. Nucleic Acids Research. 47 (16), 8785-8806 (2019).
- Zhao, J., Qin, B., Nikolay, R., Spahn, C. M. T., Zhang, G. Translatomics: The global view of translation. International Journal of Molecular Sciences. 20 (1), 20010212 (2019).
- Luthe, D. S. A simple technique for the preparation and storage of sucrose gradients. Analytical Biochemistry. 135 (1), 230-232 (1983).
- Wang, Z., Gerstein, M., Snyder, M. RNA-Seq: A revolutionary tool for transcriptomics. Nature Review Genetics. 10 (1), 57-63 (2009).
- Orlando, V. Mapping chromosomal proteins in vivo by formaldehyde-crosslinked-chromatin immunoprecipitation. Trends in Biochemical Sciences. 25 (3), 99-104 (2000).
- Schmiedeberg, L., Skene, P., Deaton, A., Bird, A. A Temporal Threshold for Formaldehyde Crosslinking and Fixation. PLoS One. 4 (2), 4636 (2009).
- Solomon, M. J., Varshavsky, A. Formaldehyde-mediated DNA-protein crosslinking: A probe for in vivo chromatin structures. Proceedings of the National Academy of Sciences. 82 (19), 6470-6474 (1985).
- Solomon, M. J., Larsen, P. L., Varshavsky, A. Mapping proteinDNA interactions in vivo with formaldehyde: Evidence that histone H4 is retained on a highly transcribed gene. Cell. 53 (6), 937-947 (1988).
- Bohlen, J., Fenzl, K., Kramer, G., Bukau, B., Teleman, A. A. Selective 40S footprinting reveals cap-tethered ribosome scanning in human cells. Molecular Cell. 79 (4), 561-574 (2020).
- Shirokikh, N. E. Translation complex stabilization on messenger RNA and footprint profiling to study the RNA responses and dynamics of protein biosynthesis in the cells. Critical Reviews in Biochemistry and Molecular Biology. , (2021).
- Giess, A., et al. Profiling of small ribosomal subunits reveals modes and regulation of translation initiation. Cell Reports. 31 (3), 107534 (2020).
- Firmino, A. A. P., et al. Separation and paired proteome profiling of plant chloroplast and cytoplasmic ribosomes. Plants (Basel). 9 (7), (2020).
- Gerashchenko, M. V., Gladyshev, V. N. Translation inhibitors cause abnormalities in ribosome profiling experiments. Nucleic Acids Research. 42 (17), 134 (2014).
- Santos, D. A., Shi, L., Tu, B. P., Weissman, J. S. Cycloheximide can distort measurements of mRNA levels and translation efficiency. Nucleic Acids Research. 47 (10), 4974-4985 (2019).
- Schneider-Poetsch, T., et al. Inhibition of eukaryotic translation elongation by cycloheximide and lactimidomycin. Nature Chemical Biology. 6 (3), 209-217 (2010).
- Plénat, F., et al. Formaldehyde fixation in the third millennium. Annales De Pathologie. 21 (1), 29-47 (2001).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proceedings of the National Academy of Sciences. 105 (7), 2415-2420 (2008).
- Wang, N. S., Minassian, H. The formaldehyde-fixed and paraffin-embedded tissues for diagnostic transmission electron microscopy: A retrospective and prospective study. Human Pathology. 18 (7), 715-727 (1987).
- Grifo, J. A., et al. Characterization of eukaryotic initiation factor 4A, a protein involved in ATP-dependent binding of globin mRNA. Journal of Biological Chemistry. 257 (9), 5246-5252 (1982).
- Li, Y. Commonly used tag combinations for tandem affinity purification. Biotechnology and Applied Biochemistry. 55 (2), 73-83 (2010).
- Blum, S., et al. ATP hydrolysis by initiation factor 4A is required for translation initiation in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences. 89 (16), 7664-7668 (1992).
- Merrick, W. C. eIF4F: A Retrospective. Journal of Biological Chemistry. 290 (40), 24091-24099 (2015).
- Rogers, G. W., Komar, A. A., Merrick, W. C. eIF4A: The godfather of the DEAD box helicases. Progress in Nucleic Acid Research and Molecular Biology. 72, 307-331 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır