Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Protein Düşük Yatan Konformasyon durumlarını tespit etmek için Yüksek Basınçlı NMR Deneyleri
Bu Makalede
Özet
Yüksek basınçlı bir hücreyi monte etmek, yüksek basınçlı NMR deneylerini kurmak ve kaydetmek ve son olarak basınç altında hem pik yoğunluk hem de kimyasal kayma değişikliklerini analiz etmek için gereken adımların ayrıntılı bir açıklamasını sunuyoruz. Bu deneyler, proteinlerin katlanır yolları ve yapısal stabilitesi hakkında değerli içgörüler sağlayabilir.
Özet
Yüksek basınç, küresel proteinlerin dengesini bozmak ve protein komplekslerini ters çevrilebilir bir şekilde ayrıştırmak için kullanılabilecek iyi bilinen bir pertürbasyon yöntemidir. Hidrostatik basınç termodinamik dengeyi daha düşük azı dişi hacmi ile durum(lar)a doğru yönlendirir. Artan basınç, bu nedenle, küresel proteinlerin stabilitesini ve protein komplekslerinin oligomerizasyon dengesini ince bir şekilde ayarlama fırsatları sunar. Yüksek basınçlı NMR deneyleri, basınç pertürbasyonunun ince stabilite ayar yeteneğini ve çözelti NMR spektroskopisi tarafından sunulan saha çözünürlüğünü birleştirerek globüler proteinlerin stabilitesini, katlama mekanizmalarını ve oligomerizasyon mekanizmalarını yöneten faktörlerin ayrıntılı bir şekilde karakterizasyonuna izin verir. Burada, 1 bar'dan 2,5 kbar'a kadar kaydedilen 2D 1H-15N deneyleri seti aracılığıyla bir proteinin yerel katlama stabilitesini araştırmak için bir protokol sunuyoruz. Bu tür deneylerin alınması ve analizi için gereken adımlar, hnRNPA1'in RRM2 etki alanında elde edilen verilerle gösterilmiştir.
Giriş
Proteinlerin ve protein komplekslerinin daha yüksek enerjili, seyrek nüfuslu konformasyon durumlarının birçok biyolojik yolda kilit rol oynadığı uzun zamandır kabul edilmektedir1,2,3. Carr-Purcell-Meiboom-Gill (CPMG)4,Kimyasal Değişim Doygunluk Transferi (Tsİ)5ve karanlık durum değişim doygunluk transferi (DEST)6 darbe dizisi (diğerleri arasında) tabanlı deneyler sayesinde, çözelti NMR spektroskopisi geçici uygun durumları karakterize etmek için bir seçim yöntemi olarak ortaya çıkmıştır7. Bu deneylerle birlikte, daha yüksek enerji konformasyonel alt durumlarının göreli popülasyonunu artırmak için sıcaklık, pH veya kimyasal denatürantlar gibi pertürbasyonlar da tanıtılabilir. Benzer şekilde, protein dengesi de yüksek hidrostatik basınç uygulanarak bozılabilir. İlgili konformasyon değişiklikleriyle ilişkili hacim değişiminin büyüklüğüne bağlı olarak, basıncın birkaç yüz ila birkaç bin çubuk artması, daha yüksek bir enerji durumunu önemli ölçüde stabilize edebilir veya bir proteinintamamen ortayaçıkmasına neden olabilir 8 ,9,10. Protein NMR spektrumu tipik olarak hidrostatik basınçla iki tür değişiklik gösterir: (i) kimyasal kayma değişiklikleri ve (ii) pik yoğunluk değişiklikleri. Kimyasal kayma değişiklikleri, protein yüzey suyu arayonundaki değişiklikleri ve/veya protein yapısının hızlı bir zaman ölçeğinde (NMR zaman ölçeğine göre) yerel sıkıştırmasını yansıtır11. Büyük doğrusal olmayan kimyasal kaymalar gösteren çapraz geçişler basınç bağımlılığı, daha yüksek enerji konformasyon durumlarının varlığını gösterebilir12,13. Öte yandan, pik yoğunluk değişiklikleri, katlanmış/katlanmış durum popülasyonlarındaki değişiklikler gibi yavaş bir zaman ölçeğinde büyük konformasyon geçişlerine işaret eder. Katlanır ara maddelerin veya daha yüksek enerji durumlarının varlığı, belirli bir proteinin farklı kalıntıları için ölçülen açma üzerine hacim değişiminin büyüklüğündeki büyük varyasyonlardan tespit edilebilir14,15,16,17. Deneyimlerimize dayanarak, tipik olarak iki durumlu klasörler olarak sınıflandırılan küçük proteinler bile, yerel katlama stabiliteleri hakkında yararlı bilgiler sağlayan basınca karşı tekdüze olmayan yanıtlar sergiler. Burada açıklanan, heterojen nükleer ribonükleoprotein A1'in(hnRNPA1) izole RNA tanıma motifi 2'yi (RRM2) model protein olarak kullanarak, amide tepe yoğunluğu ve 1 H kimyasal kayma basınç bağımlılığının kazanılması ve analizi için bir protokoldür.
Protokol
NOT: Burada açıklanan protokol, (i) 2,5 kbar dereceli alüminyum sertleştirilmiş zirkonya tüpü18,(ii) NMR spektrumunun analizi için SPARKY19 yazılımı ve (iii) bir eğri uydurma yazılımına sahip yüksek basınçlı bir pompa ve hücre gerektirir.
1. Numune hazırlama, yüksek basınç hücresinin montajı ve deneylerin ayarlanması.
- Tampon seçimi: Fosfat ve Tris20,21gibi anionik ve katyonik tamponların eşit karışımını kullanın.
NOT: Fosfat ve MES gibi anionik tamponların pKa'ları önemli bir reaksiyon hacmi (yani, asit ve iyonize ürünlerin kısmi molal hacimlerindeki fark) ile ilişkilidir. Bu nedenle, bu tür tamponların pH'ı basınç değişiminden önemli ölçüde etkilenebilir (~0,25-0,5 pH birim/kbar). - Gerekli numune hacminin standart 3 mm çapında NMR tüpüne (~300μL) benzer olduğundan emin olun.
- 15 Netiketli numuneyi zirkonya tüpüne cam pipet ile sokun. Tüpün altındaki örnek koltuklardan emin olun. Numunenin iletim sıvısı (örneğin su) ile karışmasını önlemek için 200 μL mineral yağ ile tamamlayın. Tüpün geri kalanını iletim sıvısı ile doldurun.
- Zirkonya tüpünün üzerine tek kullanımlık bir O-halka koyun ve tüpü tabana kaydırın (Şekil 1A, B). Daha sonra tüpü yüksek basınçlı bağlama hattına bağlayın ve tabanı önce elle hücreye sıkın. Daha sonra, daha düşük basınçta sızıntıları önlemek için 14,7 Nm tork uygulayın (Şekil 1C,D).
- Basınç hücresi tertibatının bütünlüğünü kontrol etmek için, hücre desteği ve muhafaza kabını kullanarak tüpü spektrometrenin dışında 300 bar'a kadar basınçlandırın. 15 dakika bekleyin, basıncı 1 bara sıfırlayın ve temiz tüy bırakmayan bir mendille sızıntı olup olmadığını kontrol edin.
- Basınçsız tüpü, bağlama hattını dikkatlice yönlendirerek spektrometreye yerleştirin. Numune oturma konumuna ulaşana kadar tüpü spektrometreye kaydırın(Şekil 1E).
- 1 H ve 15 N kanallarını her zamanki gibi kilitleyin, dolgu yapın, eşleştirin ve ayarlayın.
NOT: Yüksek basınç dereceli zirkonya tüpleri için dolgular standart NMR tüplerinden çok farklıdır. Optimize edilmiş dolguların ileride kullanılmak üzere kaydedilmeleri önerilir. - 1H-15N-HSQC veya TROSY-HSQC kurun ve atmosferik koşullarda (1bar) bir referans deneyi kaydedin.
2. Yüksek basınçlı NMR deneylerinin kaydedilme
- Proteinin genel stabilitesini test etmek için basıncı kademeli olarak 500 bar artışla 1 bar'dan 2,5 kbar'a yükseltin. Basınç pompasının hızını varsayılan olarak ~18 bar/s olarak ayarlayın. Kesin katlama/açılma oranları bilinmiyorsa, numunenin her 500 barlık artıştan sonra 15-20 dakika arasında dengelenmesine izin verin. 2,5 kbar'da bir spektrum kaydedin.
- Basınç pertürbasyonunun geri döndürülebilirliğini test etmek için 500 bar adımlarla basıncı kademeli olarak 1 bar'a düşürin. Atmosferik koşullarda başka bir spektrum kaydedin ve kimyasal kaymaları ve tepe yoğunluklarını daha önce aynı koşullarda kaydedilen referans spektrumununkiyle karşılaştırın.
NOT: Basınç çalışmasından sonra yerel çapraz geçişler daha yoğunsa, atmosferik basınçta çözeltide bulunan küçük agregaların ayrışmış ve düzgün bir şekilde yeniden katlanmış olabileceğini gösterebilir. Öte yandan, yoğunluktaki bir kayıp veya önemli kimyasal kayma değişiklikleri, proteinin yüksek basınç koşullarında geri döndürülemez bir yanlış katlama yaşayabileceğini göstermektedir. - Her 500 barda 1 bar'dan 2,5 kbar'a kadar bir dizi 2D deneme kaydedin. Uyumun hassasiyetini artırmak için katlama/açma geçişinin çekim noktasının yakınında ek deneylerin kaydedilmeleri önerilir.
3. Tepe yoğunluğu değişikliklerini analiz etme
- Tüm spektrumu işleyin ve omurga atamasını 1 çubukta referans spektrumundan 500 bar'da kaydedilen spektruma aktarın ve ardından atamayı 500 bar'dan 1 kbar'a vb. aktarın.
NOT: Basınç 1 H ve 15 Nkimyasal kaymaların düzgün olmayan bir kaymasına neden olduğundan, omurga atamasını bir spektrumdan diğerine kopyalamayın. El ile ayarlayın. - Sparky menüsünde, Tepe > Tepe Listesi 'ne (lt)tıklayın. Tepe Listesi penceresinde, Seçenekler'i tıklatın ve hem Frekansları (ppm) hem de Veri Yüksekliğinigörüntüleme seçeneğini belirleyin. Her spektrum için elde edilen listeyi kaydedin.
- Eğri sığdırma yazılımında, X ekseni değişkeni olarak basınç değerlerine (çubukta) ve Y ekseni değişkeni olarak yoğunluğa sahip olmak için çapraz geçiş kimliğini ve tepe yoğunluğu değerlerini kopyalayın.
- Tam veya neredeyse tam (%>80) açılma gözlenirse, basit bir iki durumlu model kullanarak, açıldıktan sonra serbest enerji ve hacim değişimini çıkarmak için bireysel tepe yoğunluğu profillerine uyun:
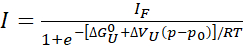 Eş. 1
Eş. 1
Burada, "I" belirli bir basınç p'de bir çaprazlamanın gözlemlenen yoğunluğudur ve IF, aynı çapraz el çarpının tamamen katlanmış bir durumda yoğunluğudur. R gaz sabitidir, T mutlak sıcaklıktır, ΔGU0 atmosferik basınçta p0 (1 bar) açılmış ve katlanmış durumlar arasındaki standart Gibbs serbest enerji farkı ve ΔVu açılmadan sonra hacim değişimi. Çubukta p basıncı ve kelvin, R = 1.987 cal/K sıcaklıkta, ΔGU0 cal/mol'da ve ΔVU cal/mol/bar'dadır. Fit'ten elde edilen ΔVU değerlerini mL/mol'a dönüştürmek için 41,84 ile çarpın. Burada, tüm parametreler açılma reaksiyonu ile ilgili olarak ifade edilir, ancak kolayca katlanır reaksiyon parametrelerine dönüştürülebilir (ΔGU0 =-ΔG F0 ve ΔVU = -ΔVF).
4. Kimyasal kayma değişikliklerinin analizi
- Yazılımdaki sütunları, basınç noktalarını değişken ve Sparky listelerinden Y ekseni olarak çıkarılan 1H kimyasal kaydırmaları olacak şekilde düzenleyin.
- 1H kimyasal kaymalarının basınç bağımlılığını basit bir ikinci dereceden denkleme sığdırın:
δ(p) = δ0(p0) + B1(p-p0) + B2 (p-p0)2 Ayr.
Burada, δ (p) belirli bir basınç p ve δ 0(p0)bir çaprazın ölçülen1H kimyasal kayması, 1barda kaydedilen referans spektrumunda aynı çaprazın 1 H kimyasal kaymasıdır. B1 ve B2, sırasıyla ppm/bar ve ppm/bar2ile ifade edilen birinci ve ikinci derece parametreleri temsil eder.
Sonuçlar
Burada açıklanan protokol, 2,5 kbar aralığında (%>90) neredeyse tamamen açılan hnRNPA1'in (kalıntılar 95-106) ikinci RNA tanıma motifi olan RRM2'nin basınç bağımlılığını araştırmak için kullanılmıştır. 1 H-15N spektrumları 1 bar, 500 bar, 750 bar, 1 kbar, 1.5 kbar, 2 kbar ve 2.5 kbar 'da toplanarak toplandırıldı (Şekil 2). Yerel çapraz uçların hiçbiri 2,5 kbar'daki gürültü seviyesinin üzerinde görünmediği için, karşılık gele...
Tartışmalar
Bu çalışmada, protein yapısal ve termodinamik yanıtlarının basınç pertürbasyonuna araştırılması için uygulanan bir protokol ayrıntılı olarak yer alıyor. Burada RRM2'de kaydedilen yüksek basınç deneyleri, ΔVU değerlerinde, tamamen işbirliğine bağlı olmayan açılmanın göstergesi olan büyük varyasyonların nispeten küçük bir tek alan proteininde bulunabileceğini göstermektedir. Benzer bir tablo basınç altında 1H kimyasal kayma değişikliklerinin analizinden ort...
Açıklamalar
Tüm yazarlar makaleyi okudu ve onayladı. Çıkar çatışması ilan değiller.
Teşekkürler
Bu çalışma Roy J. Carver Hayır Kurumu'ndan Julien Roche'a fonlar tarafından desteklendi. J. D. Levengood ve B. S. Tolbert'e RRM2 örneğini sağladıkları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bruker Nmr Cell 2.5 Kbar | Daedalus Innovations LLC | NMRCELL-B | |
| Sparky3 | University of California San Francisco, CA | N/A | |
| Xtreme-60 Syringe pump | Daedalus Innovations LLC | XTREME-60 |
Referanslar
- Alderson, R. T., Kay, L. E. Unveiling invisible protein states with NMR spectroscopy. Current Opinion in Structural Biology. 60, 39-49 (2020).
- Korzhnev, D. M., Kay, L. E. probing invisible, low-populated states of protein molecules by relaxation dispersion NMR spectroscopy: An application to protein folding. Accounts of Chemical Research. 41, 442-451 (2008).
- Loria, P. J., Berlow, R. B., Watt, E. D. Characterization of enzyme motions by solution NMR relaxation dispersion. Accounts of Chemical Research. 41, 214-221 (2008).
- Ishima, R. CPMG relaxation dispersion. Methods in Molecular Biology. 1084, 29-49 (2014).
- Longo, D. L., et al. Chemical exchange saturation transfer (CEST): an efficient tool for detecting molecular information on proteins' behaviour. Analyst. 39, 2687-2690 (2014).
- Fawzi, N. L., Ying, J., Torchia, D. A., Clore, M. G. Probing exchange kinetics and atomic resolution dynamics in high-molecular-weight complexes using dark-state exchange saturation transfer NMR spectroscopy. Nature Protocols. 7, 1523-1533 (2012).
- Anthis, N. J., Clore, M. G. Visualizing transient dark states by NMR spectroscopy. Quarterly Reviews of Biophysics. 48, 35-116 (2015).
- Roche, J., et al. Cavities determine the pressure unfolding of proteins. Proceedings of the National Academy of Sciences of the United States of America. 109, 6945-6950 (2012).
- Chen, C. R., Makhatadze, G. I. Molecular determinant of the effects of hydrostatic pressure on protein folding stability. Nature Communications. 8, 14561 (2017).
- Roche, J., Royer, C. A. Lessons from pressure denaturation of proteins. Journal of the Royal Society Interface. 15, 20180244 (2018).
- Xu, X., Gagné, D., Aramini, J. M., Gardner, K. H. Volume and compressibility differences between protein conformations revealed by high-pressure NMR. Biophysical Journal. 120, 924-935 (2021).
- Akasaka, K., Li, H. Low-lying excited states of proteins revealed from non-linear pressure shifts in 1H and 15N NMR. Biochemistry. 40, 8665-8671 (2001).
- Akasaka, K. Probing conformational fluctuation of proteins by pressure perturbation. Chemical Reviews. 106, 1814-1835 (2006).
- Kitahara, R., Yokoyama, S., Akasaka, K. NMR snapshots of a fluctuating protein structure: ubiquitin at 30 bar-3 kbar. Journal of Molecular Biology. 347, 277-285 (2005).
- Roche, J., et al. remodeling of the folding free energy landscape of Staphylococcal nuclease by cavity-creating mutations. Biochemistry. 51, 9535-9546 (2012).
- Nucci, N. V., Fuglestad, B., Athanasoula, E. A., Wand, J. A. Role of cavities and hydration in the pressure unfolding of T4 lysozyme. Proceedings of the National Academy of Sciences of the United States of America. 111, 13846-13851 (2014).
- Maeno, A., et al. Cavity as a source of conformational fluctuation and high-energy state: High-pressure NMR study of a cavity-enlarged mutant of T4 lysozyme. Biophysical Journal. 108, 133-145 (2015).
- Peterson, R. W., Wand, J. A. Self-contained high-pressure cell, apparatus, and procedure for the preparation of encapsulated proteins dissolved in low viscosity fluids for nuclear magnetic resonance spectroscopy. Review of Scientific Instruments. 76, 094101 (2005).
- Goddard, T. D., Kneller, D. G. . Sparky 3. , (2010).
- Caro, J. A., Wand, J. A. Practical aspects of high-pressure NMR spectroscopy and its applications in protein biophysics and structural biology. Methods. 148, 67-80 (2018).
- Kitamura, T., Itoh, J. Reaction volume of protonic ionization for buffering agents. Prediction of pressure dependence of pH and pOH. Journal of Solution Chemistry. 16, 715-725 (1987).
- Royer, C. A. Revisiting volume changes in pressure-induced protein unfolding. Biochimica et Biophysica Acta. 1595, 201-209 (2002).
- Erlach, M. B., et al. Relationship between nonliner pressure-induced chemical shift changes and thermodynamic parameters. Journal of Physical Chemistry B. 118, 5681-5690 (2014).
- de Oliveira, G. A. P., Silva, J. L. A hypothesis to reconcile the physical and chemical unfolding of proteins. Proceedings of the National Academy of Sciences of The United States of America. 112, 2775-2784 (2015).
- Nguyen, L. M., Roche, J. High-pressure NMR techniques for the study of protein dynamics, folding and aggregation. Journal of Magnetic Resonance. 277, 179-185 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır