Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Floresan Ömür Boyu Görüntüleme Mikroskobu Kullanarak Kanser Hücrelerinin Metabolizmasını ve Viskozitesini İnceleme
Bu Makalede
Özet
Burada, canlı kanser hücre kültüründe hücresel metabolizmayı ve plazma membran viskozitesini sıralı olarak görüntülemek için floresan ömür boyu görüntüleme mikroskobunun (FLIM) kullanımını gösteriyoruz. Metabolik değerlendirmeler endojen floresan tespit edilerek yapılır. Viskozite, bir floresan moleküler rotor kullanılarak ölçülür.
Özet
Viskozite, canlı hücrelerin morfolojik ve fizyolojik durumunun düzenlenmesi için anahtar parametrelerden biri olduğu için biyolojik bir zarın önemli bir fiziksel özelliğidir. Tümör hücrelerinin plazma zarlarının bileşiminde, yapısında ve fonksiyonel özelliklerinde önemli değişiklikler olduğu bilinmektedir. Glikoz ve lipitlerin düzensiz metabolizması ile birlikte, bu spesifik zar özellikleri, tümör hücrelerinin düşmanca mikro çevreye uyum sağlamasına ve ilaç tedavilerine direnç geliştirmesine yardımcı olur. Burada, canlı kanser hücre kültüründe hücresel metabolizmayı ve plazma membran viskozitesini sıralı olarak görüntülemek için floresan ömür boyu görüntüleme mikroskobunun (FLIM) kullanımını gösteriyoruz. Metabolik değerlendirmeler, indirgenmiş nikotinamid adenin, dinükleotid, NAD(P)H ve oksitlenmiş flavinler gibi endojen metabolik kofaktörlerin floresansının saptanmasıyla gerçekleştirilir. Viskozite, viskoziteye duyarlı sentetik bir boya olan bir floresan moleküler rotor kullanılarak ölçülür ve güçlü bir floresan ömrü yakın ortamın viskozitesine bağlıdır. Kombinasyon halinde, bu teknikler membran durumu ile kanser hücrelerinin metabolik profili arasındaki bağlantıları daha iyi anlamamızı ve kemoterapinin neden olduğu değişiklikleri görselleştirmemizi sağlar.
Giriş
Hücrelerin malign transformasyonuna, morfolojik ve fizyolojik durumlarında çoklu değişiklikler eşlik eder. Kanser hücrelerinin hızlı ve kontrolsüz büyümesi, enerji üretimi ve biyosentezden sorumlu biyokimyasal yolların temelden yeniden düzenlenmesini gerektirir. Kanser metabolizmasının karakteristik özellikleri, normal oksijen konsantrasyonları altında bile (Warburg etkisi) glikoliz oranının artması, alternatif yakıtlar olarak amino asitlerin, yağ asitlerinin ve laktatın kullanılması, yüksek antioksidan seviyelerinin varlığında yüksek ROS üretimi ve yağ asitlerinin biyosentezinin artmasıdır 1,2. Kanser hücresi metabolizmasının oldukça esnek olduğu, bu da elverişsiz ve heterojen ortama uyum sağlamalarına izin verdiği ve ek bir sağkalım avantajı sağladığı artık takdir edilmektedir3.
Değişmiş metabolizma, tümör hücrelerinin zarlarının spesifik organizasyonunu ve bileşimini destekler. Kanser hücrelerinde plazma zarının lipid profili, kanserli olmayan hücrelerden kantitatif olarak farklıdır. Lipidomdaki ana değişiklikler, fosfatidilinositol, fosfatidilserin, fosfatidiletanolamin ve fosfatidilkolin dahil olmak üzere fosfolipid seviyesinin artması, sfingomyelin seviyesinin azalması, kolesterol miktarının artması ve yağ asitlerinin daha düşük derecede doymamışlığıdır, bunlardan birkaçıdır 4,5,6. Bu nedenle, akışkanlığın tersi olan membran viskozitesi gibi membranın fiziksel özellikleri kaçınılmaz olarak değişir. Viskozite, biyolojik zarların geçirgenliğini belirlediğinden ve zarla ilişkili proteinlerin (enzimler, taşıyıcılar, reseptörler) aktivitesini kontrol ettiğinden, homeostatik düzenlemesi hücre işleyişi için hayati önem taşır. Aynı zamanda, membran lipid profilinin ayarlanması yoluyla viskozitenin modifikasyonu, hücre göçü/istilası ve koşullu değişiklikler üzerine hayatta kalma için önemlidir.
Floresan ömür boyu görüntüleme mikroskobu (FLIM), endojen floresan veya eksojen problar7 kullanılarak canlı hücrelerde çoklu parametrelerin non-invaziv değerlendirmesi için güçlü bir yaklaşım olarak ortaya çıkmıştır. FLIM yaygın olarak (alt) hücresel çözünürlük sağlayan çok fotonlu bir lazer tarama mikroskobu üzerinde gerçekleştirilir. Zamanla ilişkili tek foton sayma (TCSPC) modülü ile donatıldığında, yüksek doğrulukla zaman çözümlü floresan ölçümlerini mümkün kılar8.
FLIM ile hücresel metabolizmanın araştırılması, dehidrojenazların endojen kofaktörlerinin, indirgenmiş nikotinamid adenin dinükleotid (fosfat), NAD(P)H ve oksitlenmiş flavinlerin - flavin adenin dinükleotid FAD ve flavin mononükleotid FMN'nin floresan ölçümüne dayanır ve bunlar bir dizi biyokimyasal reaksiyonda elektron taşıyıcıları olarak işlev görür 7,9,10. NAD (P) H'nin tespit edilen floresansı, spektral olarak neredeyse aynı oldukları için NADH ve fosforile formu olan NADPH'den gelmektedir. Tipik olarak, NAD(P)H ve flavenlerin floresan bozunmaları iki üstel bir fonksiyona uyar. NAD (P) H durumunda, birinci bileşen (~ 0.3-0.5 ns, ~% 70 -% 80) glikoliz ile ilişkili serbest durumuna ve ikinci bileşen (~ 1.2-2.5 ns, ~% 20 -% 30) mitokondriyal solunum ile ilişkili proteine bağlı durumuna. Flavinler söz konusu olduğunda, kısa bileşen (~ 0.3-0.4 ns, ~% 75 -% 85) FAD'ın söndürülmüş durumuna ve uzun bileşen (~ 2.5-2.8 ns, ~% 15 -% 25) söndürülmemiş FAD, FMN ve riboflavine atanabilir. Glikoliz, glutaminoliz, oksidatif fosforilasyon ve yağ asidi sentezinin nispi seviyelerindeki değişiklikler, kofaktörlerin kısa ve uzun ömürlü fraksiyonlarında değişikliklere neden olur. Ek olarak, bu floroforların floresan yoğunluk oranı (redoks oranı) hücresel redoks durumunu yansıtır ve aynı zamanda metabolik bir gösterge olarak kullanılır. Redoks oranı, floresan ömrü ile karşılaştırıldığında, veri toplama açısından daha basit bir metrik sunsa da, FLIM, NAD(P)H ve FAD'yi tahmin etmek için avantajlıdır, çünkü floresan ömrü, floroforun içsel bir özelliğidir ve özellikle dokularda uyarma gücü, fotoağartma, odaklanma, ışık saçılımı ve absorpsiyonu gibi faktörlerden neredeyse hiç etkilenmez, emisyon yoğunluğunun aksine.
Canlı hücrelerde ve dokularda viskoziteyi mikroskobik düzeyde haritalamanın uygun yollarından biri, floresan parametrelerinin yerel viskoziteye11,12 güçlü bir şekilde bağlı olduğu floresan moleküler rotorların, küçük sentetik viskoziteye duyarlı boyaların kullanımına dayanmaktadır. Viskoz bir ortamda, molekül içi bükülme veya dönüşün yavaşlaması nedeniyle rotorun floresan ömrü artar. Moleküler rotorlar arasında, bor dipirrometen (BODIPY) türevleri, fizyolojik viskozite aralığında iyi bir dinamik floresan ömrü aralığına, sıcaklık bağımsızlığına, basit veri yorumlamasına izin veren monoüstel floresan bozunmalarına, yeterli suda çözünürlüğe ve düşük sitotoksisiteye sahip oldukları için biyolojik sistemlerde viskoziteyi algılamak için çok uygundur13,14. BODIPY bazlı rotorlar ve FLIM kullanılarak mikroviskozitenin kantitatif değerlendirmeleri daha önce in vitro kanser hücresi, çok hücreli tümör sferoidleri ve fare tümörü in vivo15,16 üzerinde gösterilmiştir.
Burada, FHIM tarafından in vitro olarak kanser hücrelerinde hücresel metabolizmayı ve plazma zarı viskozitesini incelemek için sıralı sondalama metodolojilerinin ayrıntılı bir tanımını sunuyoruz. Nispeten zayıf endojen floresansın BODIPY bazlı rotorun floresansı ile kirlenmesini önlemek için, aynı hücre tabakasının görüntülenmesi, önce görüntülenen NAD (P) H ve FAD floresansı ile sırayla gerçekleştirilir. Kofaktörlerin floresan ömürleri sitoplazmada ölçülür ve rotorun floresan ömrü, ilgili bölgeler olarak karşılık gelen bölgelerin manuel olarak seçilmesiyle hücrelerin plazma zarlarında ölçülür. Protokol, farklı kanser hücre hatları için metabolik durum ve viskoziteyi ilişkilendirmek ve kemoterapi sonrası değişiklikleri değerlendirmek için uygulandı.
FLIM numune hazırlama protokolü, konfokal floresan mikroskobu için olandan farklı değildir. Veriler elde edildikten sonra, ana görev ham verilerden floresan ömrünü çıkarmaktır. Protokolün performansı HCT116 (insan kolorektal karsinomu), CT26 (murin kolon karsinomu), HeLa (insan servikal karsinomu) ve huFB (insan derisi fibroblastları) hücreleri kullanılarak gösterilmiştir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. FLIM gerçekleştirmek için minimum kurulumun açıklaması
- Bu deneyi gerçekleştirmek için gerekli kurulumun mevcut olduğundan emin olun: ters çevrilmiş bir konfokal mikroskop, darbeli bir lazer, tipik olarak bir ps veya fs, senkronizasyon sinyali, hızlı bir foton sayma dedektörü (zaman tepkisi 150 ps) ve foton sayma elektroniği, dedektör ve lazer için sırasıyla mevcut çıkış ve giriş portları, mikroskop üzerinde, mikroskop tarama kontrolöründen gelen tarama saati darbeleri, lazer ışını birleştiricileri ve FLIM için kullanılan lazerin dalga boyuna uygun ana dikroik ışın ayırıcılar ile mikroskobun tarama kafası.
- FDIM için iki fotonlu uyarma kullanılıyorsa, mikroskobun NDD bağlantı noktasını içerdiğinden emin olun.
- Memeli hücre çalışmaları için, özellikle uzun süreli deneyler için, bir CO2 inkübatörünün istenen sıcaklıkta tutulduğundan emin olun.
NOT: Bu deneyde kullanılan sistem için Malzeme Tablosuna bakınız.
2. Mikroskopi için hücrelerin hazırlanması
- Hücreleri rutin olarak 37 ° C'de bir inkübatörde %5 CO2 ve nemli bir atmosfer ile büyütün.
- Mikroskopi için, hücre süspansiyonunu 1 x 106 hücre / mL konsantrasyonunda tam bir kültür ortamında hazırlayın.
NOT: Hücre konsantrasyonları ve ortam koşulları hücreye bağlıdır. Tohumlama için kullanılan hücre sayısı ve kuluçka süresi, mikroskobik çanakta% 70 -% 80 birleşme elde edecek şekilde uyarlanmalıdır. - Hücreleri, 200 μL'lik bir otomatik pipet kullanarak cam tabanlı 35 mm'lik hücre kültürü kaplarına (tabak başına 100 μL'de 1 x10 5 hücre) tohumlayın.
NOT: Dinamik olarak aynı mikroskobik görüş alanlarındaki hücreleri izlemek için hücre tohumlaması için ızgaralı cam tabanlı tabaklar kullanın.- Manuel tohumlama sırasında, tabana zarar vermemek için pipet ucunun tabağın altını veya yanlarını çizmediğinden emin olun.
- Çanağı CO2 inkübatörüne (37 °C,% 5 CO2, nemli atmosfer) yerleştirin ve hücreleri 24 saat inkübe edin.
- 24 saat sonra, çanağı inkübatörden çıkarın ve ışık mikroskobu altında hücrelerin morfolojisini ve birleştiğini kontrol edin. Hücreler yaklaşık% 80 birleşmeye ulaşmadıysa, 24 saat daha inkübe edin.
- 1.000 μL'lik otomatik pipet kullanarak eski ortamı tabaktan nazikçe çıkarın ve fenol kırmızısı içermeyen 2 mL DMEM ortamı ekleyin (ör., DMEM Life veya FluoroBrite).
NOT: Görüntüleme için farklı kültür ortamları kullanılabilir. Mikroskopi için hücreler kullanırken ortamdaki fenol kırmızısından kaçının. - Hücrelerin adaptasyonunu sağlamak için çanağı 60-120 dakika inkübatöre yerleştirin.
3. Metabolik kofaktörlerin FLIM
- Cam tabanlı tabağı hücrelerle birlikte (adım 2.7'den itibaren) mikroskop tablasına yerleştirin.
- Lazer taramalı mikroskop yazılımındaki (örneğin, ZEN - ZEISS Efficient Navigation) Bul sekmesine tıklayın ve ardından ışığı açmak için İletim Işığı (TL) öğesine tıklayın.
- Bir karenin hücreler tarafından maksimum olarak işgal edildiği (40x büyütmede) hücrelerin merkezi dilim seviyesindeki göz merceğinden görüntüleyerek numunenin odak düzlemini bulun.
- Işığı kapatmak için KAPALI düğmesine tıklayın.
- Edinme sekmesini açın. Endojen NAD(P)H'nin iletim ve otofloresan yoğunluğu görüntülerini elde etmek için aşağıdaki ayarları girin: Uyarma dalga boyu: iki foton modu 750 nm, Kayıt aralığı: 450-490 nm, Lazer gücü: %5 (~6 mW), Görüntü boyutu: 1024 x 1024 piksel.
NOT: Uyarma dalga boyu ve kayıt aralığının seçimi, NAD(P)H17'nin spektral özelliklerine (maksimum uyarma ve maksimum emisyon) dayanmaktadır.- Görüntü elde etmek için yağa daldırma objektif lensi С Plan-Apochromat 40x/1.3 NA kullanın.
- Yapış düğmesine basın ve görüntüyü ZEN formatında kaydedin.
- FAD'nin iletim ve otofloresan yoğunluğu görüntülerini elde etmek için, Uyarma Dalga Boyunu 900 nm olarak değiştirin. Kayıt Aralığı: 500-550 nm, Lazer gücü: %9 (~6 mW) ve Görüntü Boyutu: 1024 x 1024 piksel'i ayarlayın.
NOT: Uyarma dalga boyu ve kayıt aralığının seçimi, FAD18'in spektral özelliklerine (maksimum uyarma ve maksimum emisyon) dayanmaktadır.- Görüntü elde etmek için yağa daldırma objektif lensi С Plan-Apochromat 40x/1.3 NA kullanın.
- Yapış düğmesine basın ve görüntüyü ZEN formatında kaydedin.
- NAD(P)H için, parametreleri lazer tarama mikroskobu yazılımında adım 3.5'te açıklandığı gibi ayarlayın. Görüntü Boyutu'nu 256 x 256 piksel olarak değiştirin.
- SPCM (Tek Foton Sayma Modülleri) menüsüne aşağıdaki parametreleri girin: FLIM modülünün işletim yazılımı: Toplama Süresi: 60 sn; TAC Aralığı: 5.00E-8; CFD Limiti düşük: -29.41; ADC Çözünürlüğü: 256, Görüntüler Boyutu: 256 x 256 piksel.
- Numuneyi 60 saniye tarayın, taramayı durdurun ve elde edilen NAD(P)H FLIM görüntüsünü kaydedin.
- Elde edilen FLIM verilerini kontrol edin. Bunun için, ham verileri görüntü yazılımında açın , imleci üzerine getirerek hücrenin sitoplazmasındaki bir pikseli seçin ve bu pikseldeki floresan bozunmasını analiz edin. Piksel yoğunlukları, gruplama 1'de bozunma eğrisi başına ≥3.000 foton olmalıdır.
NOT: Foton sayısı 3.000'in altındaysa, hücrelerin morfolojisini ve foton sayma hızını kontrol ederken lazer gücünü veya görüntü toplama süresini artırın. Tipik olarak, sayım oranındaki düşüş başlangıç değerinin% 10'unu aşarsa, foto ağartma gerçekleşir. - FAD için, parametreleri lazer tarama mikroskobunun yazılımındaki adım 3.7'de açıklandığı gibi ayarlayın. Görüntü boyutunu 256 x 256 piksel olarak değiştirin.
- SPCM (Tek Foton Sayma Modülleri) menüsüne aşağıdaki parametreleri girin: FLIM modülünün işletim yazılımı: Toplama süresi: 60 s; TAC Aralığı: 5.00E-8; CFD Limiti düşük: -29.41; ADC Çözünürlüğü: 256, Görüntüler Boyutu: 256 x 256 piksel.
- Numuneyi 60 saniye boyunca tarayın. Taramayı durdurun ve FAD'ın elde edilen FLIM görüntüsünü kaydedin.
NOT: Adım 3.10 ve 3.15'te belirtilen parametreler, kullanılan elektronik aksamlara ve dedektöre özeldir. - Elde edilen verileri adım 3.12'de açıklandığı gibi kontrol edin.
- Farklı görüş alanlarından FLIM görüntüleri kaydetmek için 3.5-3.16 adımlarını tekrarlayın.
4. Floresan moleküler rotor ile hücrelerin boyanması
NOT: Hücreler, rotorun içselleşmesini yavaşlatmak için oda sıcaklığında (~ 20 ° C) yıkanmadan floresan moleküler rotor çözeltisinde görüntülenir. Membran viskozitesi, önceki çalışmalarımızdagösterildiği gibi sıcaklığa bağlıdır 19,20. Mikroskobun sıcaklık kontrollü aşaması önceden, yani rotor hücrelere eklenmeden önce kapatılmalıdır. Kurulumumuz için sahnenin soğutulması yaklaşık 10 dakika sürüyor.
- Floresan moleküler rotor BODIPY 2'nin (Stok 1, 25,7 mM) genel bir stok çözeltisini hazırlayın.
- BODIPY 2'yi steril bir ortamda açın ve doğru bir terazi kullanarak yaklaşık 2 mg ağırlığında tutun. Dikkatlice bir mikrosantrifüj tüpüne yerleştirin.
- 3 μL'lik uygun bir çözücü (örn., DMSO) eklemek için otomatik 20 μL'lik bir pipet kullanın.
- Numune DMSO'da tamamen çözündüğünde, 297 μL steril PBS ekleyin ve otomatik 200 μL'lik bir pipet kullanarak iyice karıştırın.
NOT: Stok solüsyonunu buzdolabında +4 °C'de koyu renkli ambalajda saklayınız. Yeniden askıya alındıktan sonra buzdolabında birkaç ay saklanabilir.
- Bir mikrosantrifüj tüpüne 25 μL genel stok çözeltisi (Stok 1) ve ardından 48 μL steril PBS ekleyerek bir Stok 2 (8.9 mM) hazırlayın. Otomatik 200 μL'lik bir pipet kullanarak hafifçe karıştırın.
NOT: Mikromolar konsantrasyon gerektiğinden hücre boyaması için uygulanan son boyama stoğunu hazırlamak için stok 2'yi kullanın. - Tabaktaki kültür ortamını (adım 3.1'den itibaren) Ca2 + / Mg2 + içermeyen buz gibi Hank çözeltisi ile nazikçe değiştirin ve hücreleri +4 ° C'de 3 dakika inkübe edin.
NOT: Buz gibi soğuk çözelti kullanımı ve +4 °C'de inkübasyon, moleküler rotorun içselleştirilmesini yavaşlatır ve zarın lokal lekelenmesi 20-30 dakika devam eder. - 999 μL buz gibi soğuk Hank çözeltisine veya PBS'ye 1 μL Stok 2 ekleyerek 4,5 μM BODIPY 2 içeren son boyama solüsyonunu hazırlayın.
NOT: Son boyama çözeltisindeki BODIPY 2 konsantrasyonu, hücreler üzerinde herhangi bir toksik etki olmaksızın ~ 10 μM'ye yükseltilebilir, bu da daha verimli bir boyama ve daha fazla sayıda toplanan foton ile sonuçlanır. Daha yüksek konsantrasyonlarda, FLIM dedektörünün aşırı yüklenmesi meydana gelebilir. - Hank solüsyonunu hücre kültürü kabından aspire edin ve buz gibi soğuk 4.5 μM BODIPY 2 solüsyonu ile değiştirin. Hücreler yıkanmadan BODIPY 2 solüsyonunda görüntülenir.
5. Hücrelerdeki floresan moleküler rotorun FLIM
NOT: BODIPY 2'nin floresan spektrumu, endojen kofaktörler NAD(Р)H ve FAD12,17,18'in emisyonu ile örtüştüğünden, her zaman metabolik kofaktörlerin FLIM'inden sonra floresan moleküler rotorun FLIM'ini gerçekleştirin.
- Lekeli hücrelerin bulunduğu çanağı görüntüleme için mikroskop aşamasına (~ 20 ° C) aktarın.
- Lazer tarama mikroskobunun yazılımında tek foton modu için aşağıdaki parametreleri ayarlayın: Argon iyon lazeri ile 488 nm dalga boyunda uyarma , Lazer gücü %1-%2, Kayıt Aralığı 500-550 nm dalga boyu.
- Görüntü elde etmek için yağa daldırma objektif lensi С Plan-Apochromat 40x/1.3 NA kullanın.
- Canlı düğmesine basın. Entegre bir motorlu aşama ile XY ve Z konumlandırmasını taramaya ve kullanmaya başlayın, odağı ayarlayın ve bir önizleme penceresinde hücrelerin iletim ve floresan yoğunluğu görüntülerini elde edin. Gerekirse elde edilen görüntüleri kaydedin.
- Rotorun floresansının beklenen konumdan (hücrenin plazma zarı) gelip gelmediğini görmek için üst üste binen iletim ve floresan görüntüsünü kontrol edin.
- FLIM modülünün SPCM yazılımı menüsüne aşağıdaki parametreleri girin: Toplama süresi: 60 s; TAC Aralığı: 5.00E-8; CFD Limiti düşük: -29.41; ADC Çözünürlüğü: 256, Görüntüler Boyutu: 256 x 256 piksel.
NOT: FLIM için kullanılan sistem yapılandırmasına ve dedektörlere bağlı olarak, görüntü alma parametreleri değişebilir. - Mikroskobun Ti: Safir lazerini 850 nm dalga boyuna ve iki fotonlu FLIM için Lazer Gücünü %1-2'ye ayarlayın.
- Lazer tarama mikroskobu yazılımında Sürekli sekmesini seçin ve ardından SPCM yazılımında Başlat'a basın. Örneği 60 saniye tarayın, taramayı durdurun ve elde edilen FLIM görüntüsünü kaydedin.
- Elde edilen FLIM verilerini kontrol edin. Bunun için ham verileri FLIM veri analizi SPCImage yazılımına yükleyin, imleci üzerine getirerek hücre zarındaki bir pikseli seçin ve bu pikseldeki floresan çürümesini analiz edin. Piksel yoğunlukları, makul bir toplama süresinde (60-120 sn) bozunma başına (muhtemelen gruplama dahil) ≥5.000 olmalıdır.
- Farklı görüş alanlarından hücrelerin FLIM görüntülerini kaydetmek için 5.4-5.8 adımlarını tekrarlayın.
NOT: BODIPY 2 ile boyanmış canlı hücrelerin FLIM ölçümleri, BODIPY 2 eklendikten sonra ~ 30 dakika ile sınırlandırılmalıdır.
6. Veri analizi
- Floresan yoğunluk analizi: redoks oranı
- ImageJ kullanarak NAD(P)H ve FAD'nin floresan yoğunluğunun görüntülerini açın.
- Bir daire veya kare seçeneği kullanarak NAD(P)H görüntüsünde hücresiz bir alanı vurgulayın. Ölç'e tıklayın ve ardından arka plan sinyalinin elde edilen değerini çıkarmak için Çıkar'a tıklayın (ana panelde İşlem'i seçin ve ardından Matematik ve Çıkar'ı seçin).
- FAD görüntüsü için 6.1.2 adımını tekrarlayın.
- FAD floresan yoğunluğunu NAD(P)H floresan yoğunluğuna bölerek redoks oranının görüntüsünü elde edin. Bunu, ana panelde İşlem'i seçerek yapın ve ardından Görüntü Hesaplayıcı ve Böl'ü seçin; Yeni pencere oluştur kutusunu işaretleyin ve ardından Tamam'a basın.
- Görüntüyü TIFF formatında kaydedin.
- Redoks oranını hesaplamak için, TIFF görüntüsündeki belirli hücredeki sitoplazmanın bölgesini seçin ve M tuşuna basın. İlgilendiğiniz tüm hücreler için bu işlemi tekrarlayın.
- Ölçümü bir elektronik tablo belgesine aktarın.
NOT: Alternatif olarak, hücrelerdeki NAD (P) H ve FAD'nin floresan yoğunlukları, mikroskobun standart yazılımı kullanılarak ölçülebilir ve redoks oranı, bu değerlerin elektronik tablo yazılımına bölünmesiyle elde edilebilir.
- FLIM veri analizi: metabolizma
- NAD(P)H'nin FLIM görüntüsünü SPCImage yazılımına aktarın.
- Bileşenler bölümüne 2 koyarak görüntüye iki üstel bozunma uyumu uygulayın.
- SPCImage yazılımındaki ilgili kutuyu işaretleyerek Offset parametresini düzeltin.
- Seçenekler'e gidin ve Model'i seçin. Eksik Çok Üstel uydurma modelini ve Sığdırma Yöntemi MLE'yi kullanın.
- Bozunma eğrisi başına ≥5000 fotonluk piksel yoğunlukları elde etmek için gruplamayı ayarlayın.
- χ2 değerini kontrol edin. χ2≤ 1.20, kullanılan modelin makul bir uyum sağladığını gösterir.
- Üst menüye tıklayarak her görüntüdeki floresan ömrünün histogramını hesaplayın Hesapla, ve sonra Bozunma Matrisi, üzerine.
- Belirli bir hücrenin sitoplazmasındaki alanı ilgi alanı olarak seçin.
- Renk seçeneğini kullanarak kısa ve uzun ömürlü bileşenleri (sırasıyla τ1 ve τ2) ve ömür boyu bileşenlerin göreli genliklerini (a1 vea 2, buradaa 1 + a2 = %100) analiz edin.
- Ölçümleri bir elektronik tablo yazılımına aktarın.
- İlgilendiğiniz her hücre için 6.2.8-6.2.10 adımlarını tekrarlayın.
- FAD görüntüsü için 6.2.1-6.2.11 adımlarını tekrarlayın.
- FLIM veri analizi: viskozite
- FLIM görüntüsünü FLIM veri analizi SPCImage yazılımına aktarın.
- Dağılım kutusundaki işareti kaldırın.
- Rotor floresan bozulmasının monoüstel bir modele uyması gerektiğinden, Bileşenler bölümüne 1 koyun.
- Bozunma eğrisi başına ≥5000 fotonluk bir piksel yoğunluğu elde etmek için gruplamayı ayarlayın.
- Plazma zarındaki χ2 değerini kontrol edin. χ2≤ 1.20 değeri, kullanılan modelin makul bir uyum sağladığını gösterir. χ2≥ 1.20 durumunda, monoüstel yaklaşım uygulanamaz, bu tür veriler boya agregasyonunu gösterebilir ve atılmalıdır. Toplulaştırma, kalibrasyon eğrilerinin kullanılmasını imkansız hale getirir ve yanlış viskozite tahminlerine yol açar.
NOT: İki üstel bozunmalar toplamanın göstergesi olabilir. Değişken filtrelere sahip FLIM modüllü bir mikroskopta bu, referans21'de açıklandığı gibi monomer ve agregaya özgü emisyon dalga boyu aralıkları, 500-550 nm ve 580-650 nm test edilerek tespit edilebilir. - Üst menüye tıklayarak her görüntü için floresan ömrünün τ histogramını oluşturun Hesapla, ve sonra Bozunma Matrisi.
- ROI seçeneğini kullanarak monoüstel bozunma (χ2≤ 1.20) olan tek bir hücrenin plazma zarı bölgesini seçin.
- Floresan ömrünün değerini bir elektronik tablo yazılımına aktarın.
- İlgilendiğiniz her hücre için 6.3.7-6.3.8 adımlarını tekrarlayın.
- Aşağıdaki denklemi kullanarak BODIPY 2'nin deneysel olarak ölçülen ömürlerini (ns cinsinden) viskozite değerlerine (cP cinsinden) dönüştürün (daha önce metanol/gliserol karışımlarında BODIPY'nin kalibrasyon grafiği temelinde elde edilmişti):
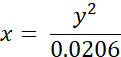
burada x - viskozite (cP cinsinden), y - floresan ömrü τ (ns cinsinden).
NOT: IRF (Alet Yanıt Fonksiyonu), FLIM bağlantısının önemli bir parçasıdır. SPCImage'de IRF, floresan bozunma eğrilerinin yükselen kenarından otomatik olarak hesaplanır. Bu arada, IRF, floresan olmayan numune, örneğin seramikler veya SHG (İkinci Harmonik Nesil) sinyali üreten bir numune, örneğin kollajen, üre kristalleri veya şeker kullanılarak kaydedilebilir. Yazılımda hesaplama seçeneği varsa, kaydedilen IRF'lerin kullanılması önerilmez.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Burada açıklanan protokolü kullanarak, FLIM kullanarak canlı kültürlenmiş hücrelerde metabolik kofaktörleri ve mikroskobik membran viskozitesini görselleştirdik. Ölçümler farklı kanser hücre hatlarında yapılmıştır - insan kolorektal karsinomu HCT116, murin kolon karsinomu CT26, insan rahim ağzı kanseri HeLa Kyoto ve insan derisi fibroblastları huFB.
Floresan yoğunluğuna...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu protokol, kanser hücrelerinin multiparametrik, fonksiyonel ve biyofiziksel analizi için FLIM'in olanaklarını göstermektedir. Endojen floresansa dayalı optik metabolik görüntüleme ve floresan moleküler rotor ile ekzojen etiketleme kullanılarak plazma membran viskozitesi ölçümlerinin kombinasyonu, bir hücre kültüründeki canlı kanser hücrelerinde bu iki parametre arasındaki bağlantıları karakterize etmemizi ve kemoterapiye yanıt olarak değişiklikleri takip etme...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Metabolik görüntüleme protokolünün geliştirilmesi Rusya Federasyonu Sağlık Bakanlığı tarafından desteklenmiştir (Hükümet Görevi, kayıt No. АААА-А20-120022590098-0). Viskozite çalışması, Rusya Bilim Vakfı tarafından desteklenmiştir (Proje No. 20-14-00111). Yazarlar, video prodüksiyonu konusundaki yardımları için Anton Plekhanov'a (PRMU) müteşekkirdir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Item/Device | |||
| Cell culture incubator | Sanyo | 37°C, 5% CO2, humidified atmosphere | |
| Centrifuge 5702 R | Eppendorf | 5703000010 | |
| imageJ 1.53c | Wayne Rasband (NIH) | ||
| FLIM module Simple Tau 152 TCSPC (in LSM 880) | Becker & Hickl GmbH | ||
| Laminar flow hood | ThermoFisher Scientific | ||
| Leica microscope DFC290 | Leica Microsystems | ||
| LSM 880 confocal microscope | Carl Zeiss | ||
| Ti:Sapphire femtosecond laser Mai Tai | Spectra Physics | ||
| Microscope incubator XLmulti S DARK LS | PeCon GmbH | 273-800 050 | |
| Mechanical pipettor | Sartorius mLINE | volume 0.5-10 μL; 20-200 μL; 100-1000 μL | |
| Oil-immersion objective C-Apochromat 40×/1.2 NA W Korr (in LSM 880) | Carl Zeiss | 421767-9971-790 | |
| Power-Tau 152 module with the detector HPM-100-40 | Becker&Hickl GmbH | ||
| SPCImage software | Becker & Hickl GmbH | SPC 9.8; SPCImage 8.3 | |
| ZEN software | Carl Zeiss | ZEN 2.1 SP3 (black), Version 14.0.0.201 | |
| Reagent/Material | |||
| 5-fluorouracil | Medac GmbH | 3728044 | |
| DMEM | Gibco, Life Technologies | 31885023 | |
| DMSO | PanEco | F135 | |
| FBS | Hyclone | A3160801 | |
| FluoroBright DMEM | Gibco, Life Technologies | A1896701 | |
| Hank’s solution without Ca2+/Mg2+ | Gibco, Life Technologies | 14175 | |
| l-Glutamine | PanEco | F032 | |
| Mammalian cells | HCT116, CT26, HeLa Kyoto, huFB | ||
| Molecular rotor BODIPY 2 | Synthesized and Supplied by Marina Kuimova Group, Imperial College London | ||
| Penicillin/streptomycin | PanEco | A065 | |
| Tissue culture dish with cover glass-bottom FluoroDishes | World Precision Instruments, Inc | ||
| Trypsin- EDTA 0.25% | PanEco | P034 | |
| Versen buffer | PanEco | R080p |
Referanslar
- Vazquez, A., et al. Cancer metabolism at a glance. Journal of Cell Science. 129 (18), 3367-3373 (2016).
- Li, Z., Zhang, H. Reprogramming of glucose, fatty acid, and amino acid metabolism for cancer progression. Cellular and Molecular Life Sciences. 73 (2), 377-392 (2015).
- Strickaert, A., et al. Cancer heterogeneity is not compatible with one unique cancer cell metabolic map. Oncogene. 36 (19), 2637-2642 (2016).
- Szlasa, W., Zendran, I., Zalesińska, A., Tarek, M., Kulbacka, J. Lipid composition of the cancer cell membrane. Journal of Bioenergetics and Biomembranes. 52, 321-342 (2020).
- Preta, G. New insights into targeting membrane lipids for cancer therapy. Frontiers in Cell and Developmental Biology. 8, 571237(2020).
- Kojima, K. Molecular aspects of the plasma membrane in tumor cells. Nagoya Journal of Medical Science. 56, 1-18 (1993).
- Datta, R., Heaster, T. M., Sharick, J. T., Gillette, A. A., Skala, M. C. Fluorescence lifetime imaging microscopy: fundamentals and advances in instrumentation, analysis, and applications. Journal of Biomedical Optics. 25 (7), 071203(2020).
- Becker, W. Advanced time-correlated single photon counting applications. Springer Series in Chemical Physics. , Springer. (2015).
- Shirmanova, M. V., Shcheslavskiy, V. I., Lukina, M. M., Becker, W., Zagaynova, E. V. Exploring tumor metabolism with time-resolved fluorescence methods: From single cells to a whole tumor. Multimodal Optical Diagnostics of Cancer. 3, 133-155 (2020).
- Kalinina, S., Rück, A. FLIM and PLIM in biomedical research. An innovative way to combine autofluorescence and oxygen measurements. Photonics & Lasers in Medicine. 5 (4), 257-266 (2016).
- Kuimova, M. K. Molecular rotors image intracellular viscosity. Chimia. 66 (4), 159-165 (2012).
- Kuimova, M. K. Mapping viscosity in cells using molecular rotors. Physical Chemistry Chemical Physics. 14 (37), 12671(2012).
- Haidekker, M. A., Theodorakis, E. A. Molecular rotors-fluorescent biosensors for viscosity and flow. Organic & Biomolecular Chemistry. 5, 1669-1678 (2007).
- Liu, X., et al. Molecular mechanism of viscosity sensitivity in BODIPY rotors and application to motion-based fluorescent sensors. ACS Sensors. 5 (3), 731-739 (2020).
- Shirmanova, M. V., Shimolina, L. E., Lukina, M. M., Zagaynova, E. V., Kuimova, M. K. Live cell imaging of viscosity in 3D tumour cell models. Multi-Parametric Live Cell Microscopy of 3D Tissue Models. Advances in Experimental Medicine and Biology. Dmitriev, R. 1035, 143-153 (2017).
- Shimolina, L. E., et al. Imaging tumor microscopic viscosity in vivo using molecular rotors. Scientific Reports. 7, 41097(2017).
- Scott, T. G., Spencer, R. D., Leonard, N. J., Weber, G. Synthetic spectroscopic models related to coenzymes and base pairs. V. Emission properties of NADH. Studies of fluorescence lifetimes and quantum efficiencies of NADH, AcPyADH, [reduced acetylpyridineadenine dinucleotide] and simplified synthetic models. Journal of the American Chemical Society. 92 (3), 687-695 (1970).
- Harvey, R. A., Damle, S. A fluorescent modification of flavin adenine dinucleotide. FEBS Letters. 26 (1-2), 341-343 (1972).
- Kubánková, M., Summers, P., López-Duarte, I., Kiryushko, D., Kuimova, M. K. Microscopic viscosity of neuronal plasma membranes measured using fluorescent molecular rotors: Effects of oxidative stress and neuroprotection. ACS Applied Materials and Interfaces. 11, 36307-36315 (2019).
- Kubánková, M., López-Duarte, I., Kiryushko, D., Kuimova, M. K. Molecular rotors report on changes in live cell plasma membrane microviscosity upon interaction with beta-amyloid aggregates. Soft Matter. 14, 9466-9474 (2018).
- Wu, Y., et al. Molecular rheometry: Direct determination of viscosity in Lo and Ld lipid phases via fluorescence lifetime imaging. Physical Chemistry Chemical Physics. 15 (36), 14986(2013).
- Shimolina, L. E., et al. Mapping cisplatin-induced viscosity alterations in cancer cells using molecular rotor and fluorescence lifetime imaging microscopy. Journal of Biomedical Optics. 25 (12), 126004(2020).
- Berezin, M. Y., Achilefu, S. Fluorescence lifetime measurements and biological imaging. Chemical Reviews. 110 (5), 2641-2684 (2010).
- Skala, M. C., et al. In vivo multiphoton fluorescence lifetime imaging of protein-bound and free nicotinamide adenine dinucleotide in normal and precancerous epithelia. Journal of Biomedical Optics. 12 (2), 024014(2007).
- Rück, A., Hauser, C., Mosch, S., Kalinina, S. Spectrally resolved fluorescence lifetime imaging to investigate cell metabolism in malignant and nonmalignant oral mucosa cells. Journal of Biomedical Optics. 19 (9), 096005(2014).
- Lee, D. -H., Li, X., Ma, N., Digman, M. A., Lee, A. P. Rapid and label-free identification of single leukemia cells from blood in a high-density microfluidic trapping array by fluorescence lifetime imaging microscopy. Lab on a Chip. 18 (9), 1349-1358 (2018).
- Lukina, M. M., et al. Interrogation of tumor metabolism in tissue samples ex vivo using fluorescence lifetime imaging of NAD(P)H. Methods and Applications in Fluorescence. 8 (1), 014002(2019).
- Alam, S. R., et al. Investigation of mitochondrial metabolic response to doxorubicin in prostate cancer cells: An NADH, FAD and Tryptophan FLIM assay. Scientific Reports. 7 (1), 10451(2017).
- Walsh, A. J., et al. Quantitative optical imaging of primary tumor organoid metabolism predicts drug response in breast cancer. Cancer Research. 74 (18), 5184-5194 (2014).
- Lukina, M. M., et al. In vivo metabolic and SHG imaging for monitoring of tumor response to chemotherapy. Cytometry Part A. 95 (1), 47-55 (2019).
- Shah, A. T., et al. Optical metabolic imaging of treatment response in human head and neck squamous cell carcinoma. PLoS One. 9 (3), 90746(2014).
- Sergeeva, T. F., et al. Relationship between intracellular pH, metabolic co-factors, and caspase-3 activation in cancer cells during apoptosis. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1864 (3), 604-611 (2017).
- Shirmanova, M. V., et al. Chemotherapy with cisplatin: insights into intracellular pH and metabolic landscape of cancer cells in vitro and in vivo. Scientific Reports. 7, 8911(2017).
- Lukina, M. M., et al. Metabolic cofactors NAD(P)H and FAD as potential indicators of cancer cell response to chemotherapy with paclitaxel. Biochimica et Biophysica Acta (BBA) - General Subjects. 1862 (8), 1693-1700 (2018).
- Druzhkova, I. N., et al. The metabolic interaction of cancer cells and fibroblasts - coupling between NAD(P)H and FAD, intracellular pH and hydrogen peroxide. Cell Cycle. 15 (9), 1257-1266 (2016).
- Lakowicz, J., Szmacinski, H., Nowaczyk, K., Johnson, M. Fluorescence lifetime imaging of free and protein bound NADH. Proceedings of the National Academy of Sciences of the United States of America. 89 (4), 1271-1275 (1992).
- Vanden Berg, P. A. W., Feenstra, K. A., Mark, A. E., Berendsen, H. J. C., Visser, A. J. W. G. Dynamic conformations of flavin adenine dinucleotide: Simulated molecular dynamics of the flavin cofactor related to the time-resolved fluorescence characteristics. The Journal of Physical Chemistry B. 106 (34), 8858-8869 (2002).
- Liu, Z., et al. Mapping metabolic changes by noninvasive, multiparametric, high-resolution imaging using endogenous contrast. Science Advances. 4 (3), (2018).
- Blacker, T. S., et al. Separating NADH and NADPH fluorescence in live cells and tissues using FLIM. Nature Communications. 5, 3936(2014).
- Lu, W., Wang, L., Chen, L., Hui, S., Rabinowitz, J. D. Extraction and quantitation of nicotinamide adenine dinucleotide redox cofactors. Antioxidants and Redox Signaling. 28 (3), 167-179 (2018).
- Ranjit, S., Malacrida, L., Jameson, D. M., Gratton, E. Fit-free analysis of fluorescence lifetime imaging data using the phasor approach. Nature Protocols. 13 (9), 1979-2004 (2018).
- Stringari, C., et al. Phasor approach to fluorescence lifetime microscopy distinguishes different metabolic states of germ cells in a live tissue. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13582-13587 (2011).
- Smith, J. T., et al. Fast fit-free analysis of fluorescence lifetime imaging via deep learning. Proceedings of the National Academy of Sciences of the United States of America. 116 (48), 24019-24030 (2019).
- Wang, S., Chacko, J. V., Sagar, A. K., Eliceiri, K. W., Yuan, M. Nonparametric empirical Bayesian framework for fluorescence-lifetime imaging microscopy. Biomedical Optics Express. 10 (11), 5497-5517 (2019).
- Quinn, K. P., et al. Quantitative metabolic imaging using endogenous fluorescence to detect stem cell differentiation. Scientific Reports. 3 (1), 3432(2013).
- Hou, J., et al. Correlating two-photon excited fluorescence imaging of breast cancer cellular redox state with seahorse flux analysis of normalized cellular oxygen consumption. Journal of Biomedical Optics. 21 (6), 060503(2016).
- Wang, H., et al. Red-emitting fluorescence probe for sensing viscosity in living cells. Chemical Papers. 74, 1071-1078 (2020).
- Chen, B., et al. Sensing and imaging of mitochondrial viscosity in living cells by a red photoluminescent probe with long lifetime. Chemical Communications. 55, 7410(2019).
- Shen, B., Wang, L. F., Zhi, X., Qian, Y. Construction of a red emission BODIPY-based probe for tracing lysosomal viscosity changes in culture cells. Sensors and Actuators B: Chemical. 304, 127271(2019).
- Chen, T., Chen, Z., Liu, R., Zheng, S. NIR fluorescent probe for detection of viscosity and lysosome imaging in live cells. Organic and Biomolecular Chemistry. 17, 6398(2019).
- Angelucci, C., et al. Epithelial-stromal interactions in human breast cancer: effects on adhesion, plasma membrane fluidity and migration speed and directness. PLoS One. 7 (12), 50804(2012).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır