Method Article
Kronik ve Akut In Vivo Kayıtlar için Karbon Fiber Mikroelekrod Dizilerinin yapımı ve uygulanması
Bu Makalede
Özet
Bu protokol, birden fazla beyin bölgesinden fare(Mus musculus)ve gelincikte(Mustela putorius furo) kronik ve akut in vivo elektrofizyolojik kayıtlar için karbon fiber mikroelektrod dizileri oluşturmak için bir prosedür açıklanmaktadır. Mikroelekrod dizisi implantasyonuna ham karbon fiberlerin satın alınmasını takiben atılan her adım, mikroelekrod dizisi yapımına vurgu yaparak ayrıntılı olarak açıklanmıştır.
Özet
Çok kanallı elektrot dizileri çalışan beyin hakkında fikir verir ve tek hücreli ve devre seviyelerinde sinirsel süreçleri aydınlatmaya yarar. Bu araçların geliştirilmesi karmaşık davranışları ve bilişi anlamak ve klinik uygulamaları ilerletme için çok önemlidir. Bununla birlikte, uzun zaman dönemlerinde hücre popülasyonlarından sürekli olarak ve sürekli olarak yoğun bir şekilde kayıt yapmak zor olmaya devam etmektedir. Tetrotlar ve silikon diziler gibi birçok popüler elektrot, ekleme sırasında hasar üreten ve nöronal ölümle ilişkili kronik reaktif doku yanıtlarını ortaya çıkararak kararlı, sürekli sinirsel aktivitenin kaydedilini engelleyen büyük çapraz çaplara sahiptir. Buna ek olarak, çoğu tel demeti kanallar arasında geniş aralıklar sergiler ve küçük bir alanda kümelenmiş çok sayıda hücreden eşzamanlı kaydı önler. Bu protokolde açıklanan karbon fiber mikroelekrod dizileri bu endişelere erişilebilir bir çözüm sunar. Çalışma, in vivo hem akut hem de kronik kayıtlar için kullanılabilecek karbon fiber mikroelekrod dizileri oluşturmak için ayrıntılı bir yöntem sunmaktadır. Bu elektrotların fiziksel özellikleri, onları yüksek hücre yoğunluklarında istikrarlı ve sürekli uzun süreli kayıtlar için ideal hale getirir ve araştırmacının aylar boyunca tek ünitelerden sağlam, net kayıtlar yapmasını sağlar.
Giriş
Elektrotlar ve elektrot dizileri, beynin nöronal düzeyde bilgiyi nasıl işlerdiğini anlamak için değerli araçlardır. Elektrofizyolojik kayıtlar iki yüzyılı aşkın bir süredir ulaşılabilir olsa da1, tüm sinir devrelerinin aktivitesini, bireysel nöronların sıçramasını yakalamak için gereken mekansal ve zamansal çözünürlükte aynı anda ölçmek hala mümkün değildir. Elektroensefalografi2, pozitron emisyon topografyası3ve fonksiyonel manyetik rezonans görüntüleme4 gibi invaziv olmayan yöntemler tüm beyin ölçümlerine izin verse de, nöral devrelerin aktivitesini çözmek için gerekli mekansal ve zamansal çözünürlüğe ulaşamazlar2,5. Buna karşılık, voltaja duyarlı boyalar veya genetik olarak kodlanmış kalsiyum göstergeleri kullanılarak optik görüntüleme gibi görüntüleme yöntemleri tek birimli uzamsal çözünürlük elde edebilir, ancak düşük zamansal çözünürlük ve zayıf seçicilik3, 4,5,6gibi sorunlar oluşturur. Elektrik kayıtları bu yöntemlere güçlü bir alternatiftir. Kayıt elektrotları benzersiz zamansal çözünürlük sağlar ve kullanıcının beynin herhangi bir bölgesinde çivi zamanı hassasiyetiyle ölçümler yapmasına izin verir7. Ek olarak, kronik olarak implante edilmiş multielekrod dizileri (MEA'lar),8,9aylarına kadar bir süre boyunca hayvanların davranışlarında büyük ölçekli (on ila yüzlerce hücre), tek hücreli kayıtlar sağlar. Bununla birlikte, daha yüksek yoğunluklarda kayıt yapan silikon problar büyük bir ayak izine sahiptir ve oldukça invazivdir ve kronik olarak implante edilmiş diziler genellikle iltihap yanıtı, doku kapsülleme ve nöronal ölüm10 , 11,12,13oluşturur.
Mevcut elektrotların sınırlamaları, istikrarlı, yüksek çözünürlüklü, uzun süreli kayıtlara izin veren son yeniliklerle sonuçlandı. Tipik elektrotlar tungsten veya platin-iridyum gibi metalik bir iletkenden oluşur veya silikon veya polimer bazlıdır. Metal bazlı mikrotel dizileri uzun süreli, istikrarlı kayıtları koruyabilirken, tek bir tel çapı 10-200 μm14arasında değişen çok daha büyük bir ayak izine sahiptir. Buna karşılık, silikon bazlı elektrot dizileri yüksek uzamsal çözünürlüğe sahip kayıtlar verir, ancak nispeten sert tasarımları nedeniyle, genellikle aynı nöronlardan gelen sinyali ve kaydı aylar boyunca koruyamazlar15. Silikon tabanlı dizilerdeki son gelişmeler, kronik kayıtları güvenilir bir şekilde gerçekleştirebilen elektrotlarla sonuçlandı, ancak bu diziler daha büyük hayvanlarda derin beyin bölgelerinden kayıt yapmak için kullanılamaz ve doğrusal kayıtlar için tasarlanmıştır9. Polimer dizilerindeki gelişmeler, esnekliğin artmasına ve tek ünitelerin kayıt stabilitesinin artmasına neden oldu ve yakın gelecekte yüksek yoğunluklu kayıtlar için potansiyelsunuyor,ancak şu anda sınırlı kullanılabilirlikile 8,16,17. Karbon fiberler, burada açıklanan raf dışı malzemelerle yüksek yoğunluklu kayıtlara izin verir.
Karbon fiber kayıt mikroelekrodları on yıllardır kullanılmaktadır ve ilk karbon fiber elektrotlar bir cam mikropipette içine yerleştirilmiş tek bir karbon fiberden oluşandır. Bu mikroelekrodlar tek üniteli hücre dışı kayıtlar için kullanıldı ve sinyal-gürültü oranı en iyi camdaki tungsten mikroelekrodlarla karşılaştırılabilir olmasına rağmen, esneklikleri, daha düşük empedans değerleri ve18,19üretme basitliği nedeniyle avantajlıydılar. Karbon fiber elektrot dizileri geliştirme çabaları, karbon fiberlerin biyosensör yetenekleri nedeniyle son zamanlarda hızlandırılmıştır. Artan biyouyumluluklarına ve olağanüstü elektrik iletkenliklerine ek olarak, yüksek sıcaklık direnci, düşük bağıl yoğunluk, yüksek çekme mukavemeti, düşük bükülme sertliği, yüksek algılama hassasiyeti ve küçük bir kesit alanı10,12dahil olmak üzere benzersiz bir özellik kümesine sahiptirler. Tüm bu özellikler, tek nöronların kronik, kararlı, yüksek verimli kayıtlarını kolaylaştıran karbon fiber mikroelekrod dizilerinin (CFEA' lar) geliştirilmesini motive etmiştir. Bu tür CFEA'lar artık elle üretilebilir20,21 ( Şekil1), aylarca tek nöronları tutabilen mikroelektod dizileri verir. Burada açıklanan, iki türdeki bireysel nöronların akut ve kronik kayıtları için iki şekilde uyarlanmış CFEA'lar için erişilebilir bir inşaat sürecidir.
Protokol
Tüm deneysel prosedürler Brandeis Üniversitesi veya Washington Üniversitesi Hayvan Bakım ve Kullanım Komitesi tarafından onaylanmıştır. Gösterilen veriler bir dişi gelincik ve bir erkek fareden toplanarak elde edildi.
1. Karbon fiberlerin ve aletlerin hazırlanması
- Ticari karbon fiberlerin hazırlanması
- Epoksi büyüklüğündeki lif demetinden 8 cm şeritler kesin. Şeritleri bir potaya paralel yerleştirin ve epoksiyi ticari liflerden çıkarmak için 6 saat boyunca 400 °C'de bir fırında pişirin. Ardından, pişmiş lifleri standart bir Petri kabında veya konik bir tüpte saklayın.
NOT: 7 μm çapında lifler kullanılmıştır. Diğer gruplar 4 μm fiber20,21kullanmıştır. - Bireysel lifleri tutmak için kasetler hazırlayın. Kasetleri ve ilişkili kaset tutucuyu oluşturmak için bir 3D yazıcı veya lazer kesici kullanın (bkz. Şekil 2).
- Lifleri kasetlere yükleyin. Kasetin iki uzun tarafına bir parça çift taraflı bant sererek, bandın kenarını kasetin iç kenarıyla hizalayarak başlayın. Tek tek lifleri pişmiş demetten ayırın ve elyaflar arasında 2-3 mm tutarak kasetin kısa tarafına paralel olarak yerleştirin. Her kasete 20-30 lif sığdırdığınızdan emin olun. Çift çubuklu bandın üzerine şeffaf bant döşeyerek lifleri yerine kapatın. Doldurulmuş kasetleri kaset tutucusuna yerleştirin.
NOT: Deneyimli bir inşaatçı için, bir elyaf kasetini doldurmak ~ 1 saat sürecektir. Acemi oluşturucu için, bu işlem büyük olasılıkla ~ 1.5-3 saat sürecektir. Bir kutuda on kaset var ve iki kaset tutucu parilen biriktirme odasına sığabilir. - Ticari vakum biriktirme odası kullanarak ayrı lifleri parilen C ile kaplayın. Kaplama için tek bir çalışma gereklidir. Her koşu için 2,3 g parilen ölçün. Aynı anda odaya iki kaset tutucu sığar. Kaplama prosedürü çalışma başına ~2 saat sürer.
NOT: 2,3 g parilen C ölçümü yaklaşık 1 μm kaplama sağlar. Kaplamalı lifler süresiz olarak saklanabilir.
- Epoksi büyüklüğündeki lif demetinden 8 cm şeritler kesin. Şeritleri bir potaya paralel yerleştirin ve epoksiyi ticari liflerden çıkarmak için 6 saat boyunca 400 °C'de bir fırında pişirin. Ardından, pişmiş lifleri standart bir Petri kabında veya konik bir tüpte saklayın.
- Karbon fiber manipülasyon aracının hazırlanması
- Küçük bir esnek yapışkan filmi 30 G iğnenin etrafına sarın ve yapışkan filmle keskin ama esnek bir nokta oluşturur.
NOT: Bir iğne ucunu parafilm ile sarmak ve bunu yaparken parafilm'i germek, kullanıcının bireysel lifleri almasını ve manevra yapmasını sağlayan hafif bir yapışkan etki yaratır.
- Küçük bir esnek yapışkan filmi 30 G iğnenin etrafına sarın ve yapışkan filmle keskin ama esnek bir nokta oluşturur.
2. Tasarım ve imalat
- Üretilecek elektronun özelliklerine göre gerekli olan uygun jig tasarımını seçin. Bu, herhangi bir tasarım eklemesiyle birlikte ihtiyaç duyulan kanal sayısına göre yapılacaktır.
NOT: Jig, elektrotlar ve elektrik bağlantıları için bir ankraj sağlayan 3D baskılı bloğu ifade eder. - Bilgisayar destekli tasarım (CAD) yazılımını kullanarak jig'in özel tasarımını oluşturun veya değiştirin.
- Jigleri yüksek çözünürlüklü bir SLA 3D yazıcı kullanarak yazdırmak için bir 3D baskı şirketi veya kurumsal maker laboratuvarı kullanın.
3. Karbon fiber mikroelekrod dizisinin montajı (CFEA)
NOT: Bu adım deneyimli bir oluşturucu için ~2 h ve acemi bir oluşturucu için ~6 saat sürer. 10x stereo mikroskop altında tüm CFEA montaj adımlarını ve fiber ambalaj adımlarını gerçekleştirin. CFEA'yı minimum hava hareketine sahip bir ortamda komple monte edin, çünkü bu işlem yapı sürecini bozabilir.
- İstenilen elektrodu oluşturmak için gereken uygun jig'i seçin.
- Metal tel kesiciler kullanarak, yaklaşık 7 cm uzunluğunda 0.003 (76.2 μm) çapında iki parça tungsten tel kesin.
- Her kabloyu jig'in (GND ve REF) konektör ucundaki uygun kanaldan geçirin. İki ucu eşit uzunluğa gelene kadar yeterince besleyin ve ardından jig'e sabitlemek için birlikte bükün.
NOT: 16 kanallı akut tasarım için, metal telin jig'deki sırta sığmasını sağlayın.- Teli sabitlemek için UV ile kürlenmiş diş çimentosu uygulayın. Telin beslendiği açık kanal içinde diş çimentosu almamaya dikkat edin.
NOT: Kullanıcı, olası göz hasarını önlemek için UV ile ilgili tüm prosedürler sırasında UV filtreleme göz koruması takmalıdır. Birçok UV kürleme asasında yerleşik görüntüleme filtreleri vardır. - UV kür asasını kullanarak diş çimentosuna 20 sn kür edin.
- Jig'i takı mengenesine, jig'in kollarından biriyle sabitleyin. Jig'i yan yüzlerden biri yere paralel olacak şekilde yönlendirin.
- Jig ve mengeneyi mikroskop altında yönlendirin, böylece konektör ucu, havza ve huni ucu görünür. Huninin kullanıcıdan uzağa işaret ettiği ve bağlayıcı ucu kullanıcıya bakacak şekilde jig'i yönlendirin.
- Karbon fiber aletleri ve keskin uçlu 25 G iğneyi toplayın.
- Parilen-C kaplı lifli bir kaseti beyaz bir kağıda yerleştirin, liflerin doğrudan kağıda olmaması için bantlayın.
- Kasetten tek bir karbon fiber kesmek için 25 G iğneyi kullanın. Bunu, iğnenin ucunu çıkarılacak lifin çıktığı kasete doğru kaydırarak yapın.
- Yarım lif kullanarak inşa ediyorsanız, yukarıda açıklandığı gibi lifin bir ucunun kesilmesi. Lifi düz olacak şekilde yönlendirin ve iğneyi kullanarak lifi kağıda karşı keserek ikiye bölün. Hala kasete bağlı olan diğer yarısını kesmek için, daha önce yapılan karbon fiber aracı ile lifin serbest ucunu tutun ve daha sonra iğneyi yukarıda açıklandığı gibi hala kasete bağlı olan lifi kesmek için kullanın.
- Tam lifler kullanarak inşa ediyorsanız, yukarıda açıklandığı gibi lifin bir ucunun kesilmesi. Daha önce yapılmış karbon fiber aleti kullanın ve yeni kesilmiş olan fiberin serbest ucunun tutun. İğneyi kullanarak, lifin diğer ucını kasetten kesin.
- Daha önce yapılmış karbon fiber aracını kullanarak karbon fiberi alın. Lifi alın, böylece bir ucu aletten yaklaşık 1 cm uzunluğa sahip olur.
- Karbon fiber aleti lif takılı olarak kullanın ve lifin daha kısa ucını jig'in orta havzasından huni parçasından besleyin. Görselleştirmek için mikroskop kullanın.
- Lif uzunluğunun çoğu geçene kadar lifi jig hunisi ile beslemeye devam edin (bkz. Şekil 3A).
- Daha önce yapılmış karbon fiber aracı kullanarak lifin arka kısmını mevcut bir kanaldan besleyin. Yaklaşık 5 mm lif arkadan çıkana kadar lifi arkadan besleyin. Gerekirse boyuta kesin (bkz. Şekil 3B).
NOT: Fiberleri metal telleri içeren kanallara beslemeyin.
- Kanalların geri kalanını, yukarıda verilen talimatları izleyerek jig'in bir tarafındaki liflerle doldurun.
NOT: Lifleri hunine beslerken, liflerin yarısını huninin her bölümüne, kanalların sağ yarısını sağ bölmeye ve kanalların sol yarısını sol bölmeye besleyin. Lifler huni içinde yakın temas halinde olduğunda, mevcut liflerin gevşemesine veya kopmasına yol açan lifler arasında, jig içine yeni lifler beslenirken elverişsiz sürtünme vardır. Lifler daha sonraki bir adıma kadar daha küçük demetler halinde tutulduğu için dört bölüme bölünmesi biraz rahatlama sağlar. - Standart bir kıvılcım tekerleği çakmak kullanın ve alevi konnektör ucundaki açıkta kalan liflerin üzerinden hızla geçirin. Tüm liflerin yalıtımının uçlardan çıkarıldığından emin olun (bkz. Şekil 3C).
NOT: Liflerin aleve maruz kalan kısmı, lifin geri kalanından biraz daha ince görünmelidir. - Alevli lifi jig'den besleyin, böylece elyafın aleve maruz kalan kısmı artık kanal içindedir. Jig'in arkasına hiçbir lif çıkmadığından emin olun (bkz. Şekil 3D).
NOT: Fiberi havzanın içinden kavramak ve alevli lifi jig'den beslemek için karbon fiber aracını kullanın. Bu kısım daha kırılgan olduğu için liflerin aleve maruz kalan kısmına dokunmayın. - Jig havzasındaki liflere UV ile kürlenmiş diş çimentosu uygulayın. Kanalların açıklıklarını ve huni açıklığı kapsayacak şekilde tüm havzayı doldurun (bkz. Şekil 3E).
- UV ışığını kullanın ve diş çimentosuna 20 sn kür edin. Diş çimentosu tamamen tedavi değilse, ek 20 s için kür.
NOT: Diş çimentosunda kanalların içinde hareket etmediğine emin olun.
- UV ışığını kullanın ve diş çimentosuna 20 sn kür edin. Diş çimentosu tamamen tedavi değilse, ek 20 s için kür.
- Jig'i mengeneden çıkarın, ters çevirin ve daha önce sabitlenmiş olarak mengenedeki jig'i sabitleyin. Lifleri içeren tarafın artık yüzüstü olduğundan emin olun.
- Jig'in boş tarafını tam olarak yukarıda açıklandığı gibi karbon fiberlerle doldurun.
- Tüm kanallar liflere sahip olduktan ve lifler diş çimentosu ile sabitlendikten sonra, jig'i mengeneden çıkarın ve huninin aşağıyı işaret ettiği şekilde yönlendirin. Bağlayıcı ucu yukarıyı işaret edene kadar jig'i mengeneye sabitleyin.
- Keskin uçlu 25 G iğne, 1 mL şırınga, gümüş iletken boya, pamuk uçlu aplikatörler, tiner, doku mendilleri ve uygun baş sahne konektörünü toplayın.
NOT: Gümüş iletken boyanın iyi karıştığından ve homojen bir çözelti olduğundan emin olun. Boyanın kurumasına izin vermeyin. - 1 mL şırıngaya 0,3 mL gümüş boya çizin ve ardından keskin uçlu 25 G iğneyi takın.
- Diş çimentosu tarafından durdurulana kadar iğneyi dikkatlice bir kanala yerleştirin. Kanalı boya ile doldurmak için iğneyi kanaldan çıkarırken şırıngayı yavaşça bastırın (bkz. Şekil 3E).
- İğnedeki boyaları silin ve bir sonraki kanala geçin.
- Tüm kanalları boya ile doldurun.
NOT: Boya ilk birkaç dakika kanallarda ayarlanırken kanallara ek geçişler gerekebilir.
- Tüm kanalları boya ile doldurun.
- Pamuk uçlu bir aplikatörü tiner içine batırın ve ardından yüzeydeki herhangi bir boyanın jig tabanını temizleyin. Bunun için birkaç pamuk uçlu aplikatör gerekli olabilir.
NOT: Boya tinerine batırılmayan pamuk uçlu aplikatörler de jig'i temizlemek için yararlı olabilir. - Pimleri kanallarla hizalayarak baş sahne konektörünü uygun yönde yerleştirin. Başörtü konnektörünün dik oturduğundan ve jig'e mümkün olduğunca sifonu çektiğiden emin olun (bkz. Şekil 3F).
- Jig'in 24 saat boyunca tedavi etmesine izin verin.
- Baş sahne konnektörünün jig ile buluştuğu kenar boyunca diş çimentosu uygulayarak UV kürlenmiş diş çimentosu kullanarak baş sahne konektörünü jig'e sabitleyin. 20 sn için UV ışığı kullanarak UV kür.
- Teli sabitlemek için UV ile kürlenmiş diş çimentosu uygulayın. Telin beslendiği açık kanal içinde diş çimentosu almamaya dikkat edin.
4. Fiber paket ambalaj
NOT: Bu adımı gerçekleştirmek yaklaşık 30 dakika sürer. Kalın bir pia mater tabakasına sahip hayvan modellerinde kullanılan elektrotlar için bu adımı tamamlayın. Bükmeyi en aza indirmek için lif demetini güçlendirin. Fare yordamlarında, bu adım gerekli olmayabilir.
- Su gerilimi kullanarak lif demetini tek bir şaftta bir araya getirin. Elektrot bir mengene içinde dik olarak sabitlenirken huni ucundan demet ucuna bir damla su çalıştırmak için bir transfer pipeti kullanın.
- Huni ucundaki demetin etrafına yaklaşık 1,5 mm kalınlığında bir diş çimentosu tabakası uygulayarak başlayın. Diş çimentosunun 20 s UV ışığı ile kürlen.
NOT: Kortikal kayıtlar için başka ambalaj gerekmez. Daha derin beyin bölgeleri için, demetin etrafına bir kılavuz tüp sabitleyin. - Kılavuz tüpün yapımı ve demetin kılavuz tüpe yerleştirilmesi
- Poliimid borunun istenen uzunluğunu ölçün ve kesin. Poliimid boru uzunluğunun 2 mm karbon fiber uçları serbest bıraktığından emin olun. Poliimid borudan 2 mm daha kısa olan 30 G metal borunun bir parçasını ölçün ve kesin. Metal boru üzerindeki keskin kenarları çıkarmak için bir döner alet kullanın. Poliimid boruyu metal borunun içine yerleştirin.
- Elektrodu karbon fiber demeti yukarıyı işaret ederek bir mengeneye yerleştirin. Monte edilen boruyu bir mikromanipülatöre sabitleyin ve bir mikroskop kullanarak, lif demetinin üzerine dikkatlice küçümseyin. Boruyu ek bir diş çimentosu tabakası kullanarak mevcut diş çimentosu tabanına sabitleyin. Diş çimentosunun 20 s UV ışığı ile kürlen.
NOT: İnşaat işlemi burada duraklatılabilir.
5. Elektrot ucu hazırlama
NOT: Bu adımı gerçekleştirmek için dizi başına yaklaşık 30 dakika sürer.
- Elektrotları istediğiniz uzunluğa kesin.
- Elektrot ucunu kesmeye hazırlanırken, yaklaşık 1,5 mm yüksekliğinde bir platform oluşturmak için yapışkan notlar yığın. Platformun kenarından istenen elektrot uzunluğunu ölçün ve bu mesafeyi işaretleyin. Platform, kesim için bir rehber görevi görecektir.
- Huni ucu tamamen suya batırılana, önce uçlanana ve yüzeye normal tutulana kadar elektrotunu bir deiyonize veya damıtılmış su kabına haline getirin. Elektrodu sudan çıkararak bireysel karbon fiberleri bir araya getirin. Yüzey gerilimi demetleri bir araya getirecektir. Elektrotun 30 dakika boyunca kurumasını bekleyin.
- #10 neşter bıçağını sapa takın. Neşter ve elektrodu -18 °C dondurucuya yerleştirerek en az 5 dakika dondurun.
- Elektrodu, liflerin kılavuzun yüzeyine floş bırakacak şekilde döşeyin (adım 5.1.1'de hazırlanır). Lifleri yuvarlanan bir hareket kullanarak neşterle istediğiniz uzunluğa kesin. Elektrot ve neşterin hala donduğundan emin olmak için bu adımı hızlı bir şekilde tamamlayın (bkz. Şekil 3G).
- Elektrot uçlarının empedansını azaltmak için pozitif akım enjekte edin.
- Elektrodu uygun adaptörü kullanarak multielekrod empedans test cihazına takın (bkz. Malzeme Tablosu). 0,1 M fosfat tamponlu salin (PBS) mikrosantrifüj tüpüne ~2 mm daha düşük elektrot ucu. Topraklama telini mikrosantrifüj tüpüne yerleştirin.
- Akımı seçilen genlik ve süre ile enjekte edin.
NOT: Bu adım, CFEA'nın ucundaki empedans değerlerini azaltmayı amaçlamaktadır. Bu çalışmada elektrolizleme yazılımı grafik kullanıcı arayüzüne aşağıdaki parametreler girildi: Akım: 0.100 μA; Süre: 10 s; Duraklat: 1 sn. Bu işlem, elektrot empedansları istenen değerleri karşılayana kadar kanal başına gerektiği gibi tekrarlanabilir (bkz. Şekil 4C). - Empedans değerleri istenildiği gibi olduğunda, temizlemek için lifleri deiyonize veya damıtılmış suda durulayın.
- Altın kaplama çözeltisinde elektroliz.
NOT: Bu adım implantasyondan kısa bir süre önce (aynı gün) yapılmalıdır.
DİkKAT: CFEA uçlarının hazırlanmasında kullanılan kimyasallardan bazıları, altın kaplama çözeltisi de dahil olmak üzere aşındırıcıdır. Kullanmadan önce SDS'ye danışın ve çözümü güvenli bir şekilde ele almak için alınması gereken uygun ihtiyati önlemleri belirleyin.
NOT: Fiber demetine sertlik sağlamak için, kullanıcı önce PEG8000'i 1 mg/mL'de deiyonize veya damıtılmış suda çözünürlükte bırakarak altın kaplama çözümü oluşturabilir. Ardından, 625 μL çözünmüş PEG8000 ve 375 μL altın kaplama solüsyonu ve vorteks solüsyonını 10 sn karıştırmak için birleştirin. PEG8000, beyne lif takıldıktan sonra çözünür.- Elektrot demeti ucunu ~2 mm kaplama karışımının mikrosantrifüj tüpüne küstürün. Topraklama telini mikrosantrifüj tüpüne yerleştirin.
- Elektrolizleme için uygun parametreleri ayarlayın. Bu çalışmada elektrolizleme yazılımı grafik kullanıcı arayüzüne aşağıdaki parametreler girildi: Akım: -0.05 μA; Süre: 30 s; Duraklat: 5 sn.
- Lifleri deiyonize veya damıtılmış su ile iyice durulayın. Şu anda, istenirse empedans değerlerini yeniden ölçün.
6. Beyne ekleme: Sağkalım ameliyatı, fare(Mus musculus)ve sağkalımsız cerrahi, gelincik(Mustela putorius furo)
NOT: Cerrahi prosedürler IACUC'ye uygun olarak standart protokole uymalıdır. Ayrıntılı bilgiiçin bkz. Kemirgen türlerinde sağkalım cerrahisi için ASC yönergelerine göre aseptik cerrahi prosedürleri izleyin. Bunlar arasında 135 °C'deki tüm cerrahi alet ve malzemelerin 15 dakika boyunca otomatik olarak kapatıldırılarak stereotaksik aparatların ve cerrahi alanın %70 etanol ile tedavi edilmesi yer almaktadır. İşlem sırasında steril cerrahi eldivenler, tek kullanımlık bir önlük ve yüz maskesi kullanın.
- Sağkalım ameliyatı, fare (Mus musculus).
- Nefes alma hızı 55-65 nefes / dk'ya ulaşana kadar fareleri ~ 1 dakika boyunca bir indüksiyon kutusunda% 2.5 izofluran ile uyuşturun. Daha sonra anesteziyi korumak için burun konisine %2.0 izofluran sürün. Kornea hasarsını önlemek için her iki göze veteriner merhem uygulayın. Uygun anestezi derecesini doğrulamak için bir parmak sıkışması gerçekleştirin.
- Doğrulamadan sonra, Ma ve ark.22'deayrıntılı olarak açıklanan sağkalım cerrahisi prosedürlerini izleyin. Solunum hızını izleyin ve 60 nefes / dak'ta koruyun. Termostatik kontrollü bir ısıtma yastığı kullanarak vücut sıcaklığını 37 °C'de koruyun. Kafatasını kraniyotomi, durotomi ve elektrot implantasyonu için hazırlama talimatları için 6.3-6.5 (aşağıda ayrıntılı olarak açıklanmıştır) adımlarına bakın.
- Ameliyattan sonra, fareleri diğer hayvanlardan izole edilmiş 37 ° C ısıtma yastığı ile donatılmış bir iyileşme kafesine geri döndürün.
- Antibiyotik merhemdeki cerrahi yaraları kapatın. Sternal rekumbensi korumak için yeterli bilinci geri kazanana kadar hayvanları izleyin ve 2-5 günlük bir süre boyunca iyileşmelerine izin verin. Onları tek tek barındırın ve enfeksiyon veya rahatsızlık belirtileri için sürekli izleyin. Hayvanlara analjezik olarak ameliyat günü bir doz buprenorfin verin 72 h sürekli salınım (0.5-1.0 mg/kg).
- Sağkalımsız cerrahi, gelincik(Mustela putorius furo)
- Gelinciği başlangıçta ketamin (20 mg/kg, i.m. ) ile uyuşturun ve daha sonra maske yoluyla 2:1 nitröz oksit ve oksijen karışımında% 1.0-% 2.0 izofluran ile havalandırın. Uygun anestezi derecesini doğrulamak için bir parmak sıkışması gerçekleştirin.
- Doğrulamadan sonra, Popovic ve ark.23'teayrıntılı olarak açıklanan sağkalımsız cerrahi prosedürlerini izleyin. Trakeostomi gerçekleştirin ve hayvanları 2:1 azot oksit ve oksijen karışımında izofluran% 1.0-% 2.0 ile havalandırın. Kornea hasarını önlemek için her iki göze de veteriner merhem uygulayın.
- Termostatik kontrollü bir ısıtma yastığı kullanarak vücut sıcaklığını 37 °C'de koruyun. Kalp atış hızını, son gelgit CO2 seviyelerini ve solunum hızını izleyin. Solunum oranını uygun fizyolojik aralıkta tutun (%3,5-%4,0). Kafatasını kraniyotomi, durotomi ve elektrot implantasyonu için hazırlama talimatları için 6.3-6.5 (aşağıda ayrıntılı olarak açıklanmıştır) adımlarına bakın.
- Yeterli anesteziyi sağlamak ve EKG herhangi bir sıkıntı gösteriyorsa izofluran yüzdesini artırmak için hayvanın EKG'sini sürekli izleyin.
- Deneyin tamamlanmasıyla, kalp atış hızı ve son gelgit CO 2 0 ölçene kadar gelincik ve monitöre1 mL pentobarbital sodyum ve fenitoin sodyum çözeltisi verin.
- Kafatasının hazırlanması
- 0,8 mm matkap çapak kullanarak, implantasyon için istenen yerde tek bir 4 mm x 4 mm kraniyotomi delin. Fare için, paslanmaz çelik zemin vidası yerleştirme için kontralteral bir sahada ek bir çapak deliği açın.
NOT: Elektrot implantasyona hazır olana kadar durotomi yapmayın. - Bir zemin/referans oluşturun. Akut gelincik deneylerinde, kraniyotomiden karşıdaki hayvanın kafasının kenarındaki kafatasını çevreleyen deriyi ve kas tabakasını delmek için 18 G'lik bir iğne kullanın. Ag/Cl referans elektrodunun tel ucunu iğnenin ucuna yerleştirin ve ardından iğneyi kas/deriden geri çekerek peletin artık kas ve kafatası arasında güvenli bir şekilde oturmasını sağlayın. Farede, gümüş zemin telini paslanmaz çelik topraklama vidasının etrafına sarın. UV kürlü diş çimentosu ile emniyetli.
- Elektrodu ince bir etiketleme bandı şeridi kullanarak elektrot tutucuya takın ve elektrot tutucuyu mikromanipülatöre sabitleyin. Topraklama telini bir timsah klipsi aracılığıyla topraklama kaynağına takın. Referans teli hayvanın kasına gömülü referans elektrot'a takın.
- 0,8 mm matkap çapak kullanarak, implantasyon için istenen yerde tek bir 4 mm x 4 mm kraniyotomi delin. Fare için, paslanmaz çelik zemin vidası yerleştirme için kontralteral bir sahada ek bir çapak deliği açın.
- Durotomi ve pia penetrasyonu
- Dura çekme kullanarak kraniyotomiden durayı çıkarın.
- Pia'da küçük bir delik oluşturun. Bunu yapmak için, metal bir mikroelekrod takın ve çekin (gelincikte önerilir). Alternatif olarak, herhangi bir vaskülattan kaçınmak için CFEA ortogonalini beynin yüzeyine küçümseyin. Bu konum belirlendikten sonra, elektrodu kaldırın ve beynin yüzeyini o yerde bir dura çekme ile hafifçe araklayın, çekme ile yukarı doğru çekerek (farede önerilir).
- Elektrot implantasyonu
- Elektrot ucunu aynı konuma 2 düşür ve ince modda elektrotları beyne ~2 μm/s hızında sürmeye başlayın. Elektrodun düzgün girdiğinden ve bükülmediğine emin olmak için bir mikroskop kullanın.
NOT: Elektrot düzgün girilmezse, beyinden kaldırın ve açıyı yeniden düzeltin. Sorunsuz bir şekilde girmeden bükülmeye devam ederse, konumu ayarlayın ve yeni giriş yeri için beynin yüzeyini çalma işlemini tekrarlayın. - Aşağıdaki adımları kullanarak kronik ve akut implantasyonu gerçekleştirin.
- Kronik implantasyon için: Elektrot UV kürlü diş çimentosu kullanarak yerinde çimento.
- 5-0 cerrahi dikiş kullanarak kesiği kapatın ve başlığı yapın.
- Bir kafa kapağı oluşturmak için implant bölgesinin etrafına ek diş çimentosu ekleyin. Jig'in burnunu kapattığından emin olun.
- Deriyi baş kapağının etrafına çekin. Kafa kapağının arkasındaki kesiyi 5-0 cerrahi dikişle dikin.
- Lidokin kremi ve antibiyotik merhem uygulayın.
- Anesteziyi durdurun ve standart kurtarma prosedürlerini izleyin.
- Akut implantasyon için: Elektrodu indirdikten ve istenen derinliğe ulaştıktan sonra, elektrodun yerine oturmasını sağlamak için elektrofizyolojik kayda başlamadan önce en az 30 dakika bekleyin.
- Kronik implantasyon için: Elektrot UV kürlü diş çimentosu kullanarak yerinde çimento.
- Elektrot ucunu aynı konuma 2 düşür ve ince modda elektrotları beyne ~2 μm/s hızında sürmeye başlayın. Elektrodun düzgün girdiğinden ve bükülmediğine emin olmak için bir mikroskop kullanın.
Sonuçlar
Bu protokolün tamamlanmasıyla, tek birimli spiking aktivitesinin istikrarlı kayıtları mümkün olacaktır. Bu mikroelekrod dizileri, araştırmacının ihtiyaçlarına göre malzeme, kanal sayısı ve baş sahne adaptöründe özelleştirilebilir. Altın kaplama lifleri kayıt için uygun empedansların azalmasına neden olur (Şekil 4 ve Şekil 5). Kullanıcı kronik olarak kayıt yapmak istiyorsa, hayvan cerrahi işlemden çıktıktan sonra ölçümler yapılabilir. Kronik prosedürler en az 120 gün boyunca istikrarlı, tek üniteli kayıtlarla sonuçlandı. Şekil 6'da,özgürce davranan yetişkin bir erkek farenin retrosplenial korteksinde kararlı 64 kanallı elektrofizyolojik aktiviteyi gösteren temsili bir kayıt gösterilmiştir. Akut bir hazırlık amaçlanıyorsa, kayıtlar implantasyondan kısa bir süre sonra başlayabilir (~30 dk). Bu, elektrodun beyne yerleşmesine zaman sağlayacaktır. Şekil 7, yetişkin bir dişi gelinciğin birincil görsel korteksinden elde edilen akut 16 kanallı CFEA kaydının temsili bir örneğini sunmaktadır. Fare ve gelincikte sivri sıralama, sivri sıralama yazılımı ile gerçekleştirildi (bkz. Malzeme Tablosu).
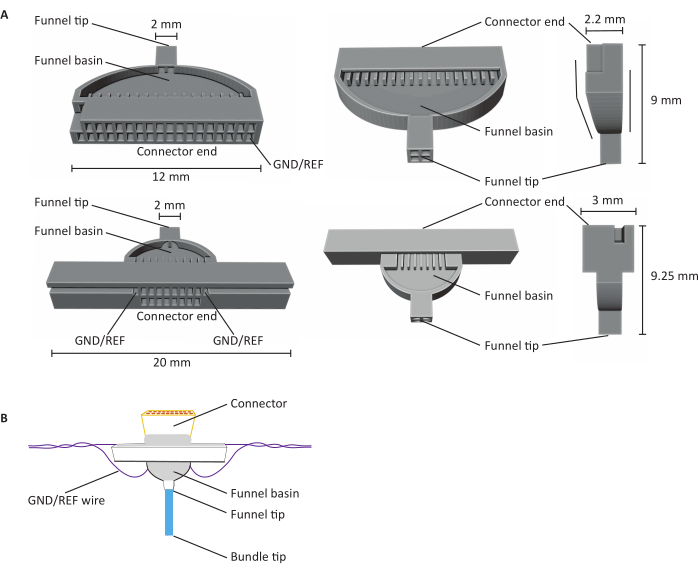
Şekil 1: 16 ve 32 kanallı karbon fiber mikroelekrod dizilerinin (CFEAs) anatomisi( A) Üç farklı görünümden 32 kanallı (üst) ve 16 kanallı (altta) CFEA şemaları. 16 kanallı CFEA, kullanım amaçları için genişletilmiş bir tasarıma sahiptir. 32 kanallı tasarım, 64 kanallı cfea için iki jig'in birleştirilmesine izin veren düz bir yüze sahiptir. Her iki diyagramda da boyutlar ile etiketlenmiş tanımlayıcı yapılar vardır. Bağlayıcı ucu bağlayıcı eklemenin konumunu, GND/REF kanalları ise topraklama telinin nereye yerleştirildiğini gösterir. Huni havzası, liflerin UV ışıkla kürlenmiş diş çimentosu ile kaplanmak için geçtiği yeri ifade eder ve huni ucu, liflerin jig'den çıktığı yeri ifade eder. Huni ucu, birbirine yapışan ve hasar yaratan lifleri en aza indirmek için kadranlara ayrılır. Lifler daha sonra diş çimentosu kullanılarak tek bir demet halinde çekilir. Jig'ler SLA reçine yazıcıları kullanılarak 3D yazdırılır. Diyagramlar ayrıntıları göstermek için büyütülür. (B) CFEA inşa edilmiştir. Diyagramda etiketlenmiş tanımlayıcı yapılar vardır. Mavi demet ucu, kayıt ölçümleri elde eden karbon fiberlerin segmentini temsil eder. Huni havzası içindeki ve konektörü çevreleyen gri, huni havzasında karbon liflerini yerinde tutan ve konektörü jig'e sabitleyen UV ışıkla kürlenmiş diş çimentosunun göstergesidir. Mor tel topraklama telini temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
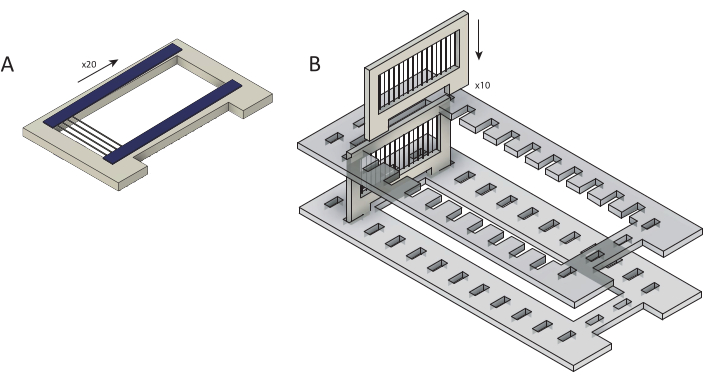
Şekil 2: Ham karbon fiberlerin parilen C kaplama için kasetlere yüklenmesi. (A) Karbon fiberler, iki çift taraflı bant (mavi) şeridi ile kaplanmış kartuşlara yüklenir. Her kaset ~25 lif ile doludur. (B) Kasetler, parilen C kaplamaya hazırlık olarak lazer kesim tutucuya (gri) yüklenir. Her birinde on kaset var. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
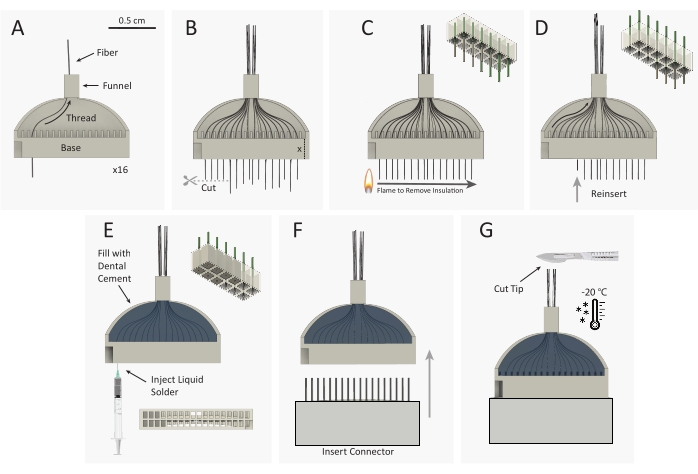
Şekil 3: Karbon fiber mikroelekrod dizisi (CFEA) demet yapı şeması. (A) 16 ayrı, kaplanmış karbon fiberler (siyah) 32 kanallı 3D baskılı jig (gri) üzerinden geçirilür. (B) Karbon fiber uçları mikro makasla kesilir, fazla lif jig tabanının yüksekliğine eşit bırakarak jig tabanının dışına uzanır. (C) Parilen C yalıtımını kaldırmak için standart bir plastik kıvılcım tekerleği çakmağı, fazla lifin üzerinden hızla geçirilir. Sağ üst şema, parilenin 12 lifin 9'undan çıkarıldığını gösterir. (D) Lif ucu tabanla yıkanana kadar lifler jig içine yeniden takılır. Sağ üst şema, jig tabanının içinde bulunan yalıtımsız (gri) lif uçları ile 9 lifin yeniden yüklenmesini gösterir. Jig daha sonra ters çevrilir ve A-D adımları karşı 16 kanalı akıtmak için tekrarlanır. (E) Jig, lifleri sabitlemek için diş çimentosu ile doldurulur. Jig tabanının her kuyusuna gümüş baskı enjekte edilir. (F) Erkek konnektör jig tabanına yerleştirilir. (G) CFEA ve neşter -20 °C dondurucuda dondurulur. Dizi ucu istenen uzunluğa kesilir ve 32 eşit lif bırakır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
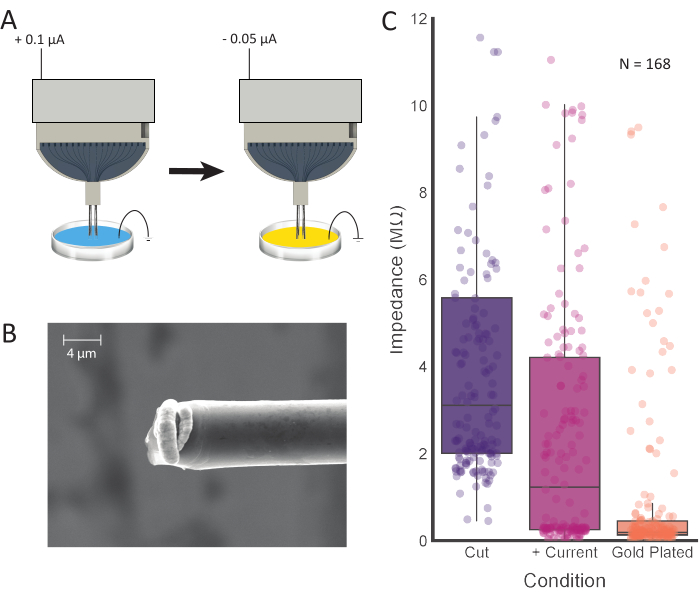
Şekil 4: Uç tedavisi ve elektrolizleme. (A) Elektrot uçları ilk olarak her elektrottan akımın geçirildiği 0,1 M PBS'ye yerleştirilir. Uçlar daha sonra durulanır ve akımla elektroliz haline geldikleri altın kaplama çözeltisine aktarılır. (B) Hazırlanan karbon fiberin SEM görüntüleri ucunda yoğunlaşmış altın kaplama soluyu göstermektedir. Ölçek çubuğu, ilk kesimden sonra 168 kanaldan 4 μm. (C) Empedans değerlerini temsil eder (mor; 3,11 MΩ ± 0,42 MΩ, ortanca ± SE, n = 168 lif), pozitif akım enjeksiyonu (pembe; 1.23 MΩ ± 0.36 MΩ, ortanca ± SE, n = 168 fiber) ve elektrolizleme (turuncu; 0.19 MΩ ± 0.15 MΩ, ortanca ± SE, n = 168 fiber) her işlem adımından sonra empedans değerlerinin azaldığını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Orta derecede altın elektrolizleme süreleri karbon fiber demet uçlarında küçük, yuvarlatılmış tortular üretir. Resimdeki karbon fiber uçlarının tümü, empedans azaltma veya altın kaplama için enjekte edilen akımın farklı sürelerini yansıtan farklı mikroelekrod dizilerindendir. Görüntüler ayrıca karbon fiberleri yalıtan ve liflerin uçları dışında bir yerden sinyal alınmasını önleyen parilen C kaplamasını tasvir eder. (A) Karbon fiber uçların elektron mikroskopi görüntüsünü dondurduktan ve jiletle tek bir kesim yaptıktan sonra tarama. Ölçek çubukları 10 μm'dir. (B) A ile aynı ama daha sonra 10 s için pozitif akım enjeksiyonu ile takip. (C) B ile aynı ama daha sonra 5 s için altın ile elektroliz. (D) B ile aynı ama daha sonra 15 s. (E) Altın ile elektroliz, ancak daha sonra 30 s. (F) B ile aynı altın ile elektroliz ama daha sonra 120 s için altın ile elektroliz. -0.05 μA akımda 30 sn elektrolizlemenin elektrofizyolojik kayıtlar için en uygun olduğunu gördük. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
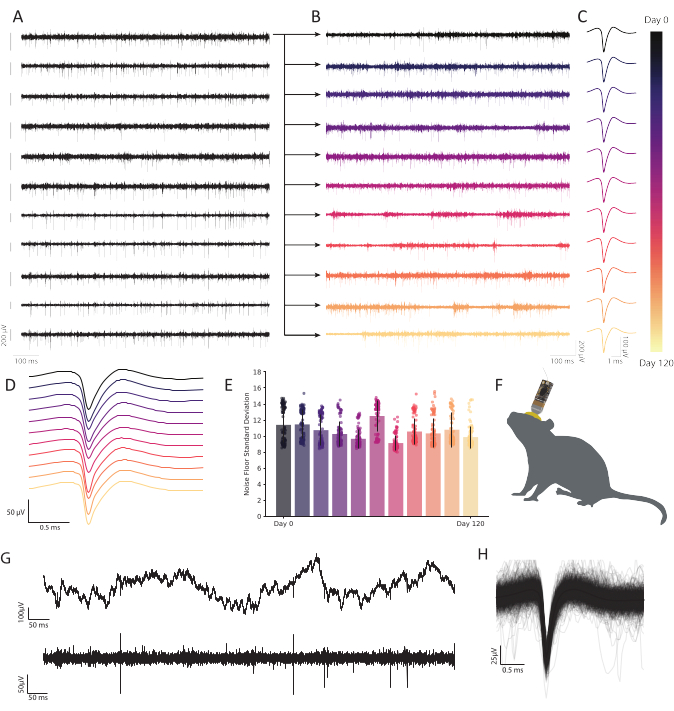
Şekil 6: Karbon fiber mikroelektod dizilimi ile serbestçe davranan fare retrosplenial korteksteki kronik hücre dışı kayıtlar kalıcı, kararlı sinirsel aktivite göstermektedir. (A) Aynı anda on bir bantlı voltaj izi kaydedilmiştir. İlk kanaldan (üst satır) kaydedilen sonraki izlemeler, zaman içinde dayanıklılığı göstermek için B'de çizilir. Kalan on satır kayıt kalitesinin tutarlılığını gösterir ve dizi genelinde sağlam etkinlik gösterir. Her izlemenin solundaki ölçek çubuğu 200 μV'lik bir potansiyeli temsil eder. (B) A'daki üst iz ile aynı fiberden bantlanmış veriler, 120 günlük sürekli kayıt boyunca sağlam bir aktivite gösterecek şekilde genişletildi. (C) Kümeleme, aylar boyunca sağlam tek birim algılamasını ortaya koymaktadır. İzler, her zaman noktasında B'de çizilen fiberden çıkarılan 120 gün boyunca sürekli gözlemlenebilir temsili tek bir ünitenin ortalama dalga biçimini temsil eder. (D) Zaman içinde tutarlılık göstermek için C'den istiflenmiş ortalama, normalleştirilmemiş ani dalga formları. (E) Karbon fiber kayıtları aylar boyunca sabit bir gürültü zemini göstermektedir. B'deki gürültü tabanının standart sapması (iz eksi sıçrama aktivitesi) gürültüde aşamalı bir değişiklik göstermiyor. Çubuklar ortalama kontaminasyonu temsil eder. Hata çubukları standart sapmayı temsil eder. (F) Kronik olarak yerleştirilmiş bir CFEA ve baş kulis ile bir farenin çizimini ölçeklendirin. (G) İmplantasyondan 11 ay sonra ham voltaj izi (üstte) sağlam LFP gösterir. Bantlı voltaj izi (altta) sabit sinirsel aktivite gösterir. (H) C'den lif üzerinde kaydedilen nöronun ortalama ani dalga formu, ilk 1.000 spiking aktivitesi insidansı ile alttan alınır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7: Gelincik birincil görsel korteksinden karbon fiber mikroelekrod dizisi (CFEA) kayıtları. (A) 16 kanallı CFEA'dan kaydedilen sivri sıralanmış tek ünitelerin dalga formları. Tek nöronlardan kaynaklanan eylem potansiyelleri genellikle birden fazla kanalda biraz farklı genliklerde belirgindi. (B) Seçilen nöronlardan yön ayarlama eğrileri. Renkler A'da kaydedilen birimlere karşılık gelir. Oklar uyaran hareketinin yönünü gösterir. Ölçek çubukları yanıt oranını gösterir. Hata çubukları, standart hatayla ortalama yanıtı gösterir. Yatay kesikli çizgi, boş bir ekrana maruz kalma sırasında aynı hücrenin kendiliğinden ateş etme hızını temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, hem akut hem de kronik kullanım için işlevsel bir CFEA oluşturmak için gerekli her adımı açıklar. Açıklanan süreç araştırmacının ihtiyaçlarına göre özelleştirilebilir, bu da onu aylar boyunca tek nöronları izlemek için erişilebilir ve ucuz bir seçenek haline getirir. Protokol, uyuşturulmış bir hayvana implantasyondan sonraki dakikalar içinde ve uyanık, davranışlı bir hayvanda dört ay boyunca hem sağlam tek ünite aktivitesinin kaydedilme fizibilitesini gösterir ve bu CFEA'ların sinirsel yanıtlardaki kısa süreli ve uzun vadeli değişiklikleri inceleme potansiyelini göstermektedir.
Açıklanan protokolün adımları, aylar boyunca net tek birimleri yoğun ve kesin bir şekilde kaydetme yeteneğine sahip, düşük marjinal maliyetle (< 100,00 $) hızlı bir şekilde tamamlanabilecek verimli bir prosedür sağlamak için zaman içinde kapsamlı bir şekilde test edilmiş ve geliştirilmiştir. İnşaat adımları bir günden daha kısa bir sürede tamamlanabilir ve önde gelen herhangi bir ticari diziyle karşılaştırılabilir elektrofizyolojik sinyaller üretecektir. CFEA'lar ayrıca benzer ticari dizilerden çok daha küçük bir ayak izine (16 kanallı lif demeti ~ 26 μm çapa sahiptir) sahiptir ve biyouyumlulukları onları uzun süreli kullanım için uygun hale getirir13. Daha da önemlisi, benzer performansa sahip işleyen bir CFEA üretmek için izlenmesi gereken birkaç kritik adım ve talimat vardır.
Karbon fiberlerin kırılganlığı nedeniyle, son derece dikkatli bir şekilde ele alınmalıdır. Bunları keskin kanatlarla veya diğer aletlerle işlemek liflerin kırılmasına neden olabilir. Ek olarak, CTA'ları sınırlı hava hareketine sahip bir alanda inşa etmek önemlidir, böylece lifler patlamaz. Liflerin arka kısmını alevlerken, çakmağın sadece yaklaşık 1 sn boyunca çok kısa bir süre ileri geri hareket etmesi gerekir. İzolasyonun bu şekilde kaldırılmasını takip eden adımlar, çalışma kanallarına sahip bir elektrot oluşturmak için çok önemlidir. Alevli uçlar, herhangi bir ek temas olmadan jig içine beslenmelidir. Daha sonra, havzayı diş çimentosu ile doldururken, çimentonun dikkatlice uygulanması ve kanalları ve huni havzasını tamamen doldurması, açıklıkları doldurmadan kapatması önemlidir. Diş çimentosu devam etmeden önce UV ışığı ile tamamen iyileştirilmelidir. Bu tamamlandıktan sonra, gümüş boya tamamen dolana kadar her kanala enjekte edilmeli, ancak dökülmemelidir. Bu, işlemdeki en değişken adımdır. Herhangi bir aşırı doldurma kanallar arasında çapraz konuşma üretebilir ve yetersiz doldurma bağlantı hatasına neden olabilir. 25 G'lık bir iğne kullanarak gümüş boya enjekte edemezse, çözeltinin çok viskoz olması ve bu durumda daha akışkan bir çözelti oluşturmak için az miktarda boya tinerinin eklenmesi muhtemeldir. Tüm kanallar doldurulduktan ve baş sahne konektörü yerleştirildikten sonra, konektörü diş çimentosu ile sabitlemeden önce dizinin 24 saat boyunca kürlemesine izin vermek önemlidir. Bunu yapmamanın bağlı kanalların sayısını düşürdüğünü gördük. Sinyal alma sistemiyle etkileşime girdiğinde konektörün bağlantısının kesilmemesi için bol miktarda diş çimentosu uygulamak da önemlidir. Ayrılırlarsa, kanalların tekrarlanan gümüş boya ile doldurulmasıyla yeniden bağlanmayı denemek mümkündür, ancak kullanıcı bağlı kanalların sayısını değerlendirmek için CFEA'nın empedans değerlerini test etmelidir. Diş çimentoslarının bir gecede tedavi edilmesine izin vermek de olası kopuşun önlenmesine hizmet eder.
Elektrodun empedansının ölçülmesi bağlı kanalların doğru bir tahminini sağlayacaktır. Bu, zemini ve referans tellerini ve PBS'deki karbon fiber uçları batırdıktan sonra yapılabilir. Yüksek empedans (>15 MΩ) açık, bağlantısız bir kanalın göstergesi olduğunu gözlemledik. Akım ve elektrolizleme enjekte etmeden önce, bağlı bir kanal bu işlemle önemli ölçüde azalması gereken bir dizi empedans değerine sahip olabilir. 16 kanallı elektrot başına ortalama bağlı kanal sayısı (akım enjeksiyonundan sonra empedans < 4 MΩ) 12,96 ± 2,74 (ortalama ± SD; N = 48 elektrot). Bir dizi elektrolizleme süreleri test edildi ve 30 s kayıt siteleri arasında üstün sinyal yalıtımı üretti (Şekil 5). PEDOT-pTS12, 24,25,26ve PEDOT-TFB21'in karbon fiber kayıt alanlarını hazırlamak için güvenilir seçenekler sunduğu iyi tespit edilmiş olsa da, kronik implantasyon için elektrotların elektrolizlenmesi için kanıtlanmış ve güvenilir bir yöntem olan altın kaplamanın27,28 , implantasyon kolaylığını artırdı ve elektrot uçlarının bir araya topaklanmasını önledi. Ortalama 0,2 MΩ'den daha az nihai empedans değerleri üretirken, bu yöntem PEDOT-TFB21 ve PEDOT-pTS26kullanılarak elde edilen değerlerle karşılaştırılabilir.
Mikroelekrod dizisini yerleştirirken, karbon fiber uçlarının mikroskop altına yerleştirilmesini görsel olarak takip etmek önemlidir. Liflerin bükülmemesi olmadan başarılı yerleştirme belirgin olmalıdır. Lifler bükleniyor gibi görünüyorsa, beyne başarılı bir şekilde girmeleri olası değildir. Bu durumda, probun açısı ikinci bir deneme için ayarlanmalıdır. Bu işlem, probun eklenmesi başarılı olana kadar devam edebilir. Elektrot istenen derinliğe geldikten sonra, en az 30 dakika beklemenin probun optimum sinyal alımına (akut kayıtlar) razı olmasını sağlayacağını bulduk.
Açıklanan CFEA'lar, küçük ayak izlerine ve biyouyumlanabilirliklerine ek olarak, inşaat kolaylığı ve düşük maliyeti nedeniyle ticari dizilere sağlam, özelleştirilebilir bir alternatif sunar. Bu protokolde ayrıntılı olarak açıklanan CFA'lar için en büyük sınırlama ölçeklenebilirlikleridir. Yapımlarının manuel doğası nedeniyle, yüzlerce kayıt sitesiyle tasarımlara kadar ölçeklendirme pratik olmayabilir. Ayrıca, nanoteknoloji kullanarak mikroelekrod dizi imalatındaki gelişmeler, burada açıklanan yöntemlerden daha büyük ölçekli popülasyon kayıtlarına olanak sağlayacaktır. Bununla birlikte, bu protokol, karbon fiber elektrotların tezgah üstü imalatı ile ilgilenen laboratuvarlara CFEA erişilebilirliği sağlar. 120 günlük kronik deneyler süresince spike genliğinde stabilite kaybı veya sağlamlık azalması gözlemlemedik, bu zaman ölçeğindeki gözlemlerimizin tipik temsili tek bir kanalda belirtildiği gibi (Şekil 6A-E). Ek olarak, CFEA'lar kalıcı tek ünite aktivite kapasitesini gösterir, çünkü dört tek ünite fareye implantasyondan 11 ay sonra ayırt edilebilir kalmıştır (Şekil 6G, H). Tek nöronların kısa süreler içinde incelenmesi için diğer birçok ticari elektrota göre avantaj sağlayan kararlı, tek üniteli kayıtları akut olarak elde etmek de mümkündür (Şekil 7). Gelecekte, minimum çapa sahip bu tür esnek, biyouyumlu probların geliştirilmesi karmaşık süreçlerin incelenmesini sağlayacaktır. Bu araçlar, sürekli, uzun vadeli stabilite gerektiren beyin-makine arayüzlerindeki (BMI' ler) uygulamalar da dahil olmak üzere sinir teknolojisinin geliştirilmesinde önemli bir yardımcı program sağlayacaktır29.
Açıklamalar
Yazarlar finansal çıkar çatışması olmadığını beyan eder.
Teşekkürler
Greg Guitchounts'a elektrot tasarımı ve yapımı konusunda rehberlik yaptığı için ve Tim Gardner'a laboratuvarını ve tesislerini bize açtığı için teşekkür ederiz. Christos Michas'a Biyo-Arayüz ve Teknoloji çekirdek tesisinde PDS kullanımına yaptığı yardım için ve Neil Ritter, Jon Spyreas ve David Landesman'a 16 kanallı jig'in erken sürümlerini tasarlamadaki yardımları için teşekkür ederiz. Tim Cavanaugh'a Harvard Nano ölçekli sistemler merkezinde SEM görüntüleme konusundaki yardımı için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| #10 scalpel blade | Fisher Scientific | 14-840-15 | Building tool |
| 16-channel CFEA Jig | Realize Inc. | CFMA component | |
| 16-channel Omnetics connector | Omnetics | A79014-001 | CFMA component |
| 25 G needle | Fisher Scientific | 14-840-84 | Building tool - sharp-tipped |
| 30 G needle | Fisher Scientific | 14-841-03 | Building tool |
| 31 G stainless steel 304 hypodermic round tubing | Small Parts Inc | B000FMYN38 | For guide tube |
| 32-channel CFEA jig | Realize Inc. | CFMA component | |
| 32-channel Omnetics connector | Omnetics | A79022-001 | CFMA component |
| 6 in cotton tip applicators | Fisher Scientific | 22-363-156 | Building tool |
| Acetone | Fisher Scientific | A16P4 | Building tool |
| AutoCad 3D printing software | Autodesk | Computer-aided design tool/ 3D modeling software | |
| Autodesk Fusion 360 | Autodesk | Computer-aided design tool/ 3D modeling software | |
| BD disposable syringes | Fisher Scientific | 14-823-30 | 1 mL |
| Carbon fibers | Good Fellow USA | C 005725 | 7 μm epoxy sized |
| Cassettes and cassette holder | For coating fibers | ||
| Clear tape | Scotch | For coating raw fibers | |
| Deionized water | Electroplating component | ||
| Double-sided tape | Scotch | For coating raw fibers | |
| Flowable Dental Composite | Pentron | Flow-It ALC | CFMA component/ UV cured dental cement |
| Gold plating solution | Sifco ASC | 5355 | 10.0-20.0% glycerol, 1.0-5.0% ethylenediamine, 1.0-5.0% acetic acid (ethylenedinitrilo)tetra-, dipotassium salt, 5.0-10.0% butanoic acid, mercapto-monogold(1+) sodium salt, 1.0–5.0% potassium metabisulfite, 55.0-82.0% water |
| Jewelry clamp | Amazon | B00GRABH9K | Building tool |
| JRClust | Ferret spike sorting software | ||
| Lighter | BIC | LCP62DC | Building tool |
| Micromanipulator | Scientifica | PS-7000C | For guide tube |
| Microscissors | Fisher Scientific | 08-953-1B | Building tool |
| MountainSort | Mouse spike sorting software | ||
| NanoZ 16-channel adapter | Multi-channel systems | ADPT-nanoZ-NN-16 | Electroplating component |
| NanoZ 32-channel adapter | White Matter | NZA-OMN-32 rev A | Electroplating component |
| NanoZ multi-electrode impedance tester | White Matter | Electroplating component | |
| Parafilm | Fisher Stockroom | 13-374-10 | Semi-transparent, flexible film with adhesive properties |
| Parylene 'C' Dimer | Specialty Coating Systems | 980130-C-01LBE | For coating raw fibers |
| PEG 8000 | Fisher Scientific | 25322-68-3 | Electroplating component |
| Phosphate-buffered saline | Electroplating component | ||
| Polyimide tubing | MicroLumen | BRAUNI001 | For guide tube |
| Rotary tool | Dremel | 300124 | For guide tube |
| Scalpel handle | Fine Science Tools | 10003-12 | Building tool |
| Silver conductive coating | MG Chemicals | 842AR Super Shield | CFMA component |
| Stereo microscope with range 6.7:1 | Motic | SMZ-168 | Building tool |
| Sticky notes | Post-it | Building tool | |
| Tissue wipes | Kimtech Science | 34155 | Building tool |
| Tungsten wire | A-M Systems | 797550 | CFMA component |
| UV curing wand | Woodpecker | Building tool | |
| Vacuum deposition chamber | Specialty Coating Systems | Labcoter 2 (PDS 2010) |
Referanslar
- Galvani, L. . De viribus electricitatis in motu musculari commentarius. , (1791).
- Buzsaki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nature reviews. Neuroscience. 13 (6), 407-420 (2012).
- Ledochowitsch, P., et al. On the correspondence of electrical and optical physiology in in vivo population-scale two-photon calcium imaging. bioRxiv. , 800102 (2019).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Seymour, J. P., Wu, F., Wise, K. D., Yoon, E. State-of-the-art MEMS and microsystem tools for brain research. Microsystems and Nanoengineering. 3 (1), 16066 (2017).
- Kerr, J. N., Denk, W. Imaging in vivo: watching the brain in action. Nature reviews. Neuroscience. 9 (3), 195-205 (2008).
- Hong, G., Lieber, C. M. Novel electrode technologies for neural recordings. Nature reviews. Neuroscience. 20 (6), 330-345 (2019).
- Chung, J. E., et al. High-density, long-lasting, and multi-region electrophysiological recordings using polymer electrode arrays. Neuron. 101 (1), 21-31 (2019).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Kozai, T. D., Jaquins-Gerstl, A. S., Vazquez, A. L., Michael, A. C., Cui, X. T. Brain tissue responses to neural implants impact signal sensitivity and intervention strategies. ACS Chemical Neuroscience. 6 (1), 48-67 (2015).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Kozai, T. D., et al. Ultrasmall implantable composite microelectrodes with bioactive surfaces for chronic neural interfaces. Nature Materials. 11 (12), 1065-1073 (2012).
- Chen, R., Canales, A., Anikeeva, P. Neural recording and modulation technologies. Nature Reviews Materials. 2 (2), 16093 (2017).
- Szostak, K. M., Grand, L., Constandinou, T. G. Neural interfaces for intracortical recording: requirements, fabrication methods, and characteristics. Frontiers in Neuroscience. 11, 665 (2017).
- Subbaroyan, J., Martin, D. C., Kipke, D. R. A finite-element model of the mechanical effects of implantable microelectrodes in the cerebral cortex. Journal of Neural Engineering. 2 (4), 103-113 (2005).
- Park, S., et al. One-step optogenetics with multifunctional flexible polymer fibers. Nature Neuroscience. 20 (4), 612-619 (2017).
- Guo, Y., et al. Polymer composite with carbon nanofibers aligned during thermal drawing as a microelectrode for chronic neural interfaces. ACS Nano. 11 (7), 6574-6585 (2017).
- Armstrong-James, M., Millar, J. Carbon fibre microelectrodes. Journal of Neuroscience Methods. 1 (3), 279-287 (1979).
- Garris, P. A., Ciolkowski, E. L., Pastore, P., Wightman, R. M. Efflux of dopamine from the synaptic cleft in the nucleus accumbens of the rat brain. Journal of Neuroscience: The Official Journal of the Society of Neuroscience. 14 (10), 6084-6093 (1994).
- Guitchounts, G., Markowitz, J. E., Liberti, W. A., Gardner, T. J. A carbon-fiber electrode array for long-term neural recording. Journal of Neural Engineering. 10 (4), 046016 (2013).
- Guitchounts, G., Cox, D. 64-channel carbon fiber electrode arrays for chronic electrophysiology. Scientific Reports. 10 (1), 3830 (2020).
- Ma, Z., Turrigiano, G. G., Wessel, R., Hengen, K. B. Cortical circuit dynamics are homeostatically tuned to criticality in vivo. Neuron. 104 (4), 655-664 (2019).
- Popovic, M., et al. Development of cross-orientation suppression and size tuning and the role of experience. Journal of Neuroscience: The Official Journal of the Society of Neuroscience. 38 (11), 2656-2670 (2018).
- Patel, P. R., et al. Chronic in vivo stability assessment of carbon fiber microelectrode arrays. Journal of Neural Engineering. 13 (6), 066002 (2016).
- Welle, E. J., et al. Ultra-small carbon fiber electrode recording site optimization and improved in vivo chronic recording yield. Journal of Neural Engineering. 17 (2), 026037 (2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. Journal of Neural Engineering. 12 (4), 046009 (2015).
- Ferguson, J. E., Boldt, C., Redish, A. D. Creating low-impedance tetrodes by electroplating with additives. Sensors and Actuators. A, Physical. 156 (2), 388-393 (2009).
- Vafaiee, M., Vossoughi, M., Mohammadpour, R., Sasanpour, P. Gold-plated electrode with high scratch strength for electrophysiological recordings. Scientific Reports. 9 (1), 2985 (2019).
- Lebedev, M. A., Nicolelis, M. A. Brain-machine interfaces: From basic science to neuroprostheses and neurorehabilitation. Physiological Reviews. 97 (2), 767-837 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır