Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Zebrafish Gastrula'da İki Foton Mikroskobu Kullanılarak Derin ve Mekansal Kontrollü Hacim Ablasyonları
Bu Makalede
Özet
Embriyonik gelişim, hücre hareketinin büyük ölçekli koordinasyonunu gerektirir. İki fotonlu ekscitasyon aracılı lazer ablasyon, büyük derin hücre gruplarının mekansal olarak kontrol edilen 3 boyutlu ablasyonunu sağlar. Ek olarak, bu teknik , in vivo olarak toplu olarak göç eden hücrelerin mekanik ortamlarındaki pertürbasyonlara reaksiyonlarını araştırabilir.
Özet
Morfogenez, hücreleri dokulara ve organlara düzenlemek için birçok hücre hareketini içerir. Doğru gelişim için, tüm bu hareketlerin sıkı bir şekilde koordine edilmesi gerekir ve kanıtların birikmesi, bunun en azından kısmen mekanik etkileşimlerle başarılmasını göstermektedir. Bunu embriyoda test etmek doğrudan fiziksel pertürbasyon gerektirir. Lazer ablasyonlar, mekanik kısıtlamaların giderilmesine veya iki hücre popülasyonunun fiziksel olarak birbirinden izole edilmesine izin veren giderek daha fazla kullanılan bir seçenektir. Bununla birlikte, birçok ablasyon, sınırlı eksenel çözünürlük ve doku penetrasyonu sunan ultraviyole (UV) lazer ile gerçekleştirilir. Burada iki fotonlu mikroskop kullanarak derin, önemli ve mekansal olarak iyi tanımlanmış hacimleri alevlendirmek için bir yöntem açıklanmıştır. Ablasyonlar, eksenel mezendodermdeki yeşil floresan proteini ifade eden transgenik bir zebra balığı hattında gösterilir ve ektodermi veya alttaki yumurta sarısı hücresini etkilemeden eksenel mezendodermi kesmek için kullanılır. Hücre davranışı ablasyon öncesi ve sonrası canlı görüntüleme ile izlenir. Ablasyon protokolü farklı gelişim aşamalarında, herhangi bir hücre tipinde veya dokuda, birkaç mikrondan yüzden fazla mikrona kadar değişen ölçeklerde kullanılabilir.
Giriş
Hücre-hücre etkileşimleri gelişimde hayati roller oynar. Hücreler, doğrudan komşularının veya daha uzaktaki hücrelerin algılayabildiği sinyaller sağlar, böylece kaderlerini ve/ veya davranışlarını etkileri. Bu sinyallerin çoğu doğada kimyasaldır. Örneğin, iyi karakterize indüksiyon olaylarında, bir hücre grubu başka bir hücre popülasyonunun kaderini etkileyen difüzör moleküller üretir1. Bununla birlikte, diğer sinyaller mekaniktir; hücreler, komşuların algıladığı ve yanıt verdiği komşuları üzerinde kuvvetler ve kısıtlamalar uygular2.
Bu hücre-hücre etkileşimlerinin vivodaki önemini incelemenin bir yolu, bazı hücreleri ortadan kaldırmak ve sonraki gelişimi gözlemlemektir. Ne yazık ki, hücreleri çıkarmak veya yok etmek için mevcut teknikler sınırlıdır. Hücreler cerrahi olarak 3,4, iğneler veya küçük teller kullanılarak çıkarılabilir, ancak bu tür tedaviler invazivdir, çok kesin değildir ve genellikle bir stereomikroskop altında gerçekleştirilir ve mikroskop altında anında görüntülemeyi önler. Ayrıca, derin hücreleri hedeflemek, aşırı dokularda bir delik açmak ve istenmeyen pertürbasyonlar oluşturmak anlamına gelir. KillerRed gibi genetik olarak kodlanmış ışığa duyarlılıklar, ışık aydınlatması yoluyla hücre ölümünü teşvik etmek için kullanılmıştır5. Işığa duyarlılıklar, ışık ışınlama üzerine reaktif oksijen türleri üreten kromoforlardır. Ana sınırlamaları, hücreler hareket ediyorsa elde edilmesi zor olabilecek uzun ışık aydınlatmaları (yaklaşık 15 dk) gerektirmeleri ve acil olmayan apoptoz yoluyla hücre ölümünü teşvik etmeleridir.
Son olarak, lazer ablasyonları son 15 yılda geliştirilmiş ve yaygın olarak kullanılmaktadır6,7,8,9,10,11,12. Lazer ışını hedeflenen hücre/dokuya odaklanır. Isıtma, fotoablasyon veya plazma kaynaklı ablasyon yoluyla ablasyonunu tetikler; ilgili süreç güç yoğunluğuna ve pozlama süresine bağlıdır13. Çoğu ablasyon protokolü yüksek enerjileri için UV lazerleri kullanır. Bununla birlikte, UV ışığı biyolojik dokular tarafından hem emilir hem de dağılır. Bu nedenle, derin hücreleri hedeflemek yüksek bir lazer gücü gerektirir, bu da daha yüzeysel, düzlem dışı dokularda hasarlara neden olandır. Bu, UV lazerlerin kullanımını yüzeysel yapılarla sınırlar ve nispeten düşük eksenel çözünürlüklerini açıklar. Doğrusal olmayan optikler (iki foton mikroskopisi olarak adlandırılır), kızılötesi etki alanında yaklaşık yarım enerjili iki foton ile bir floroforu heyecanlandırmak için ışığın doğrusal olmayan özelliklerini kullanır. Ablasyonlara uygulandığında, bunun üç ana avantajı vardır. İlk olarak, kızılötesi ışık biyolojik dokular tarafından UV ışığından daha az dağınık ve daha az emilir14, gerekli lazer gücünü artırmadan daha derin yapılara ulaşmayı sağlar. İkincisi, femtosaniye darbeli lazer kullanımı çok yüksek güç yoğunlukları sağlar, plazma indüksiyonu yoluyla bir ablasyon oluşturur, bu da ısıtmanın aksine, mekansal olarak yayılmaz15. Üçüncü olarak, plazma oluşumunu indükleyen güç yoğunluğuna sadece odak noktasında ulaşılır. Bu özellikleri sayesinde iki fotonlu lazer ablasyonlar, çevredeki doku ortamını etkilemeden derin hücreleri hassas bir şekilde hedeflemek için kullanılabilir.
Kolektif göçler, hücre-hücre etkileşimlerinin temel olduğu gelişimsel süreçlerin mükemmel bir örneğidir. Toplu geçişler, komşu hücrelerin bir hücrenin davranışını etkilediği hücre geçişleri olarak tanımlanır16. Bu etkileşimlerin doğası (kimyasal veya mekanik) ve hücre göçini nasıl etkilediği büyük ölçüde değişebilir ve çoğu zaman tam olarak anlaşılamamıştır. Hücreleri çıkarma ve bunun diğerlerini nasıl etkilediğini gözlemleme yeteneği, bu kolektif süreçlerin daha da çözülmesinde kritik öneme sahiptir. Birkaç yıl önce, cerrahi yaklaşımlar kullanarak, zebra balığı gastrülasyonu sırasında polster göçünün kolektif bir göç olduğunu belirledik17. Polster, embriyonun dorsal tarafındaki ilk içselleştirici hücreleri oluşturan bir hücre grubudur18. Tg(gsc:GFP) transgenik çizgisinde yeşil etiketli bu hücreler embriyonun derinliklerinde, epiblast hücrelerinin birkaç katmanının altında bulunur. Gastrülasyon sırasında bu grup eksenel mezoderm'in uzantısına öncülük eder ve embriyonik organizatörden hayvan kutbuna göç eder19,20,21,22,23 (Şekil 1A). Hücrelerin göçlerini hayvan kutbu yönünde yönlendirmek için komşularıyla temasa ihtiyaç duyduklarına dair tespit ettik. Bununla birlikte, bu kolektif göçün hücresel ve moleküler temellerini daha iyi anlamak, bunun kalanları nasıl etkilediğini görmek için bazı hücrelerin çıkarılmasını içerir. Bu nedenle, iki fotonlu bir mikroskopi kurulumu kullanarak büyük ve derin hacimlerde ablasyonlar geliştirdik. Burada, histone2B-mCherry ile etiketlenmiş çekirdekleri izleyerek bu protokolün ortasındaki polster'ı kesmek ve hücre göçü üzerindeki sonuçlarını gözlemlemek için kullanıldığını gösteriyoruz.
Protokol
Tüm hayvan çalışmaları Etik Komitesi N 59 ve Ministère de l'Education Nationale, de l'Enseignement Supérieur et de la Recherche tarafından APAFIS#15859-2018051710341011v3 dosya numarası altında onaylanmıştır. Aşağıda açıklanan adımlardan bazıları ekipmanımıza ve yazılımımıza özgüdir, ancak farklı ekipmanlara kolayca uyarlanabilir.
1. Enjeksiyon hazırlığı
- Embriyo Ortamı'nda (EM) %1 agarose çözeltisinin 75 mL'sini hazırlayın.
- Enjekte kalıbını 90 mm Petri kabına yerleştirin ve kalıbın yüzmesi için yeterli olan yaklaşık 50 mL agarose dökün. Agarose katılaşmaya bırakın ve enjekte kalıbını çıkarın.
- 30 mm Petri kabına 1 mL agarose dökerek agarose kaplı bir tabak hazırlayın.
- Stok çözeltisini RNase içermeyen suda seyrelterek 4 μL 30 ng/μL Histone2B-mCherry mRNA çözeltisi hazırlayın ve buzda tutun.
NOT: RNaz aracılı bozulmayı önlemek için mRNA'yı manipüle ederken eldiven giymeye özen edin. - Mikropipette puller kullanarak bir kılcal damardan bir enjeksiyon iğnesi çekin.
2. Embriyo hazırlığı
- Balıklar yumurta bıraktıktan sonra, EM'deki 90 mm Petri kabında toplayın, durulayın ve hasat edin. Embriyoları 28,5 °C inkübatöre yerleştirin.
- İlk hücrenin görünür olması için 20 dakika bekleyin.
- EM ile dolu enjeksiyon plakasına 30 embriyo transfer edin. Embriyoları hafif künt tokmaklar kullanarak oluklara sıkın ve hayvan direği yukarı doğru yönlendirin.
- Bir mikro doldurucu ucu kullanarak, bir enjeksiyon iğnesi 2 μL mRNA çözeltisi ile doldurun. İğneyi, politetrafloroetilen (PTFE) boru ile bağlanmış bir mikro manipülatöre yerleştirilen kılcal tutucuya bir hava enjektörüne yerleştirin.
- Stereomikroskop altında, iğnenin ucunu dikkatlice kırın.
- İğneyi hücreye sokarak 1 hücreli evre embriyolara mRNA solüsyonuna enjekte edin.
NOT: Eklenen birim hücre hacminin yaklaşık üçte biri kadardır. - Enjekte edilen embriyoları 28,5 °C inkübatöre geri yerleştirin.
3. İki foton mikroskopunun hazırlanması
NOT: Bu protokolde iki lazer kullanılmaktadır. Biri GFP'yi (920 nm'de) görüntülemek ve ablasyonlar yapmak için kullanılır (820 nm'de). Yeşil/ablasyon lazer olarak anılacaktır. Diğeri mCherry'yi görüntülemek için 1160 nm'de kullanılır. Kırmızı lazer olarak adlandırılacak.
- Yeşil/ablasyon lazeri 820 nm (ablasyon dalga boyu) ve kırmızı lazeri 1160 nm (mCherry excitation) olarak ayarlayın.
- Optik yolda hareketli aynalar kullanarak, tarama kafasının hem girişinde hem de çıkışında yeşil/ablasyon ve kırmızı lazer ışınlarını hizalayın.
NOT: Bu, lazer ışını odağını arttırır ve heyecan ve ablasyon için odak hacmini en aza indirir. - Yeşil/ablasyon lazerin maksimum gücünü hedef altında 820 nm olarak ölçün. Bunu yapmak için, güç ölçeri hedefin altına yerleştirin, siyah odayı kapatın, yeşil / ablasyon lazer gücünü% 100'e ayarlayın ve panjurları açın. 300 mW'a ulaşmak için gereken lazer gücünün yüzdesini hesapla.
- Yeşil/ablasyon lazeri 920 nm'ye (GFP ekscitasyon) geri ayarlayın ve lazer gücünü %7'ye ayarlayın. Kırmızı lazer gücünü %15 olarak ayarlayın.
- Yeşil ve kırmızı çizgiler için epi-PhotoMultiplier Tüpler (PMT) dedektörlerini etkinleştirin; yeşil ve kırmızı çizgi PMT hassasiyetini 65 olarak ayarlayın.
- Görüş alanını 400 x 400 μm, görüntü çözünürlüğünü 512 x 512 piksel ve tarama sıklığını 800 Hz olarak ayarlayın.
- 3D Timelapse Görüntüleme modunu seçin. Ardından, bir klasör oluşturun ve her alımdan sonra veriler için Otomatik Kaydet'i etkinleştirin.
- Isıtma odasını monte edin ve 28 °C'ye ayarlayın. Oda ve hedefin ısınması için en az 10 dakika bekleyin.
4. Embriyonun montajı
- Floresan stereomikroskop altında, embriyoları GFP'yi ifade eden% 70 epiboly olarak tanımlayın.
NOT: Daha iyi görüntüleme kalitesi için eksenel mezodermde parlak sinyal ve arka plan floresansız embriyoları seçin. - Seçilen üç ila dört embriyoyu plastik bir Pasteur pipet kullanarak agarose kaplı çanağa (adım 1.3) aktarın ve ince tokalar kullanarak dikkatlice kaynatın.
NOT: Kafeinsiz embriyolar çok hassastır ve hava veya plastikle temas halinde patlar. - 1x penisilin-streptomisin EM'de küçük bir cam şişeye 1 mL% 0.2 agarose dökün. Şişeyi önceden ısıtılmış 42 °C kuru blok ısıtıcıya yerleştirin.
NOT: Agarose setleri öncesinde embriyo oryantasyonuna izin vermek için aşağıdaki adımlar hızlı bir şekilde yapılmalıdır. - Ateş cilalı bir cam pipet kullanarak% 0.2 agarose cam şişesinde kafeinsiz bir embriyo aktarın. Seyreltmemek için agarose'a çok fazla EM eklememeye dikkat edin. Kalan EM'yi pipetten atın ve embriyo pipetten düşmeden önce cam alt kabın kaydıramasını örtecek kadar agarose ile birlikte embriyoyu tekrar aspire edin.
- Agarose ve embriyoyu yemeğin cam kaydırağı üzerine üfleyin. Embriyonun havaya veya yemeğin plastik tarafına dokunmasına izin vermemeye dikkat edin. Ardından, cam kaydırağın etrafındaki odayı agarose ile doldurun.
- Embriyoyu hedeflenen bölgenin en üstünde olacak şekilde yönlendirmek için bir kirpik kullanın (Şekil 1B).
NOT: Embriyoları yönlendirirken, çok kırılgan yumurta sarısına değil, sadece blastoderm'e dokunmaya özenin. Agarose, oda sıcaklığına bağlı olarak yaklaşık 1 dakika içinde yer alacaktır. - Agarose'un tamamen ayarlandırığı için ~5 dakika bekleyin ve ardından birkaç damla penisilin-streptomisin EM ekleyin.
5. Embriyonun ve ablasyon öncesi görüntülemenin bulunması
- Cam alt kabı ısıtılmış hazneye hedefin altına yerleştirin. Hedefi penisilin-streptomisin EM'ye daldırın ve ısıtılmış hazneyi kapatın.
- Işık yolunu oküler olarak ayarlamak için kaydırıcıyı hareket ettinin. Daha sonra, oküler, floresan lambalar ve sahne kontrolü kullanarak bir embriyo bulun ve odağı embriyonun yüzeyine ayarlayın.
- Floresan lambayı kapatın, PMT'lere ışık yolunu ayarlayın ve siyah odayı kapatın.
NOT: PMT'lere zarar verebileceğinden siyah haznedeki tüm ışık kaynaklarını kapatmaya dikkat edin. - Canlı görüntülemeye başlayın ve eksenel mezodermi bulun. Yeşil/ablasyon ve kırmızı lazer güçlerini iyi bir sinyale sahip olacak şekilde ayarlayın (örneğin, GFP ifade alanları için piksel başına 1.000 ila 20.000 foton). Aşamayı embriyonun en üstüne taşımak için kırmızı kanalı kullanın ve bu pozisyonu Z = 0 olarak ayarlayın.
- 1 dakikalık bir zaman adımı ve 2 μm'lik bir Z adımı seçin. 110 μm'lik bir Z-kursu tüm polster'ı kapsamak için yeterlidir ve bu ayarlarla 1 dakikadan daha kısa bir sürede elde edilir. İlk dilimi eksenel mezodermden 15 μm yukarı ayarlayın (daha yüzeysel ektodermde).
NOT: Polster kavisli bir çizgi boyunca hareket eder, böylece Z yığınının alt dilimi, zaman atlamalı görüntüleme sırasında hareketini karşılamak için polster en derin konumundan 30 μm daha derine ayarlanmalıdır (Şekil 1E). - 10-15 dakikalık ablasyon öncesi film kaydedin.
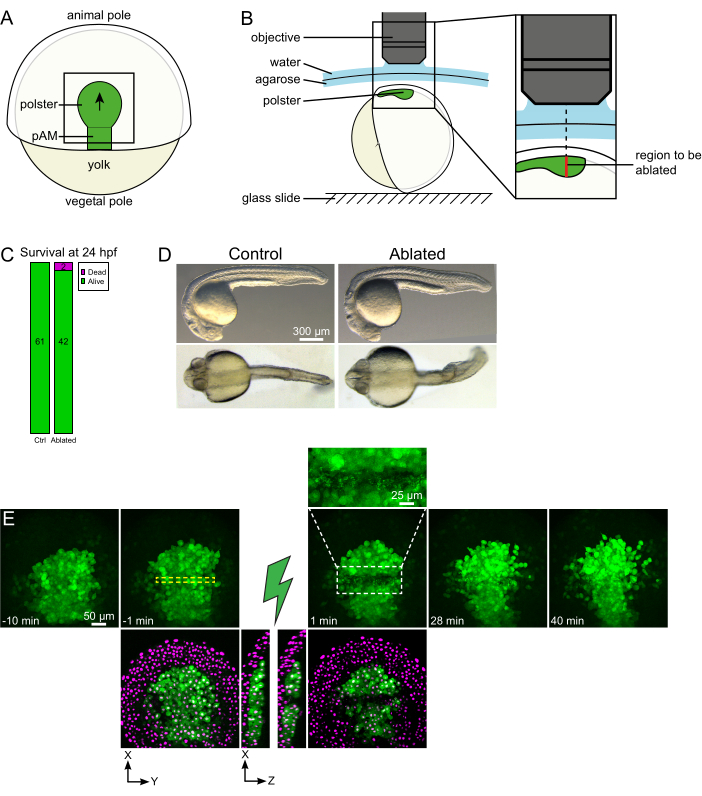
Şekil 1: Lazer ablasyonlarının başarılı sonucu. (A) Dorsal görünümde% 70 epiboly gazlı embriyo şeması; pAM: arka eksenel mezoderm; siyah ok polster göçü yönünü işaretler; siyah kare, polsterdeki ablasyonlar için tipik bir görüş alanını gösterir. (B) Polster kesme için embriyo montaj şeması. Yanal görünüm. Embriyo, polster düzlemi optik eksene dik olacak şekilde monte edilir. (C) döllenme sonrası 24 saat kontrol ve ablated embriyoların sağkalım ve (D) morfolojisi. Ölçek çubuğu 300 μm. (E) Histone2B-mCherry ifade eden bir Tg (gsc:GFP) embriyosunun polsterinde lazer ablasyondan zaman dizisidir. Yeşil kanallı görünümler yalnızca maksimum projeksiyonlardır. Yakın çekim, hücre kalıntıları içeren ablated alanı görüntüler. Yeşil ve kırmızı (macenta olarak görüntülenir) kanallara sahip görünümler, ablasyondan önce ve sonra XY ve XZ dilimleridir (yeşil şimşek ablasyonu temsil eder). XZ dilimleri, üstteki dokuların (GFP ekspresyonsuz macenta çekirdeği) alttaki yapıların ablasyonundan etkilenmediğini göstermektedir. Sarı kesikli kutu lazer ablasyon tedavisi için seçilen yatırım getirisine karşılık gelir. Ölçek çubuğu büyük görünümlerde 50 μm ve yakın çekimde 25 μm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
6. Hedef konum ve lazer ablasyon
- Canlı görüntülemede polster konturunun yerini tespit edin ve Elektro-Optik Modülatör İlgi Alanı (EOM ROI) aracını kullanarak, polster genişliğini kapsayan 20 piksel (15 μm) büyük bir dikdörtgen çizin. Bu dikdörtgeni polster'ın ortasına yerleştirin (Şekil 1E).
- Polster hücreleri içeren en yüksek ve en düşük düzlemlerin eksenel konumuna dikkat edin. Ablasyonlar bu iki düzlem arasında her 10 μm'de bir yapılacaktır. Yatırım getirisinin bu düzlemlerin hiçbirinde yumurta sarısı hücresiyle çakışmamasına dikkat edin.
- Sahneyi aralığın en düşük Z konumuna getirin. Enkaz ışığı emerken ablasyonlar aşağıdan yukarıya yapılmalıdır.
- Yeşil/ablasyon lazer dalga boyunu 820 nm olarak ayarlayın ve 300 mW çıkış gücü elde etmek için Güç Yüzdesi'ni ayarlayın (adım 3.3).
- Görüntüleme Frekansını 200 Hz olarak ayarlayın.
- Yeşil/ablasyon lazer görüntüleme EOM'yi 0 olarak ayarlayın ve YATıRıM YGSi-Tedavi modunu seçin.
- EOM'yi açın ve tedaviyi hemen başlayacak şekilde ayarlayın (0 kareden sonra).
- Görüntüleme Modunu ZamanLayıcı olarak ayarlayın ve Otomatik Kaydetme'yi devre dışıleyin.
- Zaman Adımını Hızlı moda ayarlayın.
- Tedavi Çerçevelerinin Sayısını ve Kare Sayısını hedeflenen derinliğe karşılık gelen değere ayarlayın (Tablo 1).
| Derinlik (μm) | Tedavi çerçeveleri |
| -30 | 1 |
| -35 | 1-2 |
| -40 | 1-2 |
| -45 | 2 |
| -50 | 2-3 |
| -55 | 3 |
| -60 | 3-4 |
| -65 | 4 |
| -70 | 4 |
| -75 | 4-5 |
| -80 | 4-5 |
| -85 | 5 |
| -90 | 5 |
| -95 | 5-6 |
| -100 | 6 |
| -105 | 6 |
Tablo 1: Embriyoda hedeflenen hücre derinliğinin bir fonksiyonu olarak önerilen lazer tedavi çerçevesi sayısı (0 embriyonun yüzeyidir).
- Görüntülemeye başlayın. EOM tedavisi sırasında PMT deklanşörü kapanırken satın alma siyahtır.
- Sahne alanı yukarıyı listenin bir sonraki Z konumuna taşıyın (adım 6.2).
- Polster'ın tepesine ulaşılana kadar 6.10 ile 6.12 arası adımları yineleyin.
7. Ablasyon sonrası doğrulama ve görüntüleme
- Yeşil/ablasyon lazeri 920 nm ve %5 güce ayarlayın. Yeşil/ablasyon lazer görüntüleme EOM'yi 100 olarak ayarlayın ve Fullfield modunu seçin.
- Görüntüleme Frekansını 800 Hz olarak ayarlayın.
- Her düzlemin ablatılıp ablatlanmadığını kontrol etmek için tüm yığını canlı modda gözden geçirin. Durum böyle değilse, 6.2 adımına geri dönün.
NOT: Ablasyon bazen komşu dokuların dikey kaymasına neden olur, böylece Z yığınının yeniden tanımlanması gerekebilir. - Görüntüleme Modunu 3D Timelapse olarak ayarlayın ve Otomatik Kaydetme'yi yeniden etkinleştirin. 40-60 dakikalık ablasyon sonrası film kaydedin.
- Ablasyon sonrası filmde, hedeflenen hücrelerin etkili bir şekilde ablatlanıp emilmediğini kontrol edin. Floresan iyileşmesi veya yer kaplayan ve takipçi hücrelerin hareket etmesini engelleyen hedeflenen hücreler, hedeflenen hücrelerin sadece fotobleached olduğunu ve ablated olmadığını gösterir (Şekil 1E ve Şekil 2A).
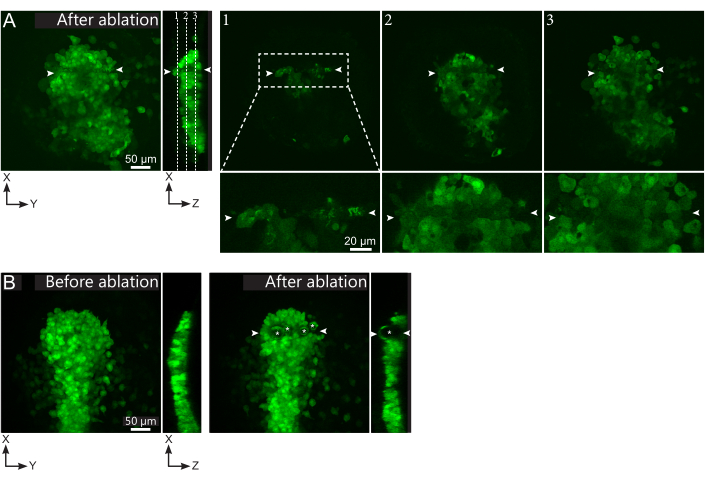
Şekil 2: Lazer ablasyonlarının negatif sonuçları. (A) Lazer ablasyondaki olası başarısızlıkların tipik örnekleri. Büyük XY görünümleri maksimum projeksiyonlardır, XZ görünümü yeniden yapılandırılmış bir bölümdür. Lazerle tedavi edilen alan iki beyaz ok ucu arasında bulunur. Yeniden yapılandırılan bölümde üç odak düzlemi vurgulanır ve sağda görüntülenir. Üç farklı başarısızlık türüne karşılık gelir. Uçak 1, polster'ın üstündeki hücrelerin aklandığını gösteriyor. Bu, polster'ın üzerindeki bu odak düzleminde otofluoresan kalıntılarının varlığıyla tanımlanabilir (yeniden inşa edilen bölümdeki 1. düzlem konumuna bakın). Bu büyük olasılıkla, ablatlanacak bölgenin yanlış tanımlanmasından kaynaklanır. Düzlem 2, ağartılmış ancak ablated olmayan hücreleri gösterir. Düşük floresan sinyali hala sağlam hücre hatlarını ortaya çıkardığı için tanımlanabilirler (bkz. yakın çekim). Düzlem 3, lazer tedavisi ile neredeyse hiç ağartılmış sağlam hücreler görüntüler. Bu, bölgenin yanlış tanımlanmasından veya kötü muameleden neden olabilir. 2. ve 3. düzlemlerde tasvir edilen durumlarda ablatasyon tedavisi ablatlanmamış hedefli hücrelere yeniden uygulamak mümkündür. Ölçek çubuğu büyük görünümlerde 50 μm ve yakın çekimlerde 20 μm'dir. (B) Çok yoğun bir lazer tedavisi nedeniyle kavitasyon ile oluşan kabarcıkların (beyaz yıldızlarla işaretlenmiş) tipik bir örneği. Bu tür kabarcıklar bir Z düzlemi ile sınırlı değildir, hatta bazen polster'ın tam yüksekliğini kaplar, komşu dokuları deforme eder. Ölçek çubuğu 50 μm'dir . Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
8. Veri analizi
- Görüntü analiz yazılımıyla zaman atlamalı serileri açın ve doğru piksel boyutunu ayarlayın.
- Spot işlevinde, gastrülasyon sırasında ortalama çekirdek boyutu olduğu için Nesne Boyutunu 10 μm olarak ayarlayın. Ardından, çekirdeği algılamak ve izlemek için Spot işlevini çalıştırın.
NOT: Algılama, Z ekseni boyunca 12 μm uzunluğunda elipsoidal bir şekle uyan alt eksenel çözünürlük göz önünde bulundurularak biraz iyileştirilebilir. - Yanlış pozitifleri kaldırmak için filtreleri kullanın. Tg(Gsc:GFP) çizgisinde embriyonik eksenden hücreler ve bazı endodermal hücreler yeşil olarak etiketlenir. Bu nedenle, yeşil yoğunlukta filtreleme, bu hücrelerin hızlı bir şekilde seçilmesini sağlar (Şekil 3A).
- Ardışık noktalar arasındaki maksimum mesafeyi hücrelerin hızıyla uyumlu bir değere ayarlayın.
NOT: İki kare arasındaki zaman aralığını göz önünde bulundurmaya dikkat edin. Polster hücreleri 2.8 ± 0.8 μm/ dak'da göç etti. Bu nedenle, 1 dakikalık bir zaman adımı için 4 μm maksimum yer değiştirme izin vermek çoğu artefactual parçayı kaldırır. - Bir veya iki zaman noktası üzerinde boşluklara izin vermek daha uzun sürekli izler sağlar, ancak izleme hatalarına neden olabilir. Bir çekirdek tek seferlik bir noktada doğru algılanmazsa, nokta algılamayı farklı parametrelerle/filtrelerle yeniden çalıştırmayı düşünün.
- İzleri görsel olarak kontrol edin ve gerekirse düzeltin.
- Sonuçları .xlsx dosyası olarak dışa aktar. Dosyayı yayımlanmış elektronik tablo yordamları24 (Şekil 3B) ve veri çözümleme yazılımındaki özel yordamları (istek üzerine kullanılabilir) kullanarak işleyin.
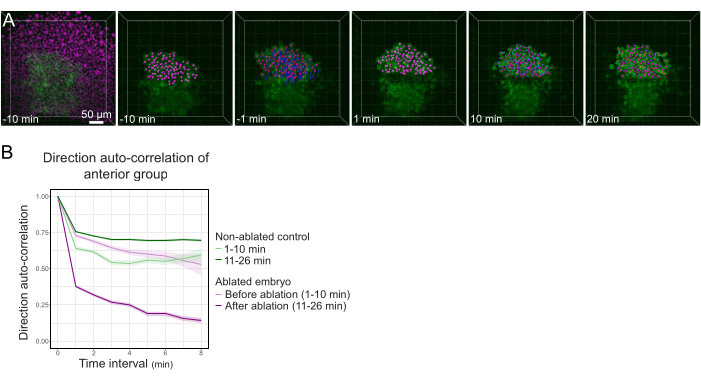
Şekil 3: Polsterin ön yarısının izolasyonu hücre yönlülüğünü etkiler. (A) 3D, ortasındaki polsteri kesen bir lazer ablasyondan önce ve sonra Histone2B-mCherry'yi (macenta ile görüntülenen) ifade eden bir Tg (gsc:GFP) embriyosunu yeniden yapır. Polster'ın ön yarısına ait çekirdekler bir macenta noktası ile işaretlenir ve ablasyondan önce ve sonra zaman içinde izlenir (bkz. Film S1). Ölçek çubuğu 50 μm'dir. (B) Göç kalıcılığının bir ölçüsü olarak, ablasyondan önce ve sonra polsterin ön kısmına ait hücrelerin yön otomatik korelasyonu. Hücreler ablasyondan önce sürekli bir hareket gösterir, bu da ablasyondan sonra büyük ölçüde azalır ve bu da kolektif yönelimli göç kaybını gösterir. Yön otomatik korelasyonu, ablatlanmamış bir embriyonun polsterinin ön yarısını oluşturan hücreler üzerinde de kontrol olarak ölçüldü. Grafik zarfları standart hatayı gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Polster'ı ortasında kesmek için, 4. Polster GFP ekspresyasyonu ile tanımlandı ve embriyo, polster düzleminin optik eksene dik olması için monte edildi (Şekil 1B). Embriyoyu bu pozisyondan uzağa yatırmak prosedürü zorlaştıracaktır. Işığın ablasyon düzlemlerine ulaşmak için daha fazla dokudan geçmesi gerekecek ve ablasyon düzlemleri embriyonik eksenlere göre eğilecek. Tüm hücre çekirdeklerinin doğru etiketlendiğini doğruladıktan sonra, ablasyondan ön...
Tartışmalar
Burada, derin ve mekansal olarak iyi tanımlanmış hacim ablasyonları gerçekleştirmek için doğrusal olmayan optikler kullanan bir protokol açıklıyoruz. Protokolün en kritik adımı, aşırı döküntü veya kavitasyondan kaçınmak için ablasyonlara izin vermek için yeterli enerji sağlayan, ancak çok fazla enerji vermeyen tedavi koşulları bulmaktır. Hedef sahadaki enerji miktarı esas olarak şunları bağlıdır: (1) lazer çıkış gücü, (2) lazer hizalama kalitesi, (3) ablasyon düzlemine ulaşmak i...
Açıklamalar
Yazarlar rakip çıkarlar beyan etmemektedir.
Teşekkürler
Emilie Menant'a balık bakımı için, Polytechnique Biyogörüntüleme Tesisi'ne, özellikle Pierre Mahou'ya, kısmen Région Ile-de-France (interDIM) ve Agence Nationale de la Recherche (ANR-11-EQPX-0029 Morphoscope2, ANR-10-INBS-04 France BioImaging) tarafından desteklenen ekipmanlarında canlı görüntüleme konusunda yardım için teşekkür ederiz. Bu çalışma ANR hibeleri 15-CE13-0016-1 tarafından desteklenmiştir, 18-CE13-0024, 20-CE13-0016 ve Marie Skłodowska-Curie hibe anlaşması no 840201 kapsamında Avrupa Birliği'nin Horizon 2020 araştırma ve yenilik programı, Ministère de l'Enseignement Supérieur et de la Recherche ve Centre National de la Recherche Scientifique.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 25x water immersion objective | Olympus | XLPLN25XWMP2 | |
| Agarose | PanReac AppliChem | A8963,0500 | |
| Data analysis software : Matlab | Math Works | ||
| Electro-optic modulator (EOM) | ConOptics | 350-80LA | |
| Embryo Medium (EM) solution | Westerfield, M. The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Danio rerio), 5th Edition. University of Oregon Press, Eugene (Book). (2000). | ||
| Environmental chamber chamber | Okolab | H201-T-UNIT-BL | |
| EOM driver | ConOptics | 302RM | |
| Fluorescence source | Lumencor | SOLA | |
| Glass bottom dishes | MatTek | P35G-0-10-C | |
| Glass capillaries | Harvard Apparatus | 300085 | Outside diameter 1.0 mm, inside diameter 0.58 mm |
| Glass pipettes | Volac | D810 | Tip should be fire polished |
| Green/ablation laser | Spectra Physics | Mai Tai HP DeepSee | |
| Histone2B-mCherry mRNA | Synthesized from pCS2-H2B-mCherry plasmid (Dumortier& al. 2012) | ||
| Image analysis software: IMARIS | Bitplane | ||
| ImSpector software | Abberior Instruments Development Team | ||
| Injection mold | Adapative Science Tools | I-34 | |
| Microloader tips | Eppendorf | 5242956003 | |
| Micromanipulator | Narishige | MN-151 | |
| Micropipette puller | Sutter | P-1000 | |
| mMESSAGE mMACHINE SP6 Transcription Kit | Invitrogen | AM1340 | |
| Penicillin-Streptomycin | Thermofisher | 15140-122 | 10 000 units penicillin and 10 mgstreptomycin per ml |
| Photomultiplier tube (PMT) | Hammamatsu | H7422-40 | |
| PicoPump (Air injector) | World Precision Instrument | PV820 | |
| Red laser | Spectra Physics | OPO/Insight DeepSee | |
| RNAse free water for injection | Sigma | W3500 | |
| Spreadsheet software: Excel | Microsoft | ||
| Stereomicroscope | Nikon | SMZ18 | |
| Tg(gsc:GFP) zebrafish line | Doitsidou, M. et al. Guidance of primordial germ cell migration by the chemokine SDF-1. Cell. 111 (5), 647–59, doi: doi.org/10.1016/S0092-8674(02)01135-2 (2002). | ||
| TriM Scope II microscope | La Vision Biotech |
Referanslar
- Slack, J. M. W. Embryonic induction. Mechanisms of Development. 41 (2-3), 91-107 (1993).
- Fernandez-Sanchez, M. -. E., Brunet, T., Röper, J. -. C., Farge, E. Mechanotransduction's impact on animal development, evolution, and tumorigenesis. Annual Review of Cell and Developmental Biology. 31, 373-397 (2015).
- Shih, J., Fraser, S. E. Characterizing the zebrafish organizer: microsurgical analysis at the early-shield stage. Development. 122 (4), 1313-1322 (1996).
- Selleck, M. A. J. Culture and microsurgical manipulation of the early avian embryo. Methods in Cell Biology. 51 (51), 1-21 (1996).
- Bulina, M. E., et al. A genetically encoded photosensitizer. Nature Biotechnology. 24 (1), 95-99 (2006).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. Laser microsurgery in Caenorhabditis elegans. Methods in Cell Biology. 107, 177-206 (2012).
- Colombelli, J., Grill, S. W., Stelzer, E. H. K. Ultraviolet diffraction limited nanosurgery of live biological tissues. Review of Scientific Instruments. 75 (2), 472-478 (2004).
- Smutny, M., Behrndt, M., Campinho, P., Ruprecht, V., Heisenberg, C. -. P. UV laser ablation to measure cell and tissue-generated forces in the zebrafish embryo in vivo and ex vivo. Methods in Molecular Biology. 1189, 219-235 (2015).
- Behrndt, M., et al. Forces driving epithelial spreading in zebrafish gastrulation. Science. 338 (6104), 257-260 (2012).
- Volpe, B. A., Fotino, T. H., Steiner, A. B. Confocal microscope-based laser ablation and regeneration assay in zebrafish interneuromast cells. Journal of Visualized Experiments: JoVE. (159), (2020).
- Bonnet, I., et al. Mechanical state, material properties and continuous description of an epithelial tissue. Journal of the Royal Society, Interface. 9 (75), 2614-2623 (2012).
- Rauzi, M., Lenne, P. F., Lecuit, T. Planar polarized actomyosin contractile flows control epithelial junction remodelling. Nature. 468 (7327), 1110-1115 (2010).
- Niemz, M. H. . Laser-Tissue Interactions. Encyclopedia of Biomaterials and Biomedical Engineering, Second Edition - Four Volume Set. , (2019).
- Smith, A. M., Mancini, M. C., Nie, S. Bioimaging: second window for in vivo imaging. Nature Nanotechnology. 4 (11), 710-711 (2009).
- Rauzi, M., Lenne, P. -. F. Cortical forces in cell shape changes and tissue morphogenesis. Current Topics in Developmental Biology. 95, 93-144 (2011).
- Theveneau, E., David, N. B. Migrations cellulaires collectives. Medecine/Sciences. 30 (8-9), 751-757 (2014).
- Dumortier, J. G., Martin, S., Meyer, D., Rosa, F. M., David, N. B. Collective mesendoderm migration relies on an intrinsic directionality signal transmitted through cell contacts. Proceedings of the National Academy of Sciences of the United States of America. 109 (42), 16945-16950 (2012).
- Solnica-Krezel, L., Stemple, D. L., Driever, W. Transparent things: cell fates and cell movements during early embryogenesis of zebrafish. BioEssays. 17 (11), 931-939 (1995).
- Montero, J. -. A., Kilian, B., Chan, J., Bayliss, P. E., Heisenberg, C. -. P. Phosphoinositide 3-kinase is required for process outgrowth and cell polarization of gastrulating mesendodermal cells. Current Biology. 13 (15), 1279-1289 (2003).
- Ulrich, F., et al. Slb/Wnt11 controls hypoblast cell migration and morphogenesis at the onset of zebrafish gastrulation. Development. 130 (22), 5375-5384 (2003).
- Kai, M., Heisenberg, C. -. P., Tada, M. Sphingosine-1-phosphate receptors regulate individual cell behaviours underlying the directed migration of prechordal plate progenitor cells during zebrafish gastrulation. Development. 135 (18), 3043-3051 (2008).
- Smutny, M., et al. Friction forces position the neural anlage. Nature Cell Biology. 19 (4), 306-317 (2017).
- Johansson, M., Giger, F. A., Fielding, T., Houart, C. Dkk1 controls cell-cell interaction through regulation of non-nuclear β-Catenin pools. Developmental Cell. 51 (6), 775-786 (2019).
- Gorelik, R., Gautreau, A. Quantitative and unbiased analysis of directional persistence in cell migration. Nature Protocols. 9 (8), 1931-1943 (2014).
- Grill, S. W., Howard, J., Schäffer, E., Stelzer, E. H. K., Hyman, A. A. The distribution of active force generators controls mitotic spindle position. Science. 301 (5632), 518-521 (2003).
- Desprat, N., Supatto, W., Pouille, P. -. A. A., Beaurepaire, E., Farge, E. Tissue deformation modulates twist expression to determine anterior midgut differentiation in Drosophila embryos. Developmental Cell. 15 (3), 470-477 (2008).
- Farhadifar, R., Röper, J. -. C., Aigouy, B., Eaton, S., Jülicher, F. The influence of cell mechanics, cell-cell interactions, and proliferation on epithelial packing. Current Biology. 17 (24), 2095-2104 (2007).
- Willier, B. H., Oppenheimer, J. M. . Foundations of Experimental Embryology. , (1964).
- Ashby, W. J., Zijlstra, A. Established and novel methods of interrogating two-dimensional cell migration. Integrative Biology: Quantitative Biosciences from Nano to Macro. 4 (11), 1338-1350 (2012).
- Bosze, B., et al. Pcdh18a regulates endocytosis of E-cadherin during axial mesoderm development in zebrafish. Histochemistry and Cell Biology. 154 (5), 463-480 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır