Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tüberküloz için Ev Sahibi Tarafından Yönlendirilen Tedavilerin Preklinik Testlerinde Kullanılmak Üzere Otomatik Bir Kültür Sistemi
Bu Makalede
Özet
Hücre içi M. tuberculosis büyümesinin hızlı ve etkili bir şekilde ölçülmesi, tüberküloza (TB) karşı gelişmiş tedavilerin sürdürülmesi için çok önemlidir. Bu protokol, aday konakçı tarafından yönlendirilen tedavilerle tedavi edilen makrofajlarda Mtb büyümesini ölçmek için otomatik bir sıvı kültür sistemi kullanan et suyu bazlı bir kolorimetrik tespit testini tanımlar.
Özet
Tüberkülozun (TB) etken maddesi olan Mycobacterium tuberculosis (Mtb), COVID-19'un ortaya çıkışına kadar dünya çapında en önemli bulaşıcı hastalık katiliydi. Mtb, hücre içi ortamında devam etmek, konakçı savunmasından kaçınmak ve birçok anti-tüberküler ilaca karşı direnç geliştirmek için evrimleşmiştir. Direnci çözmeye yönelik bir yaklaşım, Mtb'ye karşı konakçı bağışıklık tepkisini artıracak mevcut onaylanmış ilaçları tanımlamaktır. Bu ilaçlar daha sonra tedavi süresini kısaltmak ve antibiyotik direncinin üstesinden gelmeye yardımcı olmak için yardımcı konakçı yönelimli tedaviler (HDT) olarak yeniden kullanılabilir.
Makrofajlarda hücre içi Mtb büyümesinin ölçülmesi, potansiyel HDT'nin değerlendirilmesinde çok önemli bir husustur. Mtb büyümesini ölçmek için altın standart, agar plakaları üzerindeki koloni oluşturan birimleri (CFU) saymaktır. Bu, ilaçların hızlı bir şekilde taranmasına kendini ödünç vermeyen yavaş, emek yoğun bir tahlildir. Bu protokolde, klinik örneklerde Mtb'yi tespit etmek için daha yaygın olarak kullanılan otomatik, et suyu bazlı bir kültür sistemi, konakçıya yönelik tedavilerin klinik öncesi taraması için uyarlanmıştır. HDT ile tedavi edilen makrofajlarda sıvı kültür tahlil sisteminin hücre içi Mtb büyümesini araştırma kapasitesi değerlendirildi. Mtb büyümesini inhibe etme yetenekleri açısından test edilen HDT'ler, hem çözelti içinde hem de poli(laktik-ko-glikolik asit) (PLGA) mikropartiküllerinde ve interferon-gama ve linezolid kombinasyonunda kapsüllenmiş all-trans Retinoik asit (AtRA) idi. Bu otomatik sıvı kültür bazlı tekniğin CFU yöntemine göre avantajları, kurulumun basitliğini, daha az emek yoğun hazırlığı ve sonuçlara daha hızlı ulaşma süresini içerir (agar plakaları için 21 gün veya daha fazlasına kıyasla 5-12 gün).
Giriş
TB'nin etken maddesi olan Mycobacterium tuberculosis (Mtb), 2019 yılında dünya çapında en önemli bulaşıcı hastalık öldürücüolmuştur 1. Konakçı savunmasından kaçınmak için Mtb, makrofajlar ve dendritik hücreler (DC'ler) gibi doğuştan gelen bağışıklık hücrelerinin mikobakterisidal aktivitesini bozar ve hücre içinde devam etmesine ve2'yi çoğaltmasına izin verir. Erişkin akciğer tüberkülozunu önlemek için etkili bir aşının bulunmaması ve ilaca dirençli suşların giderek daha fazla ortaya çıkması, yeni tedavilere olan acil ihtiyacı vurgulamaktadır.
Yardımcı konak yönelimli tedaviler (HDT) tedavi süresini kısaltabilir ve direncin üstesinden gelmeye yardımcı olabilir3. Makrofajlar içindeki mikobakterisidal aktiviteyi belirlemek için HDT adaylarının in vitro preklinik değerlendirmesi, genellikle katı agar plakaları üzerinde koloni oluşturan birimler (CFU) tarafından Mtb büyümesinin miktarına dayanır. Bu, ilaçların hızlı bir şekilde taranmasına kendini ödünç vermeyen yavaş, emek yoğun bir tahlildir. Ticari olarak temin edilebilen otomatik, et suyu bazlı mikrobiyal tespit sistemleri, klinik mikrobiyoloji laboratuvarlarında, klinik örneklerde Mtb ve diğer mikobakteriyel türlerin tespiti ve ilaca duyarlılık testi için daha yaygın olarak kullanılmaktadır4. Bu araçlar, zamanla izlenen kültür ortamındaki fiziksel değişikliklere (CO2 veya O2 seviyelerindeki veya basıncındaki değişiklik) yol açan bakteriyel metabolik aktiviteye dayanarak dolaylı olarak büyümeyi ölçer5. Okuma, daha önce 6,7 tedavisine yanıt olarak TB hastalarının balgam örneklerinde ve enfekte murin akciğer ve dalak8 lizatlarında Mtb CFU ile ilişkili olduğu gösterilen pozitiflik zamanıdır (TPP). Ek olarak, geleneksel patojene yönelik tedavilerin aksenik kültürde ve kültürlenmiş makrofajlarda mikobakterilerin büyümesi üzerindeki etkisini ölçmek için sıvı kültür tespit sistemleri kullanılmıştır 9,10. Cihaz ayrıca dendritik hücrelerin ve alveolar makrofajların Mtb 11,12'nin hücre içi büyümesini kontrol etme konusundaki doğuştan gelen yeteneğini araştırmak için kullanılmıştır. Bu deneysel protokol, kültürlü makrofajlarda TB için HDT'nin klinik öncesi taramasını gerçekleştirmek için bir sıvı kültür tanı sisteminin uyarlanabileceğini göstermektedir. CFU sayımı ile karşılaştırıldığında, bu tekniğin temel avantajı, hücre içi mikobakteriyel büyümeyi / sağkalımı ölçmek için gereken deneysel emeği ve zamanı önemli ölçüde azaltmasıdır. Bu teknik, konakçı bağışıklığını artırmak için hücresel fonksiyonları hedefleyen çok çeşitli farmakolojik reaktiflerle tedavi edilen bağışıklık hücrelerinde hücre içi mikobakteriyel sağkalımı değerlendirmek için kullanılabilecek otomatik bir kültür cihazına erişime dayanır.
Access restricted. Please log in or start a trial to view this content.
Protokol
Bu protokolde özetlenen deneyler, bir Muhafaza Seviyesi 2 laboratuvarında ele alınabilen Mtb'nin zayıflatılmış H37Ra suşu kullanılarak gerçekleştirilmiştir. Canlı mikobakterilerin tüm manipülasyonları Sınıf II biyolojik güvenlik kabininde (BSC) gerçekleştirildi. Aerosol oluşumunu en aza indirmek için deneysel prosedürler tasarlanmıştır. Ökaryotik hücre kültürü (THP-1 hücreleri) de Sınıf II BSC'de gerçekleştirildi. Laboratuvar, bir risk değerlendirmesi gerçekleştirmiş ve tüm prosedürlerin kurumsal ve ulusal biyolojik güvenlik düzenlemelerine uygun olarak yürütülmesini sağlamıştır. Yöntemi tarif edildiği gibi gerçekleştirmek için insan monositik THP-1 hücre hattı kullanıldı (adım 1). Hücreler, mikobakterilerle enfeksiyondan önce forbol 12-miristat 13-asetat (PMA) ile uyarıldıktan sonra makrofajlara farklılaşır.
1. Hücre kültürü
- H37Ra tohum stoğunu, albümin-dekstroz-katalaz (ADC) zenginleştirme (% 10) ve% 0.05 polisorbat 80 ile desteklenmiş Middlebrook 7H9 (MB) suyunda log fazına yayınlayın. H37Ra stoğunu 1 mL alikotta -80 °C dondurucuda 1 yıla kadar saklayın.
- 1 mL'lik bir Mtb-H37Ra şişesini çözün ve planlanan deneyden yaklaşık 1 hafta önce 9 mL MB takviyeli et suyu içeren bir filtre kapağına sahip bir T25 şişesine aktarın. Statik bir inkübatörde 5-7 gün boyunca 37 ° C'de inkübe edin.
- RPMI-1640'taki THP-1 hücrelerini, CO 2 nemlendirilmiş bir inkübatörde% 5 CO2/37 ° C'de bir T75 şişesinde ısı öldürmemiş% 10 fetal buzağı serumu (tam (c) RPMI) ile desteklenmiş olarak büyütün ve 1 x 106 hücre / mL'den daha az bir yoğunluğu korumak için haftada iki kez alt kültür yapın.
- THP-1 hücrelerini, enfeksiyondan 3 gün önce, herhangi bir kümeyi dağıtmak ve 50 mL'lik bir konik tüpe yerleştirmek için T75 şişelerinde serolojik bir pipet kullanarak hücreleri birkaç kez hafifçe pipetleyerek makrofajlara ayırt edin.
- Oda sıcaklığında 10 dakika boyunca 300 x g'de hücreleri santrifüj yapın, süpernatan boşaltın ve peleti 2 mL RPMI'de yavaşça askıya alın. Hücreleri/mL'yi tahmin etmek için hücre sayımı gerçekleştirin.
- 12 kuyucuklu doku kültürü plakalarında 2 mL THP-1 makrofajları, 72 saat boyunca 100 ng / mL PMA ile cRPMI'de 100.000 hücre / mL yoğunlukta tohumlayın. PMA içeren ortamı hücrelerden çıkarın ve Mtb enfeksiyonundan önce taze cRPMI ile doldurun.
- Gerekli her zaman noktası için ayrı ayrı plakalar ayarlayın.
- 2 delikli cam haznede aynı yoğunluktaki (100.000 hücre/mL) tohum hücreleri, enfeksiyon çokluğunu (MOI) belirlemek için kayar.
- 37 °C'de 3 gün boyunca% 5 CO2 nemlendirilmiş inkübatöre yerleştirin.
2. Mtb alımının nicelleştirilmesi
- Makrofajlar (MOI) ile Mtb alımının belirlenmesi
- Enfeksiyon gününde Sınıf II biyolojik güvenlik kabinini (BSC) kurun ve dökülmeleri yakalamak için iki kat kağıt mendil üzerinde çalışın. Atık atma konteynerlerini yerel yönetmeliklere göre ayarlayın.
- T25 şişesinden 6-8 mL mikobakteriyel kültürü çıkarın ve 15 mL'lik bir polipropilen tüpe aktarın.
NOT: Daha küçük hacimli tüpler daha küçük deneyler için kullanılabilir. - Tüpü oda sıcaklığında bir tezgah üstü santrifüjde 2890 x g'de 10 dakika boyunca santrifüj yapın.
- Tüpü dikkatlice santrifüjden çıkarın ve biyolojik güvenlik kabinine aktarın. Bakterilerin yerleşmesine izin vermek için 1 dakika bekleyin.
- Süpernatantı dezenfektan atma kabına dökün, tüpü yeniden doldurun ve tüpün yan tarafına dokunarak kalan ortamdaki bakterileri yeniden askıya alın. Bakterilerin yerleşmesine izin vermek için 1 dakika bekleyin.
- 2 mL önceden ısıtılmış cRPMI ekleyin, hafifçe karıştırın ve 50 mL'lik bir konik tüpe aktarın.
- Mikobakterileri 25 G iğne ve 5 mL şırınga kullanarak çok dikkatli bir şekilde askıya alın. Yeniden askıya almak için, mikobakteri süspansiyonunu şırıngaya çekin ve aerosol üretimini en aza indirmek için tüpün yan duvarından çok nazikçe dışarı atın. 6-8 kez tekrarlayın.
NOT: Bu, yüksek yoğunluklu bir mikobakteri kültürü olduğu için çok dikkatli olun. İğne çubuğu yaralanması riskini önlemek için, mümkün olduğunca künt iğneler kullanın ve Luer kilit şırıngaları kullanın. - İğneyi ve şırıngayı BSC'deki keskin bir kaba atın.
- Süspansiyonu 2 mL'lik bir mikrofüj tüpüne (vidalı kapaklı) aktarın ve kalan kümeleri peletlemek için oda sıcaklığında 100 x g'de 3 dakika boyunca santrifüj yapın. Tüpü güvenlik kabinine geri koyun ve bakterilerin yerleşmesine izin vermek için 1 dakika bekleyin.
- Süpernatantın üst 1-1,5 mL'sini yeni bir tüpe aktarın. Orijinal tüpü dezenfektan içeren atık kovasına atın. İyice karıştırın ve 2 delikli cam hazne kızaklarına çeşitli miktarlarda mikobakteriyel süspansiyon (örneğin, 5, 25, 50, 150 μL) ekleyin ve 37 ° C'de bir CO2 inkübatöründe 3 saat boyunca inkübe edin.
- Asit hızlı bakteriler için boyama (AFB)
NOT: 3 saatlik inkübasyondan sonra, makrofajlar yıkanır ve mikobakterileri inaktive etmek için paraformaldehit ile sabitlenir. Slaytlar daha sonra hücre başına fagositozlu mikobakterileri tahmin etmek için Modifiye Auramin O kiti (Malzeme Tablosuna bakınız) kullanılarak boyanır. Balmumu hücre duvarları nedeniyle, mikobakteriler asit-alkol yıkamadan sonra Auramin boyasını tutarlar. Makrofaj çekirdekleri daha sonra Hoechst ile karşı boyanır. Bu yöntem, hücre başına fagositozlu bakteri sayısının sayılmasına izin verir ve makrofajların enfeksiyon çokluğunu (MOI) belirlemek için kullanılır.- Fagositonize edilmemiş bakterileri yerinden çıkarmak için üç kez yukarı ve aşağı pipetleme yaptıktan sonra ortamı cam hazneli slayttan çıkarın.
- 2 mL oda sıcaklığında PBS ile bir kez yıkayın.
- PBS'de -20 ° C'de alikotlarda 6 aya kadar çözünen% 4 paraformaldehit stoklarını saklayın. Kullanımdan hemen önce% 4'lük bir paraformaldehit aliquot'u çözün. PBS ile% 2'ye kadar paraformaldehit seyreltin ve kuyucuk başına 2 mL ekleyin.
- Oda sıcaklığında 10 dakika kuluçkaya yatırın. Cam hazne sürgüsü, boyama için bu aşamada güvenlik kabininden çıkarılabilir.
- Kaydırağı yumuşak bir musluk suyu akışı altında yıkayın.
- Plastik bir transfer pipeti kullanarak hücreleri örtmek için slaytın üzerine yeterince Auramin dağıtın ve karanlıkta oda sıcaklığında 1 dakika kuluçkaya yatın (alüminyum folyo ile örtün).
- Fazla boyayı musluk suyuyla kaydıraktan yıkayın ve karanlıkta 1 dakika boyunca renk gidericiyi / söndürücüyü ekleyin.
- Fazlalığı musluk suyuyla yıkayın ve karanlıkta Hoechst 33342 (PBS'de 10 μg / mL) ile oda sıcaklığında 15 dakika boyunca inkübe edin.
- Hoechst lekesini musluk suyuyla yıkayın, odaları çıkarın, slayttaki fazla suyu boşaltın, bir damla antifade ve örtü kayması ekleyin ve hava kurutun.
- 100x yağ hedefini kullanarak floresan mikroskop altındaki slaytı inceleyin. Mikobakteriler FITC filtresinin altında yeşil floresan yapar. Çekirdekler DAPI filtresinin altında mavi floresan yapar (Şekil 1C).
- MOI'yi, hücre başına fagositozlu mikobakteri sayısını ve enfekte olmuş hücrelerin yüzdesini sayarak belirleyin.
- Plakadaki bir kuyunun yüzey alanına bağlı olarak gerekli MOI'yi elde etmek için gereken mikobakteriyel süspansiyonun hacmini hesaplayın; örneğin bu deneyde kullanılan cam hazneli kızakların yüzey alanı 4cm2'dir. Düşük MOI (yaklaşık 1-2 basil / hücre), birkaç gün boyunca (örneğin, 5 gün) yapılan deneyler için arzu edilir.
- Makrofajların enfeksiyonu
- Mikobakteri süspansiyonunu iyice karıştırın ve istenen MOI'yi elde etmek için gereken hacim belirlendikten sonra 12 delikli plakalardaki hücrelere gereken miktarı ekleyin.
- Mikobakterilerin fagositonize edilmesine izin vermek için 3 saat boyunca 37 ° C'de inkübe edin.
- Kuyucukları birkaç kez ılık RPMI veya HBSS ile yıkayarak hücre dışı bakterileri çıkarın.
- Aşağıdaki adım 3'te belirtildiği gibi ilk inokulumun (3 saatlik örnek) pozitiflik yüzdesini (TTP) belirlemek için makrofajları bir kuyucukta (3 saatlik örnek) lize edin.
- Kalan kuyucuklara taze cRPMI ve gerekli ilaç dozlarını veya araç kontrolünü ekleyin, plakaları CO2 inkübatöründe gerekli süre boyunca 37 ° C'de inkübe edin (deneysel tasarıma bağlı olarak, ancak genellikle 1 ila 8 gün arasında birkaç aralıkta).
3. Sıvı kültür algılama sistemi için numune toplama
NOT: Enfeksiyon gününde, hücre dışı mikobakteriler yıkanarak uzaklaştırılır ve hücre içi mikobakteriler, enfeksiyon için temel kontrol olarak fagositozlanan başlangıç miktarını belirlemek için bir kutucuk makrofajın (3 saatlik örnek) lizisi ile toplanır. Daha sonraki zamanlarda, toplam mikobakteriyel büyümeyi ölçmek için hem ortam, hem hücre lizatı hem de yıkamalar birleştirilir. İstenirse hücre dışı ve hücre içi büyüme de ayrı ayrı değerlendirilebilir.
- TTP'yi belirlemek için 3 saatlik numunenin toplanması
- Hücre dışı mikobakterileri, adım 2.3.3'te belirtildiği gibi enfeksiyonun ilk 3 saatinden sonra tüm kuyucuklardan yıkayın. Lisat hacmini daha sonraki zaman noktalarınınkilerle eşitlemek için 3 saatlik kontrol kuyusuna 1 mL taze ortam ekleyin.
NOT: Hücre dışı mikobakteriler analizin dışında tutulacaksa adım 3.2.7'ye bakın.
- Hücre dışı mikobakterileri, adım 2.3.3'te belirtildiği gibi enfeksiyonun ilk 3 saatinden sonra tüm kuyucuklardan yıkayın. Lisat hacmini daha sonraki zaman noktalarınınkilerle eşitlemek için 3 saatlik kontrol kuyusuna 1 mL taze ortam ekleyin.
- Örnek toplama
- Oda sıcaklığına getirmek için sıcak MB et suyu ve enstrüman kültürü şişeleri.
- Ortamı 12 delikli plakadan karşılık gelen etiketli konik tüplere aktarın.
- Her bir kuyucuğa 10 dakika boyunca 500 μL steril lizis tamponu (steril 0,2 μm filtreden filtrelenmiş PBS'de %0,1 Triton x-100) ekleyin.
- Hücreleri steril bir kazıyıcı ile kuyudan yavaşça kazıyın ve uygun konik tüpte ortamla birleştirin.
- Kuyuyu 0,5 mL steril PBS ile yıkayın ve uygun tüpe aktarın.
- Kümeleri parçalamak için her numuneyi bir iğne ve şırıngadan (25 G) 6-8 kez yavaşça geçirin. MB et suyunda örnekleri 1:10 oranında seyreltin; 100 μL numune + 900 μL MB ortam.
- Gerekli zamanlarda / günlerde (genellikle 1 ila 8 gün arasında), yukarıdaki 3.2.1-3.2.6 adımlarını izleyerek kalan numuneleri hasat edin.
NOT: Araştırmacılar, hücre dışı mikobakterileri analizlerinden hariç tutmayı tercih edebilirler, bu durumda, yukarıdaki 3.2.2 adımında, her bir kuyucuktan ortam atılır ve makrofajlar lizis tamponu eklenmeden önce birkaç kez yıkanır.
- Alet kültürü şişelerinin aşılanması ve yüklenmesi
NOT: Sıvı kültür cihazının ve ilgili sarf malzemelerinin ayrıntıları Malzeme Tablosunda verilmiştir.- Alet kültürü şişesinin kauçuk kapağını% 70 alkole batırılmış kağıt mendille sterilize edin ve havanın kurumasını bekleyin.
NOT: Bu adımın BSC'de gerçekleştirilmesi gerekir. - Tüm numuneler için yeterli besin takviyesini konik bir tüpe (0,5 mL / şişe) aktararak şişeleri hazırlayın. Alet kültürü şişesine 0,5 mL Besin takviyesi enjekte etmek için bir iğne ve şırınga kullanın.
- Seyreltilmiş numunenin 500 μL'sini (1:10) 1 mL V tabanlı bir tüpe pipetleyin.
- 500 μL numuneyi atanan cihaz kültürü şişesine enjekte etmek için bir iğne ve şırınga kullanın.
- Alet kültürü şişesinin kauçuk kapağını% 70 alkole batırılmış kağıt mendille sterilize edin ve havanın kurumasını bekleyin. BSC'den çıkarmadan önce şişeleri% 70 alkole batırılmış kağıt mendille silin.
- Şişeleri biyogüvenlik kabininden yükleme cihazına dikkatlice taşıyın.
- Otomatik mikrobiyal algılama sistemindeki yükleme düğmesine basın.
- Enstrüman kültürü şişelerindeki barkodları tarayın ve şişeleri 42 güne kadar 37 ° C'de algılama sistemi inkübatörüne yerleştirin. Cihaz ekranından pozitifliğe ulaşmak için geçen süreyi okuyun ve kaydedin.
NOT: Barkod, cihazın şişeyi tanımlamasına ve yansıtma okumalarını belirli bir şişeye bağlamasına olanak tanır. - İlk hücre içi inokulumun (Gün 0) TTP'sini, belirtilen zamanlar için kültürlenmiş makrofajlarınkiyle karşılaştırarak pozitifliğe (TTP) kadar geçen yüzde süreyi hesaplayın. TTP yüzdesinde pozitif bir değişiklik, mikobakteriyel büyüme anlamına gelir13.
Örneğin, 3. gün için:
Pozitifliğe zaman içindeki yüzde değişim =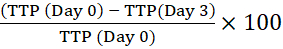
- Alet kültürü şişesinin kauçuk kapağını% 70 alkole batırılmış kağıt mendille sterilize edin ve havanın kurumasını bekleyin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bu çalışmada kullanılan otomatik sıvı kültür cihazı, her 10 dakikada bir CO2 seviyelerini izler. Cihaz şişesinin altındaki sensördeki renk değişikliği kolorimetrik olarak ölçülür ve yansıtma birimleri olarak ifade edilir. Cihaz yazılımı daha sonra pozitifliğe kadar geçen süreyi (TTP), yani aşılamadan kültürlerin pozitif olarak işaretlenmesine kadar geçen gün sayısını hesaplamak için algılama algoritmaları uygular (Şekil 1A). Başlangıç in...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Yazarlar, monosit kaynaklı makrofajlarda ve alveoler makrofajlarda vePMA 11,16,17 ile farklılaşmış THP-1 hücrelerinde Mtb büyümesini izlemek için bu protokolde açıklanan sıvı kültür yöntemini kullanmışlardır. Bu teknik, yapışkan olmayan hücrelerle kullanım için de değiştirilebilir12. Daha yakın zamanlarda, cihaz ayrıca inhale all-trans retinoik asidi (AtRA) TB...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma İrlanda Bilim Vakfı (SFI 08 / RFP / BMT1689), İrlanda'daki Sağlık Araştırma Kurulu [HRA-POR / 2012/4 ve HRA-POR-2015-1145] ve Dublin Kraliyet Şehri Hastanesi Vakfı tarafından finanse edilmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| IX51 Fluorescent Microscope | Olympus, Japan | N/A | AFB detection and imaging |
| 2 mL microtube, flat bottom, screw cap, sterile | Sarstedt, North Carolina, USA | 72.694.006 | Mtb infection of macropahges |
| 5 mL syringe, Luer lock | BD Biosciences, San Jose, CA, USA | SZR-150-031K | Mtb infection of macropahges/CFU |
| 50 mL tube, sterile | Sarstedt, North Carolina, USA | 62.547.254 | Mtb infection of macropahges |
| all-trans-Retinoic Acid (ATRA) ≥98% (HPLC) | Sigma Aldrich, Missouri, USA | R2625 | Host directed therapy candidate |
| BacT/ALERT 3D Microbial Detection System | Biomerieux ( Hampshire, UK) | 247001 | Broth-based colormetric detection system |
| BACT/ALERT MP BACT/ALERT MP Nutrient Supplement | Biomerieux ( Hampshire, UK) | 414997 | Broth-based colormetric detection assay |
| BACT/ALERT MP culture bottles | Biomerieux ( Hampshire, UK) | 419744 | Broth-based colormetric detection assay |
| BD BBL Middlebrook ADC Enrichment, 20 mL | BD Biosciences, San Jose, CA, USA | M0553 | Mycobacterium liquid culture |
| BD BBL Middlebrook OADC Enrichment, 20mL | BD Biosciences, San Jose, CA, USA | M0678 | Colony Forming Units |
| Cell scraper, 25 cm | Sarstedt, North Carolina, USA | 83.1830 | Harvest of lmacrophage lysates |
| Corning Syringe Filter, 0.2 µm | Corning Incorporated, Germany | 431219 | Sterilization of lysis buffer |
| Cover glass (borosilicate), 24 x 50 mm, #1.5 thickness | VWR International Limited | 631 - 0147 | |
| Cycloheximide, from microbial | Sigma Aldrich, Missouri, USA | C7698 | Colony Forming Units |
| Dako Fluorescent Mounting Medium | Agilent Technologies Ireland Limited | S3023 | Antifade mounting medium |
| Dulbecco’s Phosphate Buffered Saline | Sigma Aldrich, Missouri, USA | D8537 | Mtb infection of macropahges |
| Fetal Bovine Serum, Gibco | Thermo Fisher, Massachusetts, USA | 10270106 | Macrophage cell culture |
| Glycerol, Difco | BD Biosciences, San Jose, CA, USA | 228220 | Colony Forming Units |
| Hoescht 33342 (bisBenzimide H 33342 trihydrochloride) | Sigma Aldrich, Missouri, USA | B2261 | Nuclear stain |
| IFNγ, recombinant human | R&D Systems Inc, Minnesota, USA | 285-IF | Host directed therapy candidate |
| Labtek 2-well chamber slide, sterile, Nunc | Thermo Fisher, Massachusetts, USA | TKT-210-150R | Mtb infection of macropahges |
| L-Asparagine, anhydrous | Sigma Aldrich, Missouri, USA | A4159 | Colony Forming Units |
| Linezolid | Sigma Aldrich, Missouri, USA | PZ0014 | Antibiotic |
| Microlance Hypodermic Needle 25 G | BD Biosciences, San Jose, CA, USA | 300400 | Mtb infection of macropahges/CFU |
| Middlebrook 7H10 Agar Base | BD Biosciences, San Jose, CA, USA | M0303 | Colony Forming Units |
| Middlebrook 7H9 Broth Base | BD Biosciences, San Jose, CA, USA | M0178 | Mycobacterium liquid culture |
| Modified Auramine O Stain and Decolourizer | Scientific Device Laboratory, IL, USA | 345-250 | AFB stain |
| Paraformaldehyde | Sigma Aldrich, Missouri, USA | 158127 | Mtb infection of macropahges |
| Petri dishes, 92 x 16mm (20/bag) | Sarstedt, North Carolina, USA | 82.1473.001 | Colony Forming Units |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich, Missouri, USA | P8139 | Macrophage cell culture |
| Polysorbate 80, Difco | BD Biosciences, San Jose, CA, USA | 231181 | Mycobacterium liquid culture |
| RPMI-1640, Gibco | Thermo Fisher, Massachusetts, USA | 52400025 | Macrophage cell culture |
| Sterile Cell Spreader, L-Shaped | Fisherbrand, Thermo Fisher, MA, USA | RB-44103 | Colony Forming Units |
| T25 TC flask, angled neck, filter cap, sterile, Nunc | Thermo Fisher, Massachusetts, USA | 156367 | Mycobacterium liquid culture |
| THP-1 cell line | ATCC, Virginia, USA | ATCC TIB-202 | Macrophage cell culture |
Referanslar
- WHO. Global Tuberculosis Report. World Health Organization. , Geneva. (2020).
- Russell, D. G. Mycobacterium tuberculosis and the intimate discourse of a chronic infection. Immunological Reviews. 240 (1), 252-268 (2011).
- Young, C., Walzl, G., Du Plessis, N. Therapeutic host-directed strategies to improve outcome in tuberculosis. Mucosal Immunology. 13 (2), 190-204 (2020).
- Angeby, K. A., et al. Evaluation of the BacT/ALERT 3D system for recovery and drug susceptibility testing of Mycobacterium tuberculosis. Clinical Microbiology and Infection. 9 (11), 1148-1152 (2003).
- Asmar, S., Drancourt, M. Rapid culture-based diagnosis of pulmonary tuberculosis in developed and developing countries. Frontiers in Microbiology. 6, 1184(2015).
- Diacon, A. H., et al. Time to liquid culture positivity can substitute for colony counting on agar plates in early bactericidal activity studies of antituberculosis agents. Clinical Microbiology and Infection. 18 (7), 711-717 (2012).
- Diacon, A. H., et al. Time to positivity in liquid culture predicts colony forming unit counts of Mycobacterium tuberculosis in sputum specimens. Tuberculosis. 94 (2), Edinburgh. 148-151 (2014).
- O'Sullivan, D. M., et al. Evaluation of liquid culture for quantitation of Mycobacterium tuberculosis in murine models. Vaccine. 25 (49), 8203-8205 (2007).
- Heinrichs, M., et al. Mycobacterium tuberculosis Strains H37ra and H37rv have equivalent minimum inhibitory concentrations to most antituberculosis drugs. International Journal of Mycobacteriology. 7 (2), 156-161 (2018).
- Sorrentino, F., et al. Development of an intracellular screen for new compounds able to inhibit mycobacterium tuberculosis growth in human macrophages. Antimicrobial Agents and Chemotherapy. 60 (1), 640-645 (2016).
- O'Leary, S. M., et al. Cigarette smoking impairs human pulmonary immunity to Mycobacterium tuberculosis. American Journal of Respiratory and Critical Care Medicine. 190 (12), 1430-1436 (2014).
- Ryan, R. C., O'Sullivan, M. P., Keane, J. Mycobacterium tuberculosis infection induces non-apoptotic cell death of human dendritic cells. BMC Microbiology. 11, 237(2011).
- Keane, J., Remold, H. G., Kornfeld, H. Virulent mycobacterium tuberculosis strains evade apoptosis of infected alveolar macrophages. The Journal of Immunology. 164 (4), 2016-2020 (2000).
- Gao, X. F., Yang, Z. W., Li, J. Adjunctive therapy with interferon-gamma for the treatment of pulmonary tuberculosis: a systematic review. International Journal of Infectious Diseases. 15 (9), 594-600 (2011).
- Thorpe, T. C., et al. BacT/Alert: an automated colorimetric microbial detection system. Journal of Clinical Microbiology. 28 (7), 1608-1612 (1990).
- Gleeson, L. E., et al. Cutting edge: Mycobacterium tuberculosis induces aerobic glycolysis in human alveolar macrophages that is required for control of intracellular bacillary replication. The Journal of Immunology. 196 (6), 2444-2449 (2016).
- O'Connor, G., et al. Inhalable poly(lactic-co-glycolic acid) (PLGA) microparticles encapsulating all-trans-Retinoic acid (ATRA) as a host-directed, adjunctive treatment for Mycobacterium tuberculosis infection. European Journal of Pharmaceutics and Biopharmaceutics. 134, 153-165 (2019).
- O'Connor, G., et al. Sharpening nature's tools for efficient tuberculosis control: A review of the potential role and development of host-directed therapies and strategies for targeted respiratory delivery. Advanced Drug Delivery Reviews. 102, 33-54 (2016).
- Rodriguez, D. C., Ocampo, M., Salazar, L. M., Patarroyo, M. A. Quantifying intracellular Mycobacterium tuberculosis: An essential issue for in vitro assays. Microbiologyopen. 7 (2), 00588(2018).
- Ortalo-Magne, A., et al. Molecular composition of the outermost capsular material of the tubercle bacillus. Microbiology. 141, Reading. Pt 7 1609-1620 (1995).
- Stokes, R. W., et al. The glycan-rich outer layer of the cell wall of Mycobacterium tuberculosis acts as an antiphagocytic capsule limiting the association of the bacterium with macrophages. Infection and Immunity. 72 (10), 5676-5686 (2004).
- O'Sullivan, M. P., O'Leary, S., Kelly, D. M., Keane, J. A caspase-independent pathway mediates macrophage cell death in response to Mycobacterium tuberculosis infection. Infection and Immunity. 75 (4), 1984-1993 (2007).
- Cheon, S. H., et al. Bactericidal activity in whole blood as a potential surrogate marker of immunity after vaccination against tuberculosis. Clinical and Diagnostic Laboratory Immunology. 9 (4), 901-907 (2002).
- Nathan, C., Barry, C. E. TB drug development: immunology at the table. Immunological Reviews. 264 (1), 308-318 (2015).
- Bowness, R., et al. The relationship between Mycobacterium tuberculosis MGIT time to positivity and cfu in sputum samples demonstrates changing bacterial phenotypes potentially reflecting the impact of chemotherapy on critical sub-populations. Journal of Antimicrobial Chemotherapy. 70 (2), 448-455 (2015).
- Basu Roy, R., et al. An auto-luminescent fluorescent BCG whole blood assay to enable evaluation of paediatric mycobacterial responses using minimal blood volumes. Frontiers in Pediatrics. 7, 151(2019).
- Christophe, T., et al. High content screening identifies decaprenyl-phosphoribose 2' epimerase as a target for intracellular antimycobacterial inhibitors. PLoS Pathogens. 5 (10), 1000645(2009).
- Franzblau, S. G., et al. Comprehensive analysis of methods used for the evaluation of compounds against Mycobacterium tuberculosis. Tuberculosis. 92 (6), Edinburgh. 453-488 (2012).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır