Method Article
Sıvı Kromatografisi, Lysate Tabanlı Hücre içermeyen Sistemlerde Metabolit Profilleme için Kırılma İndeksi veya Kütle Spektrometrik Algılaması ile Birleştirilmiştir
Bu Makalede
Özet
Protokoller, karmaşık lisat bazlı hücre içermeyen sistemlerde metabolik reaksiyonları incelemek için kırma indeksi veya kütle spektrometrik tespiti ile birleştiğinde yüksek performanslı sıvı kromatografi yöntemlerini açıklar.
Özet
Hedeflenen biyosentez için mühendislik hücresel metabolizması, mühendis hücrenin hayatta kalma gereksinimleri etrafında çalıştığından kapsamlı tasarım-yap-test-öğrenme (DBTL) döngüleri gerektirebilir. Alternatif olarak, hücresiz ortamlarda DBTL döngüleri gerçekleştirmek bu süreci hızlandırabilir ve ana bilgisayar uyumluluğu ile ilgili endişeleri hafifletebilir. Hücresiz metabolik mühendislik (CFME) için umut verici bir yaklaşım, metabolik olarak aktif ham hücre özlerini biyo-üretim ve modifiye proteinleri ve yolları hızla keşfetmek ve prototipleme için platformlar olarak kullanmaktadır. Bu yetenekleri gerçekleştirmek ve CFME performansını optimize etmek, lysate tabanlı hücresiz platformların metabolomlarını karakterize etmek için yöntemler gerektirir. Yani, analitik araçlar hedeflenen metabolit dönüşümlerindeki iyileştirmeleri izlemek ve lysate metabolizmasını manipüle ederken akı metabolit için değişiklikleri emmek için gereklidir. Burada, E. coli S30 lisatlarında metabolit üretimini ve akısını karakterize etmek için optik veya kütle spektrometrik tespiti ile birlikte yüksek performanslı sıvı kromatografisi (HPLC) kullanılarak metabolit analizleri uygulandı. Özellikle, bu rapor, düşük maliyetli substratların (yani glikozun) çeşitli yüksek değerli ürünlere dönüştürülmesinde merkezi metabolik ara ve yan ürünlerin neslini ölçmek için kırma indeks tespiti (RID) kullanılarak HPLC analizleri için CFME lysates'ten örneklerin hazırlanmasını açıklar. Cfme reaksiyonlarında metabolit dönüşümünün analizi, 13C etiketli glikoz ile ters fazlı sıvı kromatografisi ile birlikte, spesifik metabolit verimlerini ve başlangıç malzemelerinden gelen lysate metabolik akıyı karakterize etmek için güçlü bir araç olan tandem kütle spektrometresine (MS / MS) bağlı olarak sunulmaktadır. Tamamen, bu analitik yöntemleri CFME lysate metabolizmasına uygulamak, bu sistemlerin daha hızlı veya yeni metabolik mühendislik görevlerini yürütmek için alternatif platformlar olarak ilerlemesini sağlar.
Giriş
Kimyasal üretim için mühendislik mikroplarındaki sınırlamalar, rakip hücresel sağkalım fonksiyonlarının bulunmadığı in vitro biyokimyasal reaksiyonların yeniden kapsüllenerek ele alınabilir1. Ayrıca, açık reaksiyon ortamı (yani hücre zarının yokluğu) manipülasyona daha elverişlidir ve canlı hücrelere kıyasla izlenmesi daha kolaydır. Hücresiz metabolik mühendisliğin (CFME) bu temel kavramı, hidrojen ve monoterpenler gibi değerli kimyasalları şimdiye kadar mikrobiyal hücre fabrikalarında sunulandan daha yüksek büyüklükteki üretim metrikleriyle sentezlemek için metabolik yolların yeniden uzlaştırılmasıyla zarif bir şekilde gösterilmiştir. . Bununla birlikte, tüm yolları arındırma yöntemleri şu anda zaman ve maliyetle kısıtlanmıştır. Alternatif olarak, hücresiz metabolik sistemler, tüm yol rekonsitasyonuna göre hızlı ve ucuz yöntemlerle ham hücre özlerinden türetilebilir4. Hücre özlerinde tutulan merkezi metabolizma, 24 saat5,6üzerinde merkezi metabolik öncüller oluşturmak için tamponlanmış çözeltilerde enerji substratları (örneğin, glikoz ve enzimatik kofaktörler) ve tuzlarla desteklenebilir. Lysate bazlı CFME reaksiyonuna eksojen enzimler eklemek, glikozun yüksek titrelerde daha değerli kimyasallara daha karmaşık biyo-dönüşümlerini sağlar4,6,7. Hücre benzeri metabolik karmaşıklıkları nedeniyle bu sistemlerde verim tehlikeye girme eğiliminde olsa da, daha yüksek verim dönüşümü için lisat proteomları küratörlüğünü yapmak için benzersiz yöntemler geliştirilmiştir ve geliştirilmektedir7,8.
Lisat bazlı hücre içermeyen sistemlerde metabolik dönüşümleri gerçekleştirme kolaylığı, kimyasal üretimi hücre dışına tamamen taşımak veya bu tasarımları vivo2,9'da oluşturmadan ve test etmeden önce yüksek verime sahip yeni yolları prototipleme için bu mükemmel platformları yapar. Her iki uygulama için de metabolik dönüşümleri izlemek veya lysates metabolik akı genel değişiklikleri gözlemlemek için araçlar CFME ilerlemesinin ayrılmaz bir parçası. Yüksek performanslı sıvı kromatografisi (HPLC), CFME reaksiyonlarının kimyasal bileşenlerini yüksek çözünürlükle ayırmak için kullanılabilir ve metabolit niceleme5,10için optik veya kütle spektrometrik dedektörleriyle bire bir olabilir. HPLC'nin temel prensibi, bir çözücüde çözünen (yani mobil faz) ve bir sütundan pompalanan analizlerin belirli sütun paketleme malzemesi (yani sabit faz)11ile etkileşime girmesidir. Kimyasal özelliklerine bağlı olarak, bu analitler sonunda sabit fazdan elde tutulmadan ve mobil faz tarafından bir dedektöre taşınmadan önce değişen tutma süreleri gösterir. Bu rapor, RID ve MS/MS algılamasından yararlanan HPLC tabanlı yöntemlerle E. coli lysate tabanlı CFME reaksiyonlarının hazırlanmasını ve analizini detaylandırmamaktadır.
HPLC, kırılma indisi algılaması (HPLC-RID) ile birleştiğinde, merkezi metabolik öncülleri ve son ürünleri hızlı bir şekilde tanımlamak için genel olarak erişilebilir bir yöntemdir. Kısaca, RID, analizlerin mobil faz12ile ışığın saptırılmasını nasıl değiştirdiğini ölçer. Numunelerdeki hedef analizlere karşılık gelen RID sinyalleri daha sonra standart çözümlerin RID sinyalleri ile karşılaştırmalarla ölçülebilir. CFME uygulamalarında, bu algılama modu en yaygın olarak boyut dışlama ve ligand değişim mekanizmalarının bir kombinasyonuna veya iyon moderatörlü bölüm kromatografisi 5 ,6,8,13'e göre bileşikleri ayıran HPLC sütunlarında kullanılmıştır. Bu özel teknik, glisat bazlı CFME reaksiyonlarında süksinit, laktat, format, asetat ve etanol gibi fermantasyon ürünlerinin oluşumunun yanı sıra glikoz gibi şeker substratlarının tüketimini hızlı bir şekilde ölçmek için kullanılır8. Bu bileşiklerin konsantrasyon değişikliklerini HPLC aracılığıyla kaydetmek, hem ham hücre özlerinin merkezi metabolik öncülleri havuza alma potansiyelinin aydınlatıcı olması hem de lysates6,8,14'tekiglikozdan karmaşık metabolik dönüşümler sırasında yol akısının fermentatif yollardan nasıl yönlendirildiğini anlamak için yararlı olmuştur. E. coli hücre özlerinde seminal CFME çalışmaları, fermantasyon bileşiklerinin glikoz katabolizminin son ürünleri olarak biriktiğini ve ayrıca eksojen enzimleri aşırı ifade eden lysates'te istenmeyen yan ürünler olarak ortaya çıktığını doğrulamaz6,15. Glikolitik reaksiyonları sürdürmek için kofaktörlerin (nad(P)H ve ATP) redoks eşdeğerlerinin yenilenmesinde fermentatif metabolizmanın gerekli bir rol oynadığı ileri sürülmektedir8. Bu nedenle, fermantasyon ürünlerini ayırmak için tasarlanmış HPLC tabanlı bir optik algılama yöntemi, çeşitli lisat tabanlı CFME görevlerini yürütürken kullanışlı ve yaygın olarak uygulanan bir araçtır.
CFME karbonhidrat, organik asit veya alkol olmayan metabolik son ürünleri biriktirmek için uygulanabilir4. Sentezlendikleri kadar hızlı tüketilen ara maddelerin ölçümü de istenebilir10. HPLC-RID'e maliyet ve zorluk açısından erişilebilir olsa da, bu yöntem metabolitleri yalnızca saklama süresine göre ayırt etme yeteneği ile kısıtlanır. Sıvı kromatografisi MS/MS algılama (LC-MS/MS)16ile birleştiğinde daha geniş bir metabolit yelpazesi analiz edilebilir. Bu yöntemle, mobil fazdaki analizler iyonize edilir ve her molekülün kütle ve yük özelliklerine göre farklı olarak tespit edilir. Hem metabolit'in kütle-şarj oranı (m/z) oranı hem de sütundaki tutma süresi hakkında bilgi, böylece çoğu metabolik ara ve son ürünün yüksek çözünürlüklü ayrılmasını kolaylaştırır16. Bu algılama tekniği, çok daha düşük akış hızları ve numune enjeksiyon hacimleri sağlayan nano-sıvı kromatografisi ile de birleşerek karmaşık lisat arka plan17'dekiküçük moleküllerin daha hassas bir şekilde algılanmasını sağlar. LC-MS/MS ayrıca izotop etiketleme ile uygulanabilir, çünkü birikmiş etiketler analitlerin m/z değerlerinde değişiklikler verir18. 13C6-glikoz substratı ile desteklenmiş bir CFME reaksiyonundan çıkarılan zaman noktası ölçümleri, özellikle takviye edilen glikozdan elde edilen son veya yan ürünleri belirleyebilir. Bu izotop izleme yöntemi henüz CFME çalışmalarında yaygın olarak uygulanmasa da, özellikle bu reaksiyonlardaki tuz karşıtları (yani asetat ve glutamat) ikincil substratlar olarak katabolize edildiğinden, lysate tabanlı CFME sistemlerinde metabolik dönüşümleri anlamak için güçlü bir araçtır19. Bu teknikten yararlanmak, bu güne kadar tam olarak anlaşılamayan lysates'te glikoz metabolizmasının kapsamlı bir resmini çizebilir. Burada, protokol nano-sıvı kromatografisi için nanoelekrospray iyonizasyonu (nano ESI) MS / MS ile birleştiğinde, özellikle E. coli lisates'te olası bir glikoz metabolizması modelini sorgulamak için kullanılabilecek bir yöntemi detaylandırmaktedir (Şekil 1). Model, fermentatif yolların raporlarına ve pentoz fosfat yolunun zengin medyada yetişen suşlardan elde edilen E. coli lysates'te aktif olduğu raporlarına dayanmaktadır5,6,8,14. Teknik ayrıca amino asit üretimini araştırmak için kullanılır, çünkü lizazlardaki glikozdan amino asit anabolizmi hakkındaki mevcut bilgi aromatik amino asitlerin sentezi gibi birkaç örnekle sınırlıdır7. Bu yollardaki son ürünlerin ve ara ürünlerin (yani organik asitler, şeker fosfatlar ve amino asitler) çoğunlukla polar doğası göz önüne alındığında, burada ters fazlı sıvı kromatografisi kullanılmıştır. Bu teknik kutup bileşiklerini kutupsal olmayan sabit fazdan elution ile ayırır. Bu bileşikler daha sonra nano ESI tarafından en az bir negatif temel yüke sahip analizlerin tespit edilmesine izin veren negatif iyon modunda iyonize edildi ve bu nedenle asidik bileşikleri tespit etmek için yararlıdır. Bu teknik burada glikoz türevi 13C içeren metabolitleri analiz etmek için kullanılır ve lysates glikoz metabolizmasını anlamak için LC-MS / MS'in yararını gösterir.
Protokol
1. HPLC-RID nicelemesi için kurs CFME reaksiyonlarını başlatma, durdurma ve işleme.
- Daha önce hazırlanan E. coli lysates'i çözün ve reaksiyon bileşenlerinin geri kalanını buz üzerinde hazırlayın.
NOT: Burada bildirilen elyatlar, 2xYPTG (% 1.8 glikoz) ortamda orta kütük fazında yetişen E. coli BL21DE3-Star'dan türetilmiştir.- Uygun miktarda filtre sterilize edilmiş (0,20 μm gözenek filtresi) S30 tamponu (buzul asetik asitli pH 8,2'ye ayarlanmış 1 M Tris-OAc, 1,4 M Mg(OAc)2ve 6 M KOAc) hazırlayın.
- S30 tamponunda glikoz, glutamat tuzları, ATP, Koenzim A, NAD+, Bis-Tris tamponu ve dipotassium fosfat içeren bir enerji karışımı hazırlayın. Burada CFME reaksiyonlarını hazırlamak için kullanılan istenen reaksiyon hacmindeki son konsantrasyonlar 100 mM glikozdu, 18 mM magnezyum glutamat, 15 mM amonyum glutamat, 195 mM potasyum glutamat, 1 mM ATP, 0,2 mM Koenzim A, 1 mM NAD+, 150 mM Bis-Tris ve 10 mM dipotassium fosfat.
- Toplam lysat proteininin 4,5 mg/mL'si ile son reaksiyonları hazırlamak için bileşenleri 1,5 mL mikrosantrifüj tüplerinde birleştirin. Burada CFME reaksiyonları zaman noktası başına üç taraflı olarak 50 μL'lik son hacimlerle hazırlandı. Reaksiyonları kendi zaman dilimleri için 37 °C'de kuluçkaya yatırın.
NOT: Glikoz ve glutamat tuzları ile erken metabolik reaksiyonları önlemek için hızlı çalışın ve reaksiyon karışımının son bileşeni olarak lisat ekleyin. Reaksiyon karışımlarının buz üzerinde ne kadar süre inkübe edildiğine bağlı olarak minimum glikoz tüketimi ortaya çıkabilir. - HpLC-RID analizi için reaksiyonları sonlandırın ve numuneleri işleyin.
- Triplikat reaksiyonları uygun zaman noktalarında sonlandırmak için, hemen her numunenin nihai reaksiyon hacmine eşit miktarda% 5 trikloroasetik asit ekleyin (yani, 50 μL reaksiyona% 5 trikloroasetik asitin 50 μL'si). Her numuneyi reaksiyon hacminin 2 katı (yani 100 μL) steril su ile seyreltin.
- Sıfır süresini yeniden yakalamak için, reaksiyon bileşenlerinin geri kalanını eklemeden önce toplam son reaksiyon hacmiyle (yani 50 μL) aynı hacimde%5 trikloroasetik asidi lilatla karıştırın. Bu asitleşme adımı, glikozu önemli ölçüde metabolize etmeden önce lysate enzimlerini çökeltir.
- Örnekleri ve santrifüjleri 5 dakika boyunca 11.600 x g'da bir tezgah üstü mikrosantrifüj üzerinde vorteks edin ve organik analizleri içeren süpernatantları temiz tüplere aktarın. HPLC analizleri farklı bir günde yapılacaksa numuneleri -20 °C'de saklayın. Bir sonraki adıma geçmeden önce depolanan numuneleri buz üzerinde çözdüğünüzden emin olun.
- Her bir süpernatantı 0,22 μm gözenek filtresi ile filtreleyin. Şırındlara alternatif olarak, santrifüj tüp filtreleri kullanın ve süpernatantları 1 dakika boyunca 16.300 x g'da santrifüjleyin.
- Her filtrat temiz bir HPLC cam şişeye aktarın. Şişeleri HPLC otomatik örnekleyici tepsisine yükleyin.
- Örnekleri standart eğri üretimi için hazırlayın.
- CFME reaksiyonlarında glikozun başlangıç konsantrasyonunun üzerinde equimolar miktarlarda S30 tamponunda çözünmüş tüm hedef analizlerin bir stok çözeltisini hazırlayın. Burada 150 μM glikoz, süksinat, laktat, format, asetat ve etanolden oluşan bir stok çözeltisi hazırlandı. 0 μM ile stok konsantrasyonu (yani 150 μM) arasında değişen son konsantrasyonlarda triplikat 50 μL çözeltileri elde etmek için stok çözeltisinden 1:1 (v/v) seri seyreltme gerçekleştirin.
- Her çözeltiyi 50 μL% 5 trikloroasetik asit ve 100 μL steril su ile seyreltin. 1.3.4-1.3.5 adımlarını yineleyin.
NOT: Metabolit konsantrasyonlarının doğru nicelleştirilmesini sağlamak için her numune grubuyla standart eğri üretimi için çözümler çalıştırın.
2. HPLC sistemini metabolit tespiti için hazırlama.
- Bir duman kaputunun altında, deiyonize ve filtre sterilize edilmiş sudan sterilize edilmiş 5 mM sülfürik asit çözeltisi hazırlayın. 5 mM sülfürik asit hazırlamak için 2 L suya %98 HPLC sınıfı sülfürik asit çözeltisinin ~550 μL'sini ekleyin.
DİkKAT: Sülfürik asit tehlikeli bir kimyasaldır ve uygun laboratuvar KKD'siyle duman kaputunun altında çalışmak solunmasını, cilt temasını ve göz temasını önler. Konsantre sülfürik asit su ile güçlü bir şekilde reaksiyona neden olur ve tam tersi değil, doğrudan suya eklenmelidir. Doğrudan güneş ışığından uzak serin ve kuru bir alanda saklayın ve laboratuvar tarafından belirlenen uygun atık bertaraf önlemlerini izleyin. - 5 mM sülfürik asitli 2 L şişesini HPLC aletinin yanındaki su banyosunda kukusunda tutun. Su banyoyu 35 °C'ye ayarlayın. Solvent şişesine çözücü filtreli boru yerleştirin ve diğer ucunu pompa modülüne uygun bir gaz giderici modülüne takın.
NOT: Sütunu kurmadan önce sistemi yeni hazırlanmış bir çözücü ile temizlemek iyi bir enstrüman işleme uygulamasıdır. - HPLC cihazı RID modülüne uygun olarak HPLC sütunu ile donatın. Bir sütun termostatı yoksa, sütunu 35 °C su banyosuna yerleştirin.
- Rid modülini, sistem bilgisayarında yüklü olan Kromatografi Veri Sistemi (CDS) yazılımında 35 °C'de analiz için hazırlayın.
- Görünüm menüsünde Yöntem'i seçin ve Denetim Görünümü 'nü çalıştırın. Pompa Modülü > Yöntemi'nisağ tıklatın. Akış hızını 0,55 mL·dk-1 olarak ayarlayın ve pompayı başlatmak için Açık düğmesini seçin.
NOT: Sütun HPLC'de donatılmadan önce depodaysa, üreticinin talimatlarını izleyerek sütunu dengeledikten sonra akış hızını0,55 mL·dk -1'e yükseltin. - RID Modülü > Yönteminekarşılık gelen paneli sağ tıklatın. RI dedektör modülünün sıcaklığını 35 °C olarak ayarlayın ve RI dedektör modülünü ısıtmaya başlamak için Açık'ı seçin.
- Kontrol > RID Modülüpanelini sağ tıklatın. Yeni bir çözücü kullanırken en az 15 dakika veya bu kurulumdan önce RI dedektöründen farklı çözücüler aktıysa 1 saat boyunca Temizleme Referans Hücresi için Açık'ı seçin. Açık düğmesine tıklayın.
NOT: Çevrimiçi arsada istikrarlı bir taban çizgisi elde etmek için pompayı ve RI dedektörünü açık tutun. Bu, laboratuvardaki sıcaklık dalgalanmalarından etkilenir ve 4 saat veya daha uzun sürebilir. Örnek yüklemeden önce sistemi gece boyunca açık tutun.
- Görünüm menüsünde Yöntem'i seçin ve Denetim Görünümü 'nü çalıştırın. Pompa Modülü > Yöntemi'nisağ tıklatın. Akış hızını 0,55 mL·dk-1 olarak ayarlayın ve pompayı başlatmak için Açık düğmesini seçin.
3. CDS'deki organik fermantasyon ürünlerinin izokratik HPLC ayrımı için bir yöntem oluşturulması.
- Menü çubuğundan Yöntem > Yeni Yöntem 'iseçin. Yöntemi Seç > Yöntemi [MethodName].M. Enstrüman/Alım > Tüm Yöntemi Düzenlemek > Yöntemi Seçin
- İkili Pompa sekmesinde, akışı 0,55 mL·dk-1olarak ayarlayın. Çözücüleraltında, pompa modülündeki çözücü girişine karşılık gelen harfi seçin ve izokratik elüsiyon için% 100'e ayarlayın. Basınç Sınırlarını 0 ve 400 bar olarak ayarlayın ve Durma Süresiolarak 30 dakika girin.
- Örnekleyici sekmesinde Enjeksiyon Hacmini 50 μL olarak ayarlayın. Çekme Hızı, Çıkarma Hızıve Çekme Konumu için Gelişmiş Yardımcı Ayarları 200 μL·dk-1, 200 μL·dk-1 ve -0,5mm olarak ayarlayın.
- RID sekmesinde Optik Birim Sıcaklığı'nı 35 °C olarak ayarlayın. Sinyal altında, Sinyal için Al'ı ve Peakwidthiçin >0,2 dk 'yı seçin. Stoptimeiçin Pompa/Enjektör Olarak seçeneğini belirleyin.
- RID sekmesindeki Gelişmiş altında, Analog Çıktı'yı %5 Sıfır Uzaklık ve Zayıflama için 500.000 nRIU olarak ayarlayın. Sinyal Polaritesi için Pozitif seçeneğini ve Analizden Önce Otomatik Sıfıriçin Açık seçeneğini belirleyin.
- Yöntemi > Kaydetme Yöntemi 'ni seçerek yöntemi kaydedin. Yöntem > Yükleme Yöntemi > [MethodName] öğesini seçerek yöntemi yükleyin. M.
4. Otomatik örnekleme için bir sıra tablosu oluşturma ve veri toplama için HPLC-RID sistemini başlatma.
- Menü çubuğundan Sıra > Yeni Sıra Şablonu '>seçin. Sıra şablonlarını [SequenceTemplateName] olarak kaydet > Sırala'yı seçin. S.
- Sıra > Sıra Tablosu 'nuseçin. 'n' şişelerine karşılık gelen 'n' satırlarını ekle, ardından şişe konumlarını ve örnek adları sırasıyla şişe ve Örnek Adıaltına, otomatik örnekleme tepsislerindeki düzenlemelerine göre girin. Yöntem Adı açılır menüsünden 3.
- Sıra Şablon > Sıra Şablonlarını Kaydet'i seçerek Sıra şablonlarını uygula ve kaydet 'i tıklatın. Sıra > Yükleme Sırası Şablonu > [SequenceTemplateName] öğesini seçerek sıra şablonlarının yüklendiğinden emin olun. S.
- Çevrimiçi çizimde istikrarlı bir taban çizgisi elde ettikten sonra, solvent akışını RID dedektöründen atıklara yönlendirmek için panel RID Modülü > Kontrol > Kapalı Geri Dönüşüm Vanası'nı sağ tıklayın. Veri toplamayı başlatmak için, Menü çubuğundan Sırala > Çalıştır'ı seçin.
5. Çalıştırma sonrası verileri ayıklama ve analiz etme.
- Görünüm menüsünden Veri Analizi görünümünü seçin. Sıralı Dosya Adını ekranın sol tarafındaki Dosya Listesi'nden bulun. Ekrandaki orta panelde, örnek kromatogramları görüntülemek için Sinyal Görünümü Seçimi > RID Sinyali'ne gidin.
- Ekrandaki üst panelden yüksek konsantrasyonlu standart örneğe karşılık gelen bir satır seçin. Görüntülenen kromatogramdaki hedef analit tepelerinin saklama sürelerini not alın. Hedef analitlere karşılık gelen tepeler, tutma süresi ekseni boyunca glikoz, süksinit, laktat, format, asetat ve etanol olarak düzenlenecektir(Ek Şekil 1).
NOT: Kromatogramdaki ilk büyük tepe trikloroasetik aside karşılık gelir. RI birimleri tüm standart eğri örneklerinde tutarlı olmalıdır. Her bir bileşiği ayrı bir örnek olarak çalıştırarak her hedef analitenin saklama süresini doğrulayın. - Standartların kromatogramlarından ve reaksiyon örneklerinden her hedef analit için tepe alanlarını çıkarın.
- İlgi çekici zirvelerin yazılım tarafından iyi entegre edilip edilmediğini ayırt edin. Eğrinin altında doğru bir şekilde entegre edilmiş bir alan elde etmek için kırmızı çizgiyi her tepenin tabanı olarak çizin. Otomatik tümleştirme başarısız olursa (yani kırmızı çizgi yeniden başlar), Tümleştirme Aracı Kümesi'nden Manuel Tümleştirme düğmesini seçin ve tepe alanını tümleştirmek için el ile bir tepe tabanı çizin.
NOT: Bir örnekte hedef analiz için manuel entegrasyon yapılması gerekiyorsa, tutarlı olun ve aynı analiteyi tüm örneklere manuel olarak entegre edin. - Düzgün tümleşik tepelere tıklamak için Ortak Araç Kümesi'nden İmleç aracını seçin. Tepe alanı ve seçilen tepenin ilgili saklama süresi, ekranın alt panelinde bir tablo satırı olarak vurgulanır.
- Tepe alanları vermek için Dosya > > Tümleştirme Sonuçlarını Dışarı Aktar 'ıseçin.
- İlgi çekici zirvelerin yazılım tarafından iyi entegre edilip edilmediğini ayırt edin. Eğrinin altında doğru bir şekilde entegre edilmiş bir alan elde etmek için kırmızı çizgiyi her tepenin tabanı olarak çizin. Otomatik tümleştirme başarısız olursa (yani kırmızı çizgi yeniden başlar), Tümleştirme Aracı Kümesi'nden Manuel Tümleştirme düğmesini seçin ve tepe alanını tümleştirmek için el ile bir tepe tabanı çizin.
- Standart eğrileri kullanarak hedef analit konsantrasyonlarını ölçün.
- Bir elektronik tablodaki bilinen numune konsantrasyonlarına karşılık tepe alanı değerlerini çizin. Çizilen verileri sağ tıklatın, Eğilim Çizgisi Ekle > Eğilim Çizgisini Biçimlendir > Denklemi Grafikte Görüntüle.
- Ayrı bir elektronik tabloda, tepe alanı değerlerini her örnekteki her analiz için konsantrasyonlara dönüştürmek için standart eğri eğilim çizgilerinin denklemlerini kullanın. Veri görselleştirmesi için üç taraflı ortalama tepe alanlarını ve standart hata değerlerini hesaplayın.
6. LC-MS/MS nicelleştirmesi için CFME reaksiyonlarını başlatan, durduran ve işleyen zaman kursu izotopu izleme.
- 1.1-1.2'de açıklandığı gibi buz üzerinde zaman noktası başına (sıfır zaman hariç) üç taraflı reaksiyonlar ayarlayın. Bununla birlikte, glikoz yerine, reaksiyonlarda 100 mM 13C6-glikoz nihai konsantrasyonu kullanın. Reaksiyonları 37 °C'de 1 saat, 2 saat ve 3 saat kuluçkaya yatırın.
- Sonlandırmak için, reaksiyonları sıvı nitrojende dondurun ve -80 °C'de saklayın. Aynı gün çözümlemesi için bu depolama adımlarını atlayın.
NOT: Trikloroasetik asit, LC-MS/MS yoluyla bazı merkezi karbon metabolitlerini tespit ederken asitten kaynaklanan girişimlere neden olan reaksiyonları durdurmak için kullanılmamıştır. Bunun yerine, formik asit içeren ekstraksiyon çözücü (adım 6.3), formik asidin kütlesi bildirilen MS/MS yönteminin algılama sınırının altında olduğundan metabolik proteinleri çökeltmek için kullanılmıştır. - Ekstraksiyon çözücüsunun 50 mL'sini hazırlayın. 0,1 M çözelti yapmak için 0,199 mL formik asit ile birlikte 50 mL santrifüj tüpünde 20 mL asetonitril, 20 mL metanol ve 10 mL su (tüm LC-MS sınıfı) birleştirin ve girdaplayın. Ekstraksiyon sırasında çözücüyü 4 °C'ye soğutun ve kullanılmadığında çözücüyü -20 °C'de saklayın.
- LC-MS/MS analizi için numunelerin işlenmesi
- Analiz gününde, pipet her numuneye eşdeğer bir ekstraksiyon çözücü hacmi (yani 50 μL). Numuneler dondurulduysa, glikoz metabolizmasının yeniden etkinleştirildiğini önlemek için numuneler tamamen çözülmeden önce ekstraksiyon çözücüsüyü ekleyin. Tüm numune işleme adımlarını buz üzerinde gerçekleştirin.
- Sıfır süresini yeniden yakalamak için, son ekstraksiyon çözücü hacmini (yani, 50 μL) reaksiyonda istenen son konsantrasyon için uygun bir lysate hacmine (yani, 50 μL reaksiyon hacminde 4,5 mg/ mL) pipet. Reaksiyon bileşenlerinin geri kalanını adım 1.2'deki gibi ekleyin. Bu asitleşme adımı, glikozu önemli ölçüde metabolize etmeden önce lysate enzimlerini çökeltir.
- Numuneleri buz üzerinde 30 dakika boyunca hafif sallama ile ekstraksiyon çözücüsüne inküboz edin, ardından süpernatantı çökük proteinden ayırmak için numuneleri 21.000 x g'da 4 °C'de 15 dakika santrifüj edin. Süpernatantın 50 μL'lik kısmını otomatik örnekleyici şişelere aktarın ve şişeleri 4 °C otomatik örnekleyici içindeki tepsiye yükleyin. Gelecekteki analizler için süpernatant'ın geri kalanını -20 °C'de saklayın.
7. LC-MS/MS analizi için LC sisteminin kurulması.
- 950 mL su ve 50 mL izopropanolde 77,08 mg amonyum asetat tamamen çözünerek 1 L Solvent A hazırlayın. 650 mL asetonitril, 300 mL su ve 50 mL izopropanol ile birlikte 77,08 mg amonyum asetat ile 1 L Solvent B hazırlayın. Tüm çözücülerin LC-MS sınıfı olduğundan emin olun.
- A ve B Çözücüler içeren çözücü şişeleri pompa modülüne bağlayın. Çözücülerin ekipmanı sırasında meydana gelebilecek hava kirlenmesini LC sistemine kaldırmak/sınırlamak için sistemi yüksek debiden arındırın.
- Sistemi bir C18 ters fazlı sütunla (30 cm sütun uzunluğu, 75 μm iç çap ve 5 μm parçacık çapı) donatın. %100 solvent B akarak ve Solvent A'yı %100'e yavaşça akarak sütunu LC-MS sistemine koşullandırma.
NOT: Kolon uçları bir mikropipette çekme kullanılarak şirket içinde hazırlandı ve basınç hücreleri ve helyum ile paketlendi.
8. Fourier Transform ve İyon Kapanı Kütle Spektrometrelerine bağlı LC sistemi için LC-MS/MS veri toplama ve yorumlama yazılımı üzerinde bir yöntem oluşturma.
- MS yöntemi için bir ayar dosyasını düzenlemek üzere Tune Plus yazılımını açın.
- Menü çubuğundaki Dosya'dan önceden yüklenmiş bir negatif mod ayar dosyası açın.
- Menü çubuğunda ScanMode'u seçin, ardından Tarama Penceresi Tanımla 'yıseçin. MSn için mikro tarama zaman ayarını hem İyon Tuzağı hem de FT için 1 olarak ayarlayın.
- Nano-ESI Kaynağı ayarlarına gidin ve Püskürtme Voltajı'nı 4 kV olarak ayarlayın. Kabul edilebilir bir elektrospray üretilene kadar bunu modüle edin; tipik olarak, kabul edilebilir elektrospray 2-5 kV aralığında elde edilebilir.
- Ayar dosyasını kaydedin.
- Cihazın veri toplama ve yorumlama yazılımının Kurulum Sihirbazı'nı kullanarak yeni bir LC yöntemi oluşturun. Sıralı Kurulum > Sihirbazı'> Yol Haritası 'nıaçın. Bu yöntemler sütun ısıtıcısı kullanımını gerektirmediğinden, Temp Control adımını atlayın.
- Akış Degrade Pompası Seçenekleri altında, Çok Noktalı 'yıseçin. Bir sonraki pencerede, 7 satır ekleyin ve her satırın akış hızını 0,1 mL·dk-1olarak ayarlayın. Her satır için aşağıdaki parametreleri girin: 0-3 dk arasında% 100 çözücü A teslim edin; 3-9 dakikadan itibaren% 100 solvent A ila% 20 çözücü B arasında bir gradyan tanıtın; 9-19 dk arasında% 20 solvent B'den% 100 çözücü B'ye yeni bir gradyan tanıtın; 19-27 dk arasında% 100 çözücü B'de tutun; 27-28 dk'dan itibaren degradeyi %100 solvent A'ya ayarlayın; 28-44 dk'dan itibaren, sütunun %100 solvent A'da tutularak sonraki çalıştırmalar için durulanması ve yenilenilmesi.
- Numune Alma Seçeneği olarak Numune Alma Seçenekleri > Pompa Basıncı için Varsayılan ayarları uygulayın ve Varsayılan Alım Süresi'ni kullanın ve Varsayılan Pompa Basıncı seçeneklerini kullanın.
- Enstrüman Kurulumu penceresindeki kenar çubuğundan Orbitrap Velos Pro MS simgesini seçerek bir MS/MS yöntemi oluşturun.
- Veriye Bağımlı MS/MS > Yeni Yöntem'i tıklatın. Edinme Süresini LC çalıştırması uzunluğuna (yani 44 dk), Segment'i 1'e ve Tarama Olaylarını 11'e ayarlayın. Dosyayı Ayarla için, 8.1 adımından düzenlenmiş dosyayı seçin.
NOT: İlk olay, Fourier Transform MS (FTMS) kullanan bir MS1 öncü taramasıdır. Sonraki 10 olay, MS2 parçalanması için her öncü taramada en yoğun ve benzersiz 10 iyonları seçen MS2 taramaları olacaktır. - Olay 1 için, Tarama Açıklaması altında Çözümleyici'yi FTMS ve Polarity'yi Negatif olarak ayarlayın. MSn Ayarları altında, 30.000 çözünürlük ve 35 V'lık Normalleştirilmiş Çarpışma Enerjisi kullanın, Tarama Aralıklarını ilk kütle için 50 m/z'ye ve küçük molekülleri yakalamak için son kütle için 1800 m/z'ye ayarlayın.
- 2 ile 11 arasında olan olaylar için, Tarama Açıklaması altında Çözümleyici'yi İyon Tuzağı olarak ayarlayın. Bağımlı Tarama'yı seçin ve Genel > Dinamik Dışlama ayarlarına tıklayın ve Etkinleştir '>seçin; yakın mesafedeki tekrar taramaları ortadan kaldırmak için 30 s tekrar süresi ve 120 s hariç tutma süresi ayarlayın.
- Olay ayarlarını tara'ya gidin ve tüm MS2 olayları için Tarama Olayından Belirlenen Kütle'yi 1 olarak ayarlayın (2 ile 11 arasında). En yoğun 10 iyonları taramak için, her MS2 tarama olayını 1st ila 10th arasında bir nth En Yoğun İyon algılayana kadarayarlayın. Bu nedenle, Olay 2'yi 1'i En Yoğun İyon olarak algıla, olay 3'ü 2'yi algılamak için vb.
- Kurulum penceresini kapatın ve Dosya > Farklı Kaydet [Method_Name].meth'e gidin.
NOT: LC cihazı ve kütle spektrometresinin genel kullanımı, bakımı ve kalibrasyonu için üretici tarafından sağlanan kullanım talimatlarına ve kılavuzlarına bakın.
- Veriye Bağımlı MS/MS > Yeni Yöntem'i tıklatın. Edinme Süresini LC çalıştırması uzunluğuna (yani 44 dk), Segment'i 1'e ve Tarama Olaylarını 11'e ayarlayın. Dosyayı Ayarla için, 8.1 adımından düzenlenmiş dosyayı seçin.
9. Bir çalışma sırası ayarlama ve LC-MS/MS çalıştırmasını başlatma.
- LC-MS/MS sisteminin veri toplama ve yorumlama yazılımını kullanarak bir Çalışma Sırası ayarlayın. Roadmap > Sıralı Kurulumiçinde, örnek kadar satır eklemek için tabloyu sağ tıklatın. Her satır için, Inj Vol'ı 5 μL'ye ve Konumu otomatik örnekleyici tepsisinde şişenin ilgili konumuna ayarlayın. Dosya adlarını örnek adlar olarak girin ve çalıştırma sonuçları için istediğiniz dosya yolunu ayarlayın.
NOT: Solvent A içeren boş şişeler, sütunu durulamak için sıranın başında ve her üç taraflı örnek kümesi (her zaman noktası kümesi) arasında çalıştırılabilir. - Çalıştırmayı başlatmak için Sıra'daki tüm Dosya Adlarını vurgulayın. Menü çubuğunda, Sırayı Çalıştır > Tamam > Eylemler 'iseçin.
10. Dosyaları birleştirme ve MZmine 2.53'te belirsiz ek açıklamalar arama.
- MZmine'yi açın ve 9.1 adımından '.raw' çıktı dosyalarını içeri aktarın. Menü çubuğundan Ham Veri Alma > Ham Veri Yöntemleri 'niseçin. Örneklere karşılık gelen dosyaları seçin.
- MS1 ve MS2 taramalarını ayıran tepelerin bir listesini oluşturun. Menü çubuğundan, Ham Veri Yöntemleri ms/ms peaklist oluşturucu > özellik algılama >. İlgili ayarlar arasında m/z Pencere 0,01 olarak ayarlanmış ve Zaman Penceresi çalıştırma uzunluğuna ayarlanmıştır. Ayarlanan filtreler altında Polarite Olarak Negatif ve Spektrum Türüolarak Centroided 'i seçin.
- Menü çubuğundan Özellik Algılama > Tepe Genişletici > Özellik Listesi Yöntemleri 'negidin. m/z Toleransı'yı 0,005 m/z veya 10 ppm ve Minimum Yükseklik'i 1E3 olarak ayarlayın. Bu adım tamamen ete kemiğe bürünmüş zirveler yaratacaktır.
- Yinelenen tepeleri kaldırın. Yinelenen Tepe Filtresi > Filtreleme > Özellik Listesi Yöntemleri 'ne geri dönün. İlgili ayarlar arasında 0,005 m/z veya 10 ppm'ye ayarlanmış m/z Toleransı ve 5 dk olarak ayarlanmış RT Toleransı bulunur.
- Benzer veri dosyalarındaki zirveleri hizalamak için (yani üç taraflı reaksiyonlarınkiler), Normalleştirme > Saklama Süresi Kalibrasyonu > Özellik Listesi Yöntemleri'ne geri dönün. Üç taraflı örnekleri birlikte işlediğinden ve boşlukları dışarıda bıraktığından emin olun. İlgili ayarlar arasında 0,005 m/z veya 10 ppm olarak ayarlanmış m/z Toleransı, 3 dk mutlak (dk) olarak ayarlanmış RT Toleransı ve 1E3 olarak ayarlanmış Minimum Standart Yoğunluk bulunur.
- Tüm dosyalardaki zirveleri m/z ve saklama süresine göre Hizalama Özellik Listesi Yöntemleri'nden RanSAC Hizalayıcısı > Hizalama >. m/z Toleransı'na 0,005 m/z veya 10 ppm, Düzeltme sonrası RT Toleransı ve RT Toleransı'na sırasıyla 44 ve 39 dk' ya, RANSAC Yinelemelerini 0'a, Minimum Puan Sayısını %10'a ve Eşik Değerini 1'e ayarlayın. Aynı Ücret Durumunu Gerektirseçeneğini işaretleyin.
- Boşluk Doldurma > Tepe Bulucu 'da Özellik Listesi Yöntemleri >önceki adımlarda kaybolmuş olabilecek veri noktaları için doğru. İlgili ayarlar arasında %50'ye ayarlanmış Yoğunluk Toleransı, 0,005 m/z veya 10 ppm'ye ayarlanmış m/z Toleransı ve 3 dk olarak ayarlanmış RT Toleransı bulunur. RT düzeltmesini etkinleştirin.
11. 13C etiketli glikoz türevi metabolitlerin negatif mod kütlelerinin hesaplanması ve filtrelenmiş verilerde bu analizlerin m/z özelliklerinin aranması.
- Hedeflenen arama için glikoz metabolizmasından 13C etiketli metabolit kütlelerini hesaplayın.
- Her hedef bileşiğin monoisotopik kütlesini, bileşiğin moleküler formülündeki atom sayısından ve her elementin monoisotopik kütlelerinden hesaplayın20.
- Monoizotopik kütleden 1 proton (1.007276 Da) kütlesini çıkararak bileşiğin negatif mod kütlesini [M-H]- hesaplayın. Bu, moleküller iyonlaşma sırasında bir hidrojen iyonunun soyulması sonrasında negatif mod MS tespiti ile tespit edilen kütledir.
- Negatif mod kütlesinden, 13C içeren metabolit kütlesini hesaplayın. Burada, glikozdan türetilen 13C-etiketlerini maksimum olarak birleştiren izotopologların kitleleri hesaplandı.
- MZmine sonuçlarından m/z özelliklerini aramak ve açıklama eklemek için 13C etiketli metabolitten oluşan hesaplanan kütleleri kullanın. Olası her vuruş için, aşağıdaki denklemi kullanarak kütle hatasını (ppm) hesaplayın:
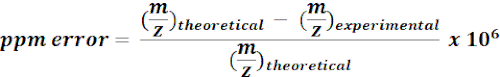
NOT: <15 ppm kütle hatası olan deneysel m/z değerleri mevcut analizde putatif ek açıklamalar olarak kabul edilmiştir. - Ek açıklamaları onaylamak için kaliteli bir tarayıcıda putatif ek açıklamaların spektrumunu manuel olarak kontrol edin.
- Qual Browser > Yol Haritası 'niaçın. Araç Çubuğu'ndan, her örneğin ham MS verilerini almak için Ham Dosyayı Açın.
- Kütle spektrumunu (alt panel) görüntülemek için toplam iyon kromatogramında (üst panel) istenen saklama süresi aralığının (yani putatif ek açıklamaya karşılık gelen) altına bir çizgi çizin. Spektruma sağ tıklayın ve hedef analyte'nin m/z'sini kapsayan bir dizi kütle girin. Putatif ek açıklamaların gürültünün önemli ölçüde üzerinde farklı tepe sinyallerine sahip olup olmadığını kontrol edin (Ek Şekil 2).
- Her zaman noktası için biyolojik çoğaltmalar arasında ortalama tepe alanlarını ve pozitif ek açıklamaların standart hatalarını hesaplayın. Glikoz metabolizmasındaki eğilimleri gözlemlemek için verileri (yani bir çubuk grafikte) görselleştirin.
Sonuçlar
Glikozdan yaygın fermantasyon ürünlerinin lizat bazlı hücre içermeyen sentezini ölçmek için, 2xYPTG ortamlarında yetişen suşlardan elde edilen lizatlar birincil karbon kaynağı olarak 100 μM glikoz ile beslendi8. Reaksiyonlar protein asitlenmesi ile 24 saat boyunca durduruldu. Glikoz katabolizmasından üretilen piruvat, süksinit, laktat, format, asetat ve etanol içeren filtrelenmiş süpernatantlar, RID modülü ile donatılmış bir HPLC sisteminin otomatik örnekleyici modülüne yüklendi. 1.17 μM'de fermentatif son ürünler ve glikoz filtrelenmiş karışımları ile şişeler, S30 tamponunda 2,34 μM, 4,69 μM, 9,38 μM, 18,75 μM, 37,50 μM, 75 μM ve 150 μM konsantrasyonlar standart olarak cihaza yüklendi. Analizler bir HPLC sütunundan RID'ye isokratik olarak elde edildi. 1 ila 150 μM aralığında glikoz, süksinat, laktat, format, asetat ve etanol için tepeler RID ile çözülebilir. Glikoz için tepe alanları, zaman seyri ve standart eğri örnekleri için RID verilerinden manuel entegrasyon ile türetilmiştir. Succinate, laktat, format, asetat ve etanol için çıkarılan tepe alanları otomatik olarak entegre sinyallerden alınmıştır. Tüm standart eğriler (tepe alanı ve bilinen konsantrasyon) R2 değerlerine sahipti >0.99 ve burada kullanılan konsantrasyon aralığı boyunca doğrusaldı.
Tüm hedef analizler için molar konsantrasyonları kendi standart eğrilerinden hesaplanmıştır. Glikoz reaksiyonun ilk 3 h'sine kadar tüketildi ve esas olarak laktata fermente edildi (Şekil 2A,B). Etanol birikimi de reaksiyonun ilk 3 h'sinde önemli ölçüde meydana geldi ve daha sonra durdu (Şekil 2C). 3 saat sonra önemli glikoz tüketimi ile anlamlı laktat ve etanol üretiminin gözlemlenmesi, laktat ve etanol üretim yollarının glikoliz yoluyla sürekli glikoz tüketimi için gerekli olan glikolitik NADH'dan 1 net mol NAD+ yenilenmesine izin verinden daha önce görülmemiş bir şey değildi(Şekil 1). Laktat ve etanol böylece lysate bazlı hücre içermeyen glikoz metabolizmasında başlıca fermantasyon son ürünleri olarak düşünülebilir. Asetat başlangıçta S30 tamponunun bir bileşeni olarak reaksiyonlarda mevcuttu ve beklenmedik bir şekilde sadece glikoz tüketimi yavaşladığında 6 saat sonra metabolizma nedeniyle birikti (Şekil 2D). Bu sonuç, asetat fermantasyonunun daha önceki zaman noktalarında hızlı glikolitik akıyı mutlaka etkinleştirmediğini göstermektedir. Bu arada, format ve succinate küçük fermantasyon ürünleri olarak sentezlendi (Şekil 2E,F). Yöntem, E. coli S30 lisatlarında şeker substrat tükenmesinin ve fermentatif ürün oluşumunun mutlak nicelemesini sağladı.
Özellikle lysate glikoz metabolizmasını profillamak için MS tespiti burada uygulandı. 2xYPTG ortamlarında yetişen suşlardan elde edilen lysates karbon kaynağı olarak 13C6-glikoz ile beslendi. CFME reaksiyonları üç taraflı olarak 0 saat, 1 saat, 2 saat ve 3 saat boyunca çalıştırıldı. Her zaman noktasından alınan numuneler, ters fazlı bir sütunla donatılmış bir LC sistemine yüklendi ve Fourier dönüşümü ve iyon kapanı kütle spektrometreleriyle birleştirilmişti. Organik asitler, şeker fosfatlar ve amino asitleri analiz etmek için negatif iyon modu spektrumları elde edildi ve işlendi. Merkezi karbon metabolizmasına ait 13C etiketli türün hesaplanan teorik kütleleri, özellikle glikoz türevi bileşikleri tanımlamak için arandı. E. coli CFME'deki kullanılan kaynak gerinim ekim koşullarına ve önceki aktif yol raporlarına dayanarak, burada lysate proteomunun glikolitik fermantasyona, pentoz fosfat yoluna ve muhtemelen amino asit anabolizması 5 , 6,7,8,14 ' e (Şekil 1)glikoz besleyen metabolik bir ağdan oluştuğu varsayılmıştır. Bu nedenle, arama, glikoz türevi 13C etiketlerini içeren 16 metabolitin açıkça açıklama eklendiğini gösteren bu yolların üyelerine daraltıldı (Ek Tablo 1).
13 C6-glikoz, glikolitik ara bolluklardaki dalgalanmaların kanıt ettiği gibi glikoliz yoluyla gözle görülür şekilde tüketildi (Şekil 3A-E). HPLC-RID verileriyle tutarlı olarak, glikoz 13C3-laktata birikti ve reaksiyonun ilk 3 h'si içinde 13C3-succinate fermente edildi(Şekil 4A, B). 13C3-succinate izotopologue oluşumu, süksitin 2 karbonlu asetil-CoA molekülünün TCA döngüsüne girişinden değil, 3 karbon fosfolinolün (PEP) molekülünün karboksilasyonu ile üretilmesi muhtemel olduğu lysate glikoz metabolizmasının önerilen modelini destekler (Şekil 1). TCA döngüsünün aktivasyonu önceki CFME çalışmalarında varsayılmıştır, ancak TCA'nın diğer 13C etiketli ara malı burada tespit edilmiştir8,19,21. 13 C3-aspartat sentezi ancak ilk h içinde meydana geldi ve PEP'in doğrudan oksaloasetat'a dönüştürüldüğü fikrini güçlendirerek tüketildi (Şekil 1, Şekil 6C). Veriler, glikoz bakımından zengin medyada (2xYPTG) fermentatif büyüme sırasında toplanan kaynak suşlarından elde edilen bir lysate proteomunu yansıtır. Bu, süksinit üretimine katılmayan TCA enzimlerinin geri kalanının oksidatif bir TCA dalı oluşturduğu anlamına da neden olacaktır (Şekil 1). Bununla birlikte, bu yoldaki metabolitlerin hiçbiri tespit edildi, muhtemelen CFME reaksiyonuna tuz karşıtlığı olarak eklenen yüksek glutamat konsantrasyonları bu dalın ilerlemesini önler.
HPLC-RID verileri ayrıca 3 saat reaksiyon süresi içinde 13C2-asetat algılamasının olmaması ile tamamlanır ve glikozdan 3 h'ye kadar asetat birikmesi olmadığını gösterir(Şekil 2B). Bununla birlikte, asetatın doğrudan öncüsü olan asetil-fosfat (asetil-P), asetil-CoA'dan asetat sentezi için Pta-AckA yolunun Pta kolunun aktif olduğunu düşündürmektedir (Şekil 4C,D). AckA katalizörlü defosforilasyonu 13C2-asetil-P ila 13C2-asetat, asetat reaksiyonlarda kullanılan S30 tamponunun önemli bir bileşeni olduğu için muhtemelen bu zaman dilimi içinde oluşmaz (Şekil 1, Şekil 2B).
Şeker fosfatları 6-fosfooğluconolactone (6PGL), 6-fosfogluconat (6PG), ribüloz-5-fosfat (Ru5P) ve sedoheptulose-7-fosfat (S7P) için 13C6-glikoz türevi karbonların birleştirilmesi de gözlenmiştir (Şekil 5). Bu sonuçlar pentoz fosfat yolunun lizat glikoz metabolizmasına katılımını doğrular ve muhtemelen daha önce proteomik bir çalışma tarafından önerilen 13C9-tirozin sentezini besler, aynı zamanda 13C5-histidin üretimi için bir öncü sağlar (Şekil 6A,B)7. Etiketli fenilalanin ve triptofan burada gözlenmemiştir ve esansiyel amino asitlerin çoğu da gözlenmemiştir. Bununla birlikte, amino asit anabolizminin besin açlığı çeken koşullarda veya sabit faz7,22'deyetişen hücrelerden elde edilen lysatlarda zenginleştirilmesi muhtemel olduğundan, bu tamamen şaşırtıcı değildir. Ayrıca, şimdiye kadarki veriler, glikoliz ve fermantasyon ara maddelerinin kofaktör rejenere edici uç reaksiyonlara doğru hunilendiğini göstermektedir, gliseraldehit-3-fosfat, piruvat ve asetil-CoA'dan (örneğin glisin, sistein, serine, alanin, valine, leucine ve lizin) elde edilen birçok amino asidin sentezini engellemelidir (Şekil 1). Belirtildiği gibi, ilk bir saat içinde 13C3-aspartat üretilirken, aspartat 13C içeren amino asit (yani, threonine, isoleucine, methionine ve asparagine) türetilmiştir, çünkü glikoz türevi aspartat fermantasyona katılır (Şekil 1, Şekil 6C). Son olarak, glutamattan elde edilen etiketli glutamat ve amino asitlere doğru akı reaksiyon ortamında yüksek glutamat seviyeleri tarafından engellenmiş olabilir (Şekil 1).
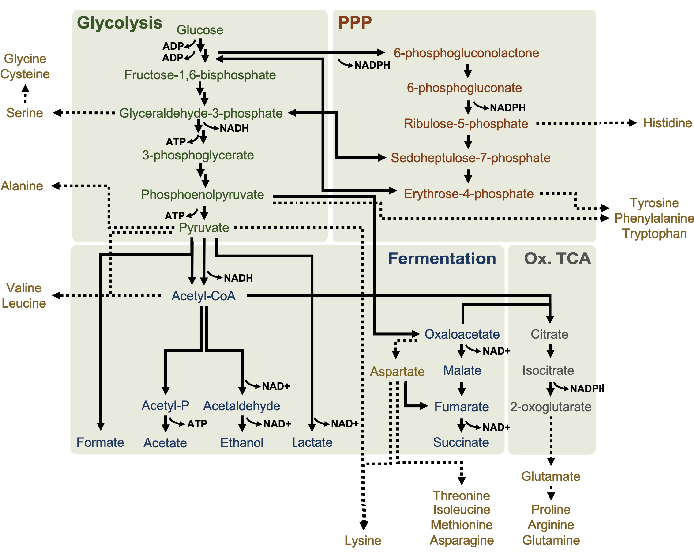
Şekil 1: Yüksek glikoz konsantrasyonlarında katlanarak büyüyen E. coli BL21DE3-Star'dan elde edilen putatif metabolik bir lysates modeli. Glikoliz (yeşil), pentoz fosfat yolu (koyu turuncu) ve asetil-CoA'dan fermentatif yolların (mavi) ara ve son ürünleri lizat bazlı CFME'de bildirilmiştir. Süksinit fermantasyonunun varlığı, oksidatif TCA dalının (gri) aktivasyonunu ima eder. Lysates amino asit anabolizması (altın) iyi tanımlanmamıştır ve burada araştırılmaktadır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
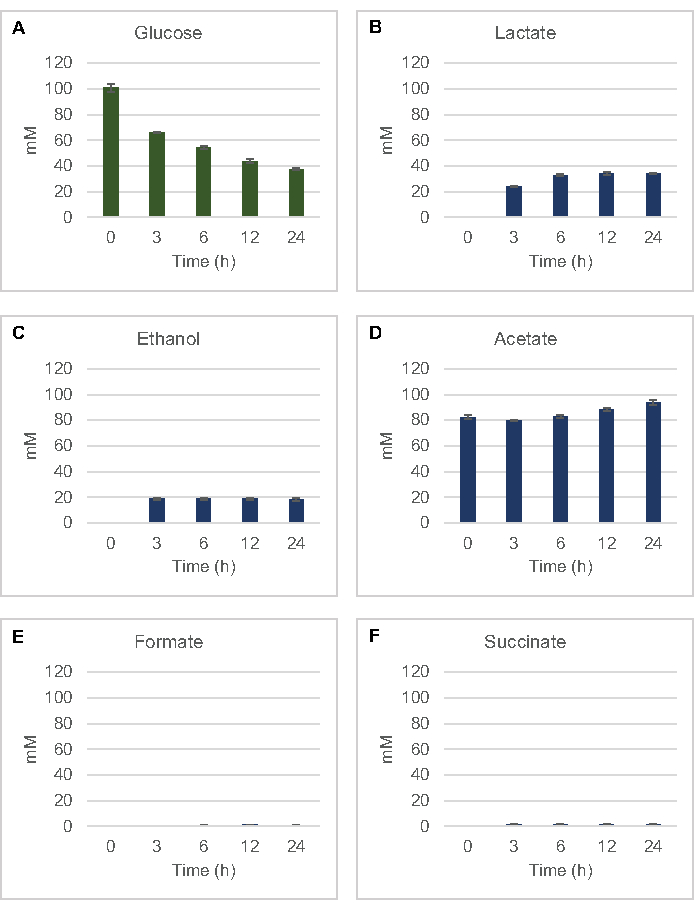
Şekil 2: E. coli ham özleri ile hazırlanan CFME reaksiyonlarında glikoz tüketimi ve fermentatif son ürün sentezi için HPLC-RID verileri. (A) Glikoz tüketimi ve (B) laktat, (C) etanol, (D) asetat, (E) formate ve (F) CFME reaksiyonlarında süksinit üretimi 24 saat boyunca izlendi. Standart eğrilerle ölçülen ortalama mM konsantrasyonları ve hata çubukları (n = 3) sunulur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
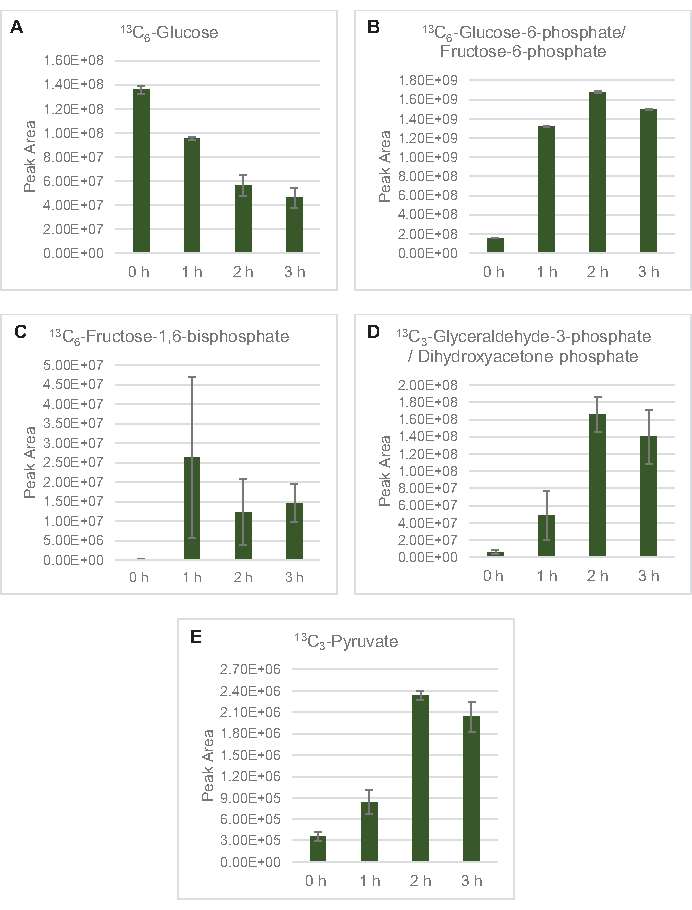
Şekil 3: E. coli lysate CFME'de 13 C6-glikoz ve 13C etiketli glikolitik ara malı zaman seyri eğilimleri. (A) 13C6-glikoz, (B) 13C6-glikoz-6-fosfat/ fruktoz-6-fosfat, (C ) 13C6-fruktoz-1,6-bifosfat, (D) 13C3-gliseraldehit-3-fosfat/dihidroksiyaceton fosfat ve (E) 13C6 -CFME reaksiyonlarında 3 saatin üzerindeki piruvat. MzMINE yazılımı tarafından çıkarılan ham tepe alanları, pozitif ek açıklamalar için ortalamaları ve hata çubuklarını (SE) hesaplamak için kullanılmıştır (n = 3). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: E. coli lysate CFME'de 13C6-glikoz fermantasyonunda ara ve son ürünlerin zaman seyri eğilimleri. 3 saat üzerindeki CFME reaksiyonlarında (A) 13C3-laktat, (B) 13C3-süksinit, (C) 13C2-asetil-fosfat ve (D) 13C2-asetil-CoA'nın bağıl bollukları. MzMINE yazılımı tarafından çıkarılan ham tepe alanları, pozitif ek açıklamalar için ortalamaları ve hata çubuklarını (SE) hesaplamak için kullanılmıştır (n = 3). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
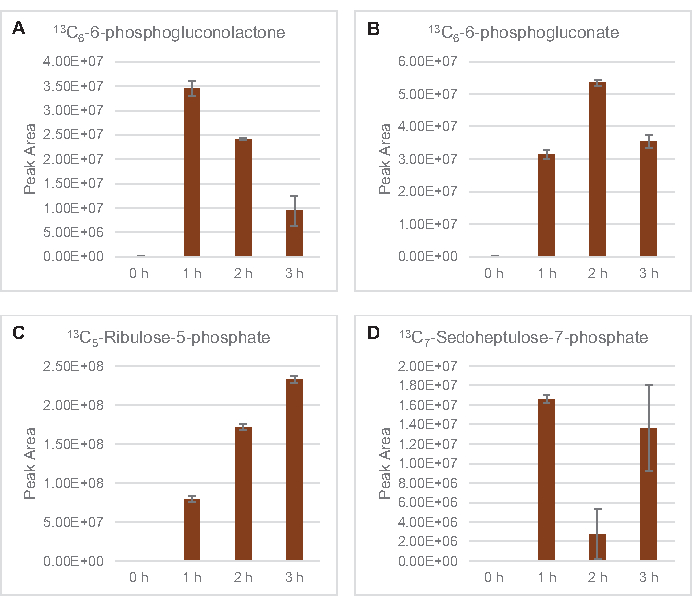
Şekil 5: E. coli lysate CFME'de 13C6-glikoz türevi pentoz fosfat yolu aralarının zaman seyri eğilimleri. (A) 13C6-6-fosphogluconolactone, (B) 13C6-6-fosfolikonat, (C) 13C5-ribulose-5-fosfat ve (D) 13C7-sedoheptulose-7-fosfat 3 saatin üzerinde. MzMINE yazılımı tarafından çıkarılan ham tepe alanları, pozitif ek açıklamalar için ortalamaları ve hata çubuklarını (SE) hesaplamak için kullanılmıştır (n = 3). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
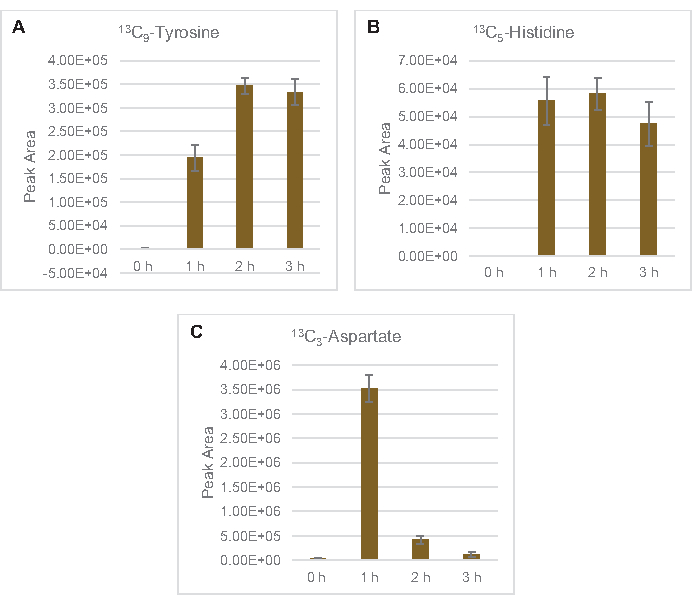
Şekil 6: E. coli lysate CFME'de saptanan 13C6-glikoz türevli amino asitlerin zaman seyri eğilimleri. (A) 13C9 -tirozin,(B) 13C5-histidin ve (C) 13C3-aspartate 3 saat üzerinde göreceli bolluk. MzMINE yazılımı tarafından çıkarılan ham tepe alanları, pozitif ek açıklamalar için ortalamaları ve hata çubuklarını (SE) hesaplamak için kullanılmıştır (n = 3). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: 24 saat boyunca 37 °C'de inkübe edilmiş bir CFME reaksiyonunda majör fermentatif ürünler için zirveleri gösteren temsili HPLC-RID kromatogramı. Glikoz, süksinit, laktat, format, asetat ve etanol zirveleri, 5 mM sülfürik asit çözücü ile izokratik elüasyon sırasında bir HPLC sütununda tutma süreleri ile yeterince ayırt edilebilir. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil 2: 13C etiketli metabolitler için temsili kütle spektrumu, özellikle (A) laktat,(B) glikoz ve (C) 6-fosfoogluconat (6PG) 1 saat boyunca 37 °C'de inkübe edilmiş bir CFME reaksiyonunda.
Ek Tablo 1: Algılanan 13C etiketli metabolit listesi, saklama süreleri (MZmine kullanan örnekler arasında hizalanmış), teorik olarak tam 13C etiketli negatif mod m/z değerleri, algılanan özelliklerin m/z değerleri ve hesaplanan kütle hataları. Bu Tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
Özetlenen HPLC-RID yaklaşımı, şeker substrat tüketimini ve daha sonra zaman içinde lisat merkezi metabolizmanın ana organik asit ve alkol ürünlerine dönüşümlerini başarıyla ölçmek için kullanılabilir. Ayrıca, bu protokol tek bir mobil faz kullanarak basit bir izokratik yöntem kullanıyor, minimum numune hazırlama gerektiriyor ve basit bir hedeflenen aşağı akış analizine izin veriyor. HPLC-RID yöntemiyle ölçülen analizler, yalnızca saklama süreleri ve dolayısıyla seçilen sütun reçinesi ile etkileşimleri ile ayırt edilir. Burada kullanılan HPLC sütunu özellikle karbonhidratları, organik asitleri ve alkolleri boyut dışlama ve ligand değişimini (yani iyon moderatörlü bölme kromatografisi) birleştirerek ayırmak için tasarlanmıştır. Bu nedenle, açıklanan yöntem, karbonhidrat substratlarının daha hedefli analizi ve öncelikle lisat bazlı biyo-dönüşümleri kolaylaştırması ve enerji vermesi beklenen glikoz fermantasyon yollarının son ürünlerini seçmek için yararlıdır8,15,21. Ancak, bu protokol hücre özlerinde diğer metabolik yolların aktivasyonunu hesaba katmaz. Amino asitler ve şeker fosfatları23 ,24gibi diğer metabolitleri tespit etmek için diğer kromatografik ayırma tekniklerini (yani hidrofilik etkileşim kromatografisi), gradyan elütasyon yöntemlerini, daha karmaşık numune hazırlamayı (yani türetmeyi) ve farklı optik dedektörleri (örneğin, ultraviyole ışık veya buharlaştırıcı ışık saçılma dedektörleri) kullanan boru hatları kullanılabilir. . Alternatif olarak, LC-MS/MS kullanılarak lysate metabolizmasını incelemek için küresel bir yaklaşım alınabilir.
Açıklanan LC-MS/MS yöntemi, daha geniş bir metabolit aralığını ölçmek ve tanımlamak için tek bir iş akışıdır. LC-MS/MS, metabolitleri tutma süresine ve yüksek çözünürlüklü m/z oranlarına göre ayırt etme hassasiyeti ve yeteneği nedeniyle metabolom profilleme için son teknoloji ürünü bir analitik araçtır16. Merkezi karbon metabolik yolları ve amino asit anabolizması üzerinde durulan negatif mod MS/MS, özellikle polar organik asitleri, şeker fosfatlarını ve amino asitleri tespit etmek için uygulanmıştır. Nano-sıvı kromatografi tekniği ile birleştiğinde, yöntem karmaşık lisat arka plan17'dekiküçük molekülleri tespit etmek için yüksek hassasiyet sağlar. Bununla birlikte, lysate tabanlı CFME metabolizmasının profillerinin profillendirilmesi açısından, açıklanan LC-MS / MS protokolünün bir sınırlaması, 50 m / z'lik alt algılama sınırıdır, bu da lysate glikoz metabolizmasında önemli bir ürün olan etanolün ve her ikisinin de ayrıntılı HPLC-RID yöntemiyle kolayca ölçülen formatlanmasını önler. LC-MS/MS ile karşılaştırıldığında, HPLC-RID maliyet ve zorluk açısından göreceli erişilebilirliğin ek avantajına sahiptir. İkinci noktaya kadar, burada açıklanan LC-MS/MS yönteminin sorunlarını gidermek, kütle spektrometresinde bir dereceye kadar uzmanlık gerektirebilir. Bununla birlikte, MS algılaması, metabolomlardaki etiketli izotopları da ayırt edebildiğinden RID üzerinde benzersiz çekici uygulamalara sahiptir, karmaşık lisat metabolik ağ aracılığıyla karbon hareketini takviyeli substratlardan anlamak için mükemmel bir teknik18. Burada 13C6-glikoz ile reaksiyonları destekleyerek ve aşağı akış 13C içeren metabolitlerin göreceli bolluk değerlerini analiz ederek böyle bir yaklaşım uygulandı. Analiz, aktif ve aktif olmayan yolların tanımlanmasına izin vererek, daha önce bildirilen varsayımları destekledi ve lisatlardaki metabolik akı hakkında yeni içgörüler sağladı. Belirli analizler için yöntem dahilinde değişiklikler de yapılabilir. Örneğin, 13C etiketli hedef bileşiğin standart çözümleri, zaman içinde glikoz türevi moleküllerin mutlak nicel ölçümlerini elde etmek ve akı dağılımları hakkında sonuçlar çıkarmak için numunelerle birlikte analiz edilebilir. Pozitif yüklü bileşiklerin daha iyi algılanması, pozitif mod algılama için ayarlanmış .meth dosyalarıyla diziler çalıştırılarak mevcut iş akışında da etkinleştirilebilir.
Açıklanan her iki yöntemde de analitik örnekleme, yüksek tekrarlanabilirlik sağlayarak uygun şekilde otomatikleştirilmiştir. Ayrıca, uygun cihaz taşıma uygulamaları ve bakımı gözlendiği sürece sorunsuz analitik çalıştırmalar beklenebilir. CFME reaksiyonlarını analiz etmek için bu araçları kullanırken, örneklemenin yukarı ve aşağı akışında daha kritik hususlar yapılmalıdır. Numune hazırlama sırasında, zaman kursu kontrollerinin zaman sıfırı temsili olması önemlidir. Burada, metabolik reaksiyonları durdurmak için asitleşme ile proteinler lysates çökebilirsiniz. Zaman sıfır örnekleri için, asit çözücü glikoz içeren reaksiyon karışımını eklemeden önce lysate ile birleştirildi. Trikloroasetik asit ile asitleşme, HPLC-RID verilerinde gösterildiği gibi glikozun sıfır zamanında metabolize edilmesini etkili bir şekilde sağlamıştır (Şekil 2). Bildirilen LC-MS/MS analizinde glikoz metabolizmasını söndürmek için benzer bir prosedür yapılırken, daha sonraki zaman noktalarında çıkarılan örneklere göre önemli ölçüde düşük bolluk değerlerinde de olsa, zaman sıfır örneklerinde 13C etiketli metabolit tespit edildi. Ayrıca, bu gözlemler glikoliz ara maddeleri ile sınırlıydı. Veriler, reaksiyonların bu son derece hassas yöntemle tespit edilen ekstraksiyon çözücü ile asitleşmeden sonra bir dereceye kadar glikolitik aktiviteyi koruduğunu göstermektedir. Ancak bu etkinliğin kapsamı ölçülmelidir. Önceki bir çalışma, asidik ekstraksiyon çözücülerinin ara glikolitik reaksiyonları yeterince söndürmeyebileceğini, ancak önemli glikoz tüketimini durdurabileceğinibildirmiştir 10. Bu, burada kullanılan sistemde daha fazla araştırılmaya devam ederken, zaman-sıfır ve daha sonraki zaman noktası örnekleri arasındaki göreceli bolluk değerlerindeki sert değişiklikler glikoz metabolizmasındaki eğilimler olarak yorumlanabilir. Bununla birlikte, alternatif söndürme yöntemlerinin araştırılması, özellikle mutlak miktarlarda metabolik ara madde elde etmek için benzer uygulamalarda tavsiye edilir10. Ayrıca, aşağı akış yazılım analizleri sırasında iyi uygulamalar da gözlenmelidir. İnsan hatasını azaltmak için RID sinyallerinden tepe alanlarını manuel olarak entegre ederken tutarlılık zorunludur. Manuel entegrasyon, numunelerdeki metabolit konsantrasyonlarını ölçmek için manuel olarak entegre edilmiş tepe alanları kullanıldığında standartların tepe alanlarına da uygulanmalıdır. Hedeflenen LC-MS/MS analizi boyunca, MZmine analizinden gelen belirsiz ek açıklamalar, MS kalitesinde bir tarayıcı kullanılarak manuel tepe denetimi ile doğrulanmalı ve m/z özellikleri yalnızca hesaplanan kütle hataları kabul edilebilir olduğunda açıklama eklenmelidir. Burada, izotop arama için kapsamlı ve sağlam yazılım henüz belirlenmediğinden, bu analizler sınırlı bir hedef kümesi için manuel olarak gerçekleştirildi. Bununla birlikte, 13C etiketli metabolitleri aramak için bu tür otomatik yöntemler şu anda ortaya çıkıyor ve merkezi karbon metabolizması25'inötesindeki lysates'in profil oluşturması gibi daha karmaşık analizleri de kolaylaştıracaktır.
Gelişmiş sıvı kromatografisi, karmaşık metabolik karışımlarda küçük molekülleri ayırmak için sağlam ve yaygın olarak uygulanan bir yöntemdir11. Açıklanan yöntemler, lysate tabanlı CFME reaksiyonlarında metabolit dönüşümlerini başarıyla analiz etmek için bu ayırma tekniğini kırılma indeksi veya kütle spektrometrik algılaması ile birleştirilmiştir. HPLC-RID ve LC-MS/MS, aktif lysate metabolizmasını profilleme için ayrı ayrı güçlü araçlardır ve tamamlayıcılıkları her tekniğin doğal sınırlamalarını gidermek için daha da kullanılabilir. Bildirilen yöntemler, lysate metabolizmasını anlamak, hedeflenen metabolit dönüşümlerindeki gelişmeleri izlemek ve lysate metabolizmasını manipüle ederken metabolit akısına yapılan değişiklikleri emmek için kullanılabilecekleri için CFME'nin uygulanmasını ve geliştirilmesini sağlar.
Açıklamalar
Yazarlar, bilinen rakip finansal çıkarları veya diğer çıkar çatışmaları olmadığını beyan ederler.
Teşekkürler
Bu araştırma, Bitki Mikrop Arayüzleri Bilimsel Odak Alanı (http://pmi.ornl.gov) kapsamında Genomik Bilim Programı, ABD Enerji Bakanlığı, Bilim, Biyolojik ve Çevre Araştırmaları Ofisi tarafından desteklenmiştir. Oak Ridge Ulusal Laboratuvarı, DE-AC05-00OR22725 sözleşmesi kapsamında ABD Enerji Bakanlığı için UT-Battelle, LLC tarafından yönetilmektedir. Bu makale UT-Battelle, LLC tarafından ABD Enerji Bakanlığı ile DE-AC05- 00OR22725 Sözleşmesi kapsamında yazılmıştır. Amerika Birleşik Devletleri Hükümeti makaleyi yayınlanmak üzere kabul ederek, Amerika Birleşik Devletleri Hükümeti'nin bu makalenin yayınlanmış formunu yayınlamak veya çoğaltmak veya başkalarının bunu yapmasına izin vermek için münhasır olmayan, ödenmiş, geri alınamaz, dünya çapında bir lisansa sahip olduğunu kabul eder. Enerji Bakanlığı, DOE Kamu Erişim Planı (http://energy.gov/downloads/doe-public-access-plan) uyarınca federal sponsorlu araştırmaların bu sonuçlarına kamu erişimi sağlayacaktır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 μm centrifuge tube filters (spin columns) | Corning Costar | 8160 | |
| 1.5 mL microcentrifuge tubes | VWR | 87003-294 | |
| 1260 Infinity Binary LC Pump | Agilent | G1312B | HPLC-RID system |
| 1260 Infinity High Performance Degasser | Agilent | G4225A | HPLC-RID system |
| 1260 Infinity Refractive Index Detector | Agilent | G7162A | HPLC-RID system |
| 1260 Infinity Standard Autosampler | Agilent | G1329B | HPLC-RID system |
| 13C6-glucose | Sigma-Aldrich | 389374 | CFME reaction mix component (LC-MS/MS) |
| 500 mL 0.20 μm pore (PES membrane) filter | VWR | 10040-436 | |
| Acetonitrile (LC/MS grade) | Fisher Scientific | A955 | Solvent preparation for LC-MS/MS |
| Adenosine triphosphate | Sigma-Aldrich | A7699 | CFME reaction mix component |
| Aminex HPX 87-H column | Bio-rad | 1250140 | Chromatography column for HPLC-RID |
| Ammonium acetate (LC/MS grade) | Fisher Scientific | A11450 | Solvent preparation for LC-MS/MS |
| Ammonium glutamate | Sigma-Aldrich | G1376 | CFME reaction mix component |
| Autosampler vial caps (yellow, snap) | Thermo Scientific | C4011-50Y | Sample storage/delivery for LC-MS/MS |
| Autosampler vials (0.30 mL, polypropylene) | Wheaton | W225181 | Sample storage/delivery for LC-MS/MS |
| Benchtop microcentrifuge | Fisher Scientific | 13-100-675 | |
| Bis-Tris | Sigma-Aldrich | B9754 | CFME reaction mix component |
| Coenzyme A (CoA) | Sigma-Aldrich | C4282 | CFME reaction mix component |
| D-dextrose (Glucose) | VWR | BDH9230 | CFME reaction mix component |
| Dipotassium phosphate | Sigma-Aldrich | P8281 | CFME reaction mix component |
| Ethanol | Fisher Scientific | BP2818100 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Formic acid (LC/MS grade) | Thermo Scientific | 85178 | Solvent preparation for LC-MS/MS |
| Fused silica (internal diameter of 100 μm, external diameter of 375 μm) | Polymicro Technologies | WM22005-ND | Chromatography column for LC-MS/MS |
| Glacial acetic acid | Sigma-Aldrich | A6283 | S30 buffer ingredient |
| Isopropanol (LC/MS grade) | Fisher Scientific | A461 | Solvent preparation for LC-MS/MS |
| Kinetex 5 μm C18 stationary phase (100 Å) | Phenomenex | N/A; special order | Chromatography column for LC-MS/MS |
| LTQ Orbitrap Velos Pro Mass Spectrometer | ThermoFisher Scientific | N/A; special order | Mass spectrometer for LC-MS/MS |
| Magnesium acetate | Sigma-Aldrich | M5661 | S30 buffer ingredient |
| Magnesium glutamate | Sigma-Aldrich | 49605 | CFME reaction mix component |
| Methanol (LC/MS grade) | Fisher Scientific | A456 | Solvent preparation for LC-MS/MS |
| NAD+ | Sigma-Aldrich | N0632 | CFME reaction mix component |
| Nanospray Ionization Source | ThermoFisher Scientific/Proxeon | ES071 (newest model) | Mass spectrometer for LC-MS/MS |
| OpenLab CDS (Online) Software | Agilent | Version 2.15.26 | Chromatography Data System for acquiring and analyzing HPLC data |
| Orbitrap Velos Pro LTQ Tune Plus Software | Thermo | Version 2.7 | Software for tuning the LC-MS/MS system |
| Potassium acetate | Sigma-Aldrich | P1190 | S30 buffer ingredient |
| Potassium glutamate | Sigma-Aldrich | G1501 | CFME reaction mix component |
| Refrigerated centrifuge | Eppendorf | 5415 C | |
| Screw caps (with septa, 9 mm) | Supelco | 29315-U | Sample storage/delivery for HPLC-RID |
| Screwthread glass vials (2 mL) | Supelco | 29376-U | Sample storage/delivery for HPLC-RID |
| Sodium acetate | Sigma-Aldrich | 241245 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium formate | Sigma-Aldrich | 247596 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sodium lactate | Sigma-Aldrich | 71716 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Succinic acid | Sigma-Aldrich | 398055 | Dissolved in S30 buffer for standard curve solution preparation (HPLC-RID) |
| Sulfuric acid | Sigma-Aldrich | 258105 | Solvent preparation for HPLC-RID |
| Trichloroacetic acid | Sigma-Aldrich | T6399 | |
| Tris-acetate | GoldBio | T-090-100 | S30 buffer ingredient |
| Ultimate 3000 LC with autosampler | Dionex | Solvent Rack: SRD-3600 | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Binary Pump: HPG-3400RS | Liquid chromatography system for LC-MS/MS analysis |
| Ultimate 3000 LC with autosampler | Dionex | Rapid Separation Well Plate Autosampler: WPS-3000TRS | Liquid chromatography system for LC-MS/MS analysis |
| Water (LC/MS grade) | Fisher Scientific | W6500 | Solvent preparation for LC-MS/MS |
| Xcalibur Software | Thermo | Version 3.0.63 | Data acquisition and interpretation software for LC-MS/MS |
Referanslar
- Rollin, J. A., et al. High-yield hydrogen production from biomass by in vitro metabolic engineering: Mixed sugars coutilization and kinetic modeling. Proceedings of the National Academy of Sciences of the United States of America. 112, 4964-4969 (2015).
- Bowie, J. U., et al. Synthetic biochemistry: The bio-inspired cell-free approach to commodity chemical production. Trends in Biotechnology. 38 (7), 766-778 (2020).
- Korman, T. P., Opgenorth, P. H., Bowie, J. U. A synthetic biochemistry platform for cell free production of monoterpenes from glucose. Nature Communications. 8, 1-8 (2017).
- Dudley, Q. M., Nash, C. J., Jewett, M. C. Cell-free biosynthesis of limonene using enzyme-enriched Escherichia coli lysates. Synthetic Biology. 4 (1), 003 (2019).
- Garcia, D. C., et al. Elucidating the potential of crude cell extracts for producing pyruvate from glucose. Synthetic Biology. 3, (2018).
- Kay, J. E., Jewett, M. C. Lysate of engineered Escherichia coli supports high-level conversion of glucose to 2,3-butanediol. Metabolic Engineering. 32, 133-142 (2015).
- Mohr, B., Giannone, R. J., Hettich, R. L., Doktycz, M. J. Targeted growth medium dropouts promote aromatic compound synthesis in crude E. coli cell-free systems. ACS Synthetic Biology. 9, 2986-2997 (2020).
- Garcia, D. C., et al. A lysate proteome engineering strategy for enhancing cell-free metabolite production. Metabolic Engineering Communications. 12, 00162 (2021).
- Karim, A. S., Jewett, M. C. Cell-free synthetic biology for pathway prototyping. Methods in Enzymology. 608, 31-57 (2018).
- Cui, J., et al. Developing a cell-free extract reaction (CFER) system in Clostridium thermocellum to identify metabolic limitations to ethanol production. Frontiers in Energy Research. 8, 72 (2020).
- Coskun, O. . Separation Tecniques: Chromatography. 3, (2016).
- Bernardes, A. N., et al. Organic acids and alcohols quantification by HPLC/RID in sugarcane vinasse: analytical method validation and matrix effect assessment. International Journal of Environmental Analytical Chemistry. 101, 325-336 (2021).
- Garcia, D. C., et al. Computationally guided discovery and experimental validation of indole-3-acetic acid synthesis pathways. ACS Chemical Biology. 14, 2867-2875 (2019).
- Karim, A. S., Rasor, B. J., Jewett, M. C. Enhancing control of cell-free metabolism through pH modulation. Synthetic Biology. 5, (2020).
- Bujara, M., Schümperli, M., Billerbeck, S., Heinemann, M., Panke, S. Exploiting cell-free systems: Implementation and debugging of a system of biotransformations. Biotechnology and Bioengineering. 106, 376-389 (2010).
- Xiao, J. F., Zhou, B., Ressom, H. W. Metabolite identification and quantitation in LC-MS/MS-based metabolomics. TrAC - Trends in Analytical Chemistry. 32, 1-14 (2012).
- Asensio-Ramos, M., Fanali, C., D'Orazio, G., Fanali, S. Nano-liquid chromatography. Liquid Chromatography: Fundamentals and Instrumentation: Second Edition. 1, 637-695 (2017).
- Nagana Gowda, G. A., Djukovic, D. Overview of mass spectrometry-based metabolomics: Opportunities and challenges. Methods in Molecular Biology. 1198, 3-12 (2014).
- O'Kane, P. T., Dudley, Q. M., McMillan, A. K., Jewett, M. C., Mrksich, M. High-throughput mapping of CoA metabolites by SAMDI-MS to optimize the cell-free biosynthesis of HMG-CoA. Science Advances. 5, (2019).
- Creasy, D. M., Cottrell, J. S. Unimod: Protein modifications for mass spectrometry. Proteomics. 4 (6), 1534-1536 (2004).
- Dudley, Q. M., Anderson, K. C., Jewett, M. C. Cell-free mixing of Escherichia coli crude extracts to prototype and rationally engineer high-titer mevalonate synthesis. ACS Synth Biol. 5 (12), 1578-1588 (2016).
- Jaishankar, J., Srivastava, P. Molecular basis of stationary phase survival and applications. Frontiers in Microbiology. 8, 2000 (2017).
- Bartolomeo, M. P., Maisano, F. Validation of a reversed-phase HPLC method for quantitative amino acid analysis. Journal of Biomolecular Techniques. 17, 131-137 (2006).
- Hauck, T., Landmann, C., Brühlmann, F., Schwab, W. Formation of 5-methyl-4-hydroxy-3[2H]-furanone in cytosolic extracts obtained from Zygosaccharomyces rouxii. Journal of Agricultural and Food Chemistry. 51, 1410-1414 (2003).
- Huang, H., Yuan, M., Seitzer, P., Ludwigsen, S., Asara, J. M. IsoSearch: An untargeted and unbiased metabolite and lipid isotopomer tracing strategy from HR-LC-MS/MS datasets. Methods and Protocols. 3 (3), 54 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır