Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Arabidopsis Tohumlarının Yüzey Sterilizasyonu için Yüksek Verimli, Sağlam ve Son Derece Esnek Yöntem
Bu Makalede
Özet
Arabidopsisthaliana (Arabidopsis) tohumlarının yüzey sterilizasyonu için yüksek verimli bir protokol sağlanır ve sıvı taşıma adımlarını vakum pompası ile inşa edilmiş basit bir emiş cihazı ile optimize eder. Bir günde yüzlerce tohum örneği yüzey sterilize edilebilir.
Özet
Arabidopsis, fonksiyonel çalışmalar için en yaygın kullanılan bitki modeli türüdür. Arabidopsis tohumlarının yüzey sterilizasyonu bu amaçla gerekli olan temel bir adımdır. Bu nedenle, aynı anda onlarca ila yüzlerce örneği (örneğin transgenik çizgiler, ekotipler veya mutantlar) işlemek için yüksek verimli Arabidopsis tohum yüzey sterilizasyon yöntemleri oluşturmak çok önemlidir. Bu çalışmada, ortak bir vakum pompasından üretilen ev yapımı bir emme cihazı ile tüplerdeki sıvının verimli bir şekilde ortadan kaldırılmasına dayanan bir tohum yüzey sterilizasyon yöntemi sunulmuştur. Bu yöntemle emek yoğun uygulamalı zamanı önemli ölçüde azaltarak, bir günde birkaç yüzlerce numuneyi işlemek çok az çabayla mümkündür. Seri zaman seyri analizleri, yüksek çimlenme oranlarını koruyarak yüzey sterilizasyonunun son derece esnek bir zaman aralığına işaret etti. Bu yöntem, tohum boyutuna göre emme cihazının basit bir şekilde özelleştirilmesi ve sıvının ortadan kaldırılması için istenen hız ile diğer küçük tohum türlerinin yüzey sterilizasyonu için kolayca uyarlanabilir.
Giriş
Arabidopsis, Brassicaceae familyasına ait bir diploid bitki türüdür. Nispeten kısa yaşam döngüsü (uzun gün yetiştirme koşullarında nesil başına iki ay), küçük bitki büyüklüğü ve bitki başına yüzlerce tohum üretimi ile kendi kendine tozlaşması onu ilk temel bitki modeli türü1,2yaptı. Buna ek olarak, genomu tamamensıralanmıştır 3, kapsamlı ters genetik araçları (doymuş T-DNA, transposon ve kimyasal olarak mutajened popülasyonlar)mevcuttur 4,5,6ve etkili Agrobacteriumaracılı dönüşüm, daha fazla aşağı akış çalışması için yeterli transgenik çizgi elde etmek için iyi kurulmuştur7 . Bu nedenle, son yirmi yıl boyunca, arabidopsis'i, doğal, genetik ve fenotipik varyasyon8,9dahil olmak üzere moleküler düzeyde bitki biyolojisinin çeşitli yönlerini parçalamak için bir model tür olarak kullanarak büyük ilerlemeler elde edilmiştir.
Arabidopsis'e ilgi genlerini işlevsel olarak karakterize etmek için, mantar ve bakteriyel kirleticileri ortadan kaldırmak için tohum yüzey sterilizasyonu, aksinik kültürler gerektiren birçok aşağı akış protokolü için ön koşul adımıdır. Gen fonksiyonunun aşırı ekspresyonu10, devirme (RNA-I11)veya nakavt (genom düzenleme12,13),hücre altı lokalizasyonu14, promotör aktivitesi15 , 16,protein-protein17ve protein-DNA etkileşimi18için genetik dönüşüm , sadece en yaygın uygulamalardan alıntı yapmak için, hepsi bir tohum yüzey sterilizasyonu adımı gerektirir. Bu nedenle, göreceli basitliğine rağmen, tohum yüzey sterilizasyonu birçok fonksiyonel analizde temel bir rol oynar.
Şimdiye kadar, gaz veya sıvı fazlı sterilizasyon19temel alınarak iki ana tohum yüzey sterilizasyonu yöntemi kategorisi geliştirilmiştir. Gaz fazlı tohum yüzey sterilizasyonunun verimi orta ila yüksek olsa da, tehlikeli reaktif klor gazını yüzey sterilizasyon maddesi olarak kullanmak geniş uygulamasını engellemiştir. Sıvı fazlı sterilizasyona dayanan yöntemler, aksine, yüzey sterilizasyonu için etanol ve çamaşır suyu çözeltileri gibi daha hafif kimyasallara dayanır ve doğal olarak klor fümigasyonundan daha düşük verime sahip olmalarına rağmen daha yaygın olarak kullanılırlar. Genel olarak, sıvı reaktifleri kullanan iki farklı yöntem yaygın olarak kullanılmaktadır. Büyük ölçüde kullanılan bir yöntem, farklı konsantrasyonlarda etanol ve çamaşır suyu ile farklı sürelerde yıkamaya dayanır20,21. Başka bir yöntem çamaşır suyu uygulamasına dayanır sadece21,22. Her iki yöntem de esas olarak küçük ölçekli tohum yüzey sterilizasyonu için uygulanmaktadır. Bununla birlikte, birçok deneyde, bir dönüşümden türetilen birçok Arabidopsis transgenik çizginin taranması gerekir15,23 veya ekran paralel olarak farklı dönüşümlerden oluşturulan birçok transgenik çizgi 24,25. Bilgimiz dahilinde, yüksek verimli tohum yüzey sterilizasyonu için sıvı bazlı bir yöntem yayınlanmamıştır, bu da çok az tanınmasına rağmen, fonksiyonel genomik yaklaşımlar için önemli bir darboğaz oluşturmaktadır. Bu nedenle, tohum yüzey sterilizasyonu için güvenli, sağlam ve yüksek verimli yöntemler geliştirmek, birçok genin aynı anda fonksiyonel karakterizasyonunun başarısı için gerekli ve kritik bir adımdır.
Bu amaçla, mevcut çalışmada, Arabidopsis tohumlarının yüzey sterilizasyonu için geliştirilmiş bir yöntem sunulmuştur. Bu yöntem güvenli, düşük maliyetli, son derece sağlam ve yüksek verime sahiptir ve tohum yüzey sterilizasyonunun başlangıcından Petri kaplarında tohum ekiminin sonuna kadar bir saat içinde 96 bağımsız hattın işlenmesine izin verir. Gösterilen yöntem, vakum pompası, sarf malzemesi züccaciye ve plastik gereçler gibi yaygın olarak bulunan temel laboratuvar araçlarına dayanmaktadır. Bu geliştirilmiş yöntem, arabidopsis ve diğer model olmayan bitki türlerinde modern fonksiyonel genomik yaklaşımlara yeterli bir verimle tohum yüzey sterilizasyonunu kolaylaştırmak için bilim topluluğuna güvenli, basit ve uygun fiyatlı bir yaklaşım sağlar.
Protokol
1. Reaktifler ve medya hazırlama
- %70 etanol çözeltisi hazırlayın: 263 mL damıtılmış suya %95 teknik etanolden 737 mL ekleyin. İyice karıştırın.
NOT: Steril olmayan bir çalışma tezgahında %70 etanol çözeltisi hazırlayın.
DİkKAT: Etanol oldukça yanıcıdır ve gözlere ciddi tahrişe neden olabilir. Alevlerden ve ısı kaynaklarından uzak tutun. Gözlerle temas halinde bol su ile durulayın. - % 5 çamaşır suyu çözeltisi hazırlayın: 95 mL steril damıtılmış suya 5 mL ev çamaşır suyu (Sodyum hipoklorit, NaClO'nun ~ % 3,5'ini içerir) ekleyin. Birkaç damla iyonik olmayan deterjan ekleyin (örneğin, Ara 20) ve iyice karıştırın.
NOT: Laminar davlumbazın içine %5 çamaşır suyu çözeltisi hazırlayın.
DİkKAT: Çamaşır suyunun aktif bileşeni olan sodyum hipoklorit oldukça tahriş edicidir. Oldukça aşındırıcıdır ve gastrointestinal sisteme ciddi zararlar verebilir. Temas durumunda, hemen bol su ile durulayın. Yutulması durumunda, tedavi tavsiyesi için zehir kontrol merkezini veya bir tıp doktorunun aramasını isteyin. - Yarı mukavemetli Murashige ve Skoog (1/2 MS) orta26 hazırlayın.
- 800 mL damıtılmış suya 2,2 g MS orta tozu (vitaminler dahil) ve 10 g sakkaroz ekleyin. Çözeltinin pH'ını 1 M KOH kullanarak ayarlayın ve damıtılmış su kullanarak hacmi 1 L'ye kadar getirin. 1 L şişeye Aliquot 500 mL ve sağlam bir ortam hazırlamak için 4g agar ekleyin. Çözümü otomatik olarak örtün.
- Otoklavlamadan sonra, orta ila 50-53 ° C'yi bir su banyosunda soğutun ve laminar akış başlığının altındaki Petri kaplarına dökün. Seçici ortamı hazırlamak için, 50 mg/mL kanamycin stok çözeltisinin 1000 μL/L'sini ekleyin (10 mL damıtılmış suda 500 mg Kanamycin sülfat monohidrat karıştırın, sterilize edin ve -20 °C'de saklayın) ortasına (50-53 °C). Dönerek iyice karıştırın ve daha önce de belirtildiği gibi Petri tabaklarına dökün.
2. Aspiratör kurulumu
NOT: Cihaz kurulumu Şekil 1'de özetlenmiştir.
- Vakum pompası giriş kısmını uygun boyutta bir polietilen (PE) tüpün bir ucuna bağlayın. Tüpün diğer ucunu kaynatma şişesinin iki yönlü kapağının çıkışına bağlayın. Hava geçirmez bağlantı sağlamak için borunun kavşağını bir sızdırmazlık filmi(Malzeme Masası)ile sıkıca sarın.
- İkinci bir PE tüpünü, dekantasyon şişeslerindeki vida kapağının girişine (şişenin içine çıkıntılı delik) bağlayın. Tüpün diğer tarafını bir akvaryum vanasının çıkışına takın. Gerekirse, hava kaçağını ortadan kaldırmak için kavşak boyunca bir sızdırmazlık filmi ile sarın.
- Kullanmadan hemen önce, laminar akış başlığının altındaki akvaryum filtresinin girişine steril bir 200 μL pipet ucu takın.
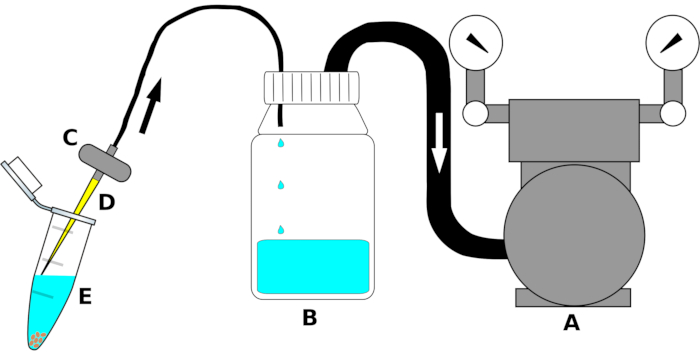
Şekil 1: Sterilizasyon sıvılarının yüksek verimli bir şekilde çıkarılması için emme cihazının şematik çizimi. Netlik için, tek parçalar ölçeklemek için çizilmez. Harf (A) vakum pompasını, (B) sıvıları (etanol, çamaşır suyu veya steril su), (C) sıvıların reflüsünü önlemek için valf, (D) steril 200 μL pipet ucunu ve (E) tohum ve sterilizasyon sıvısı içeren 1,5 mL mikrosantrifüj tüpünü gösterir. Oklar hava akımının yönünü gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Tohumların yüksek verimli sıvı yüzey sterilizasyonu
NOT: Arabidopsis thaliana (L.) Heynh wild-type (Col-0) (Arabidopsis) tohumlarının 96 bağımsız örneklem ile yüzey sterilizasyonu için gereken genel prosedür ve minimum süre Şekil 2'deözetlenmiştir.
- Kalıcı bir işaretleyici ile etiket, aşamalı sayılara sahip 48 x 1,5 mL mikrosantrifüj tüplerden oluşan iki parti.
- 96 steril 1,5 mL mikrosantrifüj tüpünün her birine (tüpün konik ucunun dibinden yaklaşık 1-2 mm yukarıda) 100-200 Arabidopsis tohumu ekleyin.
- Aliquot yaklaşık 1000 μL her tüpe% 70 etanol laminer akış davlumbazının içinde 10 mL steril serolojik pipet kullanarak (tohum toplu bir, 48 tüp) ve kapakları dikkatlice kapatın.
NOT: Dağıtılan hacim tohum hacminden birkaç kat daha yüksek olduğu sürece, çözeltilerin dağıtılmasının son derece doğru olması gerekmez. Alternatif olarak, bu adımı laminar davlumbazın dışında gerçekleştirin (steril olmayan durum). - Tüpleri bir çalkalayıcıda en az 3 dakika boyunca 8,0 Hz salınım frekansında sallayın.
- Adaptörleri çalkalayıcıdan çıkarın ve bir tezgah üstü mikrosantrifüj sepetine aktarın.
- 1880 x g'a (~15 sn) ulaşmak için darbe işlevini (çoğu tezgah üstü santrifüjde bulunur) kullanarak tohumları hızla aşağı çevirin.
NOT: Daha uzun süre veya daha yüksek santrifüjleme kuvvetleri tohum çimlenmesini olumsuz yönde etkiler. - 48 tüpü adaptörlerden tek bir rafa aktarın ve laminar akış başlığının altındaki tüm tüpleri açın. Kapakların borulara sığan kısmına dokunmayarak kirlenmelerden kaçının. Kapaklar birbirine çok yakınsa, daha kolay kullanım için tüpleri iki rafa bölün.
- Laminar akış başlığının altındaki ev yapımı aspiratörün akvaryum valfi girişine steril 200 μL sarı bir uç takın ve pompayı kapatın.
- Sıvıyı emerken tohumlara dokunmamak için sarı ucu tohumların seviyesinin hemen üzerine yerleştirin. Alternatif olarak, ucu tüpün altına hızlı bir şekilde yerleştirin; bir tohum sıvının emilmesini engelliyorsa, sarı ucu ortadan kaldırın ve yeni bir tane takın.
- Aliquot, laminar akış davlumbazının içindeki 10 mL steril serolojik pipet kullanarak her tüpe yaklaşık 1000 μL% 5 çamaşır suyu.
- Tüm kapakları sıkıca kapatın ve tüm tüpleri çalkalayıcı adaptörlere geri koyun. Tüpleri çalkalayıcıda en az 3 dakika boyunca 8,0 Hz salınım frekansında sallayın.
- 1880 x g'a (~15 sn) ulaşmak için gereken süre boyunca tezgah üstü santrifüjün darbe işlevini kullanarak tohumları hızla aşağı çevirin.
- Laminer akış başlığının altındaki vakum pompasına bağlı akvaryum valfine yeni bir steril 200 μL sarı uç takın ve pompayı kapatın.
- Çamaşır suyu çözeltisini emerken tohumlara dokunmamak için sarı ucu tohumların seviyesinin üzerine yerleştirin.
- Aliquot, laminer akış davlumbazında 10 mL steril serolojik pipet kullanarak yaklaşık 1000 μL sterilize edilmiş H2O tüpüne girer.
NOT: Çalışma süresini en aza indirmek için iki tohum grubunu birleştirin. - Laminar akış başlığının altındaki vakum pompasına bağlı akvaryum valfine yeni bir steril 200 μL sarı uç takın ve pompayı kapatın.
- H2O'yu emerken tohumlara dokunmamak için sarı ucu tohumların seviyesinin hemen üzerine yerleştirin.
- Aliquot, 10 mL steril serolojik pipet kullanarak yaklaşık 500 μL sterilize edilmiş H2O'ya girer ve laminer akış davlumbazındaki tüm kapakları kapatır. Tohumlar ekilmeye hazır. Gerekirse, tüpleri oda sıcaklığında en fazla birkaç saat veya gece boyunca 4 °C'de tutun.
- Sıvı toplamak için kullanılan rezervuar şişesini yeterli miktarda su ile doldurun ve otoklavlayın. Daha sonra, sıvıyı normal bir lavaboya atın.
NOT: Rezervuar içindeki tüm tohumları öldürmek için sıvıyı otoklavlayın.
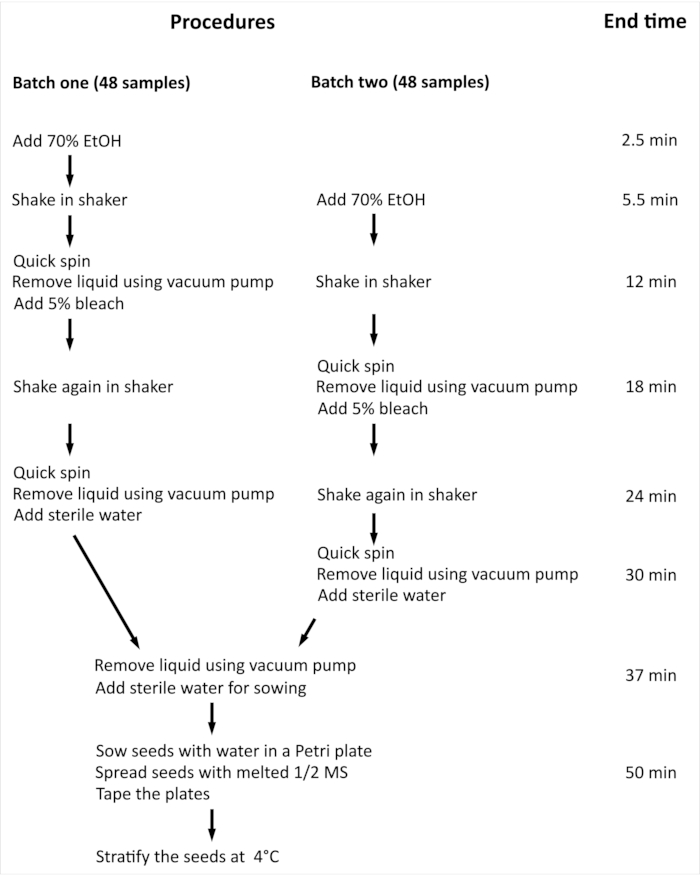
Şekil 2: Arabidopsis tohumlarının 96 bağımsız numune ile yüzey sterilizasyonu için gereken prosedüre ve minimum süreye genel bakış. Sunulan deneyde, 96 bağımsız örnek iki eşit büyüklükte parti halinde işlenir. Tüm yordam her iki toplu iş için de aynıdır ve paralel olarak işlenir, ancak ikinci toplu iş, birinci toplu işle karşılaştırıldığında bir adım gecikmeyle işlenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. 1/2 MS plakalarda Arabidopsis kaplama ve puanlama
- Tohumları ve 300-400 μL steril H2O'yu 1000 μL pipetle hafif pipetleme ile bir Petri kabına aktarın.
- 10 tüp aktardıktan sonra, her bir tabağa antibiyotiksiz erimiş 1/2 MS ortamın 1,5-2,0 mL civarında dökün.
NOT: Önceden eritin ve katılaşmayı önlemek için 1/2 MS erimiş ortamı 50-53 °C'de ayarlanmış bir termostatik banyoda tutun. Tohumların çimlenebilirliğini azaltmak için sıcaklığın 58 ° C'yi aşmamasını sağlayın. - İçindeki tohumları dağıtmak için tabağı hızla döndürün. Plakaları karşı tarafa bantlayın.
- Plakaları plastik veya alüminyum bir folyoya sarın ve ardından düzgün çimlenme elde etmek için karanlıkta 3 gün boyunca bir buzdolabına (4 °C) yerleştirin.
- Plakaları 100-120 μmol·m -2 ·s-1 ve %60 bağıl nem yoğunluğunda uzun gün koşullarında (16 saat ışık/8 saat karanlık)23°C'de ayarlanmış bir büyüme odasına aktarın.
- İki gün sonra, bitkileri radik varlığı ile puanlayın. Tohum çimlenmesini değerlendirmek için radik ortaya çıkışını ve yeşil cotyledon oluşumunu (iki cotyledon'un tam açıklığı) tespit edin.
5. İstatistiksel analizler
NOT: Burada istatistiksel analizler için Tukey'in çift yönlü testi kullanılmıştır.
- 0.01'in altındaki P değerlerini istatistiksel olarak anlamlı olarak düşünün. Tüm deneyleri en az beş biyolojik kopya ile gerçekleştirin.
Sonuçlar
Tüm tohum sterilizasyon prosedürü için gereken süreyi değerlendirmek için, mevcut protokoldeki 96 numunenin sıvı elleçlenmesi için zaman farkları hesaplandı ve geleneksel pipetleme yöntemleri ile karşılaştırıldı. Sonuç, mevcut protokolün zaman kazandırdığını ve geleneksel protokollerle sıvı taşıma süresini bunun dörtte birine düşürdüğünü gösterir (Tablo 1). Tablo ayrıca, mevcut protokoldeki sıvı çıkarma süresinin, genel olarak sekiz kat azaltma ile gelenekse...
Tartışmalar
Tohumların sterilizasyonu Arabidopsis'te fonksiyonel çalışmalar için temel adımdır. Birçok farklı amaç için sıkça yapılmasına rağmen Arabidopsis'te yüksek verimli tohum yüzey sterilizasyonu ile ilgili sınırlı çalışmalar mevcuttur.
Şimdiye kadar, en yüksek verime sahip yöntemlerden biri, çamaşır suyunu konsantre HCl ile karıştırarak üretilen klor gazı kullanmaktır. Bu yöntem sınırlı uygulamalı zaman gerektirmesine rağmen, insanlar için oldukça zehirli...
Açıklamalar
Tüm yazarlar çıkar çatışması olmadığını beyan eder.
Teşekkürler
Bu araştırma, Fondazione E. Mach'in Ecogenomics grubunun temel finansmanı yoluyla Trento Özerk Eyaleti tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Aquarium valve | Amazon | B074CYC5SD | Kit including 2 valves and thin-walled tubings. The valve prevents the liquids to go back to the sterile tip |
| Arabidopsis Col-0 wild-type seeds | Nottingham Arabidopsis Stock Center | N1093 | Wild type seeds (sensitive to kanamycin) |
| Arabidopsis transgenic line AdoIspS-79 seeds | NA | NA | Transgenic line overexpressing an isoprene synthase gene from Arundo donax transformed in the Col-0 background, resistant to kanamycin (Li et al. (2017) Mol. Biol. Evol., 34, 2583–2599). Available on request from the authors |
| Microcentrifuge | Eppendorf | EP022628188 | Benchtop microcentrifuge used for spinning down the seeds |
| Murashige & Skoog medium including vitamins | Duchefa | M0222 | Standard medium for plant sterile culture |
| Pipette controller | Brand | 26300 | Used to operate the serological pipette |
| Polyethylene tube 1 | Roth | 9591.1 | Tube for connection from vacuum pump to decantation bottle (inner diameter: 7 mm; outer diameter: 9 mm) |
| Polyethylene tube 2 | Roth | 9587.1 | Tube for connection from decantation bottle to the aquarium valve (inner diameter: 5 mm; outer diameter: 7 mm) |
| Screw cap with connectors | Roth | PY86.1 | 2-way dispenser screw cap GL45 in polypropylene for decanting bottle |
| Serological pipette | Brand | 27823 | Graduated glass (reusable) serological pipette. Disposable pipettes can be used instead |
| Shakeret al. | Qiagen | 85300 | TissueLyser II bead mill used normally for tissue homogenization. Without the addition of beads to the tubes it works as shaker. |
| Technical ethanol | ITW Reagents (Nova Chimica Srl) | 212800 | Ethanol 96% v/v partially denatured technical grade |
| Tween 20 | Merck Millipore | 655205 | Non-ionic detergent acting as surfactant |
| Universal tubing connectors | Roth | Y523.1 | Can be used to improve/simplify tubing connections |
| Vacuum pump | Merck Millipore | WP6222050 | Used for making the suction device |
Referanslar
- Somerville, C., Koornneef, M. A fortunate choice: The history of Arabidopsis as a model plant. Nature Reviews Genetics. 3 (11), 883-889 (2002).
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. Plant Journal. 61 (6), 909-921 (2010).
- Initiative, T. A. G. Analysis of the genome sequence of the flowering plant Arabidopsis thaliana. Nature. 408 (6814), 796-815 (2000).
- Krysan, P. J., Young, J. C., Sussman, M. R. T-DNA as an insertional mutagen in Arabidopsis. Plant Cell. 11 (12), 2283-2290 (1999).
- Speulman, E., et al. A two-component enhancer-inhibitor transposon mutagenesis system for functional analysis of the arabidopsis genome. Plant Cell. 11 (10), 1853-1866 (1999).
- Jander, G., et al. Ethylmethanesulfonate saturation mutagenesis in Arabidopsis to determine frequency of herbicide resistance. Plant Physiology. 131 (1), 139-146 (2003).
- Zhang, X., Henriques, R., Lin, S. -. S., Niu, Q. -. W., Chua, N. -. H. Agrobacterium-mediated transformation of Arabidopsis thaliana using the floral dip method. Nature Protocols. 1 (2), 641-646 (2006).
- Togninalli, M., et al. AraPheno and the AraGWAS catalog 2020: A major database update including RNA-Seq and knock-out mutation data for Arabidopsis thaliana. Nucleic Acids Research. 48 (1), 1063-1068 (2020).
- Lan, Y., et al. AtMAD: Arabidopsis thaliana multi-omics association database. Nucleic Acids Research. 49 (1), 1445-1451 (2021).
- Xu, J., Trainotti, L., Li, M., Varotto, C. Overexpression of isoprene synthase affects ABA-and drought-related gene expression and enhances tolerance to abiotic stress. International Journal of Molecular Sciences. 21 (12), 1-21 (2020).
- Czarnecki, O., et al. Simultaneous knock-down of six non-family genes using a single synthetic RNAi fragment in Arabidopsis thaliana. Plant Methods. 12 (1), 1-11 (2016).
- Yan, L., et al. high-efficiency genome editing in arabidopsis using YAO promoter-driven CRISPR/Cas9 system. Molecular Plant. 8 (12), 1820-1823 (2015).
- Liu, Y., Gao, Y., Gao, Y., Zhang, Q. Targeted deletion of floral development genes in Arabidopsis with CRISPR/Cas9 using the RNA endoribonuclease Csy4 processing system. Horticulture Research. 6 (1), (2019).
- Grefen, C., et al. Subcellular localization and in vivo interactions of the Arabidopsis thaliana ethylene receptor family members. Molecular Plant. 1 (2), 308-320 (2008).
- Gazzani, S., et al. Evolution of MIR168 paralogs in Brassicaceae. BMC Evolutionary Biology. 9 (1), (2009).
- Lee, S., Korban, S. S. Transcriptional regulation of Arabidopsis thaliana phytochelatin synthase (AtPCS1) by cadmium during early stages of plant development. Planta. 215 (4), 689-693 (2002).
- Long, Y., et al. In vivo FRET-FLIM reveals cell-type-specific protein interactions in Arabidopsis roots. Nature. 548 (7665), 97-102 (2017).
- Freire-Rios, A., et al. Architecture of DNA elements mediating ARF transcription factor binding and auxin-responsive gene expression in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 117 (39), 24557-24566 (2020).
- Rivero, L., et al. Handling arabidopsis plants: Growth, preservation of seeds, transformation, and genetic crosses. Methods in Molecular Biology. 1062, 3-25 (2014).
- Chen, J. H., et al. Drought and salt stress tolerance of an arabidopsis glutathione S-transferase U17 knock-out mutant are attributed to the combined effect of glutathione and abscisic acid. Plant Physiology. 158 (1), 340-351 (2012).
- Li, D. Z., et al. Comparative analysis of a large dataset indicates that internal transcribed spacer (ITS) should be incorporated into the core barcode for seed plants. Proceedings of the National Academy of Sciences of the United States of America. 108 (49), 19641-19646 (2011).
- Mathur, J., Koncz, C. Establishment and maintenance of cell suspension cultures. Arabidopsis Protocols. Methods in Molecular Biology. 82, 27-30 (1998).
- Li, M., Cappellin, L., Xu, J., Biasioli, F., Varotto, C. High-throughput screening for in planta characterization of VOC biosynthetic genes by PTR-ToF-MS. Journal of Plant Research. 133 (1), 123-131 (2020).
- Li, M., et al. In planta recapitulation of isoprene synthase evolution from ocimene synthases. Molecular Biology and Evolution. 34 (10), 2583-2599 (2017).
- Li, M., et al. Evolution of isoprene emission in Arecaceae (palms). Evolutionary Applications. 14, 902-914 (2020).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Bent, A. Arabidopsis thaliana floral dip transformation method. Methods in Molecular Biology. 343, 87-104 (2006).
- Lundberg, D. S., et al. Defining the core Arabidopsis thaliana root microbiome. Nature. 488 (7409), 86-90 (2012).
- Tkacz, A., Cheema, J., Chandra, G., Grant, A., Poole, P. S. Stability and succession of the rhizosphere microbiota depends upon plant type and soil composition. ISME Journal. 9 (11), 2349-2359 (2015).
- Singh, N., Gaddam, S. R., Singh, D., Trivedi, P. K. Regulation of arsenic stress response by ethylene biosynthesis and signaling in Arabidopsis thaliana. Environmental and Experimental Botany. 185, 104408 (2021).
- Lindsey, B. E., Rivero, L., Calhoun, C. S., Grotewold, E., Brkljacic, J. Standardized method for high-throughput sterilization of Arabidopsis seeds. Journal of Visualized Experiments: JOVE. (128), e56587 (2017).
- Acemi, A., Özen, F. Optimization of in vitro asymbiotic seed germination protocol for Serapias vomeracea. The EuroBiotech Journal. 3 (3), 143-151 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır