Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Primer Hastaya Özgü Aort Düz Kas Hücrelerinin İzolasyonu ve Yarı Kantitatif Gerçek Zamanlı Kasılma Ölçümleri In Vitro
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu yazıda birincil, hastaya özgü insan aort düz kas hücrelerinin ve dermal fibroblastların izolasyonu ve kültürlenmesi için eksplant kültürüne dayalı bir yöntem anlatılmaktadır. Ayrıca, hücre kasılmasını ölçmek ve daha sonra bu hücrelerdeki hastaya özgü farklılıkları incelemek için kullanılabilecek yeni bir yöntem sunulmaktadır.
Özet
Düz kas hücreleri (SMC'ler) aort ortamındaki baskın hücre tipidir. Kasılma mekanizmaları aorttaki kuvvetin iletimi için önemlidir ve vazokonstriksiyon ve vazodilatasyonu düzenler. SMC kontraktil aparat proteinlerini kodlayan genlerdeki mutasyonlar, torasik aort anevrizmaları gibi aort hastalıkları ile ilişkilidir. SMC kasılmasını in vitro olarak ölçmek, özellikle hasta materyalini taramak için gerekli olan yüksek verimli bir şekilde zordur. Şu anda mevcut yöntemler bu amaç için uygun değildir. Bu yazıda elektrik hücre-substrat empedans algılamasına (ECIS) dayanan yeni bir yöntem sunulmaktadır. İlk olarak, aort anevrizmalarının incelenmesi için hastaya özgü insan primer SMC'lerini aort biyopsilerinden ve hastaya özgü insan primer dermal fibroblastlarından izole etmek için bir eksplant protokolü tanımlanmıştır. Daha sonra, bu hücrelerin kasılma tepkisini ölçmek için, farklı grupları karşılaştırmak için sonraki analiz ve öneri de dahil olmak üzere yeni bir kasılma yönteminin ayrıntılı bir açıklaması verilir. Bu yöntem, translasyonel (kardiyovasküler) çalışmalar ve hasta ve ilaç tarama çalışmaları bağlamında yapışkan hücrelerin kasılmasını incelemek için kullanılabilir.
Giriş
Düz kas hücreleri (SMC'ler), aortun en kalın tabakası olan aort medial tabakasında baskın hücre tipidir. Duvar içinde, radyal olarak yönlendirilirler ve diğer fonksiyonların yanı sıra vazokonstriksiyon ve vazodilatasyon1'de rol oynarlar. SMC kontraktil makinesi, aorttaki kuvvetin hücre dışı matris2 ile fonksiyonel bağlantı yoluyla iletilmesinde rol oynar. Düz kas miyozin ağır zinciri (MYH11) ve düz kas aktini (ACTA2) gibi SMC kontraktil aparatının proteinlerini kodlayan genlerdeki mutasyonlar, ailesel torasik aort anevrizması vakalarıyla ilişkilendirilmiş ve SMC kasılmasının aortun yapısal ve fonksiyonel bütünlüğünün korunmasındaki önemini vurgulamıştır 1,2 . Ayrıca, TGFβ sinyal yolundaki mutasyonlar da aort anevrizmaları ile ilişkilidir ve bunların aort anevrizması patofizyolojisindeki etkileri deri fibroblastlarında da incelenebilir3.
SMC kasılmasının in vitro yüksek verimli ölçümü zordur. SMC kontraktilitesi insanlarda in vivo olarak ölçülemediğinden, insan hücreleri üzerindeki in vitro testler uygulanabilir bir alternatif sunar. Ayrıca, hayvan modellerinde abdominal aort anevrizması (AAA) gelişimi, örneğin elastaz perfüzyonu tarafından kimyasal olarak indüklenir veya spesifik bir mutasyondan kaynaklanır. Bu nedenle, hayvan verileri, çoğunlukla sigara, yaş ve / veya ateroskleroz gibi çok faktörlü bir nedene sahip olan insanlarda AAA gelişimi ile karşılaştırılamaz. İn vitro SMC kontraktilitesi şimdiye kadar esas olarak traksiyon kuvveti mikroskobu4,5, Fura-2 floresan hücre içi kalsiyum akılarının nicelleştirilmesi6 ve kollajen buruşma tahlilleri7 ile ölçülmüştür. Çekiş kuvveti mikroskobu, tek bir hücre tarafından üretilen kuvvetler hakkında paha biçilmez sayısal bilgiler sağlarken, karmaşık matematiksel veri işleme ve bir seferde bir hücrenin analizi nedeniyle yüksek verimli tarama için uygun değildir, bu da donör başına temsili bir hücre sayısını ölçmenin çok zaman alıcı olduğu anlamına gelir. Fura-2 boya ve kollajen kırışma testleri, kasılmanın yüzeysel olarak belirlenmesine izin verir ve kesin bir sayısal çıktı vermez, bu da onları hastaya özgü farklılıkları ayırt etmek için daha az uygun hale getirir. Abdominal aort anevrizması hastalarının aortundan türetilen hücrelerde bozulmuş SMC kontraksiyonu, SMC kontraksiyonunu in vitro8 ölçmek için yeni bir yöntemin optimize edilmesiyle ilk kez gösterilmiştir. Bu, elektrik hücre-substrat empedans algılama (ECIS) yönteminin yeniden kullanılmasıyla yapıldı. ECIS, SMC büyümesi ve yara iyileşmesi ve göç tahlillerinde davranış 12,13,14 gibi yapışkan hücre davranışı ve kasılmasının 9,10,11 miktarının ölçülmesi için gerçek zamanlı, orta verimli bir testtir. Tam yöntem protokol bölümünde açıklanmıştır. Bu optimize edilmiş şekilde, ECIS, benzer boyut ve morfolojileri nedeniyle fibroblast kasılmasını incelemek için de kullanılabilir.
Bu makalenin amacı, ECIS8 kullanarak SMC kontraksiyonunu in vitro olarak ölçme yönteminin aşamalı bir tanımını sağlamak ve kontrol ile hasta SMC'leri arasındaki kontraksiyonu karşılaştırmaktır. İlk olarak, primer SMC'lerin kontrol ve hasta aort biyopsilerinden izole edilmesi ve kültürlenmesi, kasılma ölçümü için kullanılabilecek şekilde açıklanmaktadır. İkincisi, SMC belirteç ifadesinin doğrulanmasının yanı sıra kasılma ölçümleri ve analizi açıklanmaktadır. Ayrıca, bu yazıda aynı metodoloji kullanılarak kontraksiyonu ölçülebilen hastaya özgü dermal fibroblastların izolasyon yöntemi açıklanmaktadır. Bu hücreler, aort anevrizması veya diğer kardiyovasküler patolojilere odaklanan hastaya özgü çalışmalariçin kullanılabilir 15 veya anevrizma cerrahisinden önce kasılma ölçümüne izin veren bir transdiferansiyasyon protokolü kullanan prognostik çalışmalar16.
Access restricted. Please log in or start a trial to view this content.
Protokol
NOT: Aort biyopsileri Amsterdam Üniversitesi Tıp Merkezleri, VU Üniversitesi Tıp Merkezi, Amsterdam, Zaans Medisch Centrum, Zaandam ve Dijklander Hastanesi, Hoorn, Hollanda'da açık anevrizma onarımı sırasında elde edildi. Kontrol aort dokusu, böbrek nakli için toplanan renal artere bağlı aort parçasından elde edildi. Sadece 18 yaşın üzerindeki hastalar dahil edildi ve tüm hastalar çalışmaya katılmak için bilgilendirilmiş onamlarını verdiler. Tüm materyaller, WMA Helsinki Deklarasyonu'nun düzenlemelerine ve VU Tıp Merkezi Tıbbi Etik Komitesi'nin kurumsal kılavuzlarına uygun olarak toplanmıştır. Tüm deneyler ve deneysel protokoller kurumsal kılavuzlara uygun olarak gerçekleştirilmiş ve VU Tıp Merkezi Tıbbi Etik Kurulu tarafından onaylanmıştır. Kullanılan kontrol ve hasta hücre hatları hakkında tam bilgi için, 8'e bakınız.
1. Birincil insan SMC'lerinin aort biyopsilerinden izole edilmesi
NOT: Steril doku kültürü laminer akış başlığı altında aşağıdaki adımları uygulayın. Eldiven giyin ve insan kanı ve insan dokusu örneklerini kullanırken standart aseptik teknikler kullanın. SMC'ler, 100 U / mL penisilin, 100 μg / mL streptomisin ve SMC ortamı olarak adlandırılan Düz Kas Büyüme Takviyesi ile desteklenmiş 231 İnsan Vasküler Düz Kas Hücresi Bazal Ortamında kültürlenir.
- İki çift cerrahi forseps ve bir neşteri% 70 etanol içine batırarak ve daha sonra kurutarak sterilize edin.
- Doku diseksiyonunun yapılacağı bir Petri kabında 2 mL SMC ortamından pipet.
- İki T25 şişeye 2,5 mL SMC ortamı pipetin. Şişeleri etrafta döndürün, böylece küçük hacimli ortam tüm yüzeyi kaplar.
- Hasat edilen insan aort duvarı biyopsisini ameliyathaneden laboratuvara buz üzerinde, soğuk, steril doku transfer çözeltisi ( Malzeme Tablosuna bakınız) veya% 0.9 NaCl ile steril bir plastik tüp içinde taşıyın.
- Tüpü, doku kültürü başlığının içindeki doku ile açın. Sterilize forsepsleri kullanarak biyopsiyi tüpten çıkarın ve Petri kabına yerleştirin (Şekil 1A).
- Üç aort tabakasını, tunika intima'yı (iç), medyayı (orta) ve adventitia'yı (dış tabaka) tanımlamak için biyopsiyi görsel olarak inceleyin. Katmanları ayırt etmek için intima tarafında aterosklerotik plakların ve adventitial tarafta sümüksü bağ dokusunun varlığını araştırın (Şekil 1B).
- SMC'leri medyadan yalıtmak için diğer iki katmanı kaldırın. Dokuyu önce intima plağı tarafı yukarı bakacak şekilde yerleştirin (Şekil 1B). Katı plağı, forseps ile dokudan uzaklaştırarak çıkarın ve dokuyu diğer forseps çiftiyle aşağı doğru itin. Pembe, düzgün medial tabaka görünene kadar sonraki plak katmanlarını çıkarın.
- Dokuyu çevirin (Şekil 1C). Adım 1.7'de olduğu gibi, adventitial tabakayı çekerek aynı prosedürü tekrarlayın (Şekil 1D). Görünür tüm parçaları gerektiği kadar denemede çıkardığınızdan emin olun, çünkü bu katman ortamdan kolayca ayrılmaz.
NOT: Mümkün olduğunca temiz bir SMC popülasyonu elde etmek için intimal ve adventitial katmanların uygun şekilde çıkarılması esastır. - Medial tabaka izole edildikten sonra, dokuyu yaklaşık 1 mm x 1 mm x 1 mm'lik küpler halinde kesin. Medyayı forseps ile bastırın ve neşteri kullanarak dokuyu bir yönde kesin. İleri geri kesmeyin; hasarı en aza indirmek için temiz, tek yönlü kesimler yapın. Biyopsinin büyüklüğü göz önüne alındığında mümkün olduğunca çok küp yapmaya çalışın (Şekil 1E).
- Forsepsleri kullanarak doku parçalarını T25 şişesinin üst çeyreğine yerleştirin. Malzeme miktarı izin veriyorsa şişe başına 10-20 küp yerleştirin (Şekil 1F).
NOT: Dokunun forseps kaburgalarına yapışmasını en aza indirmek ve dokuyu şişeye kolayca ayırmak için pürüzsüz forseps kullanın. - T25 şişelerindeki doku küplerini bir inkübatörde 37 ° C'de% 5 CO2'de yaklaşık 10 gün boyunca inkübe edin.
NOT: İlk hücre büyümesi bu süre zarfında bekleniyor. Başlangıçta göç eden hücreler normal SMC'lerden daha küçük görünebilir. - Hücre büyümesi gözlendikten sonra, şişeye 2,5 mL orta madde ekleyin ve ayrılmalarını önlemek için doku parçalarına pipet yapmadığınızdan emin olun.
- Yaklaşık 5 gün sonra, doku parçalarının etrafında hücre kümeleri gözlendiğinde, kültür ortamını değiştirin. Doku parçaları ayrılırsa, tekrar takılmayacakları için bunları çıkarın.
- Hücreler% 80-90 birleştiğinde, onları bir T75 şişesine aktarın ve bu formatta kültürlemeye devam edin.
NOT: 1:2 veya 1:3 bölme oranı önerilir. Hücrelerin yedeğini erken bir geçişte dondurun. Hücreler genellikle 10. geçide kadar özelliklerini korurlar; Daha sonraki pasajlar deneyler için kullanılmamalıdır.
2. Primer dermal fibroblastların cilt biyopsilerinden izole edilmesi
NOT: Steril doku kültürü laminer akış başlığı altında aşağıdaki adımları uygulayın. Eldiven giyin ve insan kanı ve insan dokusu örneklerini kullanırken standart aseptik teknikler kullanın. Fibroblastlar, %10 fetal sığır serumu, 100 U/mL penisilin ve fibroblast besiyanı olarak adlandırılan 100 μg/mL streptomisin ile desteklenmiş Bazal Medium'da kültürlenir.
- İki çift cerrahi forseps ve bir neşteri% 70 etanol içine batırarak ve daha sonra kurutarak sterilize edin.
- Doku diseksiyonunun yapılacağı bir Petri kabında 2 mL fibroblast ortamı pipeti.
- İki T25 şişeye 2,5 mL fibroblast ortamı pipetin. Şişeleri etrafta döndürün, böylece küçük hacimli ortam tüm yüzeyi kaplar.
- Hasat edilen cilt biyopsisini ameliyathaneden laboratuvara soğuk, steril doku transfer solüsyonunda buz üzerinde ( Malzeme Tablosuna bakınız) veya% 0.9 NaCl'yi steril bir plastik tüp içinde taşıyın.
- Tüpü, doku kültürü başlığının içindeki doku ile açın. Sterilize forsepsleri kullanarak biyopsiyi tüpten çıkarın ve Petri kabına yerleştirin (Şekil 2A).
- Üç cilt tabakasını, epidermis, dermis ve deri altı yağını tanımlamak için biyopsiyi görsel olarak inceleyin. Epidermisi tanımlamak için bazen görünür saçlarla tanınabilir bir cilt yüzeyi arayın. Karşı tarafta, genellikle sarı ve sümüksü olan deri altı yağını arayın. Epidermis ve deri altı yağ arasındaki tabakayı, canlı fibroblastların kaynağı olan dermis olarak tanımlayın (Şekil 2B).
- Fibroblastları dermisten izole etmek için, diğer iki katmanı çıkarın ve dokuyu üç katmanın da görülebilmesi için yan tarafına yerleştirin.
NOT: Aort dokusunun aksine, cilt katmanları birbirinden ayrılamaz; bu nedenle, kesilmeleri gerekir. Doku ayrıca daha kauçuktur, bu da kesilmesini zorlaştırır. Keskin bir neşter kullanın. - Dokuyu forseps ile aşağı doğru tutun. Epidermis ve dermis arasındaki sınıra paralel olarak kesin. Tüm epidermisi kesin. Temiz bir çizgide kesmeye çalışın ve doku hasarını önlemek için ileri geri hareket etmeyin.
- Dokuyu çevirin. Adım 2.8'deki yordamın aynısını yineleyin; bu kez, deri altı yağ ile sınıra paralel olarak dermis içinde kesin.
- Dermis izole edildikten sonra, dokuyu yaklaşık 1 x 1 x 1mm3 küpler halinde kesin. Dokuyu forseps ile bastırın ve neşteri kullanarak dokuyu bir yönde kesin. İleri geri kesmeyin; hasarı en aza indirmek için temiz, tek yönlü kesimler yapın. Biyopsinin büyüklüğü göz önüne alındığında mümkün olduğunca çok küp yapmaya çalışın (Şekil 2C).
- Forsepsleri kullanarak doku parçalarını T25 şişesinin üst çeyreğine yerleştirin. Malzeme miktarı izin veriyorsa şişe başına 10-20 küp yerleştirin (Şekil 2D).
NOT: Dokunun forseps kaburgalarına yapışmasını en aza indirmek ve dokuyu şişeye kolayca ayırmak için pürüzsüz forseps kullanın. - T25 şişelerindeki doku küplerini bir inkübatörde 37 ° C'de% 5 CO2'de yaklaşık 10 gün boyunca inkübe edin.
NOT: İlk hücre büyümesi o zaman civarında bekleniyor. Başlangıçta göç eden hücreler normal fibroblastlardan daha küçük görünebilir. - Hücre büyümesi gözlendikten sonra, şişeye 2,5 mL orta madde ekleyin ve ayrılmalarını önlemek için doku parçalarına pipet yapmadığınızdan emin olun.
- Yaklaşık 5 gün sonra, doku parçalarının etrafında hücre kümeleri gözlenebildiğinde, kültür ortamını değiştirin. Doku parçaları ayrılırsa, tekrar takılmayacakları için bunları çıkarın.
- Hücreler% 80-90 birleştiğinde, onları bir T75 şişesine aktarın ve bu formatta kültürlemeye devam edin.
NOT: 1:2 veya 1:3 bölme oranı önerilir. Hücrelerin yedeğini erken bir geçişte dondurun. Hücreler genellikle 10. geçide kadar özelliklerini korurlar; Daha sonraki pasajlar deneyler için kullanılmamalıdır.
3. Kasılmanın ölçülmesi (örnek SMC'ler)
- Bir 96w10e ECIS dizisi hazırlayın (büyütülmüş elektrotlar ve elektrotlar üzerine tohumlanmış hücreler içeren dizinin temsili bir görüntüsü için Şekil 3A'ya bakın).
NOT: Steril doku kültürü laminer akış başlığı altında aşağıdaki adımları uygulayın.- Steril bir 96w10e dizisini oda sıcaklığında 30 dakika boyunca kuyucuk başına 200 μL 10 mM L-sistein ile kaplayın.
- Tabağı iki kez steril suyla yıkayın. Plakayı, kapağı hafifçe açıkken doku kültürü davlumbazında gece boyunca kurumaya bırakın.
NOT: Plakanın L-sistein ile kaplanması sadece plakayı ilk kez kullanırken gereklidir. - Ertesi gün, 30 dakika boyunca plaka ve kapağı UV sterilize edin. Kapağı yukarı doğru çevirin, böylece iç kısım sterilize edilir. Plaka sterilize edildikten sonra, plakayı akış davlumbazının dışında açmayın.
- ECIS dizisindeki tohumlama hücreleri
- Su banyosunda 30 dakika boyunca% 1 steril jelatin çözeltisini önceden ısıtın.
NOT: Çözelti buzdolabında saklanır ve katılaşarak pipet takılmasını zorlaştırabilir. - Daha sonra, kuyucukları kuyu başına% 1 jelatin çözeltisinden 100 μL ile kaplayın ve plakayı en az 1 saat boyunca 37 ° C'de inkübe edin.
- Jelatini kuyucuklardan aspire edin.
- Otomatik bir hücre sayacı kullanarak hücreleri sayın ve SMC'leri 200 μL SMC ortamında 30.000 hücre/kuyu tohumlama yoğunluğunda üçlü olarak tohumlayın.
- SMC'lerle birlikte plakayı, hücre kültürü inkübatöründeki ECIS 96 kuyucuğuna yerleştirin. Programı açmak için ECIS Applied Biophysics yazılımına çift tıklayın ve Setup (Kurulum ) düğmesine basın.
- Tüm elektrotların Kuyu Yapılandırması etiketli sol alt paneldeki tutucuyla (yeşil; bağlantı yoksa kırmızı) temas edip etmediğini kontrol edin. Elektrotlar düzgün bir şekilde bağlanmazsa, ölçüme başlamadan önce tutucudaki plakayı ayarlayın.
- Dizi türü'nü tıklatarak aynı panelde plaka türünü (96 delikli dizi) seçin.
- Sağ üst paneldeki Veri Toplama Kurulumu'nda, tek frekansa tıklayın ve empedans değerini 4000 Hz'e ve aralığı 8 s'ye değiştirin.
- Ölçümleri başlatmak için Başlat düğmesine tıklayın. ECIS dosyasının kaydedilebileceği yeni bir panelin açılmasını bekleyin.
- Hücrelerin 48 saat boyunca bir monolayer tutturmasına ve oluşturmasına izin verin.
NOT: Hücrelerin elektrotlar üzerine bağlanması ve yayılması bir temel direnç değeri oluşturur (Şekil 3B).
- Su banyosunda 30 dakika boyunca% 1 steril jelatin çözeltisini önceden ısıtın.
- Kasılmayı indüklemek için hücrelerin uyarılması
- Hücreleri 10 μg / mL kalsiyum iyonofor, iyonomisin ile uyararak SMC kasılmasını indükleyin.
NOT: İyonomisin, hücre dışı Ca2 + 'nın akışını indükleyecek ve kontraktil kaskatı aktive edecektir; uyarılmamış ve uyarılmış sözleşmeli hücrelerin temsili görüntüleri için Şekil 4A'ya bakınız. - 10 mg / mL'lik bir stok çözeltisi yapmak için 1 mg iyonomisin tozunu 100 μL dimetilsülfoksit içinde seyreltin ve -20 ° C'de 10 μL alikot saklayın. Kullanmadan önce, hücrelere eklenecek çalışma çözeltisini hazırlamak için iyonomisin çözeltisi 1:10'u SMC ortamında seyreltin.
- Dizi hala hücre kültürü inkübatörünün içindeki dizi tutucusundayken hücre stimülasyonunu gerçekleştirin ve elektrotlar sisteme bağlanır.
- Hücreleri uyarmak için kapağı çıkarın ve inkübatörün içindeki steril bir yüzeye yerleştirin. 2 μL ve 150 μL'ye ayarlanmış iki pipet hazırlayın.
- Stimülasyona başlamadan önce, yazılımda İşaretle tuşuna basın ve bir yorum yerleştirin.
NOT: Bu, verileri analiz ederken stimülasyonun tam zamanlamasını bulmayı kolaylaştıracaktır. - Pipet, iyonomisin çalışma çözeltisinin 2 μL'sini mümkün olduğunca çabuk her bir kuyucuğun içine yerleştirin. Tüm hücreler uyarıldıktan sonra, ikinci pipeti kullanarak ortamı kuyucuklarda karıştırın.
NOT: Hızlı etkiler nedeniyle, uçları farklı hücre hatları ve koşulları arasında değiştirmek gerekli değildir. Uyarırken ve karıştırırken hızlı çalışın, çünkü iyonomisin akut bir etkiye sahiptir. Tam bir plakayı uyarırken, bir kerede en fazla 3 sütunu uyarın. Her stimülasyondan sonra, hücrelerin inkübatör kapısının açılmasından kaynaklanan sıcaklıktan ve CO2 değişiminden kurtulmasına izin vermek için bir sonraki stimülasyona kadar en az 30 dakika bekleyin. - Stimülasyon yapıldıktan hemen sonra, stimülasyonun yapıldığına dair bir yorum eklemek için tekrar İşaretle'ye basın.
- Stimülasyon deneyini bitirmek
- İyonomisin stimülasyonundan sonra empedans değerlerini yaklaşık 5 dakika boyunca kaydedin. Son'a basarak kaydı bitirin.
- ECIS dizilerini üç defaya kadar tekrar kullanın: kuyucukları iki kez steril suyla yıkayın ve plakayı tripsin veya benzeri bir reaktif ile 2-3 saat boyunca 37 ° C'de inkübe edin. 3.1.2 ve 3.1.3 numaralı adımları yineleyin.
- Hücreleri 10 μg / mL kalsiyum iyonofor, iyonomisin ile uyararak SMC kasılmasını indükleyin.
- Verileri dışa aktarma
- Verileri vermek için, Dosya |'ni tıklatın Veri | dışa aktarma Excel'e (Seçili). Dosyayı kaydetmek için bir klasör seçin.
- Program sayfaları birleştirmek veya ayırmak istediğinde Ayır'ı tıklatın.
- Kasılma çıktısının analizi
- Kasılma yanıtını hesaplamak için, aşağıdaki denklemi (1) kullanın, burada C kasılmayı gösterir (taban çizgisine kıyasla değişimin % 'si ile ifade edilir), ön uyarım (PrS), iyonomisin stimülasyonundan hemen önce direnç değerini (Ω olarak ifade edilir) ve post-stimülasyon (PoS), stimülasyonu bitirdikten 2 dakika sonra direnci (Ω cinsinden ifade edilir) gösterir.
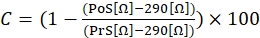 (1)
(1)
NOT: Denklem (1)'de gösterildiği gibi, herhangi bir bağlı hücre olmadan kültür ortamıyla doldurulmuş bir kuyunun empedans değeri (290 Ω değeri), son hesaplamadaki tüm sonuçlardan çıkarılır. Her deneyde kontraktil tepkilerin üçlü olarak ölçülmesi ve deneyler arası ve deneyler arası varyasyonları hesaba katmak için aynı hücre hattıyla üç bağımsız deney yapılması önerilir. - Üç bağımsız deney gerçekleştirildikten sonra, standart sapma (SD) dahil olmak üzere üç ölçümün ortalamasını hesaplayarak verileri bir araya getirin.
- Kasılma yanıtını hesaplamak için, aşağıdaki denklemi (1) kullanın, burada C kasılmayı gösterir (taban çizgisine kıyasla değişimin % 'si ile ifade edilir), ön uyarım (PrS), iyonomisin stimülasyonundan hemen önce direnç değerini (Ω olarak ifade edilir) ve post-stimülasyon (PoS), stimülasyonu bitirdikten 2 dakika sonra direnci (Ω cinsinden ifade edilir) gösterir.
- Farklı grupları karşılaştırma
- Normal kasılma aralığını tanımlamak ve sonraki spesifik araştırma sorularını araştırmak için, "normal kasılma" yı tanımlamak ve bunu hastaların veya tedavi gruplarının kasılma yanıtıyla karşılaştırmak için kontrol grubunu kullanın.
- Adım 3.5.2'de açıklandığı gibi, tüm kontrol grubunun, yani tüm hücre satırlarının uç değerlerinin ortalamasını ve SD'sini hesaplayın.
- Bu aralığın dışında kalan diğer gruptaki hücreleri tanımlamak için ortalama ± 2SD aralığını kullanın ve bu da değişmiş bir kontraktil yanıta sahip olduklarını gösterir.
NOT: Değiştirilmiş kontraktil yanıtın arkasındaki mekanizma belirli araştırma sorularına tabidir ve hücre ve duruma bağlıdır ve bu protokolde tartışılmayacaktır.
4. SMC'ye özgü belirteçlerin varlığının tespiti
- RNA izolasyonu
- Kasılma ölçümleri için kullanılan hastaya özgü hücre hatlarını, hücre hattı başına bir kuyucuk olan 6 delikli plakalarda tohumlayın. Otomatik bir hücre sayacı kullanarak hücreleri sayın ve hücreleri SMC ortamında 200.000 hücre/kuyu tohumlama yoğunluğunda tohumlayın ve gece boyunca bağlanmalarına izin verin.
- Hücreleri steril PBS ile bir kez yıkayın.
- Hücreleri lize edin ve hücreleri üreticinin talimatlarına göre izole edin.
- cDNA sentezi
- Bir ters transkripsiyon reaksiyon karışımının 20 μL'sinde cDNA sentezi gerçekleştirin. Toplam izole RNA konsantrasyonlarını, üretici tarafından sağlanan talimatlara göre seyreltin.
- qPCR
- İzole hücrelerin gerçekten SMC olduğunu doğrulamak ve SMC belirteçlerini tespit etmek için SMC belirteci genlerinin , örneğin ACTA2, CNN1, SMTN ve TAGLN'nin gen ekspresyonunu ölçün. Sonuçların kontraktil çıktı ile korelasyonunu kontrol edin.
- Verileri normalleştirmek için en az iki temizlik geni kullanın, örneğin, YWHAZ ve TBP.
NOT: qPCR çalıştırma ve analizi, laboratuvarda mevcut ve optimize edilmiş olana bağlı olarak farklı PCR makineleri ve uyumlu yazılımlar kullanılarak gerçekleştirilebilir. Astar dizileri için Ek Tablo S1'e bakınız.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bu yöntemin tekrarlanabilirliğini test etmek için, yöntem önce yalnızca kontrol SMC'leri kullanılarak doğrulanmıştır. Deneyler arası ölçüm tekrarlanabilirliğini belirlemek için, dahil edilen tüm kontrol ve hasta hücre hatlarının iki bağımsız ölçümü bir Bland-Altman grafiği olarak çizilmiştir (Şekil 3B). Grafik, bu yöntemin bir aykırı değer hücre çizgisi dışında, güven aralığının dışında değişkenlik göstermediğini göstermiştir. Ayrıca, b...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu yazıda, SMC kasılmasını in vitro olarak ölçmek için, empedans ve yüzey işgalindeki değişikliklere dayanarak bir yöntem sunulmaktadır. İlk olarak, hastaya özgü primer insan SMC'lerinin ve cilt fibroblastlarının izolasyonu, kültürlenmesi ve genişlemesi, ardından bunların kasılma ölçümleri için nasıl kullanılacağı açıklanmaktadır.
Çalışmanın bir sınırlaması, hücrelerin bir eksplant protokolü yoluyla elde edilmesiyle ilgilidir. Biyopsiden ç...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların beyan edecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Tara van Merrienboer, Albert van Wijk, Jolanda van der Velden, Jan D. Blankensteijn, Lan Tran, Peter L. Hordijk, PAREL-AAA ekibi ve Amsterdam UMC, Zaans Medisch Centrum ve Dijklander hastanesinin tüm vasküler cerrahlarına bu çalışma için malzeme ve destek sağladıkları için minnetle teşekkür ederiz.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96-well Array | Applied Biophysics | 96W10idf PET | Array used to measure contraction in the ECIS setup |
| Custodiol | Dr. Franz Höhler Chemie GmbH | RVG 12801 | Solution used to transfer tissue in from surgery room to laboratorium |
| Dimethyl sulfoxide | Sigma-Aldrich | 472301 | Solution used to dilute ionomycin |
| Fetal Bovine Serum | Gibco | 26140079 | Addition to cell culture medium |
| Ham's F-10 Nutrient Mix | Gibco | 11550043 | Medium used to culture skin fibroblasts |
| Human Vascular Smooth Muscle Cell Basal Medium (formerly ''Medium 231'') | Gibco | M231500 | Medium used to culture smooth muscle cells |
| Invitrogen countess II | Thermo Fisher Scientific | AMQAX1000 | Automated cell counter |
| Ionomycin calcium salt from Streptomyces conglobatus | Sigma-Aldrich | I0634-1MG | Compound used for contraction stimulation |
| NaCl 0.9% | Fresenius Kabi | B230561 | Solution used to transfer tissue in from surgery room to laboratorium |
| Penicillin-Streptomycin | Gibco | 15140122 | Antibiotics used for cell culture medium |
| Phospathe buffered saline | Gibco | 10010023 | Used to wash cells |
| Quick-RNA Miniprep Kit | Zymo Research | R1055 | Kit used for RNA isolation |
| Smooth Muscle Growth Supplement (SMGS) | Gibco | S00725 | Supplement which is added to smooth muscle cell culture medium |
| SuperScript VILO cDNA Synthesis Kit | Thermo Fisher Scientific | 11754250 | Kit used for cDNA synthesis |
| SYBR Green PCR Master Mix | Thermo Fisher Scientific | 4309155 | Reagent for qPCR |
| Trypsin-EDTA | Gibco | 15400-054 | Used to trypsinize cells |
| ZTheta | Applied Biophysics | ZTheta | ECIS instrument used for contraction measurements |
Referanslar
- Milewicz, D. M., et al. Genetic basis of thoracic aortic aneurysms and dissections: focus on smooth muscle cell contractile dysfunction. Annual Review of Genomics and Human Genetics. 9, 283-302 (2008).
- Milewicz, D. M., et al. Altered smooth muscle cell force generation as a driver of thoracic aortic aneurysms and dissections. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (1), 26-34 (2017).
- Groeneveld, M. E., et al. Betaglycan (TGFBR3) up-regulation correlates with increased TGF-β signaling in Marfan patient fibroblasts in vitro. Cardiovascular Pathology. 32, 44-49 (2018).
- Chen, J., Li, H., SundarRaj, N., Wang, J. H. C. Alpha-smooth muscle actin expression enhances cell traction force. Cell Motility and the Cytoskeleton. 64 (4), 248-257 (2007).
- Peyton, S. R., Putnam, A. J. Extracellular matrix rigidity governs smooth muscle cell motility in a biphasic fashion. Journal of Cellular Physiology. 204 (1), 198-209 (2005).
- Williams, D. A., Fogarty, K. E., Tsien, R. Y., Fay, F. S. Calcium gradients in single smooth muscle cells revealed by the digital imaging microscope using Fura-2. Nature. 318 (6046), 558-561 (1985).
- Wu, D., et al. NLRP3 (nucleotide oligomerization domain-like receptor family, pyrin domain containing 3)-caspase-1 inflammasome degrades contractile proteins: implications for aortic biomechanical dysfunction and aneurysm and dissection formation. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (4), 694-706 (2017).
- Bogunovic, N., et al. Impaired smooth muscle cell contractility as a novel concept of abdominal aortic aneurysm pathophysiology. Scientific Reports. 9 (1), 1-14 (2019).
- Hurst, V., Goldberg, P. L., Minnear, F. L., Heimark, R. L., Vincent, P. A. Rearrangement of adherens junctions by transforming growth factor-β1: role of contraction. American Journal of Physiology-Lung Cellular and Molecular Physiology. 276 (4), 582-595 (1999).
- Hu, N., et al. Comparison between ECIS and LAPS for establishing a cardiomyocyte-based biosensor. Sensors and Actuators B: Chemical. 185, 238-244 (2013).
- Peters, M. F., Lamore, S. D., Guo, L., Scott, C. W., Kolaja, K. L. Human stem cell-derived cardiomyocytes in cellular impedance assays: bringing cardiotoxicity screening to the front line. Cardiovascular Toxicology. 15 (2), 127-139 (2015).
- Zhang, S., Yang, Y., Kone, B. C., Allen, J. C., Kahn, A. M. Insulin-stimulated cyclic guanosine monophosphate inhibits vascular smooth muscle cell migration by inhibiting Ca/calmodulin-dependent protein kinase II. Circulation. 107 (11), 1539-1544 (2003).
- Halterman, J. A., Kwon, H. M., Zargham, R., Bortz, P. D. S., Wamhoff, B. R. Nuclear factor of activated T cells 5 regulates vascular smooth muscle cell phenotypic modulation. Arteriosclerosis, Thrombosis, and Vascular Biology. 31 (10), 2287-2296 (2011).
- Bass, H. M., Beard, R. S., Cha, B. J., Yuan, S. Y., Nelson, P. R. Thrombomodulin induces a quiescent phenotype and inhibits migration in vascular smooth muscle cells in vitro. Annals of Vascular Surgery. 30, 149-156 (2016).
- Burger, J., et al. Molecular phenotyping and functional assessment of smooth muscle like-cells with pathogenic variants in aneurysm genes ACTA2, MYH11, SMAD3 and FBN1. Human Molecular Genetics. , (2021).
- Yeung, K. K., et al. Transdifferentiation of human dermal fibroblasts to smooth muscle-like cells to study the effect of MYH11 and ACTA2 mutations in aortic aneurysms. Human Mutation. 38 (4), 439-450 (2017).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır