Method Article
Caenorhabditis elegans'ta Otomatik Inklüzyon Sayımı Kullanarak Protein Agregasyon Kinetiğinin In Vivo'da İzlenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, nematod Caenorhabditis elegans'ta protein agregasyon kinetiğinin analizi için bir yöntem sunulmuştur. Yaş senkronize edilmiş bir popülasyondan gelen hayvanlar farklı zaman noktalarında görüntülenir, ardından CellProfiler'da yarı otomatik dahil etme sayımı ve AmyloFit'teki matematiksel bir modele uyar.
Özet
Çözünmeyen inklüzyonlara protein agregasyonu, çoğu yaşa bağlı olan çeşitli insan hastalıklarının bir işaretidir. Nematod, Caenorhabditis elegans , protein agregasyonu ve toksisitesini incelemek için alanda yaygın olarak kullanılan köklü bir model organizmadır. Optik şeffaflığı, floresan mikroskobu ile protein agregasyonunun doğrudan görselleştirilmesini sağlar. Dahası, hızlı üreme döngüsü ve kısa ömür, nematodu bu süreci modüle eden genleri ve molekülleri taramak için uygun bir model haline getirir.
Bununla birlikte, canlı hayvanlarda agrega yükünün miktarı, tipik olarak tek bir zaman noktasında bir floresan diseksiyon mikroskobu altında manuel dahil etme sayımı ile gerçekleştirilen zayıf bir şekilde standartlaştırılmıştır. Bu yaklaşım, gözlemciler arasında yüksek değişkenliğe neden olabilir ve toplama işleminin anlaşılmasını sınırlar. Buna karşılık, in vitro amiloid benzeri protein agregasyonu, tioflavin T floresansı tarafından oldukça kantitatif ve zamanla çözülmüş bir şekilde rutin olarak izlenir.
Burada, ısmarlama görüntü analizi ve veri uydurma ile birleştirilmiş yüksek verimli bir konfokal mikroskop kullanarak, canlı C. elegans'ta toplama kinetiğinin tarafsız analizi için benzer bir yöntem sunulmaktadır. Bu yöntemin uygulanabilirliği, vücut duvarı kas hücrelerinde floresan olarak etiketlenmiş bir poliglutamin (poliQ) proteininin dahil edilme oluşumunun izlenmesiyle gösterilmiştir. Görüntü analizi iş akışı, bireysel kas hücrelerindeki bağımsız çekirdeklenme olaylarına dayanan matematiksel bir modele takılan farklı zaman noktalarındaki kapanım sayılarının belirlenmesini sağlar. Burada açıklanan yöntem, canlı bir hayvanda proteostaz faktörlerinin ve protein agregasyon hastalıkları için potansiyel terapötiklerin etkilerini sağlam ve nicel bir şekilde değerlendirmek için yararlı olabilir.
Giriş
Yanlış katlanmış proteinlerin çözünmeyen birikintilere birikmesi, çok çeşitli hastalıklarda ortaya çıkar. İyi bilinen örnekler, Alzheimer hastalığında amiloid-β ve tau'nun, Parkinson hastalığında α-sinükleinin ve Huntington hastalığında genişlemiş poliQ ile huntingtin'in agregasyonudur 1,2. Bu polipeptitlerin amiloid fibrillere yanlış katlanması, hala büyük ölçüde belirsiz olan mekanizmalar tarafından toksisite ve hücre ölümü ile ilişkilidir. Amiloid oluşum mekanizmalarının aydınlatılması, şu anda kullanılamayan etkili tedavilerin geliştirilmesi için çok önemli olacaktır.
Amiloid oluşumunun ayrıntılı araştırmaları, tiyoflavin T floresan ölçümlerine dayanarak in vitro olarak gerçekleştirilmiş ve agregasyon işleminin mekanik bir şekilde anlaşılmasına ve inhibitör moleküllerin etkisine yol açmıştır 3,4,5. Bununla birlikte, aynı toplama mekanizmalarının canlı hücrelerin ve organizmaların karmaşık ortamında geçerli olup olmadığı açık değildir. Nematod solucanı Caenorhabditis elegans, protein agregasyonunu in vivo olarak incelemek için uygun bir model organizmadır. Nispeten basit bir anatomiye sahiptir, ancak kas, bağırsak ve sinir sistemi dahil olmak üzere birden fazla dokudan oluşur. Genetik olarak iyi karakterize edilmiştir ve genetik modifikasyon için araçlar kolayca mevcuttur. Ayrıca, ~ 3 günlük kısa bir üretim süresine ve toplam 2-3 haftalık bir ömre sahiptir. Bu nedenle, protein agregasyonu, hayvanın ömrü boyunca deneysel olarak uygun bir zaman ölçeğinde incelenebilir. Son olarak, nematod optik olarak şeffaftır ve canlı hayvanlarda floresan olarak etiketlenmiş proteinlerin toplanmasının izlenmesini sağlar.
C. elegans'ın bu özellikleri daha önce Huntington ve diğer poliQ genişleme hastalıkları için bir model olarak poliQ proteinlerinin toplanmasını araştırmak için kullanılmıştır. 35-40 glutamin kalıntısının patojenik eşiğinin üstünde, sarı floresan protein (YFP) ile etiketlenmiş poliQ proteinlerinin, kas dokusunda6,7, nöronlar 8 ve bağırsak 9,10'da çözünmez inklüzyonlar oluşturduğu gözlenebilir. Bu özellikler, protein agregasyonu ve toksisitesinin 11,12,13 genlerini ve küçük moleküllü değiştiricileri 14'ü taramak için yaygın olarak kullanılmıştır.
C. elegans , protein agregasyonunun in vitro çalışmaları ile fareler15 gibi daha karmaşık hastalık modelleri arasındaki boşluğu kapatmada önemli bir rol oynama potansiyeline sahiptir. C. elegans , ilaç taraması16'ya uygundur, ancak yakın zamanda gösterildiği gibi, in vivo protein agregasyonunun moleküler mekanizmalarının temel bir anlayışını elde etmek için de kullanılabilir.17. Bununla birlikte, her iki uygulama için, protein agregasyonunun nicel ve tekrarlanabilir bir ölçüsünü çıkarmak çok önemlidir. Burada bu, özel bir görüntü analizi boru hattı ile birleştirilmiş yüksek verimli bir konfokal mikroskop kullanılarak elde edilir (Şekil 1).
Protokol
1. Yaş senkronize C. elegans popülasyonunun büyümesi
- C. elegans suşlarını, standart prosedürlere göre 20 °C'de Escherichia coli OP50 ile tohumlanmış nematod büyüme ortamı (NGM) plakaları üzerinde tutun18.
- Platin solucan toplama ile 6 cm'lik tohumlu bir NGM plakasına 10 yetişkin nematodu yerleştirerek senkronize bir yumurtlama gerçekleştirin. Yetişkinleri çıkarmadan önce 20 ° C'de ~ 2 saat yumurta bırakmaya bırakın. Suşun doğurganlığına ve alınacak zaman noktası sayısına bağlı olarak suş başına 1-4 plaka hazırlayın.
- Yumurtalı plakaları kuluçka makinesine 20 ° C'de yerleştirin. Hayvanların gelişimini yetişkinliğe ulaşana kadar izleyin.
NOT: Hayvanların yetişkinliğe ulaştığı gün burada 1. gün olarak tanımlanmıştır. Tipik olarak, bu yumurtlamadan üç gün sonradır. - 1. günden itibaren, hayvanları yavrularından ayırmak için günlük olarak yeni tohumlanmış NGM plakalarına aktarın. Transfer sırasında ölen veya kaybolan hayvanları telafi etmek için, suşun başına ~ 40 hayvanı, görüntülenecek nokta sayısının iki katı kadar aktarın (bkz. adım 2). Hayvanlar döllenmiş yumurta bırakmayı bırakana kadar devam edin (~ yetişkinliğin 6. günü).
NOT: Torbalama veya diğer gelişimsel fenotipleri olan hayvanları hariç tutun. Torbalanma, agregasyona eğilimli proteinleri eksprese eden suşlarda yaygın olarak görülür.
2. C. elegans'ın çok kuyulu bir plakada numune hazırlanması
NOT: Görüntüleme prosedürü sonunda hayvanları öldürecek anestezikler gerektirdiğinden, aynı hayvanlar sonraki zaman noktaları için tekrar kullanılamaz. Bunun yerine, aynı yaş senkronize edilmiş partiden farklı hayvanlar farklı günlerde görüntülenir. Çoğu suşun 1. günde çok az kapanımı olsa da, bu zaman noktasının temel olarak dahil edilmesi önerilir.
- Gerekli sayıda kuyucuğu anestezik olarak 25 mM NaN 3 ile desteklenmiş 100 μL M9 tamponu ile doldurarak384 delikli plakayı hazırlayın. Görüntülenecek gerinim başına bir kuyucuk doldurun.
NOT: Sodyum azid (NaN3) toksiktir ve dikkatle kullanılmalıdır. - Her suş için, bir platin solucan toplama kullanarak 20 hayvanı bir kuyuya aktarın.
NOT: Solucanlar, kuyuya yerleştirilmeden önce bakteri çimlerinin dışına yerleştirilmelidir. Bakteriler, hayvanların solucan seçimine yapışmasını sağlar, bu da salınımlarını önleyebilir ve kuyu içeriğini bulanıklaştırır. Genel olarak, 20, boş kuyu alanının gereksiz görüntülenmesini sınırlarken, solucanlar arasındaki örtüşmeyi önlemek için kuyu başına en uygun hayvan sayısıdır. - Buharlaşmayı önlemek için plakayı kapakla örtün ve hazırlandıktan sonra plakayı 1 saat içinde görüntüleyin.
- Dahil etme sayılarında sabit bir platoya ulaşılana kadar veya çoğu hayvan ölene kadar 2.1-2.3 arasındaki adımları her gün tekrarlayın. 24 saatlik aralıklarla numune hazırlama ve görüntülemeyi her gün aynı saatte gerçekleştirin.
3. Yüksek verimli konfokal mikroskopta görüntü yakalama
NOT: Bu deney, çok kuyulu bir plaka tutucuya sahip normal bir eğirme diski konfokal mikroskobu üzerine de kurulabilir. Geniş bir görüş alanına sahip bir kamera, tüm kuyuyu kapsayacak şekilde görüntülenmesi gereken karo sayısını sınırlamak için faydalıdır. Bu protokolde kullanılan mikroskop ve yazılım hakkında ayrıntılar için Malzeme Tablosuna bakın.
- Cihazı açın ve yazılımı açın.
- Ölçüm Ayarları | giderek yeni bir protokol başlatın Yeni. Doğru çok kuyulu plaka tipini seçin ve Yeni Bir Ölçüm Ayarı Oluştur'u tıklatın.
- Ch 1'e giderek floresan için kanalı ayarlayın. Hedefi 10x olarak ayarlayın. YFP'yi görüntülemek için ışık kaynağı olarak 488 nm ve emisyon filtresi olarak BP525/25'i seçin. Dosya boyutunu küçültmek için bağlamayı 2x2 olarak ayarlayın.
- Kanal Ekle'yi tıklayın ve yöntem olarak Brightfield'ı seçin.
- Ölçüme bir z-yığını konfokal floresan görüntüsü eklemek için, Eylem Listesi altında 3B Floresan alımı'nı seçin. Seç'e gidin ve Bölüm 1'i seçin. Dosya boyutlarını en aza indirmek için, Görüntü İşleme'yi Maksimum olarak ayarlayın, böylece tam z yığını yerine maksimum projeksiyon görüntüsü kaydedilir.
- BF/Ph Edinme |'na tıklayın | Seçin Parlak alan kanalı için Ch 2.
- Kuyu Plakalarını Boşalt'ın yanındaki oynat düğmesine tıklayın (sağa dönük üçgen sembolünü arayın) ve 384 delikli plakayı mikroskopa yerleştirin.
- 3B Floresan Alımı altında, Test'i tıklatın ve solucanların doğru şekilde ortalandığı en uygun kaydırma mesafesini belirlemek için solucanlar içeren bir kuyu seçin. Z-yığınındaki hayvanların tüm kalınlığını yakalamak için Artan Mesafeyi 50 μm'ye, Azalan Mesafeyi -50 μm'ye ve Dilimleme Aralığını 2 μm'ye ayarlayın.
- Doygunluktan kaçınırken dört suşun tümü için iyi bir sinyal yoğunluğu elde etmek için maruz kalma süresini optimize edin. Tüm suşlar ve zaman noktaları için aynı pozlama süresini kullanın.
- Kuyu Plakası Tarama Ayarı altında görüntülenecek kuyucukları seçin. Döşemeyi seçin ve Whole Well'i edinin.
- Ölçüm Ayarı'nı kaydedin ve Ölçümü Başlat'ı tıklayarak denemeyi başlatın. Sonraki zaman noktaları için aynı Ölçüm Ayarını açın ve kayma mesafesini ve görüntülenecek kuyucukları ayarlayın.
4. ImageJ'de döşenmiş görüntüleri dikiş
NOT: Bu adım yalnızca, her bir kuyucuğun görüntüsünün birden fazla karo olarak elde edildiği 4x'ten büyük bir hedef kullanıldığında gereklidir. Bu analiz iş akışında, karoların dikilmesi FIJI/ImageJ19 özgür yazılımı kullanılarak gerçekleştirilir (Şekil 2). 3. adımda kullanılan cihaza bağlı olarak, dikişleri doğrudan beraberindeki yazılımda gerçekleştirmek de mümkün olabilir.
- FIJI20'yi indirin ve açın.
- Eklentiler | Git Dikiş | Izgara/Koleksiyon Dikiş21.
- Açılır pencerede, Izgara/Koleksiyon Dikiş, kutucukların toplanma türünü ve sırasını seçin. Izgara: satır satır ve Sağ ve Aşağı'yı seçin.
- Bir sonraki pencerede, Izgara dikiş: Izgara: satır satır, Sağ ve Aşağı, karo sayısını x ve y yönlerine ekleyin. Burada kullanılan 10x hedefi için Izgara boyutu x olarak 2'yi, Izgara boyutu y olarak 3'ü ve Kutucuk çakışması olarak 0'ı seçin.
- Gözat'ı tıklatın ve dikiş atılacak TIFF görüntülerini içeren klasörü seçin.
- Kutucuklar için dosya adları altında, her dosya adındaki kutucuk numarasının konumunda {i} kullanarak ortak dosya adını ekleyin.
- Aşağıdaki tüm kutuların işaretini kaldırın.
- Eklentiyi çalıştırın.
- Elde edilen görüntüleri bir sonraki adımda analiz için TIFF dosyaları olarak kaydedin.
5. CellProfiler22 kullanarak otomatik dahil etme sayımı
- Açık kaynaklı görüntü analiz yazılımı CellProfiler23'ü indirin ve yükleyin. github.com/sinnigelab/aggregate-quantification'den InclusionCounting.cpproj işlem hattını indirin.
- CellProfiler'ı açın ve işlem hattını Buraya bir işlem hattı dosyası bırak penceresine sürükleyin. Projeyi yüklemek için Evet'i tıklatın.
- Görüntüler giriş modülüne tıklayın ve dikişli görüntüleri pencereye sürükleyin Dosyaları ve klasörü buraya bırakın.
- Meta veri giriş modülüne tıklayın. Dikişli görüntülerin adlarına göre dosya adından ayıklamak için Normal ifade'yi ayarlayın.
- NamesandTypes giriş modülüne tıklayın ve Dosya adlarındaki kanallarla eşleşmesi için Kural ölçütlerini seçin'i ayarlayın.
NOT: İşlem hattının varsayılan ayarlarında, BF içeren dosya adları parlak alan görüntüleri olarak tanınır ve Solucanlar olarak adlandırılır. YFP içeren dosya adları floresan görüntüleri olarak tanınır ve Floresan olarak adlandırılır. - Çıktıyı CellProfiler'dan kaydetmek üzere varsayılan bir klasör seçmek için Çıktı ayarlarını görüntüle'ye tıklayın.
- İlk görüntüleme veri kümesini kullanarak işlem hattının ayarlarını denetlemek için Test Modunu Başlat'a tıklayın. İşlem hattındaki tüm modülleri çalıştırmak için Çalıştır'a veya işlem hattında her seferinde bir modül çalıştırmak için Adım'a tıklayın. EditObjectsManually modülündeki solucan anahatlarını ayarlamak için, talimatları görmek üzere Yardım'a tıklayın ve işlem hattını çalıştırmaya devam etmek için Bitti'ye tıklayın.
NOT: Ayıklanan ölçümler test modundayken dışa aktarılmayacaktır. Solucanları ve inklüzyonları algılamak için eşik parametrelerinin, kullanılan gerinimlere ve büyütmeye göre ayarlanması gerekebilir. - Test Modundan Çık'a tıklayın ve görüntüleri analiz edin.
- Çıktı dosyalarını görüntülemek için çıktı klasörünü açın. Solucanların ve eklemelerin doğru şekilde üst üste bindirilip bindirilmediğini kontrol etmek için görüntüleri orijinal dosya adıyla ve ardından anahatlarla açın.
NOT: Solucan başına ekleme sayısı ExpandedWormObjects adlı dosyada bulunabilir. Giriş görüntüleri hakkında daha fazla bilgi Görüntü adlı dosyada bulunabilir. İşlem hattındaki ExportToSpreadsheet modülünde ek çıktı seçilebilir.
6. AmyloFit5 kullanarak dahil etme sayısı verilerinin küresel olarak uyarlanması
NOT: Bu adım yalnızca çoklu protein konsantrasyonları için veriler mevcut olduğunda gerçekleştirilebilir. Q40-YFP için, vücut duvarı kas hücrelerinde farklı seviyelerde aşırı ekspresyon gösteren dört suştan oluşan bir set daha önce17 yaratılmıştır. Diğer durumlarda, plazmid mikroenjeksiyonu ve genomik entegrasyon kullanılarak yeni suşlar üretilmelidir24.
- Toplama kinetiği AmyloFit25 için ücretsiz çevrimiçi uygulama platformuna gidin. Ya kaydolun ya da mevcut bir hesapla giriş yapın.
NOT: Ek yardım için AmyloFit'in nasıl kullanılacağına dair kapsamlı bir kılavuza erişilebilir. Daha fazla bilgi için web sayfasının sol üst köşesindeki bağlantıya bakın (giriş yaptıktan sonra). - AmyloFit'i kullanmaya başlamak için projeyi adlandırın ve Proje oluştur'a tıklayın. Projeyi Aç'a tıklayarak açın ve bir ad vererek bir oturum oluşturun ve Oturum oluştur ve yükle'ye tıklayın.
- Veri Ekle'yi tıklayın ve sol panelde gösterilen veri biçimi gereksinimlerini izleyerek hayvan başına ortalama ekleme sayısını içeren dosyayı yükleyin. Yeni Verileri Yükle'yi tıklayın.
- Sıfır noktası ofseti için puan sayısını ortalamaya, plato için ortalamaya puan sayısını 0'a ayarlayarak dahil etme sayısı verileri için gerekli olmayan ön işleme adımlarını atlayın. Submit'i (Gönder) tıklayın. Her protein konsantrasyonu için bu adımı tekrarlayın (yani, yüklenen dosyadaki her sütun).
- Model panelinde Özel'i seçin, denklem kutusuna Ncells*(1-exp(-Kcell*m**(n)*(t-1))) girin ve Modeli yükle'ye tıklayın.
NOT: AmyloFit başlangıçta in vitro tahlillerden kinetik verilerin analizi için tasarlandığından, C. elegans'ın dahil etme sayısı verilerini analiz etmek için özel yapım bir model yüklenmelidir. Burada kullanılan denklemde, Nhücreleri, inklüzyon oluşumunun gerçekleştiği hücre sayısı, Khücresi çekirdeklenme hızı sabiti, m hücre içi protein konsantrasyonu ve n çekirdeklenmenin reaksiyon sırasıdır. - Parametre türlerini Nhücreleri için Global Const, Khücresi ve n için Global fit ve m için Const olarak ayarlayın . Vücut duvarı kas hücreleri için Nhücrelerinin değerini 95'e ve Khücresi için ilk tahmine ve n'den 1'e ayarlayın. Sol paneldeki farklı gerinimler için m değerlerini girin.
NOT: İlk tahminler, burada kullanılan nispeten basit modelle ilgili değildir. Daha karmaşık modeller için, hesaplama süresini kısaltmak için beklenen değerlerin bir tahminini girmek faydalıdır. - Havza atlama sayısını değiştirmeden bırakın ve uygun panelde Sığdır'ı tıklatın.
- Verileri İndir ve Sığdır'ı tıklatarak sığdırmayı ayıklayın.
NOT: Modelin genel uyumu tarafından ayıklanan parametreler sağ alt köşede listelenir. Verilerin ve sığdırmanın bir grafiği sağ üst panelde otomatik olarak oluşturulur. Bu grafik, PDF'yi İndir'e tıklayarak çıkarılabilir ve Grafik Seçeneklerini Görüntüle'ye giderek özelleştirilebilir. Khücresi, molekül konsantrasyonu-n zaman-1 hücre-1 birimlerine sahiptir. Farklı n ile değerleri karşılaştırmak için, Khücresi belirli bir protein konsantrasyonunda m n ile çarpılarak çekirdeklenme hızına dönüştürülebilir.
Sonuçlar
Burada açıklanan yöntem (Şekil 1), YFP'ye (Q40-YFP) kaynaşmış 40 glutaminden oluşan bir yapının agregasyon kinetiğini analiz etmek için kullanılmıştır. Protein, unc-54 promotörünün kontrolü altında eksprese edilir ve vücut duvarı kas hücrelerinde ekspresyonu yönlendirir. Bunlar nispeten büyük ve görselleştirilmesi kolay olduğundan, 10x hedefinin kullanılması, bu dokuda Q40-YFP tarafından oluşturulan inklüzyonları çözmek için yeterlidir. Daha önce poliQ agregasyonunun in vivo17 konsantrasyon bağımlılığını değerlendirmek için proteini farklı boyutlarda ifade eden dört suş (A-D çizgileri) geliştirilmiştir.
A-D hatlarının yaş senkronize popülasyonları, 2 saatlik bir yumurtlama ile üretildi ve bunu yavrular yetişkinliğe ulaştığında günlük transfer izledi. Yetişkinliğin 1. gününden 10. gününe kadar, dört suşun her birinden 20 hayvan, yüksek verimli bir konfokal mikroskop kullanılarak 384 kuyucuklu bir plakada görüntülendi. Kuyuların görüntüleri, ImageJ21'deki bir eklenti kullanılarak birbirine dikilen 6 karo olarak elde edildi (Şekil 2). Dikişli görüntüler daha sonra, her bir suş ve zaman noktası için hayvan başına ortalama dahil etme sayısını ölçmek için özel yapım bir CellProfiler 22 boru hattı (Şekil 3) kullanılarak analiz edildi.
Veriler daha sonra AmyloFit5'teki matematiksel bir modele takıldı (Şekil 4). Model, 95 vücut duvarı kas hücresinin her birinin bağımsız olarak hız sınırlayıcı bir çekirdeklenme olayı ile bir dahil etme elde ettiği ve ardından hızlı agrega büyümesinin17 olduğu varsayımına dayanmaktadır. Uyum, 10 mM'lik bir hücre içi protein konsantrasyonunda 0.38 molekül d-1 hücre-1'in çekirdeklenme hızına karşılık gelen 9.9 × 10 5 molekül M-1 hücre-1 çekirdeklenme hızı sabiti ve 2.1'lik bir reaksiyon sırası verdi. İki bağımsız biyolojik replika, benzer bir protokol17 kullanan önceki bir çalışma ile uyumlu olan çekirdeklenme hızı ve reaksiyon sırası için yakından karşılık gelen değerlere yol açmıştır (Tablo 1).
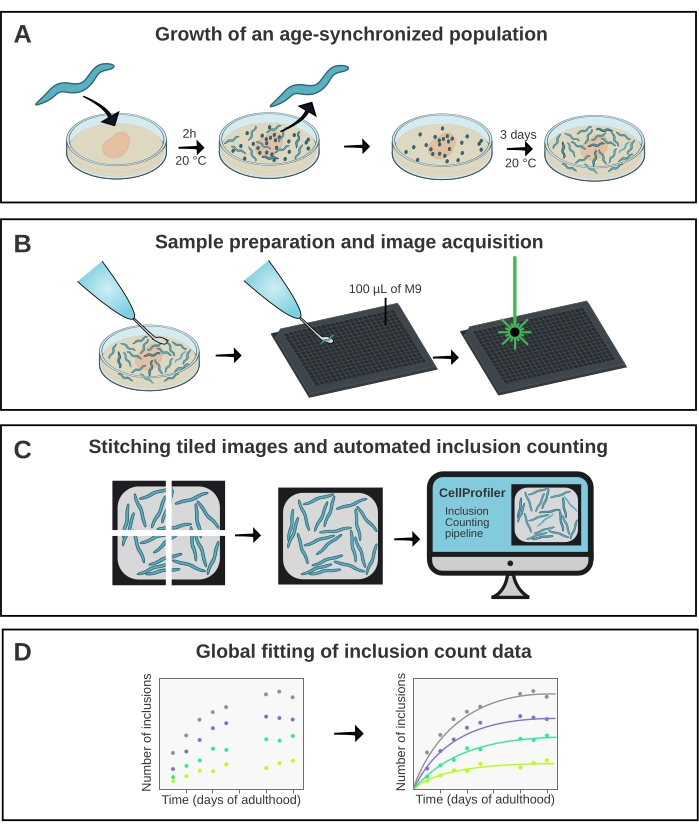
Şekil 1: Yönteme şematik genel bakış . (A) Yaş senkronize C. elegans popülasyonları zamanlanmış bir yumurtlama tarafından üretilir. (B) Aynı popülasyondan gelen hayvanlar, farklı zaman noktalarında 384 kuyucuklu bir plakada görüntülenir. (C) Fayanslar, hayvan başına dahil etme sayılarını ölçmek için CellProfiler'da analiz edilen tüm kuyuların görüntülerini oluşturmak için bir araya getirilir. (D) Veriler AmyloFit kullanılarak matematiksel bir modele yerleştirilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
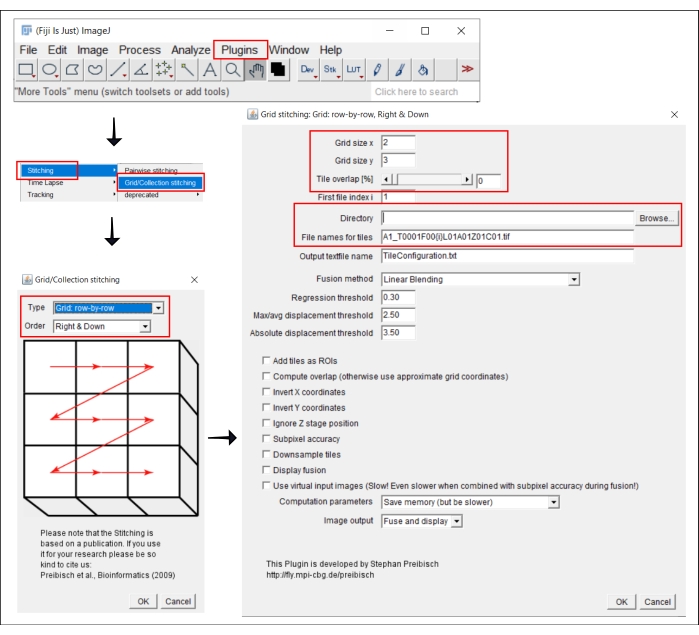
Şekil 2: ImageJ'deki dikiş prosedürünün ekran görüntüleri eklenti Izgara / Koleksiyon dikiş21. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3: Ekleme sayılarını ölçmek için CellProfiler işlem hattının şeması. (A-C) Solucanları tanımlamak için parlak alan görüntüsü (A) kullanılır (B, C'de yakın çekim). (D-G) Floresan görüntü (D, E'de yakın çekim), kapanımları (F) tanımlamak için kullanılır. Solucanlar ve kapanımlar, kuyudaki (G) her solucan için kapanım sayısını sağlamakla ilgilidir. Gösterilen görüntüler, yetişkinliğin 3. günündeki Q40 satır A hayvanlarına aittir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
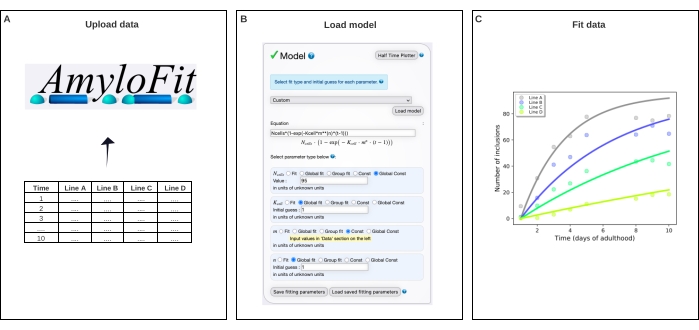
Şekil 4: Verileri AmyloFit'teki matematiksel bir modele sığdırma. (A) Veriler AmyloFit'e yüklenir. (B) Her hücredeki bağımsız çekirdeklenme olaylarını varsayarak dahil etme oluşumunu modellemek için özel bir denklem girilir. (C) Farklı Q40-YFP seviyelerini ifade eden C. elegans çizgileri A-D için toplama kinetiğinin takılması. Veriler iki bağımsız biyolojik kopyayı temsil etmektedir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Veri kümesi 1 | Veri kümesi 2 | Sinnige ve ark.17 | |
| n | 2.1 | 1.9 | 1.6 |
| Khücresi (moleküller M-n d-1 hücre-1) | 9,9 x 105 | 1,4 x 105 | 3,1 x 104 |
| 1 mM'de çekirdeklenme hızı (moleküller d-1 hücresi-1) | 0.38 | 0.21 | 0.35 |
Tablo 1: Q40-YFP agregasyonunun çekirdeklenme hızı ve reaksiyon sırası değerleri. Protokolün iki bağımsız biyolojik kopyası için veriler ve daha önce yayınlanmış verilerle karşılaştırma17.
Tartışmalar
Burada sunulan yöntem, model organizma C. elegans'taki protein agregasyon kinetiğinin tarafsız ve nicel bir analizini kolaylaştırır. Dört temel unsura bağlıdır (Şekil 1): 1) yaş senkronize bir nematod popülasyonunu korumak; 2) çok kuyulu plakalarda floresan mikroskopi; 3) CellProfiler'da otomatik dahil etme sayımı; 4) AmyloFit'te veri sığdırma. Serbestçe hareket eden hayvanlarda veya kaydedilmiş görüntülerden26 inklüzyonların manuel olarak sayılmasıyla karşılaştırıldığında, CellProfiler'daki niceleme hem daha hızlı hem de daha tarafsızdır. Protokolün diğer önemli ilerlemesi, verileri matematiksel bir modele uydurduktan sonra toplama mekanizmasına nicel içgörüler sağlayan tek zaman noktaları yerine kinetik verilerin elde edilmesidir.
Protokolün dört elemanı, uygulamaya bağlı olarak değiştirilebilen bağımsız modüller olarak kullanılabilir. Yaş senkronize popülasyonlar, hayvanları sterilize etmek için 5-floro-2′-deoksiüridin (FUDR) kullanılarak da korunabilir. Bu bileşik ömrü ve proteostazı24,25 etkiler ve deneyci için oldukça kanserojendir; Bununla birlikte, solucanların manuel transferini engeller, bu da çok sayıda işlendiğinde emek yoğun olabilir. Diğer alternatifler, yavruları ayırmak için steril mutantların29 veya filtrasyon cihazlarınınkullanılmasıdır 30.
Floresan mikroskobu adımı, örneğin nöronlardaki protein agregasyonunu izlemek için daha yüksek büyütmeler kullanılarak da ayarlanabilir. Geniş alan mikroskopisi, koşullar arasındaki nispi farkın mutlak inklüzyon sayılarından daha önemli olduğu durumlarda kas hücrelerinde poliQ agregasyonunu izlemek için yeterli olabilir. CellProfiler ardışık düzeni bu durumlarda hala kullanılabilir, ancak solucanları ve eklemeleri tanıma ayarlarının kullanıcı tarafından ayarlanması gerekir. Tekniğin verimi şu anda hayvanların 384 kuyucuklu plakaya manuel olarak toplanması ihtiyacı ile sınırlıdır. Bu, mikroakışkan cihazların kullanımıyla potansiyel olarak düzeltilebilir16. Sodyum azid, hidrojeller veya boncuklarla fiziksel immobilizasyon ile değiştirilebilen nispeten sert bir anesteziktir28,29.
Burada sunulan AmyloFit'teki analiz, bireysel hücrelerdeki bağımsız çekirdeklenme olaylarından oluşan bir toplama mekanizmasına dayanmaktadır. Bu modelin uymadığı durumlarda, kullanıcı daha önce geliştirilen kooperatif toplama modeli gibi bir alternatif düşünmelidir17. Bu yaklaşımın bir sınırlaması, ilgilenilen proteini farklı konsantrasyonlarda ifade eden suşların mevcut olması gerektiğidir, ancak bunlar rutin C. elegans yöntemleri24 kullanılarak üretilebilir.
Toplamda, bu protokol, in vivo model bir sistemde protein toplama kinetiği için yüksek kaliteli veriler elde etmek için araçlar sağlar ve toplama mekanizmalarının ayrıntılı analizine izin verir17. Yöntem, C. elegans kas dokusunda poliQ agregasyonu için gösterilmiş olmasına rağmen, protokolün gelecekteki uygulamaları diğer proteinleri ve dokuları ve proteostaz faktörlerinin ve küçük moleküllerin etkilerini içerebilir.
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
C. elegans suşları için Morimoto laboratuvarına ve yüksek verimli konfokal mikroskop konusundaki yardımları için Esmeralda Bosman'a teşekkür ederiz. Bu çalışma, Utrecht Üniversitesi'nden T.S.'ye bir start-up hibesi ile finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 384-well plate | Greiner | 781091 | Black with flat clear bottom |
| AmyloFit | Knowles lab | v2.0 | Access at www.amylofit.ch.cam.ac.uk |
| C. elegans Q40 line A | Morimoto lab | AM1228 | Genotype rmIs404[unc-54p::Q40::YFP] |
| C. elegans Q40 line B | Morimoto lab | AM1229 | Genotype rmIs404[unc-54p::Q40::YFP] |
| C. elegans Q40 line C | Morimoto lab | AM1230 | Genotype rmIs404[unc-54p::Q40::YFP] |
| C. elegans Q40 line D | Morimoto lab | AM1231 | Genotype rmIs404[unc-54p::Q40::YFP] |
| CellProfiler | Broad Institute | 4.1.3 | Downloaded from https://cellprofiler.org |
| E. coli OP50 | Caenorhabditis Genetics Center (CGC) | OP50 | |
| FIJI | Open-source | (Fiji Is Just) ImageJ v2.1/1.5.3j | Downloaded from https://imagej.net/software/fiji/ |
| High-throughput confocal microscope | Yokogawa | CellVoyager CV7000S | |
| M9 buffer | Home-made | 3 g/L KH2PO4, 6 g/L Na2HPO4, 0.5 g/L NaCl, 1 mM MgSO4 | |
| NGM plates | Home-made | 17 g/L agar, 2.5 g/L bacto-peptone, 3 g/L NaCl, 25 mM KPO4 buffer pH 6.0, 1 mM MgSO4, 1 mM CaCl2, 5 mg/L cholesterol | |
| Pasteur pipette | WU Mainz | 250 | To make worm pick, 150 mm length |
| Platinum iridium wire | Alfa Aesar | 39383 | To make worm pick, 0.25 mm diameter |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Stereomicroscope | Leica | S9 |
Referanslar
- Knowles, T. P. J., Vendruscolo, M., Dobson, C. M. The amyloid state and its association with protein misfolding diseases. Nature Reviews. Molecular Cell Biology. 15 (6), 384-396 (2014).
- Chiti, F., Dobson, C. M. Protein misfolding, amyloid formation, and human disease: a summary of progress over the last decade. Annual Review of Biochemistry. 86 (1), 27-68 (2017).
- Knowles, T. P. J., et al. An analytical solution to the kinetics of breakable filament assembly. Science. 326 (5959), 1533-1537 (2009).
- Cohen, S. I. A., et al. Proliferation of amyloid-β42 aggregates occurs through a secondary nucleation mechanism. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9758-9763 (2013).
- Meisl, G., et al. Molecular mechanisms of protein aggregation from global fitting of kinetic models. Nature Protocols. 11 (2), 252-272 (2016).
- Satyal, S. H., et al. Polyglutamine aggregates alter protein folding homeostasis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 97 (11), 5750-5755 (2000).
- Morley, J. F., Brignull, H. R., Weyers, J. J., Morimoto, R. I. The threshold for polyglutamine-expansion protein aggregation and cellular toxicity is dynamic and influenced by aging in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 99 (16), 10417-10422 (2002).
- Brignull, H. R., Moore, F. E., Tang, S. J., Morimoto, R. I. Polyglutamine proteins at the pathogenic threshold display neuron-specific aggregation in a pan-neuronal Caenorhabditis elegans model. Journal of Neuroscience. 26 (29), 7597-7606 (2006).
- Moronetti Mazzeo, L. E., Dersh, D., Boccitto, M., Kalb, R. G., Lamitina, T. Stress and aging induce distinct polyQ protein aggregation states. Proceedings of the National Academy of Sciences of the United States of America. 109 (26), 10587-10592 (2012).
- Prahlad, V., Morimoto, R. I. Neuronal circuitry regulates the response of Caenorhabditis elegans to misfolded proteins. Proceedings of the National Academy of Sciences of the United States of America. 108 (34), 14204-14209 (2011).
- Nollen, E. A. A. Genome-wide RNA interference screen identifies previously undescribed regulators of polyglutamine aggregation. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6403-6408 (2004).
- Silva, M. C., et al. A genetic screening strategy identifies novel regulators of the proteostasis network. PLoS Genetics. 7 (12), 1002438(2011).
- Brehme, M., et al. A chaperome subnetwork safeguards proteostasis in aging and neurodegenerative disease. Cell Reports. 9, 1-16 (2014).
- Calamini, B., et al. Small-molecule proteostasis regulators for protein conformational diseases. Nature Chemical Biology. 8 (2), 185-196 (2012).
- Sinnige, T., Stroobants, K., Dobson, C. M., Vendruscolo, M. Biophysical studies of protein misfolding and aggregation in in vivo models of Alzheimer's and Parkinson's diseases. Quarterly Reviews of Biophysics. 49, 22(2020).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nature Communications. 7, 13023(2016).
- Sinnige, T., et al. Kinetic analysis reveals that independent nucleation events determine the progression of polyglutamine aggregation in C. elegans. Proceedings of the National Academy of Sciences of the United States of America. 118 (11), 202188118(2021).
- Brenner, S. Caenorhabditis elegans. Methods. 77 (1), 71-94 (1974).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- FIJI/ImageJ. , Available from: https://imagej.net/downloads (2012).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Lamprecht, M. R., Sabatini, D. M., Carpenter, A. E. CellProfiler: free, versatile software for automated biological image analysis. BioTechniques. 42 (1), 71-75 (2007).
- CellProfiler. Broad Institute. , Available from: https://cellprofiler.org/releases (2021).
- Mello, C. C., Kramer, J. M., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrachromosomal maintenance and integration of transforming sequences. EMBO Journal. 10 (12), 3959-3970 (1991).
- Knowles group, University of Cambridge. , Available from: https://amylofit.com/amylofitmain/login/ (2021).
- Lazaro-Pena, M. I., Cornwell, A. B., Samuelson, A. V. Quantifying tissue-specific proteostatic decline in Caenorhabditis elegans. Journal of Visualized Experiments: JoVE. (175), (2021).
- Feldman, N., Kosolapov, L., Ben-Zvi, A. Fluorodeoxyuridine improves Caenorhabditis elegans proteostasis independent of reproduction onset. PLoS One. 9 (1), 85964(2014).
- Brunquell, J., Bowers, P., Westerheide, S. D. Fluorodeoxyuridine enhances the heat shock response and decreases polyglutamine aggregation in an HSF-1-dependent manner in Caenorhabditis elegans. Mechanisms of Ageing and Development. 141-142, 1-4 (2014).
- David, D. C., et al. Widespread protein aggregation as an inherent part of aging in C. elegans. PLoS Biology. 8 (8), 47-48 (2010).
- Hunter, S., Maulik, M., Scerbak, C., Vayndorf, E., Taylor, B. E. Caenorhabditis sieve: A low-tech instrument and methodology for sorting small multicellular organisms. Journal of Visualized Experiments: JoVE. (137), (2018).
- Burnett, K., Edsinger, E., Albrecht, D. R. Rapid and gentle hydrogel encapsulation of living organisms enables long-term microscopy over multiple hours. Communications Biology. 1, 73(2018).
- Dong, L., et al. Reversible and long-term immobilization in a hydrogel-microbead matrix for high-resolution imaging of Caenorhabditis elegans and other small organisms. PLoS One. 13 (3), 0193989(2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır