Method Article
Çift Odalı Geçirgen Destek Sisteminde Köpek Bağırsak Organoidleri
Bu Makalede
Özet
Burada, çift odacıklı, geçirgen bir destek sisteminde köpek bağırsak organoidlerinin kültürünü tanımlayan bir protokol sunuyoruz. Geçirgen desteklerde organoid tohumlama, tek katmanlı bakım ve ardından ilaç geçirgenliği deneyleri anlatılmaktadır.
Özet
Geçirgen destek sistemi tipik olarak geleneksel iki boyutlu (2D) hücre hatları ile birlikte, yeni terapötik ilaç adaylarının oral geçirgenliğini değerlendirmek için in vitro bir araç olarak kullanılır. Bununla birlikte, bu geleneksel hücre hatlarının kullanımı, sıkı bağlantıların değiştirilmiş ekspresyonu, kısmi hücre farklılaşması ve anahtar nükleer reseptörlerin yokluğu gibi sınırlamalara sahiptir. Bu eksikliklere rağmen, Caco-2 ve MDCK modelleri, insan in vivo oral geçirgenliğinin tahmini için yaygın olarak kabul edilmekte ve doğrulanmaktadır.
Köpekler, gastrointestinal anatomi ve bağırsak mikroflorasındaki insanlarla benzerlikleri nedeniyle biyomedikal araştırmalar için uygun bir translasyonel modeldir. Buna göre ve paralel ilaç geliştirmeyi desteklemek için, hem köpeklerde hem de insanlarda in vivo ilaç geçirgenlik özelliklerini tahmin etmek için etkili ve doğru bir in vitro aracın detaylandırılması oldukça arzu edilmektedir. Böyle bir araç, yetişkin kök hücrelerden türetilen üç boyutlu (3D), kendiliğinden monte edilmiş epitel yapıları ile karakterize edilen köpek bağırsak organoid sistemi olabilir.
(1) Geçirgen Destek Tohumlama Protokolü, eklerdeki köpek organoidlerinin ayrışması ve tohumlanması için deneysel yöntemleri açıklar. Köpek organoid izolasyonu, kültürü ve hasadı daha önce bu özel sayıda ayrı bir protokol setinde açıklanmıştır. Köpek bağırsak organoid monokatmanının genel bakımı için yöntemler (2) Tek Katmanlı Bakım Protokolü'nde ayrıntılı olarak tartışılmıştır. Ek olarak, bu protokol, transepitelyal elektrik direnci (TEER) ölçümleri ve ışık mikroskobu yoluyla tek katmanın yapısal bütünlüğünü değerlendirmek için yöntemleri açıklamaktadır. Son olarak, (3) Geçirgenlik Deney Protokolü, deneysel sonuçların in vitro doğrulaması da dahil olmak üzere, bir deneyden hemen önceki görevleri tanımlar.
Genel olarak, köpek organoid modeli, çift odacıklı bir hücre kültürü teknolojisi ile birleştirildiğinde, 2D deneysel modellerle ilişkili sınırlamaların üstesinden gelir, böylece hem köpek hem de insan hastada terapötik ilaç adaylarının görünür oral geçirgenliğinin tahminlerinin güvenilirliğini arttırır.
Giriş
Geçirgen destek sistemleri tipik olarak terapötik ilaç adaylarının bağırsak epitel bariyeri 1,2 yoluyla görünür geçirgenliğini belirlemek için kullanılır. Ayrıca hücresel sekresyon3, hücre göçü4 ve ilaç toksisitesi5'i değerlendirmek için de kullanılabilirler. In vitro oral ilaç geçirgenlik testleri, ilaç keşif ve geliştirme süreci2'de önemli bir adımdır ve bireysel ilaç adayları ilaç Ar-Ge yaşam döngüsünün erken aşamasında test edilmektedir6. Geçirgen destek sistemi, çok kuyulu bir plakaya yerleştirilmiş yarı gözenekli bir zara sahip bir uçtan oluşan çift odacıklı bir hücre kültürü aparatıdır. Bu sistem, kesici uç7'de yetiştirilen bir hücre monokatmanının apikal ve bazolateral taraflarına doğrudan erişim sağlar. Bu sistemlerde kullanılan tek katmanlı tipik olarak gastrointestinal epitel hücrelerinden (örneğin, insan kolorektal adenokarsinomu Kako-2 hücre hattı)8 türetilir. Hücre kültürleri, bağırsak epitel hücrelerinin doğal mikromimarisini taklit eden polarize bir durumda büyür ve daha fazla hücresel farklılaşma, benzer mikroanatomi ve işlev7'yi mümkün kılar. Geçirgen destek ekinin ayrıntıları Şekil 1'de bulunabilir. Geleneksel olarak bağırsak ilaç geçirgenliğini değerlendirmek için kullanılan 2D hücre kültürlerine sahip eklerin tohumlanması, nispeten uygun fiyatlı ve kültür9'a kolaydır. Bu sistemler, terapötik ilaç adaylarının bağırsak metabolizmasını tahmin etme kapasitelerinin sınırlı olması da dahil olmak üzere birkaç önemli sınırlama sunar10,11. Bu, epitel hücreleri arasındaki sıkı kavşaklardan pasif emilim, efflux yoluyla aktif transepitelyal absorpsiyon veya alım taşıyıcıları (örneğin, P-glikoprotein, monokarboksilat taşıyıcı 1) ve enterositler tarafından metabolize edilen ilaçlar gibi tüm ilaç emilim mekanizmaları için geçerlidir.
Köpekler insanlarla ortak bir ortamı ve diyeti paylaşırlar12. Köpek bağırsak anatomisi ve mikrobiyom bileşimi, son 36.000 yılda evcilleştirmeye ve paylaşılan diyetlere atfedilen 13 insanlarınkine çok benzemektedir14. Ne yazık ki, bu benzerlikler hastalık gelişimi için yaygın nedenler / tetikleyiciler de olabilir. Köpekler, obezite 15, inflamatuar bağırsak hastalığı 16, kolorektal adenokarsinom17, gastrointestinal stromal tümör (GİST)18 ve göreceli uzun ömürlülükleri 19 ile ilişkili diğer çeşitli patolojiler gibi insanlara benzer kronik morbiditeler geliştirir. Buna göre, köpek organoidleri, Tek Sağlık Girişimi20'nin ruhuna uygun olarak bu kronik multifaktöriyel hastalıkların ters translasyonel araştırması için başarıyla kullanılabilir.
Kako-2 hücreleri, ilaç oral absorpsiyon tahlilleri21 için en çok kullanılan hücre hatlarıdır. Bu hücreler şu anda in vitro bağırsak geçirgenlik testleri2,22,23 için "altın standart" model olarak kabul edilmektedir. Caco-2 hücre hattı, insan bağırsak sisteminde bulunan efflux ve alım taşıyıcılarını ifade eder, ancak farklı ekspresyon seviyelerinde24,25,26. Kako-2 hücreleri ayrıca bir ilacın bağırsak efflux taşıyıcılarının bir substratı mı yoksa inhibitörü mü olduğunu belirlemek için model olarak yaygın olarak kullanılmaktadır22,27. Caco-2 hücreleri kolonik kökenli olmasına rağmen, bir enterosit hücresini taklit ederler. Ne yazık ki, Caco-2 hücreleri, ince bağırsak9'un epitel tabakasından sadece bir hücre tipini temsil eder, bu da karmaşık bağırsak epitel hücre tipi bileşimini doğru bir şekilde özetleyemez. Örneğin, mukus üretimine adanmış kadeh hücreleri Kako-2 kültürlerinde yoktur, böylece mukus-ilaç etkileşimleri diğer hücre hatları28 ile kokültür olmadan değerlendirilemez. Ayrıca, Caco-2 kültürleri, gebelik X reseptörü (PXR), steroid X reseptörü (SXR) ve kurucu androstan reseptörü (CAR)29 gibi bağırsakta tipik olarak bulunan önemli nükleer reseptörlerin birkaçını ifade etmez. Sonuç olarak, Kako-2 kültürleri, bu reseptörlerin indükleyicileri olan bazı ilaçlar (örneğin, rifampin) tarafından ilaç taşıyıcılarının ve enzimlerinin indüksiyonunu modellemede başarısız olurlar30.
3D intestinal organoid teknolojisi bu sınırlamaların bazılarını ele alır19. Organoidler, mikroinvaziv teknikler kullanılarak toplanan doku örneklerinden oluşturulabilen yetişkin kök hücrelerden elde edilen kendiliğinden monte edilmiş yapılardır20. İnsan kaynaklı pluripotent kök hücreler bağırsak geçirgenlik modelleri için kullanılmaktadır31,32. Köpek organoidleri, insan organoidlerine uygun bir alternatif sağlar, çünkü insan kök hücre araştırması etik konularla sınırlıdır33. Ayrıca, köpek organoidleri, köpek ilacı geçirgenliğini, metabolizmasını, aktif taşınmasını ve ilaç-ilaç etkileşimlerini keşfetmek için in vitro bir sistem sağlar. Bu teknoloji boşluğunu gidermek için, geçirgen bir destek sisteminde köpek bağırsak organoidlerinin tutarlı ve güvenilir büyümesi tanımlanmıştır34. Köpek bağırsak organoidleri ile yapılan bir geçirgenlik testi, şu anda kullanılan testlere (Caco-2) kıyasla köpek bağırsak geçirgenliğini ve küçük ilaç moleküllerinin metabolizmasını potansiyel olarak öngörebilir. Bu önemli özelliklerin doğrulanması, bu yeni in vitro sistemi, indükleyicilerin hücre içi metabolizma ve aktif taşıma üzerindeki potansiyel etkisini araştıran gelecekteki çalışmalara ödünç vermektedir.
Köpek organoidleri, tipik olarak bağırsağın epitel tabakasında bulunan tüm hücre tiplerinden oluşur. İşlevsel ve mikroanatomik bir bakış açısıyla, köpek bağırsağının epitel tabakasının ortamını güvenilir bir şekilde çoğaltırlar19,35. Ayrıca, mukus, köpeklere özgü ilaç taşıyıcıları ve enzimlerin varlığı ve köpek bağırsak organoidlerinde genel hücresel farklılaşma, köpeklerde in vivo olarak görülenlerle karşılaştırılabilir34. Böylece, organoidler hastalıklı veteriner hastalardan izole edilebilir ve çeşitli hastalık süreçlerinin (örneğin, kronik bağırsak iltihabı) köpek oral ilaç geçirgenliği üzerindeki etkisini modellemek için kullanılabilir19,36. Köpek bağırsak organoid sistemi, ilaç geçirgenlik deneylerinden başka ortamlarda da kullanılabilir. Bu 3D yapılar, Chandra ve ark. tarafından daha önce tanımlandığı gibi hastalıklı hastalardan izole edilebilir. inflamatuar bağırsak hastalığı, kolorektal adenokarsinom ve gastrointestinal stromal tümör19.
Geçirgen Destek Tohumlama Protokolü, eklerde köpek bağırsak organoid kültürleri oluşturma yöntemlerini açıklar. Bu ilk protokol, hücre dışı membran matrisinde kaplanmış yerleşik köpek organoid kültürlerini ayrıştırma yöntemlerini özetlemektedir. Ayrıca, eklerin kollajen I ve hücre dışı membran matrisi ile ön kaplaması bu protokolde tartışılmıştır. Köpek organoidlerinin geçirgen destek uçlarına gömülmesi de ayrıntılı olarak açıklanmaktadır.
İkinci protokol, bir kesici uçta kaplanmış köpek 3D organoidlerinin genel bakımını içeren Tek Katmanlı Bakım Protokolüdür. Kültürü yenilemek için kullanılan organoid ortamın sıklığı ve hacimleri ve hücre kültürü hasarını önlemenin yolları, epitel tek katmanının akıcılığını değerlendirmek için deneysel yöntemlerle birlikte bu ikinci protokolde sunulmaktadır.
Son olarak, Geçirgenlik Deneysel Protokolü, bir geçirgenlik testindeki köpek bağırsak 3D organoidlerinin deneysel kullanıma hazır olup olmadığını ve herhangi bir deney yapmadan önce gerekli doğrulama adımlarını belirlemenin yollarına odaklanmaktadır. Bu bölüm ayrıca, tek katmanlı kültürün odalarında terapötik ilaç adaylarının inkübasyonu ve örneklemesi ile birlikte bir geçirgenlik deneyinin kurulumunu ve başarılı bir şekilde yürütülmesini açıklamaktadır. Tek katmanlı bütünlüğü izlemek için düşük geçirgenliğe sahip floresein izotiyosiyanatın (FITC-dextran) kullanımı da tartışılmaktadır. Son olarak, bir deneyin sonuçlanmasından sonra sonuçları doğrulamak için in vitro bir değerlendirme yöntemi açıklanmaktadır. Geçirgenlik deneyleri son derece geniş bir konudur ve Hubatsch ve ark.37 tarafından çok iyi özetlenmiştir. Protokollerin iş akışı Şekil 2'de özetlenmiştir.
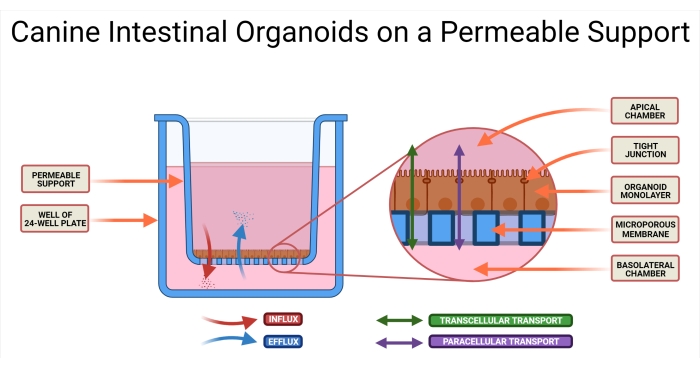
Şekil 1: Geçirgen bir destek sistemi üzerindeki köpek bağırsak organoidleri. Geçirgen destek kesici ucu, 24 delikli bir plakanın kuyuğuna yerleştirilmiştir. Mikro gözenekli membran, ayrışmış köpek bağırsak organoidlerinin tohumlanmasına izin verir ve bu hücreler sonunda bir organoid 2D tek katman oluşturur. Bu teknoloji, tek katmanın hem AP hem de BL taraflarına erişim sağlar. Organoid ortam, geçirgen desteğin hem AP hem de BL odalarına sokulur. İlaç adayının absorpsiyonu (AP→BL) ve sekresyonu (BL→AP) ve iki olası ilaç taşıma şekli gösterilmiştir. Kısaltmalar: AP = apikal; BL = bazolateral. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
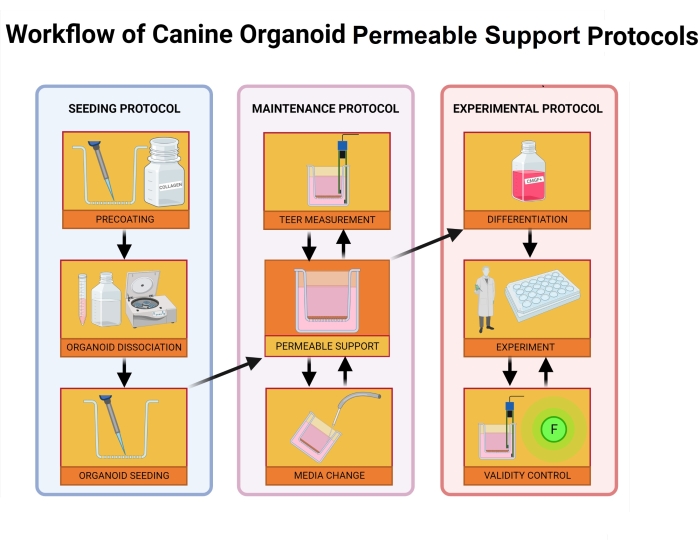
Şekil 2: Köpek organoid geçirgen destek protokollerinin iş akışı. Geçirgen destek parçası, hücre dışı membran matrisi ve kollajen I karışımı ile önceden kaplanır ve 1 saat boyunca inkübe edilir. Kuluçka işlemi sırasında, organoid kültür ayrışır. Bireysel organoid hücreler ekte tohumlanır, bazolateral odadaki ortam tohumlamadan hemen sonra eklenirken, tohumlama işlemi tamamlandıktan 24 saat sonra apikal odaya orta eklenir. Organoidlerin bakımı ve izlenmesi, düzenli ortam değişikliklerini, TEER değer ölçümlerini ve tek katmanın bütünlüğünü değerlendirmek için ışık mikroskobunu içerir. Deneyden önce, organoidler ROCK inhibitörü ve GSKiβ'yi ortamdan çıkararak ayırt edilmelidir. TEER değerleri deney gününde ölçülür ve organoid tek katmanlı hücrelere zarar vermek için ışık mikroskobu ile incelenir. Ortam daha sonra uygun bir tampon ile değiştirilir ve deneyden önce inkübe edilir. FITC-dextran testi, bağırsak geçirgenlik deneyleri39 sırasında tek katmanlı bütünlüğün bir belirteci olarak kullanılır. TEER ölçümleri deneyden sonra alınır ve ışık mikroskobu 24 saat sonra sonuçları doğrular. Kısaltmalar: TEER = transepitelyal elektrik direnci; ROCK = rho ile ilişkili kinaz; GSKiβ = glikojen sentaz kinaz beta; F = floresan. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protokol
Araştırma, Iowa Eyalet Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC-19-337; IACUC-18-065; IACUC-19-017). Aşağıdaki bölümde (adım 1.1-1.3) Geçirgen Destek Tohumlama Protokolü açıklanmaktadır ve yordamlar Şekil 3'te özetlenmiştir.
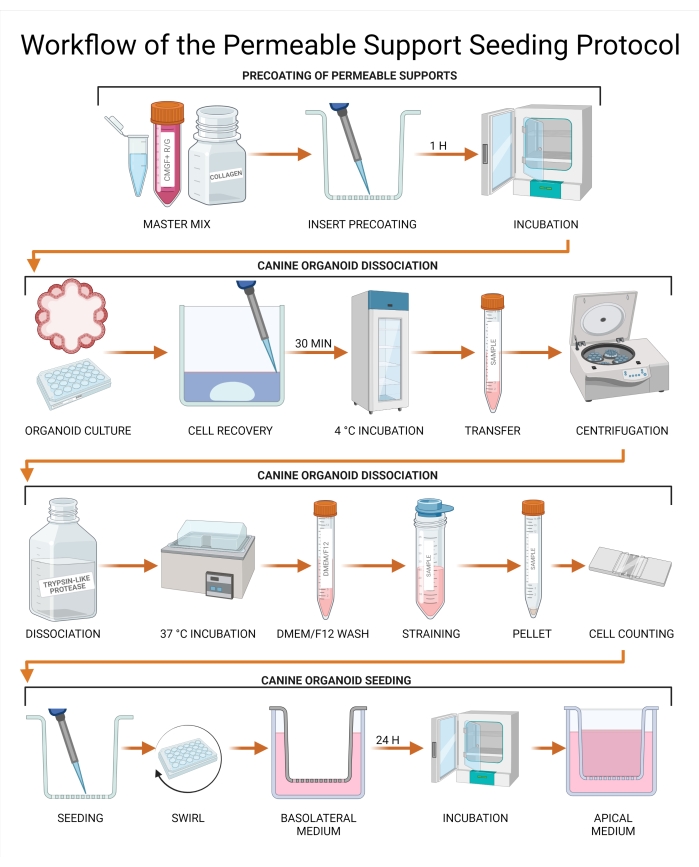
Şekil 3: Geçirgen destek tohumlama protokolünün iş akışı. Geçirgen destek uçları, CMGF + R / G, kollajen I ve hücre dışı membran matrisinin bir kombinasyonu ile önceden kaplanır ve daha sonra inkübe edilir. Köpek organoid kültüründen elde edilen ortamlar aspire edilir ve bir Hücre Kurtarma Çözeltisi ile değiştirilir, ardından 4 ° C'de 30 dakikalık bir inkübasyon yapılır. Kültür daha sonra bir tüpe aktarılır ve tripsin benzeri proteaz kullanılarak organoid ayrışma gerçekleştirilir. Ayrışmamış organoidler, tek hücreli bir süspansiyon elde etmek için bir süzgeçten geçirilerek çıkarılır ve hücre konsantrasyonu bir hemositometre veya otomatik bir hücre sayacı kullanılarak belirlenir. Hücreler geçirgen bir destek eki üzerine tohumlanır ve bazolateral odaya CMGF + R / G eklenir. Kültür daha sonra 24 saat boyunca inkübe edilir ve kalan sıvı apikal odadan çıkarılır ve CMGF + R / G ile değiştirilir. GSKiβ = glikojen sentaz kinaz beta; CMGF + R / G = ROCK inhibitörü ve GSKiβ ile geliştirilmiş büyüme faktörlerine sahip tam ortam. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
1. Geçirgen destek tohumlama protokolü
- Geçirgen destek uçlarının ön kaplaması
- Tablo 1'deki bilgilere göre Rho ile ilişkili protein kinaz (ROCK) inhibitörü ve glikojen sentaz kinaz-beta inhibitörü (GSKiβ) (CMGF + R / G) ile güçlendirilmiş büyüme faktörleri ile Tam ortam hazırlayın.
- Bir buz kovası hazırlayın ve hücre dışı membran matrisini buz üzerinde eritmeye başlayın. Ön ısıtmak için inkübatöre gerekli sayıda kesici uç içeren 24 delikli bir plaka yerleştirin. Sıçan kuyruğu kollajen I (3 mg / mL) toplayın ve ışıktan korurken buzun üzerine yerleştirin. CMGF + R / G'yi toplayın ve buzun üzerine yerleştirin.
- Her kesici uç için kaplama çözeltisinin 100 μL'sini bir kenara bırakarak deney için gereken toplam kesici uç ve boşluk sayısını hesaplayın.
NOT: İhtiyaçtan daha fazla kaplama çözeltisi hazırlayın; İhtiyaçtan en az% 15 daha fazla hazırlanması önerilir. - 15 mL'lik bir tüpte, CMGF + R / G'yi hücre dışı membran matrisi (% 1) ve kollajen I (% 1) ile karıştırın ve hafifçe pipet karışımı yapın.
- Her polyester kesici ucu 100 μL kaplama çözeltisi ile kaplayın ve kesici uçları 1 saat boyunca inkübatöre (37 °C; %5 CO2 atmosfer) yerleştirin.
- Kuluçkadan sonra, bir vakum aspiratörü veya P1000 pipet kullanarak kaplama çözeltisini her bir kesici uçtan dikkatlice aspire edin ve kesici uç filtresini rahatsız etmemeye dikkat edin. Sıcak tutmak için inkübatöre önceden kaplanmış bir plaka yerleştirin.
- Köpek organoid ayrışması
NOT: En az dört gün boyunca kültürlenmiş köpek organoidleri kullanın. Ayrışmaya başlamadan önce, bir numunenin ne zaman sağlıklı, yoğun ve deney için yeterli olduğunu belirlemek için Gabriel ve ark.38'e bakınız. Her kuyu kaplama prosedürü için ekstra bir organoid kuyucuğunun ayrıştırılması önerilir. Ayrıca, düzensiz organoid büyümesini veya yanlış manipülasyonun neden olduğu hasarı hesaba katmak için istenen kesici uç sayısının ~% 20 oranında artırılması önerilir. FITC-dextran kullanmayı planlıyorsanız, ekstra kuyucuklar hazırlayın.- Biyogüvenlik kabininde bir buz kovası ve soğuk 1x Gelişmiş DMEM/F12 stoğundan oluşan bir şişe hazırlayın.
- Çözülmeye başlamak için hücre dışı membran matrisini buzun üzerine yerleştirin, hızlı çözülmeye karşı korumak ve katılaşmasını önlemek için buza batırın. Hücre dışı membran matrisinin kaplanması için dondurucuya bir kutu pipet ucu (P200) yerleştirin.
- Soğutulmuş bir santrifüjü 4 °C'ye kadar önceden soğutun.
- CMGF+ R/G'yi dondurucudan/buzdolabından 37 °C su banyosuna taşıyın. Mümkün olduğunda doğrudan ışığa maruz kalmaktan kaçının.
- Hücre dışı membran matrisini rahatsız etmemeye özen gösterirken, uygun sayıda kuyucuk (2-4 kesici uç başına 24 delikli bir plakanın 1 kuyucuğu) için organoid kültürlü 24 delikli plakadan tüm ortamları çıkarın.
NOT: Birim, kullanılan hücre sayma sistemine bağlı olarak değişebilir. - Hücre dışı membran matris kubbelerini çözmek için kuyu başına 0,5 mL önceden soğutulmuş Hücre Kurtarma Çözeltisi ekleyin.
- Tabağı buzdolabında (4 °C) 30 dakika boyunca inkübe edin.
- Süspansiyonu pipetleyin, tüm organoidleri ve çözünmüş hücre dışı membran matrisini toplayın ve bunları 15 mL'lik bir tüpe aktarın.
- Santrifüj (4 ° C'de 5 dakika boyunca 700 × g) ve pelet rahatsız etmediğinizden emin olarak, seviye 0,5 mL işaretine ulaşana kadar süpernatantı çıkarın.
- 1 mL tripsin benzeri proteaz ekleyin ve 37 °C su banyosunda 8 dakika boyunca inkübe edin. Hücreleri karıştırmak için kuluçka döneminde tüpü birkaç kez hafifçe vurun.
- Numune ile tüpü bir biyogüvenlik kabinine geri aktarın ve tripsin benzeri proteazı inaktive etmek ve hücre ayrışmasını durdurmak için yavaşça 7 mL önceden soğutulmuş Gelişmiş DMEM / F12 ekleyin.
- 1 mL Gelişmiş DMEM/F12 ile 40 μm hücre süzgecini önceden ıslatın. Karışımı yavaşça pipetin ve süspansiyonu süzün; pipet ek Gelişmiş DMEM/F12 süzgeci durulamak için.
- Tüpü (4 ° C'de 5 dakika boyunca 700 × g) santrifüj edin ve süpernatanı çıkarın. Pelet'i rahatsız etmeyin.
- Hücre peletini, ilişkisiz bırakılan her organoid kuyucuğu için ~ 50-100 μL kültür ortamında (CMGF + R / G) yeniden askıya alın.
- Bir hemositometre veya uygun bir makine kullanarak süspansiyonun bir alt örneğini (~ 10 μL) sayın ve süspansiyondaki toplam hücre sayısını belirleyin.
- Köpek organoid tohumlama
- ML başına ~ 75.000 hücrelik bir hücre konsantrasyonu elde etmek için hücre süspansiyonunu seyreltin veya konsantre edin.
- Transfer sırasında hücre yapışmasını önlemek için BSA (%1) önceden kaplanmış uçları kullanarak süspansiyonun 100 μL'sini her bir kesici uca tohumlayın. Kaplamalı bir kesici ucu, düzenli ortam değişiklikleri almaya devam ederken herhangi bir organoid büyümeden hücresiz bir boşluk olarak ekleyin.
- Tohumlanmış hücreleri kesici uç boyunca dağıtmak için plakayı ~ 30 s boyunca dairesel bir hareketle yavaşça döndürün. Işık mikroskobu ile hücrelerin eşit dağılımını onaylayın.
- Bazolateral odaya 700 μL CMGF + R / G ekleyin ve plakayı 24 saat boyunca inkübatöre (37 ° C; % 5 CO2 atmosfer) yerleştirin.
- 24 saat sonra, hücre süspansiyonunu apikal odadan yavaşça çıkarın ve 200 μL CMGF + R / G ile değiştirin.
2. Organoid hücre tek katmanlı bakım protokolü
NOT: Aşağıdaki bölümde (adım 2.1-2.2) organoid hücre tek katmanlı bakım protokolü açıklanmaktadır. Bu protokolde sunulan prosedürlerin iş akışı Şekil 4'te özetlenmiştir. TEER değer ölçümlerinin standardizasyonuna yardımcı olabilecek not alma tablosu Ek Tablo 1'de sunulmuştur.

Şekil 4: Geçirgen destek kültürü bakımının iş akışı. TEER değerleri elektrotlar (problar) ve bir volt/ohm metre kullanılarak ölçülür. Problar, kuyucuklara yerleştirilmeden önce% 70 alkol ile kimyasal olarak sterilize edilmelidir. Boş ve organoid hücre ekleri ölçülür ve TEER değerleri hesaplanır. Ortam daha sonra hem apikal hem de bazolateral odalarda yenilenir ve kesici uç üzerindeki köpek organoid kültürü ışık mikroskobu kullanılarak görselleştirilir. Organoid kültür veya mikro gözenekli membrandaki yırtıklar protokole göre not edilir ve işlenir. Kısaltma: TEER = transepitelyal elektrik direnci. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- TEER değer ölçümü
NOT: TEER değer ölçümleri, çubuk bağlantılı bir Epitel Volt/Ohm Metre kullanılarak gerçekleştirilir. Üreticinin kullanım talimatlarına bakın. TEER değerleri, köpek organoid monokatmanının bütünlüğü hakkında bilgi sağlar.- Hücre kültürü büyümesi sırasında her alternatif günde TEER değer ölçümleri yapın.
- Epitel Volt/Ohm Metreyi ve elektrotlarını biyogüvenlik kabinine taşıyın. Kullanmadan önce elektrotları% 70 alkolle kimyasal olarak sterilize edin. İşlevi Ohm olarak ayarlayın. Elektrotlar kuruyana kadar en az bir dakika bekleyin.
- İlk ölçümü yapmadan önce, tel elektrodu porta yerleştirin ve gücü açın. Ölçüm çubuğunun, yemek çubuklarını ölçmek yerine tel elektrot eki ile 1.000 Ω gösterdiğinden emin olun. Durum böyle değilse, cihazı ayarlayın.
- Elektrotları hücresiz ekin apikal ve bazolateral odasına yerleştirin (boş), böylece apikal oda daha kısa elektrodu içerir ve bazolateral oda daha uzun elektrodu içerir ( Şekil 4'te görüldüğü gibi). Membrana dokunmayın, ancak aynı zamanda elektrotların ortama batırıldığından emin olun.
- Değer dengelenene kadar birkaç saniye bekleyin ve değeri bir laboratuvar kitabına not edin. Kalan köpek organoid monokatmanlarını ölçün, farklı numuneleri ölçerken elektrotları% 70 alkolle sterilize ettiğinizden emin olun. Organoid tek katmana elektrotla dokunmamaya dikkat edin.
- Ölçümler alındıktan sonra, elektrotları son kez% 70 alkol ile sterilize edin. Onları uygunsuz manipülasyonun neden olduğu hasarlardan koruduğunuzdan ve üreticinin talimatlarına göre sakladığınızdan emin olun.
- Eq (1) kullanarak her kuyu için TEER değerlerini hesaplayın, burada Rnumunesi ve Rboşluğu , sırasıyla tek katmanlı ve boş kuyucuklardan gelen ohm (Ω) değerleridir ve alan (cm²) kesici ucunkidir.
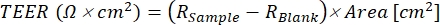 (1)
(1)
- Tek katmanlı bakım
NOT: Tablo 2'de önerilen ortam değişikliği planını gözden geçirin.- Steril tek kullanımlık 9" Pasteur pipetler ve bir vakum aspiratörü kullanarak, ortamı apikalden ve daha sonra bazolateral odalardan nazikçe aspire edin. Orta yüzeyi net bir şekilde görmek için plakayı eğin. Hücre monokatmanının zarar görmesini önlemek için apikal odadaki mikro gözenekli membrana çok yakın aspirasyon yapmaktan kaçının.
NOT: Numuneler arasında hareket ederken yeni bir Pasteur pipet kullanın. Pipetler de bu prosedür için olası bir alternatiftir. - Apikal veya bazolateral odanın duvarını hedefleyen P1000 pipetleri kullanarak CMGF+ R/G'yi yavaşça ekleyin. Tek katmana zarar vermemek için apikal odadaki ortam değişimini çok dikkatli bir şekilde gerçekleştirin.
- Kuyucukları her gün bir ışık mikroskobu altında kontrol edin, kültürün sağlığını değerlendirin ve organoid tek katmanlı veya mikro gözenekli zardaki gözyaşlarını izleyin. Kültürün ayrıntılarını vurgulamak için faz kontrastlı mikroskopi kullanın.
NOT: Köpek organoid tek katmanlı yırtılmalar durumunda, tek katmana iyileşmesi ve yeniden büyümesi için zaman verilir. Mikro gözenekli membran yırtılmaları durumunda, kuyu deneyden çıkarılmalıdır.
- Steril tek kullanımlık 9" Pasteur pipetler ve bir vakum aspiratörü kullanarak, ortamı apikalden ve daha sonra bazolateral odalardan nazikçe aspire edin. Orta yüzeyi net bir şekilde görmek için plakayı eğin. Hücre monokatmanının zarar görmesini önlemek için apikal odadaki mikro gözenekli membrana çok yakın aspirasyon yapmaktan kaçının.
Tablo 2: Organoid kültürler için medya değişikliği önerisi. CMGF + R / G, kuyuların apikal ve bazolateral odasında her alternatif günde bir değiştirilir. Hafta sonu boyunca daha uzun kültür periyodu, hem bazolateral hem de apikal odalarda Cuma öğleden sonra uygulanan ve Pazartesi günü değiştirilen artan bir ortam hacmi gerektirir. Kısaltmalar: ROCK = rho ile ilişkili kinaz; GSKiβ = glikojen sentaz kinaz beta; CMGF + R / G = ROCK inhibitörü ve GSKiβ ile geliştirilmiş büyüme faktörlerine sahip tam ortam. Bu tabloyu indirmek için lütfen tıklayınız.
3. Geçirgenlik deneysel protokolü
NOT: Aşağıdaki bölümde (adım 3.1-3.5) Geçirgenlik Deney Protokolü açıklanmaktadır. Bir ilacın in vitro geçirgenliğini ölçmek için deneysel protokol iş akışı Şekil 5'te özetlenmiştir.
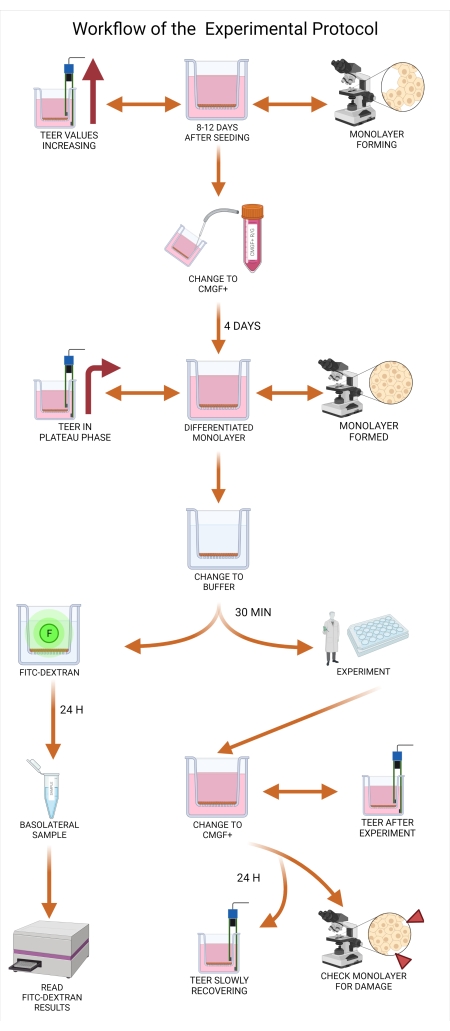
Şekil 5: Deneysel protokolün iş akışı. Organoid ortam, eklerin tohumlanmasından sekiz ila on iki gün sonra CMGF + R / G'den CMGF + 'ya değiştirilmelidir ve hücresel farklılaşmaya izin verilir. Ortamı (hem apikal hem de bazolateral) CMGF + 'ya değiştirdikten sonra, TEER değerleri hala artmalı ve köpek organoid tek katmanı neredeyse akıcılığa ulaşmalıdır. Ortam CMGF + olarak değiştirildikten en az dört gün sonra, tek katmanların hazır olup olmadığı değerlendirilir. Tek katman tamamen oluştuğunda ve TEER değerleri bir plato fazına ulaştığında (tipik olarak 1.500 ila 2.500 Ω.cm2 arasında), ortam, tek katmanın yeni ortama uyum sağlamasına izin vermek için 30 dakika boyunca taşıma tamponu ile değiştirilir. Deneyin 0 dakikası zamanında, FITC-dekstran testi yapılır ve 20 dakikalık bazolateral örnek toplanır. Sonuçlar daha sonra bir plaka okuyucuda analiz edilir. Deneyden sonra apikal ve bazolateral kamara içerikleri tekrar CMGF+ olarak değiştirilir ve TEER değer okumaları alınır. Tek katmanlar 24 saat boyunca inkübe edilir ve tek katmanın bütünlüğü tekrarlanan TEER ölçümleri ile değerlendirilir. Kısaltmalar: TEER = transepitelyal elektrik direnci; ROCK = rho ile ilişkili kinaz; GSKiβ = glikojen sentaz kinaz beta; CMGF + R/G = ROCK inhibitörü ve GSKiβ ile geliştirilmiş büyüme faktörlerine sahip tam ortam; CMGF + = Büyüme faktörleri olan ancak ROCK inhibitörü veya GSKiβ içermeyen tam ortam; FITC = floresein izotiyosiyanat; F = floresan. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Organoid tek katmanlı hazırlığın değerlendirilmesi
NOT: Bu adım tohumlamadan 8-14 gün sonra gerçekleşir.- Tek katmanı ışık mikroskobu altında en az iki günde bir kontrol edin (tek katmanın bütünlüğünü görselleştirmek için faz kontrastı kullanın). Hücre tek katmanı boşluklar veya belirgin gözyaşı belirtileri olmadan tamamen oluştuğunda bir sonraki adıma geçin.
- Organoid ortamı CMGF + R / G'den CMGF + 'ya değiştirin (orta bileşimden ROCK inhibitörü ve GSKiβ hariç). Ortamın denemeden en az dört gün önce değiştirilmesi önerilir.
NOT: Bu adım, organoid monolayer'ın uygun şekilde farklılaştırılmasını sağlayacaktır. - TEER değerlerini yaklaşık olarak her gün ölçmeye devam edin. TEER değerleri yaklaşık 1.500 ila 2.000 cm²'Ω × plato yapmaya başladığında (Şekil 6), TEER değerlerini her gün ölçün.
NOT: Bu kararlı durum yaklaşık 2-3 gün boyunca korunabilir, bu da geçirgenlik testi yapmak için en uygun zaman dilimidir (genellikle 11 ila 13. günlerde). Plato TEER değerleri, organoidlerin bağırsak lokalizasyonuna, ölçüm sıcaklığına, cinsine, yaşına ve köpeğin hastalık durumuna bağlı olarak hafifçe salınımlı olabilir. - TEER değerlerinde hızlı bir düşüşü veya organoid tek katmanın çoklu hücre katmanlarına aşırı büyümesini önlemek için ilaç geçirgenlik testini hemen planlayın.
- Deneye hazırlanma
NOT: Karıştırılmamış su tabakasının etkilerinden kaçınmak için deney sırasında inkübatör çalkalayıcılar kullanılabilir. TEER değerlerini tutarlı sıcaklıklarda ölçün.- Deney gününde, TEER değerlerini ölçün ve değerlerin sabit bir duruma ulaştığını ve hızla düşmediğini onaylayın.
- Deneyi gerçekleştirmek için %20'den fazla kesici uç arasından en iyi tek katmanlı katmanları (ışık mikroskobu ve TEER değerleri aracılığıyla) seçin.
- Tek katmanları bir ışık mikroskobu altında gözlemleyin ve eksik, yırtık veya aşırı büyümüş organoid tek katmanları hariç tutun.
- Taşıma tamponunu hazırlayın ve pH'ını istenen değerlere ayarlayın.
NOT: Deneysel tamponun bileşimi, deney düzeneğine bağlı olarak farklılık gösterir. Sık kullanılan bir tampon, Hank'in Dengeli Tuz Çözeltisi (HBSS), glikoz (12.5 mM) ve 4-(2-hidroksietil)-1-piperazineetansülfonik asitten (HEPES, 25 mM) oluşur. Bu bileşim, bir deney sırasında organoid kültürün yaşayabilirliğini sağlar. - Ortamı, seçilen kuyucukların apikal ve bazolateral odalarından dikkatlice aspire edin.
- Apikal odaya 200 μL taşıma tamponu ve bazolateral odaya 800 μL ekleyin.
NOT: Taşıma tamponu, tek tabakanın mikro gözenekli membrandan ayrılmasını önlemek için önce apikal odaya ve daha sonra bazolateral odaya eklenmelidir. - Dengelenmek için plakayı inkübatöre (37 ° C; % 5 CO2 atmosferi) 30 dakika boyunca yerleştirin.
NOT: Köpek organoid monokatmanları artık ilaç geçirgenliği deneyi için hazırdır.
- Tipik deneysel düzen-IgY konsantrasyon çözeltisi
NOT: Deneysel tasarım ve düzen, araştırma sorusuna bağlı olarak değişebilir. İmmünoglobulin Y'nin (IgY) bir organoid monokatman yoluyla geçirgenliği protokolde örnek olarak kullanılır ve değiştirilebilir. Donör odası terimi, ilacın ilk uygulandığı odayı, alıcı oda ise ilacı donör odasından kabul eden odayı ifade eder. Tipik bir deney, alıcı odalarında 2 saat boyunca numune toplar (örneğin, 15, 30, 60, 90, 120 dakika).- IgY çözeltisini (tercih edilen ilaç veya çözünür) taşıma tamponunda istenen son konsantrasyona çözerek hazırlayın. İhtiyaçtan daha fazla ilaç çözeltisi hazırlayın.
NOT: Düşük sulu çözünürlüğe sahip ilaçlar, tampona eklenmeden önce organik bir çözücü (örneğin, etanol, DMSO) içinde çözülebilir. Çözücünün nihai konsantrasyonu, hücre monokatmanına zarar vermemek için% 1'den az olmalıdır. - Tamponu her bir kuyucuğun donör odasından (apikal veya bazolateral oda) çıkarın.
- IgY solüsyonunu (ilaç solüsyonu) tüm donör odalarına ekleyin. İlk ilaç konsantrasyonunun ölçümü için kalan çözeltiyi zaman 0 donör çözeltisi olarak kullanın.
- Gerekli zaman noktalarında, alıcı odadan 50 μL'yi çıkarın ve etiketli bir tüpe yerleştirin. Son zaman noktasında, donör odasından bir örnek çıkarın. Deneyin sonunda, donör ve alıcı alikotlarını -20 ° C'lik bir dondurucuya aktarın.
NOT: Çok sayıda zaman noktasına ihtiyaç duyulursa, alıcı odadaki tamponun değiştirilmesi yapılabilir, ancak görünür geçirgenliğin hesaplanmasında hesaba katılmalıdır. Alıcı odasındaki konsantrasyon, lavabo koşullarını korumak için deneyin sonunda donör odasının% 10'undan fazlasına ulaşmamalıdır44.
- IgY çözeltisini (tercih edilen ilaç veya çözünür) taşıma tamponunda istenen son konsantrasyona çözerek hazırlayın. İhtiyaçtan daha fazla ilaç çözeltisi hazırlayın.
- Organoid hücre tek katmanlı kalite kontrolü
NOT: FITC-dextran çözeltisi, deney sırasında tek katmanlı bütünlüğü doğrulamak için kullanılabilir. FITC-dextran, tek katmanlı bütünlük testine örnek olarak kullanılır. Diğerleri arasında Lucifer sarısı, PEG-4000, radyoaktif etiketli mannitol ve inülin44 bulunur.- 0 dakika sonra, apikal odanın içeriğini aspire edin ve her deney grubu için üçlü olarak 250 μL FITC-dekstran çözeltisi (5 mg / mL, 4 kDa) ile değiştirin.
NOT: FITC-dextran'ı ışığa maruz bırakmayın. - 20 dakika sonra, tamponu bazolateral odadan çıkarın.
- Bir floresan plaka okuyucu kullanarak bazolateral numunenin floresan yoğunluğunu ölçün (bir kalibrasyon eğrisi kullanın; uyarım 485 nm ve emisyon değeri 528 nm olarak ayarlanmıştır).
NOT: FITC'nin Puygulaması , tartışmada açıklanan yöntem kullanılarak da hesaplanabilir. - Deney sona erdikten sonra, apikal ve bazolateral odalardan fazla tamponu dikkatlice aspire edin.
- Apikal odaya 200 μL CMGF + ve bazolateral odaya 700 μL ekleyin.
- Tek tek kuyulardaki TEER değerlerini ölçün.
- Plakayı 24 saat boyunca inkübatöre (37 °C; % 5 CO2 atmosferi) yerleştirin.
- Mümkünse, 24 saat sonra, deneyin kalite kontrol kısmı sırasında tek katmana olası hasarı değerlendirmek için TEER değerlerini ölçün. Köpek organoid monokatmanının bütünlüğünü görselleştirmek için ışık mikroskobu kullanın.
- 0 dakika sonra, apikal odanın içeriğini aspire edin ve her deney grubu için üçlü olarak 250 μL FITC-dekstran çözeltisi (5 mg / mL, 4 kDa) ile değiştirin.
- Aşağı akış analizi için hücre monokatmanlarının sabitlenmesi
- Formalin-Asetik Asit-Alkol çözeltisi hazırlayın (FAA, Tablo 1'deki bileşim).
- P1000 pipet veya steril tek kullanımlık 9" Pasteur pipetleri ve vakum aspiratörü kullanarak taşıma tamponunu veya CMGF+'yı apikal ve bazolateral odalardan çıkarın.
- Apikal ve bazal odaları FAA ile doldurun.
- 24 saat sonra, FAA'yı aspire edin ve% 70 etanol ile değiştirin.
- Buharlaşmayı önlemek için plakayı esnek laboratuvar filmi ile sarın ve hazırlığı engellemeye devam edin.

Şekil 6: Deney grupları arasında TEER değerleri. TEER değerleri beş grup köpek intestinal organoid monokatmanında ölçüldü. Üç grup köpek jejunal enteroidlerinden, iki grup ise kolonoidlerden oluşuyordu. Her grup 12 ila 22 çoğaltma içeriyordu. Jejunal enteroid kültürler için TEER değerleri 4. günden 14. güne kadar gösterilir ve kolonoid kültürler 4. günden 12. güne kadar gösterilir (ölçümler, organoid tek katmanın kararlı durum değerlerine ulaşmasıyla sona erer, bu da tek katmanın deneysel kullanıma hazır olduğunu gösterir). Hata çubukları ölçümlerin SEM'ini ifade eder. Kısaltma: TEER = transepitelyal elektrik direnci. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Köpek organoidlerinin kültürü için standart çalışma prosedürleri daha önce tanımlanmıştır33 ve Köpek Organoid Protokolü de bu özel sayı38'de ayrıntılı olarak tartışılmıştır. Geçirgen destekler üzerinde kültürlenen köpek bağırsak organoidleri, tek katmanlı ve hücre popülasyonlarının mikroanatomisini incelemek için sabitlenmiş ve parafin gömülmüştür. Parafin gömme işlemi daha önce Gabriel ve ark.38 tarafından tartışılmıştır. Rutin boyama (hematoksilin ve eozin) uygulanmış ve köpek organoid tek katmanındaki kadeh hücrelerini tespit etmek için Alcian Blue boyama tekniği kullanılmıştır (bkz. Şekil 7).
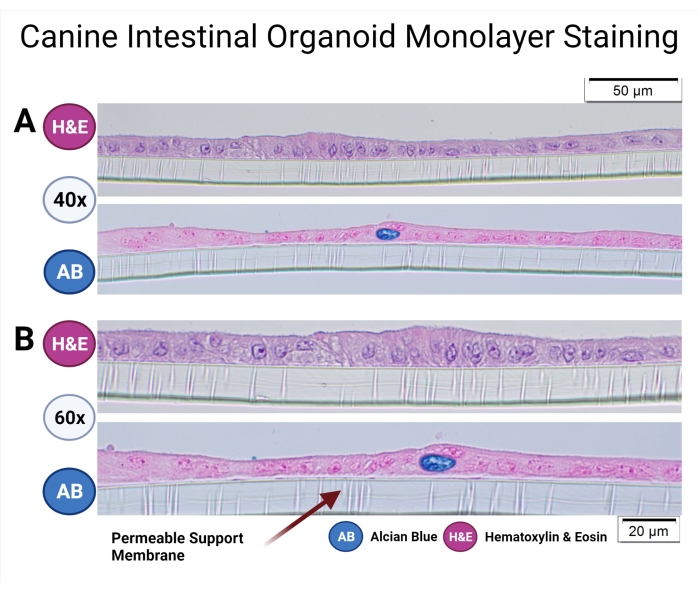
Şekil 7: Köpek bağırsak organoid tek katmanlı boyama. Geçirgen destekteki kolonik kökenli köpek bağırsak organoidleri parafin gömülü ve H & E ve AB ile boyanmıştır. temsili görüntüler 40x (A) ve 60x (B) büyütmede ışık mikroskobu kullanılarak alınmıştır. H & E boyaması sütunlu bir epitel monokatmanı ortaya çıkarır ve hücrelerin apikal kısmındaki mikrovillus 60x büyütmede gözlemlenebilir. AB boyaması, köpek bağırsak organoid monokatmanında kadeh hücrelerinin (koyu mavi) varlığını daha da ortaya koymaktadır. Ölçek çubukları = 20 μm (A), 50 μm (B). Kısaltmalar: H & E = hematoksilin ve eozin; AB = Alcian Mavisi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Geçirgenlik deneyi için hazır olması için geçirgen destek üzerindeki organoid kültürün 10 ila 14 gün boyunca yetiştirilmesi gerekir. Işık mikroskobu, ilaç adaylarının geçirgenlik testi için organoid kültürünün hazır olduğunu doğrulamak için TEER değer ölçümleri ile birlikte kullanılır. Sağlıklı ve hastalıklı hayvanlardan farklı köpek bağırsak organoid monokatmanlarının temsili ışık mikroskobik görüntüleri Şekil 8'de sunulmuştur.

Şekil 8: Köpek bağırsak organoid tek katmanlı mikroskopi. Işık mikroskobu altında görüldüğü gibi büyüyen monokatmanların görüntüleri. Sağlıklı donörlerden elde edilen organoid monotabakalar jejunal enteroid (10x; 40x) ve kolonoid (20x; 40x) kültürleri ile temsil edilir. Hastalıklı donörlerin organoid monokatmanları, PLE tanısı alan bir köpek hastasından türetilen duodenal (5x; 10x) ve ileal (5x; 10x) enteroidlerle temsil edilir. Her iki PLE organoid kültürü de organoidlerin tohumlanması sırasında yanlış hücre izolasyonunun örnekleridir ve bu kültürler 3D organoidlerin varlığı nedeniyle ilaç geçirgenlik testleri için kullanılamaz. Tek katmanlı yırtılmalar (5x) gibi uygun tek katmanlı oluşumdan sapma örnekleri, biyolojik numunelerin dikkatsiz manipülasyonundan kaynaklanır. Uzun süreli organoid kültürü (10x; 20x), organoidler orijinal 3D yapılarına benzemeye başladığında kesici uç üzerindeki organoidlerin uzun süre korunmasından kaynaklanır. Karşılaştırma için, ilaç geçirgenliği çalışmaları için yaygın olarak kullanılan geçirgen destekler üzerindeki geleneksel 2D hücre çizgilerinin görüntüleri sunulmaktadır (MDCK-10x; 40x ve Caco-2-10x; 20x). Kısaltmalar: PLE = protein kaybeden enteropati; MDCK = Madin-Darby köpek böbreği. Ölçek çubukları = 500 μm (5x), 200 μm (10x), 100 μm (20x), 50 μm (40x). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Organoid monokatmanlar ayrıca fosfat tamponlu salinde (PBS) %3 Paraformaldehit-%3 Glutaraldehit ile sabitlendi. İletim elektron mikroskobu (TEM), geçirgen destekler üzerindeki organoid kültürün ultrayapısını karakterize etmek için kullanıldı. Mikrovillusların mikroanatomik yapıları ve sıkı kavşaklar Şekil 9'da görülebilir.

Şekil 9: Sağlıklı köpek bağırsak organoid monokatmanlarının TEM görüntüleri. Jejunal (A), ileal (B) ve kolonik (C) organoid monolayerların hücresel mikromimarisini ortaya çıkarmak için TEM kullanıldı. Geçirgen destek ekinin mikro gözenekli zarı sarı bir okla işaretlenmiştir. Görüntülerde mikrovillus (mavi ok) ve sıkı kavşakların (kırmızı ok) varlığı belirtilmiştir. Kısaltma: TEM = İletim elektron mikroskobu. Ölçek çubukları = 5 μm (A), 2 μm (B, C). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sistemin geçirgenlik testine hazır olduğundan emin olmak için hem TEER ölçümleri hem de ışık mikroskobu yapılmalıdır. Tahlil, TEER sabit bir duruma ulaştığında kullanıma hazırdır, ışık mikroskobu ise organoidlerin hasarını veya aşırı büyümesini dışlamaya yardımcı olacaktır. Köpek jejunal enteroidleri ve kolonoidlerden oluşan beş grubun tipik TEER ölçümlerinin bir özeti Şekil 6'da sunulmuştur.
Tablo 1: Organoid medya ve FAA bileşimi. CMGF+, CMGF+ R/G ve FAA'nın tam bileşimi bu tabloda özetlenmiştir. Kısaltmalar: ROCK = rho ile ilişkili kinaz; GSKiβ = glikojen sentaz kinaz beta; CMGF + R/G = ROCK inhibitörü ve GSKiβ ile geliştirilmiş büyüme faktörlerine sahip tam ortam; CMGF + = Büyüme faktörleri olan ancak ROCK inhibitörü veya GSKiβ içermeyen tam ortam; FAA = formalin-asetik asit-alkol; EGF = epidermal büyüme faktörü. Bu tablo 38'den uyarlanmıştır. Bu tabloyu indirmek için lütfen tıklayınız.
Ek Tablo 1: Geçirgen destek sistemi olan köpek organoidi üzerine not alma tablosu. Kısaltmalar: TEER = transepitelyal elektrik direnci; ROCK = rho ile ilişkili kinaz; GSKiβ = glikojen sentaz kinaz beta; CMGF + R/G = ROCK inhibitörü ve GSKiβ ile geliştirilmiş büyüme faktörlerine sahip tam ortam; CMGF + = Büyüme faktörleri olan ancak ROCK inhibitörü veya GSKiβ içermeyen tam ortam. Bu tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
Geçirgen destek cihazındaki köpek bağırsak organoid kültürleri, geleneksel ilaç geçirgenlik tahlilleri40'ı yeni bir in vitro köpek modeli41 ile birleştiren benzersiz bir kavramdır. Farklı köpek bağırsak organoidleri türleri, minimum ayarlamalarla deneyin amacına göre kullanılabilir ve değerlendirilebilir. İlgilenilen ilacın çoklu konsantrasyonlarının grup başına 3-4 kuyuda test edilmesi önerilir. Konsantrasyonlar, ilacın beklenen bağırsak konsantrasyonuna dayanabilir. Ayrıca, önceki araştırmaları kullanmak, çalışma tasarımı için uygun zaman noktalarının belirlenmesine yardımcı olabilir. Tekrarlanabilirliği artırmak ve sorun gidermeye yardımcı olmak için çalışma tasarımının uygun dokümantasyonu yapılmalıdır.
Bu teknolojinin, yöntem42'nin yeniliği nedeniyle, çoğunlukla deneysel tasarımda standardizasyon eksikliği ve protokolün laboratuvarlar arasında yürütülmesi nedeniyle çeşitli sınırlamaları vardır. Bu standardizasyon eksikliği diğer grup43 tarafından kabul edilmiştir ve Köpek 3D Organoid Tek Katmanlı Protokolleri laboratuvarlar arası tekrarlanabilirliğe yol açacak ve bu sisteme standardizasyon getirecektir. Veri analizine standartlaştırılmış yaklaşımlar tekrarlanabilirliği artırır ve farklı laboratuvarlarda geçirgen destek sistemindeki köpek organoidlerini kullanarak ön uyuşturucu testinin sonuçlarını güçlendirebilir. Köpek 3D organoid modeli ayrıca, model ilaçların in vitro Puygulama değerlerini, Caco-2 hücreleri44,45,46 gibi, bilinen insan veya köpek in vivo bağırsak emilimiyle karşılaştıran veri setlerinden yoksundur. Bu tür veriler üretildikten sonra, bu köpek organoid modeli, ilaç geliştirme sırasında bağırsak geçirgenliğini değerlendirmek için kullanılabilir.
Organoidleri geçirgen destek sistemine tohumlarken, uygun şekilde ayrışmış hücrelerin yeterince yüksek bir yoğunluğunu tohumlamak için dikkatli olunması çok önemlidir. Sistemin TEER değerleri, katı monokatmanlar halinde yetiştirildiğinde daha güvenilir ve tekrarlanabilir. Tek katmanların uzun süreli kültürü, TEER değerlerinde bağırsağın fizyolojik değerlerinden daha uzağa ulaşan üstel bir artışa yol açabilir. Bu tür 3D yapıların H & E bölümleri daha sonra zara daha yakın enterositlerin değiştirilmiş yapıları ile birbirlerinin üzerinde birkaç hücre katmanı gösterir.
Köpek bağırsak organoid monokatmanının başarılı bir şekilde genişlemesinden sonra, sonuçlar bir ilacın görünür geçirgenlik katsayısı (Puygulaması) formülü44 hesaplanarak geleneksel 2D hücre tahlilleriyle aynı şekilde analiz edilebilir. Puygulaması değeri (bkz. Eq (2)), hücresel tek katmanlı47 boyunca taşıma hızını tanımlar.
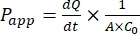 (2)
(2)
Bu 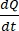 , konsantrasyonun zaman eğrisine karşı başlangıç eğimidir (örneğin, nmol / s). A , kesici ucun alanıdır (cm2) ve C0 , donör odasındaki ilacın veya bileşiğin başlangıç konsantrasyonudur37. Tek katmanlı bütünlüğün güvenilir bir şekilde tanınması, standardizasyon gerektiren geçirgenlik testinin çok önemli bir parçasıdır. Geçirgen bir destek sistemindeki köpek organoidlerini değerlendirmek ve deneyin doğru zamanlamasını belirlemeye yardımcı olmak için ışık mikroskobu ve TEER ölçümleri önerilir. Ek olarak, sıfır moleküler geçirgenlik belirteçleri (örneğin, FITC-dextran, Lucifer sarısı, PEG-400) organoid tek katmanlı bütünlüğü fonksiyonel olarak değerlendirmek için kullanılabilir. Test edilen bileşiğin bir taşıyıcıdan etkilenmesi durumunda dikkat edilmelidir. P-glikoprotein (P-gp) yaygın bir efflux pompası örneği olarak kullanılır. İyi bilinen bir P-gp prob substratı ile karşılaştırıldığında bir efflux oranı (Puygulaması, BL-AP / Puygulaması, AP-BL) oluşturulmalıdır.
, konsantrasyonun zaman eğrisine karşı başlangıç eğimidir (örneğin, nmol / s). A , kesici ucun alanıdır (cm2) ve C0 , donör odasındaki ilacın veya bileşiğin başlangıç konsantrasyonudur37. Tek katmanlı bütünlüğün güvenilir bir şekilde tanınması, standardizasyon gerektiren geçirgenlik testinin çok önemli bir parçasıdır. Geçirgen bir destek sistemindeki köpek organoidlerini değerlendirmek ve deneyin doğru zamanlamasını belirlemeye yardımcı olmak için ışık mikroskobu ve TEER ölçümleri önerilir. Ek olarak, sıfır moleküler geçirgenlik belirteçleri (örneğin, FITC-dextran, Lucifer sarısı, PEG-400) organoid tek katmanlı bütünlüğü fonksiyonel olarak değerlendirmek için kullanılabilir. Test edilen bileşiğin bir taşıyıcıdan etkilenmesi durumunda dikkat edilmelidir. P-glikoprotein (P-gp) yaygın bir efflux pompası örneği olarak kullanılır. İyi bilinen bir P-gp prob substratı ile karşılaştırıldığında bir efflux oranı (Puygulaması, BL-AP / Puygulaması, AP-BL) oluşturulmalıdır.
Işık mikroskobu (düz veya faz kontrastı ile güçlendirilmiş), olası hücresel aşırı büyümeyi değerlendirirken 2D veya 3D tek katmanın ve filtre ekinin bütünlüğünü kontrol etmek için paha biçilmez bir yöntemdir. Şekil 7 , sağlıklı köpek bağırsak organoid hücre kültürlerini tanımak için bir rehber görevi görebilir. TEER değerleri, hücreler arası bileşkelerin oluşumunun ve organoid kültürlerin sağlam bir bağırsak epiteline farklılaşmasının önemli bir ölçüsüdür. Köpek bağırsak organoidleri enterositlere ve kadeh hücrelerine farklılaşır (Şekil 6). Bu mukus üreten hücreler, geleneksel 2D hücre kültürleri kullanılarak elde edilmesi zor olan ilaç-mukus etkileşimlerinin incelenmesine izin verir48. Enteroendokrin hücrelerin varlığı daha önce Chandra ve ark.33 tarafından köpek bağırsak organoidlerinde doğrulanmıştır.
TEM kullanılarak jejunal, ileal ve kolonik organoidlerden türetilen köpek organoid monokatmanlarının daha fazla karakterizasyonu sağlanmaktadır. TEM görüntüleri, sıkı kavşaklar ve mikrovillus oluşumu da dahil olmak üzere hücresel mikromimariyi göstererek, bu organoid modellerin translasyonel tıptaki karmaşıklığını ve kullanışlılığını daha da göstermektedir. Deney sonuçlarına dayanarak, geçirgen destek üzerindeki organoid kültürler, tohumlama sonrası 11. ve 13. günler arasında deneye hazırdı (Şekil 9). Bu zaman noktasındaki TEER değerleri 1.500 ila 2.500Ω.cm2 arasında değişmiştir. TEER değerlerinin plato aşaması, TEER değerleri yavaş yavaş düşmeye başlamadan önce deneyin başlatılması gereken çok sınırlı bir zaman dilimi boyunca sürer. TEER değerleri, bazı ilaçlar veya ilaç ürünü eksipiyanları tek katmanla (örneğin, sıkı bağlantılar) etkileşime girebileceğinden, TEER değer okumalarını büyük ölçüde etkileyebileceğinden, önemli deneysel sonuçların gösterilmesinin önemli bir parçası olabilir. Bu tek başına bir deneme için veri görevi görebilir.
Çift odacıklı bir hücre kültürü aparatındaki köpek bağırsak organoidleri, ortaya çıkan hücre tek katmanının benzersiz mimarisi nedeniyle oral ilaç geçirgenliği dışındaki alanlarda uygulanabilir. Örneğin, mikrobiyoloji araştırmalarında (örneğin, GI mikrobiyal florasını değiştirmenin etkisi), viral alım çalışmalarında, ilaç-ilaç etkileşimlerinde ve ilaç taşıma mekanizmalarında kullanılabilirler49. Donör odası tipik olarak test ilacı veya tercih edilen bileşik ile doldurulur ve alıcı odasından alikotlar çeşitli zaman noktalarında alınır. Bu alikotlar, yüksek performanslı sıvı kromatografisi, kütle spektrometrisi, enzime bağlı immünosorbent testi veya çözünenin tek katmana nüfuz ettiği miktarı ve hızı belirlemek için diğer teknikler kullanılarak analiz edilebilir.
Bu çalışmalar, ilaç geçirgenliğini doğru bir şekilde değerlendirmek için sağlam bir tek katman gerektirir. Bu tipik olarak, kullanılamaz kuyuları hesaba katmak için gerekli olanlardan daha fazla monokatman yetiştirmeyi gerektirir. Organoid hücre monokatmanları, bir monokatmanın apikal veya bazal tarafından viral alımı ölçmek için de kullanılabilir; virüsün hücresel alımını tespit etmek için immünofloresan tahlilleri kullanan antikorları içeren okumalar da kullanılabilir. Son olarak, taşıyıcı bazlı ilaç-ilaç etkileşimlerini tanımlamak için donör odasına birden fazla ilaç (yani, substrat ve inhibitör) uygulanabilir.
Mevcut gözlemlere dayanarak, bu yöntemler sadece kültür eklerindeki köpek organoidlerine uygulanmakla kalmayacak, aynı zamanda diğer veteriner türleri ve organ sistemleri için de uygun olacak ve tercih edilen türlere veya organ modeline en uygun şekilde uyacak küçük değişiklikler yapılacaktır. Köpek bağırsak organoid büyümesi için protokoller, kültürün benzersiz özelliklerine göre ayarlanmalıdır. Böylece, protokol başka bir türe göre ayarlanabilir, ancak protokolde ince değişiklikler gerektirecektir. Modifikasyonlar, hücre tohumlama yoğunluğundaki değişikliklerle başlayabilir ve ilgilenilen organoidleri düzgün bir şekilde ayırt etmek için ortam bileşimindeki değişikliklere genişleyebilir.
Standardizasyon, deneysel prosedürlerin ayrıntılı dokümantasyonu ve hücre monokatmanlarının tutarlı bir şekilde izlenmesi, geçirgen destek tahlillerinde ihtiyaç duyulan çok önemli uygulamalardır ve köpek sistemi ile sınırlı değildir. Bu olası türler veya organ modifikasyonları, alandaki daha ileri ilerlemeler için belgelemek ve raporlamak için kritik öneme sahiptir. Bu modelin, örneğin maliyet gereksinimleri, laboratuvarlar arası değişkenliği ve bağırsak emilimini in vivo olarak tahmin etme yeteneği hakkında sınırlı veriler gibi çeşitli sınırlamaları vardır. Köpekler, bazı durumlarda, insanlardan farklı ilaç taşıyıcılarına ve metabolize edici enzimlere sahiptir50.
Ayrıca, köpek organoid sistemi, böyle bir modelin uygunluğunu belirlemek için diğer üreticilerin çeşitli çift odacıklı aparatları üzerinde test edilmelidir (örneğin, farklı filtre membranı bileşimlerinin uygunluğu belirlenmelidir). Diğer bir dezavantaj, makalenin ilaç geçirgenliği deneyi bölümünün önceki bölümlere göre daha az açıklayıcı olmasıdır. Bu, bu alandaki aşırı bilgiden kaynaklanmaktadır. Makalenin bu bölümünün amacı, bu deneylerin temel taşlarının kenarlarını kesmeden, bu yöntemleri değiştirilebilir bir şekilde tanımlamaktı. Geçirgenlik deneyleri hakkında daha ayrıntılı bilgi Hubatsch ve ark.37 tarafından toplanmıştır. Ek olarak, geçirgen ekler kokültür, hücre göçü ve invazyon testi deneylerinde kullanılabilir4.
Sonuç olarak, çift odacıklı kültür cihazlarındaki köpek bağırsak organoidleri, biyomedikal alanlar ve translasyonel tıp da dahil olmak üzere çok çeşitli uygulamalarda kullanılma potansiyeline sahiptir. Protokoller, bir deneyi planlamak ve biyoloji alanındaki organoid modeller için laboratuvarlar arası veri güvenilirliğini teşvik etmek için çeşitli stratejiler oluşturur.
Açıklamalar
K. Allensach, LifEngine Hayvan Sağlığı ve 3D Sağlık Çözümleri'nin kurucu ortağıdır. Ceva Animal Health, Bioiberica, LifeDiagnostics, Antech Diagnostics, Deerland Probiotics ve Mars için danışman olarak hizmet vermektedir. J.P. Mochel, LifEngine Animal Health ve 3D Health Solutions'ın kurucu ortaklarından biridir ve Ceva Animal Health ve Ethos Animal Health için danışman olarak hizmet vermektedir. Bu makale yazarların görüşlerini yansıtmaktadır ve Gıda ve İlaç İdaresi'nin onayını, görüşünü veya politikalarını temsil edecek şekilde yorumlanmamalıdır. Diğer yazarların beyan edecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Iowa Eyalet Üniversitesi çalışanlarının Veteriner Teşhis Laboratuvarı'na, yani Haley Lambert, Emily Rahe, Rosalyn Branaman, Victoria Green ve Jennifer Groeltz-Pamukçuk'a, numunelerin zamanında işlenmesi için şükranlarımızı sunmak istiyoruz. Ayrıca Jodi Smith ve Bethann Valentine'e geçirgenlik deneyleri için malzeme sağladıkları için teşekkür ederiz. Ayrıca David Diaz-Regannon'a Şekil 9 ile ilgili yardımları için teşekkür etmek istiyoruz. Şekil 6 hariç, tüm rakamlar BioRender.com olarak oluşturulmuştur. Yazarlar, Fakülte Başlangıcı, ISU VPR Miller Ödülü, ISU VPR Miller Ödülü ve ISU # 1912948'ye NSF SBIR alt ödülünün desteğini kabul etmek istiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Organoid media | |||
| ROCK inhibitor (Y-27632) | EMD Millipore Corp. | SCM 075 | |
| [Leu15]-Gastrin I human | Sigma | G9145-.5MG | |
| A-83-01 | PeproTech | 9094360 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| B27 supplement | Gibco | 17504-044 | |
| FBS | Corning | 35-010-CV | |
| Glutamax | Gibco | 35050-061 | glutamine substitute |
| HEPES | VWR Life Science | J848-500ML | |
| Human R-Spondin-1 | PeproTech | 120-38-500UG | |
| Murine EGF | PeproTech | 315-09-1MG | |
| Murine Noggin | PeproTech | 250-38-250UG | |
| Murine Wnt-3a | PeproTech | 315-20-10UG | |
| N2 supplement | Gibco | 17502-048 | |
| N-Acetyl-L-cysteine | Sigma | A9165-25G | |
| Nicotinamide | Sigma | N0636-100G | |
| Primocin | InvivoGen | ant-pm-1 | |
| SB202190 (P38 inhibitor) | Sigma | S7067-25MG | |
| Stemolecule CHIR99021 (GSK3β) | Reprocell | 04-0004-base | |
| TMS (trimethoprim sulfate) | Sigma | T7883-5G | |
| Reagents | |||
| Acetic Acid, Glacial | Fisher Chemical | A38-500 | |
| alpha-D(+)-Glucose, 99+%, anhydrous | Acros Organics | 170080010 | |
| Cell Recovery Solution | Corning | 354253 | |
| Collagen I, Rat Tail 3 mg/mL | Gibco | A10483-01 | |
| FITC-CM-Dextran | Millipore Sigma | 68059-1G | |
| Formaldehyde (37%) | Fisher Chemical | F79P-4 | |
| Glutaraldehyde solution | Sigma | G5882 | |
| HBSS (1x) | Gibco | 14025-076 | |
| Matrigel Matrix For Organoid Culture | Corning | 356255 | Extracellular Membrane Matrix |
| Paraformaldehyde, 97% | Alfa Aesar | A11313 | |
| PBS, 1x (Phosphate-Buffered Saline) | Corning | 21-040-CM | |
| TrypLE Express | Gibco | 12604-021 | Trypsin-like Protease |
| Materials and Equipment | |||
| 15 mL Centrifuge Tube | Corning | 430766 | |
| 9" Pasteur Pipets | Fisherbrand | 13-678-6B | |
| Corning Transwell 6.5 mm Polyester Membrane Inserts Preloaded in 24-Well Culture Plates, Pore Size: 0.4 µm, Sterile | Corning | 3470 | Permeable Support |
| Millicell ERS (Probes) | Millipore Sigma | MERSSTX01 | |
| Millicell ERS-2 Voltohmmeter | Millipore Sigma | MERS00002 | |
| Panasonic incubator | Panasonic | MCO-170ML-PA | |
| Parafilm M Wrapping Film | Bemis Company Inc | PM996/EMD | Flexible Laboratory Film |
| Tissue Culture Plate 24 wells | Fisherbrand | FB012929 |
Referanslar
- Ghaffarian, R., Muro, S. Models and methods to evaluate transport of drug delivery systems across cellular barriers. Journal of Visualized Experiments JoVE. (80), e50638 (2013).
- Youhanna, S., Lauschke, V. M. The Past, present and future of intestinal in vitro cell systems for drug absorption studies. Journal of Pharmaceutical Sciences. 110 (1), 50-65 (2021).
- Belic, S., et al. Comparative analysis of inflammatory cytokine release and alveolar epithelial barrier invasion in a transwell®bilayer model of mucormycosis. Frontiers in Microbiology. 3204, 3204 (2019).
- Justus, C. R., Leffler, N., Ruiz-Echevarria, M., Yang, L. V. In vitro cell migration and invasion assays. Journal of Visualized Experiments: JoVE. (88), e51046 (2014).
- Rönkkö, S., Vellonen, K. S., Järvinen, K., Toropainen, E., Urtti, A. Human corneal cell culture models for drug toxicity studies. Drug Delivery and Translational Research. 6 (6), 660-675 (2016).
- Dahlgren, D., Lennernäs, H. Intestinal permeability and drug absorption: predictive experimental, computational and in vivo approaches. Pharmaceutics. 11 (8), 411 (2019).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Hilgers, A. R., Conradi, R. A., Burton, P. S. Caco-2 cell monolayers as a model for drug transport across the intestinal mucosa. Pharmaceutical Research. 7 (9), 902-910 (1990).
- Natoli, M., Leoni, B. D., D’Agnano, I., Zucco, F., Felsani, A. Good Caco-2 cell culture practices. Toxicology in Vitro. 26 (8), 1243-1246 (2012).
- Kapałczyńska, M., et al. 2D and 3D cell cultures – a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Sun, H., Chow, E. C. Y., Liu, S., Du, Y., Pang, K. S. The Caco-2 cell monolayer: Usefulness and limitations. Expert Opinion on Drug Metabolism and Toxicology. 4 (4), 395-411 (2008).
- Chandler, M., et al. Obesity and associated comorbidities in people and companion animals: a One Health perspective. Journal of Comparative Pathology. 156 (4), 296-309 (2017).
- Coelho, L. P., et al. Similarity of the dog and human gut microbiomes in gene content and response to diet. Microbiome. 6 (1), 72 (2018).
- Galeta, P., Lázničková-Galetová, M., Sablin, M., Germonpré, M. Morphological evidence for early dog domestication in the European Pleistocene: New evidence from a randomization approach to group differences. Anatomical Record. 304 (1), 42-62 (2021).
- Kleinert, M., et al. Animal models of obesity and diabetes mellitus. Nature Reviews Endocrinology. 14 (3), 140-162 (2018).
- Allenspach, K., Wieland, B., Gröne, A., Gaschen, F. Chronic enteropathies in dogs: Evaluation of risk factors for negative outcome. Journal of Veterinary Internal Medicine. 21 (4), 700-708 (2007).
- Wang, J., et al. Proliferative and invasive colorectal tumors in pet dogs provide unique insights into human colorectal cancer. Cancers. 10 (9), 330 (2018).
- Gillespie, V., Baer, K., Farrelly, J., Craft, D., Luong, R. Canine gastrointestinal stromal tumors: Immunohistochemical expression of CD34 and examination of prognostic indicators including proliferation markers Ki67 and AgNOR. Veterinary Pathology. 48 (1), 283-291 (2011).
- Chandra, L., et al. Derivation of adult canine intestinal organoids for translational research in gastroenterology. BMC Biology. 17 (1), 33 (2019).
- Schneider, B., et al. Model-based reverse translation between veterinary and human medicine: the One Health initiative. CPT: Pharmacometrics and Systems Pharmacology. 7 (2), 65-68 (2018).
- Artursson, P., Palm, K., Luthman, K. Caco-2 monolayers in experimental and theoretical predictions of drug transport. Advanced Drug Delivery Reviews. 22 (1-2), 67-84 (1996).
- Balimane, P. V., Han, Y. H., Chong, S. Current industrial practices of assessing permeability and P-glycoprotein interaction. AAPS Journal. 8 (1), 1-13 (2006).
- Sambuy, Y., et al. The Caco-2 cell line as a model of the intestinal barrier: Influence of cell and culture-related factors on Caco-2 cell functional characteristics. Cell Biology and Toxicology. 21 (1), 1-26 (2005).
- Calcagno, A. M., Ludwig, J. A., Fostel, J. M., Gottesman, M. M., Ambudkar, S. V. Comparison of drug transporter levels in normal colon, colon cancer, and caco-2 cells: Impact on drug disposition and discovery. Molecular Pharmaceutics. 3 (1), 87-93 (2006).
- Hilgendorf, C., et al. Expression of thirty-six drug transporter genes in human intestine, liver, kidney, and organotypic cell lines. Drug Metabolism and Disposition. 35 (8), 1333 (2007).
- Seithel, A., Karlsson, J., Hilgendorf, C., Björquist, A., Ungell, A. L. Variability in mRNA expression of ABC- and SLC-transporters in human intestinal cells: Comparison between human segments and Caco-2 cells. European Journal of Pharmaceutical Sciences. 28 (4), 291-299 (2006).
- Volpe, D. A. Transporter assays as useful in vitro tools in drug discovery and development. Expert Opinion on Drug Discovery. 11 (1), 91-103 (2016).
- Hoffmann, P., et al. Caco-2/HT29-MTX co-cultured cells as a model for studying physiological properties and toxin-induced effects on intestinal cells. PLoS ONE. 16 (10), 257824 (2021).
- Sun, H., Chow, E. C. Y., Liu, S., Du, Y., Pang, K. S. The Caco-2 cell monolayer: Usefulness and limitations. Expert Opinion on Drug Metabolism and Toxicology. 4 (4), 395-411 (2008).
- Thummel, K. E., et al. Transcriptional control of intestinal cytochrome P-4503A by 1α,25-dihydroxy vitamin D3. Molecular Pharmacology. 60 (6), 1399-1406 (2001).
- Kodama, N., et al. Characteristic analysis of intestinal transport in enterocyte-like cells differentiated from human induced pluripotent stem cells. Drug Metabolism and Disposition. 44 (10), 1662-1667 (2016).
- Akazawa, T., et al. Application of intestinal epithelial cells differentiated from human induced pluripotent stem cells for studies of prodrug hydrolysis and drug absorption in the small intestine. Drug Metabolism and Disposition: The Biological Fate of Chemicals. 46 (11), 1497-1506 (2018).
- Lo, B., Parham, L. Ethical issues in stem cell research. Endocrine Reviews. 30 (3), 204-213 (2009).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), 0231423 (2020).
- Zdyrski, C., et al. Su124 homology directed repair in canine duodenal enteroids to mimic the wild-type P-glycoprotein mutation. Gastroenterology. 160 (6), 625 (2021).
- Nantasanti, S., et al. Disease modeling and gene therapy of copper storage disease in canine hepatic organoids. Stem Cell Reports. 5 (5), 895-907 (2015).
- Hubatsch, I., Ragnarsson, E. G. E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Gabriel, V., et al. Standardization and maintenance of 3D canine hepatic and intestinal organoid cultures for use in biomedical research. Journal of Visualized Experiments: JoVE. (179), e63515 (2022).
- Frost, T. S., Jiang, L., Lynch, R. M., Zohar, Y. Permeability of epithelial/endothelial barriers in transwells and microfluidic bilayer devices. Micromachines. 10 (8), 533 (2019).
- van Breemen, R. B., Li, Y. Caco-2 cell permeability assays to measure drug absorption. Expert Opinion on Drug Metabolism and Toxicology. 1 (2), 175-185 (2005).
- Huch, M., Knoblich, J. A., Lutolf, M. P., Martinez-Arias, A. The hope and the hype of organoid research. Development. 144 (6), 938-941 (2017).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Olivatti, T. O. F., Alcantara, G. P., Lemos, A. C. C. E., Silva, M. G., Miot, H. A. Standardization of organoid culture for evaluation of melanogenesis induced by UVB, UVA and visible light. Anais Brasileiros de Dermatologia. 95 (1), 46-51 (2020).
- Volpe, D. A., et al. Classification of drug permeability with a Caco-2 cell monolayer assay. Clinical Research and Regulatory Affairs. 24 (1), 39-47 (2007).
- Chen, C., Ma, M. G., Fullenwider, C. L., Chen, W. G., Sadeque, A. J. M. Biopharmaceutics permeability classification of lorcaserin, a selective 5-hydroxytryptamine 2C agonist: Method suitability and permeability class membership. Molecular Pharmaceutics. 10 (12), 4739-4745 (2013).
- Jarc, T., et al. Demonstrating suitability of the Caco-2 cell model for BCS-based biowaiver according to the recent FDA and ICH harmonised guidelines. Journal of Pharmacy and Pharmacology. 71 (8), 1231-1242 (2019).
- Newby, D., Freitas, A. A., Ghafourian, T. Decision trees to characterise the roles of permeability and solubility on the prediction of oral absorption. European Journal of Medicinal Chemistry. 90, 751-765 (2015).
- Navabi, N., McGuckin, M. A., Lindén, S. K. Gastrointestinal cell lines form polarized epithelia with an adherent mucus layer when cultured in semi-wet interfaces with mechanical stimulation. PLoS ONE. 8 (7), 68761 (2013).
- Puschhof, J., et al. Intestinal organoid cocultures with microbes. Nature Protocols. 16 (10), 4633-4649 (2021).
- Martinez, M. N., Mochel, J. P., Neuhoff, S., Pade, D. Comparison of canine and human physiological factors: understanding interspecies differences that impact drug pharmacokinetics. The AAPS Journal. 23 (3), 59 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır