Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Proteinlerin ve hidrasyon suyunun pikosaniye-nanosaniye dinamiklerini incelemek için yüksek çözünürlüklü nötron spektroskopisi
Bu Makalede
Özet
Nötron geri saçılma spektroskopisi, proteinlerin ps-ns dinamiklerine ve hidrasyon suyuna tahribatsız ve etiketsiz bir erişim sunar. İş akışı, amiloid proteinleri üzerine iki çalışma ile sunulmaktadır: agregasyon sırasında lizozimin zamanla çözülmüş dinamikleri ve tau'nun lif oluşumu üzerine hidrasyon suyu dinamikleri üzerine.
Özet
Nötron saçılması, numunelerdeki dinamikleri çok çeşitli enerjiler için tahribatsız bir şekilde ve döteryum dışında etiketlemeden inceleme imkanı sunar. Özellikle, nötron geri saçılma spektroskopisi, saçılma sinyallerini aynı anda birden fazla saçılma açısında kaydeder ve ps-ns zaman ölçeğinde biyolojik sistemlerin dinamiklerini incelemek için çok uygundur. D2O ve muhtemelen deuterated tampon bileşenlerini kullanarak yöntem, sıvı haldeki proteinlerin hem kütle merkezi difüzyonunun hem de omurga ve yan zincir hareketlerinin (iç dinamikleri) izlenmesini sağlar.
Ek olarak, hidrasyon suyu dinamikleri,H2O ile hidratlanmış perdeuterated proteinlerin tozları kullanılarak incelenebilir. Bu makale, protein ve hidrasyon suyu dinamiklerini araştırmak için Institut Laue-Langevin (ILL) IN16B cihazında kullanılan iş akışını sunmaktadır. Çözelti numunelerinin ve hidratlanmış protein tozu numunelerinin buhar değişimi kullanılarak hazırlanması açıklanmaktadır. Hem protein hem de hidrasyon su dinamikleri için veri analizi prosedürü, bir nötron geri saçılma spektrometresinde elde edilebilecek farklı veri kümesi türleri (yarı elastik spektrumlar veya sabit pencere taramaları) için açıklanmaktadır.
Yöntem, amiloid proteinlerini içeren iki çalışma ile gösterilmiştir. Lizozimin μm boyutlu küresel agregalara (partiküllerle belirtilen) toplanmasının, IN16B üzerinde incelenen uzay ve zaman aralığında tek adımlı bir süreçte meydana geldiği gösterilirken, iç dinamikler değişmeden kalır. Ayrıca, tau'nun hidrasyon suyunun dinamikleri, perdeuterated proteinin hidratlanmış tozları üzerinde çalışılmıştır. Amiloid liflerinin oluşumu üzerine suyun translasyonel hareketlerinin aktive olduğu gösterilmiştir. Son olarak, protokoldeki kritik adımlar, nötron saçılmasının diğer deneysel biyofiziksel yöntemlere göre dinamiklerin incelenmesi ile ilgili olarak nasıl konumlandırıldığı tartışılmaktadır.
Giriş
Nötron, temel fizikten biyolojiye kadar çeşitli alanlardaki örnekleri araştırmak için yıllar boyunca başarıyla kullanılan yüksüz ve büyük bir parçacıktır1. Biyolojik uygulamalar için, küçük açılı nötron saçılması, elastik olmayan nötron saçılması ve nötron kristalografisi ve reflektometrisi yaygın olarak kullanılmaktadır 2,3,4. Elastik olmayan nötron saçılması, kendi başına belirli bir etiketleme gerektirmeden dinamiklerin topluluk ortalamalı bir ölçümünü ve boyuta veya protein5'e bağlı olmayan bir sinyal kalitesi sağlar. Ölçüm, incelenen protein için, deuterated bakteriyel lizat veya hatta in vivo 3,6,7 gibi hücre içi ortamı taklit eden oldukça karmaşık bir ortam kullanılarak yapılabilir. Dinamikleri incelemek için farklı deney düzenekleri kullanılabilir, yani i) uçuş zamanı-alt-ps-ps dinamiklerine erişim sağlar, ii) ps-ns dinamiklerine geri saçılma-erişim sağlar ve iii) spin-echo-ns'den yüzlerce ns'ye kadar dinamiklere erişim sağlar. Nötron geri saçılması, Bragg'ın 2d sinθ = nλ yasasını kullanır; burada d, bir kristaldeki düzlemler arasındaki mesafe, θ saçılma açısı, n saçılma sırası ve λ dalga boyudur. Dedektörlere doğru geri saçılma için kristallerin kullanılması, tipik olarak ~ 0.8 μeV olan enerjide yüksek bir çözünürlük elde etmeyi sağlar. Enerji değişimini ölçmek için, gelen nötron dalga boyunu 8,9,10 (Şekil 1) tanımlamak ve ayarlamak için geri saçılmada bir kristal taşıyan bir Doppler sürücüsü kullanılır veya enerji çözünürlüğü11'deki bir düşüş pahasına bir uçuş zamanı kurulumu kullanılabilir.
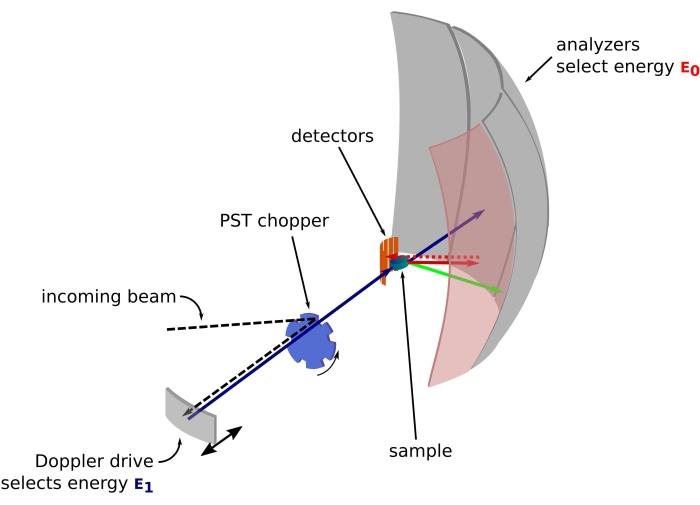
Resim 1: Doppler tahrikli bir nötron geri saçılma spektrometresinin taslağı. Gelen ışın, numune konumundaki akıyı artıran faz uzayı dönüşümü (PST) kıyıcısı42'ye çarpar. Daha sonra bir enerjiE1 (camgöbeği oku) seçen Doppler sürücüsü tarafından numuneye doğru geri saçılır. Nötronlar daha sonra numune tarafından dağılır (okların rengiyle temsil edilen farklı enerjilerle) ve Si 111 kristallerinden yapılmış analizörler, nötronları yalnızca belirli bir enerji E0 (burada kırmızı renkli oklar) ile geri saçarlar. Bu nedenle, momentum transferi q , nötronun dedektör dizisi üzerinde tespit edilen konumundan elde edilir ve enerji transferi E1- E0 farkından elde edilir. PST tarafından üretilen nötron darbesi için beklenen uçuş süresi, doğrudan dedektör tüplerine doğru dağılmış nötronlardan gelen sinyali atmak için kullanılır. Kısaltma: PST = faz uzayı dönüşümü. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Geri saçılma spektroskopisi için, proteinler gibi hidrojen proton bakımından zengin numunelerden gelen sinyale ana katkı, Sinc (q, ω) saçılma yoğunluğunun Eq (1) 12 ile gösterildiği tutarsız saçılmadan gelir
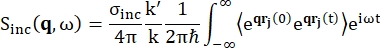 (1)
(1)
σinc, düşünülen elemanın tutarsız kesiti olduğunda, k' dağınık dalga vektörünün normu, k gelen dalga vektörünün normu, q (= k - k') momentum transferi, rj (t) atomunun t zamanındaki konum vektörü ve ω gelen nötron ile sistem arasındaki enerji transferine karşılık gelen frekanstır. Açısal parantezler topluluk ortalamasını gösterir. Bu nedenle, tutarsız saçılma, atom konumlarının zamanla topluluk ortalamalı tek parçacık kendi kendine korelasyonunu araştırır ve sistemdeki tüm atomlar ve farklı zaman kökenleri (topluluk ortalaması) üzerinde ortalamalı öz-dinamikleri verir. Saçılma fonksiyonu, Eq (2) tarafından gösterilen van Hove korelasyon fonksiyonunun uzaydaki Fourier dönüşümü olarak görülebilen ara saçılma fonksiyonu I(q, t)'nin zamanındaki Fourier dönüşümüdür:
 (2)
(2)
Burada ρ(r,t), r pozisyonunda ve t 13 zamanında bir atom bulmanın olasılık yoğunluğudur.
Bir Fickian difüzyon işlemi için, kendiliğinden difüzyon fonksiyonu, γ = Dq2 tarafından verilen çizgi genişliğindeki bir Lorentzian'dan oluşan bir saçılma fonksiyonunda çift Fourier dönüşümünden sonra sonuçlanır (bakınız Eq (3)).
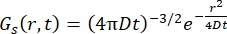 (3)
(3)
Singwi ve Sjölander'in ps-ns iç protein dinamiği14 için atlama difüzyon modeli veya Sears'ın hidrasyon suyu15,16,17 için dönme modeli gibi daha sofistike modeller geliştirildi ve yararlı bulundu.
ILL, Grenoble, Fransa'daki nötron geri saçılma (NBS) cihazı IN16B 8,9'da (Ek Şekil S1), proteinlerle yaygın olarak kullanılan bir kurulum, gelen dalga boyunu ayarlamak için Doppler tahrikli analizörler için Si 111 kristallerinden oluşur (Ek Şekil S2A), böylece momentum transfer aralığına erişim sağlar ~0.2 Å-1 < q < ~2 Å-1 ve -30 μeV enerji transfer aralığı < 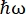 < 30 μeV-birkaç ps ile birkaç ns arasında değişen zaman ölçeklerine ve birkaç şmesafeye karşılık gelir. Ek olarak, IN16B, sabit bir enerji aktarımında veri toplamayı içeren elastik ve elastik olmayan sabit pencere taramaları (E/IFWS)10 gerçekleştirme imkanı sunar. Nötronlarla çalışırken akı sınırlı olduğundan, E / IFWS, bir enerji transferi için akının maksimize edilmesine izin verir, böylece tatmin edici bir sinyal-gürültü oranı elde etmek için gereken edinme süresini azaltır. Daha yeni bir seçenek, Doppler tahrikinden daha yüksek bir akı ile, ancak daha düşük bir enerji çözünürlüğü pahasına (Ek Şekil S2B) çok çeşitli enerji transferlerinin (örneğin, -150 μeV < <
< 30 μeV-birkaç ps ile birkaç ns arasında değişen zaman ölçeklerine ve birkaç şmesafeye karşılık gelir. Ek olarak, IN16B, sabit bir enerji aktarımında veri toplamayı içeren elastik ve elastik olmayan sabit pencere taramaları (E/IFWS)10 gerçekleştirme imkanı sunar. Nötronlarla çalışırken akı sınırlı olduğundan, E / IFWS, bir enerji transferi için akının maksimize edilmesine izin verir, böylece tatmin edici bir sinyal-gürültü oranı elde etmek için gereken edinme süresini azaltır. Daha yeni bir seçenek, Doppler tahrikinden daha yüksek bir akı ile, ancak daha düşük bir enerji çözünürlüğü pahasına (Ek Şekil S2B) çok çeşitli enerji transferlerinin (örneğin, -150 μeV < < 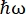 150 μeV) ölçülmesine izin veren geri saçılma ve uçuş süresi spektrometresi (BATS) mod11'dir.
150 μeV) ölçülmesine izin veren geri saçılma ve uçuş süresi spektrometresi (BATS) mod11'dir.
Nötron saçılmasının önemli bir özelliği, tutarsız kesit σinc'in hidrojen için döteryumdan 40 kat daha yüksek bir değere sahip olması ve biyolojik örneklerde yaygın olarak bulunan diğer elementler için ihmal edilebilir olmasıdır. Bu nedenle, sıvı bir ortamdaki proteinlerin dinamikleri, deuterated bir tampon kullanılarak incelenebilir ve toz durumu, D2O ile hidratlanmış hidrojene protein tozu ile protein iç dinamiklerinin incelenmesine veyaH2O ile hidratlanmış perdeuterated protein tozu için hidrasyon suyunun incelenmesine izin verir. Sıvı halde, nötron geri saçılması tipik olarak proteinlerin kütle merkezi kendi kendine difüzyonuna (Fickian tipi difüzyon) ve iç dinamiklerine aynı anda erişilmesini sağlar. İkincisi, genellikle atlama difüzyon modeli veya diğerleri 3,18 tarafından tanımlanan omurga ve yan zincir hareketleridir. Hidrojene protein tozlarında, protein difüzyonu yoktur ve sadece iç dinamiklerin modellenmesi gerekir. Hidrasyon suyu için, su moleküllerinin translasyonel ve rotasyonel hareketlerinin katkıları, veri analizi sürecinde ayrım yapmalarını sağlayan momentum transferi q'ya farklı bir bağımlılık sunar17.
Bu makale, nötron geri saçılma yöntemini, açılabildiği, çapraz β paterni19,20 olarak adlandırılan β iplikçik yığınlarından oluşan kanonik bir formda toplanabildiği ve uzun lifler oluşturduğu tespit edilen proteinlerin incelenmesiyle göstermektedir. Bu, Alzheimer veya Parkinson hastalıkları gibi nörodejeneratif bozukluklardaki merkezi rolü nedeniyle kapsamlı bir şekilde çalışılan amiloid agregasyonudur21,22. Amiloid proteinlerinin incelenmesi, 23,24 oynayabilecekleri fonksiyonel rol veya yeni biyomateryallerin geliştirilmesi için yüksek potansiyelleri ile de motive edilmektedir25. Amiloid agregasyonunun fizikokimyasal belirleyicileri belirsizliğini korumaktadır ve son yıllarda muazzam ilerlemelere rağmen amiloid agregasyonunun genel bir teorisi mevcut değildir21,26.
Amiloid agregasyonu, protein yapısında ve stabilitesinde zamanla değişiklikler anlamına gelir; bunun çalışması, doğal olarak, protein konformasyon stabilitesi, protein fonksiyonu ve protein enerjisi manzarası ile bağlantılı dinamikleri ima eder27. Dinamik, en hızlı hareketler28 için entropik katkı yoluyla belirli bir durumun kararlılığı ile doğrudan bağlantılıdır ve protein fonksiyonu, ışığa duyarlı proteinler29 için sub-ps'den alan hareketleri için ms'ye kadar çeşitli zaman ölçeklerinde hareketlerle sürdürülebilir, bu da pikosaniye-nanosaniye dinamikleri30 ile kolaylaştırılabilir.
Amiloid proteinlerini incelemek için nötron geri saçılma spektroskopisini kullanmanın iki örneği, biri protein dinamiklerini incelemek için sıvı halde ve diğeri hidrasyon su dinamiklerini incelemek için hidratlanmış toz halinde. İlk örnek, lizozimin μm boyutlu kürelere (partiküller olarak adlandırılır) gerçek zamanlı olarak toplanması ile ilgilidir 5 veikincisi, insan proteini tau31'in doğal ve toplanmış durumlarında su dinamiklerinin karşılaştırılmasıdır.
Lizozim, bağışıklık savunmasında rol oynayan bir enzimdir ve 129 amino asit kalıntısından oluşur. Lizozim, deuterated tamponda 10.5 pD'de ve 90 ° C'lik bir sıcaklıkta partiküller oluşturabilir. Nötron saçılması ile, lizozimin kütle merkezi difüzyon katsayısının zaman evriminin, tiyoflavin T floresansının tek üstel kinetiğinin (amiloid çapraz β paternlerinin oluşumunu izlemek için kullanılan bir floresan probu32) izlediğini gösterdik, bu da oluşum partikül üst yapılarının ve çapraz β desenlerinin aynı oranda tek bir adımda gerçekleştiğini gösterir. Dahası, iç dinamikler toplama süreci boyunca sabit kalmıştır, bu da NBS enstrümanlarında gözlemlenemeyen hızlı bir konformasyonel değişim veya agregasyon sırasında protein iç enerjisinde önemli bir değişikliğin olmaması ile açıklanabilir.
İnsan proteini tau, Alzheimer hastalığı33'te özellikle rol oynayan 2N4R izoformu için 441 amino asitten oluşan içsel olarak düzensiz bir proteindir (IDP). Perdeuterated protein tau tozları üzerinde nötron geri saçılması kullanarak, hidrasyon suyu dinamiklerinin lif durumunda arttığını, translasyonel hareketlere maruz kalan daha yüksek bir su molekülü popülasyonu olduğunu gösterdik. Sonuç, hidrasyon suyu entropisindeki bir artışın tau'nun amiloid fibrilasyonunu tetikleyebileceğini düşündürmektedir.
Protokol
1. Deuterated tamponu sıvı haldeki proteinler için hazırlayın
- Tamponun tüm bileşenlerini safD2O içinde çözün.
- pH elektroduH2O'dakalibre edilmişse, pD'yi NaOD veya DCl34 kullanarak pD = pH + 0.4 formülüne göre ayarlayın.
NOT:H2O yerineD2O kullanımı protein çözünürlüğünü etkileyebilir ve tampon koşullarının uyarlanması gerekebilir (örneğin, tuz konsantrasyonundaki küçük bir değişiklikle).
2.H2O-hidratlanmış perdeuterated protein tozlarını hazırlayın
- Numune tutucuyu hazırlayın.
- İndiyum tel contası ve vidaları su ve etanol ile düz bir alüminyum numune tutucuyu iyice temizleyin ve kurumasını bekleyin.
NOT: Tozun yüzeye homojen bir şekilde dağıtılabileceği şekilde düz bir numune tutucu kullanılır. Toz miktarı, duvarlar arasında korunabilecek ve numune tutucu dikey olarak yerleştirildiğinde düşmeyecek şekilde yeterli olmalıdır. - Numune tutucunun alt kısmının, kapağının ve indiyum telinin farklı kısımlarını hassas bir terazide ayrı ayrı tartın.
- 1 mm'lik indiyum tel contayı numune tutucunun alt kısmının oluğuna yerleştirin ve iki ucun birleştiği yerde küçük bir örtüşme bırakın (Şekil 2A).
- Uygun miktarda liyofilize protein (tipik olarak ~ 100 mg protein), numune tutucunun alt kısmının iç yüzeyini dolduracak şekilde yerleştirin.
- İndiyum tel contası ve vidaları su ve etanol ile düz bir alüminyum numune tutucuyu iyice temizleyin ve kurumasını bekleyin.
- Protein tozunu nemlendirin.
- Protein tozu35'i tamamen kurutmak için numune tutucuyu 24 saat boyuncaP2O5 tozu içeren bir Petri kabına sahip bir kurutucuya yerleştirin (Şekil 2B). İndiyum contayı ve kuru tozu içeren numune tutucunun kuru alt kısmını mkuru elde etmek için tartın.
DİKKAT: P2O5 tozu çok aşındırıcıdır. - P 2 O5'i kurutucudan çıkarın ve içinde D2O bulunan bir Petri kabı koyun. Hidrasyon seviyesini kontrol etmek için tozun kütlesini düzenli olarak kontrol edin h = m hyd / m kuru, burada mhyd ve m kuru, sırasıyla hidratlanmış tozun ve kuru tozun kütlesidir.
NOT: İnsülin gibi yüksek hidrofobik proteinler için, daha yüksek bir buhar basıncı elde etmek ve istenen hidrasyon seviyesi h'ye ulaşmak için kurutucunun içindeki sıcaklığın arttırılması gerekebilir. - Tüm değiştirilebilir hidrojenleri döteronlara uygun şekilde dönüştürmek için 2.2.1 ve 2.2.2 adımlarını en az üç kez tekrarlayın.
NOT: Alternatif olarak, safD2O'da dondurarak kurutma ve çözünme döngüleri, proteinin bundan etkilenmemesi koşuluyla daha iyi H/D değişimi için kullanılabilir. - Tozu istenen seviyenin biraz üzerine kadar nemlendirin, indiyum tel ve hidratlanmış toz ile numune tutucunun alt kısmının hassas dengede kalmasına izin verin ve hedef h'yi elde etmek için kütlenin yavaşça istenen değere düşmesini bekleyin (orta büyüklükte bir küresel protein bir tam hidrasyon tabakası ile kaplanacaksa tipik olarak 0.2-0.4).
- Kapağı hızlı bir şekilde alt kısma yerleştirin ve buhar değişimini durdurmak için numune tutucuyu önce dört vidayla kapatın (Ek Şekil S3A).
- Alt kısım ile kapak arasında boşluk görünmeyene kadar kalan tüm vidaları yerleştirin ve sıkın (Ek Şekil S3B).
- Nötron deneyinden sonra sızıntılar yoluyla olası hidrasyon kaybı olup olmadığını kontrol etmek için kapalı numune tutucuyu tartın.
- Protein tozu35'i tamamen kurutmak için numune tutucuyu 24 saat boyuncaP2O5 tozu içeren bir Petri kabına sahip bir kurutucuya yerleştirin (Şekil 2B). İndiyum contayı ve kuru tozu içeren numune tutucunun kuru alt kısmını mkuru elde etmek için tartın.
3. Tutarsız nötron saçılma deneyini gerçekleştirin
- Deney için gerekli olan cihazın konfigürasyonunu, atanan ışın zamanından birkaç hafta önce yerel temas ile tartışın ve iki kez kontrol edin.
- Sıvı hal örneğini hazırlayın.
- Proteini deuterated tamponda çözün.
- Su kullanarak numune tutucuya konulacak uygun sıvı hacmini belirler (numune tutucu kapalıyken taşma olmadığından emin olun; Şekil 2C).
NOT: Aşağıdaki adımlar (3.3 ve 3.4), ILL 8,9'daki NBS spektrometresi IN16B üzerinde, örnek bir ortam olarak bir kriyofunaz kullanılarak yapılan bir deneyi açıklamaktadır. Cihaz kontrol sistemi bir cihazdan diğerine değişecektir, ancak çalışma prensipleri aynı kalacaktır.
- Örneği ekleyin.
- Numune çubuğunu iyice kurutun (Şekil 2D) ve herhangi bir malzemeyi kullanmadan önce (ILL'de) iyonlaştırıcı radyasyon dozunun 100 μSv/s'den düşük olduğunu kontrol ettikten sonra varsa önceki numuneyi çıkarın.
- Numuneyi yerleştirin, ışın merkezine göre uygun merkezleme olup olmadığını kontrol edin (Ek Şekil S4) ve numune çubuğunu kriyofunace yerleştirin (Şekil 2D). Vakum pompasını 10-3 bar'dan daha azına ulaşacak şekilde açın ve aşağıdakileri üç kez tekrarlayarak cryofurnace içindeki havayı temizleyin: atmosferik basınca ulaşana kadar cryofurnace'ı helyum gazı ile doldurun ve vakum pompasını kullanarak gazı tekrar çıkarın.
NOT: Düz bir numune tutucu olması durumunda, numune tutucu gelen kirişe göre 45° açıyla yönlendirilmelidir. Yararlı momentum transfer aralığı, hücre tarafından emilim ve saçılma nedeniyle azaltılabilir. Kadmiyum gibi güçlü bir nötron emici, numune tutucunun belirli kısımlarını (örneğin, vidalar, kalın parçalar) maskelemek için kullanılabilir. - Kriyofunaca bir miktar helyum gazı ekleyin, böylece basınç ~ 0.05 bar olur.
- Veri elde edin (örneğin, ILL'de IN16B'de NOMAD kullanarak, kullanıcının yarı elastik nötron spektrumu (QENS) spektrumu elde etmeden önce 200 K'lık bir sıcaklığı tercih ettiği varsayılır, daha sonra bir sıcaklık rampası sırasında E / IFWS'yi dakikada 0,5 K'da 310 K'ya ve son olarak 310 K'da bir QENS'ye tercih ettiği varsayılır).
- NOMAD kullanarak, yürütme sekmesinde, Fırlatma Çubuğuna bir FurnaceCryostat denetleyicisini sürükleyip bırakın. Sıcaklığı 200 K'ya ayarlayın. Hızlı modu ve 30 dakikalık bir zaman aşımını kullanın, böylece sıcaklığın dengelenmesi için zamana sahip olur. Sıcaklık düşüşü sırasında verilerin alınabilmesi için arka planda çalıştırmak için dönen oklar simgesine tıklayın.
- IN16DopplerSettings denetleyicisini sürükleyip bırakın, bir EFWS yapılandırması elde etmek için hız profilini Maksimum ΔE tarafından ayarlanan doğru hız, 0,00 μeV değeri ve 128 kanal olarak ayarlayın.
- Bir Count denetleyicisini sürükleyip bırakın, Altyazı alanını verilerin kolayca tanımlanmasını sağlayan bir adla doldurun ve 30 sn'lik taramaların 60 tekrarını ayarlayın (Ek Şekil S5A).
- Bir IN16DopplerSettings denetleyicisini sürükleyip bırakın, QENS yapılandırması elde etmek için hız profilini 4,5 m/s ve 2.048 kanal değeriyle Hız tarafından ayarlanan Sinüs olarak ayarlayın.
- 30 dakikalık taramaların 4 tekrarı olan bir Count denetleyicisini sürükleyip bırakın (Ek Şekil S5B).
- Sıcaklık rampası için, bir FurnaceCryostat kontrol cihazını sürükleyip bırakın, sıcaklığı 310 K'ya ayarlayın, Rampa'yı Δ = 0,05 K ve 6 s ile SetPoint'e ayarlayın. 220 dakikalık bir zaman dilimi kullanın (Ek Şekil S6A).
- 65 tekrarlı bir for döngüsü kullanın. İçeride, adım 3.4.2'deki gibi bir IN16DopplerSettings denetleyicisi takın ve ardından 30 sn'lik tek bir sayı girin. Daha sonra, daha önce açıklandığı gibi, ancak 1,5 μeV ve 1.024 kanallık bir enerji ofseti ve ardından 3 dakikalık tek bir sayı kullanarak IN16DopplerSettings'i yerleştirin (Ek Şekil S6B).
- 310 K'da son QENS'yi almak için, sırasıyla 3.4.4 ve 3.4.5 adımlarında açıklandığı gibi yapılandırılmış IN16DopplerSettings ve Count denetleyicilerini sürükleyip bırakın.
- Komut dosyasını çalıştırmak için başlat düğmesine (pencerenin altındaki dik üçgen) basın.
NOT: Her deney kalibrasyon verilerinin alınmasını gerektirecektir; yani, çıkarma veya absorpsiyon düzeltmeleri için boş hücre, arka planı modellemek için kullanılan farklı sıcaklıklarda tek başına tampon ve cihazın çözünürlük fonksiyonunu elde etmek için vanadyum ölçümü (veya eşdeğer olarak, numune 10 K veya daha düşük bir sıcaklıkta).
4. Veri analizi - QENS
- Python yazılımı nPDyn v3.x36'daki 'IN16B_QENS.process()' yöntemini kullanarak veri kümesini içeri aktarın
nPDyn.dataParsers IN16B_QENS alma işleminden >>>>
>>> örnek = IN16B_QENS(
...
... [detGroup=... biçim>]
... ). process()
>>> örnek = sample.get_q_range(0,3, 1,8) - Aşağıdaki komutlarla veri düzeltmeleri (isteğe bağlı) gerçekleştirin (daha fazla bilgi için nPDyn belgelerine bakın, Şekil 3):
#it boş hücre, vanadyum ve arabellek için verilerin olduğu varsayılır
# 'empty_cell', 'vanadyum' adlı veri kümesinde zaten içe aktarıldı,
# ve 'tampon', sırasıyla.
# ölçekleme faktörüne sahip boş hücre çıkarma için
# (hatalar otomatik olarak yayılır)
>>> örnek = örnek - 0,95 * empty_cell
# Paalman-Ping katsayısını kullanarak düzeltme için
# (yukarıdaki örnekle karşılıklı olarak münhasır)
>>> örnek = sample.absorptionCorrection(empty_cell)
# normalleştirme için
>>> örnek = sample.normalize(vanadyum)
# gözlemlenebilir eksen boyunca bağlama için
# Gözlemlenebilir buradaki toplama süresidir
>>> örnek = örnek.bin(3, eksen=0) - Kalibrasyon verilerini sığdırın. Veri kümesi örnekleri, boş hücre, deuterated buffer (gerekirse) ve vanadyum, yerleşik modeller veya kullanıcı tanımlı bir model kullanılarak takılabilir (nPDyn belgelerine bakın):
nPDyn.models.builtins dosyasından >>> içe aktarma (
... modeliPVoigt,
... modelSu,
... modelKalibre EdilmişD2O,
... )
# Yerleşik modeller, momentumun bir sütun vektörünü kullanır
# q değerlerini aktarın
>>> q = vanadium.q[:, Yok]
# vanadyum psödo-Voigt profili kullanılarak takılır
>>> vanadium.fit(modelPVoigt(q)) - 'ModelWater' adı verilen hidrasyon suyu için yerleşik modeli kullanın. Bu model, Eq (4)17 tarafından gösterildiği gibi okunur
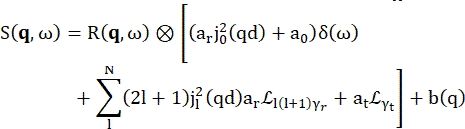 (4)
(4)
Burada 0, r ve t, sırasıyla elastik sinyalin, dönme hareketlerinin ve translasyonel hareketlerin göreceli katkısını açıklayan skalerlerdir; j1(qd), q momentum transferi olan linci dereceli küresel Bessel fonksiyonudur; d su molekülündeki O-H mesafesi; δ(ω), burada EISF ile çarpılan Dirac deltasıdır; N, kullanılan küresel Bessel fonksiyonunun en yüksek mertebesidir (tipik olarak ~ 5);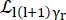 ve sırasıyla Lorentzian rotasyonel ve
ve sırasıyla Lorentzian rotasyonel ve 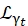 translasyonel hareketlerdir; b(q) düz bir arka plan terimidir. Küresel Bessel fonksiyonları, su moleküllerinin her açısal momentum durumunun göreceli katkısını verir ve N sayısı, momentum transferi q-aralığına göre belirlenir. Tipik bir NBS spektrometresi söz konusu olduğunda, N = 4'e kadar olan terimler neredeyse tamamen sinyali açıklar (Ek Şekil S7).
translasyonel hareketlerdir; b(q) düz bir arka plan terimidir. Küresel Bessel fonksiyonları, su moleküllerinin her açısal momentum durumunun göreceli katkısını verir ve N sayısı, momentum transferi q-aralığına göre belirlenir. Tipik bir NBS spektrometresi söz konusu olduğunda, N = 4'e kadar olan terimler neredeyse tamamen sinyali açıklar (Ek Şekil S7).
# Burada, hidrasyon suyu için denklem 2 kullanılır
# çözünürlük fonksiyonu ile evrişim ve eklenmesi
# D2O arka plan otomatik olarak yapılır
# sağlanan argümanlar
>>> sample.fit(modelWater(q),
... res=vanadyum,
... bkgd=tampon,
... volume_fraction_bkgd=0,95
... )
NOT: Rotasyonel ve translasyonel hareketlerin katkıları, mükemmel bir titizlik olması için kıvrımlı olmalıdır. Bir katkı modelinin başarısı, protein yüzeyinde farklı su popülasyonlarının varlığına ve erişilebilir sınırlı enerji aralığına bağlanmalıdır. - Verileri çizmek için aşağıdakileri kullanın (Şekil 4):
nPDyn.plot import plot sitesinden >>>
>>> arsa (örnek)
5. Veri analizi - sıcaklık rampası, elastik sabit pencere taramaları (EFWS)
- Sıcaklık rampası verilerini en düşük sıcaklıktaki (tipik olarak 10 K) sinyalle normalleştirmek için bölüm 4'e benzer bir prosedür kullanın:
nPDyn.dataParsers IN16B_FWS alma işleminden >>>
>>> örnek = IN16B_FWS(
... ,
... detGroup=[detGroup=]
... ). process()
# Normalizasyon ile 5 ilk nokta gözlemlenebilir
Sıcaklığa karşılık gelen # ekseni
>>> örnek /= örnek[:5].ortalama(0)
# Burada kullanılan momentum transferi q aralığı daha küçüktür
# Kullanılan model sadece düşük q için geçerli olduğu için
>>> örnek = sample.get_q_range(0,2, 0,8) - Başlamak için, genişliği sözde ortalama karesel yer değiştirme (MSD) tarafından verilen basit bir Gauss modeli kullanın. Aşağıdaki komutları kullanarak modeli derleyin ve sığdırın:
>>> numpy'yi np olarak içe aktarın
nPDyn.models dosyasından >>> içe aktarma Parametreleri, Modeli, Bileşeni
# a bir ölçekleme faktörüdür
>>> params = Parametreler(
... a={'değer': 1, 'sınırlar': (0, np.inf)},
... msd={'değer': 1, 'sınırlar': (0, np.inf)}
... )
>>> model = Model (paramlar)
>>> model.addComponent(Component(
... 'Gaussian',
... Lambda X, A, MSD: a * np.exp(-x ** 2 * msd / 6)
... ))
>>> sample.fit(model, x=sample.q[:, Yok])
>>> arsa (örnek)
NOT: Gauss yaklaşımı her zaman q2MSD << 1 için geçerlidir, ancak numuneler arasında göreceli karşılaştırma için daha geniş momentum transfer aralığı kullanılabilir. Gauss yaklaşımının ötesine geçen daha sofistike modeller geliştirilmiştir37,38,39.
6. Veri analizi - elastik ve elastik olmayan sabit pencere taramaları (E/IFWS)
- 4. adıma benzer şekilde, veri kümesini içeri aktarın, ancak 'IN16B_FWS' sınıfını kullanın:
nPDyn.dataParsers IN16B_FWS alma işleminden >>>
>>> örnek = IN16B_FWS(
...
... [detGroup=]
... ). process()
>>> örnek = sample.get_q_range(0,3, 1,8) - Kalibrasyon verilerini ve numune verilerini sığdırın.
- E/IFWS verilerini genelleştirilmiş bir MSD40 kullanarak veya bunları kaba-QENS spektrumları olarak değerlendirerek (enerji ekseninde yalnızca birkaç veri noktasına sahip) analiz edin. E/IFWS kaba-QENS olarak görüldüğünde, QENS için kullanılan modeller tüm E/IFWS veri kümesine aynı anda uyacak şekilde kullanılır (enerji transferlerinin ve momentum transferlerinin küresel uyumu).
NOT: E/IFWS verilerinde QENS için ikinci çözüm kullanan modeller, burada kütle merkezi difüzyonunun momentum transfer bağımlılığının ve protein iç dinamiklerinin dayatıldığı yerlerde kullanılır. - Aşağıdaki Eq (5) (nPDyn'de 'modelProteinJumpDiff') kullanarak sıvılardaki protein dinamiklerini modelleyin:
 (5)
(5)
Burada R(q,ω) çözünürlük fonksiyonudur; β her momentum transferi q için skaler bağımsız; a0 , elastik tutarsız yapı faktörüdür (EISF);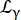 Eq tarafından verilen bir genişliğe sahip kütle merkezi difüzyonunu açıklayan bir Lorentzian (6);
Eq tarafından verilen bir genişliğe sahip kütle merkezi difüzyonunu açıklayan bir Lorentzian (6); 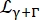 kütle merkezi difüzyonunu ve iç dinamikleri hesaba katan atlama-difüzyon modeli14'ü takip eden bir katkıyı içeren bir Lorentzian'dır (Eq (7);
kütle merkezi difüzyonunu ve iç dinamikleri hesaba katan atlama-difüzyon modeli14'ü takip eden bir katkıyı içeren bir Lorentzian'dır (Eq (7);  numunedeki hacim fraksiyonu ile yeniden ölçeklendirilen D2O'dan gelen takılı sinyaldir.
numunedeki hacim fraksiyonu ile yeniden ölçeklendirilen D2O'dan gelen takılı sinyaldir.
γ = Dsq2 (6)
D'ler kendi kendine difüzyon katsayısıdır.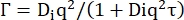 (7)
(7)
Di, iç dinamikler için görünür difüzyon katsayısı ve τ difüzif hareketler için bir gevşeme süresidir.
nPDyn.models.builtins dosyasından >>> içe aktarma (
... modeliPVoigt,
... modelProteinJumpDiff,
... modelKalibre EdilmişD2O,
... )
# Yerleşik modeller, momentumun bir sütun vektörünü kullanır
# q değerlerini aktarın
>>> q = vanadium.q[:, Yok]
# vanadyum psödo-Voigt profili kullanılarak takılır
>>> vanadium.fit(modelPVoigt(q))
# saf D2O için, kalibre edilmiş çizgi genişliğine sahip bir model
# farklı sıcaklıklar için nPDyn dahil edilmiştir
>>> buffer.fit(modelCalibratedD2O(q, temp=363))
# Burada, sıvı numuneler için denklem 3 kullanılır
# çözünürlük fonksiyonu ile evrişim ve eklenmesi
# D2O arka planı, # sağlanan argümanlarla otomatik olarak yapılır
>>> sample.fit(modelProteinJumpDiff(q),
... res=vanadyum,
... bkgd=tampon,
... volume_fraction_bkgd=0,95
... )
- E/IFWS verilerini genelleştirilmiş bir MSD40 kullanarak veya bunları kaba-QENS spektrumları olarak değerlendirerek (enerji ekseninde yalnızca birkaç veri noktasına sahip) analiz edin. E/IFWS kaba-QENS olarak görüldüğünde, QENS için kullanılan modeller tüm E/IFWS veri kümesine aynı anda uyacak şekilde kullanılır (enerji transferlerinin ve momentum transferlerinin küresel uyumu).
- Takılan verileri aşağıdakileri kullanarak grafiklendirin:
nPDyn.plot import plot sitesinden >>>
>>> arsa (örnek)
Sonuçlar
Lizozimin partiküllere toplanması, 90 ° C'de, deuterated bir tamponda 50 mg / mL'lik bir protein konsantrasyonu ile gerçekleştirildi (pD 10.5'te 0.1 M NaCl). Partiküllerin oluşumu, sıcaklığın 90 ° C'ye yükselmesiyle tetiklenir ve 6 saat içinde gerçekleşir (Ek Şekil S8). Veri toplama, yukarıdaki protokolde açıklandığı gibi IN16B üzerinde gerçekleştirilmiştir (veriler ILL tarafından kalıcı olarak küratörlüğünü yapmaktadır ve http://dx.doi.org/10.5291/ILL-DATA.8-04-811 a...
Tartışmalar
Nötron spektroskopisi, proteinin boyutuna veya döterasyon kullanıldığında çözeltinin karmaşıklığına bakılmaksızın protein örneklerinin topluluk ortalamalı ps-ns dinamiklerinin araştırılmasına izin veren tek yöntemdir6. Spesifik olarak, çözelti içindeki protein gruplarının kendiliğinden difüzyonunu araştırarak, bu tür montajların hidrodinamik boyutu açık bir şekilde belirlenebilir. Bununla birlikte, yöntem genellikle düşük nötron akısı ile sınırlıdır,...
Açıklamalar
Yazarların açıklayacak çıkar çatışmaları yoktur.
Teşekkürler
Yazarlar, Heinz Maier-Leibnitz Zentrum, Garching, Almanya'daki Jülich Nötron Bilimi Merkezi'nden Michaela Zamponi'ye, SPHERES cihazı üzerinde yapılan nötron saçılma deneylerinin bir parçası için minnettarlar. Bu çalışma, Avrupa Birliği tarafından HPRI-2001-50065 ve RII3-CT-2003-505925 Sözleşmeleri kapsamında finanse edilen Deuterasyon Laboratuvarı (DLAB) konsorsiyumunun faaliyetlerinden ve GR/R99393/01 ve EP/C015452/1 Hibeleri kapsamında Institut Laue Langevin EMBL DLAB bünyesindeki İngiltere Mühendislik ve Fizik Bilimleri Araştırma Konseyi (EPSRC) tarafından finanse edilen faaliyetlerden yararlanmıştır. Avrupa Komisyonu'nun 7. Çerçeve Programı kapsamında Anahtar Eylem: Avrupa Araştırma Alanı'nın Güçlendirilmesi, Araştırma Altyapıları aracılığıyla verdiği destek kabul edilmektedir [Sözleşme 226507 (NMI3)]. Kevin Pounot ve Christian Beck, Federal Eğitim ve Araştırma Bakanlığı'na (BMBF, hibe numarası 05K19VTB) doktora sonrası burslarının finansmanı için teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Aluminum sample holder | Not commercially available. Either the local contact on the instrument can provide them or they can be manufactured based on a technical drawing that can be provided by the local contact. | ||
| Deuterium chloride, 35 wt. % in D2O, ≥99 atom % D | Sigma-Aldrich | 543047 | |
| Deuterium oxide (D, 99.9%) | Eurisotop | DLM-4DR-PK | |
| Dow Corning high-vacuum silicone grease | Sigma-Aldrich | Z273554-1EA | |
| Ethanol 96%, EMSURE Reag. Ph Eur | Sigma-Aldrich | 1.5901 | |
| Glass dessicator | VWR | 75871-660 | |
| Glass dessicator plate, 140 mm | VWR | 89038-068 | |
| Indium wire, 1.0 mm (0.04 in) dia, Puratronic, 99.999% | Alfa Aesar | 00470.G1 | |
| Lysozyme from chicken egg white dialyzed, lyophilized, powder, ~100,000 U/mg | Sigma-Aldrich | 62970 | |
| nPDyn | v3.x | see github.com/kpounot/nPDyn, model functions fot fitting also included in the software | |
| OHAUS AX324 Adventurer balance, internal calibration | Dutscher | 92641 | |
| Phosphorus pentoxide, ReagentPlus, 99% | Sigma-Aldrich | 214701 | |
| Pipette ErgoOne 0.5-10 μL | Starlab | S7100-0510 | |
| Pipette ErgoOne 100-1,000 μL | Starlab | S7100-1000 | |
| Pipette ErgoOne 20-200 μL | Starlab | S7100-2200 | |
| Pipette tip TipOne 1,000 μL | Starlab | S1111-6001 | |
| Pipette tip TipOne 10 μL | Starlab | S1111-3200 | |
| Pipette tip TipOne 200 μL | Starlab | S1111-0206 | |
| Sodium deuteroxide solution, 40 wt. % in D2O, 99.5 atom % D | Sigma-Aldrich | 372072 |
Referanslar
- Jacrot, B. Des neutrons pour la science: Histoire de l'Institut Laue-Langevin. Des neutrons pour la science. EDP Sciences. , (2021).
- Mahieu, E., Gabel, F. Biological small-angle neutron scattering: recent results and development. Acta Crystallographica Section D. 74 (8), 715-726 (2018).
- Grimaldo, M., Roosen-Runge, F., Zhang, F., Schreiber, F., Seydel, T. Dynamics of proteins in solution. Quarterly Reviews of Biophysics. 52, 7 (2019).
- Martel, A., et al. Membrane permeation versus amyloidogenicity: A multitechnique study of islet amyloid polypeptide interaction with model membranes. Journal of the American Chemical Society. 139 (1), 137-148 (2017).
- Pounot, K., et al. Tracking internal and global diffusive dynamics during protein aggregation by high-resolution neutron spectroscopy. The Journal of Physical Chemistry Letters. 11 (15), 6299-6304 (2020).
- Grimaldo, M., et al. Protein short-time diffusion in a naturally crowded environment. The Journal of Physical Chemistry Letters. 10 (8), 1709-1715 (2019).
- Jasnin, M., Stadler, A., Tehei, M., Zaccai, G. Specific cellular water dynamics observed in vivo by neutron scattering and NMR. Physical Chemistry Chemical Physics. 12 (35), 10154-10160 (2010).
- Frick, B. The neutron backscattering spectrometer IN16 at ILL-high energy resolution with high intensity and excellent signal-to-noise ratio. Neutron News. 13 (2), 15-22 (2002).
- Frick, B., Mamontov, E., van Eijck, L., Seydel, T. Recent backscattering instrument developments at the ILL and SNS. Zeitschrift für Physikalische Chemie. 224 (1-2), 33-60 (2010).
- Frick, B., Combet, J., van Eijck, L. New possibilities with inelastic fixed window scans and linear motor Doppler drives on high resolution neutron backscattering spectrometers. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 669, 7-13 (2012).
- Appel, M., Frick, B., Magerl, A. A flexible high speed pulse chopper system for an inverted neutron time-of-flight option on backscattering spectrometers. Scientific Reports. 8 (1), 13580 (2018).
- Squires, G. L. . Introduction to the theory of thermal neutron scattering. , (1996).
- Singwi, K. S., Sjölander, A. Diffusive motions in water and cold neutron scattering. Physical Review. 119 (3), 863-871 (1960).
- Sears, V. F. Theory of cold neutron scattering by homonuclear diatomic liquids: i. free rotation. Canadian Journal of Physics. 44 (6), 1279-1297 (1966).
- Sears, V. F. Theory of cold neutron scattering by homonuclear liquid: ii. hindered rotation. Canadian Journal of Physics. 44 (6), 1299-1311 (1966).
- Schirò, G., et al. Translational diffusion of hydration water correlates with functional motions in folded and intrinsically disordered proteins. Nature Communications. 6, 6490 (2015).
- Grimaldo, M., et al. Hierarchical molecular dynamics of bovine serum albumin in concentrated aqueous solution below and above thermal denaturation. Physical Chemistry Chemical Physics. 17 (6), 4645-4655 (2015).
- Eanes, E. D., Glenner, G. G. X-ray diffraction studies on amyloid filaments. Journal of Histochemistry & Cytochemistry. 16 (11), 673-677 (1968).
- Bonar, L., Cohen, A. S., Skinner, M. M. Characterization of the Amyloid Fibril as a Cross-β Protein. Proceedings of the Society for Experimental Biology and Medicine. 131 (4), 1373-1375 (1969).
- Chiti, F., Dobson, C. M. Protein Misfolding, Amyloid Formation, and Human Disease: A Summary of Progress Over the Last Decade. Annual Review of Biochemistry. 86 (1), 27-68 (2017).
- Knowles, T. P. J., Vendruscolo, M., Dobson, C. M. The amyloid state and its association with protein misfolding diseases. Nature Reviews Molecular Cell Biology. 15 (6), 384-396 (2014).
- Maji, S. K., et al. Functional amyloids as natural storage of peptide hormones in pituitary secretory granules. Science. 325 (5938), 328-332 (2009).
- Li, J., et al. The RIP1/RIP3 necrosome forms a functional amyloid signaling complex required for programmed necrosis. Cell. 150 (2), 339-350 (2012).
- Knowles, T. P. J., Mezzenga, R. Amyloid fibrils as building blocks for natural and artificial functional materials. Advanced Materials. 28 (31), 6546-6561 (2016).
- Stephens, A. D., Kaminski Schierle, G. S. The role of water in amyloid aggregation kinetics. Current Opinion in Structural Biology. 58, 115-123 (2019).
- Adamcik, J., Mezzenga, R. Amyloid polymorphism in the protein folding and aggregation energy landscape. Angewandte Chemie International Edition. 57 (28), 8370-8382 (2018).
- Liu, Z., et al. Entropic contribution to enhanced thermal stability in the thermostable P450 CYP119. Proceedings of the National Academy of Sciences of the United States of America. 115 (43), 10049-10058 (2018).
- Coquelle, N., et al. Chromophore twisting in the excited state of a photoswitchable fluorescent protein captured by time-resolved serial femtosecond crystallography. Nature Chemistry. 10 (1), 31-37 (2018).
- Henzler-Wildman, K. A., et al. A hierarchy of timescales in protein dynamics is linked to enzyme catalysis. Nature. 450 (7171), 913-916 (2007).
- Fichou, Y., et al. Hydration water mobility is enhanced around tau amyloid fibers. Proceedings of the National Academy of Sciences of the United States of America. 112 (20), 6365-6370 (2015).
- Burns, J., Pennock, C. A., Stoward, P. J. The specificity of the staining of amyloid deposits with thioflavine T. The Journal of Pathology and Bacteriology. 94 (2), 337-344 (1967).
- Iqbal, K., Liu, F., Gong, C. -. X., Grundke-Iqbal, I. Tau in Alzheimer disease and related tauopathies. Current Alzheimer Research. 7 (8), 656-664 (2010).
- Krȩżel, A., Bal, W. A formula for correlating pKa values determined in D2O and H2O. Journal of Inorganic Biochemistry. 98 (1), 161-166 (2004).
- Dolman, M., Halling, P. J., Moore, B. D., Waldron, S. How dry are anhydrous enzymes? Measurement of residual and buried 18O-labeled water molecules using mass spectrometry. Biopolymers. 41 (3), 313-321 (1997).
- Pounot, K. kpounotnPDyn: v3.0.0. Zenodo. , (2021).
- Yi, Z., Miao, Y., Baudry, J., Jain, N., Smith, J. C. Derivation of mean-square displacements for protein dynamics from elastic incoherent neutron scattering. Journal of Physical Chemistry B. 116 (16), 5028-5036 (2012).
- Peters, J., Kneller, G. R. Motional heterogeneity in human acetylcholinesterase revealed by a non-Gaussian model for elastic incoherent neutron scattering. The Journal of Chemical Physics. 139 (16), 165102 (2013).
- Zeller, D., Telling, M. T. F., Zamponi, M., García Sakai, V., Peters, J. Analysis of elastic incoherent neutron scattering data beyond the Gaussian approximation. The Journal of Chemical Physics. 149 (23), 234908 (2018).
- Roosen-Runge, F., Seydel, T. A generalized mean-squared displacement from inelastic fixed window scans of incoherent neutron scattering as a model-free indicator of anomalous diffusion confinement. EPJ Web of Conferences. 83, 02015 (2015).
- Ortega, A., Amorós, D., García de la Torre, J. Prediction of hydrodynamic and other solution properties of rigid proteins from atomic- and residue-level models. Biophysical Journal. 101 (4), 892-898 (2011).
- Hennig, M., Frick, B., Seydel, T. IUCr Optimum velocity of a phase-space transformer for cold-neutron backscattering spectroscopy. Journal of Applied Crystallography. 44 (3), 467-472 (2011).
- Paalman, H. H., Pings, C. J. Numerical evaluation of X-ray absorption factors for cylindrical samples and annular sample cells. Journal of Applied Physics. 33 (8), 2635-2639 (1962).
- Ow, S. -. Y., Dunstan, D. E. The effect of concentration, temperature and stirring on hen egg white lysozyme amyloid formation. Soft Matter. 9 (40), 9692-9701 (2013).
- Tominaga, T., Sahara, M., Kawakita, Y., Nakagawa, H., Yamada, T. Evaluation of sample cell materials for aqueous solutions used in quasi-elastic neutron scattering measurements. Journal of Applied Crystallography. 54 (6), 1631-1640 (2021).
- Beck, C., et al. Following protein dynamics in real time during crystallization. Crystal Growth & Design. 19 (12), 7036-7045 (2019).
- Smith, A. A., Testori, E., Cadalbert, R., Meier, B. H., Ernst, M. Characterization of fibril dynamics on three timescales by solid-state NMR. Journal of Biomolecular NMR. 65 (3-4), 171-191 (2016).
- Wang, T., Jo, H., DeGrado, W. F., Hong, M. Water distribution, dynamics, and interactions with Alzheimer's β-amyloid fibrils investigated by solid-state NMR. Journal of the American Chemical Society. 139 (17), 6242-6252 (2017).
- Rezaei-Ghaleh, N., Giller, K., Becker, S., Zweckstetter, M. Effect of zinc dinding on β-amyloid structure and dynamics: Implications for Aβ aggregation. Biophysical Journal. 101 (5), 1202-1211 (2011).
- Vugmeyster, L., et al. Fast motions of key methyl groups in amyloid-β fibrils. Biophysical Journal. 111 (10), 2135-2148 (2016).
- Yang, X., Wang, B., Hoop, C. L., Williams, J. K., Baum, J. NMR unveils an N-terminal interaction interface on acetylated-α-synuclein monomers for recruitment to fibrils. Proceedings of the National Academy of Sciences of the United States of America. 118 (18), (2021).
- Tuttle, M. D., et al. Solid-state NMR structure of a pathogenic fibril of full-length human α-synuclein. Nature Structural & Molecular Biology. 23 (5), 409-415 (2016).
- Karamanos, T. K., Kalverda, A. P., Thompson, G. S., Radford, S. E. Mechanisms of amyloid formation revealed by solution NMR. Progress in Nuclear Magnetic Resonance Spectroscopy. 88-89, 86-104 (2015).
- Lai, Y. -. C., Kuo, Y. -. H., Chiang, Y. -. W. Identifying protein conformational dynamics using spin-label ESR. Chemistry - An Asian Journal. 14 (22), 3981-3991 (2019).
- Franck, J. M., Han, S. Overhauser dynamic nuclear polarization for the study of hydration dynamics, explained. Methods in Enzymology. 615, 131-175 (2019).
- Pavlova, A., et al. Protein structural and surface water rearrangement constitute major events in the earliest aggregation stages of tau. Proceedings of the National Academy of Sciences of the United States of America. 113 (2), 127-136 (2016).
- Lin, Y., et al. Liquid-liquid phase separation of tau driven by hydrophobic interaction facilitates fibrillization of tau. bioRxiv. , (2020).
- Decatur, S. M. Elucidation of residue-level structure and dynamics of polypeptides via isotope-edited infrared spectroscopy. Accounts of Chemical Research. 39 (3), 169-175 (2006).
- Chatani, E., Tsuchisaka, Y., Masuda, Y., Water Tsenkova, R. molecular system dynamics associated with amyloidogenic nucleation as revealed by real time near infrared spectroscopy and aquaphotomics. PLoS One. 9 (7), 101997 (2014).
- Goret, G., Aoun, B., Pellegrini, E. MDANSE: An interactive analysis environment for molecular dynamics simulations. Journal of Chemical Information and Modeling. 57 (1), 1-5 (2017).
- Fujiwara, S., et al. Internal dynamics of a protein that forms the amyloid fibrils observed by neutron scattering. Journal of the Physical Society of Japan. 82, (2013).
- Schiró, G., et al. Neutron scattering reveals enhanced protein dynamics in concanavalin a amyloid fibrils. Journal of Physical Chemistry Letters. 3 (8), 992-996 (2012).
- Pounot, K., et al. Zinc determines dynamical properties and aggregation kinetics of human insulin. Biophysical Journal. 120 (5), 886-898 (2021).
- Fujiwara, S., et al. Dynamic properties of human α-synuclein related to propensity to amyloid fibril formation. Journal of Molecular Biology. 431 (17), 3229-3245 (2019).
- Sanz, A., et al. High-pressure cell for simultaneous dielectric and neutron spectroscopy. Review of Scientific Instruments. 89 (2), 023904 (2018).
- Adams, M. A., et al. Simultaneous neutron scattering and Raman scattering. Applied Spectroscopy. 63 (7), 727-732 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır