Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hücresel Düzeyde Mantar-Mikrobiyal Etkileşimleri Probalamak için Mikroakışkan Araçlar
Bu Makalede
Özet
Toprağın opaklığı nedeniyle, kurucu mikroplar arasındaki etkileşimler hücresel çözünürlükle kolayca görselleştirilemez. Burada, mantar-mikrobiyal etkileşimleri araştırmak için yeni fırsatlar sunan iki mikroakışkan araç sunulmaktadır. Cihazlar çok yönlü ve kullanımı kolaydır, bu da hücresel düzeyde yüksek mekansal zamansal kontrol ve yüksek çözünürlüklü görüntüleme sağlar.
Özet
Filamentli mantarlar toprağın başarılı sakinleridir ve organik ve inorganik maddenin ayrışması ve besin seviyelerinin düzenlenmesi gibi toprak ekosistemlerinde önemli bir rol oynarlar. Orada ayrıca bakteri veya diğer mantarlar gibi çeşitli diğer mikroplarla etkileşime girmek için sayısız fırsat bulurlar. Bununla birlikte, mantar etkileşimlerini hücresel düzeyde incelemek, toprağın kara kutu benzeri doğası nedeniyle zor olabilir. Mantar etkileşimlerinin incelenmesi için yeni mikroakışkan araçlar geliştirilmektedir; bakteriyel-fungal ve mantar-fungal etkileşimlerini incelemek için tasarlanmış iki platform vurgulanmıştır. Bu mikrokanallar içinde, mantar-mikrobiyal etkileşimler, kontrollü fiziko-kimyasal ortamlarda, daha önce mümkün olandan daha yüksek zamansal ve mekansal çözünürlükte izlenebilir. Bu araçların uygulanması, hifalara bakteriyel polar bağlılığın gözlemlenmesi veya karakterize edilmemiş mantar-mantar antagonizmalarının ortaya çıkarılması gibi çok sayıda yeni biyolojik anlayış sağlamıştır. Bu metodolojilerin önemli bir özelliği, bu aracın uzman olmayanlar tarafından kullanım kolaylığı ile ilgilidir ve mikrobiyoloji laboratuvarlarında kullanılmak üzere oldukça çevrilebilir teknolojiler ortaya koymaktadır.
Giriş
Toprak, karbon ve fosfor döngüleriiçin etkili olan mikroorganizmaların bolluğunu içeren olağanüstü çeşitli bir ortamdır 1,2. Filamentli mantarlar, organik ve inorganik maddelerin ayrıştırıcıları olarak çok sayıda ekosistemin önemli bir bileşenidir ve simbiyotik ilişkilerin oluşumu yoluyla bitkilerin beslenmesini artırabilir 3,4. Toprakta, mantarlar diğer mantarlar5, bakteri6, virüsler7 ve nematodlar8 gibi çok sayıda mikropla dinamik olarak etkileşime girer. Bu etkileşimlerin toprak ve bitki sağlığı için önemli sonuçları vardır. Bununla birlikte, etkileşime giren mikroorganizmaları yüksek çözünürlükte görüntüleyebilen uygun deneysel sistemlerin bulunmaması nedeniyle, birçoğu tanımlanmamıştır.
Bakteriyel-fungal etkileşimler (BFI'ler) ve mantar-mantar etkileşimleri (FFI'ler) ile ilgili araştırmalar, tıpta antimikrobiyaller ve tarımda biyolojik kontrol ajanları da dahil olmak üzere bir dizi alanda değerli uygulamalara sahiptir. Örneğin, Coprinopsis cinerea mantarı, insan patojeni Listeria monocytogenes9'a karşı antibakteriyel aktivite sergilediği gösterilen peptid copsin'i üretir. Benzer şekilde, mantar kaynaklı bileşik olan griseofulvin, insan mantar enfeksiyonları için bir tedavi olarak yaygın olarak kullanılır ve ayrıca bitki patojenik mantarı Alternaria solani10,11'in büyümesini inhibe edebilir. Toprakta yaşayan bakteri Bacillus subtilis'in çeşitli suşlarının da mantar bitkisi patojeni Rhizoctonia solani12,13'ün etkili biyokontrol ajanları olduğu gösterilmiştir. Bununla birlikte, geleneksel metodolojilerle ilişkili sınırlamalar nedeniyle, BFI'lar ve FFI'lar tek hücreler düzeyinde yeterince anlaşılmamıştır.
Geleneksel çalışmalar tipik olarak BFI'ları ve FFI'ları, çatışmada iki veya daha fazla türe sahip agar plakaları kullanarak makro ölçekte araştırmaktadır. Etkileşimleri, karşı karşıya kalan türlerin büyüme oranlarını ve metabolit üretimini ölçerek değerlendirilir14,15,16; ancak, bu metodoloji sadece koloni seviyesine kadar çözülmüştür. Hücresel düzeyde etkileşimleri incelemek için, bakteriyel ve fungal aşılayıcılar, daha sonra mikroskop altında görüntülenen agar ile kaplanmış cam mikroskop slaytlarında yetiştirilebilir17. Bununla birlikte, hapsedilme eksikliği nedeniyle mikroskop slaytlarını kullanarak tek bir hifayı takip etmek zor olabilir, bu da hızlandırılmış görüntülerin elde edilmesinin daha zor olduğu anlamına gelir. Ayrıca, mantar miselyumunun tanımlanmış bölgeleri içindeki diğer mikroorganizmaları mekansal olarak sınırlama veya örneğin bozulabilecek tanımlanmış kimyasal ortamlar yaratma fırsatı, bu tür kurulumlarda mümkün değildir. Toprağın "kara kutu" doğası, mantar-mikrobiyal etkileşimleri tek hücreler düzeyinde incelemenin karmaşıklığına da katkıda bulunur18. Etkileşen türleri toprak mikrobiyomunun inanılmaz çeşitliliğinden uzakta gözlemleyerek, bireysel üyelerin etkileşime girme şekli tam olarak değerlendirilebilir. Bu nedenle, BFI'ların ve FFI'ların yüksek çözünürlüklü, tek hücreli görüntülenmesini sağlayan çok yönlü platformlara sürekli bir ihtiyaç vardır.
Çip üzerinde laboratuvar sistemleri olarak adlandırılan mikroakışkan teknolojiler, BFI'ların ve FFI'ların tek hücreler düzeyinde incelenmesi için ideal bir platform sağlar. Kimyasal analiz ve mikroelektronik için geliştirilen teknolojilerden kaynaklanan mikroakışkanlar alanı, biyolojik bilimler tarafından benimsenmiştir19. Mikroakışkan teknolojileri, mikrometre ölçeğinde en az bir boyuta sahip, ısmarlama bir minyatür kanallar ağı içindeki küçük hacimli sıvıları düzenler ve biyolojik araştırmalarda kullanımları20 genişlemektedir. Özellikle, filamentli mantarların büyümesini incelemek için mikroakışkan cihazlar geliştirilmiştir 21,22,23,24,25,26,27,28,29,30. Bu teknolojiyi kullanmanın bir yararı, hifaların hapsedilmesi ve besin maddelerinin mikro kanallar içindeki dağılımının, toprak ortamının yapısına geleneksel agar yöntemlerinden daha çok benzemesidir31. Son zamanlarda, insan nötrofiller ve mantar patojenleri 32, bakteri ve bitki kökleri33, mantarlar ve nematodlar34,35 arasındaki etkileşimleri araştırmak için mikroakışkan platformlar kullanılmıştır.
Mikrobiyal etkileşimleri incelemek için mikroakışkanlar kullanmanın birçok avantajından biri, mikrokanal ortamının spesifik kontrolünü içerir. Örneğin, laminer akış rejimleri, bakteriyel kemotaksis36'yı incelerken özellikle yararlı olan tanımlanmış konsantrasyon gradyanları üretmek için kullanılabilir. Diğer bir avantaj, mikroakışkan cihazların üretiminde yaygın olarak kullanılan ucuz, biyouyumlu bir elastomerik polimer olan poli (dimetilsiloksan) (PDMS) şeffaf doğasının, parlak alan ve floresan mikroskobu kullanılarak tek hücrelerin yüksek çözünürlüklü görüntülenmesini kolaylaştırmasıdır37. Benzer şekilde, mikropların mikrokanallar içinde hapsedilmesi, tek hücreleri izleyen hızlandırılmış deneylerin yapılabileceği anlamına gelir ve bireysel hücresel tepkilerin kaydedilmesine ve nicelleştirilmesine izin verir37. Son olarak, mikroakışkan cihazlar kullanıcı dostu olacak şekilde tasarlanabildiğinden, uzman olmayanlar tarafından kolayca kullanılabilirler38.
Toprakta yaşayan mikroorganizmalar arasındaki etkileşimler hakkında daha fazla bilgi sahibi olmak, biyolojik çeşitliliği koruyan sürdürülebilir ekosistem yönetimi uygulamalarını geliştirmek ve iklim değişikliğinin karasal ortamlar üzerindeki etkisini azaltmak için önemlidir39. Bu nedenle, yeni mikroakışkan araçların geliştirilmesi, mantarların ve hücresel düzeydeki etkileşimlerinin anlaşılmasını genişletmek için esastır. Buradaki protokol, Şekil 1'de gösterildiği gibi BFIs40 ve FFI41'in çalışması için üretilen iki mikroakışkan cihaza odaklanacaktır.

Şekil 1: Bakteriyel-fungal etkileşim (BFI) ve mantar-fungal etkileşim (FFI) cihazlarının görsel ve şematik gösterimi. (A) BFI cihazının görüntüsü. Hifal büyümesinin cihaza girmesine izin vermek için mikro kanalların bir ucunun girişine bir misel tıkacı yerleştirilir. Bakteri girişi karşı uçtadır. Ölçek çubuğu = 5 mm. (B) Bakteri girişlerinin konumlandırılmasını ve etkileşim mikrokanalları aracılığıyla hifal büyümesinin yönünü gösteren BFI cihazına şematik genel bakış. Kanallar 10 μm derinliğinde, 100 μm genişliğinde ve 7 mm uzunluğundadır ve toplamda 28 gözlem kanalıdır. (C) Coprinopsis cinerea ve Bacillus subtilis NCIB 3610 arasındaki agar plakası üzerinde yüzleşme testi, ölçek çubuğu = 20 mm (solda). C. cinerea ve B. subtilis NCIB 3610 arasındaki mikrokanal içindeki etkileşimi (orta ve sağ), yani bakterilerin mantar hiflerine polar bağlanmasını gösteren mikroskopi görüntüleri. Ölçek çubuğu = 25 μm (orta) ve 10 μm (sağ). (D) FFI cihazının cam tabanlı bir Petri kabına bağlanmış, misel tıkaçları ile çift aşılanmış görüntüsü. Ölçek çubuğu = 1 cm. (E) FFI cihazına şematik genel bakış. Cihazın her iki ucundaki girişlere iki mantar aşılayıcı tıkaç sokulur ve mikrokanalların hifal keşfine izin verilir. Kontrol kanalları sadece bir mantar girişine bağlanır ve test mantarları arasındaki etkileşimleri önleyen bir çıkmaz kanala sahiptir. Etkileşim kanalları hem mantar girişlerini birbirine bağlar hem de mikrokanal içindeki test denekleri arasında hifal etkileşimlerine izin verir. Her etkileşim kanalı, toplam uzunluğu 8,8 mm (elmas başına 490 x 430 μm), 10 μm derinliğinde ve her elmas arasında 20 μm'lik bir bağlantı bölgesine sahip olan 18 elmas şeklindeki bölümden oluşur. Kanal tipleri çoğaltılır, ölçek çubukları = 1 mm. (F) Birbirine bağlı etkileşim kanalının zıt uçlarından büyüyen, yaklaşan iki hifal cephesi arasındaki etkileşim bölgesi. Faz kontrastlı mikroskopi görüntüsü, ölçek çubuğu = 250 μm. Bu şekildeki paneller Stanley ve ark., 2014 (A-C)40 ve Gimeno ve ark., 2021 (D-F)41'den değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protokol
NOT: Bu protokolde özetlenen prosedürlerin bir özeti Şekil 2'de görsel olarak gösterilmiştir.
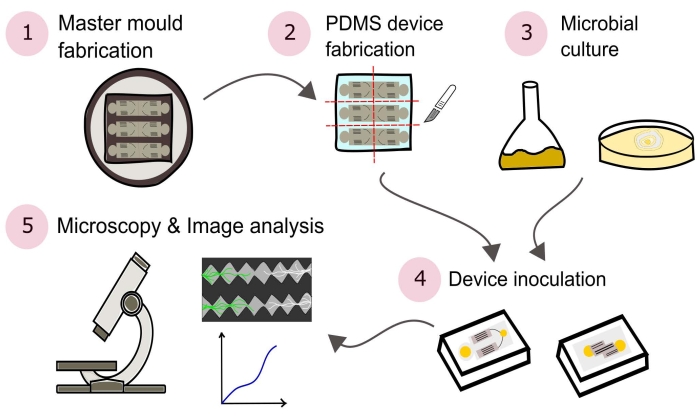
Şekil 2: Bu protokolde ayrıntılı olarak açıklanan beş ana bölümden oluşan sunulan metodolojinin şematik gösterimi. Cihaz tasarımları bilgisayar destekli tasarım (CAD) yazılımı ve fotolitografi kullanılarak üretilen bir ana kalıp kullanılarak oluşturulur (1). Bu, poli (dimetilsiloksan) (PDMS) dökmek için kullanılır, daha sonra plakalara doğranır ve mikroakışkan cihazları oluşturmak için cam tabanlı Petri kaplarına bağlanır (2). Çalışmaya dahil edilecek mikroplar kültüre alınır (3) ve cihazların aşılanmasında kullanılır (4). Etkileşimler mikroskopi kullanılarak incelenir ve görüntü analiz teknikleri kullanılarak nicelleştirilir (5). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
1. Ana kalıp imalatı
- Fotomaske üretimi
- Bilgisayar destekli tasarım (CAD) yazılımını kullanarak mikroakışkan cihaz tasarımları oluşturun. Sunulan cihazların boyutları Şekil 1'de verilmiştir ve spesifik tasarım özellikleri hakkında daha fazla ayrıntı ilgili yayınlarda kapsamlı bir şekilde listelenmiştir40,41.
- CAD tasarım dosyasını uygun bir format (ör. .dwg, .dxf) kullanarak dışa aktarın. Dışa aktarılan CAD tasarım dosyasını baskı için ticari bir sağlayıcıya göndererek bir film fotolitografi maskesi yazdırın.
- Fotolitografi
NOT: Aşağıdaki adımlar, laminer davlumbaz veya temiz oda tesisi gibi tozsuz ve ışık kontrollü bir ortamda gerçekleştirilmelidir. Burada sağlanan deneysel koşullar bir rehber olarak verilmiştir ve şirket içinde optimize edilmelidir. Yazarlar, belirli bir eğitim ve danışmanlık yapılmasını önermektedir42.- 200 °C'de fırında 2 saat pişirerek 100 mm'lik silikon gofret hazırlayın. Silikon gofreti SU-8 2010 fotorezistli spin-co, 10 μm'lik bir hedef kalınlığı hedefleyerek, aşağıdaki koşulları kullanın: 10 s için 500 rpm (hızlanma 100 rpm/s) ve 45 s için 3.000 rpm (hızlanma 300 rpm/s).
DİKKAT: SU-8 fotodirenç tehlikelidir, kullanırken dikkatli olun ve cildin solunmasını ve temasını önleyin. Yanıcı, potansiyel olarak kanserojen ve çevre için toksiktir. - Kaplanmış silikon gofreti 95 °C'de 2,5 dakika pişirin (yumuşak fırında pişirin). Film fotolitografi maskesini ve bir maske hizalayıcısı kullanarak 365 nm dalga boyunda 140 mJ /cm2'lik bir enerji dozu kullanarak fotodirenci ultraviyole (UV) ışığa maruz bırakın.
- Kaplanmış silikon gofreti 95 °C'de 3,5 dakika pişirin (pozlama sonrası fırınlayın). Silikon gofreti geliştirici çözümüne 3 dakika daldırın ve çalkalayarak maruz kalmamış fotodirenci çıkararak mikrofabrikasyon yapıları ortaya çıkarın.
DİKKAT: Geliştirici çözümü yanıcı olabilir, elleçleme ve depolama sırasında uygun önlemleri alın. - 10 saniye boyunca taze geliştirici çözümü ile durulayın. 10 s boyunca izopropil alkol ile durulayın ve hava ile kurutun. Yapıların tamamen kuru olduğundan emin olmak için filtrelenmiş, basınçlı hava kullanın. SU-8 yapılarının yüksekliğini, örneğin bir profilometre kullanarak ölçün.
- Her ana kalıbı 2 saat boyunca 50 mbar'lık bir vakum basıncı uygulayarak 50 μL klorotrimetilsilan ile silanize edin. Yazarlar, ana kalıbın yeniden silanizasyonunun gerekli bulunmadığını belirtmektedir.
DİKKAT: Klootrimetilsilan tehlikeli bir maddedir. Uygun kişisel koruyucu ekipman (KKD) giyin ve dikkatli kullanın. Cilt ve gözlerle temastan kaçının ve solunmasını önleyin. Ateşleme kaynaklarından uzak tutun ve iyi havalandırılan bir alanda kullanın.
- 200 °C'de fırında 2 saat pişirerek 100 mm'lik silikon gofret hazırlayın. Silikon gofreti SU-8 2010 fotorezistli spin-co, 10 μm'lik bir hedef kalınlığı hedefleyerek, aşağıdaki koşulları kullanın: 10 s için 500 rpm (hızlanma 100 rpm/s) ve 45 s için 3.000 rpm (hızlanma 300 rpm/s).
2. Cihaz imalatı
NOT: Aşağıdaki adımlar, laminer akış davlumbaz gibi tozsuz bir ortamda gerçekleştirilmelidir.
- Poli(dimetilsiloksan) (PDMS) plakaların hazırlanması
- Temiz bir plastik kapta bir spatula kullanarak baz ve kürleme maddesini 10: 1 oranında iyice karıştırarak yaklaşık 40 g PDMS hazırlayın. PDMS'yi içeren plastik kabı 1 saat boyunca bir vakum odasına (vakum basıncı = 50 mbar) yerleştirerek tüm hava kabarcıklarını gidermek için karışımın gazını çözün.
- Ana kalıbı şeffaf bant kullanarak plastik bir montaja sabitleyin. Toz parçacıklarını temizlemek için basınçlı filtrelenmiş hava kullanarak temizleyin.
NOT: Alternatif olarak, alüminyum folyo bir cam Petri kabının etrafında şekillendirilebilir ve daha sonra ana kalıbı barındırmak ve PDMS43'ü içermek için kullanılabilir. - PDMS karışımını ana kalıbın ortasına dökün, düz bir yüzeyde olduğundan emin olun ve yerleşmesine izin verin.
NOT: PDMS karışımı, ana kalıbın yüzeyine mümkün olduğunca yakın dökülmeli ve hava kabarcıklarının girmesini en aza indirmek için sürekli bir akış korunmalıdır. Hava kabarcıkları, basınçlı havayı kabarcık üzerine yönlendirerek veya ince bir iğne kullanılarak çıkarılarak çıkarılabilir. - Toz parçacıklarının PDMS yüzeyine yerleşmesini önlemek için ana kalıbı plastik bir kapakla gevşek bir şekilde örtün. Ana kalıbı bir fırına aktarın ve gece boyunca 70 ° C'de kürleyin.
- Ana kalıbı fırından çıkarın ve soğumaya bırakın. Kürlenmiş PDMS'yi ana kalıptan ve plastik çerçeveden soyun, ana kalıbın/PDMS'nin zarar görmemesine dikkat edin.
- Tozsuz bir yüzey sağlamak için PDMS'ye kabartılmış mikro kanalların üzerine şeffaf bant yerleştirin. Yapıştırmadan önce bandın çıkarıldığından emin olun.
- PDMS'yi, monte edilmiş bir giyotin veya tıraş bıçağı kullanarak tasarımda belirtildiği gibi plakalar halinde kesin (yani, ana kalıptaki tasarıma birden fazla cihaz dahil edilmişse, birçoğu tek bir dökümden imal edilebilir). BFI PDMS levhanın yanal açıklığını keserken, mikro kanalların tamamen açık olduğundan emin olun (Şekil 1A). FFI PDMS levha için, her köşenin Şekil 1D'de gösterilen cam tabanlı Petri kabına sığmasını sağlamak için kesildiğinden emin olun.
- Cihaz tasarımına göre istenilen giriş/çıkış deliklerini delin. Örnek BFI ve FFI cihazları için sırasıyla 3,18 mm ve 4,75 mm'lik giriş deliklerini delmek için hassas bir kesici kullanın.
- Cihaz oluşturmak için PDMS plakalarının yapıştırılması
NOT: Aşağıdaki yıkama adımları (2.2.1-2.2.2), 37 kHz'de arıtılmış su (ddH2O) ile doldurulmuş bir ultrasonik temizleyici kullanır. PDMS plakalarının yıkanması, başarılı yapıştırma44'ün geliştirilmesine ve kontaminasyon riskinin azaltılmasına yardımcı olur. PDMS plakalarını manipüle etmek için temiz forseps kullanın ve mikro kanalların veya cihaz yüzeyinin zarar görmesini önlemek için giriş deliklerini kullanarak kaldırın.- PDMS plakalarını 0,5 M NaOH'ye batırın ve 5 dakika boyunca sonikleştirin. Steril ddH2O ile durulayın PDMS plakalarını% 70 etanol çözeltisine aktarın ve 5 dakika boyunca sonikatın. Steril ddH20 ile durulayın.
- PDMS plakalarını steril ddH2O içine daldırın ve 5 dakika boyunca sonikleştirin. PDMS plakalarını steril ddH2O'dan çıkarın, filtrelenmiş basınçlı hava kullanarak kurutun ve steril kare Petri kabına yerleştirin.
- PDMS plakalarını içeren kare Petri kabını, 1 saat kuruması için 70 ° C'de bir fırına yerleştirin. Fırından çıkarın ve tozsuz bir ortamda soğumaya bırakın. PDMS plakaların yüzeyindeki tozları bant ve/veya filtrelenmiş basınçlı hava kullanarak temizleyin.
- PDMS plakalarının ve cam tabanlı Petri kaplarının yüzeylerini aşağıdaki ayarlarla bir plazma temizleyici kullanılarak bağlanacak şekilde etkinleştirin: vakum basıncı 0,75 mbar, güç% 50, kaplama süresi 1 dakika. Aktive edilecek (ve daha sonra bağlanacak) yüzeyleri plazma temizleyiciye yukarı bakacak şekilde yerleştirin.
- PDMS plakalarını ve cam tabanlı Petri kaplarını plazma temizleyiciden çıkarın ve aktif yüzeyleri nazikçe birbirleriyle konformal temasa geçirerek bağlayın. BFI ve FFI PDMS plakalarını sırasıyla 35 mm ve 50 mm çaplı cam tabanlı Petri tabaklarına (cam kalınlığı 0,17 mm) bağlayın.
NOT: Yapıştırma sırasında çok fazla basınç uygulamamaya dikkat edin, çünkü bu mikrokanalların çökmesine neden olabilir. - PDMS levhayı cam tabanlı Petri kabından cımbızla çekmeye çalışarak başarılı bir yapıştırma olup olmadığını kontrol edin. Aşılama girişlerinin veya mikrokanallarının çökmemesini sağlamak için cihazları gözle veya jenerik mikroskopi kullanarak görselleştirin.
NOT: Doymuş koşullar (yani, suya doymuş ve/veya besin açısından zengin koşullar) için, protokolün 2.2.7 adımını ekleyin. Suya doymamış koşullar gerekiyorsa, adım 2.2.8'e geçin. Cihazlar su veya medya ile doldurulabilir. - Yapıştırmadan hemen sonra, FFI cihazı için BFI cihazı için istenen çözeltinin 100 μL'sini (bakteriyel giriş ve yanal açıklık) veya 30 μL ortamını FFI cihazı için her girişe (toplam 60 μL) pipetleyerek cihazları doldurun. Hava kabarcıkları varsa, PDMS gözenekli olduğu için bunlar doldurduktan yaklaşık 10 dakika sonra dağılacaktır.
- Nemi korumak için Petri kabına steril ddH2O (~100-200 μL) ekleyin.
3. Mikrobiyal kültür
NOT: Aşağıdaki adımlar, mantar ve bakteri kültürü için genel bir mikrobiyolojik prosedür sağlar ve istenen mikroplar için gerekli olan muhafaza seviyesine uygun steril koşullar altında (yani, bir alev veya mikrobiyolojik güvenlik kabini kullanılarak) gerçekleştirilmelidir. İlgilenilen bir tür için her bölümün sonunda özel örnekler verilmiştir.
- Mantar kültürü
- Agar ile desteklenmiş istenen kültür ortamını hazırlayın. Ortamı 15 dakika boyunca 121 °C'de otoklav yapın. Ortamın 50 ° C'ye soğumasını bekleyin ve steril koşulları koruyarak 9 cm çapında Petri kaplarına dökün.
- İzolatı aktive etmek için istenen mantar suşunun buzdolabı stok kolonisinden miselyum içeren 4 mm çapında bir agar tapasını çıkarmak için bir mantar delici kullanın. Bu, cihaz aşılamasından önce mantarın standartlaştırılmış ve kuvvetli büyümesini sağlamak için yapılır.
NOT: Mikroplar ayrıca bir gliserol stoğundan, yani -70 ° C41'de% 50 gliserol çözeltisinde agar tıkaçlarında depolanan mantar izolatlarından da aktive edilebilir. - Tıpanın kenarını miselyumla birlikte, aşılanmamış Petri kabının ortasına agar yüzeyi ile temas edecek şekilde yerleştirin. Petri kabının üstündeki kapağı değiştirin ve istenen gerinim için uygun sıcaklıkta, tipik olarak yaklaşık 3 ila 4 gün boyunca gerekli miktarda inkübe etmeden önce kapatın.
NOT: Trichoderma rossicum için örnek kültür koşulları: Malt özü agar, karanlıkta 25 ° C'de 48 saat boyunca inkübe edilir.
- Bakteri kültürü
- Tek bakteri kolonileri elde etmek ve kontaminasyon olmadığından emin olmak için kaynak stoktan istenen bakteri izolatını (örneğin, gliserol stoğu veya agar plakasından tek koloni) bir agar plakasına serin45. Plakayı filmle kapatın.
- Bireysel koloniler gözlenene kadar ilginin izolatına özgü bir sıcaklıkta ve sürede inkübe edin.
- İstenilen kültür suyunu hazırlayın. Örneğin, B. subtilis kültürü için LB ortamı hazırlamak için 1 L ddH2O başına 10 g tripton, 10 g NaCl ve 5 g maya ekstresi ekleyin. Ortamı 15 dakika boyunca 121 °C'de otoklav yapın.
- Ortamın oda sıcaklığına soğumasını bekleyin. Ortamı steril bir ortamın içindeki steril bir kültür şişesine ekleyin.
- Steril bir aşılama döngüsü kullanarak agar plakasından tek bir bakteri kolonisine dokunun. Aşılanmış ilmeği, sıvıya ilmek ile kısaca dokunarak steril kültür ortamına aktarın.
- Şişeyi steril bir kapak veya folyo kullanarak kapatın ve seçilen türler için uygun ayarları kullanarak gece boyunca titreyen bir inkübatörün içine yerleştirin.
NOT: B. subtilis için örnek kültür koşulları: i) sıvı kültür - LB ortamında 200 rpm'de 37 °C'de aerobik büyüme ve ii) plaka kültürü - LB agar plakasında oda sıcaklığı. Farklı mantar suşlarının kültürlenmesi hakkında daha fazla bilgi için FFI / BFI kağıtları 40,41'e bakın.
4. Cihaz aşılama
NOT: Aşağıdaki adımlar, steril ekipman kullanılarak laminer bir davlumbazın içinde gerçekleştirilmelidir.
- Mantar aşılama
- 3 günlük bir kültürün çevresindeki koloniden bir agar tıkacı çıkarmak için sterilize edilmiş bir mantar delici (ø = 4 mm) kullanın (adım 3.1). Büyüyen hifal cephesinin sağlam kalmasını sağlayın.
- Fişi mantar girişine, miselyum tarafına aşağıya, kanalların hifal infiltrasyonunu teşvik etmek için hifal cephesinin büyüme yönü mikrokanal açıklıklarına doğru yönlendirilmiş olarak yerleştirin.
- İkinci mantar türleri için 4.1.1-4.1.2 arasındaki adımları tekrarlayın (FFI cihazı kullanılıyorsa), fişi karşı girişe sokun. BFI aygıtını kullanıyorsanız, bu adımı atlayın ve adım 4.1.4'e geçin.
- Petri kabını şeffaf filmle kapatın ve görüntüleme başlayana kadar karanlıkta 25-28 ° C'de inkübe edin. Gözlemlenecek amaçlanan biyolojik olaya, örneğin mantar-mantar çatışmalarına ve cihaza dahil edilen türlerin büyüme hızına bağlı olarak görüntüleme öncesi inkübasyon süresini belirleyin.
- Bakteriyel aşılama
- Bakterileri bir geceleme kültüründen (adım 3.2), adım 3.2.3'te ayrıntılı olarak açıklandığı gibi aynı kültür ortamını kullanarak 1:25 oranında seyreltin. 37 °C'de 3 saat kültür.
- 10 dakika boyunca 2000 x g'de bir santrifüj kullanarak kültürü peletleyerek bakterileri yıkayın. Süpernatantı atın ve hücreleri, sodyum klorür çözeltisi ile% 0.9'luk istenen hacimde yeniden askıya alın.
- Bir pelet elde etmek için tekrar santrifüj. Süpernatantı atın ve hücreleri sıvı ortamda yeniden askıya alın (örneğin; C. cinerea minimal ortamdan OD600/1'e kadar). Söz konusu bakteri suşu için OD600 değerini optimize edin.
- BFI cihazını inkübatörden çıkarın ve steril bir ortamda açın. Pipet bakteri girişine 10 μL süspansiyon sağlar.
NOT: Söz konusu bakteriyel-fungal etkileşimler için tam aşılama zamanlamalarını optimize edin. Örneğin, C. cinerea kullanıyorsanız, mantar aşılamasından 18 saat sonra BFI cihazına bakteri sürün. - Petri kabını şeffaf bir filmle kapatın ve görüntüleme başlayana kadar karanlıkta 25 ° C'de inkübe edin. Cihazı dik olarak saklayın.
5. Mikroskopi ve görüntü analizi
- Mikroskopi
NOT: Araştırmacı, yapılacak deneyin doğasına uygun uygun görüntüleme yöntemini, örneğin ters çevrilmiş geniş alan epifloresansı veya konfokal mikroskopiyi seçmelidir. Burada genel bir genel bakış sağlanmıştır, çünkü belirli detaylar seçilen mikroskopi kurulumunun özelliklerine bağlı olacaktır.- Mikroskop bilgisayarını, mikroskop ana gövdesini (varsa), kamerayı, sıcaklık kontrollü inkübatörü ve ışık kaynağını (kaynaklarını) açın. Mikroskopun doğru şekilde kurulduğundan emin olun, örneğin, numunenin eşit aydınlatılması için Köhler aydınlatması doğru şekilde uygulanmıştır. Görüntüleme yazılım paketini başlatın.
NOT: Sıcaklık kontrollü bir inkübatör kullanırken, bir deneye başlamadan önce mikroskop sıcaklığının birkaç saat boyunca dengelenmesine izin vermek önemlidir. - Mikroakışkan cihazı sahne alanına takın. Aktif sahne hareketi sırasında cihazın yerinden çıkmasını önlemek için cihazın iyi bir şekilde sabitlendiğinden, yani bantla sabitlendiğinden emin olun.
- Aşılanmış cihazların görüntülerini, örneğin tek noktalı veya hızlandırılmış deneyler elde edin. BFI ve FFI cihazları ile yapılan deneylerle ilgili kapsamlı görüntüleme özellikleri yukarıda belirtilen yayınlarda40,41 olarak verilmiştir.
NOT: Brightfield görüntüleri, otomatik odaklama yazılımı ve 10x büyütme, 0.30 NA (sayısal diyafram) veya 20x büyütme, 0.45 NA objektif lensler kullanılarak büyüme kanallarından hifal proliferasyonunu görselleştirmek için faz kontrast mikroskobu kullanılarak elde edilmiştir. Floresan muhabir proteinlerinin uyarılması, florofora özgü dalga boylarına sahip yüksek güçlü ışık yayan diyot ışık motoru kullanılarak elde edildi. - Görüntüleri sonraki görüntü işleme için uygun bir formatta dışa aktarın. Örneğin, .tiff.
- Mikroskop bilgisayarını, mikroskop ana gövdesini (varsa), kamerayı, sıcaklık kontrollü inkübatörü ve ışık kaynağını (kaynaklarını) açın. Mikroskopun doğru şekilde kurulduğundan emin olun, örneğin, numunenin eşit aydınlatılması için Köhler aydınlatması doğru şekilde uygulanmıştır. Görüntüleme yazılım paketini başlatın.
- Görüntü analizi
NOT: Yazarlar Fiji'yi önermektedir46 görüntü analizi için bir araç olarak, ancak diğer yazılım paketleri mevcuttur. Aşağıdakiler, sunulan BFI ve FFI cihaz yayınlarından Fiji kullanılarak yapılan görüntü analizlerine örneklerdir. Bu adımlar Mac'e özgüdür ve PC kullanıyorsanız biraz farklılık gösterebilir.- Hifal büyüme hızı ölçümleri
NOT: Bu yöntem, BFI makalesi40'ta bireysel hifaların büyüme oranlarını ölçmek için kullanılmıştır.- Fiji'yi indirin, kurun ve başlatın. Dosya > > Görüntü Dizisini İçe Aktar'ı seçerek hızlandırılmış bir denemeden görüntü dizisini içe aktarın. Verilerin depolandığı klasörü bulun ve Aç'ı seçin. Sıra Seçenekleri penceresinde, Tercihler'i ve ardından Tamam'ı seçin.
- Ana araç çubuğundan Düz Çizgi simgesini seçin. Düz çizginin başlangıcını, büyüyen hifal ucunun ucuna tıklayarak ve ardından imleci penceredeki başka bir noktaya sürükleyerek konumlandırın. Çizginin başlangıcını, orta noktasını ve sonunu gösteren üç kutu içeren sarı bir çizgi görünür.
- Ctrl tuşunu basılı tutarak görüntü dizisindeki bir sonraki kareye geçin ve >. Kare kutuyu seçip doğru konuma sürükleyerek düz çizginin ucunu büyüyen hifanın ucuna yerleştirin.
- Çizginin uzunluğunu piksel cinsinden ölçmek için Ctrl ve M tuşlarını basılı tutun. Ölçülen verileri içeren bir Sonuçlar penceresi görünecektir. Sonuçlar penceresinde görüntülenen verileri aşağıdaki gibi tanımlayın: Sonuçlar penceresine tıklayın ve ardından Sonuçlar'ı seçin > Ölçümleri Ayarla'yı seçin.
- Ctrl tuşunu basılı tutarak görüntü dizisindeki bir sonraki kareye geçin ve ardından >. Kare kutuyu seçip doğru konuma sürükleyerek düz çizginin başlangıcını büyüyen hifanın ucuna yerleştirin.
- Çizginin uzunluğunu piksel cinsinden ölçmek için Ctrl ve ardından M tuşunu basılı tutun. Ölçülen verileri içeren bir Sonuçlar penceresi görünecektir.
- Hifanın piksel cinsinden büyümesini ölçmeyi bitirene kadar 5.2.1.5-5.2.1.6 arasındaki adımları tekrarlayın.
- Sonuçlar penceresinde tüm verileri seçin. Verileri işlemek için başka bir yazılım programına, örneğin bir elektronik tabloya kopyalayıp yapıştırın. Hifal büyümesini (piksel veya mikrometre cinsinden) zamanın bir fonksiyonu olarak çizin ve ortalama büyüme oranlarını hesaplayın. Deney başına en az üç biyolojik replikasyon gerçekleştirin.
- Floresan yoğunluk ölçümleri
NOT: Bu yöntem, FFI yayını41'de, zamanın bir fonksiyonu olarak Clonostachys rosea 016 ile temas ettiğinde Fusarium graminearum 8/1-wt-GFP'nin hifasındaki floresan yoğunluğundaki değişimi değerlendirmek için kullanılmıştır.- Fiji'yi indirin, kurun ve başlatın. Dosya > > Görüntü Dizisini İçe Aktar'ı seçerek hızlandırılmış denemeden görüntü dizisini içe aktarın. Verilerin depolandığı klasörü bulun ve Aç'ı seçin. Sıra Seçenekleri penceresinde Tercihler'i ve ardından Tamam'ı seçin.
- Ana araç çubuğunda bulunan dikdörtgen aleti kullanarak bir hifanın mutlak floresan yoğunluğunu ölçmek için bir ilgi bölgesi (ROI) belirtin. Meydanın boyutu tam olarak şu şekilde tanımlanabilir: > Seçimi Düzenle > Belirtin; YG, YG Yöneticisi'nde gelecekte başvurmak üzere > Seçimini Düzenle > Yöneticiye Ekle seçilerek de kaydedilebilir.
- Tüm görüntü dizisindeki veya yığınındaki her görüntü için tanımlanan YG içindeki mutlak floresan yoğunluğunu (ortalama gri değer) aşağıdaki gibi ölçün: Görüntü > Yığınları > Yığını Ölçün. Sonuçlar penceresi, yığındaki tüm görüntüler işlendikten sonra otomatik olarak açılır.
NOT: Sonuçlar penceresinde görüntülenen veriler aşağıdaki gibi tanımlanabilir: Sonuçlar penceresine tıklayın ve ardından Sonuçlar > Ölçümleri Ayarla'yı seçin. Ortalama Gri Değer'in seçildiğinden emin olun. - Sonuçlar penceresinde tüm verileri seçin. Belirtilen yatırım getirisinin mutlak floresan yoğunluklarını zamanın bir fonksiyonu olarak çizmek için başka bir yazılım programına, örneğin bir elektronik tabloya kopyalayıp yapıştırın.
- Her ROI için mutlak floresan yoğunluğu ölçümlerini toplamak için 5.2.2.2-5.2.2.4 adımlarını tekrarlayın, yani ilgilenilen hifada, ilgilenilen hifanın yanında veya ilgili kontrol kanalı içinde.
- Keyfi birimlerde (AU) uygun nispi floresan yoğunluklarını hesaplayın, örneğin, ROI'nin [ilgilenilen hifa] mutlak floresan yoğunluğunu, ROI'nin [kontrol kanalı] mutlak floresan yoğunluğuna bölerek. Daha ayrıntılı bilgi için FFI yayını41'e bakın.
- Deney başına en az üç biyolojik replikasyon gerçekleştirin ve zamanın bir fonksiyonu olarak göreceli floresan yoğunluklarını çizin.
- Hifal büyüme hızı ölçümleri
Sonuçlar
Örnek BFI40 ve FFI41 cihazlarından temsili sonuçlar sunulmuştur. Hifal büyüme hızı ölçümleri, temel mikroskopi teknikleri ile birlikte bu cihazlar kullanılarak kolayca elde edilebilir. Şekil 3A-B, C. CINEREA HYPHAE ve B. subtilis NCIB 3610 arasındaki bakteriyel-fungal etkileşimleri göstermektedir. B. subtilis varlığı, ko-aşılamadan yaklaşık 5 saat sonra C. c...
Tartışmalar
Bu makalede, kanal mikroakışkanları kullanılarak mantar-mikrobiyal etkileşimlerin incelenmesi için bir protokol sunulmaktadır. Yazarlar, bu cihazların çok yönlülüğünü göstermeyi ve araştırmacının ilgi alanlarına uyacak şekilde adaptasyonu teşvik etmeyi amaçlamaktadır. Örnek BFI ve FFI cihazları kullanılarak, mantar-mikrobiyal etkileşimler daha önce erişilenden daha ayrıntılı olarak incelenebilir. Toprağın arka plan karmaşıklığını ve heterojenliğini ortadan kaldırarak, hiflerin ...
Açıklamalar
Yazarlar rakip çıkarlar olmadığını beyan ederler.
Teşekkürler
Imperial College London Biyomühendislik Bölümü ve The Leverhulme Trust'ın (Araştırma Hibe Referansı: RPG-2020-352) finansal desteğini kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agar | Difco Laboratories | 214010 | Used to solidify culture medium for bacterial and fungal cultivation within Petri dishes |
| Aluminum foil | Fisher Scientific Ltd | 11759408 | |
| AutoCAD 2021 | Autodesk, USA | ||
| Autoclave (VX-75) | Systec | ||
| Centrifuge (5810R) | Eppendorf | ||
| Chlorotrimethysilane | Merck Life Sciences | 386529 | CAUTION: Chlorotrimethylsilane is a hazardous substance. Wear appropriate PPE and handle with care. Avoid contact with skin and eyes and prevent inhalation. Keep away from sources of ignition and use in a well-ventilated area. |
| Cork borer | SLS | COR1000 | |
| Developer solution (mr-Dev 600) | Microresist Technologies | CAUTION: mr-Dev 600 developer solution is flammable | |
| Erlenmeyer flasks | VWR | 214-1108 | e.g. 200 mL; choose size to suit your exact needs |
| Ethanol (70% v/v) | Fisher Scientific Ltd | E/0650DF/15 | Diluted from 99.8% (Analytical Reagent Grade) |
| Fiji | ImageJ | Exemplar software package for imaging processing | |
| Filtered, compressed air | Available as standard in most labs. Altervatively, an oil-free compressor with air regulator can be used. | ||
| Flat-headed wafer tweezers | SLS | INS5026 | |
| Forceps | Fisher Scientific Ltd | 10008051 | Bent, sharp |
| Glass bottom petri dish | World Precision Instruments | FD35-100 | 35 mm |
| Glass bottom petri dish | World Precision Instruments | FD5040-100 | 50 mm |
| Glass crystallisation dishes | VWR | 216-1865 | Used for washing of PDMS slabs |
| Glass crystallisation dishes | VWR | 216-1866 | Used in the development of master moulds |
| Glass media bottles | Fisher Scientific Ltd | 15456113 | e.g. 250 mL; choose size to suit your exact needs |
| Glass syringe (Hamilton) | Fisher Scientific Ltd | 10625251 | Used for dispensing chlorotrimethylsilane |
| Hot plate (HP 160 III BM) | SAWATEC | ||
| Inoculation loop | VWR | COPA175CS01 | |
| Isopropyl alcohol | Sigma-Aldrich | W292907 | |
| Laminar flow hood | Air Science (PCR) | Exemplar laminar flow hood used for device fabrication | |
| LB medium | Fisher Scientific Ltd | BP9723-500 | Exemplar nutrient broth for bacterial overnight culture |
| Light emitting diode light engine (LedHUB) | Omicron-Laserage Laserprodukte GmbH | Exemplar light source that can be used for imaging fungal-microbial interactions (fluorescence) | |
| MA6 Ultraviolet mask aligner | Suss Microtec | ||
| Malt extract | VWR | 84618 | Used to make exemplar fungal culture medium (Malt extract agar) |
| Mask Writer | Applied Materials | 4700DP | Example of a mask writer which can be used to print photo-mask for photolithography |
| Master mould plastic mount | 3D-printed bespoke holder manufactured in-house | ||
| Microbiological safety cabinet (BioMat2) | Contained Air Solutions | Exemplar MSC used for microbial culture and device inoculation | |
| Milli-Q purified water | Available as standard in biology labs. | ||
| NaOH | Fisher Scientific Ltd | BP359-500 | |
| NIS-Elements Advanced Research imaging software | Nikon | Exemplar software package for image acquisition | |
| NIS-Elements Free Viewer | Nikon | Exemplar software package for viewing acquired images | |
| Oven (Binder BD115) | Fisher Scientific Ltd | 15602126 | Used for curing poly(dimethylsiloxane)(PDMS) |
| Oven (CLO-2AH-S) | KOYO | Used for preparing silicon wafers | |
| Parafilm | Bemis | HS234526B | transparent film |
| Petri dishes, square sterile | Fisher Scientific Ltd | 11708573 | 120.5 mm |
| Petri dishes, sterile | Fisher Scientific Ltd | 15370366 | 90 mm |
| Photolithography mask | Micro Lithography Services Ltd. UK | ||
| Plasma cleaner (Zepto) | Diener Electronic | 100012601 | |
| Plastic cup | Semadeni | 8323 | |
| Plastic spatula | Semadeni | 3340 | |
| Portable precision balance (OHAUS Scout) | Fisher Scientific Ltd | 15519631 | Used for weighing PDMS, media components etc. |
| Precision cutter | Syneo | HS1251135P1183 | Cutting edge diameter: 3.18 mm |
| Precision cutter | Syneo | HS1871730P1183S | Cutting edge diameter: 4.75 mm |
| Profilometer | Bruker | Dektak XT-stylus | |
| Razor blades | Häberle Labortechnik | 9156110 | |
| Refridgerator | Haden | 4-6 °C | |
| Retiga R1 CCD camera | Qimaging | Exemplar camera that can be used for imaging fungal-microbial interactions | |
| Scotch magic tape | Office Depot | 3969954 | 19 mm invisible tape; clear tape |
| Shaking incubator (Cole-Parmer SI500) | Fisher Scientific Ltd | 10257954 | |
| Silicon wafer | Inseto | 100 mm | |
| Soda lime glass plate | Inseto | 125 mm x 125 mm x 2 mm. Used to hold photolithography mask in mask aligner | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Spincoater | SAWATEC | SM-180-BM | |
| SU-8 2010 photoresist | MicroChem | CAUTION: SU-8 photoresist is hazardous, take care when handling and prevent inhalation and contact with skin. Flammable, potentially carcinogenic and toxic to the environment. | |
| Sylgard 184 elastomer kit | VWR | 634165S | Used for the preparation of poly(dimethylsiloxane)(PDMS) devices |
| Temperature controlled incubator | Okolab | Exemplar incubator that can be used for imaging fungal-microbial interactions | |
| Ti2-E inverted epifluorescence microscope | Nikon | MEA54000 | Exemplar microscope that can be used for imaging fungal-microbial interactions |
| Ultrasonic cleaner S-Line | Fisher Scientific Ltd | FB15050 | |
| Vacuum desiccator | Fisher Scientific Ltd | 10528861 | Silianisation and PDMS degassing should be conducted in separate desiccators |
| x10/0.3 NA CFI Plan Fluor DL objective lens | Nikon | MRH20105 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
| x20/0.45 NA CFI Plan Fluor DL objective lens | Nikon | MRH48230 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
Referanslar
- Zhu, Y. -. G., Miller, R. M. Carbon cycling by arbuscular mycorrhizal fungi in soil-plant systems. Trends in Plant Science. 8 (9), 407-409 (2003).
- Dai, Z., et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems. The ISME Journal. 14 (3), 757-770 (2020).
- Op De Beeck, M., et al. Regulation of fungal decomposition at single-cell level. The ISME Journal. 14 (4), 896-905 (2020).
- Bender, S. F., et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal. 8 (6), 1336-1345 (2014).
- Dullah, S., et al. Melanin production and laccase mediated oxidative stress alleviation during fungal-fungal interaction among basidiomycete fungi. IMA Fungus. 12 (1), 33 (2021).
- Deveau, A., et al. Bacterial-fungal interactions: ecology, mechanisms and challenges. FEMS Microbiology Reviews. 42 (3), 335-352 (2018).
- Bian, R., et al. Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences of the United States of America. 117 (7), 3779-3788 (2020).
- Jiang, X., Xiang, M., Liu, X. Nematode-trapping fungi. Microbiology Spectrum. 5 (1), (2017).
- Essig, A., et al. a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry. 289 (50), 34953-34964 (2014).
- Tang, H. -. Y., Zhang, Q., Li, H., Gao, J. -. M. Antimicrobial and allelopathic metabolites produced by Penicillium brasilianum. Natural Product Research. 29 (4), 345-348 (2015).
- Bai, Y. -. B., et al. Antifungal activity of griseofulvin derivatives against phytopathogenic fungi In vitro and In vivo and three-dimensional quantitative structure-activity relationship analysis. Journal of Agricultural and Food Chemistry. 67 (22), 6125-6132 (2019).
- Solanki, M. K., et al. Characterization of antagonistic-potential of two Bacillus strains and their biocontrol activity against Rhizoctonia solani in tomato. Journal of Basic Microbiology. 55 (1), 82-90 (2015).
- Jamali, H., Sharma, A., Srivastava, A. K. Biocontrol potential of Bacillus subtilis RH5 against sheath blight of rice caused by Rhizoctonia solani. Journal of Basic Microbiology. 60 (3), 268-280 (2020).
- Válková, H., Novotný, &. #. 2. 6. 8. ;., Malachová, K., Šlosarčíková, P., Fojtík, J. Effect of bacteria on the degradation ability of Pleurotus ostreatus. Science of The Total Environment. 584-585, 1114-1120 (2017).
- Leyva-Rojas, J. A., Coy-Barrera, E., Hampp, R. Interaction with soil bacteria affects the growth and amino acid content of Piriformospora indica. Molecules. 25 (3), 572 (2020).
- Dullah, S., et al. Fungal interactions induce changes in hyphal morphology and enzyme production. Mycology. 12 (4), 279-295 (2021).
- Marfetán, J. A., Romero, A. I., Folgarait, P. J. Pathogenic interaction between Escovopsis weberi and Leucoagaricus sp.: mechanisms involved and virulence levels. Fungal Ecology. 17, 52-61 (2015).
- Cortois, R., De Deyn, G. B. The curse of the black box. Plant and Soil. 350 (1), 27-33 (2012).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507 (7491), 181-189 (2014).
- Hanson, K. L., et al. Fungi use efficient algorithms for the exploration of microfluidic networks. Small. 2 (10), 1212-1220 (2006).
- Held, M., Edwards, C., Nicolau, D. V. Probing the growth dynamics of Neurospora crassa with microfluidic structures. Fungal Biology. 115 (6), 493-505 (2011).
- Thomson, D. D., et al. Contact-induced apical asymmetry drives the thigmotropic responses of Candida albicans hyphae. Cellular Microbiology. 17 (3), 342-354 (2015).
- Lee, K. K., Labiscsak, L., Ahn, C. H., Hong, C. I. Spiral-based microfluidic device for long-term time course imaging of Neurospora crassa with single nucleus resolution. Fungal Genetics and Biology. 94, 11-14 (2016).
- Asenova, E., Lin, H. Y., Fu, E., Nicolau, D. V., Nicolau, D. V. Optimal fungal space searching algorithms. IEEE Transactions on NanoBioscience. 15 (7), 613-618 (2016).
- Soufan, R., et al. Pore-scale monitoring of the effect of microarchitecture on fungal growth in a two-dimensional soil-like micromodel. Frontiers in Environmental Science. 6, (2018).
- Uehling, J. K., et al. Microfluidics and metabolomics reveal symbiotic bacterial-fungal interactions between Mortierella elongata and Burkholderia include metabolite exchange. Frontiers in Microbiology. 10, 2163 (2019).
- Millet, L. J., et al. Increasing access to microfluidics for studying fungi and other branched biological structures. Fungal Biology and Biotechnology. 6 (8), 1-14 (2019).
- Baranger, C., Fayeulle, A., Le Goff, A. Microfluidic monitoring of the growth of individual hyphae in confined environments. Royal Society Open Science. 7 (8), 191535 (2020).
- Aleklett, K., Ohlsson, P., Bengtsson, M., Hammer, E. C. Fungal foraging behaviour and hyphal space exploration in micro-structured Soil Chips. The ISME Journal. 15 (6), 1782-1793 (2021).
- Aleklett, K., et al. Build your own soil: exploring microfluidics to create microbial habitat structures. The ISME Journal. 12 (2), 312-319 (2018).
- Ellett, F., Jorgensen, J., Frydman, G. H., Jones, C. N., Irimia, D. Neutrophil interactions stimulate evasive hyphal branching by Aspergillus fumigatus. PLOS Pathogens. 13 (1), 1006154 (2017).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Schmieder, S. S., et al. Bidirectional propagation of signals and nutrients in fungal networks via specialized hyphae. Current Biology. 29 (2), 217-228 (2019).
- Tayyrov, A., Stanley, C. E., Azevedo, S., Künzler, M. Combining microfluidics and RNA-sequencing to assess the inducible defensome of a mushroom against nematodes. BMC Genomics. 20 (1), 243 (2019).
- Stanley, C. E., Grossmann, G., Casadevall i Solvas, X., deMello, A. J. Soil-on-a-Chip: microfluidic platforms for environmental organismal studies. Lab on a Chip. 16 (2), 228-241 (2016).
- Stanley, C. E., vander Heijden, M. G. A. Microbiome-on-a-Chip: new frontiers in plant-microbiota research. Trends in Microbiology. 25 (8), 610-613 (2017).
- Ortseifen, V., Viefhues, M., Wobbe, L., Grünberger, A. Microfluidics for biotechnology: bridging gaps to foster microfluidic applications. Frontiers in Bioengineering & Biotechnology. 8, 589074 (2020).
- Jansson, J. K., Hofmockel, K. S. The soil microbiome-from metagenomics to metaphenomics. Current Opinion in Microbiology. 43, 162-168 (2018).
- Stanley, C. E., et al. Probing bacterial-fungal interactions at the single cell level. Integrative Biology (Camb). 6 (10), 935-945 (2014).
- Gimeno, A., et al. A versatile microfluidic platform measures hyphal interactions between Fusarium graminearum and Clonostachys rosea in real-time. Communications Biology. 4 (1), 262 (2021).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Stanley, C. E., et al. Fabrication and use of the dual-flow-RootChip for the imaging of Arabidopsis roots in asymmetric microenvironments. Bio-protocol. 8 (18), 3010 (2018).
- Choi, C. -. H., Lee, H., Weitz, D. A. Rapid patterning of PDMS microfluidic device wettability using syringe-vacuum-induced segmented flow in nonplanar geometry. ACS Applied Materials & Interfaces. 10 (4), 3170-3174 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. (63), e3064 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Harting, R., et al. Pseudomonas strains induce transcriptional and morphological changes and reduce root colonization of Verticillium spp. Frontiers in Microbiology. 12, 652468 (2021).
- Boenisch, M. J. . Structural and molecular characterisation of the penetration process of Fusarium graminearum during Fusarium head blight infection. , (2013).
- Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., von Tiedemann, A. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques. European Journal of Plant Pathology. 118 (3), 259-274 (2007).
- Ghanem, N., Stanley, C. E., Harms, H., Chatzinotas, A., Wick, L. Y. Mycelial effects on phage retention during transport in a microfluidic platform. Environmental Science & Technology. 53 (20), 11755-11763 (2019).
- Alrifaiy, A., Lindahl, O. A., Ramser, K. Polymer-based microfluidic devices for pharmacy, biology and tissue engineering. Polymers. 4 (3), 1349-1398 (2012).
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nature Reviews Molecular Cell Biology. 16 (9), 554-567 (2015).
- Hoelzle, D., et al. Microfluidic device design, fabrication, and testing protocols. Protocol Exchange. , (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır