Method Article
Pnömoni Çözünürlüğünü Değerlendirmek için Deneysel Model
Bu Makalede
Erratum Notice
Özet
Bu el yazması, farelerde enfeksiyöz bir pnömoni modelinin oluşturulmasını ve bakteri yetiştirme ve intratrakeal damlatma yöntemleri ile birlikte yaralanma çözünürlüğünün ilgili karakterizasyonunu açıklamaktadır. Bağışıklık ortamını değerlendirmek için yüksek boyutlu akış sitometrisi kullanan yeni bir yaklaşım da açıklanmaktadır.
Özet
Akut respiratuar distres sendromu (ARDS), hızlı alveoler hasar ve ciddi hipoksemi ile karakterize akut akciğer hasarına neden olur. Bu da yüksek morbidite ve mortaliteye yol açmaktadır. Şu anda, insan ARDS'nin karmaşıklığını özetleyen klinik öncesi modeller yoktur. Bununla birlikte, enfeksiyöz pnömoni modelleri (İİAB) ARDS'nin ana patofizyolojik özelliklerini çoğaltabilir. Burada, C57BL6 farelerinde canlı Streptococcus pneumoniae ve Klebsiella pneumoniae'nin intratrakeal damlatılmasıyla indüklenen bir PNA modelini açıklıyoruz. Modeli değerlendirmek ve karakterize etmek için, yaralanmaya neden olduktan sonra, akciğer hasarı belirteçlerini ölçmek için vücut ağırlığı ve bronkoalveoler lavaj (BAL) seri ölçümleri gerçekleştirdik. Ek olarak, hücre sayımı ve diferansiyelleri, BAL protein miktarı, sitospin, bakteri kolonisi oluşturan birim sayıları ve histoloji için akciğerleri hasat ettik. Son olarak yüksek boyutlu akım sitometrisi yapıldı. Bu modeli, akciğer hasarının erken ve geç çözünürlük aşamalarında bağışıklık ortamını anlamak için bir araç olarak öneriyoruz.
Giriş
Akut solunum sıkıntısı sendromu (ARDS), yoğun bakım ünitesi (YBÜ) hastalarının yaklaşık %10'unu ve mekanik ventilasyon altındaki bireylerin %23'ünü etkileyen ve %35-%46 arasında bir hastane mortalite oranına yol açan yaygın bir ölümcül ve engelleyici sendrom olmaya devam etmektedir1. Ayrıca, son COVID-19 pandemisi, ARDS çalışmasının önemini bir kez daha vurgulamıştır. COVID-19 pozitif vakalar, ARDS mortalitesinde bir artışa neden olmuş ve farmakolojik tedavilerin sınırlılığını vurgulamıştır2.
İnsanlarda ARDS, hızlı başlangıçlı hipoksemi (PaO2 / FiO2 < 300) ve aşırı alveolar-kapiller geçirgenlik ve alveolit3'e bağlı hidrostatik olmayan bilateral pulmoner ödem kanıtı ile karakterizedir. ARDS geleneksel olarak çeşitli hakaretlere sekonder bir akut akciğer hasarı (ALI) paterni olarak tanımlansa da, bakteriyel ve viral pnömoni (PNA) en yaygın nedenler arasında yer almaktadır. Eksüdatif, proliferatif ve fibrotik evreler olmak üzere üç ana patofizyolojik evre tanımlanırken, ARDS'nin iki ana kardinal özelliği düzensiz inflamasyon ve alveolokapiller bozulmadır4. Bu süreçler sırasında, alveolar hasar, enflamatuar sitokinlerin salınmasıyla üretilir (ör., tümör nekroz faktörü [TNF-α], interlökin [IL-1β, IL-6, IL-8, vb.]), nötrofil ve inflamatuar makrofaj akışı ve protein açısından zengin sıvının taşması. Sonuçta, bu olaylar yamalı ve bilateral alveoler hasara yol açar 5,6,7,8.
Erken akciğer hasarı ve inflamasyonunun anlaşılmasında önemli ilerlemeler kaydedilmiş olmasına rağmen, PNA'nın rezolüsyonunun altında yatan mekanizmalar daha az bilinmektedir ve gelecekteki mekanik araştırmaların odak noktası olmalıdır. Bu yöntem makalesinin temel amacı, araştırmacılara ARDS'nin ana patofizyolojik özelliklerini kopyalayabilen bir enfeksiyöz pnömoni yaralanma çözünürlük modeli sunmaktır. Bu modelin, akciğer iltihabı ve onarımının çözümünün altında yatan biyolojik mekanizmaların daha iyi anlaşılmasına yardımcı olacağını ve böylece kurtarma terapötikleri için bir platform görevi göreceğini öneriyoruz.
ARDS sırasında meydana gelen ana fizyopatoloji aşamaları, inflamatuar yanıt, doku hasarı, fizyolojik disfonksiyon, alveolit ve alveolar-kapiller bariyerin değişmesinin histolojik kanıtını içermesi gereken ALI'nin klinik öncesi hayvan modellerinde tekrarlanabilir9. PNA ve ALI'yi indükleyen bir fare modeli, yüksek tekrarlanabilirliği, hızlı üremesi ve mekanik ve moleküler çalışmaları gerçekleştirmek için birden fazla aracın mevcudiyeti nedeniyle avantajlıdır. İnsan ARDS9'un tüm özelliklerini tam olarak özetleyen tek bir model yoktur.
Farelerde PNA modelleri, insanlarda enfeksiyöz ARDS tarafından üretilen hızlı başlangıç, histolojide doku hasarı kanıtı, alveolo-kılcal bariyer bozukluğu, inflamatuar yanıt kanıtı ve fizyolojik işlev bozukluğu gibi temel patofizyolojik mekanizmaların replikasyonuna izin verirken, mütevazı mortalite üretirken10 . Enfeksiyöz modeller, patojenin lokal veya sistemik olarak verilmesiyle indüklenebilir, intranazal, intratrakeal ve intravenöz uygulama en sık uygulama yollarıdır. İntratrakeal yol, enfeksiyöz ajanın akciğerlere doğrudan aşılanmasına izin verir, aerosolizasyonu azaltır ve uygulamayı optimize eder11,12.
Canlı Streptococcus pneumoniae (Spn) veya Klebsiella pneumoniae'nin (Kp) intratrakeal damlatılması ile PNA'nın klinik öncesi bir murin modeli için metodoloji burada açıklanmaktadır. Bu modeller, bakteriyel PNA tarafından üretilen ARDS'nin iyi bir vekilini temsil eder ve aşağıdakiler de dahil olmak üzere çeşitli avantajlara sahiptir: insan PNA-ARDS'nin yaygın nedenleri (toplum ve hastane kaynaklı); yüksek tekrarlanabilirlik; mortalite ve yaralanma, alveolit ve alveolokapiller disfonksiyona yol açan sağlam bir enflamatuar yanıt sergilemek için kolayca titre edilebilir (farklı derecelerde pulmoner inflamasyonun modellenmesi); akciğer hasarının erken ve geç evrelerinin değerlendirilmesi ve çözülmesi; ve PNA-ARDS'nin farklı aşamalarında terapötik stratejilerin değerlendirilmesi.
Protokol
Bu çalışmada açıklanan tüm hayvan protokolleri, hayvan protokolü MO21M160 için Johns Hopkins Üniversitesi Tıp Fakültesi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (ACUC) tarafından onaylanmıştır. Ek olarak, deneyler hayvan araştırmaları için kurumsal, eyalet ve federal düzenlemelere uygun olarak gerçekleştirildi.
DİKKAT: Aşağıda açıklanan tüm protokollerin çoğaltılmasının, biyogüvenlik kabini altındaki tüm kurumsal BSL-2 yönergelerine uygun olarak bir Biyogüvenlik seviye 2 (BSL-2) kabininde gerçekleştirilmesi gerekir.
1. Bakteri stoklarının ticari döngülerden kaplanması
NOT: Bu protokol, sağlayıcıdan elde edilen çeşit ilmeklerden başlayarak Spn (ATCC 49619) ve Kpn (ATCC 43816) için bakteri stoklarının yetiştirilmesi için kullanılabilir (ayrıntılar için Malzeme Tablosuna bakın).
- %5'lik bir koyun kanı agar plakasını bir kuluçka makinesinde 37 °C'de 15 dakika ısıtın. Bu amaçla bir hücre inkübatörü kullanılabilir.
- Kaputun altında, kılıfı bakteri aşılama halkasından çıkarın ve zikzak bir desen izleyerek agar plakasına çizerek dikkatlice yayın. Kopya olarak ayrı bir plaka kullanarak bu adımı tekrarlayın. Aynı döngü ile en fazla beş plaka çizilebilir.
- Optimum bakteri üremesi için plakaları gece boyunca 37 °C'de inkübe edin. Bakterileri 3 gün boyunca günlük olarak geçirin. Kanlı agar plakalarını 37 ° C'de 15 dakika ısıtın, tek kullanımlık bir aşılama halkası kullanarak ilk agar plakasından 15 ila 20 koloni alın ve bunları yeni, önceden ısıtılmış bir agar plakasına yayın. Plakayı uygun şekilde etiketleyin.
2. Gelecekte kullanılmak üzere bakteri üremesi ve depolanması
- 3 gün sonra, bir çizgi halkası ile kanlı agar plakasından 30'a kadar koloni alın ve doğrudan Todd Hewitt suyu (TH suyu) içeren 250 mL'lik bir şişeye yerleştirin. 37 ° C'de, 250 rpm'de çalkalayarak, yaklaşık 4 saat% 5 CO2 ile inkübe edin.
- OD620nm'yi 0.3'e ulaşana kadar ölçmek için her 15 dakikada bir alikot alın, bu da mL başına yaklaşık 3 x 108 koloni oluşturan birime (CFU) eşdeğerdir.
- Yeni bakteri stoğunun 1 mL'sini hemen 2 mL'lik kriyojenik şişelere boşaltın. Taze aliquoted şişeleri 5 dakika boyunca sıvı nitrojen içinde dondurun. Bakteri parçalarını -80 ° C'lik bir dondurucuda saklayın (şişeler, güçlerini kaybetmeden önce 6-8 aya kadar kullanılabilir).
- 7 günlük donmadan sonra, alikotlar hayvan çalışmaları için kullanılabilir. Bu nedenle, bakterilerin yeni konsantrasyonunu belirleyin.
3. İntratrakeal damlatma için bakteri çözme
- Bir kanlı agar plakasını bir çalkalayıcıda 37 °C'de 10 dakika ısıtın. Dondurucudan yeni stok şişelerinden birini alın ve 37 ° C'lik bir su banyosunda yaklaşık 2 dakika boyunca hafifçe çalkalayarak çözdürün. O-ringe veya kapağa ılık suyla dokunmaktan kaçının.
- Bakteri kolonilerini manuel olarak saymak için bir kan agar plakası üzerindeki plaka. 1 x 10-6 seyreltme gerçekleştirin ve önceden ısıtılmış bir kan agar plakasında son seyreltmeden 200 μL plaka yapın. Bunu iki kopya halinde yapın.
- Bakterilerin en iyi şekilde büyümesi için plakaları gece boyunca 37 °C'de inkübe edin. Ertesi gün, yeni bakteri konsantrasyonunu belirlemek için aşağıdaki formülü uygulayın: CFU/mL = (koloni sayısı x seyreltme faktörü) / kaplanmış stok hacmi
4. Canlı bakterilerin intratrakeal damlatılması
NOT: Bu protokol, intratrakeal olarak 50 μL'lik bir hacim aşılamak için optimize edilmiştir. Bakteri stokları 6-9 aya kadar saklanabilir. Her şişede bakteriyel CFU'yu sağlamak için, her deneyden önce plakaladığınızdan emin olun, bakteri stok CFU'sunu yukarıda açıklandığı gibi hesaplayın ve sonraki seyreltmeler için TH suyu kullanın.
DİKKAT: Biyogüvenlik kabininin altında, steril cerrahi aletler kullanarak bir kemirgen hayatta kalma prosedürü gerçekleştirin.
- İntraperitoneal olarak 100 mg / kg ketamin ve 2.5 mg / kg asetilpromazin enjekte ederek fareyi uyuşturun. Bir seferde enjekte edilen fare sayısı için tekrarlayın.
NOT: Fareler, hayvan kullanımını kolaylaştırmak için izoflurana maruz kalabilir. Bununla birlikte, önemli hayvan sıkıntısına neden olmadan intraperitoneal anestezikleri enjekte edebilen deneyimli bir işleyici, izofluran maruziyetini önleyebilir. Enjekte edilecek fare sayısı cerrahın uzmanlığına bağlıdır. - Tüm fareler uygun anestezi altında olduktan sonra, anesteziyi kuyruk tutamıyla onaylayın. Anestezi uygulanmış fareyi temiz ve sterilize edilmiş bir yüzeye yerleştirin, hayvanı kesici dişlerinden asın ve ön ayakları nazikçe bantlayın (Şekil 1A).
NOT: Hayvan sağlığını sağlamak için, anestezi uygulanan tüm hayvanlarda kornea kayganlığı sağlayın. Karboksimetilselüloz göz damlası kullanılabilir, göz başına bir damla uygulanır. - Boyun bölgesini tıraş edin ve bölgeyi klorheksidin ve% 70 alkol ile dezenfekte edin. Cerrahi makas kullanarak, trakeayı görüntülemek için 1 cm'lik yüzeyel orta hat boyun kesisi yapın (Şekil 1B). Küçük bir kesi yeterli olmalıdır, ancak bol miktarda yağ dokusu görülürse, trakeayı görselleştirmek için yağ dokusunu dikey olarak dikkatlice inceleyin.
NOT: Yalnızca uç tekniği ile steril eldivenler ve steril aletler kullanın. İşlem steril koşullar altında yapılırsa enfeksiyon riski minimumdur. - Forseps kullanarak, her fareyi entübe edin. Dili nazikçe dışarı doğru çekin ve kateteri trakeaya doğru ilerleterek ağızdan 20 G'lik bir anjiyo-kateter sokun. Entübasyonu kolaylaştırmak için trakea üzerine hafif bir baskı uygulayın.
NOT: Trakea fare gövdesinin önünde olduğundan, kateterin ucunu hafifçe bükün, çünkü bu, fareyi başarılı bir şekilde entübe etmek için açıyı elde etmeye yardımcı olacaktır. Boyun kesisi esas olarak görselleştirme amaçlı yapılır; Alternatif olarak, operatör trakeayı kör olarak entübe edebilir. - Entübasyondan sonra, entübasyonu onaylamak için fareyi bir solunum cihazına bağlayın. Bu prosedürde kullanılan normal ventilatör parametreleri 200 μL strok hacmi ve dakikada 200 stroktur. Hızlı ve kolay onay için ventilatör oranını kısa bir süre yukarı ve/veya aşağı çevirin.
- Entübasyonu onayladıktan sonra, fareyi solunum cihazından ayırın ve 200 μL'lik bir pipet jel yükleme ucu kullanarak anjiyo-kateter yoluyla 50 μL bakteri ajanını dikkatlice damlatın. Kontrol fareleri için 50 μL steril TH suyu enjekte edin.
- Bakteriyel ajanı damlattıktan sonra, solunumu yeniden başlatmaya yardımcı olmak için fareyi tekrar solunum cihazına bağlayın. Fareyi 30-60 saniye solunum cihazında bırakın. Tüm fareleri enjekte ettikten sonra solunumlarını izleyin. Yavaş bir solunum paterni varsa, fareleri tekrar solunum cihazına bağlayın.
- Cilde küçük bir damla yapıştırıcı ekleyerek kesiği kapatın. Cilt kıvrımlarını bir araya getirin ve tutkal kuruyana kadar hafif bir baskı uygulayın.
- Fareleri iyileşmek için bir ısıtma yastığına yerleştirin ve yeterli bilinçlerini geri kazanana kadar yakından izleyin. Tamamen iyileştikten sonra fareleri kafese geri aktarın. Ameliyat sonrası ağrı / sıkıntı yönetimi için, fareler deri altından (SC) 0.05-0.1 mg / kg'lık bir dozla buprenorfin ile tedavi edilebilir.
NOT: %20'den fazla kilo kaybı olan veya işlem sonrası uyuşukluk, suya veya yiyeceğe ulaşamama, nefes almada zorluk, dış uyaranlara tepkide bozulma veya zihinsel uyanıklıkta azalma gibi önemli sıkıntılar yaşayan hayvanlara ötenazi yapılmalıdır.
5. Bronkoalveoler lavaj ve akciğer hasadı
- Fareyi% 5 izofluran içeren kapalı bir kaba koyarak ötenazi yapın. Fare nefes almayı bıraktıktan sonra 1 dakika boyunca izofluran maruziyetine devam edin. Ötenaziyi doğrulamak için torakotomi yapın.
NOT: Görsel ve fizik muayene ile ötenaziyi onaylayın. Kalp atmayı bırakmış ve fareler nefes almıyor olmalı. Mukoza zarları beyaz veya soluk olmalıdır. - Fareyi temiz bir cerrahi tahta üzerine sırtüstü pozisyonda yatırın ve kesici dişlerden asın. Fare derisine% 70 etanol püskürtün. Cerrahi makas kullanarak, farenin trakeasını görselleştirmek için küçük bir yüzeysel orta hat boyun kesisi yapın.
- Trakeayı 20 G'lik bir kateter ile kanüle edin. Dikkatlice, 1 mL'lik bir şırınga kullanarak intratrakeal olarak 1 mL kalsiyum içermeyen fosfat tamponlu salin (PBS) ekleyin. Tam akciğer genişlemesine izin verin ve ardından aynı şırıngayı kullanarak sıvıyı aspire edin. Bu adımı toplam 2 mL boyunca tekrarlayın.
- BAL'ı 2 mL'lik bir alikot içine aktarın. 2 mL'lik son hacim için bu adımı iki kez gerçekleştirin. Alveolar boşluğun bozulma riski yüksek olduğu için akciğerleri bir seferde 1 mL'den fazla lavaj yapmayın.
- Göğüs boşluğunu açın ve makas ve forseps kullanarak akciğeri, kalbi ve trakeayı ortaya çıkarın. Diyaframı dikkatlice inceleyin ve göğüs kafesini çıkarın. Akciğer dokusunu sıkıştırmadığınızdan emin olun.
- Kan kaybına izin vermek için abdominal aortu transekt edin. Makas kullanarak sağ ventrikülde yaklaşık 2 mm'lik küçük bir kesi yaparak akciğer dokusunu perfüze edin ve 20 G kateter kullanarak 5 mL soğuk PBS enjekte edin. PBS akciğere perfüze etmelidir. Yeterli bir perfüzyon yapılırsa, akciğer dokusu beyaza dönecek ve PBS abdominal aort yoluyla intravasküler bölmeyi terk edecektir.
- Dikkatlice, akciğerleri çıkarın ve histoloji veya tek hücreli süspansiyona daha fazla işlem yapmak için trakeadan inceleyin.
- Histoloji için işleniyorsa, akciğerleri formalin çözeltisi (nötr tamponlu% 10) ile 25 cm H2O'ya kadar şişirmek için dikkatlice 20 G'lik bir kateter yerleştirin. Akciğerler insüflasyona uğradıktan sonra, trakeanın altından yaklaşık 5 cm uzunluğunda bir 3.0 dikiş ipi geçirin ve formalinin akciğer dokusunda kalmasını sağlamak için iki kez sıkıca bağlayın. Nazikçe, akciğeri dokuların geri kalanından ayırın ve 10 mL formalin çözeltisi içeren 15 mL'lik konik bir tüpe yerleştirin.
6. Bronkoalveoler lavaj işleme
- BAL'ı 500 x g'da 4 °C'de 5 dakika santrifüjleyin. Hücresiz süpernatanı ayrı bir tüpte çıkarın ve -80 °C'de saklayın.
NOT: BAL süpernatında, protein miktar tayini (örneğin, BCA testi13) veya spesifik biyobelirteçlerin veya sitokinlerin ölçümü (ELISA testleri ve MSD ve Luminex gibi platformlarla çoklu tahliller) dahil olmak üzere daha fazla analiz yapılabilir. - 1 dakika boyunca 100 μL parçalama tamponu ekleyerek kırmızı kan hücrelerini parçalayın. 1 mL PBS ekleyerek parçalanma reaksiyonunu nötralize edin. BAL'ı 5 dakika boyunca 4 ° C'de 500 x g'da santrifüjleyin ve süpernatanı çıkarın.
- Hücreleri PBS'de yeniden süspanse edin (100-300 μL; hücre pelet boyutuna bağlı olarak). Manuel veya otomatik hücre sayımı ile %0,4 tripan mavisi lekesi olan bir hücre sayımı gerçekleştirin. Daha fazla test için sıvı nitrojen içinde akış sitometrisi boyama ve/veya kriyoprezervasyon (kriyoprezervasyon solüsyonunda yeniden süspanse ederek) için kalan peleti kullanın.
7. Tek hücreli süspansiyon için akciğer işleme
- Akciğeri dokuların geri kalanından nazikçe inceleyin ve 5 mL soğuk PBS içeren 15 mL'lik konik bir tüpe yerleştirin. Akciğeri PBS'den çıkarın ve bir kağıt havlu kullanarak kurulayın.
- 1 mL düşük glikozlu Dulbecco'nun modifiye edilmiş Eagle's besiyerine (DMEM) 1 mg DNaz ve 5 mg kollajenaz ekleyerek bir sindirim kokteyli hazırlayın. Akciğeri 1 mL sindirim kokteyli içeren bir C-tüpüne aktarın.
- C-tüpünü doku ayrıştırıcıya aktarın ve akciğer dokusunu işlemek için standartlaştırılmış protokolü izleyin14.
- C-tüpüne 10 mL soğuk PBS ekleyin ve uygun şekilde karıştırın. 50 mL'lik bir konik tüpün üstünde 70 μm'lik bir hücre süzgeci kullanarak tek hücreli süspansiyonu filtreleyin. Filtrelemeyi iki kez gerçekleştirin.
- Süspansiyonu 500 x g'de 4 °C'de 5 dakika santrifüjleyin. Süpernatanı dikkatlice boşaltın ve oda sıcaklığında 1 dakika boyunca 1 mL parçalama tamponu ekleyin. Parçalanma reaksiyonunu durdurmak ve süpernatanı çıkarmak için 10 mL soğuk PBS ekleyin.
- Süspansiyonu 500 x g'de 4 °C'de 5 dakika santrifüjleyin. Süpernatanı dikkatlice boşaltın ve 10 mL soğuk PBS ekleyin.
- Manuel veya otomatik hücre sayımı ile tripan mavisi lekesi ile hücre sayımı yapın. Daha fazla test için akış sitometrisi boyama ve/veya sıvı nitrojen içinde kriyorezervasyon için bir hücre peleti kullanın.
Sonuçlar
Yukarıda açıklanan prosedürler, farelerde bakteriyel pnömoniye bağlı akciğer hasarının altında yatan patofizyolojik mekanizmaların modellenmesine izin verdi. Modellemeye başlamak için, C57BL / 6 vahşi tip (WT) fareler Jackson Laboratuvarı'ndan elde edildi ve enstitünün hayvan tesisinde yetiştirildi. 8 haftalık erkek WT C57BL / 6 farelerine, TH et suyu (kontrol), 3 x 106 CFU canlı Spn veya 200 CFU canlı Kpn'nin intratrakeal aşılaması uygulandı. Enfeksiyondan sonra, fareler Spn ve Kpn için sırasıyla 6 ve 10 gün boyunca izlendi. Enfekte gruplar, enfekte olmayan kontrole kıyasla daha düşük vücut ağırlığı gösterse de, Spn grubu vücut ağırlıklarını taban çizgisine doğru geri kazanırken, Kpn ile enfekte olmuş fareler 6 günlük enfeksiyondan sonra yavaş iyileşme gösterdi (Şekil 2A). Çalışma süresi boyunca, vücut ağırlığının% 20'nin üzerinde olması nedeniyle ötenazi geçirmesi gerekmeyen hiçbir fareye ihtiyaç duyulmadı ve ağrı ve sıkıntı olduğuna dair bir kanıt yoktu.
Akciğer hasarını farklı aralıklarla ölçtük. Enfekte gruplarda BAL protein konsantrasyonu ve hem BAL hem de akciğerler için toplam hücre sayısı belirgin şekilde daha yüksekti (Şekil 2). Her iki modelde de inflamatuar süreci gösteren temsili histolojik kesitler, aşılamadan sonraki 2, 4 ve 6. günlerde elde edildi (Şekil 3), Kpn ile enfekte farelerde (Şekil 4), hatta 10. günde bile kalıcı alveolar inflamasyon kanıtı gösterdi. Kpn ile enfekte fareler 10. güne kadar yaralanmaya devam ederken (Şekil 2 ve Şekil 4), Spn ile enfekte fareler akciğer iltihabını 6. güne kadar çözdü (Şekil 2 ve Şekil 3).
Akciğer tek hücreli süspansiyonlar, floresanla aktive hücre sıralamasında (FACS) 18 renkli bir panel kullanılarak, Spn modelinde enfeksiyondan sonraki 6. günde yüksek boyutlu akış sitometrisi ile bağışıklık manzarasını ayırt etmek için kullanıldı. T-dağıtılmış stokastik komşu gömme (t-SNE) kullanılarak, bağışıklık hücresi bileşimindeki genel farklılıklar görselleştirilebilir, artan sayıda granülosit (CD45 +, CD11b +, CD24 +, MHC-II-), interstisyel makrofajlar (CD45 +, CD11b +, MHC-II-, CD24-), monositler (CD45 +, CD11b +, MHC-II-, CD24-, CD64-), B hücreleri (CD45 +, CD19 +) ve T hücreleri (CD45 +, CD3 +), doğal öldürücü hücreler (CD45 +, CD3 +, NK1.1 +) dahil, Şekil 5'te gösterildiği gibi. Geçit stratejileri Şekil 6'da gösterilmiştir.
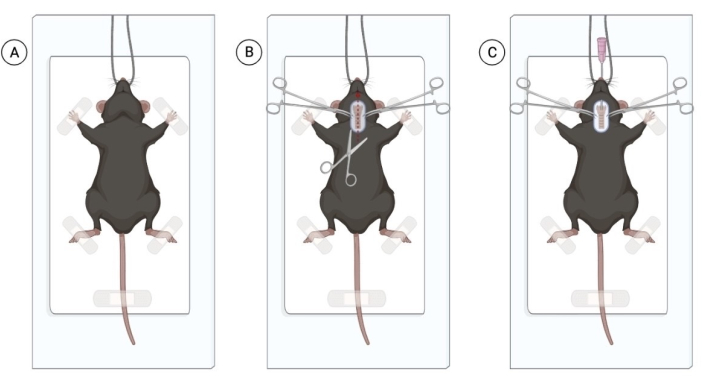
Şekil 1: Canlı bakterilerin intratrakeal damlatılması için cerrahi prosedür. (A) Farenin steril cerrahi alanda, kesici dişlerden asılı pozisyonu. (B) Kesi alanı ve trakea maruziyeti. (C) 20 G kateterin yerleştirildiği entübasyon işlemi. Biorender.com ile oluşturulan figür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
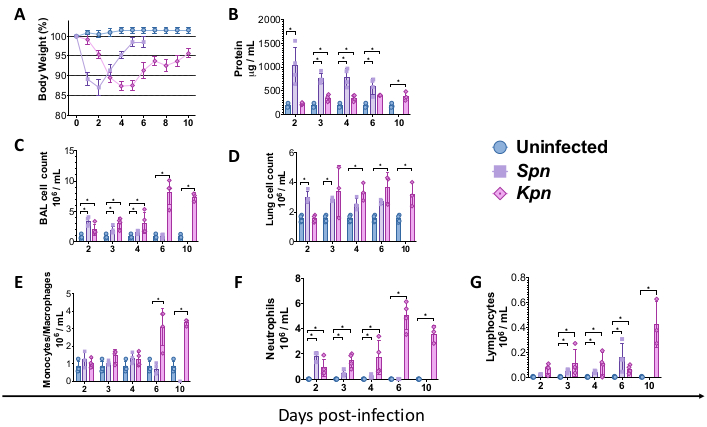
Şekil 2: Pnömoni modellerinden sonra akut akciğer hasarı (ALI) profilleri. (A) Taban çizgisine göre zaman içinde vücut ağırlığı, Kpn ve Spn'ye karşı kontrol (n = 4, grup başına). (B) BCA testi ile BAL toplam protein tayini (n = 4, grup başına). (C) Kontroldeki BAL toplam hücre sayıları (n = 3), Kpn (n = 4) ve Spn (n = 3). (D) Kontroldeki akciğer toplam hücre sayısı (n = 3), Kpn (n = 4) ve Spn (n = 3). (E-G) Kontroldeki BAL sitospininin manuel histoloji sayısı (n = 3), Kpn (n = 4) ve Spn (n = 3) ile BAL hücre diferansiyeli. İstatistiksel testler, enfekte olmayan kontrol ile enfekte grupları karşılaştıran bireysel t-testi ile yapıldı. *p < 0.05. Veriler, her çizim için standart hata (SE) kullanılarak görüntülenir. Y ekseni, tüm paneller için enfeksiyondan sonraki günlerdir. Kısaltmalar: BAL = bronkoalveoler lavaj; Spn = Streptococcus pneumoniae; Kpn = Klebsiella pneumoniae. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
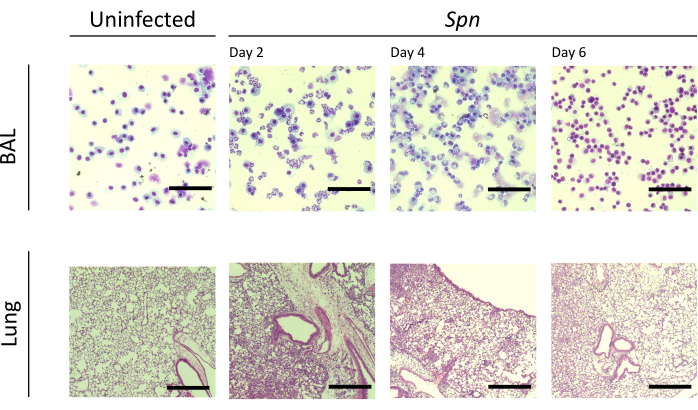
Şekil 3: Spn enfeksiyonu sırasında akciğer histopatolojik bulguları. Spn'nin intratrakeal enfeksiyonundan sonra ve 2, 4 ve 6. günlerde temsili bir BAL ve akciğer bölümünün histolojik bölümlerinin hematoksilen ve eozin (H&E) boyanması. BAL büyütme = 100x; Akciğer büyütme = 10x. Kısaltmalar: BAL = bronkoalveoler lavaj; Spn = Streptococcus pneumoniae. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
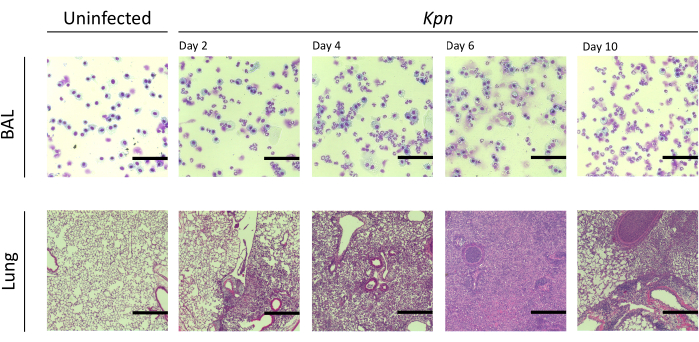
Şekil 4: Kpn enfeksiyonu sırasında akciğer histopatolojik bulguları. 2, 4, 6 ve 10. günlerde Kpn'nin intratrakeal enfeksiyonundan sonra temsili bir BAL ve akciğer bölümünün histolojik bölümlerinin hematoksilen ve eozin (H&E) boyanması. Görüntüler yüksek güçte büyütme gösterir (ölçek çubuğu = 50 μm). Kısaltmalar: BAL = bronkoalveoler lavaj; Kpn = Klebsiella pneumoniae. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
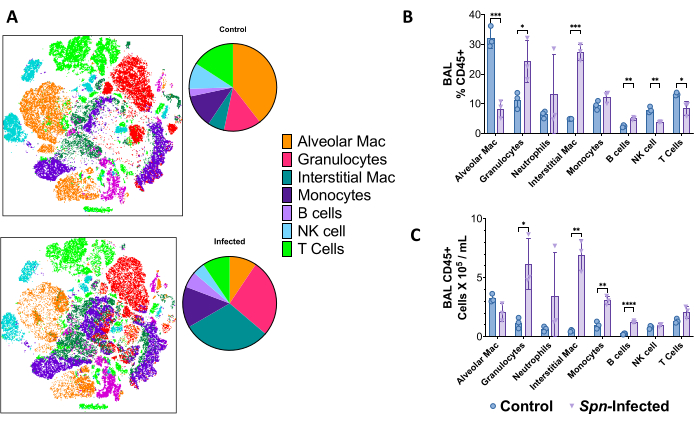
Şekil 5: 6 günlük Spn enfeksiyonundan sonra çok renkli akış sitometrisi ile bağışıklık hücresi manzarası. (A) Akciğerin bağışıklık hücresi popülasyonlarını (CD45+) görselleştirmek için enfekte olmamış kontrol ile enfekte olmuş grubu karşılaştırmak için T-dağıtılmış stokastik komşu gömme (t-SNE) kullanıldı. (B) Akciğerdeki toplam CD45 + hücrelerinden bağışıklık hücresi frekanslarının özeti. (C) Her bir popülasyonun toplam hücre sayısı. İstatistiksel karşılaştırmalar, kontrol ve enfekte olanlar arasında t-testleri ile yapıldı. *p < 0.05, **p < 0.01, ***p < 0,001. Veriler, her çizim için standart hata (SE) kullanılarak görüntülenir. Kısaltmalar: BAL = bronkoalveoler lavaj; Spn = Streptococcus pneumoniae. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Başlangıçta ve pnömoni sonrasında akciğerlerdeki bağışıklık hücresi alt popülasyonunu tanımlamak için geçit stratejileri. BAL ve Akciğer hücre süspansiyonu çok renkli akım sitometrisi için boyandı. Enkaz ilk olarak SSC-A ve FSC-A kullanılarak dışarı çıkarıldı ve tek hücreler iki strateji ile kapılandı (SSC-W'ye karşı SSC-H ve FSC-W'ye karşı FSC-H). Canlı hücreler, SSC-A'ya karşı canlı/ölü ayrımcı kullanılarak tanımlandı. Sonraki hücre popülasyonları, önceden tanımlanmış belirteçler 15 ile tanımlandı. Kısaltma: BAL = bronkoalveoler lavaj. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
PNA'nın deneysel fare modelleri, ARDS'nin yaralanmasının altında yatan hücresel ve moleküler mekanizmaları ve çözünürlüğü değerlendirmek için bir platform sunar. Değerlendirilebilecek patofizyolojik bileşenler arasında erken inflamatuar yolaklar, bakteriyel klirens, dinamik immün manzara değişiklikleri, inflamasyonun çözülmesi, fibroproliferasyon ve epitel ve vasküler onarımyer alır 16. Bununla birlikte, bu pnömoniye bağlı akciğer hasarı modelini tekrarlamayı planlarken, yaş, cinsiyet, fare suşu, içsel konak faktörleri (örneğin, bağışıklığı baskılanmış durum), kullanılan spesifik patojen ve bakteri yükü ve prosedürü gerçekleştiren personelin deneyimi dahil olmak üzere çeşitli hususlar göz önünde bulundurulmalıdır.
PNA, ARDS'nin önde gelen nedenleri arasındadır. İnsanlarda toplum ve hastane kökenli PNA'nın yaygın nedenleri olan canlı Spn ve Kpn'yi kullanmayı tercih ettik17. Araştırmacının hipotezine en iyi uyan istenen mortalite ve yaralanma çözünürlük profilini elde etmek için canlı bakteri dozlarını titre ederek PNA'nın bakteriyel modellerini optimize etmeyi öneriyoruz. Farelerde Spn için 3 x 106 CFU ve Kpn için 200 CFU'luk intratrakeal bakteri aşılamasını optimize ettik, bu da alveolar inflamasyona, alveolokapiller bariyerin bozulmasına ve organ disfonksiyonuna neden oldu (Şekil 2). Bununla birlikte, farklı kaynaklardan veya hatta çift döngüler içindeki bakteri yığınları, aynı suş ve CFU kullanıldığında bile farklı derecelerde iltihaplanma ve yaralanma gösterebilir.
Bu nedenle, bu yazıda sunulan sonuçları tekrarlamak için araştırmacılar burada açıklanan bakteri konsantrasyonu ile başlamalıdır; Bununla birlikte, benzer bir model profili elde etmek için dozu artırmaları veya azaltmaları gerekebilir. Bu nedenle, kullanılan her yeni bakteri partisinin potansiyel yaralanma çözme etkisi için optimize edilmesi gerekir. Araştırmacıların immünolojik mekanizmaları değerlendirmeleri ve özellikle pik enfeksiyonda veya sonrasında (örneğin, enfeksiyondan 2 gün sonra) terapötik müdahaleleri test etmeleri için platformlar olarak hizmet edebilecek, biri kendi kendine çözülen (Spn) ve diğeri yavaş/çözülmeyen (Kpn) olmak üzere iki farklı çözünürlük sonucuna sahip sağlam bir PNA modeli sunuyoruz.
Yaş, cinsiyet, zorlanma ve genetik faktörler yaralanma rezolüsyon modellerinin kinetiğini etkiler16. Örneğin, cinsiyet, kadınlarda erkeklere kıyasla daha hızlı çözünürlük sağlar18; Bu nedenle, bakteri yükündeki artış, erkeklerde kadınlara kıyasla mortalitenin artmasına ve gecikmiş çözülmeye yol açar. Yaşlanma, kullanılan bakterilerin CFU'sunu titre ederken göz önünde bulundurulması gereken başka bir faktördür. Yaşlanan fareler, belirtilen Spn dozunu kullandığımızda% 100 mortalite gösterdi (burada gösterilmemiştir). Genç fareler en sık pnömokok PNA modellerinde (6 ila 14 hafta arasında değişen) kullanılırken, yaşlı fareler (19-26 aylık) değişmiş bir bağışıklık tepkisi gösterir ve PNA11'de yaşlanmanın rolünü araştırmak için kullanılır. Yaşlanan hayvanlarda hayatta kalabilmek için CFU'yu %300'e düşürmek zorunda kaldık (burada gösterilmemiştir). Bu çalışmada erkek C57BL / 6 fareleri (8-12 haftalık) kullanıldı ve enfeksiyondan 6 ila 10 gün sonra takip edildi. Suşlar arasında duyarlılıkta önemli farklılıklar da bulunabilir; BALB/C ve C57BL6/J gibi akraba suşların enfeksiyona farklı yanıtları vardır11,19.
Bakterilerin intratrakeal olarak doğrudan aşılanması, aşının (% 99'a kadar) akciğerlere12 daha hassas bir şekilde verilmesine izin verir, bu da daha az virülan serotipler için bir alternatifi temsil eder ve bakterilerin aerosolizasyonunu azaltır11. Ancak invaziv bir işlem olduğu söylenebilir. Entübasyon zor olabilir, sistemik anestezi gerektirir ve ardından hava yolu ödemi ve stridor ile trakeal travmaya yol açabilir. Fareler, apneye yol açan bir vazovagal refleks geliştirebilir ve bunun için gerektiğinde ek ventilatör desteği sağlamak için küçük bir fare ventilatörüne sahip olmak gerekir. İşlemi gerçekleştiren cerrahın uzmanlığı, başarılı entübasyonu garanti etmek için kritik bir bileşendir11. Çalışmamızda, uygun ağrı yönetimi ve vücut ağırlığının% 20'den fazla olmaması nedeniyle hiçbir fareye ötenazi yapılmasına gerek yoktu. Uyuşukluk, suya veya yiyeceğe ulaşamama, nefes almada zorluk veya zihinsel uyanıklıkta azalma gibi ağrı ve sıkıntı belirtisi görülmedi. Akciğerlere doğrudan bakteri verilmesinin alternatif yöntemleri orofaringeal aspirasyondur, ancak akciğer hasarının çözülmesi daha hızlı gerçekleşiyor gibi görünmektedir ve bazı bakteriler mide ve gastrointestinal sistemde sona erebilir20.
PNA'nın klinik öncesi modelleri, araştırmacıların bağışıklık ortamını değerlendirmelerini sağlar. Bronkoalveolar ve interstisyel bölmeler, bağışıklık hücrelerindeki dinamik değişiklikler için değerlendirilebilir16. Ayrıca, hücreler, spesifik sitokin ve kemokin üretimlerini belirlemek için ex vivo olarak kültürlenebilir ve uyarılabilir. Burada, çok renkli akış sitometrisi kullanarak akciğer ve BAL'daki bağışıklık hücresi manzarasını keşfetmeye odaklanıyoruz. Tek hücreli RNA dizilimi, yaralanma çözünürlüğünün farklı aşamalarında hücreye özgü transkriptomik imzaları anlamak için de yapılabilir.
PNA-ARDS modelleri, hastalığın seyri sırasında vücut ağırlığını ölçerek erken tespit edilebilen sistemik etkiler oluşturur10. ARDS'nin sistemik etkilerini doğrudan ölçmesek de, organ disfonksiyonu kimya profillerinin kan ölçümü ve histoloji için dalak, böbrek ve karaciğer gibi farklı dokuların toplanması ile de değerlendirilebilir. Pnömokokal PNA-ARDS'nin sistemik etkileri daha önce aynı bakteri suşunu kullanan diğer gruplar tarafından tanımlanmıştır21.
Burada, insan ARDS'sinin altında yatan bazı temel patofizyolojik bulgulara benzeyen bir deneysel PNA modeli tanımlanmıştır. İnsan ARDS9'un karmaşıklığını ve heterojenliğini tamamen özetleyen ideal modeller olmamasına rağmen, bu modeller akciğer hasarı ve onarımı mekanizmalarını incelemek için ilgili ve tekrarlanabilirdir, aynı zamanda akciğer iltihabının çözülmesini hızlandırmaya ve akciğer onarımını teşvik etmeye odaklanan yeni potansiyel farmakolojik hedeflerin tanımlanması için bir platform görevi görür.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma NIH hibesi R01 HL131812 ve R01HL163881 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1-200 µL Round 0.5 mm Thick Gel-Loading Pipet Tips | Corning | 4853 | |
| 2 mL Cryogenic vials | Corning Incorporated | 431420 | 2 mL self standing, round bottom, red cap, polypropylene |
| 2 mL Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Fisherscientific | 05-402-24C | Shape: Round, Length (Metric): 38mm, Diameter (Metric) Outer: 10mm, Capacity (Metric): 2mL |
| 70 µm Cell Strainer | Falcon | 352350 | White, Sterile, Individually Packaged |
| 96-well Clear Round Bottom | Falcon | 353077 | TC-treated Cell Culture Microplate, with Lid, Individually Wrapped, Sterile |
| Acepromizine Maleate Injection, USP 500 mg/50 mL (10mg/mL) | Phoenix | NDC 57319-604-04 | EACH mL CONTAINS: acepromazine maleate 10 mg, sodium citrate 0.36%, Citric acid 0.075%, benzyl alcohol 1% and water for injection. |
| Ammonium-Chloride-Potassium (ACK) Lysing Buffer | Quality Biological | 118-156-721 | 4 x 100mL |
| Anti-mouse I-A/I-E | Biolegend | 107628 | APC/Cyanine7 anti-mouse I-A/I-E [M5/114.15.2]; Isotype: Rat IgG2b |
| BCA Protein Assay Kit | Thermo Scientific | 23225 | |
| BD Trypticase Soy Agar | BD-Biosciences | 90001-276 | 5% Sheep Blood Prepared Media Stacker Plates, BD Diagnostics |
| Biotix Disposable Reagent Reservoirs | Biotix | 89511-194 | |
| Bovine Serum Albumin | Sigma-Aldrih | A4503 | |
| CD103 | Invitrogen | 509723 | Integrin alpha E) Armenian Hamster anti-Mouse, FITC, Clone: 2E7 |
| CD11b | Invitrogen | RM2817 | PE-Texas Red, Clone: M1/70.15, Invitrogen |
| CD11c | BD Biosciences | 565872 | Hamster anti-Mouse, APC-R700, Clone: N418, BD Horizon |
| CD19 | Biolegend | 152410 | APC anti-mouse CD19 [1D3/CD19]; Isotype: Rat IgG2a, κ |
| CD24 | BD Biosciences | 563450 | Rat anti-Mouse, Brilliant Violet 711, Clone: M1/69 |
| CD4 | BD Biosciences | 563790 | BUV395; Clone: GK1.5 |
| CD45 | Biolegend | 103157 | Brilliant Violet 750 anti-mouse CD45 [30-F11]; Isotype: Rat IgG2b, κ; |
| CD8a | BD Biosciences | 612759 | Rat anti-Murine, Brilliant Ultraviolet 737, Clone: 53-6.7 |
| Cell Counting Slides | Bio-rad | 1450017 | For TC20 Cell Counter |
| Cell strainer 70 µL Nylon | Falcon | 198718 | REF 352350 |
| Collagenase Type1 | Worthington Biochemical Corporation | LS004197 | |
| Culti-Loop Streptococcus pneumoniae | Thermo Scientific | R4609015 | ATCC 4961 |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrih | DN25 | |
| Disposable inoculation loops/needles | Fisherbrand | 22-363-603 | Color blue; Volume 1 µL |
| DMEM (Dulbecco’s Modified Eagle’s Medium) | Corning | 10-014-CV | |
| Fc Block | BD Biosciences | 553142 | CD16/CD32 Rat anti-Mouse, Unlabeled, Clone: 2.4G2 |
| Formalin solution | Sigma-Aldrih | HT501640 | Formalin solution, neutral buffered, 10% |
| Gauze Sponges, Covidien | Curity | 2146- | |
| gentleMACS C Tubes | MACS Miltenyi Biotec | 130-093-237 | |
| gentleMACS Dissociator | MACS Miltenyi Biotec | 130-093-235 | SN: 4715 |
| Hema 3 Manual Staining System and Stat Pack | Thermo Scientific | 23123869 | |
| Isoflurane Liquid Inhalation | Henry Schein | 1182097 | |
| IV CATHETER JELCO 20GX1.25" | Hanna Pharmaceutical Supply Co., Inc | 405611 | |
| Ketamine HCl Injection | Henry Schein | 1049007 | Ketamine HCl Injection MDV 100mg/mL 10mL 10/Box |
| Klebsiella pneumoniae | ATCC | 43816 | subsp. pneumoniae (Schroeter) Trevisan |
| Loctite 409 | Electron Microscopy Sciences | 7257009 | |
| Ly-6C | Biolegend | 128036 | Brilliant Violet 605 anti-mouse Ly-6C [HK1.4]; Isotype: Rat IgG2c |
| Ly-6G | BD Biosciences | 740157 | Rat anti-Mouse, Brilliant Violet 510, Clone: 1A8, BD Optibuild |
| MiniVent Type 845 | Hugo Sachs Elektronik- Harvard Apparatus | 4694 | D-79232 March (Germany) |
| NK-1.1 | BD Biosciences | 553165 | Mouse anti-Mouse, PE, Clone: PK136, BD |
| Phase Hemacytometer | Hausser Scientific | 1475 | |
| Phosphate-Buffered Saline | Corning | 21-040-CV | 1X without calcium and magnesium, |
| Round Bottom | Sarstedt | 55.476.305 | |
| Round-Bottom Polystyrene Test Tubes | Falcon | 352235 | With Cell Strainer Snap Cap, 5mL |
| SealRite 1.5 mL Natural Microcentrifuge Tube | USA Scientific | 1615-5500 | Free of detectable Rnase, DNase, DNA and pyrogens. |
| Shandon EZ Single Cytofunnel | Epredia | A78710003 | |
| Siglec-F | BD Biosciences | 562681 | Anti-Mouse, Brilliant Violet 421, Clone: E50-2440 |
| Silk Black Braided 30"(75 cm) Sterile, nonabsorbable surgical suture U.S.P. | Ethicon | K-834 | 0 (3.5 metric) |
| Stainless-Steel Slide Clip | Epredia | 59910052 | |
| Sterile Single Use Vacuum Filter Units | Thermo Scientific | 1660045 | |
| Syringe sterile, single use, 1 mL | BD-Biosciences | 309628 | |
| TC20 Automatic Cell Counter | Bio-Rad | 508BR05740 | |
| TipOne 200 ul yellow pipet tip refill | USA Scientific | 1111-0706 | |
| TODD HEWITT BROTH | RPI | T47500 | |
| TPX Sample Chamber | Epredia | A78710018 | |
| TPX Single Sample Chamber, Caps and Filter Cards | Epredia | 5991022 | |
| Trypan Blue | Bio-rad | 1450022 | |
| U-100 Insulin Syringes | BD-Biosciences | 329461 | |
| Wet-Proof Multi-Heat Electric Heat Pad | Cullus | Model PR7791AB | 120 volst AC; 45 watts; Listed 562B/E26869 |
Referanslar
- Bellani, G., et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 315 (8), 788-800 (2016).
- Hariri, L., Hardin, C. C. Covid-19, angiogenesis, and ARDS endotypes. The New England Journal of Medicine. 383 (2), 182-183 (2020).
- Ferguson, N. D., et al. The Berlin definition of ARDS: an expanded rationale, justification, and supplementary material. Intensive Care Medicine. 38 (10), 1573-1582 (2012).
- Tomashefski Jr, J. F. Pulmonary pathology of the adult respiratory distress syndrome. Clinics in Chest Medicine. 11 (4), 593-619 (1990).
- Martin, T. R. Lung cytokines and ARDS: Roger S. Mitchell lecture. Chest. 116 (1 Suppl), 2S-8S (1999).
- Colletti, L. M., et al. Role of tumor necrosis factor-alpha in the pathophysiologic alterations after hepatic ischemia/reperfusion injury in the rat. The Journal of Clinical Investigation. 85 (6), 1936-1943 (1990).
- Donnelly, S. C., et al. The association between mortality rates and decreased concentrations of interleukin-10 and interleukin-1 receptor antagonist in the lung fluids of patients with the adult respiratory distress syndrome. Annals of Internal Medicine. 125 (3), 191-196 (1996).
- Miller, E. J., Cohen, A. B., Matthay, M. A. Increased interleukin-8 concentrations in the pulmonary edema fluid of patients with acute respiratory distress syndrome from sepsis. Critical Care Medicine. 24 (9), 1448-1454 (1996).
- Matute-Bello, G., et al. An official American Thoracic Society workshop report: features and measurements of experimental acute lung injury in animals. American Journal of Respiratory Cell and Molecular Biology. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: an official American Thoracic Society Workshop report. American Journal of Respiratory Cell and Molecular Biology. 66 (2), e1-e14 (2022).
- Borsa, N., Pasquale, M. D., Restrepo, M. I. Animal models of pneumococcal pneumonia. International Journal of Molecular Sciences. 20 (17), 4220(2019).
- Rubins, J. B., et al. Dual function of pneumolysin in the early pathogenesis of murine pneumococcal pneumonia. The Journal of Clinical Investigation. 95 (1), 142-150 (1995).
- Thermo Scientific, Pierce BCA Protein Assay Kit. , https://www.thermofisher.com/order/catalog/product/23225 Forthcoming.
- Jungblut, M., Oeltze, K., Zehnter, I., Hasselmann, D., Bosio, A. Standardized preparation of single-cell suspensions from mouse lung tissue using the gentleMACS Dissociator. Journal of Visualized Experiments. (29), e1266(2009).
- Tighe, R. M., et al. Improving the quality and reproducibility of flow cytometry in the lung. an official American Thoracic Society Workshop report. American Journal of Respiratory Cell and Molecular Biology. 61 (2), 150-161 (2019).
- Aeffner, F., Bolon, B., Davis, I. C. Mouse models of acute respiratory distress syndrome: a review of analytical approaches, pathologic features, and common measurements. Toxicologic Pathology. 43 (8), 1074-1092 (2015).
- Torres, A., et al. Pneumonia. Nature Reviews Disease Primers. 7 (1), 25(2021).
- Xiong, Y., et al. Estradiol resolves pneumonia via ERβ in regulatory T cells. JCI Insight. 6 (3), e133251(2021).
- D'Alessio, F. R., et al. Enhanced resolution of experimental ARDS through IL-4-mediated lung macrophage reprogramming. American Journal of Physiology. Lung Cellular and Molecular Physiology. 310 (8), L733-L746 (2016).
- D'Alessio, F. R. Mouse models of acute lung injury and ARDS. Methods in Molecular Biology. 1809, 341-350 (2018).
- Gotts, J. E., et al. Clinically relevant model of pneumococcal pneumonia, ARDS, and nonpulmonary organ dysfunction in mice. American Journal of Physiology. Lung Cellular and Molecular Physiology. 317 (5), L717-L736 (2019).
Erratum
Formal Correction: Erratum: Experimental Model to Evaluate Resolution of Pneumonia
Posted by JoVE Editors on 6/13/2023. Citeable Link.
An erratum was issued for: Experimental Model to Evaluate Resolution of Pneumonia. A figure was updated.
Figure 2 was updated from:

to:

Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır