Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kemik Analoglarının Üretimi için Hücre Yüklü Süspansiyonlarda Seramik Çok Yönlü Biyobaskı
Bu Makalede
Özet
Bu protokol, jelatin bazlı granüler bir destekte bir kalsiyum fosfat mürekkebi biriktirerek kemik benzeri yapılar üretmek için bir 3D baskı tekniğini açıklar. Baskılı kemik analogları, baskının doğrudan toplanması veya multifazik yapılar için canlı bir hücre matrisi içinde çapraz bağlanma esnekliği ile serbest formda biriktirilir.
Özet
Yapısal olarak, kemik dokusu, hiyerarşik, yüksek mineralize bir matris içine gömülü metabolik olarak aktif hücreler içeren inorganik-organik bir kompozittir. Bu organizasyonun, kemiğin heterojen ortamı nedeniyle çoğaltılması zordur. Hücre süspansiyonlarında seramik çok yönlü biyobaskı (COBICS), kemiğin mineral ve hücresel yapısını benzersiz bir şekilde kopyalayan mikrojel bazlı bir biyobaskı tekniğidir. COBICS, kemik mimetik yapılarının eklemeli üretimindeki en büyük zorluklardan ikisi olan fedakarlık destek malzemelerine veya zorlu son işlem adımlarına (örneğin, radyasyon ve yüksek sıcaklıkta sinterleme) ihtiyaç duymadan karmaşık, biyolojik olarak ilgili yapıları yazdırır. Bu teknik, jelatin bazlı bir mikrojel süspansiyon içinde yeni bir kalsiyum fosfat bazlı mürekkebin serbest biçimli ekstrüzyonu yoluyla sağlanır. Süspansiyonun akma gerilme özellikleri, birikmeye izin verir ve basılan kemik yapısını destekler. UV çapraz bağlama ve nanoçökeltme daha sonra yerine "kilitleyin". Hücre yüklü biyomalzemeler içinde nanoyapılı kemik-mimetik seramikler basma yeteneği, makro ve mikro mimari üzerinde mekansal zamansal kontrol sağlar ve klinik ortamlarda karmaşık kemik yapılarının gerçek zamanlı olarak üretilmesini kolaylaştırır.
Giriş
Kemik, endojen iyileşme kapasitesinin tehlikeye girdiği kritik bir kusur boyutuna kadar normal hücresel bileşimini, oryantasyonunu ve mekanik gücünü yeniden yaratarak iyileşebilen vücuttaki birkaç yapıdan biri olarak olağanüstü rejenerasyon yeteneklerine sahiptir1. Kemik, kıkırdak ve bağ ile birlikte, vücut hareketini destekler ve kolaylaştırırken, aynı zamanda mineralleri ve yağları depolar ve kan hücreleri üretir. Sert, yoğun bir bağ dokusu olarak, kemik esas olarak inorganik bir fazdan, sudan ve esas olarak kollajen liflerinden oluşan organik malzemedenoluşur 2. Hücreler, kollajen I liflerinin ve hidroksiapatit (HA) kristallerinin bu yüksek mineralize matrisine gömülür ve hiyerarşik bir yapı oluşturur3.
Bu dokunun karmaşık organizasyonu, heterojen kemik mikro ve nano ortamlarını çoğaltmak için sentetik alternatiflerin üretilmesini son derece zorluhale getirir 3. Bu amaçla, biyoseramikler, hücre yüklü hidrojeller ve sentetik malzemeler de dahil olmak üzere çeşitli malzemeler, kemik matrisleri oluşturmak için çözümler olarak önerilmiştir. İskele imalat teknikleri arasında, 3D baskı tabanlı teknikler son zamanlarda ortaya çıkmış ve hastaya özgü tedavi vaadi ile son derece sofistike ve hassas yapıların üretilmesine izin verme konusundaki olağanüstü yetenekleri nedeniyle doku mühendisliği topluluğundan çok dikkat çekmiştir 4,5,6 . Hidrojeller, matris taklitlerinin ve biyo-mürekkeplerin en popüler seçimi olmuştur, çünkü hücreler ve biyoaktif moleküllerle birlikte basılabildikleri için fonksiyonel yapılar oluştururlar6. Bununla birlikte, hidrojeller, mekanik mukavemet ve metabolik olarak aktif hücreler içeren yüksek kalsifiye, inorganik bir faz gibi kemiğin fonksiyonel özelliklerinden yoksundur.
3D baskılı seramik iskeleler tipik olarak sinterleme, yüksek sıcaklık işlemleri veya in vitro veya in vivo uygulamalardan önce iyice yıkanması gereken sert kimyasalların kullanılması dahil olmak üzere işlem sonrası adımlar gerektirir5. Bu sınırlamaları ele almak için, Lode ve ark.7 yakın zamanda hidroksiapatit tarafından oluşturulan, fizyolojik koşullar altında basılabilen ve ayarlanabilen α-trikalsiyum fosfat bazlı bir macun geliştirdi. Bununla birlikte, bu malzeme nemli bir ortamda işlem sonrası işlem ve ardından uzun süre sulu çözelti daldırma gerektirdiğinden canlı hücrelerle birlikte basılamaz.
Alternatif olarak, inorganik parçacıkların dahil edildiği hücre yüklü hidrojeller, 3D kemik matrisi 8,9'un yerine önerilmiştir. Hücre canlılığını destekleme konusundaki büyük yeteneklerine rağmen, yoğun mineralize kemik dokusu ortamını özetleyemezler. Thrivikarman ve ark.10, nano ölçekli apatit birikimini daha iyi taklit etmek için kollajenöz olmayan bir protein analoğu ile aşırı doymuş bir kalsiyum ve fosfat ortamının kullanıldığı biyomimetik bir yaklaşım benimsemiştir. Bununla birlikte, yapıları hala kemiğe benzeyen mikro ve makro ölçekli mimariye sahip katı 3B yapılar üretemez.
Bu çalışma, bu eksiklikleri, hem hücreleri hem de büyüme faktörlerini entegre edebilen inorganik ve organik fazlarda kemik taklit eden yapılar üretmek için bir baskı stratejisinin geliştirilmesi yoluyla ele almaktadır11. COBICS, mikrojel bazlı bir biyobaskı tekniği kullanarak kemiğin mineral ve hücresel yapısını benzersiz bir şekilde özetler. Buradaki protokol, seramik kemik mürekkebi ve jelatin bazlı mikrojellerin sentezlenmesi ve daha sonra COBICS'i etkinleştiren hücrelerin birleştirilmesi sürecini açıklamaktadır. İşlem, kemik mürekkebinin ana öncü malzemesinin sentezi ile başlar. Çapraz bağlanabilir hidrojel daha sonra sentezlenir ve mikrojeller halinde oluşturulur. Son olarak, kemik mürekkebi, hücrelerle yüklü mikrojellerin bir destek banyosunda çok yönlü olarak biriktirilir (Şekil 1).
Kemik mürekkebi, uygun akma gerilmesi özelliklerine sahip mikrojellerin herhangi bir süspansiyonuna, yani belirli bir kesme hızında akışkanlaştırma ve daha sonra biriken yapıyı destekleme yeteneğine sahip herhangi bir süspansiyona basılabilir. İki esnek yaklaşım gösterilmiştir: jelatin mikrojellerinden oluşan bir süspansiyon ve jelatin metakrilat (GelMA) mikrojellerinden oluşan bir süspansiyon. İlk süspansiyon, sıcaklık 37 ° C'ye yükseltildiğinde çözülür, askıya alınmış hidrojellerin (FRESH) serbest biçimli geri dönüşümlü gömülmesi tekniği12, ikincisi ise baskıdan sonra fotoçapraz bağlanabilir, mikrojelleri etkili bir şekilde "diker" ve basılı kemik mürekkebini yerine kilitler. Bu çalışma, karmaşık kemik mimetik yapılarının in situ baskısı ile hücre büyümesini destekleyebilmenin eşsiz avantajını sağladığı için GelMA'yı matris olarak kullanmaya odaklanmaktadır. Nihayetinde, bu yaklaşım, yüksek düzeyde biyomimikri ve hastalık modellemesi, ilaç keşfi ve rejeneratif mühendislik için geniş etkileri olan karmaşık doku modellerinin üretilmesini sağlar.
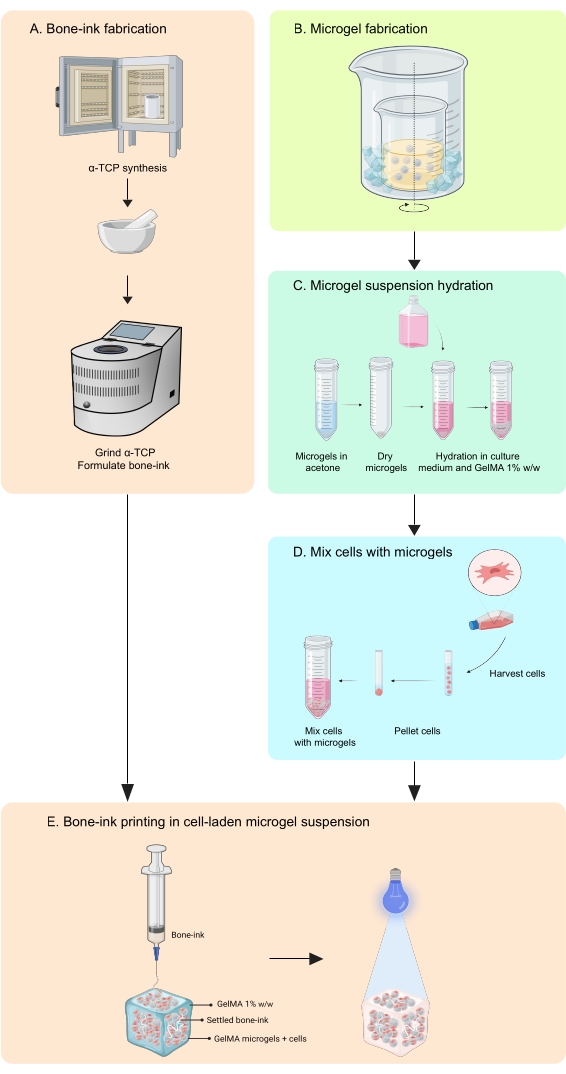
Şekil 1: İş akışının şeması . (A) Kemik mürekkebi, α-trikalsiyum fosfat sentezinden ve ardından gliserol, polisorbat 80 ve amonyum fosfat dibazik ile kombinasyonundan başlayarak sentezlenir. (B) GelMA mikrojelleri, yağda su emülsiyonu yöntemi ile üretilir. Elde edilen mikrojeller daha sonra (C) hidratlanır ve (D) hücrelerle birleştirilir. Hücre-mikrojel kompozitler daha sonra kemik-mürekkebin biriktirildiği granüler bir banyo olarak kullanılır. (E) Tüm yapı daha sonra UV çapraz bağlanır ve kültür için inkübatöre aktarılır. Kısaltmalar: α-TCP = α-trikalsiyum fosfat; GelMA = jelatin metakrilat. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Kemik-mürekkep üretimi
- α-trikalsiyum fosfat sentezi
- Kalsiyum hidrojen fosfat (CaHPO4) ve kalsiyum karbonat (CaCO 3) tozlarını3:2 Ca:P molar oranında tartın. Bir spatula kullanarak, iki tozu iyice homojenize edin.
- Kalsiyum hidrojen fosfat-kalsiyum karbonat tozu karışımını bir zirkonya potasına% 75'ten fazla dolu olmayacak şekilde ekleyin.
NOT: Kirlenmeyi önlemek için, aynı malzemeyi yapmak için daha önce kullanılmış yeni bir pota veya pota kullanın. Temizlemek için,% 100 etanol ile durulayın ve tozları eklemeden önce tamamen kuruyana kadar bir duman davlumbazında hava ile kurutun. - Potayı bir fırına aktarın. 5 °C/dak hızında 1.400 °C'ye ısıtın ve 3 saat bekletin.
- Potayı fırından çıkararak reaksiyonu söndürün ve refrakter bir bloğun üzerinde bırakın. Kullanmadan önce tamamen soğumasını bekleyin.
NOT: Uygun uzunlukta pota maşaları kullanın ve yeterli ısı koruması sağlayın. - α-TCP kekini kırmak ve öğütmek için bir harç ve havane kullanın, böylece elde edilen granüller maksimum 200 μm boyuta sahip olur.
NOT: Doğru partikül boyutunu sağlamak için standart bir paslanmaz çelik elek kullanın. - İki aşamada bir planet değirmen kullanarak granülleri daha da öğütün. İlk olarak, 8: 1 top: toz ağırlık oranında 3 mm ittriya stabilize zirkonya topları, daha sonra% 100 etanol, 3: 1 etanol: toz ağırlık oranında ekleyin. Kapağı sabitleyin ve 180 rpm'de 2 saat boyunca taşlayın.
- Süspansiyonu toplayın ve yıkama için% 100 etanol kullanarak topları ayırın.
- Süspansiyonu 120 °C'de bir fırında 24 saat kurulayın.
- Kurutulmuş tozu 1 mm zirkonya bilyeli freze kavanozlarına ve %100 etanolle ilk aşamada olduğu gibi aynı ağırlık oranlarında ekleyin. 180 rpm'de 2 saat boyunca öğütün, ayrı ve kurutun.
NOT: Tüm sentez prosedürü Şekil 1A'da gösterilmiştir.
- Kemik-mürekkep formülasyonu
- Kemik mürekkebini yapmak için, 630 μL gliserol ve 130 μL polisorbat 80 içeren bir bilyalı değirmen kavanozuna 2 g α-TCP tozu ekleyin ve sürekli olarak bir spatula ile karıştırın.
- 100 mg amonyum fosfat dibazik ((NH 4)2HPO4, APD) ekleyin ve birleştirmek için karıştırın.
NOT: Spatula üzerinde kalan sıvı fazların aşırı kalıntısı, mürekkep bileşenlerinin oran dengesizliğine ve dolayısıyla ayar kinetiğine neden olacaktır. - 25 mm'lik bir zirkonya bilyesi ekleyin, kapağı sabitleyin ve kavanozun kenarlarını bir spatula ile kazımak için yarıya kadar durarak 180 rpm'de 60 dakika boyunca bir planet değirmenin içine yerleştirin.
- Bir spatula kullanarak, mürekkebi 1 mL'lik bir şırıngaya yükleyin. Nem ile teması önlemek için yeterince sarın. Hemen kullanılmazsa −20 °C'de saklayın.
- Kemik-mürekkep mikroyapı karakterizasyonu
- Kemik mürekkebini deiyonize suya yazdırın ve 5 dakika bekletin.
- Numuneyi% 100 etanol ile 3x yıkayın ve tamamen kurumasını bekleyin.
- İnce bir altın tabaka (15 nm kalınlığında) ile kaplan.
- 5 kV'luk bir hızlanma voltajında bir alan emisyon taramalı elektron mikroskobu kullanarak mikrografları yakalayın.
2. Baskı için mikrojel süspansiyonların imalatı
- GelMA'nın Sentezi
NOT: Bu prosedür, 10 g ve 20 g jelatinden oluşan parti boyutları için test edilmiştir. Bu yöntem, 10 g kullanan bir parti için ölçümleri detaylandırır.- 10 g jelatin tartarak ve 90 mL PBS içeren konik bir şişeye ekleyerek, 1x fosfat tamponlu salin (PBS) içinde% 10'luk bir w / w jelatin tip A (domuz, Çiçeklenme mukavemeti 300) çözeltisi yapın. Jelatin tamamen çözünene kadar karıştırırken 50 ° C'ye ısıtın.
- 5.796 mL metakrilik anhidrit ekleyin. Konik şişeye lastik bir kapak yerleştirin ve karanlıkta 50 ° C'de 90 dakika boyunca karıştırmaya devam edin.
DİKKAT: Metakrilik anhidrit solunduğunda veya yutulduğunda toksiktir ve cilt ve göz tahriş edicidir. Sadece bir duman davlumbazının içinde tutun ve uygun KKD kullanın. - Konik şişenin içeriğini PBS ile iki kat seyrelterek reaksiyonu söndürün.
- 50 mL tüplere dekant yapın ve reaksiyona girmemiş metakrilik anhidriti çıkarmak için oda sıcaklığında 3.000 × g'da santrifüj yapın.
- 14 kDa kesilmiş selüloz diyaliz tüplerinin içindeki süpernatantı 40 °C'de deiyonize suya karşı 5 gün boyunca hafifçe karıştırarak diyalize edin. Deiyonize suyu her gün değiştirin.
- 50 mL tüplere boşaltarak, kapağı sabitleyerek ve buzdolabına 12 saat boyunca yerleştirerek depolamaya hazırlanın. 7 güne kadar buzdolabında saklayın.
- Sıvı azot kullanarak dondurun ve hemen -54 ° C ve 0.4 mbar'da 5 gün boyunca liyofilize edin.
NOT: Donma sırasında tüplerin 40 mL'den fazla sıvı içermediğinden emin olun. Dondurulduktan sonra, kapağı elastik bir bantla sabitlenmiş hassas bir görev mendili gibi gaz değişimine izin veren bir kapakla değiştirin. - Elde edilen köpüğü, mikrojel süspansiyon sentezi için gerekli olana kadar -20 ° C'de bir dondurucuda saklayın.
- GelMA mikrojellerinin sentezi
NOT: Mikrojeller, yağda su emülsiyon yöntemi13 kullanılarak sentezlenir (Şekil 2). Bu yöntem 1-10 mL'lik GelMA çözelti hacimleri için test edilmiştir. Aynı protokol, bağımsız kemik baskılarını yazdırmak için kullanılan jelatin mikrojellerini sentezlemek için de kullanılabilir.- Liyofilize GelMA'yı tartarak, PBS'li bir tüpe ekleyerek ve tamamen nemlendirilene kadar 50 ° C'de bir su banyosunda ısıtarak PBS'de% 10'luk bir w / w GelMA çözeltisi yapın.
- Bir beherin içine 1 mL GelMA çözeltisi başına 37 mL yağ ekleyerek %65'ten fazla dolu olmadığından emin olun.
- Yağ içeren beheri daha büyük bir kabın içine yerleştirerek manyetik karıştırmalı bir sıcak plaka üzerine çift beher sistemi kurun.
NOT: İki kabın boyutu, buzun duvarları arasındaki boşluğa kolayca düşebileceği şekilde olmalıdır. Kurulum Şekil 2'de gösterilmiştir. - Karıştırırken 40 °C'ye ısıtın.
NOT: Vorteksin çalkantılı olmadığından ve beherdeki yağın yüksekliğinin yaklaşık 1 / 3'ü derinliğinde olduğundan emin olun. - GelMA çözeltisini bir şırıngaya yükleyin ve 0,45 μm'lik bir filtreden karıştırıcı yağın içine damla damla ekleyin. Emülsiyonun 10 dakika boyunca dengelenmesine izin verin.
- İki beher arasındaki boşluğa ezilmiş buz ekleyerek küreleri termal olarak stabilize etmek için emülsiyonun sıcaklığını 15 ° C'ye düşürün.
- Eğirme emülsiyonuna, asetona 1:11 GelMA çözeltisi hacim oranında aseton ekleyin.
NOT: Emülsiyonun bozulmasını önlemek için asetonu, bir huniden yavaşça ekleyin. 60 dakika karıştırın. - Beherin içeriğini 50 mL tüplere boşaltın, beherin duvarlarını asetonla yıkadığınızdan emin olun. Susuz kalmış mikrojellerin dibe çökmesine izin vermek için 20 dakika bekletin.
- Süpernatantı atın ve asetonla en az 2 kat yıkayın.
NOT: Süpernatant açık olmalıdır. - Tek bir tüpte birleştirin, asetonla doldurun ve 10 saniye boyunca sonikasyon yapın. 2x'i asetonla yıkayın.
- Baskı için gerekli olana kadar oda sıcaklığında asetonda saklayın.
- GelMA mikrojel süspansiyonunun baskı için hazırlanması
- Liyofilize GelMA'yı bir tüpe tartarak, DMEM ekleyerek ve tamamen nemlendirilene kadar 50 ° C'de bir su banyosunda ısıtarak Dulbecco'nun Modifiye Kartal Ortamında (DMEM) % 1'lik bir W / w GelMA çözeltisi hazırlayın.
- Asetonu kurutulmuş mikrojellerden buharlaştırın ve elde edilen tozu bir tüpe tartın. Aseton ekleyin ve steril bir ortama aktarın.
- Mikrojel süspansiyonunu oluşturmak için, asetonu buharlaştırın ve DMEM'de% 1 w / w GelMA çözeltisi ve% 2.5 w / w lityum fenil-2,4,6-trimetilbenzoilfosfin (LAP) başlatıcı çözeltisi ekleyerek% 30'luk bir nihai paketleme fraksiyonu elde edin. Oda sıcaklığında en az 12 saat boyunca tamamen nemlendirilmesine izin verin. 7 güne kadar buzdolabında saklayın. Kullanmadan önce oda sıcaklığına kadar gelmeye izin verin.
NOT: Bu reaktiflerin hacimleri, mikrojellerin kuru ağırlığına dayanmaktadır ve Tablo 1'deki denklemler kullanılarak hesaplanabilir.
| Denklem | |
| x = kuru mikrojellerin ağırlığı (mg) | |
| DMEM'de %1 w/w GelMA'nın hacmi, a (μL) | a = 21,93x |
| DMEM hacmi, b (μL) | b = 8.773x |
| %2,5'lik hacim w/w LAP çözeltisi, c (μL) | c = 0,6267x |
| Üretilen mikrojel süspansiyonun toplam hacmi (μL) | a + b + c |
Tablo 1: GelMA mikrojel süspansiyonlarını nemlendirmek için gereken reaktiflerin hacimlerini hesaplamak için denklemler. Kısaltmalar: GelMA = jelatin metakrilat; LAP = lityum fenil-2,4,6-trimetilbenzoilfosfinat.
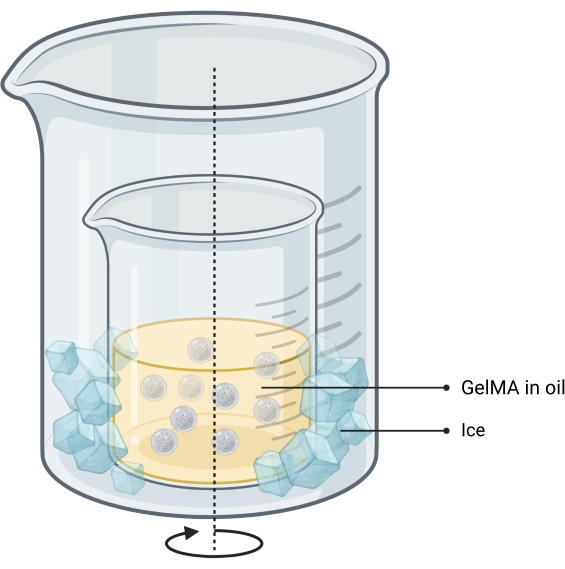
Şekil 2: Mikrojel sentezi için kullanılan yağ-emülsiyon yönteminin şeması. Çift beher kurulumu, soğutmaya izin vermek için daha büyük bir kabın içine yerleştirilen karıştırma (okla belirtilen) emülsiyonunu içeren bir beheri gösterir. Kısaltma: GelMA = jelatin metakrilat Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
3. Kemik mürekkebinin hücre süspansiyonlarına basılması
NOT: Jelatin bazlı mikrojeller, birçok farklı hücre tipinin yapışmasını destekler, bu da bu yaklaşımı mikrojel matrisi içindeki tek ve çoklu hücrelere uygun hale getirir. Bu protokol, adipoz kaynaklı mezenkimal kök hücrelerin (ADSC'ler) kullanım prosedürünü açıklar, çünkü bu, kas-iskelet sistemi doku mühendisliği için popüler ve sağlam bir hücre tipidir.
- Düşük glukozlu DMEM'deki ADSC'lerin 37 °C'de %10 fetal sığır serumu ve %1 penisilin-streptomisin ve %5 CO2 ile takviye edildiği kültür.
- ADSC'leri, ortamı çıkararak, steril PBS ile yıkayarak ve 37 ° C'de ve% 5 CO2'de% 0.25 tripsin ile 3 dakika boyunca inkübe ederek doku kültürü şişesinden ayırın.
- Hücreleri oda sıcaklığında 5 dakika boyunca 150 × g'da santrifüj yaparak toplayın.
- Hücreleri sayın ve her 1 mL GelMA mikrojeli için 5 × 105 hücre hesaplayın. Gerekli hücre süspansiyonu hacmini yukarıdaki gibi ayrı bir tüp ve pelet için ayırın.
- Bir pipet kullanarak mümkün olduğunca fazla süpernatantı dikkatlice çıkarın ve sadece hücre peletini bırakın. Pelet için gerekli miktarda mikrojel süspansiyonu ekleyin ve eşit hücre dağılımını sağlamak için nazikçe aspire edin.
NOT: Süspansiyonda aşırı hava kabarcıkları varsa, çıkarmak için yavaşça santrifüj yapın ve hücreleri yeniden dağıtmak için yukarı ve aşağı pipet uygulayın. - Hücre yüklü mikrojel süspansiyonunu pipet kullanarak bir reaktöre yükleyin.
NOT: Bu çalışmada hacim kapasitesi 100 μL olan 10 mm x 10 mm x 3 mm reaktörler 3D baskılanmıştır. - 23 G iğne ile donatılmış 1 mL'lik bir şırınga kullanarak kemik mürekkebini biriktirin.
NOT: Bu, bir 3D yazıcı ile doğrudan 1 mL şırıngadan yazdırmaya izin veren bir ekstrüzyon sistemini güçlendirerek veya kemik mürekkebini doğrudan yazıcının ekstrüzyon kartuşuna yükleyerek yapılabilir (Şekil 3). - Hücre ve kemik mürekkebi yüklü GelMA mikrojel yapısını 90 s için bir UV çapraz bağlayıcı lamba (405 nm) ile çapraz bağlayın. Hemen uygun boyutta bir kuyu plakasına aktarın ve tam DMEM ile örtün.
NOT: Yukarıda belirtilen 3D baskılı reaktörler, 24 kuyucuklu hücre kültürü plakalarının içine sığar. - 37 °C'de ve %5 CO2'de inkübe edin. Kültür ortamını 24 saat sonra, daha sonra gerektiği gibi her 48-72 saatte bir değiştirin.
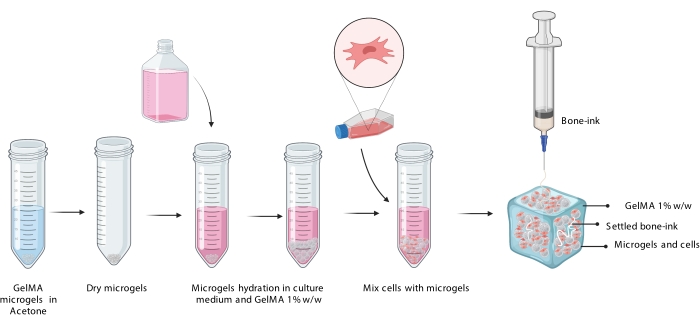
Şekil 3: Mikrojellerin hidrasyonunu, hücrelerin dahil edilmesini ve ardından hücre yüklü mikrojel süspansiyonunda kemik-mürekkebin basılmasını gösteren COBICS prosedürünün şematik gösterimi. Kısaltma: COBICS = hücre süspansiyonlarında seramik çok yönlü biyobaskı; GelMA = jelatin metakrilat. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
4. Hücre canlılığı ve proliferasyon değerlendirmesi
- Kemik-mürekkep sitotoksisitesini değerlendirmek için, hücre yüklü COBICS yapılarını tam kültür ortamında tutun. Live Dead tahlilini 24 saat, 72 saat ve 120 saat (veya ilgili zaman noktalarında) gerçekleştirin.
- Her zaman noktasında, yapıları PBS ile yıkayın, ardından 4 mM kalsein ve 2 mM ethidyum bromür içeren bir fenol içermeyen DMEM çözeltisi ekleyin. 37 °C'de 1 saat inkübe edin ve% 5 CO2.
- PBS ile yıkayın ve 494/517 nm ve 528/617 nm Ex/Em spektrumlarında konfokal mikroskopla görüntüleme için cam tabanlı bir kaba aktarın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
COBICS, kemik mimetik yapılarının katkısal üretimindeki en büyük zorluklardan ikisi olan fedakarlık destek malzemelerine veya zorlu son işlem adımlarına (örneğin, radyasyon ve yüksek sıcaklıkta sinterleme) ihtiyaç duymadan karmaşık, biyolojik olarak ilgili yapıları yazdırır. Karmaşık kemik yapılarının COBICS oluşumunu ve mikrojel süspansiyonlardaki hücrelerin birlikte baskılanmasını göstermek için, kemik-mürekkepten yapılmış kemik benzeri kompozitlerin temsili görüntüleri alınd...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
3D baskı tekniği COBICS, mineralize kemik benzeri yapıların ekstrüzyon yoluyla canlı hücreler içeren çapraz bağlanabilir bir mikrojel süspansiyonuna üretilmesini sağlamak için geliştirilmiştir. Teknik, parçalanabilir bir mikrojel süspansiyonuna uygulanmıştır ve hücreler sistem içinde iyi canlılık, yayılma ve osteojenik farklılaşma yeteneği gösterir11. Bu teknik kullanılarak oluşturulan yapıların başarısının önemli bir belirleyicisi, α-TCP tabanlı kemik mür...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar, açıklayacakları herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Yazarlar, Ulusal Sağlık ve Tıbbi Araştırma Konseyi'ne (Hibe no. GNT1111694 ve GNT1141602) ve Avustralya Araştırma Konseyi'ne (Hibe no. FT180100417, FL150100060 ve CE14100036) teşekkür etmek istemektedir. Yazarlar, New South Wales Üniversitesi'ndeki Biyomedikal Görüntüleme Tesisi'ne teşekkür etmek istiyor. Rakamlar Biorender.com, Adobe Photoshop ve Adobe Illustrator ile oluşturulmuştur ve ücretli bir abonelik altında dışa aktarılmıştır.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3D Printer Extruder | Hyrel3D | EMO-25 | |
| 50 mL centrifuge tubes | Falcon | BDAA352070 | |
| Absolute Ethanol 100% Denatured | Chem-Supply | ||
| Acetone | Chem-Supply | 154871 | |
| Alumina crucible | Coors | ||
| Ammonium phosphate dibasic (NaHPO4) | Sigma | A5764 | |
| Autodesk Fusion 360 | Autodesk | ||
| Biosafety cabinet level 2 | |||
| Calcium carbonate | Sigma | 239216 | |
| Calcium hydrogen phosphate (CaHPO4) | Sigma | C7263 | |
| Cell culture flasks | Corning | various volumes used | |
| Cellulose Dialysis Tubes, 14 kDa cut-off | Sigma | D9777 | |
| Centrifuge | Eppendorf | 5430R | |
| Centrifuge | Sigma | 3-16KL | |
| Dispensing Tip, 23 G | Nordson | 7018302 | |
| DMEM, low glucose, pyruvate | Thermo FIsher | 11885084 | |
| DPBS, no calcium, no magnesium | Thermo FIsher | 14190144 | |
| Elevator furnace | Labec | ||
| Engine HR Multihead Printer | Hyrel3D | ||
| Fetal Bovine Serum | Bovogen | ||
| Gelatin type A, from porcine skin | Sigma | G2500 | |
| General Purpose Stainless Steel Tips | Nordson EF | ||
| Glycerol | Sigma | G9012 | |
| Human adipose derived stem cells | ATCC | PCS-500-011 | |
| LSM 800 Confocal Microscope | ZEISS | ||
| Lyophilizer (Alpha 1-4 LDplus) | Christ | 101541 | |
| Magnetic hot plate and stirrer | |||
| Methacrylic anhydride | Sigma | 276685 | |
| Mini 2 Desktop 3D Printer | LulzBot | ||
| Parafilm sealing film | Parafilm | PM996 | |
| Penicillin-Streptomycin | Thermo FIsher | 15140122 | |
| Planetary ball mill | |||
| Planetary ball mill jar | |||
| Polyoxyethylenesorbitan monooleate Tween-80 | Sigma | P6224 | |
| Scanning electron microscope | FEI Nova NanoSEM 450 FE-SEM | ||
| Science Kimwipes Delicate Task Wipers | Kimtech | 18813156 | |
| Stainless steel standard test sieve | |||
| Sunflower Oil | Community Co | ||
| Trypsin-EDTA 0.25% phenol red | Thermo FIsher | 25200056 | |
| ZEN Microscope Software | ZEISS | ||
| Live/Dead viability/ cytotoxicity kit for mammalian cells | Invitrogen | L3224 | |
| DMEM, low glucose, no phenol red | Thermo Fisher | 11054020 |
Referanslar
- Bates, P., Ramachandran, M. Bone injury, healing and grafting. Basic Orthopaedic Sciences. The Stanmore Guide. , CRC Press. Boca Raton, FL. 123-134 (2007).
- Lin, X., et al. The bone extracellular matrix in bone formation and regeneration. Frontiers in Pharmacology. 11, 757(2020).
- Reznikov, N., et al. A materials science vision of extracellular matrix mineralization. Nature Reviews Materials. 1, 16041(2016).
- Kang, H. W., et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nature Biotechnology. 34 (3), 312-319 (2016).
- Lin, K., et al. 3D printing of bioceramic scaffolds-Barriers to the clinical translation: From promise to reality, and future perspectives. Materials. 12 (17), 2660(2019).
- Qu, M., et al. Multi-dimensional printing for bone tissue engineering. Advanced Healthcare Materials. 10 (11), 2001986(2021).
- Lode, A., et al. Fabrication of porous scaffolds by three-dimensional plotting of a pasty calcium phosphate bone cement under mild conditions. Journal of Tissue Engineering and Regenerative Medicine. 8 (9), 682-693 (2014).
- Bernal, P. N., et al. Volumetric bioprinting of complex living-tissue constructs within seconds. Advanced Materials. 31 (42), 1904209(2019).
- Diloksumpan, P., et al. Combining multi-scale 3D printing technologies to engineer reinforced hydrogel-ceramic interfaces. Biofabrication. 12 (2), 025014(2020).
- Thrivikraman, G., et al. Rapid fabrication of vascularized and innervated cell-laden bone models with biomimetic intrafibrillar collagen mineralization. Nature Communications. 10 (1), 3520(2019).
- Romanazzo, S., et al. Synthetic bone-like structures through omnidirectional ceramic bioprinting in cell suspensions. Advanced Functional Materials. 31 (13), 2008216(2021).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), 1500758(2015).
- Phromsopha, T., Baimark, Y. Preparation of starch/gelatin blend microparticles by a water-in-oil emulsion method for controlled release drug delivery. International Journal of Biomaterials. 2014, 829490(2014).
- Moreno, D., et al. Solid-state synthesis of alpha tricalcium phosphate for cements used in biomedical applications. Boletín de la Sociedad Española de Cerámica y Vidrio. 59 (5), 193-200 (2020).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır